-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prehľad možných komplikácií u pacientov po dekompresívnej kraniektómii
A review of possible complications in patients after decompressive craniectomy
Through the decades of its use in the management of neurosurgical emergencies decompressive craniectomy has found its place as a life-saving procedure capable of a radical reduction of the intracranial pressure. Clinical results and rate of survival after decompressive craniectomy vary according to the primary diagnosis, and they have been a subject of multicentric randomized trials. However, considerable attention also needs to be kept on complications associated with the craniectomy. They are based not only on the procedure’s invasivity but also on the pathophysiological changes associated with a conversion of the closed intracranial space to an open one. The complications may further disturb the postoperative care and convalescence in the surviving patients, and therefore in the salvageable patients the indication of decompressive craniectomy should be based on information about the expected outcome and complications rate, at the same moment prevention, early recognition and adequate therapy of the complications should be emphasized. This work describes the most common complications occurring in patients after decompressive craniectomy, their pathophysiological principles and means of treatment and prevention.
Keywords:
complications – decompressive craniectomy – intracranial hypertension
Autoři: M. Hanko 1; J. Soršák 2; P. Snopko 1; R. Opšenák 1; K. Zeleňák 2; B. Kolarovszki 1
Působiště autorů: Neurochirurgická klinika, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave a Univerzitná nemocnica Martin 1; Rádiologická klinika, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave a Univerzitná nemocnica Martin 2
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 1, s. 5-14.
Kategorie: Súhrnný článok
doi: https://doi.org/10.33699/PIS.2020.99.1.5–14Souhrn
Dekompresívna kraniektómia si za dekády svojho používania našla miesto v riešení neurochirurgických emergencií ako život zachraňujúci výkon schopný radikálne znížiť intrakraniálny tlak. Klinické výsledky a miera prežívania pacientov po dekompresívnej kraniektómii sa líšia vzhľadom na základnú diagnózu, boli a sú predmetom multicentrických randomizovaných štúdií. Nemalú pozornosť však treba upriamiť aj na komplikácie, ktoré so sebou vykonanie kraniektómie prináša. Vychádzajú nielen z invazivity výkonu, ale aj z patofyziologických zmien súvisiacich s konverziou uzavretého intrakraniálneho priestoru na otvorený. Komplikácie môžu ďalej narúšať pooperačnú starostlivosť a rekonvalescenciu prežívajúcich pacientov, a preto by dekompresívna kraniektómia mala byť u zachrániteľných pacientov indikovaná na základe informácií o očakávateľnom klinickom výsledku a miere komplikácií. Zároveň by sa prevencii, včasnému rozpoznaniu a správnej terapii komplikácií mal venovať dostatočný dôraz. Článok rozoberá najčastejšie komplikácie vyskytujúce sa u pacientov po dekompresívnej kraniektómii, ich patofyziologický základ, možnosti liečby a prevencie.
Klíčová slova:
dekompresívna kraniektómia – intrakraniálna hypertenzia – komplikácie
Úvod
Na neurochirurgických a traumatologických pracoviskách podstupujú každoročne desiatky pacientov dekompresívnu kraniektómiu (DK) ako emergentný, život zachraňujúci výkon. Prežívajúci pacienti sú následne väčšinou odosielaní do periférnych nemocníc, neskôr pri zohľadnení ich neurologického stavu prípadne aj do zariadení dlhodobej starostlivosti. Vo všetkých fázach pooperačnej starostlivosti sa však, napriek relatívnej technickej a principiálnej jednoduchosti DK (odstránenie kostnej platničky, durotómia, sanácia a evakuácia prípadného expanzívneho ložiska, plastika dury), môžeme stretnúť so značným množstvom pooperačných komplikácií. Niektoré vyplývajú zo samotnej invazivity operácie, iné sú vyvolané následnými zmenami tlakových pomerov v intrakrániu vrátane zmien perfúzie či dynamiky cirkulácie likvoru a sú pre postkraniektomické obdobie špecifické [1–3]. DK sa aktuálne využíva najmä v manažmente závažných kraniocerebrálnych poranení, malígnych mozgových infarktov, intracerebrálneho krvácania, opuchu mozgu po subarachnoidálnom krvácaní či iných, menej častých diagnózach [3]. Schopnosť DK znížiť patologicky elevovaný intrakraniálny tlak (ICP) a zlepšiť mozgovú oxygenáciu bola jednoznačne potvrdená [4]. Naskytá sa tedanemenej dôležitá otázka správnej indikácie DK, ktorá by mala byť cielená najmä na pacientov schopných z nej reálne profitovať. Tu ale vstupujeme do zložitej medicínsko-eticko-právnej debaty. Je neopomenuteľné, že multicentrické randomizované štúdie sa v prvom rade zaoberali finálnym klinickým stavom pacientov (outcome), pričom vplyv a miera jednotlivých komplikácií, ktoré pooperačnú starostlivosť a rekonvalescenciu prežívajúcich pacientov môžu do značnej miery ovplyvňovať, však systematicky skúmané neboli. Je preto na mieste zvážiť pri indikácii DK aj potenciálne riziko závažných pooperačných komplikácií. Z didaktického a patofyziologického hľadiska môžeme komplikácie rozdeliť na hemoragické, infekčné, komplikácie vyplývajúce zo zmeny tlakových pomerov a narušenej dynamiky likvorovej cirkulácie a komplikácie menej frekventné, respektíve špecifické komplikácie, napríklad poruchy hojenia operačnej rany.
Hemoragické komplikácie
Subdurálny hematóm
Subdurálny hematóm sa ako komplikácia DK vyskytuje zriedkavo. Ak je prítomný, predstavuje buď reziduum neadekvátne evakuovaného predchádzajúceho krvácania, prípadne vzniká ako následok koagulopatie či nedostatočnej hemostázy v bezprostrednom perioperačnom období [3]. Ďalšou zriedkavou možnosťou je vznik kontralaterálneho subdurálneho hematómu po DK následkom prudkého poklesu ICP a straty tampónujúceho efektu, ktorý dekompresiu sprevádza [1]. V prípade expanzívneho správania sa subdurálneho hematómu sa nevyhneme chirurgickej revízii.
Extradurálny hematóm
Častejšou včasnou komplikáciou limitujúcou samotný dekompresívny efekt výkonu a potenciálne ohrozujúcou život pacienta je prítomnosť akútneho epidurálneho (Obr. 1a), respektíve subgaleálneho hematómu v oblasti kraniektómie [3]. Keďže kostná platnička je odstránená, typický bikonvexný tvar epidurálneho hematómu nepozorujeme. Okrem toho môže extradurálny hematóm vznikať aj atypicky – kontralaterálne. Najpravdepodobnejším patomechanizmom zodpovedným za jeho vznik a progresiu je opätovne pokles ICP po DK, ktorý umožní ďalšie krvácanie, publikovaná incidencia po DK pre úraz mozgu je 7,4 % [5]. K rozvoju kontralaterálneho epidurálneho hematómu môže prísť už počas operácie, keď po otvorení dury náhle pozorujeme masívne vyklenutie mozgového tkaniva cez kraniektómiu a diagnózu potvrdí len kontrolné CT vyšetrenie alebo probatórny návrt [6]. Kontralaterálny epidurálny hematóm môže vznikať aj v bezprostrednom pooperačnom období, jeho oneskorený vývoj a záchyt je možný, ale zriedkavejší [5,6]. Zvýšené riziko pre jeho vznik predikuje prítomnosť kontralaterálnej fraktúry kalvy [6,7]. Pretože ide o závažnú komplikáciu bez ohľadu na stranu vzniku, kľúčová je rýchla diagnostika a prípadná urgentná chirurgická liečba. V rámci prevencie sa preto odporúča bezprostredná pooperačná CT kontrola intrakránia a ďalšia kontrola najneskôr do 24–48 hodín [2,5,6]. Počas operácie je v rámci prevencie samozrejmosťou dôkladná hemostáza a perioperačná kontrola a podľa potreby korekcia prípadnej koagulačnej poruchy.
Obr. 1. Príklady hemoragických komplikácií:
1a – extradurálny hematóm; 1b – prekrvácanie temporálneho svalu; 1c–d – akútny subdurálny hematóm vpravo, po jeho evakuácii a dekompresívnej kraniektómii dochádza k vykresleniu intracerebrálneho hemoragického ložiska (archív autora)
Fig. 1. Examples of haemorrhagic complications:
1a – extraaxial (epidural) haematoma; 1b – a haemorrhage in the temporal muscle; 1c–d – a right-sided acute subdural haematoma with a development of intracerebral haemorrhage after its evacuation and decompressive craniectomy (author’s archive)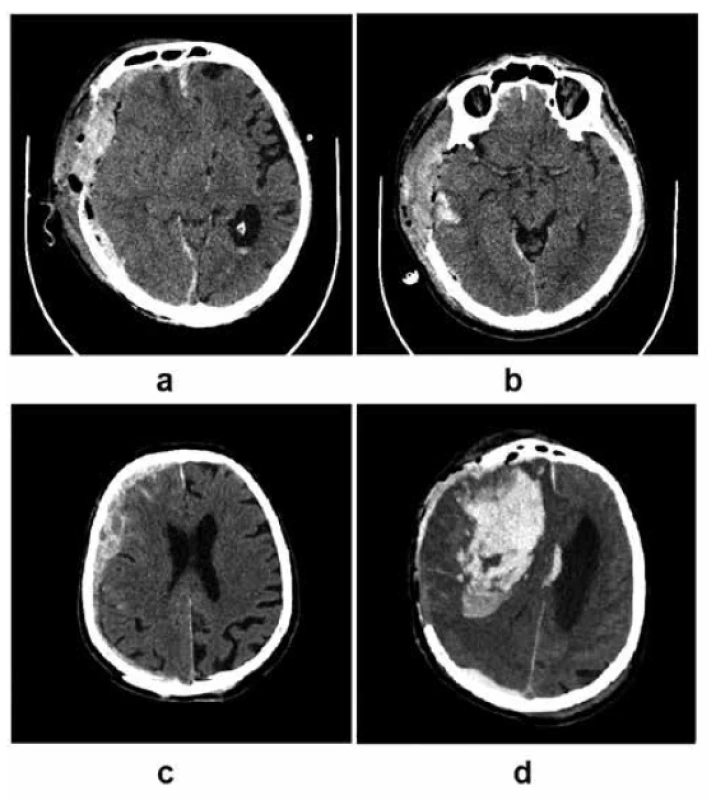
Prekrvácanie a edém temporálneho svalu
Podobne ako extradurálny hematóm nad oblasťou kraniektómie, aj rozvoj prekrvácania a edému skalpu alebo priamo temporálneho svalu (Obr. 1b) môže potenciálne redukovať efekt získanej dekompresie. Príčinou vzniku uvedenej komplikácie je buď poškodenie svalu už pri vzniku prípadného kraniocerebrálneho poranenia, alebo nešetrná operačná technika a nedostatočná hemostáza. Niekedy je nutné temporálny sval počas revízie resekovať. Resekcia temporálneho svalu už počas DK je však aj jednou z možností získania ďalšieho objemu pre expanziu výrazne edematózneho mozgového tkaniva [3,8,9]. Následkom resekcie temporálneho svalu býva nepriaznivý kozmetický efekt a oslabená funkcia mastikácie, túto sú však pacienti schopní kompenzovať [9].
Progresia mozgových kontúzií a nové intracerebrálne krvácanie
Po náhlej zmene tlakových pomerov v intrakrániu, ktorá je nevyhnutným následkom DK, sa stráca tampónujúci efekt uzavretého intrakraniálneho priestoru. Nastáva riziko progresie intracerebrálnych krvácaní, špecificky hemoragickej komponenty mozgových kontúzií, alebo aj vzniku nových hemoragických ložísk [2,10]. Prirodzený vývin hematokontúznych ložísk zahŕňa ich progresiu, signifikantne (o viac ako 30 %) sa zväčšuje až 42,3 % hematokontúznych ložísk [11]. Carnevale et al. uvádzajú mieru expanzie až 67,6 % [12], ale na základe prirodzenej progresie objemu kontúzie sa nepodarilo preukázať zhoršujúci sa finálny klinický výsledok [11,13]. V prípade pridruženej rýchlej klinickej deteriorácie s progresiou presunu stredočiarových štruktúr a kompresiou bazálnych cisterien je riziko nepriaznivého výsledku vysoké, najmä u pacientov starších ako 70 rokov [11]. Rovnako, ako hemoragická zložka, prirodzene progreduje aj perifokálny edém, jeho prirodzený nárast o viac ako 50 % bol pozorovaný u 55% pacientov počas prvých 24 hodín od úrazu a jeho progresia je asociovaná s horším outcomom [13]. Už v experimentálnych podmienkach bola verifikovaná tendencia hemoragicko-kontúznych ložísk k progresii po vykonaní DK [14]. Progresia a nový vznik kontúznych ložísk po DK (Obr. 1c, d) je asociovaná s horším klinickým výsledkom [15], najnovšia analýza uvádza incidenciu progresie až na úrovni 25,82 % [15]. Flint et al. dokonca uvádzajú, že po vykonaní unilaterálnej DK bola pozorovaná progresia alebo objavenie sa nových intracerebrálnych ložísk o objeme nad 5ml u 58 % operovaných, predominantne v dekomprimovanej hemisfére, pričom progresia nad 20 ml bola asociovaná s vyššou mortalitou alebo nepriaznivým klinickým výsledkom u prežívajúcich [16]. Rizikovým faktorom pre progresiu alebo vznik nových intracerebrálnych ložísk u pacientov po úraze mozgu podstupujúcich DK je vyššie Rotterdam skóre [16], prítomnosť akútneho subdurálneho hematómu a kontúzneho ložiska s objemom nad 20 ml [15].
Hemoragická transformácia ischémie
Hemoragická transformácia malígneho mozgového infarktu sa po DK vyskytuje v 23,7 % prípadov, prognóza pacientov prežívajúcich s touto komplikáciou je považovaná za menej priaznivú [10,17]. Vznik prekrvácania ischemického ložiska je opäť zdôvodňovaný náhlym poklesom ICP po vykonaní DK. Stráca sa tzv. tampónujúci efekt a zároveň dochádza k hyperémii zasiahnutého mozgového tkaniva aj s možným ischemicko-reperfúznym poškodením [3,10].
Sekundárne krvácanie do mozgového kmeňa
Sekundárne krvácanie do ventrálnej časti pontu alebo mezencefala, eponymicky nazývané Duretovo krvácanie, vzniká typicky ako následok rapídne vzniknutej descendentnej transtentoriálnej herniácie sprevádzajúcej napríklad expanzívny intrakraniálny hematóm, alebo pri situácii opačnej, teda po rýchlej dekompresii intrakraniálneho priestoru s preexistujúcou intrakraniálnou hypertenziou [18,19]. Ideálnym príkladom pre takýto scenár je evakuácia intrakraniálneho krvácania a následná DK. Ojedinele vzniká Duretovo krvácanie aj pri epizóde akútnej intrakraniálnej hypotenzie, napríklad pri paradoxnej herniácii u pacienta po DK [20]. Incidencia Duretovho krvácania je podľa autoptických štúdií prekvapivo vysoká – napríklad až 51% pacientov zomrelých pre expanzívne posttraumatické ložisko [21] a 45 % u zomrelých na spontánne intracerebrálne krvácanie [22]. Makroskopicky je viditeľná iba jedna pätina z nich [21]. Patomechanizmom vzniku Duretovho krvácania je pravdepodobne ruptúra perforujúcich kmeňových arteriol poškodených mechanicky a metabolicky, najčastejšie pri prudkom náraste objemu expanzívnej lézie v supratentoriálnom priestore. Po DK vzniká Duretovo krvácanie na základe reperfúzneho poškodenia pri obnovení, respektíve náhlom zvýšení prítoku krvi do spomínaných, už potenciálne poškodených perforátorov [19,23,24]. Duretovo krvácanie je tradične považované za prediktor nepriaznivej prognózy, kazuisticky však boli popísané viaceré prípady prežívania pacientov len s minimálnym pretrvávajúcim neurodeficitom. Väčšinou sa tak stalo u mladších pacientov a pri menšom rozsahu krvácania v mozgovom kmeni [18,25,26].
Komplikácie vychádzajúce zo zmeny tlakovo-perfúznych pomerov
Malígny edém mozgu
Intraoperačne sa môže vyskytnúť tzv. malígny edém mozgu s prítomnosťou masívnej herniácie mozgového tkaniva do kraniektómie. Vzniká následkom poruchy autoregulácie v mozgových cievach a hyperémie vyvolanej náhlym zvýšením mozgového perfúzneho tlaku, alebo aj poúrazovým či peroperačným poškodením venóznej drenáže mozgu. Samotná externá herniácia mozgu venóznu drenáž ďalej obmedzuje, čím vzniká bludný kruh [3,27]. V tomto prípade je nutné pristúpiť k ukončeniu operácie a uzáveru skalpu, a to v prípade nutnosti aj bez vykonania duraplastiky. Zároveň netreba zabudnúť na fakt, že aj kontralaterálny epidurálny hematóm sa môže rozvinúť už peroperačne a spôsobiť tak externú mozgovú herniáciu napodobňujúcu malígny edém. Nutná je preto skorá pooperačná CT kontrola intrakránia [3,6].
Externá mozgová herniácia (fungus cerebri)
Externá herniácia mozgu cez kraniektómiu je pravidelne uvádzaná ako pooperačná komplikácia. V skutočnosti je presne tým, čo od vykonania DK očakávame, keďže DK je výkonom zameraným na umožnenie expanzie mozgového tkaniva smerom „navonok“. Ide teda o uplatnenie efektu dekompresie, čo však neznamená, že so sebou nenesie potenciálne riziká. Nadmerná expanzia edematózneho mozgu do defektu po kraniektómii (Obr. 2a) je častým nálezom a môže sa vyskytnúť až u 27,8 % pacientov. Predstavuje potenciálne riziko lacerácie kortexu alebo kompresie povrchových vén o okraj kraniektómie, čo môže vyústiť do infarzácie herniujúceho tkaniva. Toto riziko je obzvlášť závažné v prípade, že bola vykonaná DK nedostatočnej veľkosti [5,28]. Dekomprimovaná hemisféra má tendenciu správať sa v bezprostrednom pooperačnom období expanzívne a následne herniovať cez kraniektómiu. Dôvodom je pooperačná hyperperfúzia a zvýšená tendencia k edému kvôli pooperačnému zvýšeniu tlakového gradientu medzi intra a extravaskulárnym prostredím v mozgu [3,27,29]. Príčinou externej mozgovej herniácie môže byť aj hydrocefalus alebo kontralaterálna tekutá či hemoragická kolekcia, preto je vhodné realizovať opakované CT kontroly intrakránia. Prevenciou nadmernej externej mozgovej herniácie s útlakom vén môže byť augmentatívna plastika dury [5], ochrana povrchových vén metódou „vascular tunnel“ [30] a hlavne technicky správne vykonanie DK, kde kľúčovým faktorom zostáva jediné – jej adekvátny rozsah [1,3,28].
Obr. 2. Typické komplikácie vyplývajúce zo zmeny tlakových pomerov v intrakrániu:
2a – externá mozgová herniácia; 2b – vpadnutý kožný lalok; 2c – vpadnutý kožný lalok u iného pacienta po dekompresívnej kraniektómii a ventrikuloperitoneálnom shunte bez vykonania kranioplastiky (archív autora)
Fig. 2. Typical complications resulting from changes of intracranial pressure gradients:
2a – external cerebral herniation; 2b – sinking skin flap; 2c – sinking skin flap in a different patient after decompressive craniectomy and ventriculo-peritoneal shunt (author’s archive)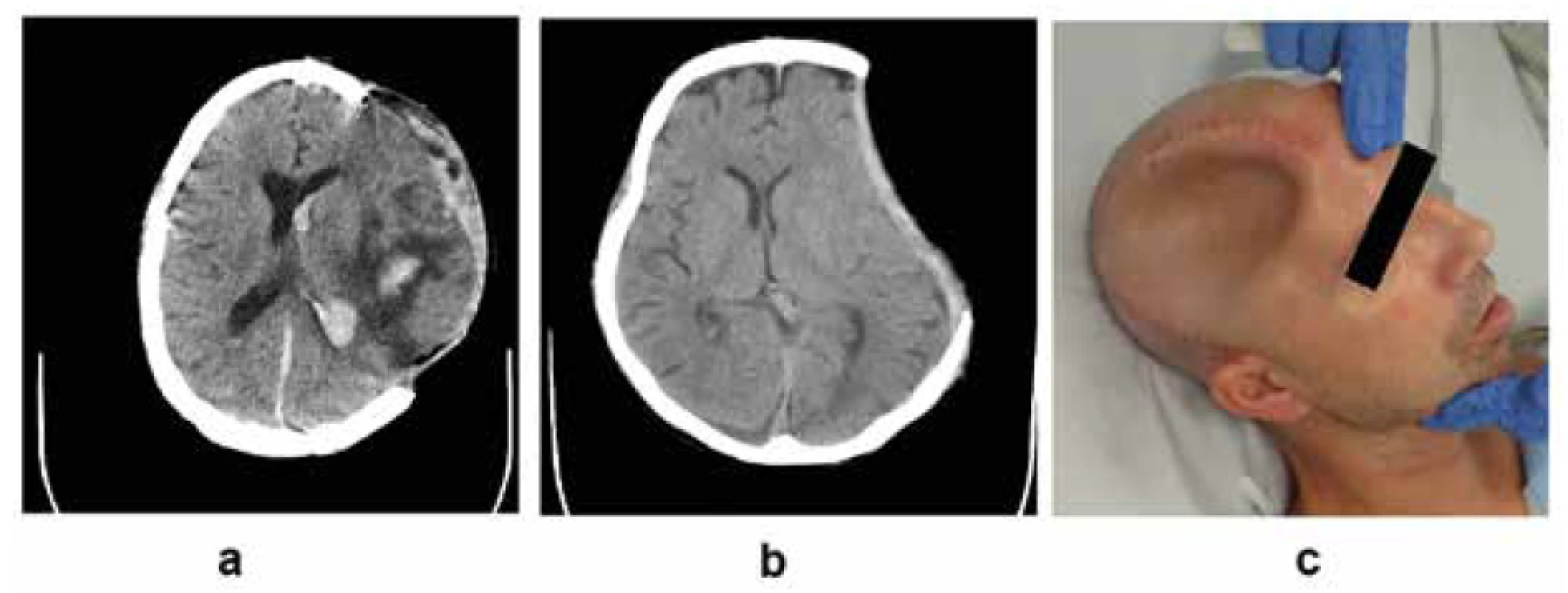
Posttrepanačný syndróm, paradoxná herniácia
Vykonaním DK dochádza ku konverzii pôvodne uzavretého intrakraniálneho priestoru na otvorený. Ide o cielenú zmenu, pričom sa očakáva poskytnutie dostatočného priestoru mozgovému tkanivu k ďalšej expanzii, a tento efekt sa uplatňuje najmä v akútnom období po primárnom inzulte. Po odoznení edému mozgu (respektíve napr. aj vstrebaní hemoragických ložísk) sa začína uplatňovať nová biomechanika. Mozgové tkanivo v oblasti kraniektómie je kryté len kožným lalokom a duraplastikou. Bez ochrany, ktorú mu pôvodne poskytovala kalva, sa naň cez kožný lalok prenáša pôsobenie atmosferického tlaku a vzniká tak pozitívny tlakový gradient medzi vonkajším prostredím, intrakrániom a intraspinálnym priestorom [31–33]. S odstupom týždňov po DK bol in vivo potvrdený presun ICP do záporných hodnôt, po kraniektómii posturálna regulácia likvorového tlaku de facto mizne [34]. Môže dochádzať k deformácii mozgového tkaniva v oblasti kraniektómie, presunu stredočiarových štruktúr na kontralaterálnu stranu (Obr. 2b), narušeniu dynamiky likvoru a perfúzie mozgového tkaniva so zodpovedajúcim znížením jeho metabolizmu [31–34]. Výsledkom je neurologická dysfunkcia, ktorá nie je podmienená prvotným inzultom, ktorý k vykonaniu DK viedol, ani žiadnym iným prebiehajúcim komplikujúcim procesom v intrakrániu. Tento stav, sprevádzaný konkávnou deformitou v oblasti kraniektómie (Obr. 2c), nazývame syndróm vpadnutého kožného laloka (sinking skin flap syndrome). Jeho príznakmi bývajú kvantitatívna porucha vedomia, porucha reči, narušenie hybnosti, či iné objektívne známky neurodeficitu [32]. Môže vznikať postupne dlhodobo v rámci pooperačného obdobia so zvýraznením pri vzpriamenej polohe či dehydratácii [32–34]. Možný je však aj jeho akútny a búrlivejší priebeh, najmä ak je prítomný faktor zvyšujúci tlakový gradient medzi vonkajším prostredím a intrakraniálnym, respektíve ďalej intraspinálnym priestorom. Typickým príkladom je likvorová hypotenzia vznikajúca po zavedení ventrikuloperitoneálneho shuntu alebo externej lumbálnej drenáže a predrénovaní, niekedy postačuje aj podanie osmotických diuretík [3,35,36]. Eskaláciou takéhoto priebehu môže byť až paradoxná descendentná mozgová herniácia [3]. Liečbou je napolohovanie pacienta do Trendelenburgovej polohy, kompenzácia strateného objemu likvoru adekvátnou rehydratáciou a zastavením lumbálnej drenáže či zvýšením prepúšťacieho tlaku vo ventile shuntových systémov. Definitívne riešenie poskytuje až kranioplastika, po ktorej dochádza k zlepšeniu tlakovo – perfúznych pomerov v priľahlej, ale aj kontralaterálnej hemisfére [3,31,36–38]. Podobnou klinickou jednotkou je aj skôr popísaný syndróm trepanovaných, tu sú však častejšie prítomné aj subjektívne príznaky ako cefalea, nauzea, vertigo, únava alebo nepokoj, prípadne poruchy zraku či sluchu nastupujúce rádovo v týždňoch až mesiacoch po kraniektómii [39]. Kranioplastika poskytuje opäť definitívne riešenie tohto stavu [31]. Súčasná literatúra oba uvedené syndrómy neadekvátne rozlišuje, zároveň sa však pripúšťa minimálne ich podobný patofyziologický základ. Prevenciou posttrepanačných syndrómov u správne indikovaných pacientov môže byť osteoplastická dekompresívna kraniotómia, keď je kostná platnička len voľne fixovaná o temporálny sval, čím sa umožní jej nadvihnutie edematóznym mozgovým tkanivom. Po odznení edému kostná platnička klesá na pôvodné miesto a vhojí sa [40].
Komplikácie vyplývajúce z narušenej dynamiky likvoru
Extraaxiálna tekutá kolekcia (hygrómy)
Subdurálny hygróm je najčastejšou manifestáciou narušenej likvorovej dynamiky vyskytujúcou sa po vykonaní DK. Podľa metaanalýzy sa vyskytuje až u 27,4 % pacientov po DK pre úraz mozgu a u 12,5 % pacientov po DK pre malígny mozgový infarkt [10]. V jednotlivých reportoch sa publikovaná incidencia výrazne líši, napríklad Aarabi et al. pozorovali subdurálny hygróm až u 57,4 % pacientov po DK. V 90 % prípadov vzniká hygróm na strane kraniektómie (Obr. 3a) a pozorovateľný býva už na druhý pooperačný deň. Maximálny objem dosahuje v 3. až 4. týždni a vo väčšine prípadov sa spontánne resorbuje do 4 mesiacov po operácii [41]. Kontralaterálny výskyt hygrómov (Obr. 3b) je vzácnejší a je uľahčený znížením ICP po kraniektómii, incidencia je 7,3 % a môže naň upozorniť externá herniácia mozgu pretrvávajúca 2 až 3 týždne po operácii [42]. Kontralaterálne hygrómy majú väčšiu tendenciu spôsobovať presun stredočiarových štruktúr, a teda aj neurologickú symptomatiku, vyžadujú si agresívnejšiu liečbu [41,42]. Pri ipsilaterálnej tekutej kolekcii vzniká najzávažnejší stav v prípade, že sa táto správa expanzívne. Pri nedostatočnej tesnosti plastiky dury preniká tekutina aj do podkožia alebo subgaleálne, kde sa môže akumulovať pri uplatnení mechanizmu jednosmerného ventilu. Vo všetkých týchto prípadoch je kožný lalok vyklenutý, tenzný a priľahlé mozgové tkanivo komprimované. Hovoríme o externej mozgovej tamponáde s nutnosťou včasnej chirurgickej revízie [3,33]. Z patofyziologického hľadiska treba upriamiť pozornosť aj na nejednoznačnosť pojmov v odbornej literatúre. Niektorí autori rozlišujú subdurálne/subgaleálne hygrómy, respektíve likvorové kolekcie a výpotky (effusion), iní tieto výrazy považujú za synonymá. Rozdiel je reálne badateľný pri biochemickom rozbore tekutiny. Jej charakter sa môže pohybovať od čírej likvorovej kolekcie až po xantochrómnu, bohatú na proteiny a krvné elementy [3,41,43,44]. Ako prvotná príčina vzniku subdurálnych hygrómov sa uvádza traumatická ruptúra arachnoidey s prienikom likvoru subdurálne. Pri kontralaterálnej kolekcii je vznik hygrómov uľahčený uvoľnením tampónujúceho efektu pri odstránení kostnej platničky a následnom poklese ICP. Poškodenie hranice arachnoidea – dura sa deje aj iatrogénne otvorením dury počas operácie. Ďalej sa uplatňuje narušenie toku a vstrebávania likvoru, keďže po vykonaní DK sa oplošťuje pôvodne dikrotická pulzová vlna v rámci fyziologickej oscilácie ICP. Bez jej prítomnosti neexistuje na arachnoidálnych granuláciach pozitívny tlakový gradient nutný k likvorovej reabsorpcii [5,41,43,45]. Zároveň môžu byť granulácie aj zápalovo poškodzované alebo krvou zablokované [43]. Prítomnosť hygrómu môže predznamenať neskorší rozvoj hydrocefalu práve pri porušenej likvorovej reabsorpcii, tento stav býva označovaný aj ako „externý hydrocefalus“ [41–43]. Postupne, najmä pri prítomnosti tekutiny bohatej na krvné elementy a proteiny sa v oblasti hygrómu formuje zápalová reakcia. Prítomná je formácia krehkých neomembrán a následná progresia objemu kolekcie cestou zvýšeného osmotického tlaku tekutiny a zvýšenej kapilárnej permeability v membránach, či cestou opakovaných drobných krvácaní, nakoniec aj konverzia na chronický subdurálny hematóm [41,44–46]. Väčšina extraaxiálnych tekutých kolekcií má tendenciu spontánne vymiznúť. V prípade, že sa tak nedeje alebo sa kolekcia správa expanzívne, alebo je sprevádzaná neurologickou symptomatikou, nevyhneme sa operačnej liečbe. Pokiaľ možno, mala by byť čo najskôr vykonaná kranioplastika a počas nej drenáž kolekcie, v prípade kontralaterálnej cez trepanačný návrt. V pooperačnom období u niektorých pacientov býva pozorovaná postupná dilatácia komorového systému s rozvojom hydrocefalu, vtedy je nutná shuntová operácia. Význam a efektivita subduroperitoneálnych shuntov sú sporné, avšak v niektorých prípadoch účinné [3,41,42,44,45]. Navrhovanou prevenciou vzniku subdurálnych hygrómov po DK je vodotesná augmentatívna plastika dury a bandáž hlavy po ústupe mozgového edému [3,5].
Obr. 3. Komplikácie vyplývajúce z narušenej likvorovej dynamiky:
3a – bilaterálne subdurálne hygrómy, predominantne na strane kraniektómie; 3b – bilaterálne subdurálne hygrómy, predominantne kontralaterálny hygróm vyvolávajúci kompresiu a externú herniáciu mozgu, presun stredočiarových štruktúr, ventrikulomegália; 3c – hydrocefalus (archív autora)
Fig. 3. Complications resulting from impaired cerebrospinal fluid dynamics:
3a – bilateral subdural hygromas, predominantly at the site of craniectomy; 3b – bilateral subdural hygromas, predominantly contralateral hygroma causing brain compression, external herniation and midline shift, ventriculomegaly; 3c – hydrocephalus (author’s archive)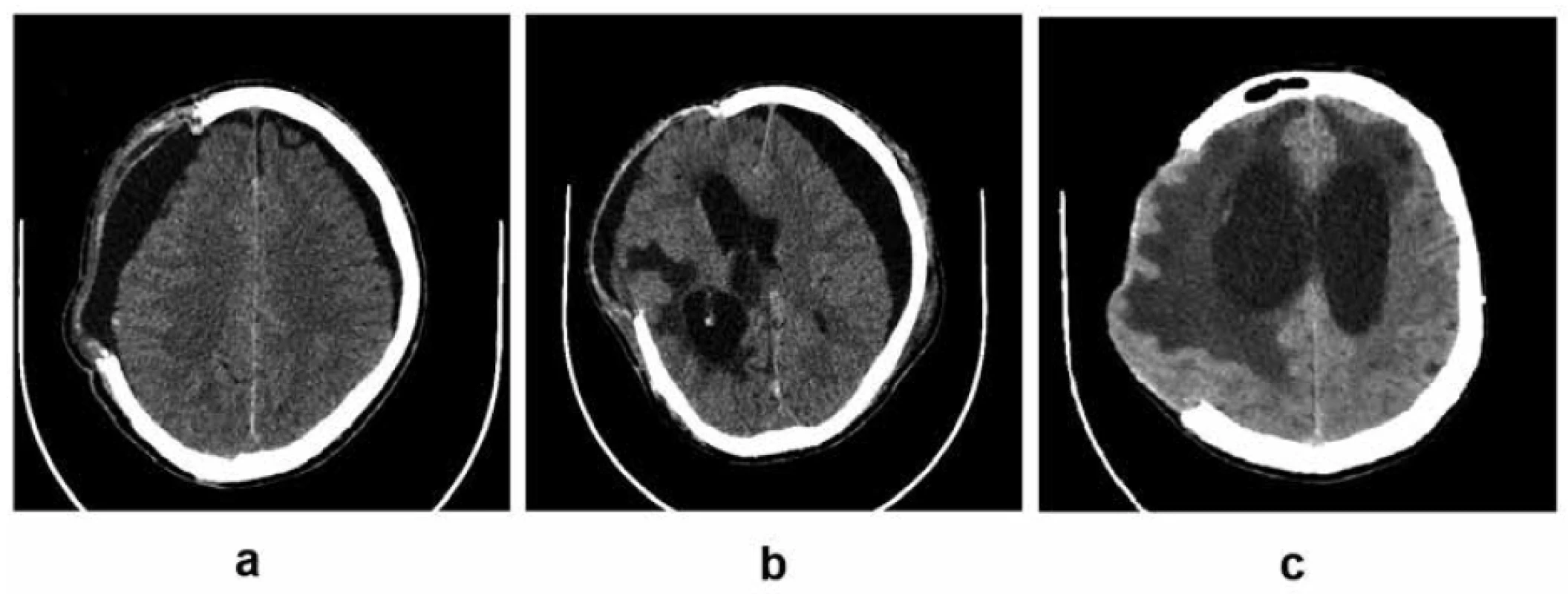
Hydrocefalus a ventrikulomegália
Obávanou komplikáciou u postkraniektomických pacientov je rozvoj hydrocefalu (Obr. 3c), ktorý je preukázateľne spojený s menej priaznivým outcomom [47]. Ventrikulomegália po vykonaní DK môže byť následkom atrofie poškodenej časti mozgového parenchýmu, kedy môže ostať klinicky bez manifestácie, zároveň môže byť prejavom rozvíjajúceho sa, prípadne už prítomného hydrocefalu [5]. U pacientov po DK pre ischémiu v povodí a. cerebri media sa progresívna ventrikulomegália s modifikovaným Evansovým indexom nad 0,3 vyskytla u 47,8 % pacientov, po DK pre spontánne intracerebrálne krvácanie sa ventrikulomegália vyskytuje u 47,6 % pacientov, častejšie u pacientov s intraventrikulárnym krvácaním, s hranicou kraniektómie bližšie k stredovej čiare a s pooperačnou meningitídou, asociovaná je s nepriaznivým outcomom [48,49]. Možná je regresia ventrikulomegálie po vykonaní kranioplastiky a finálne množstvo pacientov vyžadujúcich shuntovú operáciu je nižšie [48,49]. Permanentný shunt v rámci posttraumatického hydrocefalu po DK si stále môže vyžadovať až 25 % pacientov [50]. Vzdialenosť hornej hranice kraniektómie ku stredovej čiare pod 25 mm bola vo viacerých štúdiách uvádzaná ako rizikový faktor pre rozvoj hydrocefalu po vykonaní DK. Toto pozorovanie sa v metaanalýze potvrdiť nepodarilo [51]. Ďalším rizikovým faktorom pre rozvoj hydrocefalu je prítomnosť interhemisferálneho hygrómu, ktorý často hydrocefalu predchádza a môže byť epifenoménom narušenej likvorovej dynamiky [43], ďalej aj mladší vek pacientov [42] a intraventrikulárne krvácanie [52]. Inými rizikovými faktormi sú napríklad závažnejšia porucha vedomia a vyšší intrakraniálny tlak pred vykonaním DK [47]. Patomechanizmom postkraniektomického hydrocefalu môže byť práve odhalenie arachnoidálnych granulácií voči atmosferickému tlaku a zároveň narušenie fyziologických pulzácii likvoru, keď dochádza aj k narušeniu jeho reabsorpcie. Tento stav je potenciálne korigovateľný skorou kranioplastikou. Pri vykonaní kranioplastiky s dlhším odstupom však môže dysfunkcia v likvorovej reabsorpcii pretrvávať a hydrocefalus je následne trvalý a vyžaduje operačnú intervenciu [53,54]. De Bonis et al. uvádzajú, že za rozvoj hydrocefalu sú zodpovedné aj zmeny vo venóznom odtoku z intrakránia, keďže najmä po DK blízko stredovej čiary sa zvyšuje reabsorpcia extracelulárnej tekutiny na úkor jej produkcie a znižuje sa tak objem mozgového tkaniva. Následkom je neskoršia akumulácia likvoru buď v subdurálnom priestore, najmä pri prítomnosti posttraumaticej lézie arachnoidey, keď vznikajú subdurálne hygrómy, prípadne priamo dochádza k rozvoju ventrikulomegálie a hydrocefalu. V inom scenári sa hydrocefalus prejaví až po vykonaní kranioplastiky zhoršovaním neurologického stavu pacienta a progresiou v šírke komorového systému s prítomnosťou transependymálnych priesakov v mozgovom tkanive [43]. Ďalšou možnosťou vzniku hydrocefalu je zablokovanie arachnoidálnych granulácií krvou a jej degradačnými produktmi či posthemoragická arachnoiditída blokujúca likvorové cisterny [42,55]. Prítomnosť náhle vzniknutej prekážky v likvorových cestách či ich úplná obturácia útlakom samozrejme vedú k rozvoju akútneho hydrocefalu.
Motor trephine syndrome
V rámci posttrepanačných syndrómov bola identifikovaná klinická entita spojená s narušeným spätným vstrebávaním likvoru. U pacientov po DK pre kraniocerebrálne poranenie sa s odstupom v mediáne 4,5 mesiaca rozvíjala postupná monoparéza, najmä na horných končatinách. Rizikovými faktormi vzniku „motor trephine syndrómu“ boli prítomnosť hematokontúznych ložísk a pooperačné známky narušenej likvorovej dynamiky, najmä prítomnosť subdurálnych hygrómov. CT a perfúzne štúdie dokázali u týchto pacientov edém a následnú hypoperfúziu v oblasti postkontúznych ložísk, stav sa typicky zlepšil po kranioplastike. Príčinou uvedeného je najpravdepodobnejšie narušená reabsorpcia likvoru po vykonaní DK, pri ktorej zvýšený likvorový tlak vyvoláva prestup likvoru do „locus minoris resistentiae“, v tomto prípade sú ním postkontúzne ložiská. Pri ich následnom edéme a hypoperfúzii je výsledkom nový neurologický deficit, konkrétne motorická dysfunkcia [56,57].
Ranové a infekčné komplikácie
Poruchy hojenia operačnej rany a kožného laloka
Najčastejšou ranovou komplikáciou je dehiscencia, nasledujú ulcerácia a nekróza kožného laloka. Predisponuje k nim zvýšený tlak intrakraniálneho obsahu, ktorý po odstránení kostnej platničky priamo tlačí na suturovanú kožu. Ďalšími predispozíciami sú ranové infekcie, likvorea, operačné revízie a ischemizácia kožného laloka spôsobená rozsiahlym kožným rezom, ktorý je nutný pre dostatočný prístup k lebke, zvlášť, ak sa poškodí vetva a. temporalis superficialis. V prípade rozvoja dehiscencie rany a následnej ranovej infekcie je vyššie riziko jej prestupu aj na samotný, už napríklad úrazom poškodený mozog [1,2,10,58]. Pri T-incízii sú najviac rizikové rohy oboch kožných lalokov, pri otáznikovitom reze jeho temporookcipitálna časť, najmä ak sú poškodené okcipitálne a retroaurikulárne artérie [3]. Kožný lalok by nemal zasahovať viac ako 5 cm retroaurikulárne. Jeho dobré vyživovanie je možné dosiahnuť aj začínaním oblúkovitého kožného rezu nie pre – ale retroaurikulárne, zároveň môžeme počas operácie prechodne uvoľniť retrakciu kožného laloka, čím zlepšujeme jeho cirkulačné pomery [2,58]. Liečbou dehiscencie rany sú pri prítomnosti tenzného vyklenutia dekomprimovanej oblasti iniciálne denné preväzy. Pri ústupe edému mozgu nasleduje resutúra, v prípade neúspechu je nutná operačná revízia, niekedy sa nevyhneme ani použitiu posuvných alebo vzdialených kožných lalokov, rovnako ako pri liečbe nehojacich sa ulcerácií a kožných nekróz [58].
Likvorea v operačnej rane
Likvorea v operačnej rane sa vyskytuje v 3,7–6,3 % [5,10]. Predstavuje zvýšené riziko infekčných komplikácií [2]. Tradične uznávanou prevenciou môže byť vodotesné zošitie dury, galey a kože [3]. Komparácia techník s voľnou a naopak, vodotesnou duraplastikou však nepotvrdila štatisticky významné rozdiely medzi prítomnosťou likvorey či pooperačnej infekcie [10,59]. Iniciálnou liečbou likvorey v operačnej rane je resutúra a zavedenie odľahčujúcej externej lumbálnej drenáže [3].
Pooperačné ranové a hlboké infekcie
Pri DK sa neočakáva častejší výskyt infekčných komplikácií ako pri štandardných intrakraniálnych operáciach [3]. Po DK z dôvodu kraniocerebrálneho poranenia sa vyskytujú u 10 % prežívajúcich [5], celkový výskyt hlbokých infekčných komplikácií dosahuje 4 % [10]. Rizikovými faktormi, pri ktorých môžeme očakávať vyššiu incidenciu intrakraniálnych infekcií, sú najmä prítomnosť penetrujúceho poranenia a kontaminácie rany, prípadné úrazové či perioperačné otvorenie prínosových dutín [1,3]. Vyššie riziko infekčných komplikácií bolo potvrdené pri výskyte likvorey [2,60], použití najmä dlhšie trvajúcej ventrikulárnej drenáže [60], či dlhšom zavedení snímača vnútrolebkového tlaku [61] a takisto pri použití syntetických durálnych náhrad [62]. Pri nevykonaní duraplastiky a prekrytí povrchu mozgu hemostatickým materiálom sa signifikantne skracuje operačný čas a zvýšená frekvencia infekčných komplikácií prekvapivo potvrdená nebola [59]. Avšak následná kranioplastika pri takejto technike môže byť komplikovaná obtiažnou preparáciou kožného laloka v teréne adhézií [1]. Zároveň je plastika dury považovaná za prevenciu extraaxiálnych tekutých kolekcií a nadmernej externej mozgovej herniácie [3,5]. Pooperačné infekcie operačnej rany a centrálneho nervového systému samozrejme môžu zvýšiť morbiditu a mortalitu pacientov. Najčastejším agensom býva Staphylococcus epidermidis, ktorý je bežnou flórou na koži, prevenciou je samozrejme prísna asepsa s antibiotickou profylaxiou [2,63]. Infekčné komplikácie – subdurálny empyém a mozgový absces – ilustruje Obr. 4.
Obr. 4. Príklady infekčných komplikácií:
4a – stav po resekcii intraaxiálneho tumoru komplikovanom zakrvácaním, vykonaná evakuácia a dekompresívna kraniektómia, postupne rozvoj septického stavu s nálezom postkontrastne sa sýtiacich stien v resekčnej dutine, intraoperačne verifikovaný intracerebrálny absces; 4b – subdurálny empyém (archív autora)
Fig. 4. Examples of infectious complications:
4a – status after a resection of an intraaxial tumour complicated by haemorrhage, an evacuation of the haemorrhage and decompressive craniectomy was performed, afterwards there was an onset of septic status with a finding of a contrast- enhancing margins of the resection cavity, intraoperatively we have verified an intracerebral abscess; 4b – subdural empyema (author’s archive)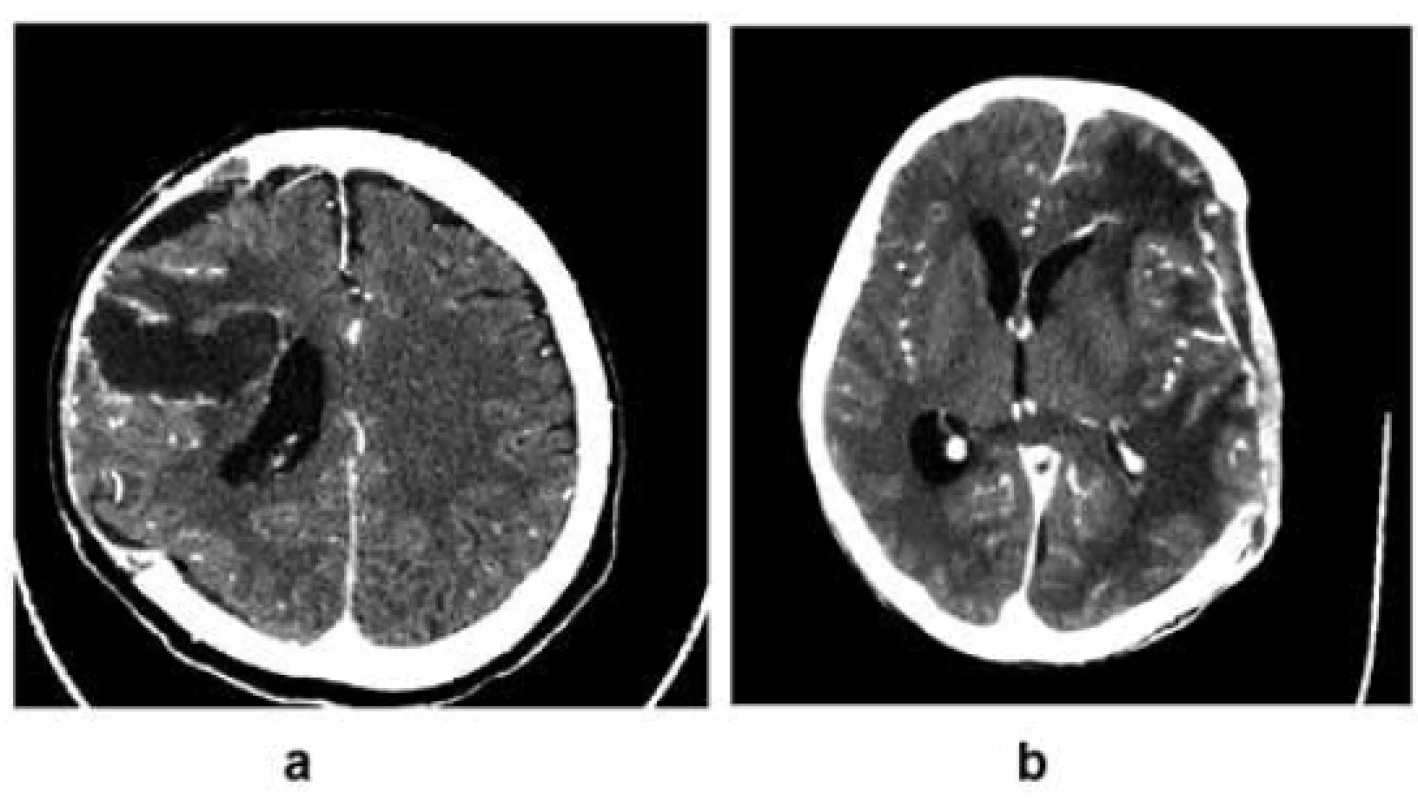
Ostatné komplikácie
Komplikácie po odbere štepu na duraplastiku
Ako materiál pre augmentatívnu plastiku dury využívame štep z fascia lata, perikránia, temporálnej fascie alebo syntetickú durálnu náhradu [3]. V prípade odberu graftu z fascia lata vytvárame druhý operačný prístup, ktorý sám o sebe môže byť zaťažený komplikáciami. Vyskytnúť sa môže nezhojenie alebo nekróza okrajov rany, infekcie, formácia serómu, či hematómu v operovanej oblasti [64–65]. Pri výraznom krvácaní v rane po odbere fascie a formácii podkožného hematómu v stehne je nutná aj operačná revízia. Oneskorenou komplikáciou sú prolongované bolesti a parestézie v operovanom stehne u prežívajúcich alebo aj herniácia kvadricepsu cez defekt fascie [64–65]. Riziko likvorey z operačnej rany je pri využití štepu z perikránia nižšie ako pri využití syntetickej náhrady [62].
Atrofia temporálneho svalu
Oneskorenou komplikáciou po DK je vznik adhézií medzi durou alebo durálnou náhradou a tkanivami kožnosvalového laloka, následne aj atrofia temporálneho svalu. Samotná formácia adhézií sťažuje preparáciu pri kranioplastike s rizikom poškodenia dury či svalu [3]. Musculus temporalis môže byť poškodený aj pri vykonávaní tradičnej temporálnej alebo pterionálnej kraniotómie v prípade excesívneho použitia elektrokoagulácie či pri nešetrnej preparácii s následným poranením cievneho zásobenia a inervácie. Pri DK sa k príčinám jeho atrofie pridáva aj dlhodobá inaktivita či neadekvátne odpreparovanie svalu od dury pri kranioplastickej operácii [3,66]. Kazuisticky bolo vypracovaných viacero techník šetrenia temporálneho svalu, napr. použitie zdvojenej durálnej náhrady na prevenciu adhézií [67]. Viacnásobne bola publikovaná technika použitia syntetického materiálu prekrývajúceho duraplastiku k zamedzeniu vzniku adhézií medzi ňou a temporálnym svalom [68,69]. Použitie syntetických materiálov je však rizikovým faktorom pre rozvoj infekčných komplikácií [62].
Poranenie „odhalenej“ časti mozgu
Neopomenuteľným rizikom vychádzajúcim zo samotnej podstaty DK je možnosť poranenia nechráneného mozgového tkaniva korešpondujúceho s kraniektomickým otvorom. Môže k nemu dôjsť už počas hospitalizácie, napríklad pri páde a nedostatočnom dozore u nefixovaného pacienta, prípadne pri ďalšom poranení po demitácii. Jedinou možnou prevenciou je nosenie ochrannej prilby do času vykonania kranioplastiky a zvýšený dozor nad pacientami po DK [3,70].
Epilepsia
Epilepsia je považovaná skôr za komplikáciu primárnej diagnózy, než DK samotnej. Vychádza z hyperexcitability poškodeného mozgového tkaniva a po závažnom úraze mozgu sa epileptické záchvaty vyskytujú s incidenciou až 79,4 % [5,71]. Skoré poúrazové epileptické záchvaty sa vyskytujú častejšie u mladších pacientov, neskoré u pacientov nad 65 rokov. Ďalšími rizikovými faktormi pri posttraumatickej epilepsii sú intrakraniálne krvácanie – najmä subdurálny hematóm, kontúzne ložiská, alkoholizmus a väčšia závažnosť poranenia [72]. U pacientov po DK pre malígny infarkt v povodí arteria cerebri media sa epileptické záchvaty vyskytujú v 47,5% [73]. Nastavenie pacienta na adekvátnu antiepileptickú liečbu v prípade potreby ostáva v kompetencii neurológa.
Diskusia
Spektrum potenciálnych komplikácií po DK je rozsiahle a tak, ako pri každom chirurgickom výkone, ani v tomto prípade sa im úplne vyhnúť nedokážeme. V neposlednom rade aj preto, že často ide o pacientov v kritickom stave, prípadne s nezanedbateľnými komorbiditami či pridruženými poraneniami. K dosiahnutiu adekvátneho efektu vonkajšej dekompresie a aspoň čiastočnej redukcii možných komplikácií je v prvom rade nutné adekvátne technické zvládnutie operácie. To zahŕňa dostatočný rozsah kraniektómie (posledné odporúčania až do 15x12cm) s odstránením kosti až na bázu strednej jamy [74,75]. V prípade prítomnosti expanzívneho intracerebrálneho ložiska (napríklad hemoragická kontúzia) jeho evakuáciou dosahujeme vnútornú dekompresiu, ktorá celkový efekt operácie potencuje [76]. Aj keď v komparatívnej štúdii nebol potvrdený jednoznačný benefit augmentatívnej plastiky dury mater [59], v rámci českých a slovenských pracovísk a aj v rámci posledných odporúčaní sa k nej skôr prikláňame za účelom prevencie likvorey, subgaleálnych kolekcií, nadmernej herniácie mozgového tkaniva či pooperačných neuroinfekcií [3,74,75]. Pokiaľ je to možné, využívame autológny materiál, ktorý predstavuje nižšie riziko infekcie [62]. Dôležitá je dôsledná sutúra kožnosvalového laloka po vrstvách [74]. Keďže ani vykonaním DK nezískavame definitívnu kontrolu nad intrakraniálnou hypertenziou [77], vhodné je aj po zákroku pokračovať v monitoringu ICP [75–77], aby bolo možné včas terapeuticky zareagovať na jeho prípadný ďalší vzostup či už konzervatívne v rámci pokračujúcej intenzívnej antiedémovej terapie [75], alebo v prípade nutnosti aj chirurgickou revíziou, napríklad s evakuáciou výkon komplikujúceho krvácania [77], či doresekovaním teporálneho svalu pri nutnosti získania ďalšieho objemu pre expandujúci mozog [3,9]. Kontrola po zákroku samozrejme zahŕňa aj včasné pooperačné CT, odporúčania sa hýbu medzi intervalom odstupu 6–24 hodín [2,75]. Nutné sú pravidelné preväzy a kontroly hojenia operačnej rany, stehy extrahujeme neskôr ako pri bežných kraniotómiách, a to väčšinou do 14. pooperačného dňa [3]. Zvýšenú pozornosť treba venovať polohovaniu pacienta na lôžku a bezpečnosti pri prípadnej neskoršej rehabilitácii a vertikalizácii, keďže pri absencii kostného krytu je vyššia šanca na ďalšie poranenie odhaleného mozgového tkaniva [3,70].
Záver
Navzdory svojej technickej priamočiarosti a relatívne jednoduchému princípu so sebou DK prináša značné riziko pooperačných komplikácií. Ich adekvátna prevencia, včasné rozpoznanie a možné terapeutické zvládnutie sú kruciálnou časťou pooperačnej starostlivosti a významne uľahčujú rekonvalescenciu našich pacientov.
Zoznam skratiek:
DK – dekompresívna kraniektómia
ICP – intrakraniálny tlak
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
Práca bola podporená projektom „Využitie systému PACS vo výskume a vývoji“, ITMS kód Projektu 26210120004, ktorý je spolufinancovaný zo zdrojov EÚ/Európskeho fondu regionálneho rozvoja.
doc. MUDr. Branislav Kolarovszki, PhD.
Neurochirurgická klinika,
Jesseniova lekárska fakulta v Martine,
Univerzita Komenského v Bratislave
a Univerzitná nemocnica Martin
Kollárova 2
036 59 Martin
e-mail: branislav.kolarovszki@uniba.sk
Zdroje
- Stiver SI. Complications of decompressive craniectomy for traumatic brain injury. Neurosurg Focus 2009;26(:E7. doi:10.3171/2009.4.FOCUS0965.
- Gopalakrishnan MS, Shanbhag NC, Shukla DP, et al. Complications of decompressive craniectomy. Front Neurol. 2018;9 : 977. doi:10.3389/fneur.2018.00977.
- Mraček J. Dekompresivní kraniektomie. Praha, Galén 2016.
- Jaeger M, Soehle M, Meixensberger J. Effects of decompressive craniectomy on brain tissue oxygen in patients with intracranial hypertension. J Neurol Neurosurg Psychiatry 2003;74 : 513–5.
- Yang XF, Wen L, Shen F, et al. Surgical complications secondary to decompressive craniectomy in patients with a head injury: a series of 108 consecutive cases. Acta Neurochirur. (Wien) 2008;150 : 1241–8. doi:10.1007/s00701-008-0145-9.
- Su TM, Lee TH, Chen WF. Contralateral acute epidural hematoma after decompressive surgery of acute subdural hematoma: clinical features and outcome. J Trauma 2008;65 : 1298–1302. doi:10.1097/TA.0b013e31815885d9.
- Talbott JF, Gean A, Yuh EL, et al. Calvarial fracture patterns on CT imaging predict risk of a delayed epidural hematoma following decompressive craniectomy for traumatic brain injury. AJNR Am J Neuroradiol. 2014;35 : 1930–5. doi:10.3174/ajnr.A4001.
- André M, de O Py M, Niemeyer-Filho P. Temporal muscle haematoma as a cause of suboptimal haemicraniectomy: case report. Arq Neuro-Psiquiatr. 2003;61(3A). doi:10.1590/S0004-282X2003000400030.
- Yu SH, Kim BC, Choi JY, et al. Addition of resection of temporal muscle and fascia in decompressive craniectomy in the treatment of traumatic brain injury. Korean J Neurotrauma 2016;12 : 84–8. doi:10.13004/kjnt.2016.12.2.84.
- Kurland DB, Khaladj-Ghom A, Stokum JA, et al. Complications associated with decompressive craniectomy: A systematic review. Neurocrit Care 2015;23 : 292–304. doi:10.1007/s12028-015-0144-7.
- Iaccarino C, Schiavi P, Picetti E. Patients with brain contusions: predictors of outcome and relationship between radiological and clinical evolution. J Neurosurg. 2014;120 : 908–18. doi:10.3171/2013.12.JNS131090.
- Carnevale JA, Segar DJ, Powers AY, et al. Blossoming contusions: identifying factors contributing to the expansion of traumatic intracerebral hemorrhage. J Neurosurg. 2018;129 : 1305–16. doi:10.3171/2017.7.JNS17988.
- Wilkes S, McCormack E, Kenney K, et al. Evolution of traumatic parenchymal intracranial hematomas (ICHs): comparison of hematoma and edema components. Front Neurol. 2018;9 : 527. doi:10.3389/fneur.2018.00527.
- Szczygielski J, Mautes AE, Müller A, et al. Decompressive craniectomy increases brain lesion volume and exacerbates functional impairment in closed head injury in mice. J Neurotrauma 2016;33 : 122–31. doi:10.1089/neu.2014.3835.
- Nasi D, di Somma L, Glasi M, et al. New or blossoming hemorrhagic contusions after decompressive craniectomy in traumatic brain injury: Analysis of risk factors. Front Neurol. 2018;9 : 1186. doi:10.3389/fneur.2018.01186.
- Flint AC, Manley GT, Gean AD, et al. Post-operative expansion of hemorrhagic contusions after unilateral decompressive hemicraniectomy in severe traumatic brain injury. J Neurotrauma 2008;25 : 503–12. doi:10.1089/neu.2007.0442.
- Lee MH, Yang JT, Weng HH, et al. Hydrocephalus following decompressive craniectomy for malignant middle cerebral artery infarction. Clinical Neurology and Neurosurgery 2012;14(6):555–9. doi:10.1016/j.clineuro.2011.11.027.
- Lonjaret L, Ros M, Boetto S, et al. Brainstem haemorrhage following decompressive craniectomy. J Clin Neurosci. 2012;19 : 1293–5. doi:10.1016/j.jocn.2012.01.014.
- Parizel PM, Makkat S, Jorens PG, et al. Brainstem hemorrhage in descending transtentorial herniation (Duret haemorrhage). Intensive Care Med. 2002;28(1):85–8. doi:10.1007/s00134-001-1160-y.
- Cardinale M, Meaudre E, Cunqi PQ, et al. Duret hemorrhage complicating a sinking skin flap syndrome. Br J Neurosurg. 2017;8 : 1–2. doi:10.1080/02688697.2017.1374350.
- Graham DI, Lawrence AE, Adams JH, et al. Brain damage in non-missile head injury secondary to high intracranial pressure. Neuropathol Appl Neurobiol. 1987;13 : 209–17.
- Nedergaard M, Klinken L, Paulson OB. Secondary brain stem hemorrhage in stroke. Stroke 1983;14 : 501–5.
- Chew KL, Baber Y, Iles L, et al. Duret hemorrhage: demonstration of ruptured paramedian pontine branches of the basilar artery of minimally invasive, whole body post-mortem CT angiography. Forensic Sci Med Pathol. 2012;8 : 436–40. doi:10.1007/s12024-012-9329-y.
- Klintworth GK. The pathogenesis of secondary brainstem hemorrhages as studied in an experimental model. Am J Pathol. 1965;47 : 525–36.
- Stiver SI, Gean AD, Manley GT. Survival with good outcome after cerebral herniation and Duret hemorrhage caused by traumatic brain injury. J Neurosurg. 2009;110 : 1242–6. doi:10.3171/2008.8.JNS08314.
- Hanko M, Kolarovszki B, Varga K, et al. Secondary (Duret) brainstem haemorrhage may not always represent a fatal event. Romanian Neurosurgery 2019;33 : 166–73. doi:10.33962/roneuro-2019-031.
- Timofeev I, Czosnyka M, Nortje J, et al. Effect of decompressive craniectomy on intracranial pressure and cerebrospinal compensation after traumatic brain injury. J Neurosurg. 2008;108 : 66–73. doi:10.3171/JNS/2008/108/01/0066.
- Janatpour ZS, Szuflita NS, Spinelli J, et al. Inadequate decompressive craniectomy following a wartime traumatic brain injury - An illustrative case of why size matters. Mil Med. 2019;pii:usz008. doi:10.1093/milmed/usz008.
- Yamakami I, Yamaura A. Effects of decompressive craniectomy on regional cerebral blood flow in severe head trauma patients. Neurol Med Chir. (Tokyo) 1993;33 : 616–20. doi:10.2176/nmc.33.616.
- Csókay A, Együd L, Nagy L, et al. Vascular tunnel creation to improve the efficacy of decompressive craniectomy in post-traumatic cerebral edema and ischemic stroke. Surg Neurol. 2002;57(2):126–9.
- Sakamoto S, Eguchi K, Kiura Y et al. CT perfusion imaging in the syndrome of the sinking skin flap before and after cranioplasty. Clin Neurol Neurosurg. 2006;108 : 583–5. doi:10.1016/j.clineuro.2005.03.012.
- Yamaura A, Makino H. Neurological deficits in the presence of the sinking skin flap following decompressive craniectomy. Neurol Med Chir. (Tokyo) 1977;17 : 43–53. doi:10.2176/nmc.17pt1.43.
- Akins PT, Guppy KH. Sinking skin flaps, paradoxical herniation, and external brain tamponade: A review of decompressive craniectomy management. Neurocrit Care. 2008;9 : 267–76. doi:10.1007/s12028-007-9033-z.
- Lilja-Cyron A, Andersen M, Kelsen J, et al. Long-term effect of decompressive craniectomy on intracranial pressure and possible implications for intracranial fluid movements. Neurosurgery 2019;pii:nyz049. doi:10.1093/neuros/nyz049.
- Joseph V, Reilly P. Syndrome of the trephined. J Neurosurg. 2009;111 : 650–2. doi:10.3171/2009.3.JNS0984.
- Kim SY, Lee CH, Park IS, et al. Sinking skin flap syndrome after craniectomy in a patient who previously underwent ventriculoperitoneal shunt. Korean J Neurotrauma 2012;8 : 149–52. doi:10.13004/kjnt.2012.8.2.149.
- Isago T, Nozaki M, Kikuchi Y, et al. Sinking skin flap syndrome. A case of improved cerebral blood flow after cranioplasty. Ann Plast Surg. 2004;53 : 288–92.
- Fodstad H, Love JA, Ekstedt J, et al. Effect of cranioplasty on cerebrospinal fluid hydrodynamics in patients with the syndrome of the trephined. Acta Neurochir. (Wien) 1984;70(1–2):21–30.
- Grant FC, Norcross NC. Repair of cranial defects by cranioplasty. Ann Surg. 1939;110 : 488–512.
- Mraček J, Choc M, Mraček Z. Osteoplastická dekompresivní kraniotomie. Cesk Slov Neurol N. 2007;103 : 290–3.
- Aarabi B, Chesler D, Maulucci C, et al. Dynamics of subdural hygroma following decompressive craniectomy: a comparative study. Neurosurg Focus 2009;26(6):E8. doi:10.3171/2009.3.FOCUS0947.
- Wang HK, Lu K, Liang CL, et al. Contralateral subdural effusion related to decompressive craniectomy performed in patients with severe traumatic brain injury. Injury 2012;43 : 594–7. doi:10.1016/j.injury.2010.06.004.
- De Bonis P, Sturiale CL, Anile C, et al. Decompressive craniectomy, interhemispheric hygroma and hydrocephalus: A timeline of events? Clin Neurol Neurosurg. 2013;115 : 1308–12. doi:10.1016/j.clineuro.2012.12.011.
- Paredes I, Cicuendes M, Delgado MA, et al. Normal pressure subdural hygroma with mass effect as a complication of decompressive craniectomy. Surg Neurol Int. 2011;2 : 88. doi:10.4103/2152-7806.82370.
- Salunke P, Garg R, Kapoor A, et al. Symptomatic contralateral subdural hygromas after decompressive craniectomy: plausible causes and management protocols. J Neurosurg. 2015;122 : 602–9. doi:10.3171/2014.10.JNS14780.
- Feng JF, Jiang JY, Bao YH, et al. Traumatic subdural effusion evolves into chronic subdural hematoma: two stages of the same inflammatory reaction? Med Hypotheses 2008;70 : 1147–9. doi:10.1016/j.mehy.2007.11.014.
- Honeybul S, Ho KM. Incidence and risk factors for post-traumatic hydrocephalus following decompressive craniectomy for intractable intracranial hypertension and evacuation of mass lesions. J Neurotrauma 2012;29 : 1872–8. doi:10.1089/neu.2012.2356.
- Takeuchi S, Takasato Y, Masaoka H, et al. Hydrocephalus following decompressive craniectomy for ischemic stroke. Acta Neurochir Suppl. 2013;118 : 289–91. doi:10.1007/978-3-7091-1434-6_56.
- Takeuchi S, Nawashiro H, Wada K, et al. Ventriculomegaly after decompressive craniectomy with hematoma evacuation for large hemispheric hypertensive intracerebral hemorrhage. Clin Neurol Neurosurg. 2013;115 : 317–22. doi:10.1016/j.clineuro.2012.05.026.
- Vedantam A, Yamal JM, Hwang H, et al. Factors associated with shunt-dependent hydrocephalus after decompressive craniectomy for traumatic brain injury. J Neurosurg. 2018;128 : 1547–52. doi:10.3171/2017.1.JNS162721.
- Wang QP, Ma JP, Zhou ZM, et al. Impact of operation details on hydrocephalus after decompressive craniectomy. Neurosciences (Riyadh) 2016;21 : 10–16. doi:10.17712/nsj.2016.1.20150543.
- Takeuchi S, Nagatani K, Wada K, et al. Is Decompressive craniectomy a risk factor for ventriculomegaly? Acta Neurochir Suppl. 2013;118 : 281–3. doi:10.1007/978-3-7091-1434-6_54.
- Malcolm JG, Rindler RS, Chu JK, et al. Early cranioplasty is associated with greater neurological improvement: a systematic review and meta-analysis. Neurosurgery 2018;82 : 278–88. doi:10.1093/neuros/nyx182.
- Waziri A, Fusco D, Mayer SA, et al. Postoperative hydrocephalus in patients undergoing decompressive hemicraniectomy for ischemic or hemorrhagic stroke. Neurosurgery 2007;61 : 489–93. doi:10.1227/01.NEU.0000290894.85072.37.
- Hasan D, Herve L, Tanghe J. Distribution of cisternal blood in patients with acute hydrocephalus after subarachnoid hemorrhage. Ann Neurol. 1992;31 : 374–8.
- Stiver SI, Wintermark M, Manley GT. Motor trephine syndrome: a mechanistic hypothesis. Acta Neurochir Suppl. 2008;102 : 273–7. doi:10.1007/978-3-211-85578-2_51
- Stiver SI, Wintermark M, Manley GT. Reversible monoparesis following decompressive hemicraniectomy for traumatic brain injury. J Neurosurg. 2008;109 : 245–54. doi:10.3171/JNS/2008/109/8/0245.
- Di Rienzo A, Pangrazi PP, Riccio M. Skin flap complications after decompressive craniectomy and cranioplasty: Proposal of classification and treatment options. Surg Neurol Int. 2016;7(Suppl 28):S737–S745.
- Güresir E, Vatter H, Schuss P, et al. Rapid closure technique in decompressive craniectomy. J Neurosurg. 2011;114 : 954–60. doi:10.3171/2009.12.JNS091065.
- Lin C, Zhao X, Sun H. Analysis on the risk factors of intracranial infection secondary to traumatic brain injury. Chin J Traumatol. 2015;18 : 81–3. doi: 10.1016/j.cjtee.2014.10.007.
- Morton R, Lucas 2nd TH, Ko A, et al. Intracerebral abscess associated with the Camino intracranial pressure monitor: case report and review of the literature. Neurosurgery 2012;71:E193–8. doi:10.1227/NEU.0b013e318232e250.
- Malliti M, page P, Gury C, et al. Comparison of deep wound infection rates using a synthetic dural substitute (neuro-patch) or pericranium graft for dural closure: a clinical review of 1 year. Neurosurgery 2004;54 : 599–603; discussion 603–4. doi:10.1227/01.neu.0000108640.45371.1a.
- Zunt JR : Infections of the central nervous system in the neurosurgical patient. Handbook of Clinical Neurology 2010;96 : 125–41. doi:10.1016/S0072-9752(09)96009-2.
- Amir A, Gatot A, Zucker G, et al. Harvesting large fascia lata sheaths. A rational approach. Skull Base Surg. 2000;10(1):29–34.
- Kohanna FH, Adams PX, Cunningham JN Jr., et al. Use of autologous fascia lata as a pericardial substitute following open-heart surgery. J Thorac Cardiovasc Surg. 1977;74 : 14–9.
- Yasuda CL, Costa AL, Franca M Jr., et al. Postcraniotomy temporalis muscle atrophy: a clinical, magnetic resonance imaging volumetry and electromyographic investigation. J Orofac Pain 2010;24 : 391–7.
- Missori P, Paolini S, Ciapetta P, et al. Preservation of the temporal muscle during the frontotemporoparietal approach for decompressive craniectomy: technical note. Acta Neurochir. (Wien) 2013;155 : 1335–9. doi:10.1007/s00701-013-1695-z.
- Bulters D, Belli A. Placement of silicone sheeting at decompressive craniectomy to prevent adhesions at cranioplasty. Br J Neurosurg. 2010;24 : 75–6. doi:10.3109/02688690903506135.
- Kawaguchi T, Hosoda K, Shibata Y, et al. Expanded polytetrafluoroethylene membrane for prevention of adhesions in patients undergoing external decompression and subsequent cranioplasty. Neurol Med Chir. (Tokyo) 2003;43 : 320–3.
- Honeybul S. Decompressive craniectomy: a new complication. J Clin Neurosci. 2009;16 : 727–9. doi:10.1016/j.jocn.2008.06.015.
- Chen W, Li MD, Wang GF, et al. Risk of post-traumatic epilepsy after severe head injury in patients with at least one seizure. Neuropsychiatr Dis Treat. 2017;13 : 2301–6. doi:10.2147/NDT.S141486.
- Frey LC. Epidemiology of posttraumatic epilepsy: A critical review. Epilepsia 2003;44(S10):11–17. doi:10.1046/ j.1528-1157.44.s10.4.x.
- Santamarina E, Sueiras M, Toledo M, et al. Epilepsy in patients with malignant middle cerebral artery infarcts and decompressive craniectomies. Epilepsy Res. 2015;112 : 130–6. doi:10.1016/j.eplepsyres.2015.02.016.
- Mraček J, Mraček Z, Choc M. Poznámky k operační taktice a technice dekompresivní kraniotomie – přehledný referát. Rozhl Chir. 2007;86 : 217–23.
- Hutchinson PJ, Kolias AG, Tajsic T, et al. Consensus statement from the international consensus meeting on the role of decompressive craniectomy in the management of traumatic brain injury. Acta Neurochir. (Wien) 2019; 161 : 1261–74. doi: 10.1007/s00701-019-03936-y.
- Navrátil L. Dekompresivní kraniotomie u kraniocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu. Cesk Slov Neurol N. 2007;103 : 294–301.
- Picetti E, Caspani ML, Iaccarino C, et al. Intracranial pressure monitoring after primary decompressive craniectomy in traumatic brain injury: a clinical study. Acta Neurochir. (Wien) 2017;159(4):615–22. doi: 10.1007/s00701-017-3118-z.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Historie, vývoj a využití klasifikací zlomenin thorakolumbální páteře
- Atlantookcipitální disociace
- Majú trvanie subdurálnej drenáže a počet trepanačných otvorov vplyv na incidenciu recidívy unilaterálneho chronického subdurálneho hematómu?
- Příležitosti k řezu i k hojení
- Instrumentace laterálních mas atlasu cestou inzerce zadního oblouku – morfometrická studie
- Transpedikulární fixace s augmentovanými fenestrovanými šrouby u osteoporotických fraktur páteře
- Využití metod nukleární medicíny v operační léčbě degenerativního postižení bederní páteře
- Prehľad možných komplikácií u pacientov po dekompresívnej kraniektómii
- Téma chronického subdurálneho hematómu v článkoch českých a slovenských autorov
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prehľad možných komplikácií u pacientov po dekompresívnej kraniektómii
- Atlantookcipitální disociace
- Transpedikulární fixace s augmentovanými fenestrovanými šrouby u osteoporotických fraktur páteře
- Historie, vývoj a využití klasifikací zlomenin thorakolumbální páteře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



