-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKarcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
Esophageal cancer − results of surgical treatment at the Department of Surgery I. at the University Hospital Olomouc
The authors present the results of surgical treatment of esophageal cancer at Department of Surgery I, University Hospital Olomouc between 2006−2016. The aim of the study was to use retrospective analysis to evaluate the results of patients operated for esophageal cancer and statistically evaluate the results based on the type of surgical approach (transhiatal, transthoracic).
Method:
A total of 240 patients with esophageal cancer were operated at Department of Surgery I between the beginning of 2006 and the end of 2016. We evaluated respiratory complications, the incidence of anastomotic fistula and complications based on the Clavien-Dindo classification of complications, based on the type of surgical approach selected (transhiatal or transthoracic esophagectomy).
Results:
The patient set included 207 men (86.3%) and 33 women (13.7%). The mean patient age was 60.4 years. The histological type was adenocarcinoma in 145 (60.4%) and squamous cell carcinoma in 90 (37.5%) patients; another type of carcinoma was observed in 5 cases. Transhiatal esophagectomy was performed in 194 patients (80.2%) (transhiatal laparoscopic in 190 and classic Orringer in 4 patients). Transthoracic approach was used in 46 patients (19.2%), thoracoscopic in 16, and thoracotomic in 30 patients. A gastric conduit was used in 236 patients and coloplasty was performed in 4 patients. The mean duration of surgery was 217 min for the transhiatal approach, 239 min for the thoracoscopic approach and 277 min for the thoracotomic approach. Total blood loss per patient was 562 ml on average for all the operated patients. Peri - or postoperative blood transfusions were administered to 148 patients. Lymphadenectomy was performed as part of the procedure in all patients; the mean of 16.1 lymph nodes were removed. The average hospital stay was 20.7 days. In the patient set, 30-day mortality included 12 patients (respiratory complications 10, MI 1, conduit necrosis 1) and 90-day mortality included 4 (multi organ failure during ARDS). Based on statistical analysis, the incidence of respiratory complications significantly correlated with ASA classification (p=0.0001) and Clavien-Dindo classification (p<0.0001). ASA score 3 was significantly more common and ASA score 2 uncommon in patients with severe respiratory complications (respiratory failure, ARDS) compared to patients without respiratory complications. Furthermore, patients with severe complications were significantly more commonly classified as Clavien-Dindo 4 and 5 compared to patients with less severe or no respiratory complications. Based on statistical analysis, we did not observe a significant difference in the rate of respiratory complications between the transhiatal and transthoracic approaches.
Conclusion:
Esophageal cancer is a malignant disease whose curative treatment is surgical esophagectomy. Esophagectomy should unequivocally be performed in specialized centers experienced in the treatment of this serious malignancy (High volume centers) and by knowledgeable oncosurgeons with many years of experience with esophageal surgery.
Key words:
esophageal cancer − transhiatal esophagectomy − transthoracic esophagectomy
Autoři: R. Vrba 1; R. Aujeský 1; M. Stašek 1; K. Vomáčková 1; J. Tesaříková 1; L. Hlaváčková 1; J. Cincibuch 2; D. Vrána 2; M. Horáková 3; J. Zapletalová 4; Č. Neoral 1
Působiště autorů: I. Chirurgická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 1; Onkologická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 2; Oddělení IPCHO Fakultní nemocnice Olomouc 3; Katedra biofyziky Lékařské fakulty Univerzity Palackého 4
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 7, s. 342-348.
Kategorie: Původní práce
Souhrn
Úvod:
Autoři prezentují výsledky chirurgické terapie karcinomu jícnu na I. chirurgické klinice FN Olomouc za období 2006–2016. Cílem práce bylo retrospektivní analýzou vyhodnotit výsledky nemocných operovaných pro karcinom jícnu a statisticky vyhodnotit výsledky na základě operačního přístupu (transhiatální, transtorakální).
Metoda:
V období od roku 2006 do konce roku 2016 bylo na I. chirurgické klinice FN Olomouc operováno celkem 240 pacientů s karcinomem jícnu. V souboru nemocných jsme hodnotili vztah respiračních komplikací, výskytu píštěle v anastomóze a komplikace na základě Clavien-Dindovy klasifikace komplikací v závislosti na typu výkonu (transhiatální nebo transtorakální ezofagektomie).
Výsledky:
V referovaném souboru bylo zastoupeno 207 mužů (86,3 %) a 33 žen (13,7 %). Věkový průměr nemocných byl 60,4 roku. Histologicky byl popsán adenokarcinom u 145 (60,4 %) a spinocelulární karcinom u 90 (37,5 %) nemocných, jiný typ karcinomu v 5 případech. Transhiatální ezofagektomie byla provedena u 194 nemocných (80,2 %) (transhiatální laparoskopická u 190 a Orringerova klasická u 4 nemocných). Transtorakální přístup byl proveden u 46 nemocných (19,2 %). Torakoskopický u 16, torakotomický u 30 nemocných. U 236 nemocných byl jako transponát využit tubulizovaný žaludek a ve čtyřech případech koloplastika. Průměrná doba operace transhitálním způsobem byla 217 min., torakoskopickým 239 min. a torakotomickým 277 min. Celkové krevní ztráty u všech operovaných nemocných byly průměrně 562 ml. Krevní transfuze byla peri - nebo pooperačně podána celkem u 148 nemocných. Součástí výkonu byla u všech nemocných lymfadenektomie, průměrně bylo odstraněno 16,1 lymfatické uzliny. Průměrná doba hospitalizace byla 20,7 dne. V souboru byla 30denní mortalita celkem u 12 nemocných (respirační komplikace 10, IM 1, nekróza transponátu 1) a 90denní mortalita u 4 (multiorgánové selhání při ARDS). Na základě statistického vyhodnocení výskyt respiračních komplikací signifikantně koreluje s ASA klasifikací (p=0,0001) a Clavien-Dingo klasifikací (p<0,0001). U pacientů s výskytem závažných respiračních komplikací (respirační selhání, ARDS) byla zjištěna signifikantně častěji klasifikace ASA 3 a méně často klasifikace ASA 2 než u pacientů bez respiračních komplikací. Dále u pacientů s výskytem závažných komplikací byla zjištěna signifikantně častěji klasifikace Clavien-Dindo 4 a 5 než u pacientů s výskytem méně závažných respiračních komplikací nebo bez výskytu komplikací. V našem souboru jsme na základě statistické analýzy neprokázali signifikantní rozdíl respiračních komplikací v případě transhiatálního nebo transtorakálního přístupu.
Závěr:
Karcinom jícnu je maligní onemocnění, jehož kurativní léčbou je chirurgický výkon ezofagektomie. Ezofagektomie jednoznačně patří do specializovaných center se zkušeností s léčbou této závažné malignity (High volume centers) a do rukou erudovaného onkochirurga s dlouholetou zkušeností s jícnovou chirurgií.
Klíčová slova:
karcinom jícnu − transhiatální ezofagektomie − transtorakální ezofagektomie
ÚVOD
Karcinomu jícnu v České republice v roce 2012 vykazoval incidenci 3,38/100 000 a mortalitu 2,43/100 000. Karcinom jícnu tvoří v 99 % dva základní typy nádorů, v orální a střední třetině jícnu spinocelulární karcinom, v aborálním jícnu adenokarcinom většinou na podkladě prekancerózy Barrettova jícnu. Jedinou kurativní terapií karcinomu jícnu je radikální chirurgický výkon – ezofagektomie [1]. Principem operační terapie je odstranění jícnu s tumorem a lokoregionálními uzlinami ve formě lymfadenektomie [2]. Z chirurgického pohledu je ezofagektomie dle zvoleného typu operace náročný chirurgický výkon s otevřením dutiny břišní, hrudní a hlubokého krčního prostoru. Při tomto rozsáhlém výkonu nelze vyloučit vznik závažných komplikací. Z celkových komplikací nemocné ohrožují zejména respirační komplikace a z chirurgických nekróza transponátu (gastroplastiky, koloplastiky) a dehiscence anastomózy. Cílem práce bylo retrospektivní analýzou vyhodnotit výsledky nemocných operovaných pro karcinom jícnu a statisticky vyhodnotit výsledky na základě operačního přístupu (transhiatální, transtorakální).
METODA
V souboru nemocných s karcinomem jícnu byly retrospektivní analýzou zhodnoceny výsledky operační terapie na I. chirurgické klinice FN Olomouc za období 2006−2016. V souboru nemocných jsme hodnotili vztah respiračních komplikací, výskytu píštěle v anastomóze a komplikací na základě Clavien-Dindovy klasifikace komplikací v závislosti na typu výkonu (transhiatální nebo transtorakální ezofagektomie). Karcinom jícnu byl diagnostikován endoskopickým vyšetřením s biopsií tumoru, endosonografickým a PET/CT vyšetřením. Při lokalizaci tumoru v orální partii jícnu bylo doplněno tracheobronchoskopické vyšetření k vyloučení infiltrace dýchacích cest nádorem. Před operačním výkonem bylo u všech nemocných provedeno interní, spirometrické a nutriční vyšetření. Selektivně u nemocných s kardiologickou anamnézou bylo doplněno kardiologické a echokardiografické vyšetření. K vyloučení infekce dýchacích cest bylo sedm dnů před operací všem nemocným odebráno sputum a stěr z krku na mikrobiologické vyšetření. Na základě mikrobiologické kultivace sputa byla volena cílená ATB profylaxe. Pokud byla mikrobiologicky závažná kontaminace dolních cest dýchacích, byli nemocní přeléčeni cílenou ATB terapií a výkon byl postponován. Dle předoperačního stagingu karcinomu jícnu byli pacienti v primárních stadiích onemocnění na základě TNM klasifikace (T1-2N0M0) indikováni k primárnímu chirurgickému výkonu, nemocní v pokročilejších stadiích onemocnění (T1-2, N1,2, M0, T3-4, N0-2, M0) bez průkazu generalizace byli indikováni k neoadjuvantní onkologické terapii. Nutritivní jejunostomie dle Witzela byla založena u pacientů s endoskopicky stenotizujícím tumorem jícnu před zahájením neoadjuvance. Neoadjuvance proběhla ve formě tří cyklů chemoterapie v kombinaci preparátů 5-fluorouracil a cisplatiny, radioterapie frakcionovaně po 2 Gy v celkové dávce 55 Gy. Po neoadjuvanci byl proveden restaging onemocnění (PET/CT, endoskopie) ke zhodnocení efektu neoadjuvantní terapie a pacienti byli v odstupu 8–12 týdnů od skončení terapie indikováni k ezofagektomii. Ezofagektomie byla provedena hybridním způsobem (kombinovaným miniinvazivním a klasickým způsobem) nebo klasickým způsobem. Pokud byl tumor jícnu lokalizován v jeho aborálních partiích, indikovali jsme transhiatální miniinvazivní ezofagektomii, jen při předchozích operacích v oblasti ezofagokardiální junkce nebo při kontraindikaci miniinvazivního přístupu jsme provedli Orringerovu ezofagektomii ze střední laparotomie. V případě tumoru lokalizovaného v oblasti hrudního jícnu do vzdálenosti 30 cm od řezáků byl zvolen transtorakální torakoskopický přístup. U nemocných s objemným transtorakálním tumorem, kdy na základě předoperačních vyšetření (PET/CT, EUS) nešlo vyloučit infiltraci dýchacích cest nebo aorty, byla operace provedena primárně z pravostranné torakotomie. Při transhiatálním přístupu byla provedena standardní mediastinální lymfadenektomie do výše bifurkace trachey. Pokud byl přístup torakotomický, byla provedena rozšířená mediastinální lymfadenektomie na pravé straně trachey. Rekonstrukční fáze byla provedena z minilaparotomie a krční incize v hlubokém krčním prostoru resekovaným žaludkem ve formě gastroplastiky. V případě, že nešlo využít gastroplastiku (nádorová infiltrace jícnu i žaludku nebo předchozí operace na žaludku), byla provedena koloplastika. Ve všech případech pro přerušení obou vagových vláken s následnou možností vzniku pylorospazmu byla provedena pyloromyotomie v modifikaci dle Holle. Nemocní byli operováni v endotracheální anestezii v poloze na zádech s abdukovanými dolními končetinami. Transhiatální miniinvazivní fáze operace byla provedena z pěti incizí za použití 5 portů, byly použity čtyři 10mm a jeden 5mm port. Po přerušení malého omenta harmonickým skalpelem a separaci bráničních crus byl postupně jícen s tumorem transhiatálně separován od mediastinální pleury a uvolňován z mediastina, současně byla provedena lymfadenektomie. Po skončení miniinvazivní resekční fáze bylo pokračováno klasickým způsobem, z levostranného krčního přístupu byl v hlubokém krčním prostoru přerušen jícen, který byl z minilaparotomie exstirpován. Anastomóza gastroplastiky na krční jícen byla konstruována v jedné vrstvě pokračujícím stehem. Transtorakální ezofagektomie byla provedena z pravostranné torakoskopie v modifikované poloze na břiše nemocného. Operováno bylo vždy v selektivní endotracheální intubaci do levého bronchu při kolabované pravé plíci. Byly použity celkem čtyři incize pro 10mm porty. Po disekci mediastinální pleury byl uvolněn celý torakální jícen s tumorem, véna azygos byla přerušena cévním endostaplerem. Klasická operace byla provedena z pravostranné torakotomie 5. nebo 6. mezižeberním prostorem. Po disekci mediastinální pleury a palpačním vyloučení infiltrace dýchacích cest nebo aorty karcinomem jícnu následovala exstirpace jícnu s mediastální lymfadenektomií. Při zachování onkologické radikality výkonu byla anastomóza konstruována ručně end to end v dutině hrudní celkem v 7 případech. Po změně polohy nemocného na záda následovala rekonstrukční fáze s identickým postupem jako u transhiatální ezofagektomie. Po operaci byli nemocní hospitalizováni na oddělení intenzivní péče chirurgických oborů (IPCHO), výživa byla zajištěna enterálně nutritivní biluminální nazojejunální sondou a parenterálně. Kontrolní polykací akt k ověření suficience anastomózy a nálezu na gastroplastice nebo koloplastice byl proveden 5. až 7. pooperační den, při jeho příznivém nálezu byli pacienti přeloženi na standardní oddělení a postupně realimentováni a propuštěni do domácí péče.
VÝSLEDKY
V období od roku 2006 do konce roku 2016 bylo na I. chirurgické klinice operováno celkem 240 pacientů s karcinomem jícnu (Tab. 1). V souboru bylo zastoupeno 207 mužů (86,3 %) a 33 žen (13,7 %). Věkový průměr nemocných byl 60,4 roku, nejmladšímu pacientovi bylo 34 a nejstaršímu 79 let. Histologicky byl popsán adenokarcinom u 145 (60,4 %) a spinocelulární karcinom u 90 (37,5 %) nemocných. Jiný typ nádoru byl popsán u 5 nemocných (malobunečný 2x, mucinózní 2x a adenoskvamózní karcinom 1x). K primárnímu chirurgickému výkonu bylo indikováno 49 pacientů (20,4 %). K neoadjuvantní onkologické terapii bylo indikováno celkem 191 nemocných (79,6 %). Transhiatální ezofagektomie byla provedena u 194 nemocných (80,2 %), transhiatální laparoskopická u 190 a Orringerova klasická u 4 nemocných. Transtorakální přístup byl zvolen u 46 nemocných (19,2 %), torakoskopický u 16, torakotomický u 30 nemocných. U 236 nemocných byl jako transponát využit tubulizovaný žaludek, ve čtyřech případech koloplastika. Průměrná doba operace transhitálním způsobem byla 217 min., torakoskopickým 239 min. a torakotomickým 277 min. Časové rozmezí operací bylo od 163 min. do 372 min. Celkové krevní ztráty u všech operovaných nemocných byly průměrně 562 ml s rozmezím 180–3500 ml. Krevní transfuze byla peri - nebo pooperačně podána celkem u 148 nemocných. Součástí výkonu byla u všech nemocných lymfadenektomie, průměrně bylo odstraněno 16,1 lymfatické uzliny, rozmezí bylo od 5 do 38 uzlin. Průměrná doba hospitalizace byla 20,7 dne, nejkratší hospitalizace byla 11 a nejdelší 119 dnů. Na základě histologického vyšetření resekátu byla vyhodnocena stadia onemocnění karcinomu jícnu dle TNM klasifikace z roku 2009. Ve 20 % případů jsme v definitivním resekátu histologicky neprokázali přítomnost nádoru, byla zaznamenána kompletní odezva na onkologickou léčbu (Tab. 2). Z perioperačních komplikací jsme zaznamenali závažnější krvácení z aorty (3x), poranění dýchacích cest (trachea 2x, levý bronchus 3x). Krvácení a poraněné dýchací cesty byly ošetřeny suturou. Perioperačně jsme u transhiatální laparoskopické ezofagektomie v rámci onkologické radikality výkonu zaznamenali otevření jedné nebo obou pleurálních dutin u 109 nemocných. Otevřené pohrudniční dutiny byly ošetřeny v průběhu operace založením hrudní drenáže na aktivní sání. Respirační komplikace jsme celkem zaznamenali u 104 nemocných (42,6 %). Závažné komplikace typu respiračního selhání a ARDS syndromu s multiorgánovým selháním byly zaznamenány celkem u 29 nemocných (12,1 %). Méně závažné komplikace typu pneumonie, fluidotoraxu, pneumotoraxu a empyému hrudníku jsme prokázali u 73 nemocných (30,5 %). Kardiologické komplikace se vyskytly u 21 nemocných (8,7 %). Nekrózu transponátu, na jejíž následky pacient exitoval, jsme v našem souboru zaznamenali v jednom případě. Píštěl v anastomóze jsme prokázali u 27 nemocných (11,3 %). Typ I. byl u 17, typ II. u 3 a typ III. u 7 nemocných. V 18 případech byla píštěl po transhiatálním přístupu a u 5 nemocných po transtorakální ezofagektomii. Píštěl mezi tracheou a transponátem jsme prokázali u 2 nemocných, píštěl byla ošetřena implantací potaženého biodegradabilního stentu do neojícnu. Chylotorax byl prokázán u 6 nemocných. V případě neúspěšné konzervativní terapie byl u 2 nemocných proveden chirurgický podvaz duktus toracikus. Parézu levého zvratného nervu jsme na základě foniatrického vyšetření provedeného pro chrapot prokázali u 19 nemocných, z toho u 12 nemocných po transhiatální u 5 po transtorakální ezofagektomii. Komplikace operovaného souboru nemocných byly vyhodnoceny dle Clavien-Dindovy klasifikace chirurgických komplikací (Tab. 3). V souboru byla 30denní mortalita celkem 12 (5 %) nemocných (respirační komplikace 10, IM 1, nekróza transponátu 1) a 90denní mortalita 4 (1,6 %) (multiorgánové selhání při ARDS). U transhiatální laparoskopické ezofagektomie byl zaznamenán exitus u 11 (4,6 %) nemocných, u transtorakální torakoskopické ezofagektomie u 5 (2,0 %) nemocných. K analýze dat byl použit statistický software IBM SPSS Statistics verze 22. Ke zjištění závislostí mezi výskytem respiračních komplikací a kvalitativními parametry byl použit Fisherův přesný test (Fisher’s exact test). Závislost mezi výskytem respiračních komplikací a kvantitativními parametry byla posouzena pomocí Kruskal-Wallisova testu. Jako post-hoc test byl použit test Dunnové. Normalita dat byla testována pomocí Shapiro-Wilk testu. Testy byly dělány na hladině signifikace 0,05. Na základě statistického vyhodnocení výskyt respiračních komplikací signifikantně koreluje s ASA klasifikací (p=0,0001) a Clavien-Dingo klasifikací (p<0,0001). U pacientů s výskytem závažných respiračních komplikací (respirační selhání, ARDS) byla zjištěna signifikantně častěji klasifikace ASA 3 a méně často klasifikace ASA 2 než u pacientů bez respiračních komplikací, respektive s výskytem méně závažných komplikací (Tab. 4). Dále u pacientů s výskytem závažných komplikací byla zjištěna signifikantně častěji klasifikace Clavien-Dindo 4 a 5 než u pacientů s výskytem méně závažných respiračních komplikací nebo bez výskytu komplikací (Tab. 4). Výskyt respiračních komplikací signifikantně koreluje s dobou hospitalizace (p<0,0001) a úmrtím (p<0,0001). Signifikantně delší doba hospitalizace byla u pacientů s výskytem závažných komplikací i u pacientů s výskytem nezávažných komplikací. V našem souboru jsme na základě statistické analýzy neprokázali signifikantní rozdíl respiračních komplikací v případě transhiatálního nebo transtorakálního přístupu.
Tab. 1. Charakteristika souboru nemocných pro karcinom jícnu operovaných na I. chirurgické klinice za období od roku 2006 do konce roku 2016
Tab. 1: Set of patients with esophageal cancer undergoing esophagectomy at Department of Surgery I, University Hospital Olomouc between 2006−2016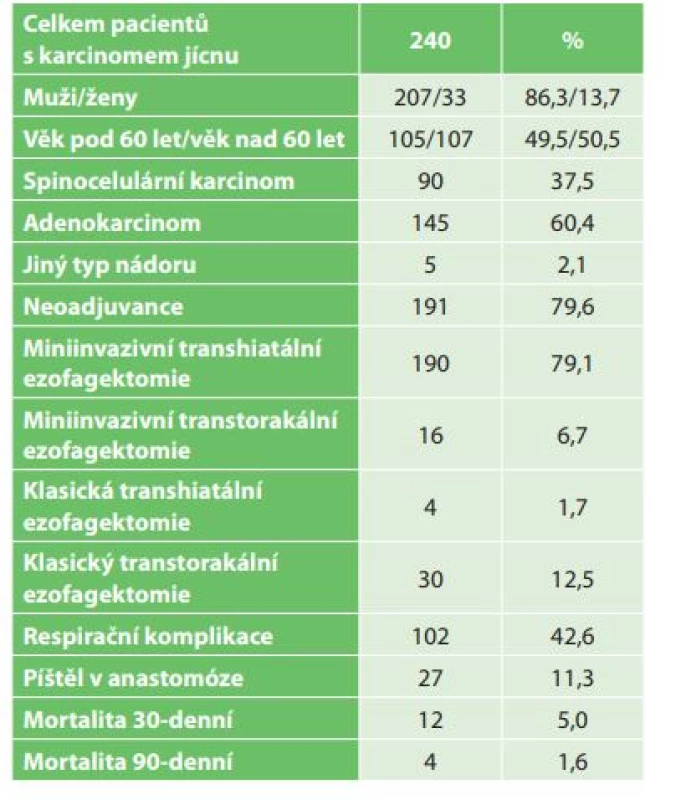
Tab. 2. Staging sestavy nemocných operovaných pro karcinom jícnu na I. chirurgické klinice FN Olomouc, ve 20 % případů byla po neoadjuvantní terapii zaznamenána kompletní patologická remise nádoru
Tab. 2: Staging of the set of patients with esophageal cancer undergoing esophagectomy Department of Surgery I, University Hospital Olomouc; complete pathological response after neoadjuvant therapy was described in 20% patients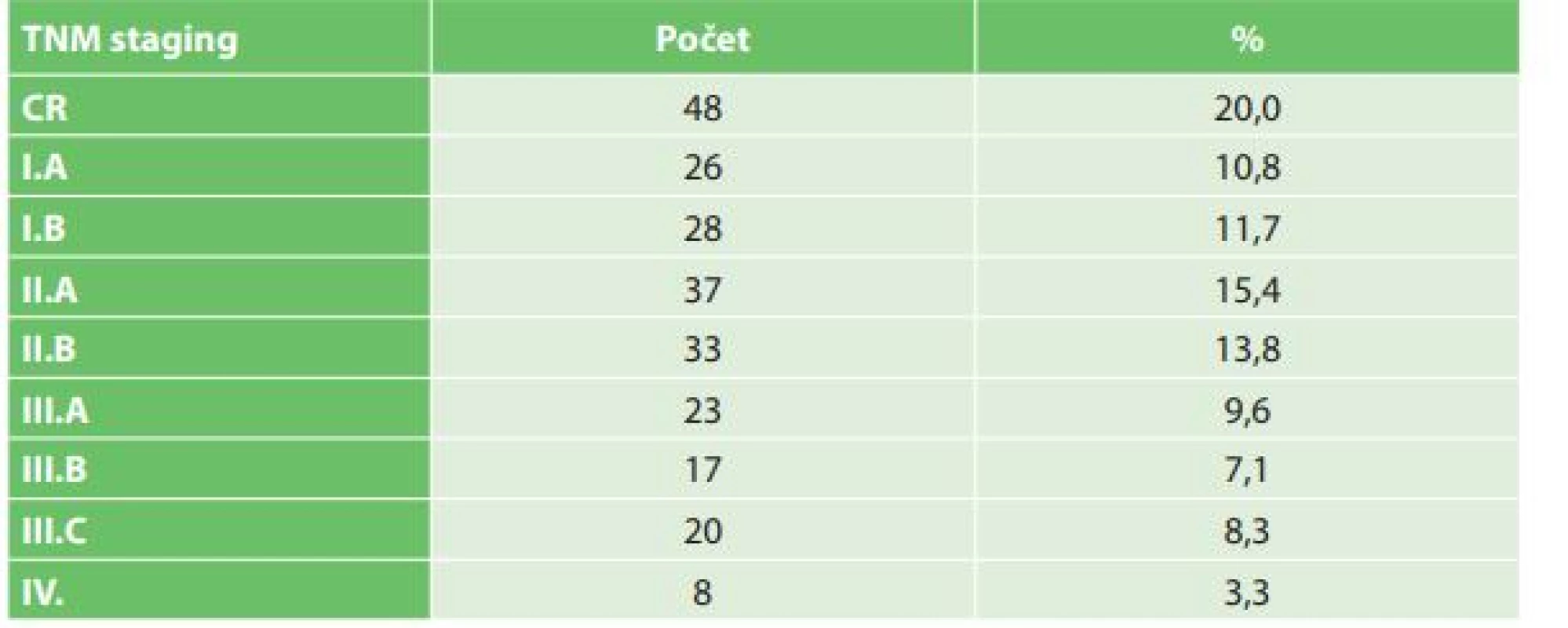
Tab. 3. Clavien-Dindova klasifikace komplikací nemocných operovaných pro karcinom jícnu
Tab. 3: Clavien-Dindo classification of complications in patients after esophagectomy for esophageal cancer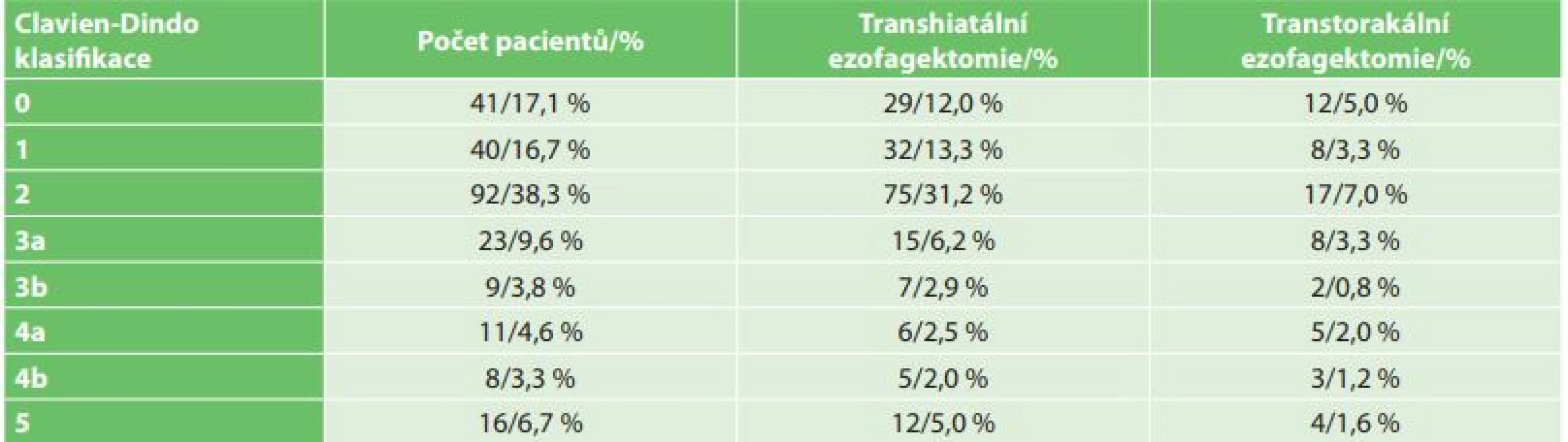
Tab. 4. Statistické vyhodnocení respiračních komplikací (lehké – pneumonie, fluidororax, pneumotorax, závažné – respirační selhání, ARDS) k ASA klasifikaci, neoadjuvanci, typu nádoru, typu výkonu (transhiatální, transtorakální), píštěli v anastomóze, Clavien-Dindovy klasifikaci a exitu
Tab. 4: Statistical evaluation of respiratory complications (mild – pneumonia, fluidothorax, pneumothorax; severe – respiratory failure, ARDS) with respect to ASA classification, neoadjuvant therapy, type of operation (transhiatal, transthoracic), anastomotic dehiscence, Clavien-Dindo classification and exitus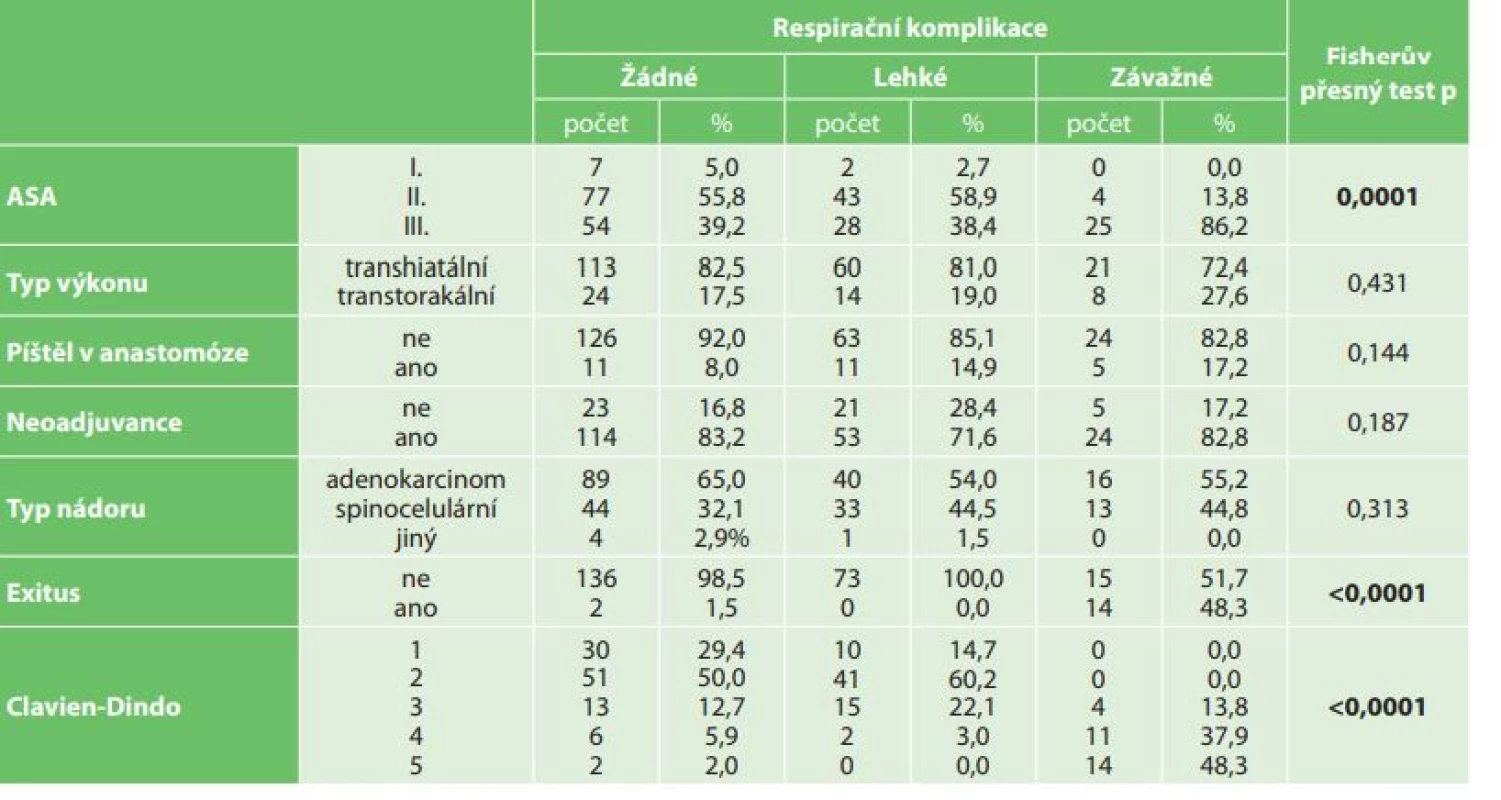
DISKUZE
Jedinou kurativní terapií karcinomu jícnu je chirurgický výkon ezofagektomie. Výkon lze provést klasickým operačním přístupem, hybridní technikou (kombinace klasické a miniinvazivní operace) nebo kompletně miniinvazivně [3,4,5]. Pokud je tumor lokalizovaný v aborálních partiích jícnu, je operace provedena transhiatálním přístupem bez otevření dutiny hrudní s obnovením pasáže většinou tubulizovaným žaludkem ve formě gastroplastiky s konstrukcí anastomózy na pahýl krčního jícnu v hlubokém krčním prostoru. V případě, že nelze jako transponát využít žaludek v důsledku onkologické radikality při maligní infiltraci jícnu a žaludku nebo po předchozích operacích na žaludku, je jako transponát použito tlusté střevo ve formě koloplastiky [6]. Na našem pracovišti preferujeme hybridní operační techniku – kombinaci miniinvazivní a otevřené ezofagektomie [7]. U tumorů v aborálních partiích jícnu je operace zahájena miniinvazivně, transhiatálním přístupem je uvolněn jícen do mediastina nad tumor. Tento přístup volíme u tumorů lokalizovaných ve vzdálenosti 30 cm a distálněji. Za hlavní benefity považujeme dokonalý přehled v operačním poli s možností selektivního ošetření krvácení a provedení standardní lymfadenektomie v mediastinu až k bifurkaci trachey. U tumorů lokalizovaných v orální a střední partii jícnu je ezofagektomie provedena nejčastěji pravostranným, transtorakálním přístupem. Výkon lze provést miniinvazivně torakoskopicky nebo cestou klasické torakotomie. Obnovení zažívacího traktu je možné, pokud je dodržena jeho onkologická radikalika, intratorakální anastomózou nebo lze anastomózu konstruovat v hlubokém krčním prostoru. U intratorakální lokalizace tumoru preferujeme miniinvazivní torakoskopickou resekci jícnu a konstrukci anastomózy na krku. Jen v případech objemného tumoru s možností infiltrace dýchacích cest nebo aorty je výkon primárně proveden z torakotomie. Konstrukce anastomózy je možná manuálně nebo staplerově, popřípadě kombinovaným způsobem. V námi referované sestavě byla konstruována anastomóza manuálně pokračujícím stehem v jedné vrstvě. U všech nemocných operovaných na našem pracovišti pro karcinom jícnu byla provedena pyloromyotomie k vyloučení stagnace obsahu v transponátu při pylorospazmu následkem přerušení obou vagových vláken. Součástí operace byla vždy lymfadenektomie. Na základě anatomické lokalizace rozlišujeme tři kompartmenty uzlin (I. krční, II. hrudní, III. břišní). V hrudním kompartmentu jsou odstraněny mediastinální uzliny, abdominálnímu kompartmentu odpovídá odstranění spádových uzlin z oblasti malé křiviny žaludku (celiakální a suprapankreatické uzliny) [8,9,10]. Ke správnému stanovení klasifikace N dle TNM klasifikace je nezbytné provést lymfadenektomii v počtu nejméně 15 uzlin [11]. Tříkompartmentová lymfadenektomie je preferována především u japonských chirurgů u karcinomu krčního jícnu [12]. U karcinomů středního a aborálního jícnu je všeobecně akceptovaná dvoukompartmentová ezofagektomie, tříkompartmentovou lymfadenektomii je možno provést v ojedinělých případech u tumorů krčního a proximálního hrudního jícnu [10,13]. Při disekci mediastinálních uzlin lze dle rozsahu resekce rozlišovat tři typy lymfadenektomie – standardní, rozšířenou a totální mediastinální lymfadenektomii. Chen popisuje horší prognózu dlouhodobých výsledků u nemocných s vyšším stadiem T a věkem nad 60 let při provedení lymfadenektomie ve třech polích (krční, intratorální a céliacké uzliny) u nemocných operovaných intratorálním přístupem [14]. Počet postižených uzlin metastatickým procesem je udáván jako nezávislý prognostický faktor predikující výsledky chirurgické terapie karcinomu jícnu [15]. Bollschweiller a kol. referuje o signifikantně delším přežívání u nemocných po resekci jícnu s více než 15 negativními uzlinami versus u nemocných s méně než 15 negativními uzlinami (p< 0,01) [16]. V literárních odkazech je mortalita výkonu referovaná v rozmezí od 1,0 % do 5,8 %, morbidita se pohybuje od 17,9 % do 58 % [17,18]. V průběhu operace jsou nemocní ohroženi typickými komplikacemi všech operačních výkonů: krvácením, poraněním orgánů v operačním poli (parenchymatózní orgány dutiny břišní, plíce, pleura, perikard). Dle vlastních zkušeností jsou perioperační komplikace vyřešeny vždy během operace a ve většině případů nemají vliv na další osud nemocných v pooperačním období. Z chirurgických komplikací v pooperačním období patří mezi nejzávažnější nekróza transponátu, ve většině případů se rozvine na podkladě jeho ischemie, přičemž častěji se vyskytuje u koloplastiky (13,3 %) versus gastroplastiky (0,5 %) [19]. Diagnóza je stanovena endoskopicky a chirurgickou revizí. Je-li potvrzena, je indikována resekce transponátu s vyvedením krční ezofagostomie a založením výživné jejunostomie. Ve druhé době je provedena rekonstrukce zažívacího traktu s využitím koloplastiky [19]. Dehiscence anastomózy je v literárních zdrojích popisovaná v rozmezí od 5 % do 20 % [20]. Na základě mezinárodního konsenzu hodnocení komplikací v souvislosti s ezofagektomií jsou popisovány tři typy dehiscencí. Typ I. lokální defekt v polykacím aktu bez změny v terapii nebo pouze dietní opatření. Typ II. lokální defekt nevyžadující chirurgickou terapii, ale vyžadující radiologickou intervenci (implantace stentu, drenáž). Typ III. vyžadující chirurgickou terapii [21]. V našem souboru se vyskytly všechny typy dehiscencí anastomózy dle klasifikace definované Lowem a kol. [21]. Pokud jsou dehiscence správně zaléčeny, vždy došlo k jejich zhojení. Dehiscence se častěji vyskytuje u krční anastomózy než u anastomózy konstruované v hrudníku, naproti tomu dehiscence v hrudníku vykazuje až 60% letalitu s rozvojem mediastinitidy a orgánového selhání při septickém šoku [20]. Komplikací ezofagektomie s nízkou incidencí je píštěl mezi neojícnem a dýchacími cestami, její výskyt je v literatuře udáván v rozmezí 0,3 až 0,5 % [22]. Klinicky se projeví alterací celkového stavu s opakovanými aspiracemi s rozvojem pneumonie. Diagnóza je stanovena RTG polykacím aktem s vodnou kontrastní látkou, endoskopicky a bronchoskopicky [22]. Po zvládnutí akutních symptomů komplikace lze píštěl ošetřit endoskopicky zavedením potahovaných stentů do transponátu nebo dýchacích cest [23]. Pokud tato terapie selže, je indikováno chirurgické ošetření píštěle, resekce píštěle se suturou transponátu a trachey a implantací svalového laloku mezi zažívací trakt a dýchací cesty [24]. V našem souboru jsme u jednoho nemocného tuto komplikaci zaznamenali, píštěl byla ošetřena implantací biodegradabilního potahovaného stentu do transponátu. Při parciálním nebo úplném přerušení duktus thoracikus se může objevit chylothorax [25]. Při jeho průkazu je primárně zahájena konzervativní terapie. V případě jejího neúspěchu při jeho úplném přerušení je nezbytné provést chirurgický podvaz duktus thoracikus. Paréza levého zvratného nervu je u nemocných operovaných z krčního přístupu popisována do 14 % [26]. Mortalita operace je ovlivněna zejména kardiorespiračními komplikacemi, dominantní jsou plicní komplikace, jejich výskyt je udáván v rozmezí od 19,3 % do 44,4 % [17,27]. Jejich vznikem jsou ohroženi zejména nemocní ve vyšších věkových skupinách, s chronickým abuzem nikotinismu, malnutricí, plicní dysfunkcí a poruchou imunity [18]. V případě vzniku závažných plicních komplikací typu respiračního selhání, ARDS syndromu je indikovaná komplexní multioborová terapie těchto komplikací (umělá plicní ventilace, tracheostomie, ATB terapie, toaleta dýchacích cest). Na základě prevence vzniku respiračních komplikací při odběru sputa a výtěru z krku s cílenou profylaxí nebo ATB přeléčením nemocných dle jejich mikrobiologického vyšetření se nám podařilo od roku 2012 redukovat mortalitu nemocných na závažné respirační komplikace z 8,5 % na 6,1 % [28]. U referované sestavy pacientů jsme neprokázali signifikantní rozdíl respiračních komplikací u nemocných s miniinvazivním transhiatálním a transtorkálním (miniinvazivním, klasickým) přístupem. Kardiální komplikace se v pooperačním období vyskytují v rozsahu do 10 % [18]. Na základě operačních výsledků publikovaných prací ezofagektomie pro karcinom jícnu jednoznačně patří do specializovaných center se zkušeností s léčbou této závažné malignity (high volume centers) [29,30].
ZÁVĚR
Karcinom jícnu je maligní onemocnění, jehož kurativní léčbou je chirurgický výkon ezofagektomie. Z chirurgického pohledu je ezofagektomie náročný resekční a rekonstrukční výkon s náhradou exstirpovaného jícnu resekovaným žaludkem ve formě gastroplastiky nebo koloplastiky. Výkon lze provést se srovnatelnými výsledky klasickým nebo kombinovaným miniinvazivním přístupem, typ výkonu odpovídá filozofii daného pracoviště. Napříč spektrem chirurgů zabývajících se jícnovou chirurgií panuje všeobecný konsenzus, že chirurgie karcinomu jícnu patří do rukou erudovaného onkochirurga s dlouholetou zkušeností s jícnovou chirurgií a do specializovaných center.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Radek Vrba, Ph.D.
I. P. Pavlova 6
775 20 Olomouc
e-mail: radek.vrba@fnol.cz
Zdroje
1. Kutup A, Nentwich MF, Bollschweiler E, et al. What should be the gold standard for the surgical component in the treatment of locally advanced esophageal cancer: transthoracic versus transhiatal esophagectomy. Ann Surg 2014;260 : 1016−22.
2. Ninomiya I, Osugi H, Fujimura T, et al. Thoracoscopic esophagectomy with extended lymph node dissection in the left lateral position: technical feasibility and oncologic outcomes. Dis Esophagus 2014;27 : 159−67.
3. Meng F, Li Y, Ma H, et al. Comparison of outcomes of open and minimally invasive esophagectomy in 183 patients with cancer. J Thorac Dis 2014;6 : 1218−24.
4. Zhai C, Liu Y, Li W, et al. A comparison of short-term outcomes between Ivor-Lewis and McKeown minimally invasive esophagectomy. J Thorac Dis 2015;7 : 2352−8.
5. Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label,randomised controlled trial. Lancet 2012;379 : 1887−92.
6. Neoral Č, Král V, Aujeský R. Náhrada jícnu tlustým střevem – zkušenosti se 109 případy. Rozhl chir 2010;12 : 740−5.
7. Aujeský R, Neoral Č, Král V, et al. Videoasistovaná resekce jícnu pro karcinom – desetileté zkušenosti. Rozhl chir 2010;12 : 746−50.
8. Smithers B M, Gotley D C, Martin I, et al. Comparison of the outcomes between open and minimally invasive esophagectomy. Ann Surg 2007;245 : 232−40.
9. Kinjo Y, Kurita N, Nakamura F, et al. Effectiveness of combined thoracoscopic-laparoscopic esophagectomy: comparison of postoperative complications and midterm oncological outcomes in patients with esophageal cancer. Surg Endosc 2012;26 : 381−90.
10. Gao Y, Wang Y, Chen L, et al. Comparison of open three-field and minimally-invasive esophagectomy for esophageal cancer. Interact Cardiovasc Thorac Surg 2011;12 : 366−9.
11. Ursehel JD. Esophagogastrostomy anastomotic leaks complicating esophagectomy: a review. Am J Surg 1995;169 : 634−40.
12. Udagawa H, Tsutsumi K, Kinoshita Y, et al. Operative technique training at en bloc dissection in esophageal surgery. Niphon Geka Gakkai Zasshi 2005;106 : 275−9.
13. Udagawa H, Ueno M, Shinohara H, et al. The importance of grouping of lymph node stations and rationale of three-field lymphadenectomy for thoracic esophageal cancer. J Surg Oncol 2012;106 : 742−66.
14. Chen X, Chen J, Zheng X, et al. Prognostic factors in patients with thoracic esophageal carcinoma staged pT1-4aN0M0 undergone esophagectomy with three-field lymphadenectomy. Ann Transl Med 2015;3 : 282.
15. Chen J, Pan J, Zheng X, et al. Number and location of positive nodes, postoperative radiotherapy, and survival after esophagectomy with three-field lymph node dissection for thoracic esophageal squamous cell carcinoma. Int J Radiat Oncol Biol Phys 2012;82 : 475−82.
16. Bollschweiler E, Baldus SE, Schröder W, et al. Staging of esophageal carcinoma: length of tumor and number of involved regional lymph nodes. Are these independent prognostic factors? J Surg Oncol 2006;94 : 355−63.
17. Ott K, Bader FG, Lordick F, et al. Surgical factors influence the outcome after Ivor-Lewis esophagectomy with intrathoracic anastomosis for adenocarcinoma of the esophagogastric junction: a consecutive series of 240 patient at an experienced center. Ann Surg Oncol 2009;16 : 1017−25.
18. Ferguson MK, Durkin AE. Preoperative prediction of the risk of pulmonary complications after esophagectomy for cancer. J Thorax Cardiovasc Surg 2002;123 : 661−69.
19. Wormuth JK, Heitmiller RF. Esophageal conduit necrosis. Thorac Surg Clin 2006;16 : 11−22.
20. Ursehel JD, Esophagogastrostomy anastomotic leaks comlicating esophagectomy: a review. Am J Surg 1995;169 : 634−40.
21. Low DE, Alderson D, Cecconello I, et al. International consensus on standardization of data collection for complications associated with esophagectomy. Annals of Surgery 2015;262 : 286−94.
22. Buskens CJ, Hulscher JBF, Fockens P, et al. Benign tracheo-neo-esophageal fistulas after subtotal esophagectomy. Ann Thorac Surg 2001;72 : 221−4.
23. Nardella JE, Van Raemdonck D, Piessevaux H, et al. Gastro-tracheal fistula – unusual and life threatening complication after esophagestomy for cancer: a case report. J Cardiothorac Surg 2009;29 : 69.
24. Freire JP, Feijo SM, Miranda L, et al. Tracheo-esophageal fistula: combined surgical and endoscopic approach. Dis Esophagus 2006;19 : 36−9.
25. Atkins BZ, Shan AS, Kelley A, et al. Reducing hospital morbidity and mortality following esophagectomy. Ann Thorac Surg 2004;78 : 1170−6.
26. Nishihira T, Suzuki T, Mori S. A prospective randomized trial of extended cervical and superior mediastinal lymphadenectomy for carcinoma of the thoracic esofagus. American J Surg 1998;175 : 47−51.
27. Tapias LF, Morse CR. Minimally invasive Ivor Lewis esophagectomy: description of a learning curve. J Am Coll Surg 2014;218 : 1130−40.
28. Horaková M, Lubušká L, Kolář K, et al. Individualized prophylaxis in patients with esophageal replacement for cancer. Surgical Infections 2015;16 : 513−7.
29. Pennathur A, Awais O, Luketich JD. Technique of minimally invasive Ivor Lewis esophagectomy. Ann Thorac Surg 2010;89:S2159−62.
30. Van Daele E, Van de Putte D, Ceelen W, et al. Risk factors and consequences of anastomotic leakage after Ivor Lewis oesophagectomy. Interact Cardiovasc Thorac Surg 2016;22 : 32−7.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2018 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Chirurgie horní části zažívací trubice (chirurgie foregutu)
- Využití retrosternálně uloženého kolon v náhradě jícnu
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
- Hybridní torakoskopická resekce jícnu pro karcinom – retrospektivní analýza a srovnání s transhiatální ezofagektomií
- K životnímu jubileu profesora Jana Wechslera
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
- Aktuální stav přípravy nového Vzdělávacího programu oboru chirurgie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití retrosternálně uloženého kolon v náhradě jícnu
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



