-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
Results of minimally invasive esophagectomy for esophageal cancer performed after ischemic gastric conditioning
Introduction: Esophageal tumor resections are extensive procedures with high postoperative complication rates including anastomotic leak. An anastomotic leak occurs when microcirculation in the proximal gastric wall used for esophageal replacement is impaired. Preoperative occlusion of certain gastric vessels (ischemic gastric conditioning) may lead to changes in vascularization and can potentially reduce the occurrence and severity of anastomotic leak after esophageal resection.
Method: This is a retrospective data analysis of patients with esophageal cancer operated on in the Department of Surgery at University Hospital in Brno after previous ischemic gastric conditioning.
Results: Preoperatively, IC was performed by means of a radiological method in 7 patients (embolisation of the left gastric artery). In another 68 patients, a diagnostic laparoscopy was performed and the left gastric artery was surgically divided. During the laparoscopy, a nutritional jejunostomy was performed to enhance nutrition supply in 44 patients with food intake issues due to a stenotizing tumor. In 15 cases, a biopsy from suspicious formations in the abdominal cavity was harvested. In 5 patients, the biopsies revealed malignant disease which had not been discovered with staging radiologic diagnostic methods. After radiological ischemic conditioning, spleen ischemia was found in 2 patients after esophageal resection, and therefore we did not continue to use this method. After surgical gastric ischemic conditioning, 39 mini-invasive esophageal resections were performed. 2 of the resected patients died after the operation (5.1%). Anastomotic leak was found in a total of 8 patients after the resection. In 6 patients with anastomotic leak, management was not complicated and no reoperation was needed. No patient had complete necrosis of the gastric conduit due to ischemia.
Conclusion: Staging laparoscopy is a safe method beneficial for patients with esophageal cancer. It offers exploration of the abdominal cavity to rule out small peritoneal and liver metastases and nutritional jejunostomy for nutrition intake improvement can be done. Ischemic conditioning can also be performed during laparoscopy which may enhance vascularization of the gastric conduit used for esophageal replacement and, despite the fact that it does not reduce the incidence of anastomotic leak, it may reduce its severity. There are no exact recommendations about adequate time delay between ischemic conditioning and esophageal resection. Performing esophageal resection is not altered by previous ischemic gastric conditioning.
Keywords:
esophageal carcinoma – ischemic stomach conditioning – minimally invasive esophagectomy – anastomotic leak – anastomosis stenosis
Autoři: V. Procházka 1
; T. Grolich 1
; V. Čan 1; F. Marek 1; B. Bartušek 2; J. Ivičič 1; Z. Kala 1
Působiště autorů: Chirurgická klinika Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno 1; Klinika radiologie a nukleární medicíny Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno 2
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 7, s. 335-341.
Kategorie: Původní práce
Souhrn
Úvod:
Resekce pro nádory jícnu jsou extenzivní operační výkony s vysokým rizikem pooperačních komplikací včetně anastomotického leaku. Tento vzniká při zhoršení mirkocirkulace ve stěně proximální části žaludku použité k náhradě jícnu. Předoperační uzávěr části cév vyživujících žaludek (ischemický conditioning) může vést ke změnám vaskularizace a potenciálně snížit výskyt a závažnost leaku po resekci jícnu.
Metoda:
Jedná se o retrospektivní analýzu výsledků pacientů po minimálně invazivní resekci jícnu pro nádor na Chirurgické klinice FN Brno po předchozím ischemickém conditioningu žaludku.
Výsledky:
Předoperačně byl ischemický conditioning proveden radiologicky u 7 pacientů (embolizace arteria gastrica sinistra). U dalších 68 pacientů byla provedena stagingová laparoskopie a chirurgicky byla přerušena levá gastrická tepna. Současně byla ve 44 případech provedena výživná jejunostomie k zajištění nutriční přípravy u pacientů se stenotizujícím tumorem jícnu. V 15 případech byla odebrána biopsie ze suspektních ložisek v dutině břišní. V 5 případech byla tato ložiska, která nebyla patrná na předoperačních stagingových vyšetřeních, prokázána jako metastatická. Po radiologickém conditioningu byl u 2 pacientů po následné resekci jícnu prokázán infarkt sleziny, proto jsme radiologii ischemického conditioningu přestali užívat. Po chirurgickém ischemickém conditioningu bylo provedeno 39 miniinvazivních resekcí jícnu pro nádor. 2 pacienti v našem souboru po operaci zemřeli (5,1 %). Celkem byl anastomotický leak zaznamenán v 8 případech (20 %), z toho v 6 případech byl průběh nekomplikován a bez nutnosti operační revize při krční anastomóze. U žádného z pacientů nebyla zjištěna kompletní nekróza žaludečního konduitu.
Závěr:
Stagingová laparoskopie je bezpečným výkonem, který je pro pacienty s tumorem jícnu přínosný. Poskytuje možnost vyloučit drobný metastatický rozsev u pacienta, čímž se zásadně změní strategie jeho léčby, a navíc umožňuje provést výživnou jejunostomii k zajištění nutriční přípravy. Taktéž je možné provést u tohoto výkonu ischemický conditioning žaludku, který může zlepšovat prokrvení gastrického konduitu při následné náhradě jícnu, a i když nesnižuje incidenci anastomotického leaku, může ale snižovat jeho závažnost. Nejsou přesná doporučení o vhodném časovém odstupu mezi conditioningem a resekčním výkonem na jícnu. Resekční výkon na jícnu navíc není předchozím conditioningem komplikován.
Klíčová slova:
karcinom jícnu − ischemický conditioning žaludku − minimálně invazivní ezofagektomie − anastomotický leak − stenóza anastomózy
Klíčová slova:
karcinom jícnu – ischemický conditioning žaludku – minimálně invazivní ezofagektomie – anastomotický leak – stenóza anastomózy
Úvod
Zhoubné nádory jícnu mají ve vyspělých státech světa včetně České republiky vzrůstající incidenci [1]. Kromě velmi časných stadií hraje resekce jícnu v jejich léčbě zásadní roli [2]. Jedná se o extenzivní zákrok s vysokým výskytem pooperačních komplikací. K náhradě jícnu je nejčastěji použit žaludeční konduit, na jehož proximální část je našita anastomóza s resekční linií krčního jícnu. Hojení anastomózy může být negativně ovlivněno řadou faktorů: mobilizací žaludku s podvazem části cévního zásobení, tubulizací žaludku a jeho mechanickým natažením při transpozici mediastinem. Místo anastomózy je zásobeno z pravé gastroepiploické tepny pouze cestou intramurálních větví a kapilár a nikoli z jejího hlavního kmene. Může tak dojít k relativní ischemii s následnou poruchou v hojení anastomózy [3]. Významná část úmrtí pacientů po resekcích jícnu přitom souvisí právě s přítomností anastomotického leaku – podle Briela až u 37 % pacientů. Polovina pacientů po zhojeném anastomotickém leaku má navíc v budoucnu problémy se stenózou anastomózy, což negativně ovlivňuje jejich kvalitu života [4]. Výskyt leaku po resekcích jícnu je častější než při operacích v jiných částech trávicího traktu. I přes různé techniky provedení anastomózy a přípravy žaludečního konduitu zůstává výskyt anastomotického leaku po resekci jícnu stále vysoký [5]. Výskyt leaku nesnížilo ani zavedení moderních miniinvazivních technik [6,12].
Logicky se tedy objevily snahy o zajištění lepšího prokrvení žaludečního konduitu v místě budoucí anastomózy. Pozornost si získala předoperační částečná devaskularizace žaludku nazvaná ischemický conditioning (IC – ischemic conditioning). Předpokládáno je následné zlepšení mirkocirkulace v proximální části žaludku. V roce 1996 Akiyama publikoval takovou přípravu žaludku provedenou radiologickou embolizací žaludečních cév [7]. Chirurgický postup s podvazem části cév vyživujících žaludek v experimentální práci popsal Urschel o rok později [8]. V klinické praxi zatím nebyl prospektivní randomizovanou studií jednoznačně prokázán pozitivní efekt IC na snížení výskytu leaku po ezofagogastroanastomóze [9]. Publikované práce o ischemické přípravě žaludku jsou značně nejednotné, a to zejména v délce časového odstupu mezi provedením IC a resekčním výkonem na jícnu. Byl preferován spíše krátký odstup resekce jícnu mezi 5. a 12. dnem po IC [7,9,10]. Experimentální práce na zvířecím modelu prokázala, že odstup 7 dnů po IC ještě nevede k neovaskularizaci v oblasti fundu žaludku, ale nastává až po několika týdnech [11]. Jistě ale nelze výrazně oddalovat operaci resekabilního nádorového onemocnění u pacientů v dobrém celkovém stavu. Někteří pacienti ale nejsou v době stanovení diagnózy schopni podstoupit časnou resekci jícnu z důvodů nutričních, nebo je u nich z důvodu pokročilého lokálního nálezu na jícnu indikována neoadjuvantní onkologická léčba. Tito vybraní nemocní by tedy mohli profitovat z delšího odstupu mezi IC a resekčním výkonem.
Cílem této práce je retrospektivní analýza výsledků minimálně invazivní torakoskopicky asistované resekce jícnu (MIE – minimally invasive esophagectomy) pro karcinom s krční anastomózou provedené po IC žaludku. Všichni pacienti měli před resekcí jícnu provedenou stagingovou laparoskopii k vyloučení generalizace tumoru s přerušením levé gastrické tepny (AGS – arteria gastrica sinistra). V české literatuře jsme nenalezli žádnou práci, která by se cíleně věnovala klinickým výsledkům resekce jícnu po IC žaludku.
Metoda
U všech pacientů s tumorem jícnu byla provedena standardní stagingová vyšetření: endoskopie s odběrem histologie, endosonografie, výpočetní tomografie (CT), v indikovaných případech pozitronová emisní tomografie (PET) nebo fúzní PET/CT vyšetření (nejasný nález na CT, odhalení generalizace, uzlinové metastázy). U pacientů s resekabilním nebo potenciálně resekabilním tumorem byla indikována stagingová laparoskopie, při níž bylo pátráno po metastázách v dutině břišní, které by dostupné zobrazovací metody neodhalily. Současně byla přerušena levá gastrická tepna a žíla (vlastní IC). U pacientů s poruchou příjmu potravy nebo malnutricí byla navíc provedena výživná jejunostomie k zajištění dobré výživy před další léčbou. Část pacientů byla na naše pracoviště odeslána až po ukončení neoadjuvantní léčby. V těchto případech byla provedena stagingová laparoskopie a IC až v rámci restagingu.
K resekčnímu výkonu nebyli indikováni pacienti s generalizací nádoru a pacienti s lokálně pokročilým tumorem bez odpovědi na neoadjuvantní léčbu. Dále nebyli resekováni pacienti, kteří nebyli interně schopni podstoupit rozsáhlý operační výkon nebo tento výkon odmítli (Tab. 3).
U části pacientů byl proveden IC žaludku radiologickým přístupem. Seldingerovou technikou byla v lokální anestezii provedena punkce femorální tepny. Dále byly retrográdní cestou sondovány větve truncus coeliacus a pomocí coilů byla uzavřena arteria gastrica sinistra. Na závěr výkonu byl nástřikem ověřen uzávěr této tepny (Obr. 1−3).
Minimálně invazivní torakoskopicky asistovaná ezofagektomie (MIE – minimally invasive esophagectomy) byla započata nejprve v pronační poloze pacienta bez selektivní plicní ventilace. Při pravostranné torakoskopii byla uvolněna hrudní část jícnu z mediastina od bránice až po horní hrudní aperturu a současně byla provedena lymfadenektomie. Po změně pacientovy polohy na záda následovalo laparoskopické přerušení krátkých gastrických cév, uvolnění fundu žaludku, gastroezofageální junkce a abdominálního jícnu. Z krátké příčné laparotomie bylo dokončeno uvolnění žaludku se šetřením cévní arkády kolem velké křiviny. Dále byl proveden Kocherův manévr, lymfadenektomie kolem truncus coeliacus, pyloroplastika a vlastní tubulizace žaludku. Po preparaci krční části jícnu a dokončení resekční fáze následovala transpozice tubulizovaného žaludku mediastinem a byla konstruována krční anastomóza stranou ke straně pomocí stapleru délky 60 mm.
Retrospektivně jsme sledovali tyto výsledky minimálně invazivní ezofagektomie: pooperační komplikace, výskyt leaku a stenóz v anastomóze u pacientů po provedení IC. Dále byly sledovány komplikace samotného IC a demografické údaje pacientů.
Výsledky
Celkem byl na Chirurgické klinice FN Brno v letech 2013−2016 proveden IC žaludku u 75 pacientů s tumorem jícnu (Tab. 1). V 7 případech byl proveden IC radiologicky, u 68 pacientů byl tento výkon proveden chirurgicky. U 5 pacientů (7,3 %) byla při laparoskopii nalezena a histologicky potvrzena dříve nediagnostikovaná generalizace nádorového onemocnění v dutině břišní. U těchto pacientů byl resekční výkon kontraindikován a následovala systémová chemoterapie. Ze sedmi pacientů s radiologicky provedeným IC žaludku došlo po resekci jícnu ve dvou případech k ischemii sleziny, která si vyžádala splenektomii (Obr. 4). Proto jsme radiologický IC přestali provádět a dále jsme hodnotili jenom výsledky pacientů po chirurgickém IC. Během stagingové laparoskopie jsme kromě přerušení levé gastrické tepny provedli i další výkony. Nejčastěji se jednalo o výživnou jejunostomii u pacientů s poruchou příjmu potravy (Tab. 1). V jednom případě byla současně provedena pravostranná hemikolektomie. Jednalo se o 42letého pacienta, u kterého byl současně zjištěn adenokarcinom jícnu a duplicitní resekabilní tumor céka. Tumor jícnu byl indikovaný k neoadjuvantní onkologické léčbě, a proto byla primárně provedena pravostranná hemikolektomie a IC. Po neoadjuvatní chemoterapii následovala u pacienta úspěšná resekce jícnu.
Tab. 1. Charakteristika pacientů po ischemickém conditioningu
Tab. 1: Characteristics of patients after ischemic conditioning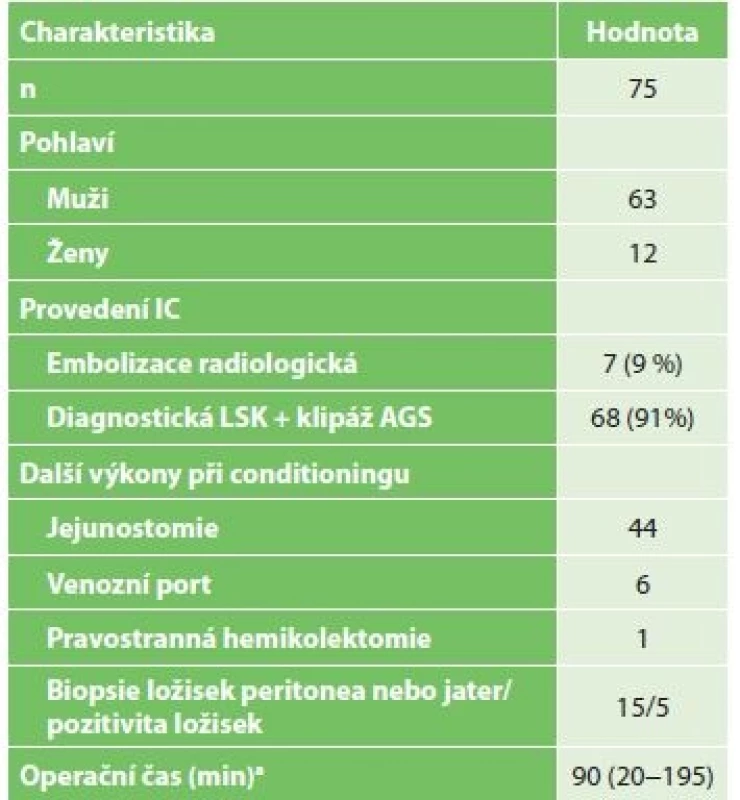
Vysvětlivky: a hodnoty uvedeny jako medián (rozsah) / values are given as median (range) Komplikace po laparoskopickém IC ukazuje Tab. 2. Jednalo se vesměs o komplikace chirurgicky nezávažné. Vyskytly se celkem u 8 pacientů (12 %). Nejčastěji byla nutná výměna ucpané jejunostomické sondy − u 3 pacientů. Dále se u 1 pacienta vyskytl paralytický ileus tenkého střeva, jedenkrát ileus terminálního ilea, v obou případech s úspěšnou konzervativní léčbou. U 1 pacienta byla nutná laparoskopická revize dutiny břišní pro suspekci na krvácení s negativním výsledkem. Povrchní infekce operační rány byla zaznamenána u 2 pacientů.
Tab. 2. Komplikace pacientů po chirurgickém IC
Tab. 2: Patients complications after surgical IC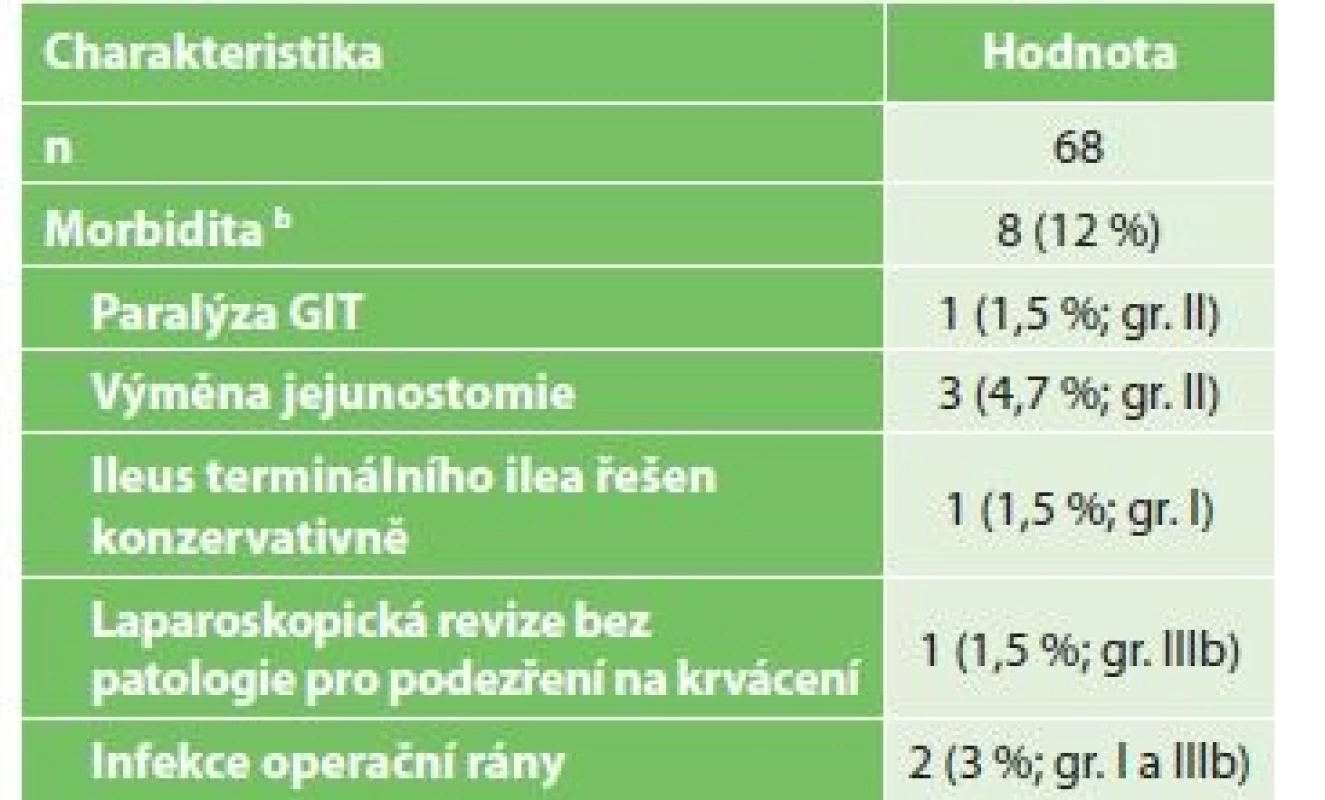
Vysvětlivky: n počet/the total number of patients; a hodnoty uvedeny jako medián (rozsah)/values are given as median (range) ; b klasifikace komplikací dle/classification according to Dindo-Clavien Ze 63 pacientů bez známek generalizace nádoru při stagingové laparoskopii byla následně provedena resekce jícnu u 39 pacientů. Důvody, proč nebyla u zbylých 24 pacientů kurativní resekce možná, jsou shrnuty v Tab. 3. Demografická data pacientů po IC indikovaných k resekci jícnu shrnuje Tab. 4.
Tab. 3. Charakteristika pacientů po chirurgickém IC
Tab. 3: Characteristics of patients after surgical IC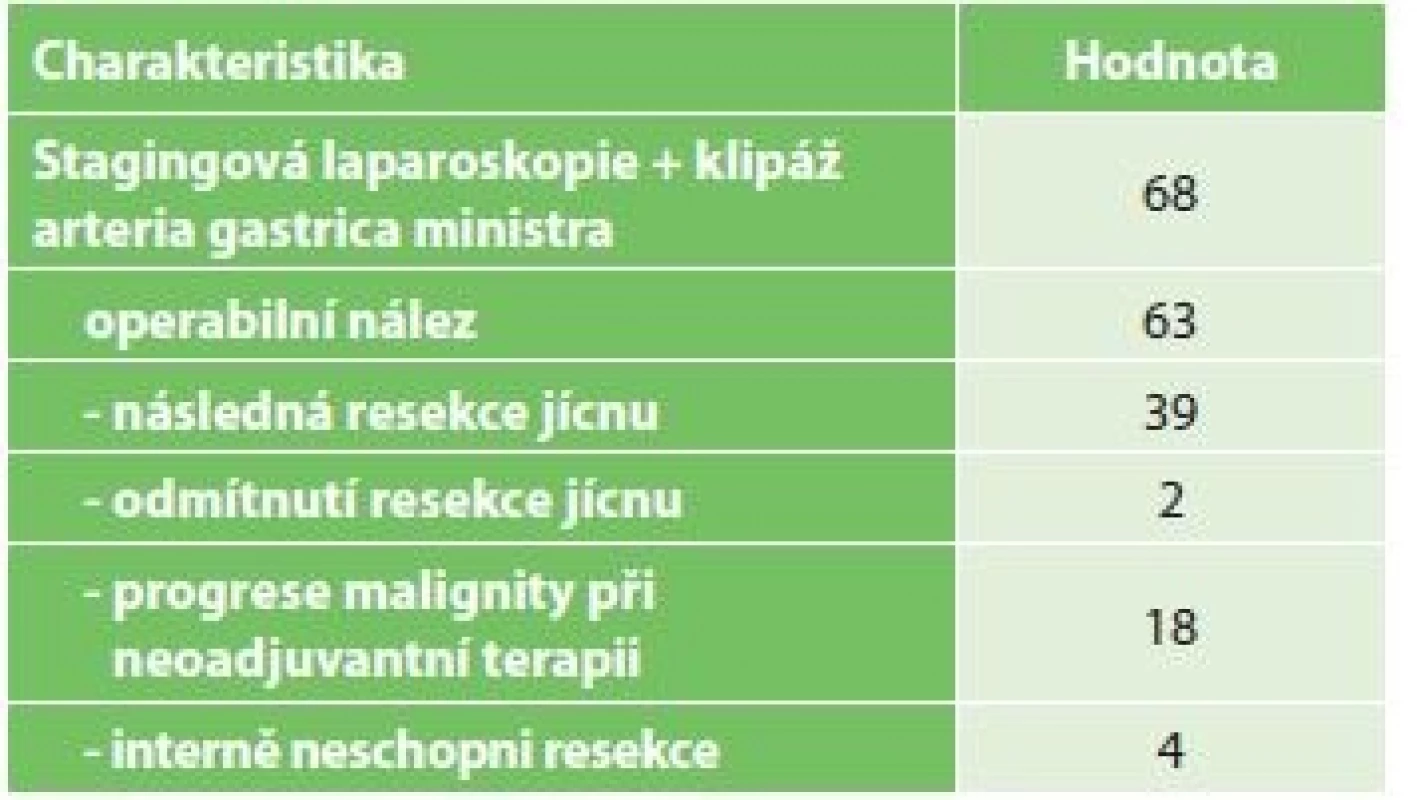
Tab. 4. Charakteristika pacientů indikovaných k resekci jícnu po předchozím chirurgickém IC
Tab. 4: Characteristics of patients indicated for esophageal resection after surgical IC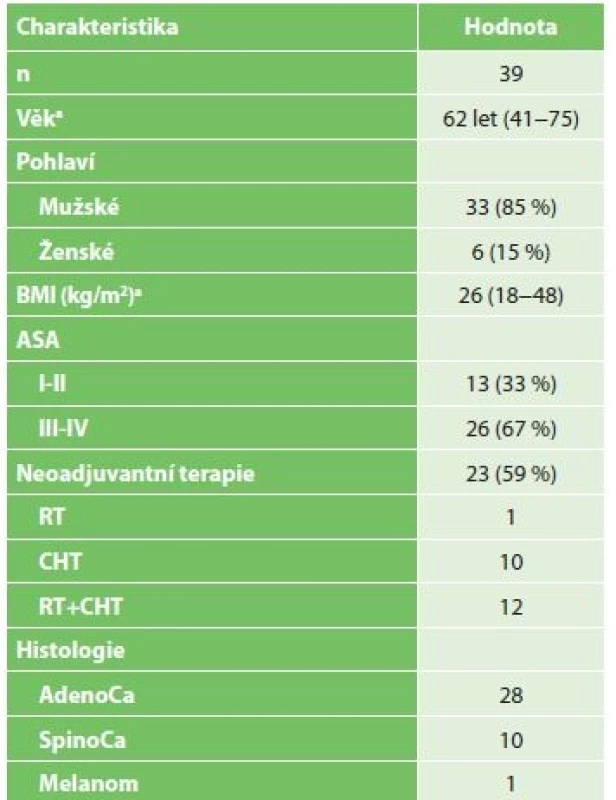
Vysvětlivky: n celkový počet pacientů/the total number of patiens; BMI body mass index; ASA American Society of Anesthesiologist risk skóre; a hodnoty uvedeny jako medián (rozsah)/values are given as median (range) 23 pacientů mělo před resekcí jícnu neoadjuvantní léčbu. Resekce bez neoadjuvance byla provedena u 16 pacientů. Odstup mezi IC a resekcí jícnu byl 9 až 185 dnů. Ve skupině bez proběhlé neoadjuvantní léčby byl medián odstupu 16 dnů, ve skupině s neoadjuvancí byl tento interval 49 dnů.
Komplikace po resekci jícnu jsou shrnuty v Tab. 5. Jako leak byla vedena každá patologická sekrece v oblasti krční incize nebo z hrudního drénu. Kromě 2 případů byl průběh leaku nekomplikovaný, bez známek sepse a během jednoho týdne došlo při lokálním ošetřování rány na krku k vymizení patologické sekrece. Ve zbývajících dvou případech výskytu anastomotického leaku byla nutná operační revize pro zatékání patologické sekrece do pravého hemithoraxu. První tento pacient zemřel, u druhého byla nutná dlouhodobá umělá plicní ventilace s nutností tracheostomie pro oboustrannou bronchopnemonii. Reoperace byla nutná ve 4 případech: 2x pro leak z anastomózy, 1x byla provedena pravostranná retorakoskopie s úspěšnou ligací ductus thoracicus pro chylózní sekreci z hrudního drénu 2 dny po resekci a 1x resutura laparotomie po vyhojení povrchové infekce.
Tab. 5. 30denní morbidita pacientů po miniinvazivní resekci jícnu
Tab. 5: 30-day morbidity of patients after miniinvasive esophagectomy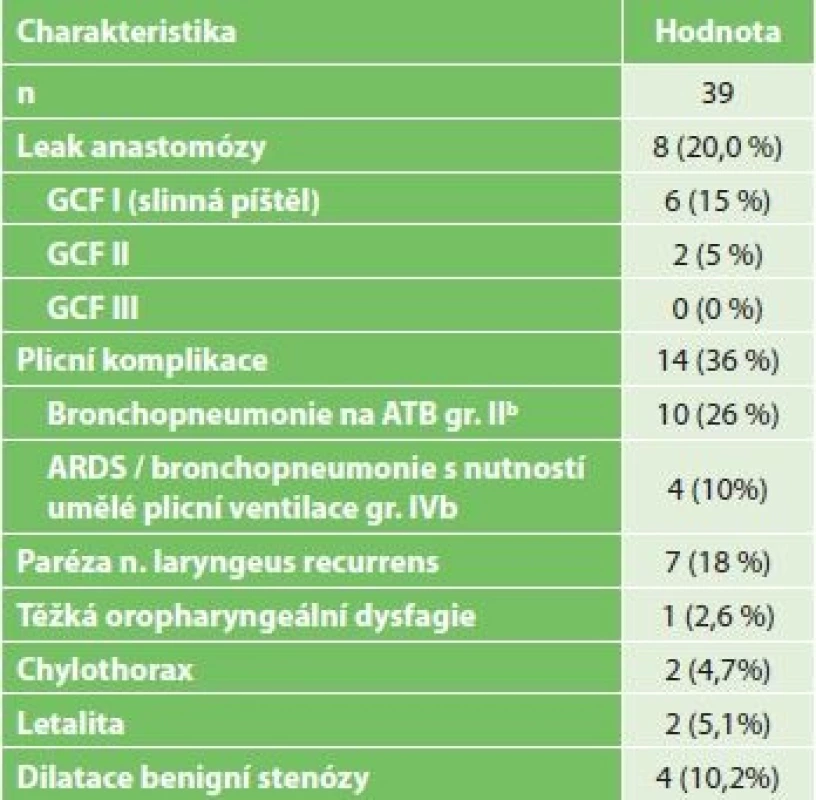
Vysvětlivky: n počet/the total number of patiens; GCF − gastric conduit failure dle Veramooto [13]; GCF I − gastric conduit failure I (selhání žaludečního konduitu 1. stupně) − jednoduchý leak z anastomózy; GCF II − gastric conduit failure II. stupně - nekróza orálního konce žaludečního konduitu; GCF III - gastric conduit failure III. stupně − kompletní nekróza žaludečního konduitu ; b klasifikace komplikací dle/complication classification according to Dindo-Clavien Plicní komplikace byly nejčastějším pooperačním problémem. Jeden pacient zemřel na bilaterální bronchopneumonii bez známek chirurgické komplikace. Při pooperačním sledování došlo k rozvoji stenózy anastomózy ve 4 případech. Všechny stenózy byly histologicky potvrzeny jako benigní a byly řešeny úspěšnou endoskopickou dilatací.
Diskuze
Problémem hodnocení vlivu IC na snížení výskytu nebo závažnosti anastomotického leaku po ezofagektomii je různorodost technik provedení IC, délky odstupu mezi IC a resekcí a také technik samotného resekčního výkonu. V našem souboru pacientů jsme dali přednost provedení chirurgickému IC při stagingové laparoskopii, i když to znamená nutnost operačního výkonu v celkové anestezii. Kromě 2 případů byl u dalších 6 pacientů po torakoskopicky asistované resekci jícnu po provedeném IC zaznamenán anastomotický leak pouze 1. stupně, klasifikován dle Veeramootoo [13], s možnou konzervativní léčbou a rychlým zhojením. Nezaznamenali jsme žádný případ nejzávažnější komplikace, tedy kompletní nekrózu žaludečního konduitu, která by si vyžádala jeho resekci s ezofagostomií. Ve srovnání se světovou literaturou se naše celkové procento zaznamenaných leaků pohybuje v horní polovině většiny udávaných intervalů. Nutno ale říci, že jenom 2 případy z celkově 8 anastomotických leaků byly dle Veeramootoo klasifikace II. Stupně, a tedy klinicky významné (5,1 % resekovaných pacientů). Podle Hegera [26], který publikoval v roce 2017 velkou metaanalýzu dostupných klinických studií zabývajících se resekcí jícnu, nesnižuje IC incidenci anastomotického leaku. Provedení IC před resekcí jícnu ale snižuje počet reoperací pro tuto komplikaci, tedy pravděpodobně snižuje stupeň závažnosti anastomotického leaku.
V našem souboru jsme u 5 pacientů ze 68 nalezli při stagingové laparoskopii generalizaci nádoru, která nebyla dříve standardními stagingovými vyšetřeními prokázána. Laparoskopie navíc umožňuje současně provést výživnou jejunostomii. Přínos stagingové laparoskopie jsme ověřili na našem pracovišti i u jiných malignit trávicího traktu, zejména u karcinomu pankreatu.
Radiologickou metodu IC popsal Akiyama s provedením resekce jícnu za 12 dnů. Jedná se o radiologický intervenční výkon bez anestezie. Jsou však popisována rizika možné dislokace embolizačního materiálu, které se jeví častější než komplikace při laparoskopickém přerušení levé gastrické tepny [7]. V našem souboru 7 pacientů po radiologické embolizaci levé gastrické tepny a následné resekci jícnu jsme ve dvou případech zaznamenali infarkt sleziny, což nebylo pozorováno ani u jednoho pacienta po laparoskopické klipáži žaludečních cév. Navíc je nutné vzít v úvahu i významný finanční rozdíl v podmínkách České republiky, kde je cena endovaskulárního výkonu mnohonásobně vyšší než cena výkonu chirurgického. V literatuře je také diskutováno, zda nedochází po radiologické embolizaci k revaskularizaci na rozdíl od chirurgického přerušení cév, kdy je revaskularizace nemožná [14].
Chirurgických postupů při provedení IC bylo publikováno několik typů: přerušení arkády kolem malé křiviny žaludku vaskulárním staplerem, současné přerušení krátkých gastrických cév, případně i provedení kompletní mobilizace žaludku [10]. V našem souboru byl preferován nejjednodušší postup: chirurgické klipování a přerušení levé gastrické tepny. Cílem minimálnípreparace při stagingové laparoskopii je zabránit pooperačním změnám komplikujícím následný resekční výkon jícnu [15]. V průběhu samotné resekce jícnu jsme nezaznamenali žádné komplikace, které by byly způsobeny stagingovou laparoskopií a provedením IC. Za vhodnější považujeme nepreparovat přímo odstup levé gastrické tepny, ale klipy naložit blíže žaludku, aby nebyla komplikována následná lymfadenektomie kolem větví truncus coeliacus. Tím odpadá i obava z dlouhého odstupu mezi provedením IC a resekční fází, který se někteří autoři snaží zkracovat, aby nedošlo k vytvoření nevýhodných srůstů [10].
Odstup IC a resekce je popisován v širokém rozmezí, nejčastěji do 2 týdnů [7,9]. Velmi krátký odstup doporučil Hölscher spíše z důvodu operační taktiky. Po laparoskopickém kompletním uvolnění žaludku provádí za 4–6 dnů resekci jícnu a anastomózu pouze pravostrannou torakotomií. Transpozice žaludku do hrudníku se děje bez možnosti přímé kontroly břišního nálezu, a transpozice musí být tedy provedena ještě před vytvořením významných adhezí [10]. Tento postup sice vzhledem ke krátkému intervalu od conditioningu nevede k neovaskularizaci, ale umožňuje rozpoznat suficientně prokrvený konduit připravený k anastomóze.
Předpoklad lepšího prokrvení proximální části tubulizovaného žaludku v oblasti budoucí anastomózy po provedení IC byl prokazován různými metodami. Pokles saturace žaludeční sliznice kyslíkem při provedení kompletní mobilizace žaludku byl následován normalizací po 4 až 5 dnech [16]. Metodou laserové dopplerovské flowmetrie bylo prokázáno stejné prokrvení proximální části žaludku za 2 týdny od IC jako při fyziologickém nálezu [17].
Cévní zásobení proximální části žaludku po kompletní mobilizaci a vytvoření žaludečního konduitu není přímo z hlavní cévní arkády kolem velké křiviny, ale z intramurálních větví. Pozornost se proto zaměřila na sledování jejich morfologických změn po IC. Byla prokázána jak novotvorba cév, tak jejich následná dilatace. Hlavní vrchol tvorby neovaskularizace v oblasti fundu žaludku je podle práce Lamase za 15 dnů po IC [18]. Mittermair publikoval studii zabývající se sledováním neovaskularizace žaludku metodou fluorescenční mikroskopie. Do 8 týdnů po chirurgické klipáži levé gastrické tepny narůstala postupně tzv. funkční kapilární denzita v oblasti fundu žaludku. Ve stejném časovém období docházelo i k postupné dilataci vaskulárních větví ve stěně velké křiviny o téměř 90 % [19]. Vasodilataci i angiogenezi v proximální části žaludku po IC prokázaly i další experimentální studie [11]. Reavis provedl na zvířecím modelu ezofagogastrickou anastomózu v různých časových odstupech po IC s následným histologickým vyšetřením. Ve skupině s nejdelším časovým odstupem od IC byla kromě neoangiogeneze a vasodilatace nalezena i nejnižší depozita kolagenu, což může znamenat i menší riziko vzniku pooperační stenózy anastomózy [20]. V našem souboru jsme řešili benigní stenózu anastomózy ve 4 případech.
Experimentální práce tedy favorizují spíše dlouhý odstup resekce jícnu po IC. Velmi zajímavá je v tomto kontextu klinická práce Oezcelika, která je založena na stejném fyziologickém principu jako IC. U 37 pacientů ze souboru 554 ezofagektomií byla peroperačně zhodnocena kvalita vaskularizace tubulizovaného žaludku jako nevhodná k provedení anastomózy. V těchto případech byla zvolena taktika provedení anastomózy v druhé době s vytvořením dočasné krční ezofagostomie s fixací tubulizovaného žaludku v podkoží krku. Všichni pacienti tuto operaci přežili a u 35 z nich byla s odstupem 89 až 110 dnů provedena ezofagogastrická anastomóza. Nebyl zaznamenán žádný leak a pouze u 3 pacientů (9 %) vznikla po operaci stenóza. Jedná se o excelentní výsledky u pacientů s primárně makroskopicky insuficientní vaskularizací žaludečního konduitu [21]. Objevily se i práce zkoumající možnosti farmakologicky podpořit neovaskularizaci a vasodilataci v žaludečním konduitu po resekci jícnu, zatím bez jasných dopadů do klinické praxe [22,23]. Peroperačně je možné hodnotit prokrvení žaludečního konduitu i s použitím fluorescenčního zobrazení po intravenózním podání indocyaninové zeleně (indocyanine green – ICG). Je-li prokrvení žaludečního fundu nekvalitní po mobilizaci žaludku, je výkon ukončen v této fázi a resekce jícnu s tubulizací žaludku je provedena s odstupem 2 týdnů [5,27]. Možnost předoperačního stanovení typu cévního zásobení žaludku je značně limitována. Jistě lze pomocí CT s podáním kontrastní látky zobrazit v arteriální fázi velké cévní kmeny vyživující žaludek (aa. gastricae, aa. gastroepiploicae), ale morfologie cév nemusí nutně odpovídat i stavu funkčnímu. Možnou metodou se jeví podání ICG před a po klipáži AGS a srovnání prokrvení žaludečního fundu. Zkušenosti s tímto postupem jsou ale velmi omezené.
Některé práce doporučují provádět IC pouze u rizikových pacientů, kteří mají kardiopulmonální choroby, renální selhávání nebo kalcifikace odstupu viscerálních tepen z aorty na CT. Výsledky byly publikovány na velmi malých souborech, a není tedy možné posoudit vliv IC na výsledky resekčního výkonu u vybraných skupin pacientů [24]. Předoperační chemoterapie ani chemoradioterapie nemá podle studií vliv na výskyt pooperačních komplikací [25]. V našem souboru pacientů byla chemoterapie u části pacientů vřazena mezi conditioning a resekci jícnu. Výsledky po resekci byly stejné jako u pacientů bez chemoterapie.
Jsme si vědomi toho, že v našem případě se nejedná o prospektivní randomizovanou studii. Výsledky v našem souboru ukazují, že je možné standardní provedení stagingové laparoskopie s IC u všech pacientů chystaných k ezofagektomii nezávisle na tom, zda bude indikována neoadjuvantní léčba nebo resekce jícnu jako první léčebná modalita. Výhodou stagingové laparoskopie je především možnost vyloučení generalizace nádorového onemocnění nezjistitelné jinými diagnostickými metodami a provedení výživné jejunostomie k nutriční přípravě. V naší skupině pacientů nevedl IC ke snížení počtu komplikací po provedení resekce jícnu. Nicméně provedení diagnostické laparoskopie je velkým přínosem pro naši klinickou praxi.
Závěr
Stagingová laparoskopie u pacientů s tumorem jícnu je jednoduchý a přínosný výkon. V našem souboru byla u 5 ze 68 pacientů objevena v průběhu stagingové laparoskopie dříve nediagnostikovaná generalizace malignity ještě před zahájením onkologické léčby, a změnila se tedy celková strategie léčby nemocných, kteří byli do té doby považováni za kandidáty radikálního resekčního výkonu. Navíc tato operace umožňuje založení nutritivní jejunostomie, která je velmi přínosná jak u malnutričních pacientů před operací, tak u všech pacientů po resekci jícnu k časné enterální výživě. Současně může stagingová laparoskopie poskytnout prostor k provedení IC před neoadjuvantní léčbou. Na našem pracovišti tedy nyní provádíme stagingovou laparoskopii s přerušením levé gastrické tepny standardně všem pacientům chystaným k resekčnímu výkonu pro karcinom jícnu. Výhodou toho postupu je především možnost vyloučení nepoznané generalizace nádorového onemocnění a založení výživné jejunostomie u pacientů s poruchou příjmu stravy, což umožní překlenout dobu neoadjuvantní onkologické léčby. I když se zatím jeví, že provedení IC nesnižuje výskyt anastomotického leaku, patrně podle posledních zpráv má IC vliv na zmírnění stupně anastomotického leaku a redukci počtu závažných dehiscencí anastomózy s nutností reoperace. Další studie na větším souboru pacientů by mohly zpřesnit doporučení stran klinického významu IC žaludku, protože doba mezi jeho provedením a resekcí jícnu může být významným faktorem ovlivňujícím neovaskularizaci, a tedy i efektivitu na snížení komplikací plynoucích z poruch hojení anastomózy.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Vladimír Procházka, Ph.D.
Chirurgická klinika FN Brno
Jihlavská 20
625 00 Brno
Zdroje
- Duda M, Adamčík L, Dušek L, et al. Zhoubné nádory jícnu v České republice. Rozhl Chir 2012;91 : 132−40.
- Takeo Y, Yoshida T, Shigemitu T, et al. Endoscopic mucosal resection for early esophageal cancer and esophageal dysplasia. Hepatogastroenterology 2001;48 : 453−7.
- Liebermann-Meffert DM, Meier R, Siewert JR. Vascular anatomy of the gastric tube used for esophageal reconstruction. Ann Thorac Surg 1992;54 : 1110−5.
- Briel JW, Tamhankar AP, Hagen JA, et al. Prevalence and risk factors for ischemia, leak, and stricture of esophageal anastomosis: gastric pull-up versus colon interposition. J Am Coll Surg 2004;198 : 536−41.
- Zehetner J, DeMeester SR, Alicuben ET, et al. Intraoperative assessment of perfusion of the gastric graft and correlation with anastomotic leaks after esophagectomy. Ann Surg 2014;260 : 1030−3.
- Aujeský R, Neoral Č, Král V, et al. Videoasistovaná resekce jícnu pro karcinom – desetileté zkušenosti. Rozhl Chir 2010;89 : 746−9.
- Akiyama S, Ito S, Segikuchi H, et al. Preoperative embolisation of gastric arteries for esophageal cancer. Surgery 1996;120 : 542−6.
- Urschel JD, Takita H, Antkowiak JG. The effect of ischemic conditioning on gastric woung healing in the rat: implications for esophageal replacement with stomach. J Cardiovasc Surg 1997;38 : 535−
- Nguyen NT, Nguyen XM, Reavis KM, et al. Minimally invasive esophagectomy with and without gastric ischemic conditioning. Surgical Endoscopy 2012;26 : 1637−41.
- Hölscher AH, Schneider PM, Gutschow Ch, et al. Laparoscopic ischemic conditioning of the stomach for esophageal replacement. Ann Surg 2007;245 : 241−6.
- Perry KA, Banarjee A, Liu J, Shah N, et al. Gastric ischemic conditioning increases neovascularization and reduces inflammation and fibrosis during gastroesophageal anastomotic healing. Surg Endosc 2013;27 : 753−60.
- Luketich JD, Pennathur A, Awais O, et al. Outcomes after minimally invasive esophagectomy: review of over 1.000 patients. Ann Surg 2012;256 : 95−103.
- Veeramootoo D, Parameswaran R, Krishnadas R, et al. Classification and early recognition of gastric conduit failure after minimally invasive esophagectomy. Surg Endosc 2009;23 : 2010−6.
- Diana M, Hübner M, Vuilleumier H, et al. Redistribution of gastric blood flow by embolisation of gastric arteries before esophagectomy. Ann Thorac Surg 2011;91 : 1546−51.
- Nguyen NT, Longoria M, Sabio A, et al. Preoperative laparoscopic ligation of the left gastric vessels in preparation for esophagectomy. Ann Thorac Surg 2006;81 : 2318−20.
- Bludau M, Hölscher AH, Vallböhmer D, et al. Ischemic conditioning of the gastric conduit prior to esophagectomy improves mucosal oxygen saturation. Ann Thorac Surg 2010;90 : 1121−6.
- Veeramootoo D, Shore AC, Wajed SA. Randomized controlled trial of laparoscopic gastric ischemic conditioning prior to minimally invasive esophagectomy, the LOGIC trial. Surgical Endoscopy 2012;26 : 1822−9.
- Lamas S, Azuara D, de Oca J, et al. Time course of necrosis/apoptosis and neovascularization during experimental gastric conditioning. Dis Esophagus 2008;21 : 370−6.
- Mittermair Ch, Klaus A, Scheidl S. Functional capillary density in ischemic conditioning: implications for esophageal resection with the gastric conduit. Am J Surg 2008;196 : 88−92.
- Reavis KM, Chang EY, Hunter JG, et al. Utilization of the delay phenomenon improves blood flow and reduces collagen deposition in esophagogastric anastomoses. Ann Surg 2005;241 : 736−45.
- Oezcelik A, Banki F, DeMeester SR, et al. Delayed esophagogastrostomy: a safe strategy for management of patients with ischemic gastric conduit at the time of esophagectomy. J Am Coll Surg 2009;208 : 1030−4.
- Matsuzaki Y, Edagawa M, Maeda M, et al. Beneficial effect of prostaglandin E1 on blood flow to the gastric tube after esophagectomy. Ann Thorac Surg 1999;67 : 908−10.
- Enestvedt CK, Hosack L, Hoppo T, et al. Recombinant vascular endothelial growth factor (165) gene therapy improves anastomotic healing in an animal model of ischemic esophagogastrostomy. Dis Esophagus 2012;25 : 456−64.
- Perry KA, Enestvedt CK, Pham Th, et al. Esophageal replacement following gastric devascularization is safe, feasible and may decrease anastomotic complications. J Gastrointest Surg 2010;14 : 1069−73.
- van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012;366 : 2074−84.
- Heger P, Blank S, Diener MK, et al. Gastric preconditioning in advance of esophageal resection-systematic review and meta-analysis. J Gastrointest Surg 2017;21 : 1523−32.
- Ohi M, Toiyama Y, Mohri Y, et al. Prevalence of anastomotic leak and the impact of indocyanine green fluorescein imaging for evaluating blood flow in the gastric conduit following esophageal cancer surgery. Esophagus 2017;14 : 351−9.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2018 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Chirurgie horní části zažívací trubice (chirurgie foregutu)
- Využití retrosternálně uloženého kolon v náhradě jícnu
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
- Hybridní torakoskopická resekce jícnu pro karcinom – retrospektivní analýza a srovnání s transhiatální ezofagektomií
- K životnímu jubileu profesora Jana Wechslera
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
- Aktuální stav přípravy nového Vzdělávacího programu oboru chirurgie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití retrosternálně uloženého kolon v náhradě jícnu
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



