-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kombinované řešení časné tracheobronchopleurální píštěle po pravostranné sleeve pulmektomii
Combined treatment of early tracheobronchopleural fistula after right tracheal sleeve pneumonectomy
Extended tracheo-bronchoplastic resection for lung cancer with carinal involvement ranks among technically demanding procedures. Despite certain progress in oncological therapy, this type of resection remains the only potentially curative treatment of NSCLC in this localization. However, given the severity of complications postoperative mortality is relatively high (7−11%). The main cause of death is tracheobronchopleural fistula complicated by thoracic empyema, bronchopneumonia and septic shock. If ARDS (acute respiratory distress syndrome) develops, the mortality rate rises up to 70%. The treatment of tracheobronchopleural fistula is arduous, long-term and essentially multidisciplinary.
In this case report, the authors present the case of a 58 years old patient developing the tracheobronchopleural fistula early after carinal resection and sleeve pneumonectomy for a centrally localised squamous cell carcinoma of the right lung. The fistula was primarily sutured and secured using a muscular flap. For recurrence of the fistula, tissue adhesive glue was applied in combination with the introduction of a plastic stent, which resulted in healing of the tracheobronchopleural fistula.Key words:
sleeve pulmonectomy − carinal resection − tracheobronchopleural fistula − tracheobronchial stenting
Autoři: J. Hanuliak; M. Szkorupa; J. Chudáček; M. Stašek; Č. Neoral
Působiště autorů: I. chirurgická klinika FN Olomouc přednosta: prof. MUDr. Č. Neoral, CSc.
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 5, s. 213-217.
Kategorie: Kazuistika
Souhrn
Rozšířené tracheobronchoplastické resekce s karinálním postižením u bronchogenního karcinomu patří mezi technicky nejnáročnější výkony v plicní chirurgii. Přes určitý pokrok v onkologické léčbě zůstávají prakticky jedinou skutečně kurabilní metodou léčby nemalobuněčného karcinomu v této lokalizaci. Komplikace po těchto výkonech však mívají závažný charakter, a proto i mortalita je relativně vysoká (7−11 %). Její hlavní příčinou bývají infekční komplikace (bronchopneumonie, sepse, ARDS), nejčastěji na podkladě tracheobronchopleurální píštěle. Pokud dojde k rozvoji ARDS (acute respiratory distress syndrome), dosahuje mortalita až 70 %. Léčba tracheobronchopleurální píštěle je svízelná, dlouhodobá a v zásadě multioborová. V této kazuistice autoři představují případ 58letého pacienta, u kterého se časně objevila tracheobronchopleurální píštěl po pravostranné sleeve pulmektomii pro centrálně uložený spinocelulární karcinom pravé plíce. Píštěl byla primárně ošetřena suturou a pojištěna muskulárním lalokem. Pro recidivu bylo do píštěle aplikováno tkáňové lepidlo v kombinaci se zavedením plastového stentu, na kterém došlo k vyhojení píštěle.
Klíčová slova:
sleeve pulmektomie − resekce kariny − tracheobronchopleurální píštěl − tracheobronchiální stentÚVOD
Na rozdíl od klasické plicní lobektomie jsou bronchoplastické operace technicky náročnější a zatíženy i vyšší perioperační morbiditou a mortalitou. Principiálně se provádějí s cílem prezervace zdravého plicního parenchymu při zachování onkochirurgické radikality. V případě centrálně uložených karcinomů s postižením kariny je sleeve resekce technicky jedinou možnou R0 resekcí. Tracheobronchopleurální píštěl (TBPP) po výkonech tohoto typu je závažná komplikace s incidencí mezi 5−7 % a vysokou mortalitou dosahující až 35 % [1,2]. Hlavními příčinami úmrtí bývají rozvoj postpneumonektomického empyému (PPE) a těžká druhostranná bronchopneumonie způsobená aspirací infikovaného sekretu z pleurální dutiny, zpravidla spojená s rozvojem respirační insuficience, sepse a ARDS. Léčba TBPP je svízelná, multioborová, s nejistým výsledkem.
Autoři představují případ 58letého pacienta, u kterého se objevila časná tracheobronchopleurální píštěl po pravostranné sleeve pulmektomii pro centrálně uložený spinocelularní karcinom pravé plíce.
KAZUSTIKA
U 58letého pacienta byl nově zjištěn spinocelulární karcinom pravé plíce, jenž obturoval pravý hlavní bronchus a zasahoval téměř ke karině. Distálně končil 5−10 mm v intermediárním bronchu. Nemocný opakovaně podstoupil bronchoskopickou rekanalizaci. CT nález koreloval s bronchoskopickým, kdy tumor zasahoval centrálně ke karině (Obr. 1). Na PET/CT nebyly známky generalizace (Obr. 2). Předoperační staging byl hodnocen jako stadium cT3N0M0. Dle spiroergometrie byl pacient schopen výkonu do rozsahu pneumonektomie. Po projednání na pneumoonkochirurgickém boardu byl indikován k primárně operačnímu řešení do rozsahu pravostranné sleeve pneumonektomie, případně parenchym šetřící tracheobronchoplastické resekce.
Obr. 1. Počítačová tomografie hrudníku: nádorové postižení kariny Fig. 1: Computed tomography of the chest: tumor of the carina 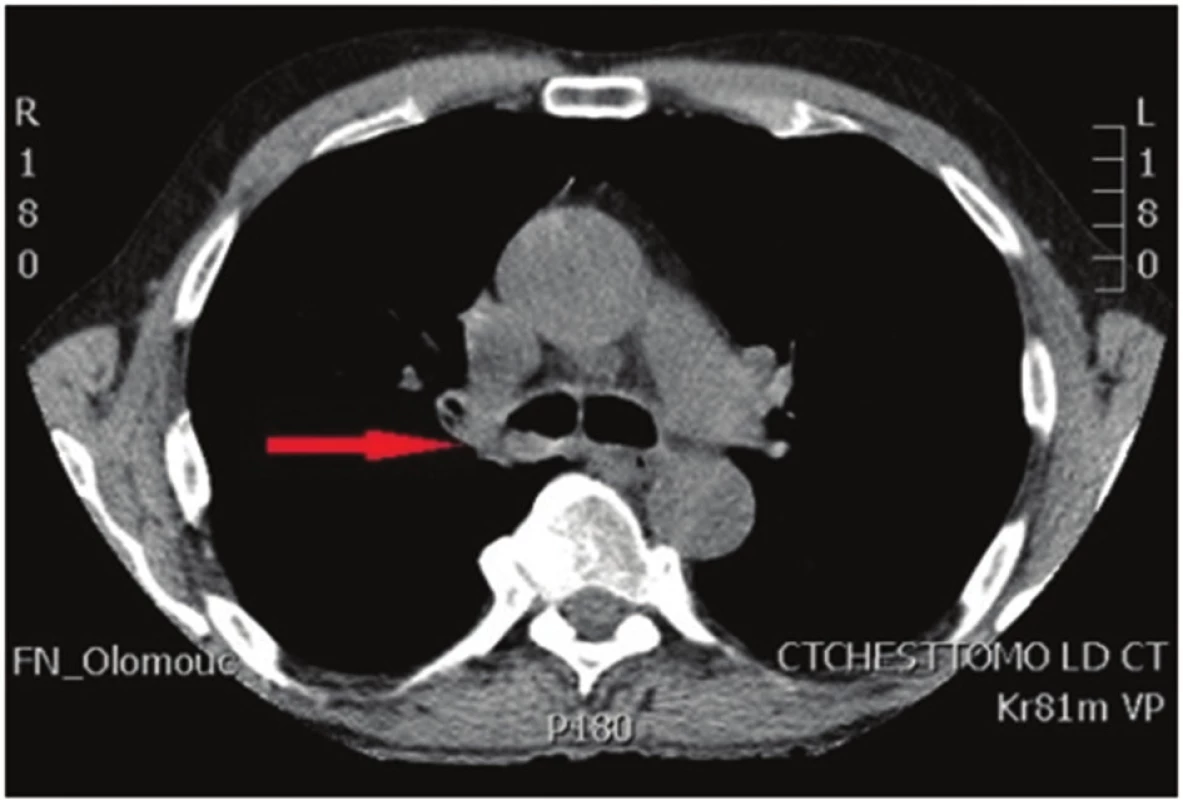
Obr. 2. PET/CT: nádorové postižení kariny Fig. 2: PET/CT: tumor of the carina 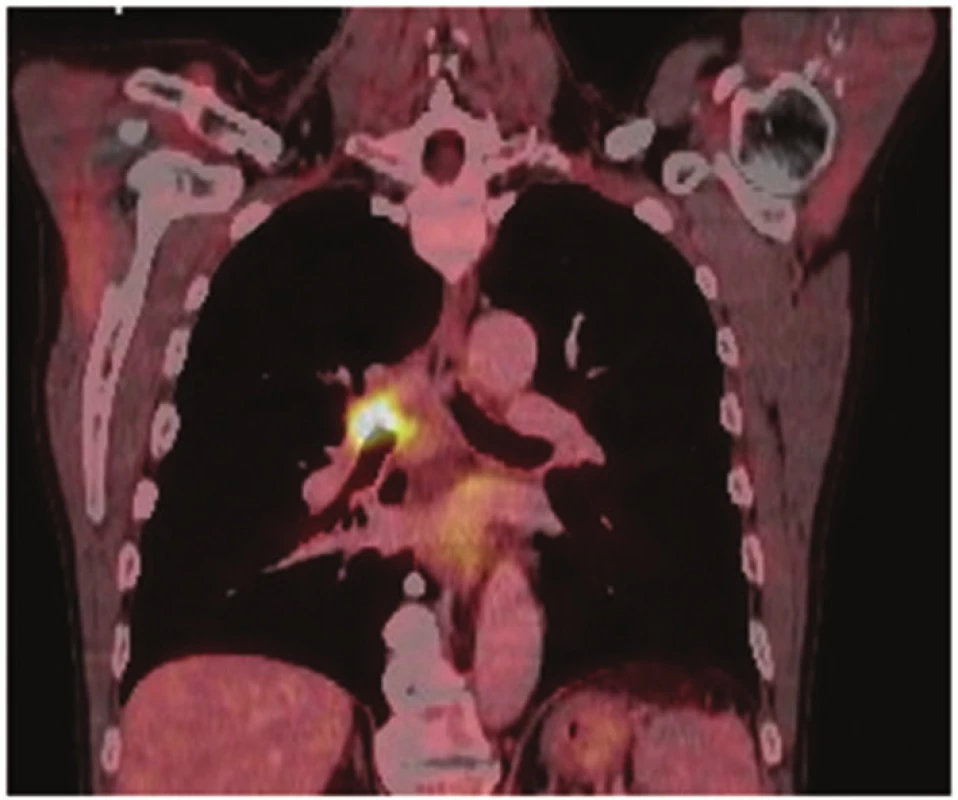
Perioperačně byl nalezen tumor horního lobárního bronchu s šířením centrálně až na karinu (Obr. 3). Primárně byla provedena pravostranná horní lobektomie s resekcí bifurkace trachey (Obr. 4, 5) a s anastomózou levého hlavního bronchu na tracheu, dočasně s ponecháním středního a dolního laloku pravé plíce při předpokladu možné implantace intermediárního bronchu do levého hlavního bronchu. Perioperačně kryo-histologické vyšetření resekčních okrajů trachey a intermediárního bronchu byly negativní. Reimplantace však technicky nebyla možná (zbylá plíce vpravo s intermediárním bronchem ani po uvolnění z perikardu nedosahovala k levému hlavnímu bronchu tak, aby bylo možno bezpečně našít anastomózu), a byla tedy dokončena pneumonektomie vpravo. Anastomóza mezi tracheou a levým hlavním bronchem byla primárně přešita záplatou z v. azygos a zkontrolována vzduchotěsnost anastomózy. Pro kontaminaci operačního pole sekretem z dýchacích cest byla nasazena kurativně antibiotika. 2. pooperační den se objevil z hrudního drénu air leak, jenž v závislosti na poloze pacienta dosahoval až k hodnotám 1500 ml/min. Následovala revize anastomózy, při které byla nalezena netěsnost na její boční hraně, která byla přešita. Anastomóza pak byla zajištěna vitálním interkostálním svalovým lalokem a byla opět vzduchotěsná. Pacient byl po operaci ve stabilním stavu, spontánně ventiloval. V dalším průběhu došlo ke vzniku podkožního emfyzému, hrudní drén byl bez známek air leaku. Z důvodu zmenšení mrtvého prostoru a zlepšení péče o dýchací cesty bylo indikováno založení tracheostomie, po kterém došlo k ústupu podkožního emfyzému. 8. pooperační den byl pacient přeložen na standardní oddělení. 15. pooperační den byla při bronchoskopii verifikována drobná asi 3mm píštěl v anastomóze, kterou se při předešlých bronchoskopiích nepodařilo identifikovat (Obr. 6). 17. pooperační den byl proto v celkové anestezii pomocí bronchoskopu zaveden Dumonův® stent (Obr. 6). 23. pooperační den byl uzavřen hrudní drén, nicméně došlo ke zvýšení expektorace při možné netěsnosti stentu a zatékání sekretu do dýchacích cest. 33. pooperační den byla provedena další bronchoskopie s aplikací dvousložkového tkáňového lepidla na píštěl s úpravou polohy stentu. V dalším průběhu pak zrušena tracheostomická kanyla. Pacient byl stabilní, hrudní drén s nevelkou sekrecí, kultivačně negativní, laboratorně sledován poklesem leukocytů i CRP. 45. pooperační den byl pacient v dobrém stabilním stavu propuštěn do domácí péče s ponechaným hrudním drénem na přenosné hrudní odsávačce Thopas Medela ® s minimálním podtlakem − 3 cm H2O. Za 9 dní od propuštění byl nemocnému extrahován hrudní drén. Dechově suficientní, afebrilní, bez bolestí, ráno kašel s expektorací bílých hlenů, drén před extrakcí odváděl cca 100 ml slámové tekutiny/24 hodin. Za dva měsíce od propuštění byl extrahován stent z dýchacích cest. Po odstranění stentu z dýchacích cest byly nalezeny drobné granulace pod jeho původním dolním koncem (Obr. 7). Pacient byl v dobrém klinickém stavu, bez známek infekce. Nemocný zahájil adjuvantní systémovou onkologickou léčbu.
Obr. 3. Nádorové postižení kariny, stav po horní lobektomii vpravo Fig. 3: Tumor of the carina; status after right upper lobectomy 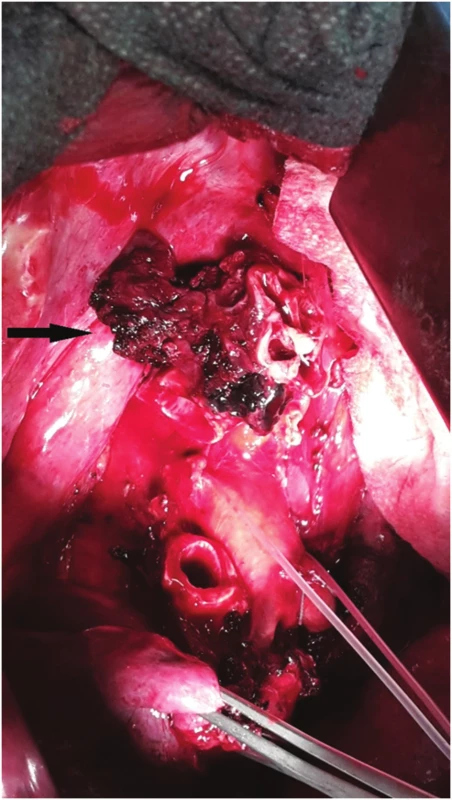
Obr. 4. Selektivní intubace z operačního pole, stav po resekci kariny Fig. 4: Selective intubation from the operation field; status after resection of carina 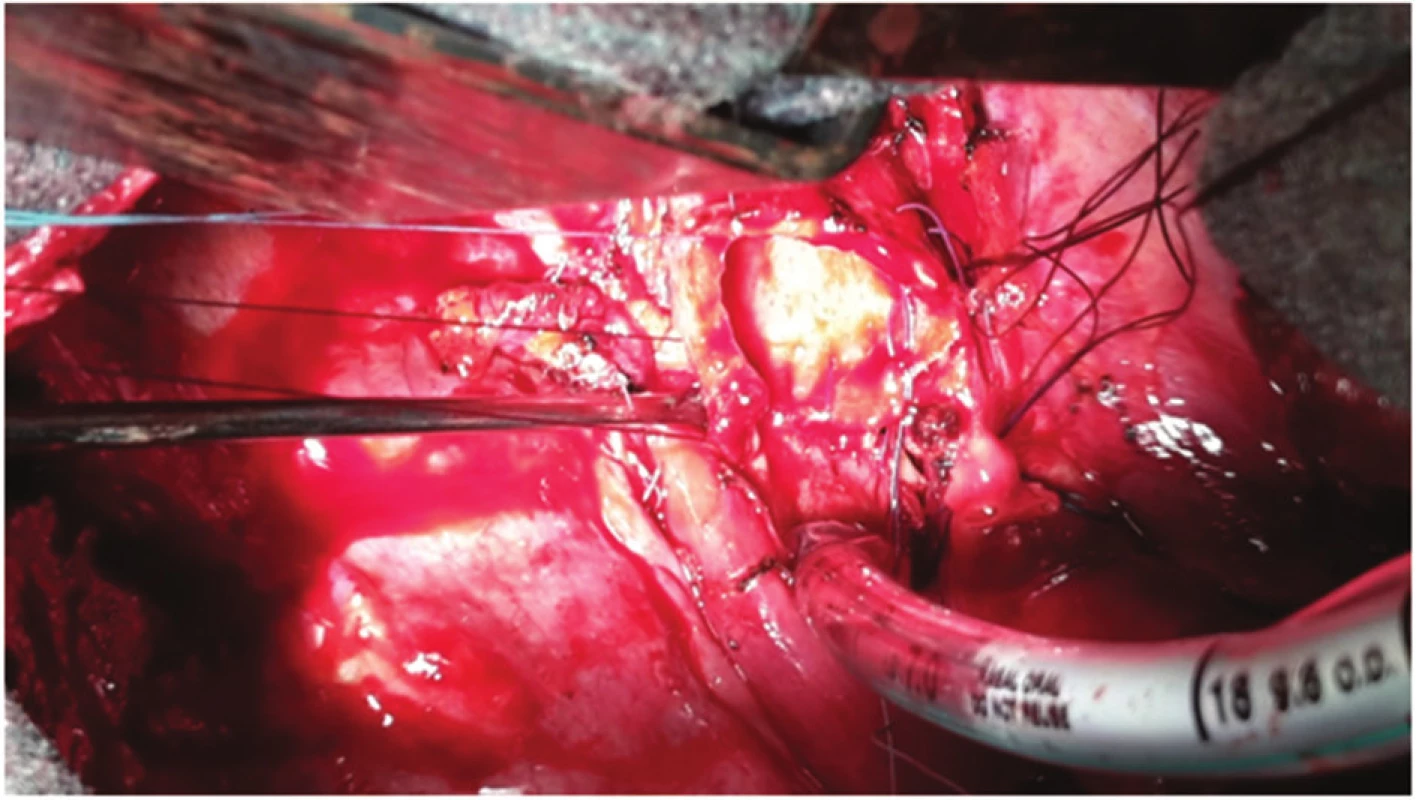
Obr. 5. Bronchoskopický pohled: drobná píštěl v anastomóze (trachea - hlavní levý bronchus) Fig. 5: Bronchoscopic view: small anastomotic fistula (trachea – left main bronchus) 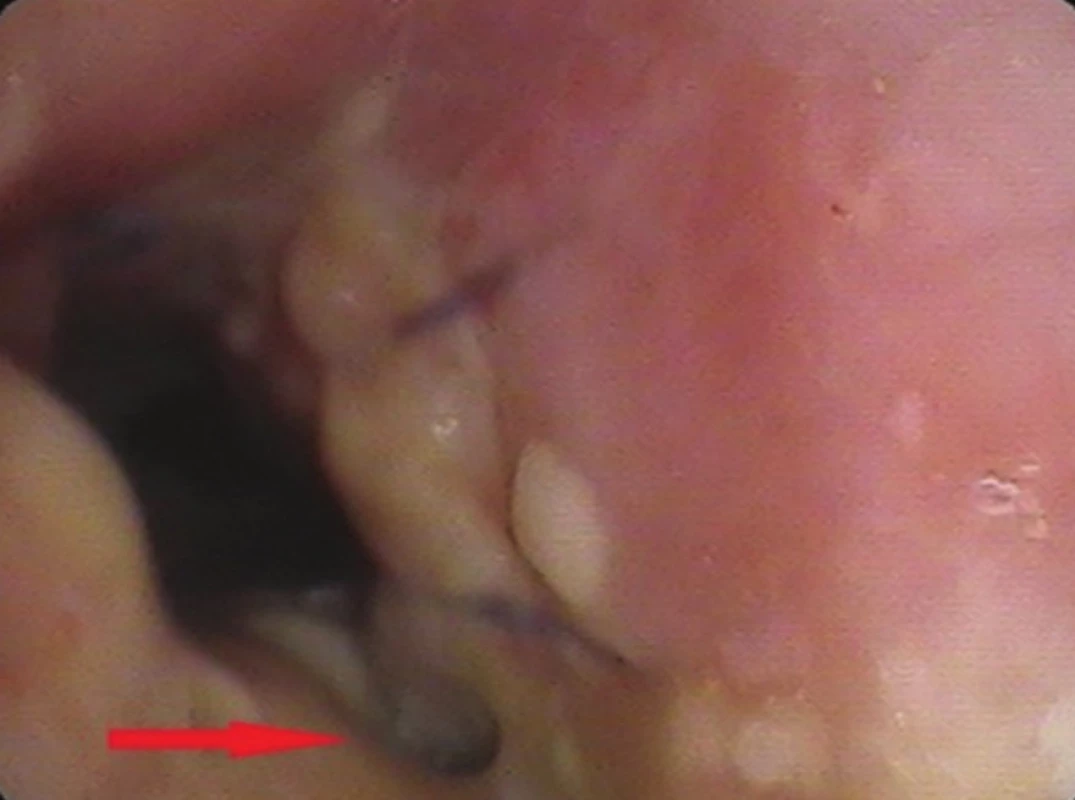
Obr. 6. Bronchoskopický pohled: Dumonův stent v trachey Fig. 6: Bronchoscopic view: Dumon stent in the trachea 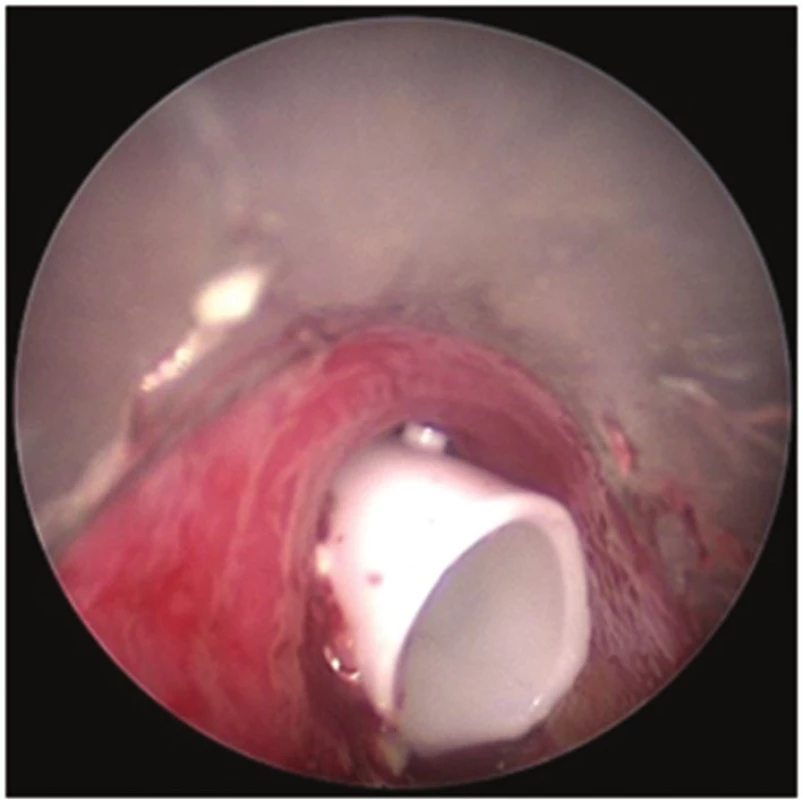
Obr. 7. Bronchoskopický pohled: zhojená anastomóza, stav po vytažení stentu Fig. 7: Bronchoscopic view: healed anastomosis; status after stent extraction 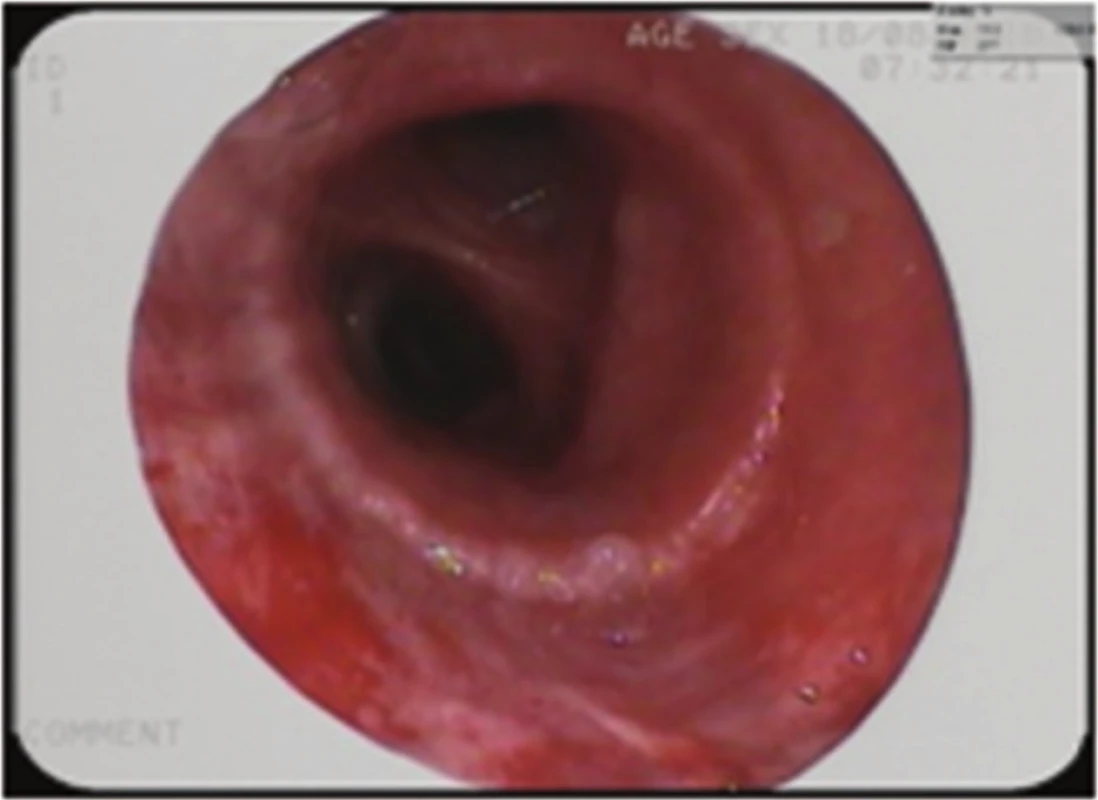
DISKUZE
Tracheobronchoplastické resekce jsou technicky obtížné výkony, zatížené vyšším rizikem vzniku řady závažných komplikací. Jednou z nejzávažnějších je TBPP, která nemocného ohrožuje přímo na životě v důsledku vzniku akutní respirační insuficience, druhostranné bronchopneumonie, sepse a ARDS. Až v 85 % je píštěl doprovázena vznikem postpneumonektomického empyému [1].
Léčba takového stavu závisí na řadě faktorů – časová souvislost píštěle (časná, pozdní), velikost BP píštěle, závažnost infekce pleurálního prostoru, celkový stav pacienta a také zkušenosti pracoviště.
Obecně se léčba řídí několika principy, které se navzájem prolínají. Je to především sanace infekce v pleurální dutině se zabráněním vzniku sepse, s tím související léčba samotné píštěle. V neposlední řadě zajištění adekvátní ventilace pacienta a jeho výživy.
Chirurgické techniky k uzavření píštěle (resutura, reresekce a reanastomóza, překrytí lalokem z vitální tkáně, pleurostomie, laváže, VAC ®) nemusejí vést vždy k uspokojivému výsledku. Mohou být proto podpořeny i dalšími metodami, jako jsou zavedení stentu či užití tkáňového lepidla k překlenutí netěsnosti píštěle.
A) Kontrola infekce v pleurální dutině. Cílem je sanace infekce pleurálního prostoru. V případě méně závažných projevů infekce a absence píštěle lze volit i konzervativní postup s cílenou hrudní drenáží a výplachy antiseptickým roztokem či antibiotiky. Častěji je však preferován aktivnější přístup podle Clagetta s možnou řadou modifikací. Jeho základem je otevřená revize s toaletou pleurální dutiny, debridementem nekrotických hmot a fibrinových povlaků či pleurektomií a snaha o uzávěr píštěle (viz níže). Obvykle se ponechává torakostomie a pohrudniční dutina se vyplní longetami, napuštěnými antiseptickým roztokem nebo antibiotiky. Po eradikaci infekce lze torakostomii uzavřít a dále pokračovat s lavážemi hrudním drénem. Torakostomie umožňuje lépe kontrolovat hojení píštěle a infekci v pleurální dutině v čase [3]. V současnosti se v případech postpneumonektomického empyému stále více využívá i systém VAC® [4]. Předpokladem jeho použití je již stabilní mediastinum. Jeho výhodou je uzavřený systém s podtlakem, s minimálním rizikem sekundární infekce, eliminací retence exsudátu a podporou tvorby nové granulační tkáně a prokrvení spodiny.
Samozřejmostí je cílená razantní antibiotická léčba dle kultivačních vyšetření.
Uzávěr torakostomie a postpneumonektomické dutiny je doporučován s odstupem, zpravidla 3−12 měsíců a v závislosti na lokálním nálezu, zmenšení pleurální dutiny nebo perzistující infekci. K výplni zbytkové dutiny lze využít cíp omenta na cévní stopce nebo svalový lalok (m. latissimus dorsi, m. pectoralis major, m. serratus anterior). Krajním řešením je provedení torakoplastiky [ 1,5].
B) Kontrola TBPP. Řešení uzávěru bronchopleurální píštěle je esenciální, v případě sleeve pneumonektomií ale velmi nesnadné. Obecně lze píštěle v bronchiálním pahýlu chirurgicky řešit reresekcí a rekonstrukcí ve zdravé nepostižené tkáni v závislosti na délce pahýlu bronchu nebo pouhým přešitím píštěle. V případě sleeve pneumonektomií je však možný pouze pokus o suturu píštěle a překrytí vitálním tkáňovým lalokem (svalovým – interkostálním, z m. pectoralis, m. etratus nebo lalokem z perikardu či z v. azygos). Další možností je využít protiinfekčních vlastností omenta. Z minilaparotomie či laparoskopicky je protažen tunelem retrosternálně nebo transdiafragmaticky cíp omenta, kterým je zajištěna anastomóza a navíc také slouží k částečné výplni pleurální dutiny.
Nechirurgické metody řešení bronchopleurální píštěle spočívají v endoskopickém (bronchoskopickém) zavedení stentu a překlenutí píštěle stentem samotným nebo v kombinaci s tkáňovým lepidlem. To může vést k utěsnění píštěle a následně jejímu vyhojení. V některých zahraničních sestavách udávají dokonce 100% úspěšnost této metody, byť šlo o velmi malý soubor pacientů [6]. Zavedení stentů je doporučováno pokud možno u stabilního pacienta co nejčasněji po vzniku píštěle. Někteří autoři uvádějí zhojení i objemných chronických píštělí [7]. Obecně je však stentáž doporučována u malých časných píštělí [8,9,10]. Bohužel neexistuje univerzálně doporučovaný stent. Zlatým standardem je silikonový Dumonův® stent, v různých modifikacích používaný od roku 1989 dodnes. Italští autoři ve své práci popisují několik úspěšných případů s využitím samoexpandibilního nitinolového stentu Silmet® [6]. Dle autorů tento samoexpandibilní stent lépe adheruje k sliznici dýchacích cest, což vede k nižšímu počtu dislokací a v konečném výsledku i k vyššímu procentu vyhojení píštěle.
C) Prevence infekce kontralaterální plíce. Polohování nemocného na postiženou stranu, důsledná toaleta dýchacích cest, správně vedená dechová rehabilitace a při nutnosti umělé plicní ventilace šetrně provedená selektivní intubace dvoucestnou endotracheální kanylou jsou základní pravidla snižující incidenci druhostranné bronchopneumonie. V případě rozvoje respirační insuficience na podkladě kontralaterální bronchopneumonie či dokonce ARDS je zde i možnost využití ECMO (extrakorporální membránová oxygenace) jako prostředku k překlenutí kritického stavu nemocných s respiračním selháním po komplikovaných chirurgických výkonech.
D) Zvládnutí následků sepse a důsledná symptomatická léčba s dostatečnou nutricí.
Těžká refrakterní sepse s respirační insuficiencí je v konečném důsledku nejčastější příčinou úmrtí nemocného. Pro diagnostiku sepse jsou důležité klinické známky (celková schvácenost, alterace vědomí, febrilie/hypotermie, tachykardie, klidová dušnost, periferní vazodilatace) a laboratorní markery (leukocytóza/leukopenie, laktátová acidóza, trombocytopenie, abnormality jaterních testů nebo renálních parametrů a zvýšení hladiny C-reaktivního proteinu a prokalcitoninu). Léčba sepse by měla probíhat na jednotce intenzivní péče, je nutné zahájit včas všechny body tzv. iniciální terapie, které by měly být splněny do 6 hodin. Patří k nim sledování hladiny laktátu k posouzení hypoperfuze. Odběr hemokultury. Širokospektrální antibiotika by měla být podána do hodiny od diagnózy sepse s následnou úpravou dle antibiogramu. Dostatečná tekutinová resuscitace, ev. s podporou vasopresory, krevní deriváty, umělá plicní ventilace, korekce acidobazické a iontové dysbalance či dialyzační program tvoří další důležité složky základní intenzivní terapie sepse. Blokátory protonové pumpy, hepatoprotektiva, prokinetika, nootropika, psychofarmaka, ale i antiarytmika, kardiotonika či bronchodilatancia jsou nejčastěji používané podpůrné léky u pacientů s těžkou sepsí. Další kapitolou je pak dostatečná nutrice. Metabolické a nutriční změny mají u těchto nemocných zásadní dopad na základní životní funkce. Adekvátní metabolická a nutriční podpora zajišťuje dostatečný substrátový příjem s podporou anabolické reakce, přispívá k reparaci orgánů a podporuje i další kompenzační mechanismy včetně imunitních. Jedině intenzivní multioborová léčba dává takto kriticky nemocnému šanci vyléčit se.
ZÁVĚR
Tracheobronchoplastické resekce patří mezi nejnáročnější výkony v plicní chirurgii a stejně tak i komplikace z těchto výkonů plynoucí jsou velmi závažné a život ohrožující. Tracheobronchopleurální píštěl se svým průběhem a dopadem řadí mezi ty nejzávažnější. Management léčby TBPP musí být aktivní, multioborový, využívající všechny dostupné prostředky moderní medicíny. Klade vysoké nároky na všechny kooperující obory. Jedině za těchto předpokladů lze očekávat úspěšné výsledky léčby těchto výjimečných případů.
Seznam zkratek
ARDS – acute respiratory distress syndrome
TBPP – tracheobronchopleurální píštěl
PPE – postpneumonektomický empyém
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jan Hanuliak
Dukelská 19
779 00 Olomouc
e-mail: hanuliak@email.cz
Zdroje
1. Stolz AJ, Pavel P. Komplikace v hrudní chirurgii. 1. vyd. Praha, Grada 2010 : 237.
2. Cerfolio RJ. The incidence, etiology, and prevention of postresectional bronchopleural fistula. Semin Thorac Cardiovasc Surg. 2001;13 : 3−7.
3. Clagett OT, Geraci JE. A procedure for the management of postpneumonectomy empyema. J. Thorac. Cardiovasc. Surg 1963;45 : 141–5.
4. Renner C, Reschke S, Richter W. Thoracic empyema after pneumonectomy: intrathoracic application of vacuum-assisted closure therapy. Ann Thorac Surg 2010;89 : 603−4.
5. Sivrikoz CM, Kaya T, Tulay CM, et al. Effective approach for the treatment of bronchopleural fistula: application of endovascular metallic ring-shaped coil in combination with fibrin glue. Ann Thorac Surg 2007;83 : 2199–201.
6. Andreetti C, D‘Andrilli A, Ibrahim M, et al. Effective treatment of post-pneumonectomy bronchopleural fistula by conical fully covered self-expandable stent. Interact Cardiovasc Thorac Surg 2012;14 : 420−3.
7. Dutau H, Breen DP, Gomez C, et al. The integrated place of tracheobronchial stents in the multidisciplinary management of large post-pneumonectomy fistulas: our experience using a novel customised conical self-expandable metallic stent. Eur J Cardiothorac Surg 2011;39 : 185–9.
8. Watanabe S, Shimokawa S, Yotsumoto G, et al. The use of a Dumon stent for the treatment of a bronchopleural fistula. Ann Thorac Surg 2001;72 : 276–8.
9. Tayama K, Eriguchi N, Futamata Y, et al. Modified Dumon stent for the treatment of a bronchopleural fistula after pneumonectomy. Ann Thorac Surg 2003;75 : 290–2.
10. Tsukada H, Osada H. Use of a modified Dumon stent for post-operative bronchopleural fistula. Ann Thorac Surg 2005;80 : 1928–30.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Leiomyóm vena iliaca externaČlánek Zomrel profesor Peter Kothaj
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Česká chirurgie a její postgraduální vzdělávání
- Současné možnosti ovlivnění infekce v místě operačního výkonu
- Kapitoly z dějin chirurgie v českých zemích
- Kolorektální karcinom u seniorů – děláme to dobře?
- Thorakoskopická epikardiální ablace fibrilace síní systémem COBRA Fusion jako první část hybridního výkonu
- Autologní kranioplastika deponovanou kostní ploténkou v podkoží mezogastria
- Kombinované řešení časné tracheobronchopleurální píštěle po pravostranné sleeve pulmektomii
- Malígny fibrózny histiocytóm ako raritná príčina akútnej končatinovej ischémie
- Leiomyóm vena iliaca externa
- XXVI. Jarní setkání Loket 2017
- Zomrel profesor Peter Kothaj
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autologní kranioplastika deponovanou kostní ploténkou v podkoží mezogastria
- Současné možnosti ovlivnění infekce v místě operačního výkonu
- Malígny fibrózny histiocytóm ako raritná príčina akútnej končatinovej ischémie
- Thorakoskopická epikardiální ablace fibrilace síní systémem COBRA Fusion jako první část hybridního výkonu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



