-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Personalizovaná antibiotická terapie na chirurgické jednotce intenzivní péče − přehled současných znalostí a výsledky observační kinetické studie
Personalised antibiotic therapy in a surgical intensive care unit − overview of current knowledge and the results of an observational kinetic study M. Kaska, J. Martinkova, E. Havel, J. Koci, A. Fouskova, D. Solichova, L. Kujovska, I. Selke-Krulichova, I. Praznovec, V. Salavec
Introduction:
The current efforts of intensivists focused on individual antibiotic treatment in patients suffering from sepsis has inspired us to conduct an open prospective clinical study to assess the relationship between body fluid retention (>10 L/24 hours) and the efficiency of hydrophilic time-dependent antibiotics used in critically ill patients. Polytrauma and abdominal catastrophes are the most frequent causes of systemic inflammatory response syndrome (SIRS). Consequent body liquid retention is taken for a pathophysiological covariate modifying the pharmacokinetics (PK) and pharmacodynamics (PD) of hydrophilic time-dependent antibiotics (betalactams and carbapenems). Not only body fluid retention but also changes in renal clearance are thought to be responsible for failure in PK/PD target attainment necessary for effective antimicrobial activity. To describe the importance of the pathophysiological covariates for the individual kinetic variables of a representative antibiotic (piperacillin) is the primary goal of this kinetic observational study.Material and methods:
Three patients with polytrauma and SIRS admitted at the ICU of the Surgical Department, Teaching Hospital Hradec Králové, whose condition was characterized by cumulative body fluid retention (>10 L), were eligible for enrolment. As per standard hospital protocol, the patients were administered with 4 g of piperacillin in combination with tazobactam 0.5 g intravenously by 1-hour (h) infusion every 8 h. A series of blood samples were taken 1, 2.5, and 5 h after the termination of the infusion. Urine was collected over each dosing interval and for 24 h. Piperacillin was detected using a previously validated HPLC method. Individual pharmacokinetic variables were estimated using non-compartmental pharmacokinetic analysis. Cumulative body fluid retention was calculated as the difference between fluid intake and output. Creatinine clearance (Cl) was used for renal function evaluation. PK/PD target attainment was analysed according to Carlier (2013).Results:
In three patients with polytrauma and SIRS, great interindividual and intraindividual differences in extravascular volume expansion, i.e. cumulative body fluid retention 20−30 L and changes in renal function, were recorded. In 2/3 patients these pathophysiological changes as well as the clinical interventions administered resulted in augmented piperacillin clearance and an increase in distribution volume (Vd) (>20 L) with a maximum at Day 2−8 after initiation of therapy. In such patients treated with a standard dose of piperacillin, only minimum PK/PD target attainment (50% Ft >MIC) was obtained. In contrast, a patient suffering from renal dysfunction attained both minimum (50% ft >MIC) and maximum PK/PD target (100% ft >MIC).Conclusions:
In three critically ill patients with polytrauma and SIRS, pathophysiological changes (covariates) had a profound effect on the key determinants of the pharmacokinetics (Cl and Vd), resulting in significant intraindividual variability in pharmacodynamic /pharmacokinetic target attainment necessary for therapeutic time-dependent antibacterial activity of piperacillin. Consequently, patients with augmented clearance of piperacillin may be at risk for treatment failure, and/or bacterial resistance without dose up-titration. A subsequent clinical study will be conducted to describe personalised kinetically guided antibiotic therapy.Key words:
time-dependent antimicrobial action − personalised antibiotic management − body fluid retention – SIRS − target PK/PD attainment
Autoři: M. Kaška 1,2; J. Martinková 2; E. Havel 1,2; J. Kočí 1,2; A. Fousková 1,2; D. Solichová 1,3; L. Kujovská 3; I. Selke-Krulichová 1; I. Práznovec 1; V. Salavec 1
Působiště autorů: Katedra chirurgie LF UK, Hradec Králové, vedoucí: doc. MUDr. RNDr. M. Kaška, Ph. D. 1; Chirurgická klinika FN v Hradci Králové, přednosta: Prof. MUDr. A. Ferko, CSc. 2; III. interní gerontometabolická klinika FN v Hradci Králové, přednosta prof. MUDr. L. Sobotka, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 9, s. 456-462.
Kategorie: Původní práce
Dedikováno IGA MZ – projekt NT14089-3/2013
Souhrn
Úvod:
Současné úsilí intenzivistů zaměřené na individuální antibiotickou léčbu septických pacientů nás inspirovalo k plánu provedení otevřené prospektivní studie věnované vztahu mezi retencí tělesných tekutin (>10 litrů/24 hod.) a účinností hydrofilních time-dependent antibiotik podávaných pacientům v kritickém stavu, a to v průběhu rozvoje i reparace patologického stavu. Polytraumata a břišní katastrofy jsou nejčastější příčinou syndromu systémové zánětové odpovědi (SIRS). Následná retence tělesných tekutin je považována za jednu z patofyziologických kovariát modifikujících farmakokinetiku (PK) i farmakodynamiku (PD) hydrofilních, time-dependent antibiotik (betalaktamy a karbapenemy). Není to pouze retence tělesných tekutin, ale také změny renální klírens, které jsou považovány za odpovědné při selhání nastavení cílového vztahu PK/PD, nezbytného pro účinnou antimikrobiální aktivitu. Popsat důležitost zmíněných patologických kovariát pro individuální kinetické parametry modelového antibiotika (piperacilin) je primárním cílem této observační studie.Materiál a metody:
Do observační studie byli zařazeni 3 pacienti s polytraumaty a známkami SIRS. Pacienti byli hospitalizováni na JIP Chirurgické kliniky Fakultní nemocnice v Hradci Králové a docházelo u nich k významné retenci tělesných tekutin (>10 litrů). V rámci standardního protokolu byli zajištěni kombinací piperacilinu 4 g/tazobactamu 0,5 g v jednohodinové i. v. infuzi každých 8 hodin. Série krevních vzorků byly odebírány 1, 2,5 a 5 hod. po skončení infuze. Sběr moči probíhal během 8 hod. dávkovacího intervalu a po dobu 24 hod. Piperacilin byl stanovován metodou HPLC validovanou v předcházejících cyklech. Individuální kinetické parametry byly odhadnuty nonkompartmentovou kinetickou analýzou. Retence tekutin byla vypočtena jako rozdíl mezi jejich příjmem a výdejem. Renální funkce byla hodnocena pomocí klírens endogenního kreatininu. Stupně dosažení cílového PK/PD byly hodnoceny metodou dle Carliera (2013).Výsledky:
U tří pacientů s polytraumaty v kritickém stavu a se známkami SIRS byly zaznamenány interindividuální a intraindividuální rozdíly v expanzi extravaskulárního objemu, charakterizovaného kumulovanou retencí tělesných tekutin 20–30 litrů a také změnami renální funkce. U 2/3 pacientů tyto patofyziologické změny spolu s klinickou léčbou vedly ke zvýšení jak klírens piperacilinu, tak distribučního objemu (>20 litrů) s maximem dosaženým ve 2.–8. dni antibiotické léčby. U těchto subjektů léčených standardní dávkou piperacilinu byla dosažena pouze minimální úroveň PK / PD (50 % ft >MIC). Opakem byl pacient s renální dysfunkcí, u kterého bylo dosaženo jak minimálního, tak maximálního cílového PK/PD.Závěr:
Patofyziologické změny navozené vlivem polytraumat a následného SIRS u tří pacientů v kritickém stavu významně ovlivnily klíčové kinetické parametry piperacilinu: klírens a distribuční objem. Důsledkem byla variabilita v dosažení cílového vztahu mezi farmakodynamikou a farmakokinetikou piperacilinu, nezbytného pro time-dependent antibakteriální účinek tohoto antibiotika. Bez individuální titrace dávky léčiva mohou být pacienti se zvýšenou hodnotou klírens piperacilinu ohroženi selháním antibiotické léčby, eventuálně vývojem bakteriální rezistence. Následná klinická studie bude mít za úkol popsat zásady individualizované kineticky řízené (personalizované) antibiotické léčby.Klíčová slova:
time-dependentní antibiotický účinek − personalizovaná antibiotická terapie − sekvestrace tekutin – SIRS − dosažení cílového PK/PDÚvod
Myšlenka, že koncentrace podávaných léků nemocným při dramatických změnách jejich vnitřního prostředí vlivem patofyziologických kovariát nemusí dosahovat terapeutických koncentrací, se stále aktuálněji promítá do klinické praxe. Není jistě nová, ale stanovení individuálního dávkování léčiva u konkrétního nemocného při jeho závažné změně vnitřního prostředí – personalizovaná terapie – je v současnosti velmi aktuální a začíná výzkum terapie antibiotiky u pacientů s významnou sekvestrací tekutin. Evropská léková agentura (EMA) mj. vybízí, aby jí doporučené postupy byly průběžně aktualizovány dle nových nálezů v rámci dalších klinických studií (postregistrační studie IV) osudů léčiv v lidském organismu při nestandardních a významných celkových patofyziologických stavech. Nelze v úvodu pominout sdělení, která se zabývají indikací konkrétních antibiotik ve stavech zánětové reakce organismu na infekci či na závažný úrazový stav s rizikem infekční komplikace. Typickými etiologickými stavy jsou perforace tlustého střeva [1−4]. Jsou ale publikovány i studie zabývající se dávkováním antibiotik při poruše stěny horního trávicího traktu (GIT) včetně jejuna [5]. Nelze opomenout ani etiologii iatrogenní, kdy k poškození stěny GIT dochází v rámci provádění gastrointestinální chirurgie [6,7]. Pooperační infekční komplikace jsou noční můrou kolorektálních chirurgických specialistů (incidence dle různých zdrojů 1–40 %) a sepse je dosud jednou z nejčastějších příčin úmrtí na jednotkách chirurgické intenzivní péče (JIP). Včasná diagnóza a efektivní terapie sepse, nebo její léková prevence, jsou zásadní pro úspěšný klinický výstup [8,9]. S těmito těžkými infekcemi jde velmi často ruku v ruce dlouhá hospitalizace, vysoká morbidita a letalita [3,10]. Vše ztěžuje i fakt, že 50 % závažných infekcí po chirurgickém výkonu se manifestuje až po propuštění z nemocnice. Proto je nutná adekvátní následná péče − follow up [11] související se zvolenou metodou terapie těchto nemocných obecně. Navíc je doloženo, že nemocní, kteří prodělají závažnou infekční komplikaci během hospitalizace, vyžadují všestranně náročnější zdravotnickou péči (medicínsky, a tedy i ekonomicky) než ti, kteří touto komplikací neprošli [12]. Celý problém dále komplikují rizikové faktory, které lze obecně rozdělit na faktory závislé na léčbě (chirurgický výkon, typ podaných léků, objemy transfuzí krve a jejích přípravků) a faktory závislé na nemocném (věk, komorbidita, stav nutrice) [2,7,9,13]. Nemocní s vážným zraněním mají navíc vyšší riziko nozokomiálních infekcí [14]. Z biologických materiálů těchto nemocných jsou nejčastěji izolovány mikroorganizmy anaerobní (Bacteroides, Bifidobacterium i aerobní Enterobacteriacae, Pseudomonas, Klebsiella) včetně kmenů produkujících širokospektré betalaktamázy a též Staphylococcus aureus včetně jeho meticilin-rezistentní formy (MRSA) [9,15]. Při hlubším zkoumání bylo zjištěno, že 21,5 % z izolovaných gramnegativních mikrobů může produkovat širokospektré betalaktamázy [16]. Nelze pochybovat, že antibiotika přinášejí nemocným postiženým infekcí prospěch. Přesto však včasné léčení nemocných v sepsi správně indikovanými antibiotiky někdy nezabrání letalitě (dle různých zdrojů až v 60 % případů)! Při zvýšené propustnosti kapilár v důsledku SIRS unikají hydrofilní antibiotika do extracelulární tekutiny a ve formě tranzudátu do tělesných dutin („třetí prostor“). Vytvářejí se tak otoky v podkoží, ve stěnách trávicího traktu a výpotky v dutinách peritoneální a pleurální. Stanovení koncentrací antibiotik v tranzudátech získaných drenáží zmíněných prostorů v podmínkách ustáleného stavu (Css) prokáže rozsah změny distribuce antibiotika a eventuálně i její dynamiky. Rozvoj a ústup tohoto patofyziologického děje vyžaduje klinické monitorování přesunu tělesných tekutin. Monitorování rychlosti renální exkrece poskytne důležitou informaci týkající se účinnosti (rychlá exkrece a riziko selhání léčby) a bezpečnosti antibiotické léčby (riziko vzestupu plazmatické koncentrace antibiotika na základě jeho kumulace). Klinicky bude studie zaměřena i na kvalitu funkcí ledvin obecně a celkovou a renální klírens antibiotika a na expozici antibiotika (AUC-plocha pod křivkou plazmatických koncentrací v čase po podání). Dávkování antibiotik vychází z citlivosti mikroorganizmu na ně. Je založeno na vztahu farmakokinetiky (PK) a farmakodynamiky (PD). Mikroorganizmus je považován za citlivý na antibiotikum, jestliže jeho plazmatické koncentrace in vivo (PK) odrážejí hodnotu minimální inhibiční koncentrace (MIC) stanovené in vitro (PD). Musí být splněn též předpoklad, že zároveň vyhovují bezpečnosti antimikrobiální léčby (PD) [17]. Cílem správného dávkování je co nejobjektivněji odhadnout cílový vztah PK/PD [18]. V praxi však tento statický parametr nestačí. Ukazuje se, že výsledek terapie antibiotikem může být vysvětlen farmakokinetickou variabilitou. Klinické studie jsou prováděny za účasti zdravých dobrovolníků nebo non-critical nemocných. V praxi při širokém spektru nemocných je však nutné brát v úvahu maturační, růstové a závažně patofyziologické stavy (kovariáty), které často významně ovlivňují PK i PD antibiotika (patří sem např.: věk, zralost, retence tekutin, porucha eliminačního orgánu etc.) [19, 20]. Ještě je třeba zmínit jejich dvě vlastnosti, které se mohou uplatnit: vazebnost na plazmatické bílkoviny a postantibiotický efekt (PAE). Vazebnost na plazmatické bílkoviny určuje podíl (%) nevázaného antibiotika, který je dostupný jak pro distribuci antibiotika z krevního řečiště do cílové tkáně, tak pro jeho eliminaci z organizmu. Z tohoto důvodu je nutno při hodnocení PK/PD vyšší vazebnost zohlednit [21−23]. PAE je definovaný jako inhibice růstu mikrobů po určitou dobu (řádově hodiny) po vysazení antibiotika [24]. U betalaktamových antibiotik je tento efekt zanedbatelný, je ale významný ve skupinách aminoglykozidů a u metronidazolu a je třeba pamatovat i na bezpečnost léčby. Nemocní s traumaty jsou ohroženi dokonce dvojnásobným rizikem nežádoucích účinků léků, jak bylo popsáno u analgetik a opiátů [15]. Volba antibiotik a jejich dávkování pro řešení septických komplikací vychází z doporučení národních nebo nadnárodních odborných a regulačních autorit (SÚKL, EMA) ve formě souhrnných údajů o léku (Summary of Product Characteristics-SPC) a také doporučení odborných lékařských společností.
Tato první pilotní studie je observační kinetickou fází, která má za úkol upozornit na interindividuální a intraindividuální změny v kinetice modelového antibiotika podávaného pacientům se SIRS. Za první antibiotikum byl vybrán piperacilin, následovat budou zástupci karbapenemů a aminoglykozidů. Jako modelový projev patologického stavu je monitorován farmakologický děj – distribuce, eliminace a příslušné kinetické parametry – distribuční objem (Vd) a klírens (Cl). Následující plánovaná klinická studie bude vycházet z výsledků fáze observační a bude zaměřena na individuální dávkování antibiotik [25].
Důvody volby modelových antibiotik: 1. Jsou hydrofilní, distribuované do extracelulární tekutiny (Vd = 0,2 − 0,3 l/kg), vylučované převážně ledvinami v metabolicky nezměněné formě a jsou na JIP často indikovány. V případě piperacilinu se na exkreci podílejí glomerulární filtrace i tubulární aktivní sekrece za účasti transportéru (organic acid transporter-OAT). 2. Z pohledu farmakodynamiky jde o antimikrobní léčiva s time-dependentním účinkem (piperacilin, karbapenemy), případně i závislým na vrcholové koncentraci léčiva (Cpeak – aminoglykosidy). Kritériem farmakodynamiky time-dependentní je časový úsek (fraction - f) dávkovacího intervalu (T), který je zabezpečen koncentrací antibiotika vyšší než MIC in vitro (% fT >MIC). Minimálním požadavkem je 50 % fT >MIC, který je nutno zvýšit podle některých autorů na 100 % fT >MIC a dokonce až na 100 % fT >4x MIC s eradikačním efektem [26,27]. Byla popsána alarmující interindividuální variabilita v dosažení cílového vztahu PK/PD pomocí těchto kritérií u nemocných v kritickém stavu [27]. Není však známo, jak se PK/PD vyvíjí intraindividuálně , tj. u pacienta v kritickém stavu při začátku, kulminaci a ústupu patologického stavu organizmu (autorům tohoto sdělení není znám žádný pramen informací). V dosud publikovaných sděleních s podobnou tématikou je vesměs konstatováno, že vlivem patofyziologických kovariát je účinek antibiotik dávkovaných podle doporučení (on label - drug use) nejasný, až nepředvídatelný [28−35].
Konečným cílem celého projektu je formulace doporučení, jak individualizovat dávkování hydrofilního antibiotika při SIRS s přihlédnutím k výsledkům observační kinetické fáze studie. Projekt vychází z kineticky řízeného dávkování modelových antibiotik na základě individuálních plazmatických koncentrací a farmakokinetických parametrů (terapeutické monitorování − TDM).
Materiál a metodika
V roce 2014 byla realizována observační farmakokinetická fáze plánované postregistrační studie zaměřená na aktuální koncentrace piperacilinu (Piperacillin/Tazobactam, výrobce Fresenius Kabi) v tělesných tekutinách po jeho podání. Do studie byli zařazeni tři nemocní hospitalizovaní na JIP Chirurgické kliniky FN v Hradci Králové, kteří byli léčeni pro polytrauma s rozvojem SIRS, rizikem infekčních komplikací a významnou sekvestrací tekutin. Tito nemocní dosáhli v prvních dvou až čtyřech dnech terapie sekvestraci tekutin v objemu 20–30 litrů, hodnocenou kumulovanou bilancí tekutin pacientem přijatých a vydaných za 24 hod. Diagnóza SIRS byla dána naplněním doporučených standardních kritérií [35] a k jeho rozvoji došlo vždy v prvních 24 hod. hospitalizace. Monitorování koncentrací piperacilinu v ustáleném stavu (css) v séru, moči a dutinových výpotcích probíhalo po podání doporučené dávky 4,0 g piperacilinu (4,5 g piperacilinu/tazocinu) každých 8 hod. i. v. infuzí trvající jednu hodinu. Série odběrů krve (0,5 hod. před podáním dávky a 1, 2,5 a 5 hod. po jejím podání) byly provedeny ve dnech, kdy kulminovala a poté ustupovala hodnota kumulované bilance tekutin. Tomu předcházela série vyšetření, která umožnila následně vypracovat finální protokol studie. Jeho principy byly schváleny Etickou komisí LFUK a FN v Hradci Králové dne 27. 6. 2012.
Stanovení koncentrací antibiotika ve výše uvedených tělesných tekutinách bylo prováděno kapalinovou chromatografií (HPLC s hmotnostní detekcí trojitého kvadrupólu neboli LC-MC) na zařízení LCMS (Tandemový hmotnostní spektrometr Agilent 6490, kapalinový chromatograf UHPLC Agilent, 1290 Infinity, výrobce Agilent Technologies, USA) v Ústavu klinické biochemie a diagnostiky FN v Hradci Králové (úseky farmakologie a toxikologie) ve vzorcích o objemu 3 ml, které byly bezprostředně po odběru dopravovány v chlazeném prostředí do příslušné analytické laboratoře. Naměřené koncentrace piperacilinu byly použity k vyhodnocení kinetického profilu v postinfuzním období a k výpočtu odhadu jeho kinetických parametrů: distribuční objem (Vd), celková klírens (Cltot) a plocha pod křivkou plazmatických koncentrací v čase po jeho podání (AUC). Ze sběru moči za 24 hod. byla vypočítána klírens endogenního kreatininu (Clkr). K výpočtům byly využity standardní metody dle odborné literatury [36,37]. Hodnocení PK/PD proběhlo stanovením času, kdy hodnota breakpoint (50 % fT >MIC a 100 % fT >MIC) [26, 27] pro Pseudomonas aeruginosa −16 mg/l (dle EUCAST) protnula individuální regresní přímku profilu plazmatických koncentrací. Kinetický profil plazmatických koncentrací piperacilinu byl vyjádřen regresní přímkou určenou 3–5 body v semilogaritmické síti souřadnic vypočítané metodou nejmenších čtverců se spolehlivostí proložení bodů (plazmatické koncentrace piperacilinu v odběrových časech dávkovacího intervalu) R2 >0,996. Vrcholová koncentrace (Cpeak) byla určena pomocí směrnice regresní přímky na ose Y (Y-intercept). Údolní koncentrace (Ctrough) odpovídající hodnotě plazmatické koncentrace piperacilinu 30 min. před podáním jeho další dávky byla vypočítána podle rovnice regresní přímky. Klírens piperacilinu v hrudním nebo břišním výpotku nebyla zatím interpretována vzhledem k jejich nedostatečným objemům u většiny sledovaných pacientů. Souběžně probíhalo sledování sérových koncentrací základních elektrolytů, ukazatelů jaterních a ledvinných funkcí, zánětu a monitorování standardních hemodynamických ukazatelů, oxygenace, diurézy a měření objemu moči a odpadů tekutin do dutinových drénů.
Výsledky
Pacient 01 − žena, věk 61 let, polytrauma pádem z výšky 10 m – pronikající rány v obličeji, tenzní pravostranný pneumotorax, fraktury obratlů L1-2 a L4-S1, oboustranné krvácení do psoatů, hematom v podjaterní krajině, otevřená zlomenina stehenní kosti vpravo a zavřená vlevo, lacerace měkkých tkání pravého stehna.
V prvních 24 hod. terapie se rozvinul SIRS a došlo k progredující sekvestraci tělesných tekutin (Graf 1). Kinetické parametry piperacilinu prokázaly velký distribuční objem, který postupně klesal společně s hodnotami kumulovaných bilancí objemů tělesných tekutin sledovaných ve 24 hod. obdobích (Tab. 1). Sérové koncentrace piperacilinu byly monitorovány 4., 6. a 8. den terapie. Byla nalezena progresivní změna strmosti přímky profilu plazmatických koncentrací piperacilinu s nárůstem Cpeak a poklesem Ctrough v závislosti na dnech terapie. Bylo dosaženo pouze minimálního cílového PK/PD, který se progresivně snižoval mezi 4. a 8. dnem terapie v mezích 75−50 % fT >MIC (Graf 2).
Graf 1. Přesuny tekutin u pacienta 01 Graph 1: Fluid movement in patient 01 
Tab. 1. Pacient 01 – kumulovaná bilance tekutin, V<sub>d</sub> a Cl<sub>tot</sub> Tab. 1: Patient 01 – cumulative fluid balance, V<sub>d</sub> a Cl<sub>tot</sub> 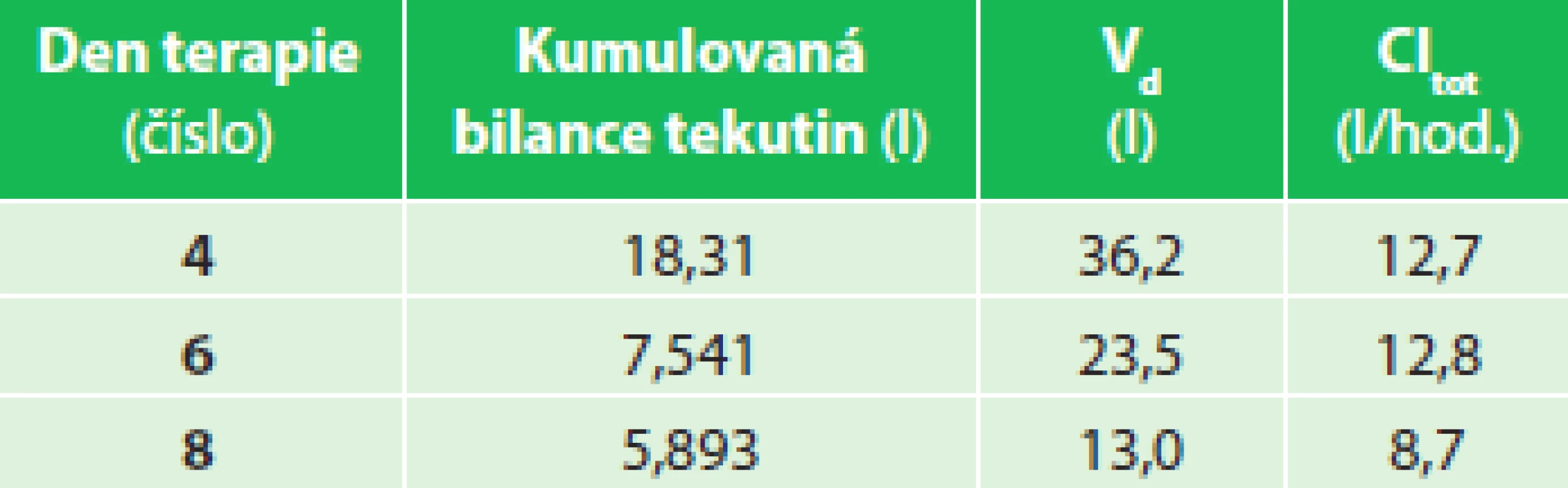
Graf 2. Profily sérových koncentrací piperacilinu u pacienta 01 Graph 2: Profiles of piperacillin serum concentrations in patient 01 
Pacient 02 − žena, věk 60 let, pád z výše 7 m v ebrietě alkoholem, polytrauma – traumaticko-hemoragický šok III. st., fraktury krčních obratlů – nosiče a čepovce bez neurologických komplikací, hemoperitoneum při rupturách sleziny (provedena splenektomie), močového měchýře (ošetřeno suturou jeho stěny) a mezenteria (což bylo ošetřeno resekcí terminálního ilea a provedením jejunoascendentoanastomózy), zlomenina pánve typu C (primárně stabilizovaná zevním fixátorem), retroperitoneální hematom při ruptuře tepen iliolumbální a horní gluteální vpravo (řešeno embolizací spirálkami a lepidlem a embolizací obou vnitřních pánevních tepen Spongostanem), zlomenina distálního předloktí vpravo (provedena repozice a naložena sádrová fixace).
SIRS se rozvinul během prvních hodin hospitalizace a s ním došlo k rozvoji významné sekvestrace tekutin (Graf 3). Sledované kinetické parametry piperacilinu opět prokázaly velký distribuční objem, který postupně klesal společně s hodnotami kumulovaných bilancí objemů tělesných tekutin za 24 hod. (Tab. 2). Opět byl zaznamenán intraindividuální rozdíl v plazmatických koncentracích piperacilinu a jejich profilu se vzestupem Cpeak a poklesem Ctrough (Graf 4) a bylo dosaženo pouze minimálního cílového PK/PD snižujícího se progresivně v probíhajícím čase terapie v rozmezí 60−45 % fT >MIC.
Tab. 2. Pacient 02 − kumulovaná bilance tekutin, V<sub>d</sub> a Cl<sub>tot</sub> Tab. 2: Patient 02 − cumulative fluid balance, V<sub>d</sub> a Cl<sub>tot</sub> 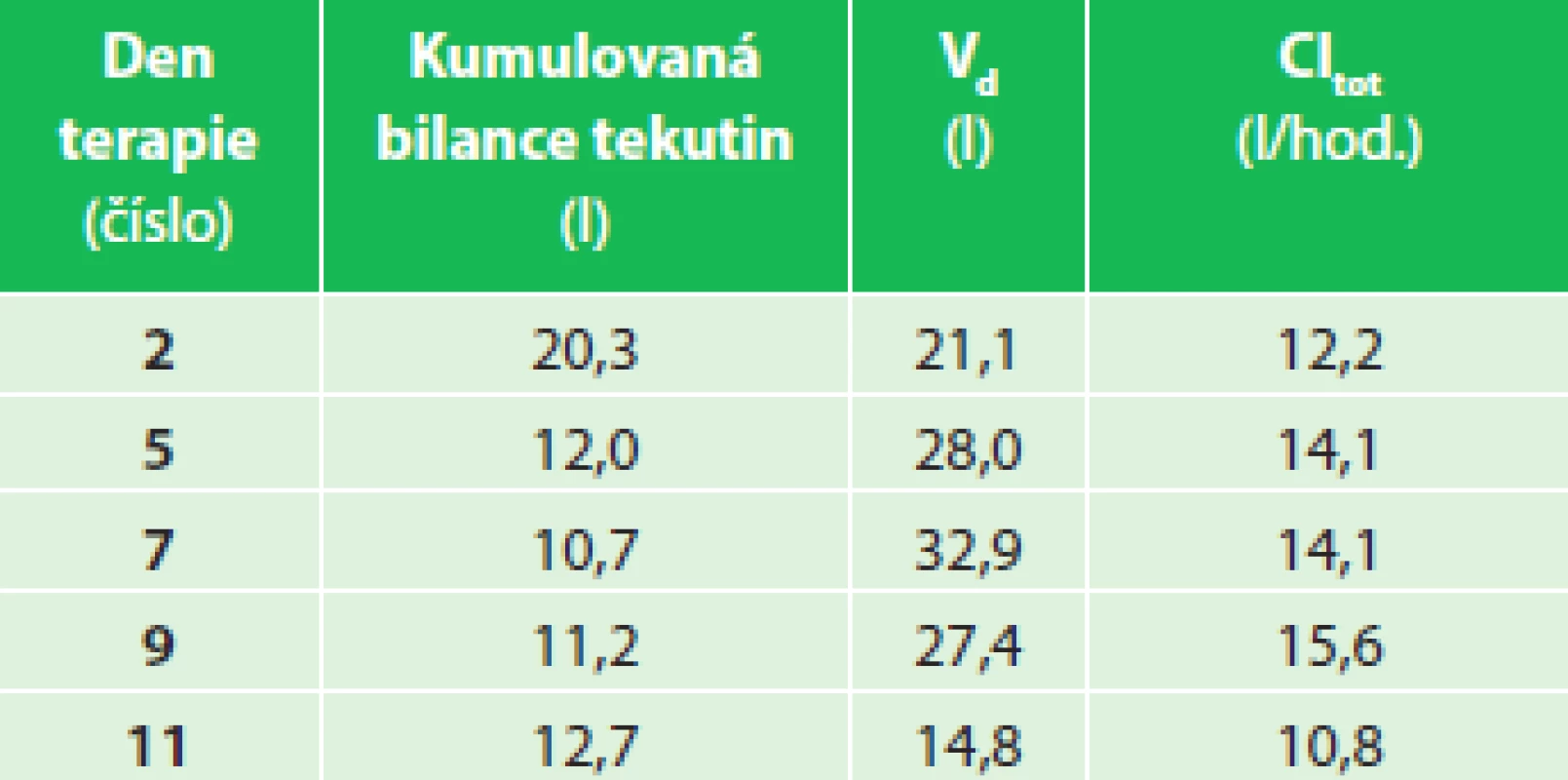
Graf 3. Přesuny tekutin u pacienta 02 Graph 3: Fluid movement in patient 02 
Graf 4. Profily sérových koncentrací piperacilinu u pacienta 02 Graph 4: Profiles of piperacillin serum concentrations in patient 02 
Pacient 03 − muž, věk 32 let, autohavárie s polytraumatem – sériová zlomenina žeber vlevo, pneumotorax vlevo, ruptura bránice vlevo, ruptura sleziny (provedena splenektomie), avulze levé ledviny (provedena levostranná nefrektomie), kontuze jater s centrálním hematomem, hemoperitoneum, otřes mozku, kominutivní zlomenina distálního rádia vlevo (řešeno dlahovou osteosyntézou), traumaticko-hemoragický šok, umělá plicní ventilace po dobu 7 dní.
Diagnostikován SIRS v prvních hodinách hospitalizace s rozvojem významné retence tělesných tekutin hodnocené kumulovanou bilancí tekutin za 24 hod. (Tab. 3, Grafy 5 a 6). Analýza PK/PD ukázala, že ztráta jedné ledviny a postupná kompenzace vylučování tekutin obsahujících piperacilin zbývající ledvinou ovlivnily jeho plazmatické koncentrace do té míry, že při standardním dávkování antibiotika bylo dosaženo minimálního i maximálního cílového PK/PD (50 % fT >MIC a 100 % fT >MIC). Kumulovaná bilance tělesných tekutin klesala velmi pomalu.
Tab. 3. Pacient 03 – kumulovaná bilance tekutin, V<sub>d</sub> a Cl<sub>tot</sub> Tab. 3: Patient 03 - cumulative fluid balance, V<sub>d</sub> a Cl<sub>tot</sub> 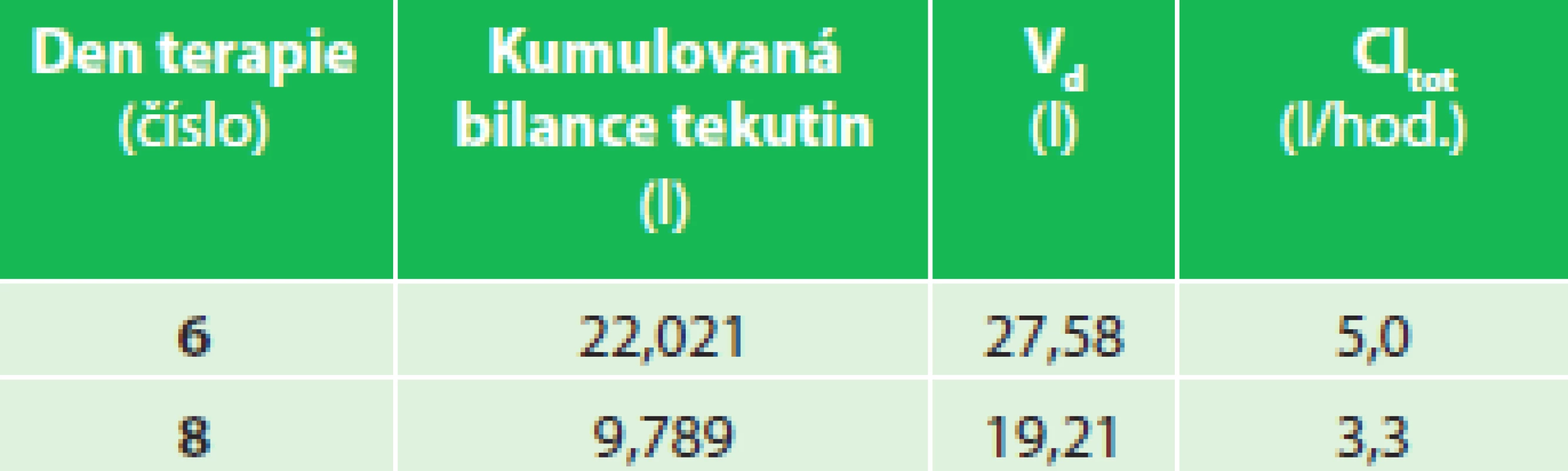
Graf 5. Přesuny tekutin u pacienta 03 Graph 5: Fluid movement in patient 03 
Graf 6. Profily sérových koncentrací piperacilinu u pacienta 03 Graph 6: Profiles of piperacillin serum concentrations in patient 03 
Diskuze
Dosavadní v zahraničí publikované studie informují poměrně zřídka o dosažení cílového PK in vivo/PD in vitro. Často je v nich konstatováno, že stav antibiotické léčby je v takových případech nepřehledný a nepředvídatelný [28−35]. Zatím zůstaly nepopsány intraindividuální rozdíly v profilech plazmatických koncentrací užitých antibiotik, tedy v průběhu léčby u téhož jedince. Je známo, že Vd piperacilinu u zdravých osob se pohybuje mezi 12 a15 litry [38]. U našich pacientů dosahoval Vd několikanásobně vyšších hodnot, protože: standardní stav (12−15 litrů) + sekvestrace tekutin (15−30 litrů).
Dosažení cílového PK in vivo/PD in vitro je základem pro odhad dávkování antibiotik. Koncentrace antibiotik v místě infekce musí nejen inhibovat růst a replikaci mikroorganizmů, ale eventuálně vést k jejich eradikaci. Musí také zůstat pod úrovní toxické koncentrace pro pacienta. Pokud je vyhověno oběma požadavkům, je mikroorganizmus považován za citlivý vůči účinku antibiotika. Dosažitelné sérové koncentrace antibiotika in vivo řídí selekci „breakpoint“ pro označení mikroorganizmů za citlivé nebo rezistentní testem „in vitro“ [17]. Tento postup slouží k odhadu výběru antibiotik a jejich dávkování. U antibiotik s time-dependentním účinkem se posuzuje vztah mezi dávkovacím intervalem a MIC in vitro.
Prvním zkoumaným modelovým antibiotikem se zásadním léčebným efektem je piperacilin, následovat budou meropenem a vankomycin. K analýze PK/PD byla použita metoda popsaná Carlierem v roce 2013 [27]. Z předchozího textu vyplývá, že tato metoda nevyužívá ani nástup a maximum antimikrobního účinku, ani nevyžaduje aktuální identifikaci bakterií. Nevyhodnocuje tedy úspěšnost antimikrobní léčby. Tyto aspekty je doporučováno využít v rozsáhlejších klinických studiích. Kromě návrhu dávkování je přínosem metody, že umožní odhad změny kinetiky antibiotika za vlivu definovaných podmínek a doporučí volbu individuálního dávkování založeného na kinetickém principu, tj. na klinicko-farmakologických metodách (TDM). Pozornost je dosud věnována změnám renální klírens piperacilinu označené skupinou intenzivistů z Gentu jako syndrom „akutního zvýšení renální klírens“ [26,27]. Autoři zároveň poukazují na nedostatečné informace o intraindividuálních změnách PK/PD. Je však možné předpokládat, že „kopírují“ vývoj patologického stavu s rizikem kumulace antibiotika v organizmu pacienta při selhání eliminační funkce ledvin. Naopak mohou znamenat riziko selhání antimikrobiální léčby v důsledku vysoké hodnoty klírens a nedostatečné sérové koncentrace léčiva.
V naší studii byl pozorován takový stav u pacientů 01 a 02. Možnostmi jeho řešení při podávání piperacilinu jsou: zkrácení dávkovacího intervalu, nebo zvýšení jeho dávek, nebo kombinace obou postupů. Nálezy v této observační studii se shodují s nálezy belgických intenzivistů [26,27], kteří se funkcí ledvin v kritických stavech zabývali studiem ARC (augmented renal clearence). Podání piperacilinu dlouhodobou infuzí se jim jako další možné řešení neosvědčilo [27]. Na druhé straně pacient 03 mj. po ztrátě ledviny s vysokou sérovou koncentrací kreatininu piperacilin kumuloval. Takový stav vyžaduje prodloužení dávkovacího intervalu a/nebo titraci dávky léčiva na nižší hodnotu. Závěry výše uvedených belgických studií deklarují ve shodě s našimi prvními pozorováními, že dávkování piperacilinu je nutné v klinické praxi individualizovat podle kinetického principu. Tedy na základě sledování jeho plazmatických koncentrací (therapeutic drug monitoring – TDM). Vliv řady kovariát u novorozenců (včetně stupně jejich zralosti a významné retence tekutin) na kinetiku gentamicinu prezentovaly výsledky klinické studie, která byla provedena na souboru pacientů Dětské kliniky VFN v Praze [39]. Na ni navazuje tento výzkumný projekt cílený na dospělou populaci.
Závěr
Výše uvedená fakta ukazují, že změny koncentrací piperacilinu při rozvoji SIRS jak vlivem retence tekutin při patologické permeabilitě kapilár a intenzivní volumoterapii, tak změnami rychlosti jeho následně zvýšené eliminace při mobilizaci sekvestrovaných tekutin mohou významně negativně ovlivňovat účinnost antibiotické terapie vedené podle doporučených dávkovacích schémat pro piperacilin. U pacientů v tomto kritickém stavu je dosažení cílového PK/PD antibiotika s time-dependentním účinkem variabilní. S prodlužující se dobou terapie se snižuje. Při doporučeném dávkování antibiotika (podle SPC − „on label-drug use“) jak ve fázi sekvestrace, tak mobilizace tekutin bylo dosahováno pouze minimálního cílového PK/PD, ale maximálního cílového PK/PD dosahováno nebylo, pokud nedošlo k poruše eliminační funkce ledvin. Důsledkem může být selhání antimikrobiální léčby, nebo (při dysfunkci ledvin) nežádoucí kumulace antibiotika v organismu. Z uvedených poznatků vyplývá nutnost zabývat se individuální predikcí dávkování zvoleného antibiotika s time-dependentním účinkem při jeho indikaci v léčbě infekčních komplikací kritických stavů generujících kovariáty, které významně ovlivňují jeho kinetiku.
Poděkování
Autoři děkují IGA MZ za podporu tohoto výzkumu v rámci projektu NT 14089-3/2013.
Doc. MUDr. RNDr. Milan Kaška, Ph.D.
Chirurgická klinika FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: kaskam@lfhk.cuni.cz
Zdroje
1. O’Neill PA, Kirton OC, Dresner LS, et al. Analysis of 162 colon injuries in patients with penetrating abdominal trauma: concomitant stomach injury results in a higher rate of infection. J Trauma 2004;56 : 304−12.
2. Salim A, Teixeira PG, Inaba K, et al. Analysis of 178 penetrating stomach and small bowel injuries. World J Surg 2008;32 : 471−5.
3. Kim J, Mittal R, Konyalian V, et al. Outcome analysis of patients undergoing colorectal resection for emergent and elective indications. Am Surg 2007;73 : 991−3.
4. Velmahos GC, Vassiliu P, Demetriades D, et al. Wound management after colon injury: open or closed? A prospective randomized trial. Am Surg 2002;68 : 795−801.
5. Chinnery GE, Madiba TE. Pancreaticoduodenal injuries: re-evaluating current management approaches. S Afr J Surg 2010;48 : 10−4.
6. Steichen FM. The use of staplers in anatomical side-to-side and functional end-to-end enteroanastomoses. Surgery 1968;64 : 948−53.
7. Watanabe A, Kohnoe S, Shimabukuro R, et al. Risk factors associated with surgical site infection in upper and lower gastrointestinal surgery. Surg Today 2008;38 : 404−12.
8. Barie PS. Surviving sepsis. Surg Infect (Larchmt). 2004;5 : 1−2.
9. Rovera F, Dionigi G, Boni L, et al. Infectious complications in colorectal surgery. Surg Oncol 2007;Suppl 1:S121−4.
10. Bokey EL, Chapuis PH, Fung C, et al. Postoperative morbidity and mortality following resection of the colon and rectum for cancer. Dis Colon Rectum 1995;38 : 480−6.
11. McIntyre LK, Warner KJ, Nester TA, et al. The incidence of post-discharge surgical site infection in the injured patient. J Trauma 2009;66 : 407−10.
12. Czaja AS, Rivara FP, Wang J, et al. Late outcomes of trauma patients with infections during index hospitalization. J Trauma 2009;67 : 805−14.
13. Hedrick TL, Heckman JA, Smith RL, et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg 2007;205 : 432−8.
14. Uchino M, Ikeuchi H, Tsuchida T, et al. Surgical site infection following surgery for inflammatory bowel disease in patients with clean-contaminated wounds. World J Surg 2009;33 : 1042−8.
15. Lazarus HM, Fox J, Burke JP, et al. Trauma patient hospital-associated infections: risks and outcomes. J Trauma 2005;59 : 188−94.
16. Mahadeva S, Khoo BL, Khoo PS, et al. Clinical impact and risk factors for percutaneous gastrostomy wound infections due to resistant organisms. Int J Infect Dis 2008;12:e149−50.
17. Chambers HF. General principles of antimicrobial therapy. In Goodman & Gilman´s The Pharmacological Basis of Therapeutics Eds. Brunton LL, Lazo JS, Parker KL. Eleventh ed. McGraw-Hill Medical publishing division 2007, Section VIII, Chapter 42 : 1095−1110.
18. Delacher S, Derendorf H, Hollenstein U, et al. A combined in vivo pharmacokinetic-in vitro pharmacodynamic approach to simulate target site pharmacodynamics of antibiotics in humans. J Antimicrob Chemother 2000;46 : 733−9.
19. Kusachi S, Sumiyama Y, Nagao J, et al. Prophylactic antibiotics given within 24 hours of surgery, compared with antibiotics given for 72 hours perioperatively, increased the rate of methicillin-resistant Staphylococcus aureus isolated from surgical site infections. J Infect Chemother 2008;14 : 44−50.
20. Kawecki D, Chmura A, Pacholczyk M, et al. Surgical site infections in liver recipients in the early posttransplantation period: etiological agents and susceptibility profiles. Transplant Proc 2007;39 : 2800−6.
21. Fuentes F, Martín MM, Izquierdo J, et al. In vivo and in vitro study of several pharmacodynamic effects of meropenem. Scand J Infect Dis 1995;27 : 469−74.
22. Mehrotra R, De Gaudio R, Palazzo M. Antibiotic pharmacokinetic and pharmacodynamic considerations in critical illness.Intensive Care Med 2004;30 : 2145−56.
23. Chambers HF, Mills J, Drake TA, Sande MA. Failure of a once-daily regimen of cefonicid for treatment of endocarditis due to Staphylococcus aureus. Rev Infect Dis 1984;6 Suppl 4:S870−4.
24. Geli P. Modeling the mechanism of postantibiotic effect and determinig implications for dosing regimens. Math Biol 2009;59 : 717−28.
25. West MA, Moore EE, Shapiro MB, et al. Inflammation and the host response to injury, a large-scale collaborative project: patient-oriented research core--standard operating procedures for clinical care VII--Guidelines for antibiotic administration in severely injured patients. J Trauma 2008;65 : 1511−9.
26. De Waele JJ, Carrete S, Carlier M, et al. Therapeutic drug monitoring-based dose optimisation of piperaicillin and propenem: a randomised controlled trial. Intensive Care Med 2013;40 : 380−387.
27. Carlier M, Carrete S, Roberts JA, et al. Meronem and piperacillin/tazobactam prescribing in critically ill patients: does augmented renal clearence affect pharmacokinetic/pharmacodynamic target attainment when extended infusions are used? Critical Care 2013;17:R84.
28. Conil JM, Georges B, Mimoz O, et al. Influence of renal function on trough serum concentrations of piperacillin in intensive care unit patients. Intensive Care Med 2006;32 : 2063−6.
29. Patanwala AE, Norris CJ, Nix DE, et al. Vancomycin dosing for pneumonia in critically ill trauma patients. J Trauma 2009;67 : 802−4.
30. Li C, Kuti JL, Nightingale CH, et al. Population pharmacokinetics and pharmacodynamics of piperacillin/tazobactam in patients with complicated intra-abdominal infection. J Antimicrob Chemother 2005;56 : 388−95.
31. Brunner M, Pernerstorfer T, Mayer BX, et al. Surgery and intensive care procedures affect the target site distribution of piperacillin. Crit Care Med 2000;28 : 1754−9.
32. Belzberg H, Zhu J, Cornwell EE 3rd, et al. Imipenem levels are not predictable in the critically ill patient. J Trauma 2004;56 : 111−7.
33. Lodise TP, Patel N, Lomaestro BM, et al. Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients. Clin Infect Dis 2009;49 : 507−14.
34. Pillai SK, Wennersten C, Venkataraman L, et al. Development of reduced vancomycin susceptibility in methicillin-susceptible Staphylococcus aureus. Clin Infect Dis 2009;49 : 1169−74.
35. Bone RC, Sibbald WJ, Sprung CL. The ACCP-SCCM consensus conference on sepsis and organ failure. Chest 1992;101 : 1481−1482.
36. Headya MA. Basic pharmacokinetics. CRC Press - Pharmacy education series, Taylor and Francis Group. Boca Raton 2007 : 300.
37. Gibaldi M. Perrier D. Pharmacokinetics.2nd ed., revised and expanded. Vol. 15 of Drugs and the pharmaceutical sciences. New York, Marcel Dekker 1982 : 489.
38. Hayashi Y, Roberts JA, Paterson DL, Lipman J. Pharmacokinetic evaluation of piperacillin-tazobactam. Expert Opin Drug Metab Toxicol 2010;6 : 1017−31.
39. Martínková J, Pokorná P, Záhora J, et al. Tolerability and outcomes of kinetically guided therapy with gentamicin in critically ill neonates during the first week of life: an open-label, prospective study. Clin Ther 2010;32 : 2400−14.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Chylózní mezenteriální cysta
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2014 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Poznámka k současnému systému postgraduálního vzdělávání chirurgů v ČR
- Limity chirurgického řešení rakoviny pankreatu
- Význam drénů v pankreatické chirurgii
- Personalizovaná antibiotická terapie na chirurgické jednotce intenzivní péče − přehled současných znalostí a výsledky observační kinetické studie
- Tekutiny, nízká resekce rekta a zase tekutiny…
- Těžká hidradenitis suppurativa
- Chylózní mezenteriální cysta
- Retroperitoneální lymfangiom − laparoskopické řešení
- K životnímu jubileu docenta Zdeňka Slezáka
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chylózní mezenteriální cysta
- Retroperitoneální lymfangiom − laparoskopické řešení
- Význam drénů v pankreatické chirurgii
- Tekutiny, nízká resekce rekta a zase tekutiny…
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



