-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Farmakorezistentní epilepsie po kraniocerebrálním poranění
Pharmacoresistant epilepsy after craniocerebral injury
Introduction:
Posttraumatic epilepsy is one of the possible serious consequencies of both closed and open head injury with clinical manifestation months or years after surgery. In pharmacoresistant patients, surgical therapy should be considered.Material and Methods:
The study summarises the results of surgical treatment of pharmacoresistant posttraumatic epilepsy in a group of 13 patients (11 males and 2 females). Average age at the time of injury was 9,6 years in males and 8,8 years in females. The average number of seizures was 10,7–17 seizures/month preoperatively. Invasive EEG monitoring was required in 5 patients in whom non invasive or semiinvasive investigations failed to localize the epileptogenic zone adequately. Temporal lobe resections were performed in 4 patients, 4 patients underwent extratemporal resections and vagus nerve stimulation system was implanted in 5 patients.Results:
Three patients (75%) after temporal resections became seizure free (Engel I) and in the remaining patient significant reduction of seizures was achieved (Engel III). There were 2 seizure free patients after extratemporal resections (50%) and significant reduction of seizure rates was achieved (Engel III) in the remaining two. One patient after vagus nerve stimulation met the criteria for > 90% response and there was a 50–90% seizure rate reduction in the remaining 4 patients (vagus nerve stimulation responder).Conclusions:
Although in limited group of patients the study confirms good results of surgical treatment of selected posttraumatic epilepsy patients – mainly temporal epilepsy patients and patients after vagus nerve stimulation. Meticulous presurgical evaluation including invasive encephalography in indicated patients is a precondition for surgical success.Key words:
head injury – epilepsy – surgical treatment – vagus nerve stimulation
Autoři: J. Chrastina 1,3; Z. Novák 1,3; I. Říha 1,3; K. Ghallab 1; L. Martínek 1
; M. Brázdil 2,3
Působiště autorů: Neurochirurgická klinika LF MU a FN u sv. Anny v Brně, Pekařská 5 , Brno přednosta: Prof. MUDr. Zdeněk Novák, CSc 1; Centrum pro epilepsie Brno, I. neurologická klinika LF MU a FN u sv. Anny v Brně přednosta: Prof. MUDr. Ivan Rektor, CSc 2; CEITEC - Středoevropský technologický institut, Masarykova univerzita, Brno 3
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 1, s. 18-25.
Kategorie: Původní práce
Souhrn
Úvod:
K možným následkům zavřených i otevřených kraniocerebrálních poranění patří poúrazová epilepsie, rozvíjející se u části zraněných s odstupem měsíců až let po primárním poranění. U nemocných s farmakorezistencí je nutné zvážit možnost chirurgické terapie.Materiál a metodika:
Práce shrnuje výsledky chirurgické terapie 13 nemocných s farmakorezistentní poúrazovou epilepsií (11 mužů, 2 ženy). Průměrný věk při traumatu byl u mužů 9,6 roku, u žen 8,8 roku. Počet záchvatů se pohyboval v rozmezí 10,7–17 záchvatů/ měsíc. U 5 nemocných bylo pro nemožnost přesné lokalizace epileptogenní zóny předoperačně indikováno invazivní EEG vyšetření. U 4 nemocných byla provedena resekce temporálního laloku, extratemporální resekce byla provedena u 4 nemocných a implantace vagového stimulátoru u 5 nemocných.Výsledky:
3 nemocní (75 %) s temporální epilepsií byli po resekční operaci bez záchvatů (Engel I), u jednoho nemocného byla výsledkem významná redukce počtu záchvatů (Engel III). U nemocných s extratemporální epilepsií byli po operaci 2 nemocní bez záchvatů (50 %) a výsledku Engel III bylo dosaženo u 2 nemocných (50 %). Jeden nemocný po vagové stimulaci splňoval kritéria > 90 % redukce záchvatů a u 4 nemocných byla redukce počtu záchvatů v rozmezí 50–90 % (respondér vagové stimulace).Závěr:
Na limitovaném souboru sdělení prokazuje dobré výsledky operační terapie u nemocných s farmakorezistentní poúrazovou epilepsií, především u temporální epilepsie a vagové stimulace. Nutnou podmínkou je komplexní předoperační vyšetření včetně invazivního EEG vyšetření u indikovaných nemocných.Klíčová slova:
kraniocerebrální poranění – epilepsie – chirurgická terapie – stimulace n.XÚVOD
I když je možné v současné době pozorovat narůstající podíl nemocných, kteří přežívají i závažná nitrolební poranění [1], není možné ignorovat následky těchto traumat se závažným medicínským i společenským dopadem. Jedním z možných závažných následků kraniocerebrálního poranění je rozvoj chronických záchvatových projevů ve smyslu poúrazové epilepsie. Důležitou otázkou z medicínského i forenzního hlediska je také vztah anamnesticky uváděného poranění hlavy ke vzniku epileptických záchvatů. Pro zařazení nemocného do skupiny poúrazové epilepsie jsou dle Hoshidy se spolupracovníky určující poúrazové změny mozkové tkáně prokázané pomocí MRI [2].
Poúrazová epilepsie tvoří přibližně 5 % veškerých epilepsií. Četnost poúrazové epilepsie u nemocných s prokázanými fokálními kontuzemi a hemoragiemi je 30 % a penetrující poranění mozku je spojeno s 50% rizikem poúrazové epilepsie [3]. Tato data podtrhují význam poúrazové epilepsie a nutnost aktivního terapeutického postupu, zvláště při farmakorezistenci, přítomné u 13 % nemocných s poúrazovou epilepsií [4, 5]. Vzhledem k podílu farmakorezistentních nemocných se nabízí otázka možností epileptochirurgické terapie.
Cílem práce je prezentace výsledků chirurgické terapie nemocných s farmakorezistentní poúrazovou epilepsií po komplexním předoperačním vyšetření v epileptochirurgickém programu a rozbor vztahu kraniocerebrálního poranění ke vzniku farmakorezistentních epileptických záchvatů na základě histologických nálezů při vyšetření resekátu.
MATERIÁL A METODA
Ve sdělení prezentujeme výsledky chirurgické terapie u nemocných s farmakorezistentní poúrazovou epilepsií, operovaných na neurochirurgické klinice LF MU FN u sv. Anny v letech 1996–2007. Nemocní byli zařazeni do souboru na základě údaje o kraniocerebrálním poranění následovaném rozvojem epileptických záchvatů. Dalšími podmínkami byla nepřítomnost epileptických záchvatů před úrazem, detailní předoperační vyšetření neprokázalo jinou možnou příčinu (např. febrilní křeče u nemocných s temporální epilepsií, jiná strukturální léze při MRI vyšetření – tumor, cévní malformace atd.) a výsledek neuroradiologického vyšetření vyslovil podezření na poúrazové změny. U nemocných po resekčních výkonech byl výsledek histologického vyšetření korelován s klinickými a neuroradiologickými daty. Jednalo se o soubor 13 nemocných, 11 mužů a 2 ženy, průměrný věk v době operace u mužů 36,8 roku (rozmezí 22–51 let), u žen 33,5 roku (32 a 35 let). Tito nemocní tvořili přibližně 3,5 % všech nemocných, kteří byli ve stejném období operováni pro farmakorezistentní epilepsii. Základní klinická data jsou shrnuta v Tab. 1 a 2, do kterých jsou nemocní zařazeni podle provedeného neurochirurgického výkonu (resekční výkon nebo vagová stimulace).
Tab. 1. Přehled klinických, radiologických a histologických dat u nemocných po resekčním výkonu pro poúrazovou epilepsii. Tab. 1: Overview of clinical, radiological and histological data in patients after resection procedure for posttraumatic epilepsy 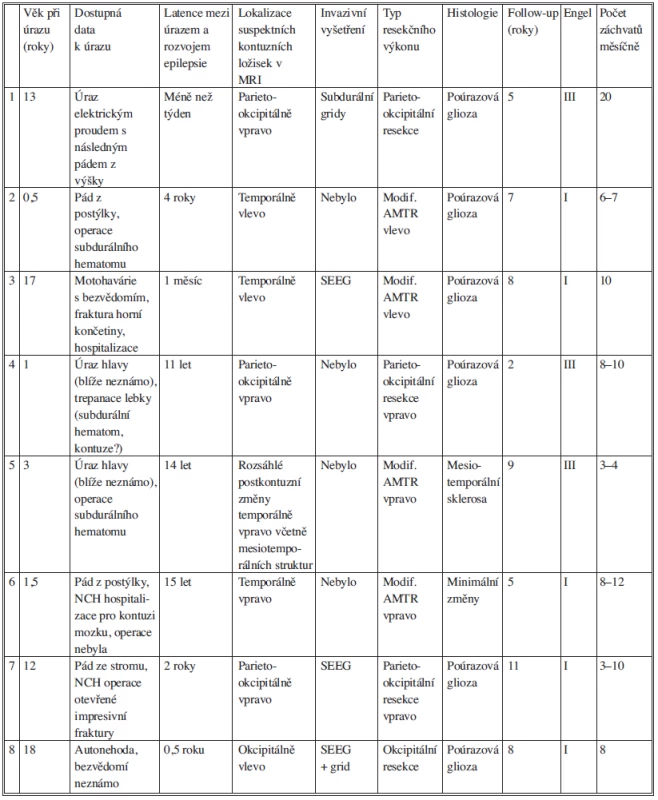
Tab. 2. Přehled klinických a radiologických dat u nemocných po implantaci vagového stimulátoru pro poúrazovou epilepsii. Tab. 2: Overview of clinical and radiological data in patients after implantation of the vagus nerve stimulation device for posttraumatic epilepsy 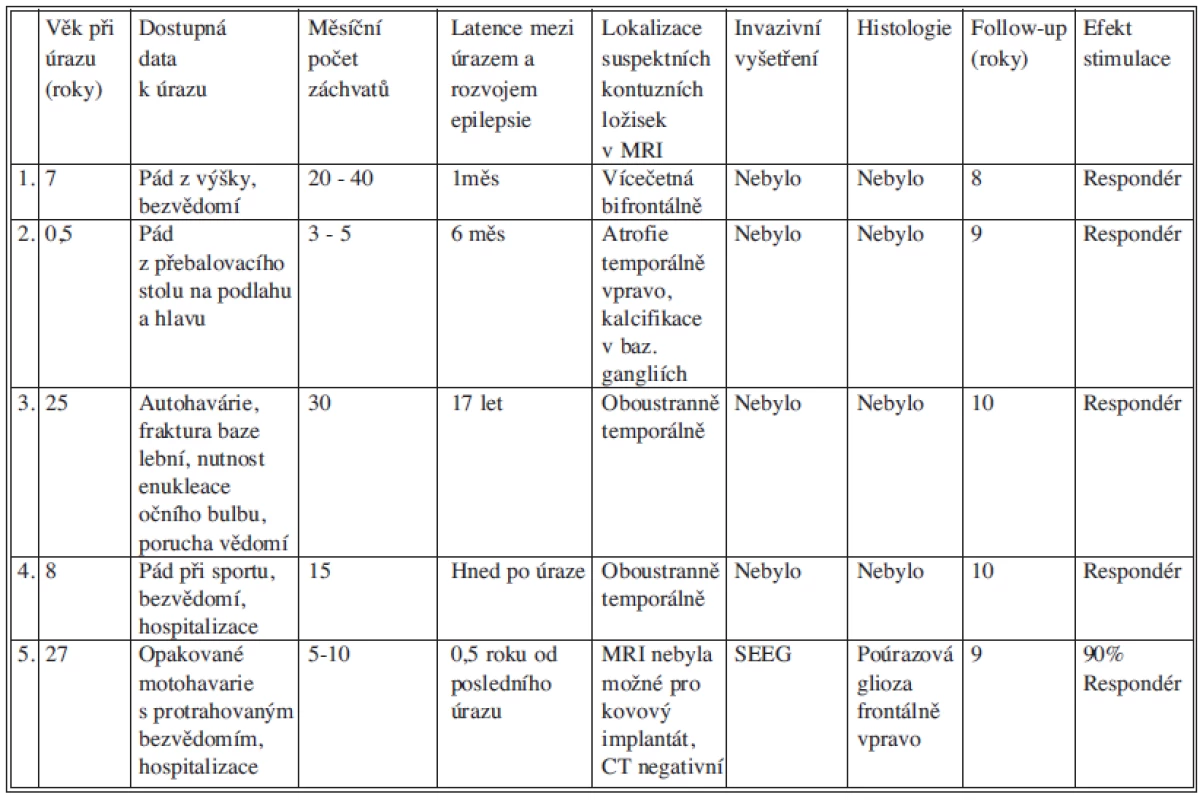
Průměrný věk nemocných při vzniku traumatu byl u mužů 9,6 roku (6 měsíců–27 let), u žen 8,8 roku (6 měsíců–17 let). Nejčastějším mechanismem úrazu byl pád (4 nemocní), u 3 nemocných se jednalo o pád z výšky (v jednom případě po úrazu elektrickým proudem), dále dopravní úrazy (4 nemocní) a častou příčinou byl pád z postýlky nebo stolu v kojeneckém nebo batolecím věku (3 nemocní). U 2 nemocných nebyly okolnosti úrazu přesně známy. U 4 nemocných byla v časném poúrazovém období indikována neurochirurgická intervence. Detailní operační data bylo možné doplnit u jediného nemocného, operovaného na pracovišti autorů ve věku 12 let pro otevřené kraniocerebrální poranění po pádu z výšky (odstranění kostních úlomků a ošetření lacerace mozku s plastikou tvrdé pleny). U ostatních nemocných byly operace provedeny 18–37 let před epileptochirurgickým výkonem mimo pracoviště autorů. Dle dostupných kusých dat se jednalo o trepanaci pro subdurální hematom (2 nemocní) nebo subdurální hematom s kontuzí mozku (Obr. 1).
Obr. 1. Rozsáhlá gliotická jizva s defektem tvrdé pleny v celém rozsahu této jizvy po trepanaci pro subdurální krvácení a kontuzi mozku v dětském věku provedené mimo neurochirurgické pracoviště. Fig. 1: A large gliotic scar with a dura mater defect throughout the extent of this scar after trepanation for subdural bleeding and cerebral contusion in childhood performed outside a neurosurgical department. 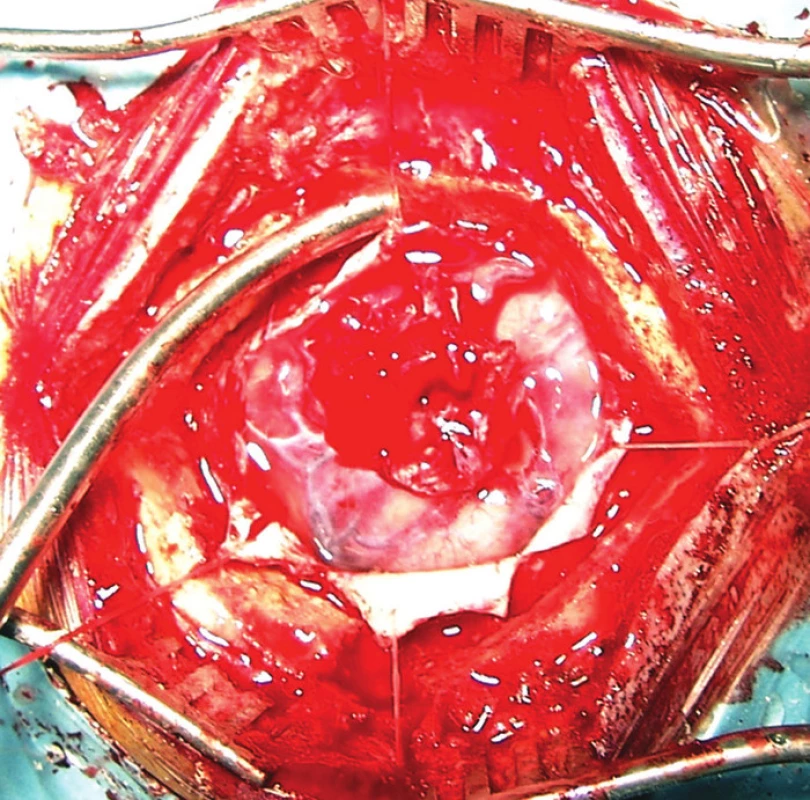
U dalších 2 nemocných bylo kraniocerebrální poranění spojeno s dalším poraněním s nutnou operací (fraktura levé horní končetiny, zlomenina spodiny lebeční a obličejového skeletu s nutností enukleace pravého očního bulbu). U jednoho nemocného byla dokumentována hospitalizace na neurochirurgickém pracovišti pro CT prokázanou kontuzi mozku.
Kromě výše uvedených operovaných nemocných byla v časném poúrazovém období kvantitativní porucha vědomí dokumentována u 4 nemocných a z nich 3 byli hospitalizováni na JIP.
U 2 nemocných (15,4 %) se farmakorezistentní záchvaty objevily s odstupem kratším než 1 týden po úrazu. V pozdějším období došlo k rozvoji záchvatů u 11 pacientů (84,6 %). U těchto nemocných byla střední hodnota intervalu mezi úrazem a prvním záchvatem 70,5 měsíce.
Střední hodnota měsíční četnosti záchvatů se pohybovala v rozmezí 10,7–17 záchvatů za měsíc. Střední hodnota intervalu první záchvat – operace dosahovala překvapivých 20,9 roku.
Před stanovením indikace k operačnímu výkonu byli nemocní kompletně vyšetřeni v rámci Centra pro epilepsie. Nemožnost lokalizace epileptogenního ložiska pomocí neinvazivních a semiinvazivních technik vedla k indikaci invazivního EEG vyšetření u 5 pacientů (38,4 %). U 3 nemocných byly stereotakticky implantovány intracerebrální elektrody (stereoencefalografie – SEEG) (Obr. 2 a, b, c) a jednomu nemocnému subdurální gridy.
Obr. 2. Farmakorezistentní epilepsie po otevřeném kraniocerebrálním poranění okcipitálně vpravo, předpokládána další nezávislá ložiska frontálně a temporálně vpravo Fig. 2: Pharmacoresistant epilepsy , secondary to open craniocerebral, right- sided occipital injury. Other independent foci are expected within the right frontal and temporal region a) Axiální scan s implantovanými elektrodami explorujícími temporální lalok a) Axial scan with implanted electrodes exploring the temporal lobe region b) Axiální scan s implantovanými elektrodami explorujícími dorzální frontální lalok a okolí gliotické jizvy b) Axial scan with implanted electrodes exploring the dorsal frontal lobe region and the region surrounding the gliotic scar c) Zóna počátku záchvatu v elektrodě implantované v parietooccipitální oblasti na okraji poúrazové gliózy (označeno červeně) s rozsahem navržené a provedené resekce – výsledek Engel I (11 let po operaci) c) A seizure onset zone in an electrode implanted in the parietooccipital region at the edge of the posttraumatic gliosis (marked red) with marked extent of the proposed and completed resection – outcome Engel I (11 years after the procedure) 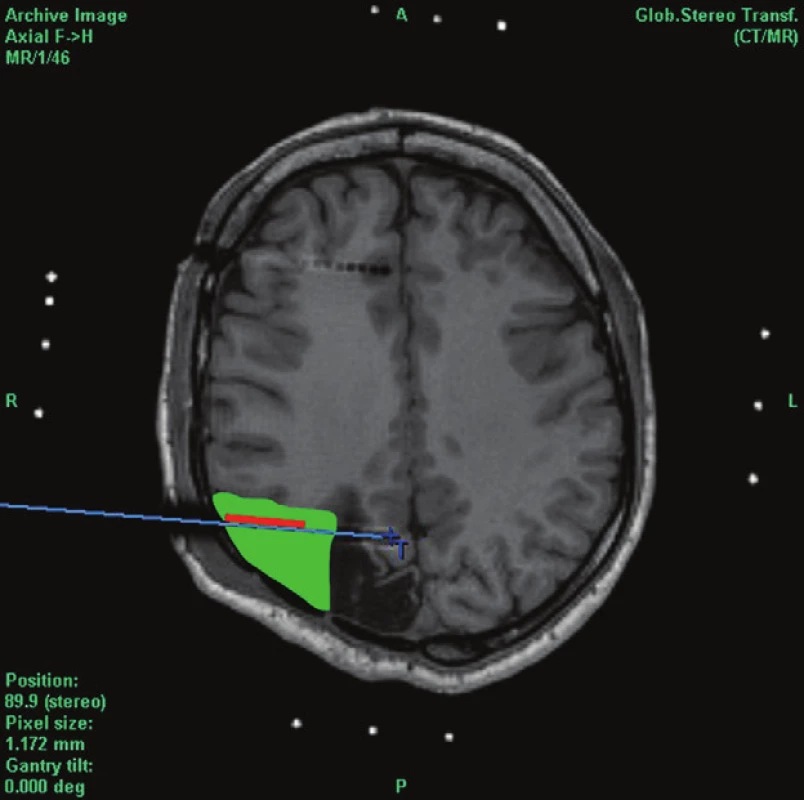
U jednoho nemocného byla využita kombinace intracerebrálních elektrod se subdurálním gridem. Výsledek invazivního EEG neumožnil provedení resekčního výkonu u jediného nemocného pro prokázané postižení obou spánkových laloků s akcentací na straně dominantní pro paměť. Tomuto nemocnému byl implantován vagový stimulátor.
Výsledky
Operační výkon byl indikován po komplexním zhodnocení dostupných dat. U 4 nemocných byl proveden resekční výkon v oblasti temporálního laloku (nejčastěji resekce přední části spánkového laloku včetně amygdaly a části hipokampu – anteromediální temporální resekce – AMTR), resekce extratemporální u 4 nemocných (u 3 resekce v parietookcipitální oblasti a u jednoho okcipitální resekce) a implantace vagového stimulátoru (vagus nerve stimulation – VNS) u 5 nemocných (4 nemocní s temporální epilepsií a 1 nemocný s epilepsií extratemporální). Výsledky resekčních výkonů byly hodnoceny pomocí Engelovy stupnice (Engel I – bez záchvatů, Engel II – ojedinělé záchvaty, Engel III – významné zlepšení počtu záchvatů, Engel IV – nevýznamné zlepšení).
Velmi dobrého výsledku (Engel I) bylo dosaženo u 3 ze 4 nemocných s temporální epilepsií a u dvou ze 4 nemocných s epilepsií extratemporální (jeden nemocný po okcipitální resekci a po resekci v parientookcipitální oblasti). Pooperační průběh byl u jednoho nemocného po rozsáhlé anteromediální temporální resekci (výsledek Engel III) komplikován levostrannou hemiparézou s neúplnou úpravou při ischemii v oblasti capsula interna.
U všech nemocných bylo po resekčním výkonu provedeno histologické vyšetření odebrané mozkové tkáně. Posttraumatické gliotické změny byly popsány u šesti z osmi nemocných. U dvou nemocných byly histologické nálezy odlišné – u jednoho byla popsána hipokampální skleroza (Tab. 1, pac. č. 5) a u jednoho nemocného byly překvapivě v resekátu laterálního temporálního neokortexu a meziotemporálních struktur prokázány pouze minimální změny (Tab. 1, pac. č. 6).
U jednoho nemocného byl odebrán vzorek z baze frontálního laloku při implantaci intracerebrálních elektrod. Vyšetření prokázalo poúrazové gliotické změny (opakované motohavárie závodního jezdce) (Tab. 2, pac. č. 5). U tohoto nemocného byl resekční výkon pro bitemporální postižení s výraznějším nálezem na straně dominantního amygdalohipokampálního komplexu kontraindikován a byl implantován vagový stimulátor s výborným výsledkem (> 90 % redukce záchvatů).
Pro hodnocení výsledků vagové stimulace jsme nemocné rozdělili do kategorií: >90 % respondér (redukce počtu záchvatů o více než 90 %) – 1 nemocný, 50–90 % respondér (redukce počtu záchvatů o 50–90 %) – 4 nemocní a non respondér – redukce počtu záchvatů o méně než 50 % (0 nemocných). Přechodná dysfonie s úplnou úpravou byla po implantaci vagového stimulátoru pozorována u 1 nemocného.
Diskuze
Poúrazová epilepsie byla v historii neurochirurgie častou indikací časných neurochirurgických operací. Z období před zavedením celkové anestézie je nutné zmínit Benjamina Winslowa Dudleyho (1785–1870), který v letech 1819–1832 provedl trepanace u 6 nemocných s poúrazovou epilepsií [6]. Vodítkem pro časné výkony pro poúrazovou epilepsii při nemožnosti rentgenologického vyšetření a elektroencefalografie byly známky zevního poranění na kůži, hmatná imprese nebo defekt kalvy. Ovšem r. 1886 Roswell Park provádí resekci poúrazového epileptogenního ložiska u nemocného bez zevní jizvy [7] a téhož roku se datuje často citovaný operační výkon Horsleyho pro poúrazovou epilepsii – elevace kostních fragmentů a resekce jizevnatě změněného laterálního frontálního kortexu [8].
Prokázanými rizikovými faktory pro vznik poúrazové epilepsie jsou subdurální hematom (operace u 3 nemocných ze souboru), mozková kontuze a otevřené kraniocerebrální poranění (operace u jednoho nemocného ze souboru). Difúzní axonální poranění může selektivně poškozovat vulnerabilní oblasti mozku důležité pro rozvoj poúrazové epilepsie (hipokampus) [9].
I když se jedná o data z válečné chirurgie, obecnější platnost má studie Aarabiho. Dle autora jsou nejvýznamnější rizikové faktory vzniku poúrazové epilepsie výsledný stav zraněného (Glasgow Outcome Scale) a přítomnost motorického deficitu. Méně významný je typ projektilu, místo poranění, počet postižených laloků, hemoragické a infekční komplikace a ponechané kovové nebo kostní fragmenty. Častý výskyt těchto rizikových faktorů vede k vysoké četnosti poúrazové epilepsie u válečných poranění (32 % v souboru zraněných z irácko-íránské války) [10].
Dle Pagniho je kaskáda rozvoje poúrazové epilepsie s latencí po kraniocerebrálním poranění iniciována úrazovým krvácením. V dalším průběhu dochází k hemolýze extravaskulárně lokalizovaných erytrocytů s uvolněním sloučenin železa a vznikem volných radikálů, vedoucím k peroxidaci lipidů a změnám buněčných membrán. Mechanismus připouští možnost preventivního zásahu, snižujícího pravděpodobnost rozvoje poúrazové epilepsie – zametače volných radikálů, antioxidanty [11]. Dę Ambrozio zmiňuje úlohu genetické predispozice (apolipoprotein E a genotypy haptoglobinu)[12]. Týž autor v animálním modelu traumatického poškození mozku prokazuje perzistující hyperexcitabilitu kortexu v oblasti poranění a v jeho okolí s reaktivními změnami gliální tkáně [13]. Podle Angeleriho byly kortikální hyperintenzní oblasti obsahující hemosiderin prokázány u většího podílu nemocných s poúrazovými epileptickými záchvaty (nejméně 2 záchvaty mezi 2. a 12. měsícem po úraze) než u nemocných bez poúrazových epileptických záchvatů s odstupem 1 roku po kraniocerebrálním poranění [14]. V našem souboru byl odstup mezi traumatem a rozvojem farmakorezistentních záchvatů kratší než 1 rok u 4 ze 7 nemocných s histologicky prokázanými poúrazovými gliotickými změnami.
S rizikovými faktory poúrazové epilepsie a poznatky o jejím vzniku souvisí i možnosti preventivních opatření, zvláště pokud jsou přítomny rizikové faktory. Jednou z možností je i preventivní podávání antiepileptik [9, 15].
U časných záchvatů je možnost jejich kontroly fenytoinem, ovšem profylaktická antiepileptická medikace selhala u pozdních záchvatů. Dle Temkinovy studie z r. 2009 nebylo prokázáno u žádného ze studovaných antiepileptik (fenytoin, fenobarbital, jejich kombinace, karbamazepin, valproát), že dokážou zabránit rozvoji epilepsie. Podle nejlepšího odhadu je redukce poúrazových epileptických záchvatů menší než 25 %. Ovšem antiepileptika vyvinutá po r. 1980 byla velmi omezeně testována [9].
Hodnocení tíže poranění a iniciálního nálezu při neuroradiologickém vyšetření po úraze u nemocných je velmi obtížné pro často nedostupná data a zkreslené údaje v anamnéze díky odstupu od primárního poranění. Neurochirurgická operace pro nitrolební krvácení nebo penetrující poranění byla nutná u 4 nemocných a operace pro rozsáhlé poranění kraniofaciálního skeletu u 1 nemocného (celkem 38,4 % nemocných). Nejčastějším pozorovaným mechanismem úrazu byl pád z výšky, následovaný dopravními úrazy a poranění kojence nebo batolete při neopatrné manipulaci. Naproti tomu Hartzfeld ve skupině nemocných s meziotemporální poúrazovou epilepsií uvádí jako nejčastější mechanismus tupé poranění při moto a autohavárii [16].
Pro došetření nemocného s poúrazovou farmakorezistentní epilepsií platí podobná pravidla jako pro jiné nemocné s farmakorezistentní epilepsií. Implantace intracerebrálních nebo subdurálních elektrod je indikována u nemocných, kde klinické vyšetření, kompletní neuroradiologická studie a neinvazivní nebo semiinvazivní video EEG monitorace neumožní přesné určení epileptogenní zóny a stanovení operační indikace. Cílem invazivního vyšetření není jen lokalizace epileptogenní zóny, ale také určení jejího vztahu k funkčně významným oblastem. Právě rozsah a lokalizace epileptogenní zóny určuje typ resekčního výkonu. Epileptochirurgická literatura rozlišuje resekce temporální a extratemporální. Pod pojem temporální resekce lze zařadit různě rozsáhlé výkony – například anteromediální temporální resekci (klasicky zahrnující resekci temporálního laloku v rozsahu 3–5 cm od pólu temporálního laloku s odstraněním amygdaly, hipokampu a parahipokampálního gyru po úroveň dorzálního mezencefala a zachováním horního temporálního závitu) a cílené selektivní výkony. Při selektivním výkonu jsou odstraněny pouze vybrané struktury (například amygdala a hipokampus). Výsledky správně indikovaných temporálních resekcí jsou z hlediska redukce farmakorezistentních záchvatů příznivé – např. Kuba et al uvádějí 82,4 %, 83,4 % a 74,3 % nemocných bez záchvatů s odstupem 1, 3 a 5 let po výkonu [17]. Součástí temporálních resekcí je i preparace v blízkosti arteria cerebri media nebo arteria chorioidea anterior, což může být i příčinou vzácných, ale potenciálně závažných ischemických komplikací (8), postihujících mimo jiné dráhy capsula interna, jak tomu bylo i u našeho nemocného.
Při klasifikaci resekcí extratemporálních je možné dle lokalizace resekované tkáně rozlišit resekce frontální, parietální, okcipitální a resekce rozsahem přesahující jednotlivé laloky mozku (v našem souboru resekce parietookcipitální).
U nemocných, kde není možné provést resekční výkon (především multifokální a bitemporální epilepsie), je v současné době indikována vagová stimulace. Cílem intermitentní elektrické stimulace levého n. vagus pomocí implantovaného systému je redukce počtu a intenzity epileptických záchvatů. Mechanismus působení VNS vyplývá z efektu vagové stimulace na struktury hrající úlohu ve vzniku, šíření a symptomatologii epileptického záchvatu – např. kmenovou retikulární formaci, hipokampus, amygdalu, thalamus, levý prefrontální kortex, postcentrální gyrus vpravo i vlevo, gyrus cinguli a inzulu cestou parabrachiálního jádra a thalamu. Velmi zjednodušeně je možné konstatovat, že minimálně 50 % nemocných má šanci alespoň na 50% redukci počtu záchvatů [18].
Hartzfeld et al při srovnání operačních výsledků meziotemporální poúrazové epilepsie s epilepsií jiného původu neprokázali významný rozdíl v klinickém výsledku mezi nemocnými s poúrazovou epilepsií a epilepsií jiného původu. Nemocní, u nichž byla provedena resekce meziotemporálních struktur, tvořili většinu souboru operovaných nemocných s poúrazovou epilepsií (30 z 57 nemocných) [16].
I když je soubor nemocných limitovaný, výsledky extratemporálních resekcí jsou méně příznivé než u resekcí temporálních – dva nemocní bez záchvatů (50 %), i když u zbylých dvou bylo dosaženo významné redukce počtu epileptických záchvatů (Engel III). Zde je možné provést srovnání s daty ze souborů neselektovaných nemocných s extratemporální epilepsií. Například Téllez Zenteno se spolupracovníky u dlouhodobě sledovaných nemocných popisují 66 % nemocných bez záchvatů po temporálních resekcích, z nemocných s okcipitální a parietální epilepsií je 46 % bez záchvatů a výsledky jsou nejhorší u frontální epilepsie – 27 % nemocných bez záchvatů [19]. Jiná sdělení popisují podíl nemocných bez záchvatů nebo s ojedinělými záchvaty po extratemporální resekci v rozmezí 43–71 % [20, 21].
Histologické nálezy u nemocných s poúrazovou epilepsií studoval Swartz se spolupracovníky. V souboru 21 nemocných s poúrazovou epilepsií byl medián intervalu mezi traumatem a počátkem záchvatů 2 roky a střední doba trvání epilepsie 16 let. V neokortexu prokazovali gliotické změny u všech nemocných, v oblasti hipokampu nacházeli ztrátu neuronů v 94 % studovaných vzorků [22].
V již citovaném souboru Hartzfelda byly histologické nálezy na resekovaných meziotemporálních strukturách popsány jako meziotemporální skleróza, glióza, atrofie a encefalomalacie [16].
Důležitým medicínským i forenzním problémem je vztah epilepsie ke kraniocerebrálnímu poranění. Hoshida et al rozlišují poúrazovou epilepsii (posttraumatic epilepsy) a epilepsii spojenou s poraněním (trauma associated epilepsy). Do kategorie poúrazová epilepsie ve striktním slova smyslu zařazují nemocné s prokázanými poúrazovými změnami v MRI obraze. V souboru 4 nemocných s poúrazovou epilepsií a 8 nemocných s epilepsií spojenou s poraněním hlavy popisují vyšší střední věk při počátku záchvatů u nemocných s poúrazovou epilepsií (28 let) než u nemocných s trauma associated epilepsy (15 let). Střední délka intervalu mezi úrazem a počátkem záchvatů byla u nemocných s poúrazovou epilepsií 12 let. U nemocných s „trauma associated epilepsy“ byla u 6 nemocných kratší než jeden rok. Histologicky byla u 3 nemocných s „trauma associated epilepsy“ prokázána hipokampální skleróza [2].
Při hodnocení vztahu epilepsie ke kraniocerebrálnímu poranění je ovšem možné vzít do úvahy i histologické nálezy při vyšetření resekované tkáně a nález při neuroradiologickém vyšetření hodnotit v souvislosti s tímto nálezem a klinickými daty. V našem souboru byly poúrazové gliotické změny prokázány u 6 z 8 nemocných s provedenou resekcí.
U nemocného s minimálními histologickými změnami v resekátu temporálního laloku byla jednoznačná úrazová anamnéza s neurochirurgickou hospitalizací pro kontuzi mozku prokázanou pomocí CT a odpovídajícími změnami v MRI obraze. Podobně u nemocného s histologickým nálezem těžké hipokampální sklerózy vpravo byla v dětství provedena pravostranná temporoparietální trepanace pro subdurální hematom. Navíc vyšetření MRI prokázalo rozsáhlejší změny temporálního laloku mozku, které byly hodnoceny jako postkontuzní, ovšem kombinace patologicko-anatomického nálezu a změn v MRI obraze nevylučuje i možnost duální patologie – poúrazových změn a hipokampální sklerózy, což by nemocného mohlo řadit do skupiny „trauma associated epilepsy“.
Literatura přináší minimum dat zaměřených na vagovou stimulaci u nemocných poúrazovou epilepsií. Lee et al v souboru 11 nemocných s poúrazovou epilepsií a přetrvávajících epileptických záchvatech po resekčních i dyskonekčních výkonech popisují v období 6 měsíců po implantaci 74,3% redukci počtu záchvatů a za 18 měsíců redukce počtu záchvatů dosáhla překvapivých 92,4 %. Ve studovaném souboru byli pouze 2 nemocní s poúrazovou epilepsií po těžkém poranění mozku. U obou nemocných bylo dosaženo úplné remise záchvatů 24 měsíců po implantaci stimulátoru [23].
Závěry
I když sdělení prokazuje uspokojivé výsledky operační terapie po komplexním předoperačním došetření v limitovaném souboru nemocných s farmakorezistentní poúrazovou epilepsií především u nemocných s temporální epilepsií a po implantaci vagového stimulátoru, ukazuje i na obtížnost diagnosticko-terapeutického procesu u těchto nemocných. Dosažené výsledky jsou výsledkem detailního došetření, které je náročné na spolupráci nemocného v rámci předoperační přípravy, fázi hospitalizační a pooperačního sledování. Výsledky operační terapie u nemocných s extratemporální poúrazovou epilepsií jsou horší než u nemocných s epilepsií temporální. Je nutné zdůraznit preventivní opatření, která vyplývají z analýzy příčin traumat u operovaných nemocných a v populaci obecně.
Podpořeno VZ MŠMT 0021622404 a NS 10411-3
MUDr. Jan Chrastina, Ph.D.
Neurochirurgická klinika LF MU,
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: jan.chrastina@fnusa.cz
Zdroje
1. Fuller G, Bouamra O, Woodford M, Jenks T, Patel H, Coasts TJ, Oakley P, Mendelow AD, Pigott T, Hutchinson PJ, Lecky F. Temporal trends in head injury outcomes from 2003 to 2009 in England and Wales. Br J Neurosurg 2011;25 : 414–421.
2. Hoshida T, Kobitsu K, Takeshima S, Hashimoto H, Kim YJ, Nakase H, Sasaki T. Head trauma related epilepsy. In: Kano T (Editor in Chief), Kato Y(Ed.): Minimally invasive neurosurgery and multidisciplinary neurotraumatology. Springer 2006;2 : 260–267.
3. Diaz-Arrastia R, Agostini MA, Madden CJ, Van Ness PC. Posttraumatic epilepsy: the endophenotypes of a human model of epileptogenesis. Epilepsia 2009;50(Suppl.2):14–20.
4. Chen JWY, Tiff RL, Eavey R, Wasterlain CG. Posttraumatic epilepsy and treatment. Journal of Rehabilitation Research and Development 2009;46 : 685–696.
5. Schierhout G, Roberts I. Prophylactic antiepileptic agents after head injury: A systematic review. J Neurol Neurosurg Psychiatry 1998;64 : 108–112.
6. Jensen RL, Stone JL. Benjamin Winslow Dudley and early American trephinations for posttraumatic epilepsy. Neurosurgery 1997;41 : 263–268.
7. Fine EJ, Reynolds D, Soria ED, Scalcione LR, Fine DL. The contributions of dr. Roswell Park to epilepsy and spinal surgery. Neurosurgery 1998;42 : 372–377.
8. Dbalý V. Epileptochirurgie dospělých. Praha, Grada Publishing, 2004.
9. Temkin NR. Preventing and treating posttraumatic seizures: the human experience. Epilepsia 2009;50 (Suppl.2):10–13.
10. Aarabi B, Taghipour M, Haghnegahdar A, Farokhi M, Mobley L. Prognostic factors in the occurence of posttraumatic epilepsy after penetrating head injury suffered during military service. Neurosurg Focus 2000;8(1):e1.
11. Pagni CA, Zenga F. Posttraumatic epilepsy with special emphasis on prophylaxis and prevention. Acta Neurochir 2005;93 : 27–34.
12. DęAmbrosio R, Perucca E. Epilepsy after head injury. Curr Opin Neurol 2004;17 : 731-735.
13. DęAmbrosio R, Fairbanks JP, Fender JS, Born DE, Doyle DL, Miller JW. Post - traumatic epilepsy following fluid percussion injury in the rat. Brain 2004;127 : 304–314.
14. Angeleri F, Majkowski J, Cacchio G, Sobieszek A, DęAcunto S, Gesuita R, et al. Posttraumatic epilepsy risk factors: one-year prospective study after head injury. Epilepsia 1999;40 : 1222–1230.
15. Servít Z, Musil F. Prophylactic treatment of posttraumatic epilepsy: results of a long term follow up in Czechoslovakia. Epilepsia 1981;22 : 315–320.
16. Hartzfeld P, Elisevich K, Pace M, Smith B, Gutierrez JA. Characteristics and surgical outcome for medial temporal posttraumatic epilepsy. Br J Neurosurg 2008;22 : 224–230.
17. Kuba R, Brázdil M, Novák Z, Pažourková M, Ošlejšková H, Chrastina J, Tyrlíková I, Rektor I. Dlouhodobá účinnost resekčních epileptochirurgických zákroků 5 let od operace. Neurol pro Praxi 2008;9 : 166–170.
18. Novák Z, Kuba R, Brázdil M, Chrastina J, Rektor I. Stimulace nervus vagus v terapii farmakorezistentní epilepsie. Neurol pro Praxi 2004;2 : 63–66.
19. Téllez-Zenteno JF, Dhar R, Wiebe S. Long-term seizure outcomes following epilepsy surgery: a systematic review and meta-analysis. Brain 2005;128 : 1188–98.
20. Devaux B, Chassoux F, Guenot M, Haegelen C, Bartolomei F, Rougier A, et al. Epilepsy surgery in France. Neurochirurgie 2008;54 : 453–465.
21. Elsharkawy AE, Behne F, Oppel F, Pannek H, Schulz R, Hoppe M, et al. Long term outcome of extratemporal epilepsy surgery among 154 adult patients. J Neurosurg 2008;108 : 676–686.
22. Swartz BE, Houser CR, Tomiyasu U, Walsh GO, deSalles A, Rich JR, et al. Hippocampal cell loss in posttraumatic epilepsy. Epilepsia 2006;47 : 1373–1382.
23. Lee HO, Koh EJ, Oh YM, Park SS, Kwon KH, Choi HY. Effect of vagus nerve stimulation in posttraumatic epilepsy and failed epilepsy surgery: Preliminary report. J Korean Neurosurg Soc 2008;44 : 196–198.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Bodná poranění u dětíČlánek Kolorektální karcinom
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Močový katetr jako rizikový faktor vzniku urologických komplikací po TEP kolenního kloubu – retrospektivní analýza
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Proč je dobré zachránit Rozhledy v chirurgii
- Bodná poranění u dětí
- 15th Annual meeting European society of Surgery
- Kolorektální karcinom v ČR – data minulá a budoucí
- Kolorektální karcinom
- Chirurgická léčba kolorektálního karcinomu
- Pohled na současnou bariatricko-metabolickou chirurgii
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Chirurgická léčba kolorektálního karcinomu
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





