-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
Autoři: L. Petruželka; P. Georgiev
Působiště autorů: Onkologická klinika 1. LF UK a VFN - VFN Praha a Ústav radiační onkologie NNB přednosta: Prof. MUDr. Luboš Petruželka, CSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 1, s. 53-58.
Kategorie: Postgraduální vzdělávání
Úvod
Kolorektální karcinomy (KRK) jsou druhou nejčastější příčinou úmrtí na nádorová onemocnění ve světě. Celosvětově je ročně diagnostikován více než 1 milion nových onemocnění a více než 500 000 nemocných na toto onemocnění zemře [1]. V České republice je KRK nejčastějším zhoubným nádorem trávicího ústrojí a druhou nejčastější orgánovou lokalizací nádorového bujení u obou pohlaví. Česká republika zaujímá ve statistikách první místo při hodnocení výskytu tohoto onemocnění v zemích, kde jsou vedeny registry [2]. KRK zahrnují z topografického hlediska karcinom rekta a rektosigmoideálního přechodu a karcinomy tračníku. Adenokarcinomy vycházející z mucin produkujících žlázek sliznice tlustého střeva a konečníku tvoří 95 % kolorektálních karcinomů (Obr. 1).
Obr. 1. Nádorová buňka – adenokarcinom tlustého střeva 
Při stejném klinickém stadiu je lokalizace v rektu prognosticky horší než v tlustém střevě. Lokalizace v příčném a sestupném tračníku je prognosticky horší než ve vzestupném tračníku a rektosigmatu [3]. Zajímavé jsou rozdíly při srovnání profilů genové exprese adenokarcinomů lokalizovaných v konečníku a tlustém střevu [4]. Lokalizace primárního nádoru nemá na volbu systémové léčby metastazujícího onemocnění doposud žádný vliv.
Rozhodujícím faktorem pro léčebný výsledek je časný záchyt onemocnění. Základem léčby časných lokalizovaných stadií je chirurgický výkon a u karcinomů rekta je neopominutelnou modalitou též radioterapie. Pravděpodobnost 5letého přežití klesá se zvyšujícím se stadiem onemocnění pro zvyšující se riziko nádorové diseminace (I. klinické stadium 93 %, II. klinické stadium 82,5 %, III. klinické stadium 59,5 %, IV. klinické stadium 8,1 % [5].
Základy léčebné strategie KRK
Strategie léčby KRK se odvíjí od léčebného záměru. Kurabilní záměr (vyléčení) je cílem léčby časných stadií onemocnění bez prokázané metastatické diseminace (viz adjuvantní léčbu). U KRK je možné dosáhnout dlouhodobé kontroly choroby i u metastázujícího onemocnění při léčbě jaterních (plicních) metastáz jako jediného sídla metastatického procesu.
S potenciálně kurativním záměrem je přistupováno k léčbě s limitovaným metastatickým postižením, když metastatický proces je omezen na játra nebo plíce. Pro tyto nemocné by měla vždy být zvažována neoadjuvantní farmakoterapie (chemoterapie, cílená biologická léčba) následovaná kurativní resekcí. Následně po resekci je podávána adjuvantní léčba („pseudo-adjuvantní“) chemoterapie. U nemocných s rozsáhlejším víceorgánovým metastatickým postižením je cílem léčby zlepšení kvality života a prodloužení doby přežití při minimu nežádoucích účinků. Pro rozhodování o léčbě metastázujícího onemocnění je důležité zvážit předchozí adjuvantní chemoterapii včetně časového intervalu bez projevů nádorového onemocnění. Při znovuvzplanutí onemocnění déle než 12 měsíců od ukončení adjuvantní léčby je možné znovu použít kombinací použitou adjuvantně.
Při volbě terapeutického postupu je kritickým faktorem, který musí být vzat v úvahu, výkonnostní stav nemocného (performance status PS). Výběr léčby u nemocných v příznivém PS (PS 0 nebo PS 1) se liší od nemocných se sníženým stavem výkonnosti (PS 2 neb PS 3). Důležité je vyhodnocení jak výkonnostního stavu, tak komorbidit. Přidružená onemocnění jsou definována jako zdravotní problémy nesouvisející s nádorovým onemocněním, které ale mohou ovlivnit výkonnostní stav PS. U nemocných s PS > 2, se závažnými komorbiditami není možné podat agresivní léčbu a pro některé nemocné může být největším přínosem léčba podpůrná. Klinicky symptomatické onemocnění je známkou agresivního průběhu onemocnění. U nemocných s horším stavem výkonnosti (PS) z důvodu symptomatologie nádorového onemocnění by měla být jako první zvažována agresivnější kombinace chemoterapie s přidáním cílené biologické léčby. Cílem je rychlé zmenšení nádorové masy a symptomatická úleva. Definitivní výběr léčby musí vycházet z rozhodnutí interdisciplinárního týmu.
Adjuvantní terapie kolorektálního karcinomu
Hlavním cílem chirurgické intervence je dostatečná resekce primárního nádoru R0 (resekční okraje bez nádoru) a lokoregionálních uzlin. Minimální požadavek je 12 odstraněných a vyšetřených spádových lymfatických uzlin. Nedostatečný počet odebraných a vyšetřených uzlin může vést k nesprávnému rozhodnutí a negativně ovlivnit léčebný výsledek. Vyšetřování sentinelových uzlin v této lokalizaci je předmětem diskuzí přesahující rámec vlastního sdělení. Většina nemocných s karcinomem tračníku v klinickém stadiu I nebo II může být vyléčena samostatnou chirurgií. Prospěch z adjuvantní léčby II. klinického stadia má jen selektovaná skupina nemocných stadia II se zvýšeným rizikem metastatické diseminace [6]. Pro III. klinické stadium je standardem léčby chirurgický výkon následovaný adjuvantní chemoterapií. Adjuvantní chemoterapie je podávána s kurativním záměrem po dobu 6 měsíců. Největší riziko rekurence je v prvních dvou letech po chirurgickém výkonu a s dalším časem významně klesá [7]. Na základě prognostických faktorů lze odhadnout biologické chování onemocnění a rozhodnout, zdali je u nemocného možné vynechat adjuvantní léčbu. Podkladem pro výběr nejvhodnější léčby jsou prediktivní faktory. Mezi rizikové faktory, jejichž přítomnost u stadia II předpovídá potřebu adjuvantní chemoterapie, patří: pT4, nepříznivý G, vaskulární invaze, lymfangioinvaze, perineuralní invaze, obstrukce nebo perforace nádoru vyžadující akutní chirurgickou intervenci, vyšetření nedostatečného počtu regionálních lymfatických uzlin [12] a vysoká koncentrace CEA [8].
Adjuvantní chemoterapie i tak může být podávána nadbytečně nebo naopak u časných stadií zvýšeného rizika vynechání chemoterapie může snížit šance na dlouhodobý léčebný výsledek. Nejlepší cestou ke správnému výběru adjuvantní léčby je co nejširší využití klinických a molekulárních prediktorů. Identifikace molekulárních prediktorů zatím pokračuje rychleji než jejich uplatnění v klinické praxi. V budoucnosti nebude možné u časných stadií zahájit adjuvantní léčbu bez kompletní znalosti vyjmenovaných prediktivních biomarkerů. Novým, ověřeným a doporučeným biomarkerem (pozn.: bohužel u nás zatím není standardně využíván) je testování mikrosatelitové nestability (MSI) a ztráta heterosygozity na chromozomu 18 (LOH 18q) [6]. Nález MSI v nádorových buňkách je spojen s rezistencí k řadě cytostatik včetně 5-fluorouracilu (5-FU). Při analýze randomizovaných klinických studií s adjuvantní chemoterapií karcinomů tlustého střeva nebyl při MSI prokázán přínos adjuvantní chemoterapie na bázi 5-fluorouracilu [9]. V současnosti by adjuvantní chemoterapie na bázi fluoropyrimidinů měla být indikována pro klinické stadium II pouze pro pacienty vysokého rizika bez MSI. U karcinomů tračníku klinického stadia III adjuvantní chemoterapie signifikantně prodlužuje dobu bez projevů onemocnění a celkovou dobu přežití. Absolutní zlepšení doby přežití je cca 15 %. Základním adjuvantním režimem je kombinace na bázi oxaliplatiny (FOLFOX4 nebo XELOX). U nemocných, u kterých se nedá předpokládat dobrá tolerance režimu na bázi oxaliplatiny, lze použít monoterapii fluoropyrimidiny. Většinou se jedná o 5-FU/leukovorin podávaný infuzně v režimu podle de Gramonta [9]. Alternativou je perorální kapecitabin. Efekt irinotekanu v této indikaci nebyl prokázán. V klinických studiích nebyl prokázán přínos přidání bevacizumabu ani cetuximabu ke standardní adjuvantní léčbě [10].
Jaterní metastázy kolorektálního karcinomu
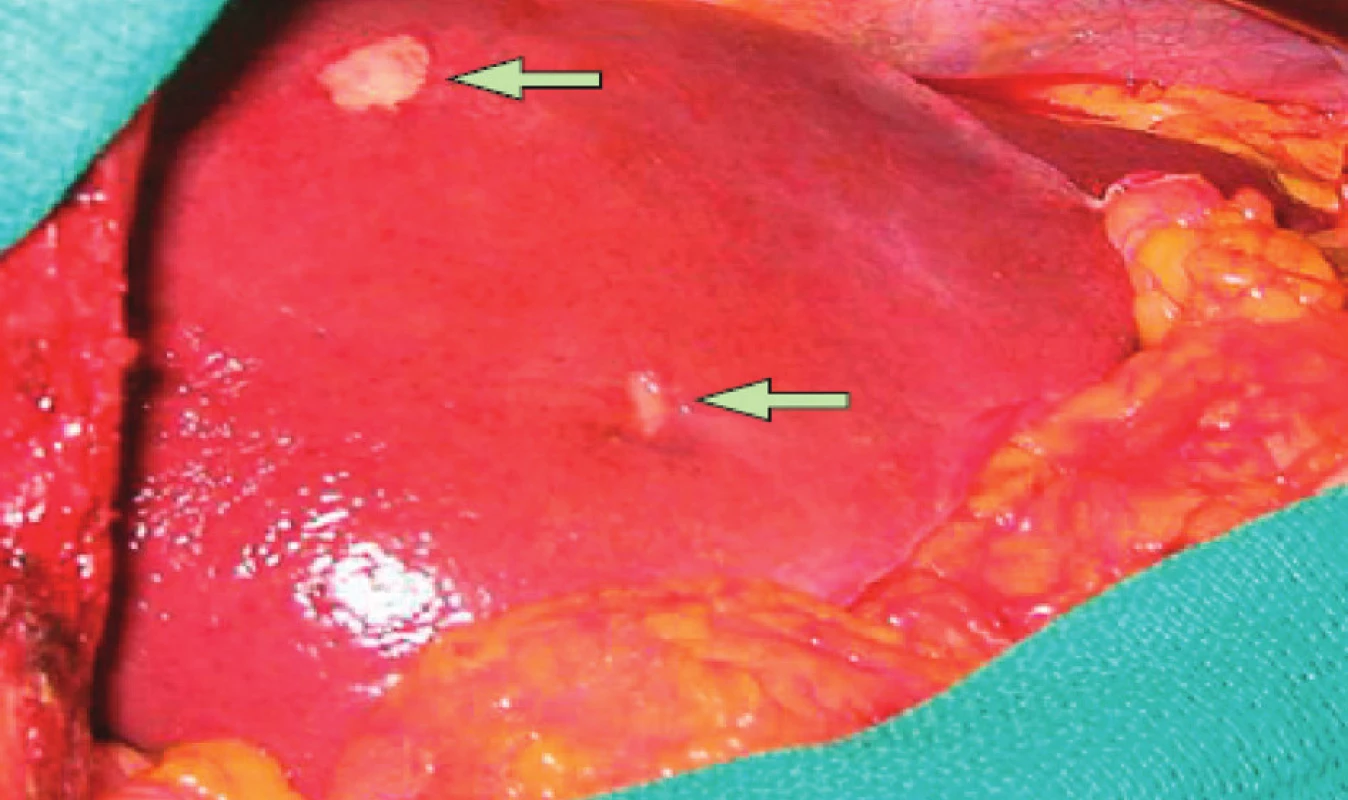
Nejčastějším sídlem metastatického procesu kolorektálního karcinomu (KRK) jsou játra (Obr. 2).
U 50–60 % nemocných s pokročilým KRK se vyvinou v průběhu choroby jaterní metastázy (metachronní metastázy) a v 15–25 % jsou metastázy prokázány již při iniciální diagnóze (synchronní metastázy) [6]. U 20–35 % nemocných je metastatický proces pouze v játrech [11]. U 20–25 % nemocných jsou jaterní metastázy chirurgicky resekabilní a u dalších 10–15 % se stanou resekabilními po chemoterapii (konverzní neoadjuvantní systémová léčba (Obr. 3).
Obr. 3. Algoritmus terapie jaterních metastáz KRK 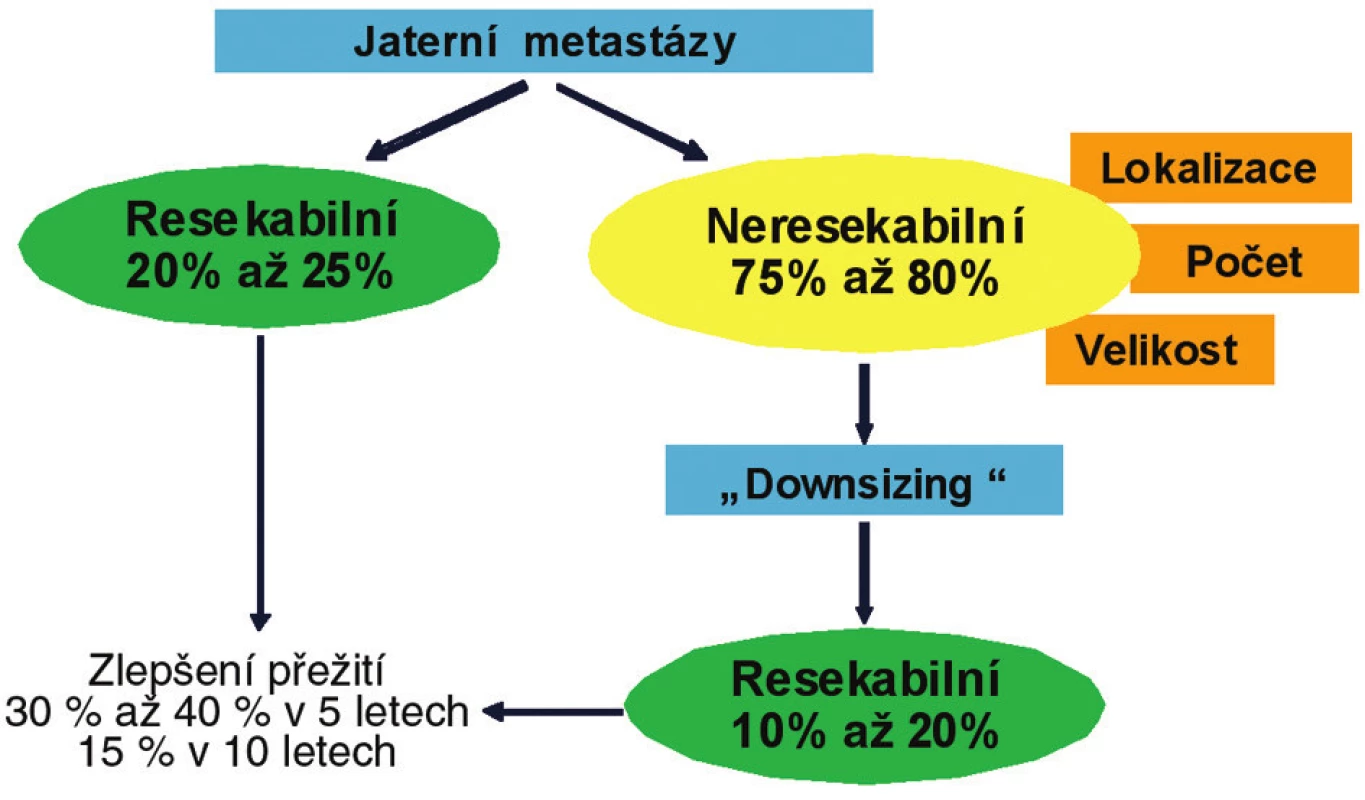
Při současném nárůstu počtu nemocných, u kterých je provedena resekce jaterních metastáz, se 5leté přežití pohybuje mezi 45–60 % [12]. Cílem chirurgické intervence je odstranění všech metastatických lézí s negativními okraji (R0 resekce). Definice chirurgické resekability se značně změnila v průběhu posledních dvou desetiletí. Chirurgická intervence se provádí na specializovaných pracovištích u nemocných, u kterých dříve vzhledem k rozsahu a velikosti nebyla indikována s dlouhodobými výsledky obdobnými jako při resekcích menšího rozsahu [13]. Po samostatném chirurgickém výkonu se do pěti let až u 55–65 % objeví recidiva onemocnění a je žádoucí doplnit chirurgický výkon léčbou farmakologickou. Zařazení systémové léčby prokazatelně přispívá ke snížení výskytu recidiv. V multicentrické analýze bylo prokázáno, že chemoterapie (před nebo pooperační) významně prodlužuje přežití bez recidivy onemocnění (relaps-free survival RFS) HR = 0,56 (CI 0,33–0,65) při mediánu doby do recidivy 16,3 měsíce a 5letém přežití 56,7 % [14].
Resekce jaterních metastáz je součástí standardní léčebné strategie. Při nevhodném postupu bez chirurgické intervence může nemocný přijít o šanci na vyléčení. Obdobně nezařazení farmakologické léčby může negativně ovlivnit léčebný výsledek [15].
Výběr a načasování optimální systémové léčby (chemoterapie a cílená biologická léčba) nebyl doposud určen. Vzhledem k rozmanitosti klinických situací a heterogenitě nádorů lze stanovit jen obecné principy. Je všeobecně přijatým konsenzem, že léčebný postup by měl stanovit multidisciplinární tým [4]. Léčebné postupy jsou stanoveny individuálně a je velmi složité pro tuto oblast léčby navrhnout a zorganizovat klinické randomizované studie fáze III. Léčená strategie proto většinou vychází z výsledků klinických studií fáze II a retrospektivních analýz.
Neoadjuvantní a adjuvantní léčba
Neoadjuvantní léčba je definovaná jako úvodní (primární, předoperační, indukční) systémová léčba zahájená po bioptické verifikaci před plánovanou léčbou lokoregionální. Adjuvantní farmakoterapie je systémová nebo regionální aplikace chemoterapie po provedené radikální chirurgické resekci. Kombinace farmakoterapie a chirurgické léčby v předem plánované časové sekvenci v léčbě jaterních metastáz KRK je v tabulce 1.
Tab. 1. Kombinace farmakoterapie a chirurgické léčby v předem plánované časové sekvenci v léčbě jaterních metastáz KRK 
Optimální režim neoadjuvantní ani adjuvantní farmakoterapie jaterních metastáz KRK není definován. Hlavním parametrem pro neoadjuvanci je vysoká účinnost a nízká toxicita. Optimální indukční režim by měl zajistit co nejvyšší počet objektivních léčebných odpovědí (RR) a co nejkratší dobu do dosažení léčebné odpovědi (TTR) při co nejnižším výskytu nežádoucích účinků.
Perioperační systémová léčba resekabilních metastáz
Novou perspektivní strategií je indukční (perioperační) systémová léčba u primárně resekabilních jaterních metastáz [16]. Zastánci předoperační strategie argumentují možností ověřit chemosenzitivitu „in vivo“, která slouží k výběru pooperační léčby. Časný zásah (likvidace) okultních metastáz mimo operovanou oblast může snížit riziko recidivy. V klinické studii (EORTC Intergroup trial 40983) byla v randomizované studii srovnávána indukční chemoterapie (FOLFOX 4) se samostatným chirurgickým výkonem. Bylo aplikováno 6 cyklů (12 týdnů) chemoterapie před a pooperačně. Celkem u 67 ze 182 nemocných byla po chemoterapii zaznamenána objektivní léčebná odpověď (čtyřikrát kompletní regrese). U 11 nemocných došlo v průběhu chemoterapie k progresi onemocnění. Celkem u 83 % byla provedena úspěšná resekce (ve skupině se samostatnou chirurgií v 84 %). Výskyt pooperačních komplikací byl vyšší ve skupině s chemoterapií (25 % vs. 16 %). Pooperační mortalita nebyla vyšší ve srovnání se samostatnou chirurgií (1 % vs. 2 %). Při mediánu doby sledování 3,9 roku byl zaznamenán trend ve srovnání 3letého období bez progrese ve prospěch kombinované léčby (35 % vs. 28 %, HR 0,79, p = 0,058). Rozhodnutí o indikaci perioperační systémové léčby u primárně resekabilních jaterních metastáz je stále kontroverzní. Klinické studie (pozn. mj. plánovaná multiinstitucionální česká studie) řeší přínos perioperační kombinace chemoterapie a cílené biologické léčby. Při rozhodování o vřazení chemoterapie je nutno vždy posoudit nárůst rizika nežádoucích účinků, což platí zejména pro primárně resekabilní metastázy KRK. Řada léků je metabolizována játry. Stav jaterních funkcí je významným faktorem v rozhodování o výběru léčby. Jaterní dysfunkce může být způsobena metastatickým onemocněním postihujícím játra nebo též preexistujícími jaterními onemocněními, jako jsou virová hepatitida, léky indukovaná hepatitida nebo cirhóza. Jaterní dysfunkce může významně ovlivnit farmakologii a farmakokinetiku léků metabolizovaných játry. Příkladem je inhibitor topoizomerázy I, irinotekan, který je třeba používat s opatrností při zvýšení hodnoty bilirubinu. V eliminaci řady cytostatik včetně oxaliplatiny a kapecitabinu hrají klíčovou roli ledviny. Ukazuje se, že oxaliplatinu je možné podávat bezpečně do hodnot clearence kreatininu 20 ml/min. Nižší hodnoty jsou kontraindikací podání oxaliplatiny. U nemocných se sníženými hodnotami se může objevit nárůst nežádoucích účinků též u kapecitabinu. Při hodnotách clearence kreatininu mezi 30 a 50 ml/za minutu je vhodná redukce dávky kapecitabinu o 25 %; kapecitabin je kontraindikován při hodnotě méně než 30 ml/min. Riziko nežádoucích účinků perioperační léčby je proto nutno pečlivě zvažovat zejména u nemocných s přidruženým onemocněním (diabetes, metabolický syndrom…). Nemocní se steatohepatitidou, cirhózou nebo jaterní steatózou mají zvýšené riziko projevů hepatotoxicity chemoterapie (viz dále) a měli by být indikováni přednostně primárně k chirurgické resekci.
Konverzní terapie iniciálně neresekabilních jaterních metastáz
Nemocní s primárně neresekabilním onemocněním mohou být kategorizováni jako konvertibilní nebo nekonvertibilní. U potenciálně nekonvertibilních nemocných je léčba paliativní s cílem prodloužení doby do progrese onemocnění za přijatelné kvality života. U potenciálně konvertibilního onemocnění je cílem dosáhnout „kurability“. Termín „konverzní terapie“ znamená použití indukční terapie u nemocných s iniciálně neresekabilním postižením jater s cílem umožnění resekability. Možnost konverze iniciálně neresekabilního onemocnění byla poprvé studována Bismuthem a kol. [17] Až u 12–33 % nemocných s iniciálně neresekabilním metastatickým procesem je možné následně provést kompletní resekci [15]. Jak již bylo uvedeno, cílem konverzní neoadjuvantní chemoterapie je umožnit resekabilitu. Na základě analýz klinických studií kombinujících chemoterapii s cílenou biologickou léčbou se ukazuje tento postup jako účinnější.
Klíčovou otázkou léčby jaterních metastáz KRC není definice resekability, ale správné načasování chirurgického výkonu jak u iniciálně operabilních, tak iniciálně inoperabilních stavů. Cílem indukční léčby u nemocných s potenciálně resekabilním metastatickým jaterním postižením je dosáhnout co nejdříve resekability (konverze). Není nutné vyčkávat na nejlepší objektivní léčebnou odpověď a chirurgický výkon by měl být indikován ihned, jakmile je stav posouzen jako chirurgicky řešitelný. Kompletní regrese činí chirurgický výkon z topografického hlediska složitějším a hlavně prodloužení doby podávání chemoterapie může vést k toxickému poškození jaterního parenchymu. Pouze pravidelné a časné hodnocení zobrazovacích nálezů v odborném týmu umožní včasnou a správnou indikaci resekčního výkonu. U každého nemocného by měla být pravidelně vyhodnocována možnost resekability v rámci interdisciplinárního týmu v relativně krátkých časových intervalech (cca 2 měsíce). Prodloužení doby podávání indukční chemoterapie zvyšuje riziko toxického poškození jaterního parenchymu. Typ chemoterapie/biochemoterapie má větší vliv na dosažení objektivní léčebné odpovědi než celková doba podávání. Porovnání konverzní a perioperační léčby je v tabulce 2.
Tab. 2. Porovnání konverzní a perioperační léčby 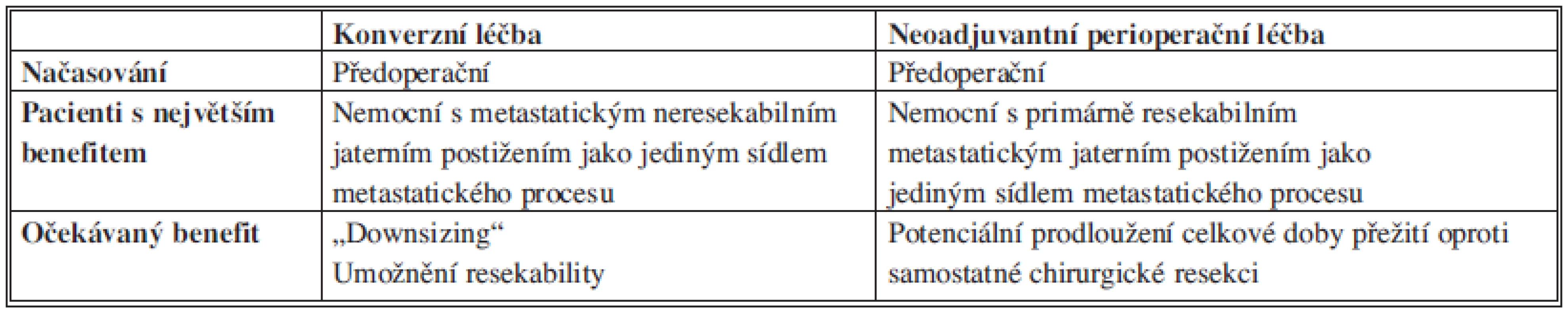
Postresekční chemoterapie?
Pojem adjuvantní léčby se používá v onkologické literatuře pro léčbu následnou po resekci primárního tumoru. V onkologické literatuře je některými autory používán i v případech radikální resekce metastáz [18].
Adjuvantní postresekční léčba je součástí doporučení posledního konsenzu odborné skupiny (European Colorectal Metastases Treatment Group) [19]. Po resekci jaterních metastáz je v současnosti doporučováno maximálně šest měsíců adjuvantní chemoterapie. Optimální režim nebyl doposud určen. V klinické praxi je u nemocných po radikální resekci jaterních metastáz používána systémová chemoterapie zejména u nemocných bez neoadjuvantní léčby. K dispozici jsou výsledky menších klinických studií fáze II. Podkladem jsou proto také výsledky adjuvantních studií časných stadií onemocnění, kde byla doložena účinnost kombinace FOLFOX a není zatím doklad účinnosti irinotekanu ani cílených biologických léků (cetuximab, bevacizumab). Otázkou je adjuvantní použití stejného režimu včetně cílené biologické léčby, u kterého byla doložena účinnost v indukčním načasování.
Nežádoucí účinky perioperační (neoadjuvantní) systémové léčby
Nežádoucí projevy hepatotoxicity (steatóza, nealkoholická steatohepatitida, vaskulární poškození, modulární regenerativní hyperplazie) při předoperační léčbě jsou jednou z limitací předoperační systémové léčby (Obr. 4, 5).
Obr. 4. Projev hepatotoxicity neoadjuvantní chemoterapie – steatohepatitida 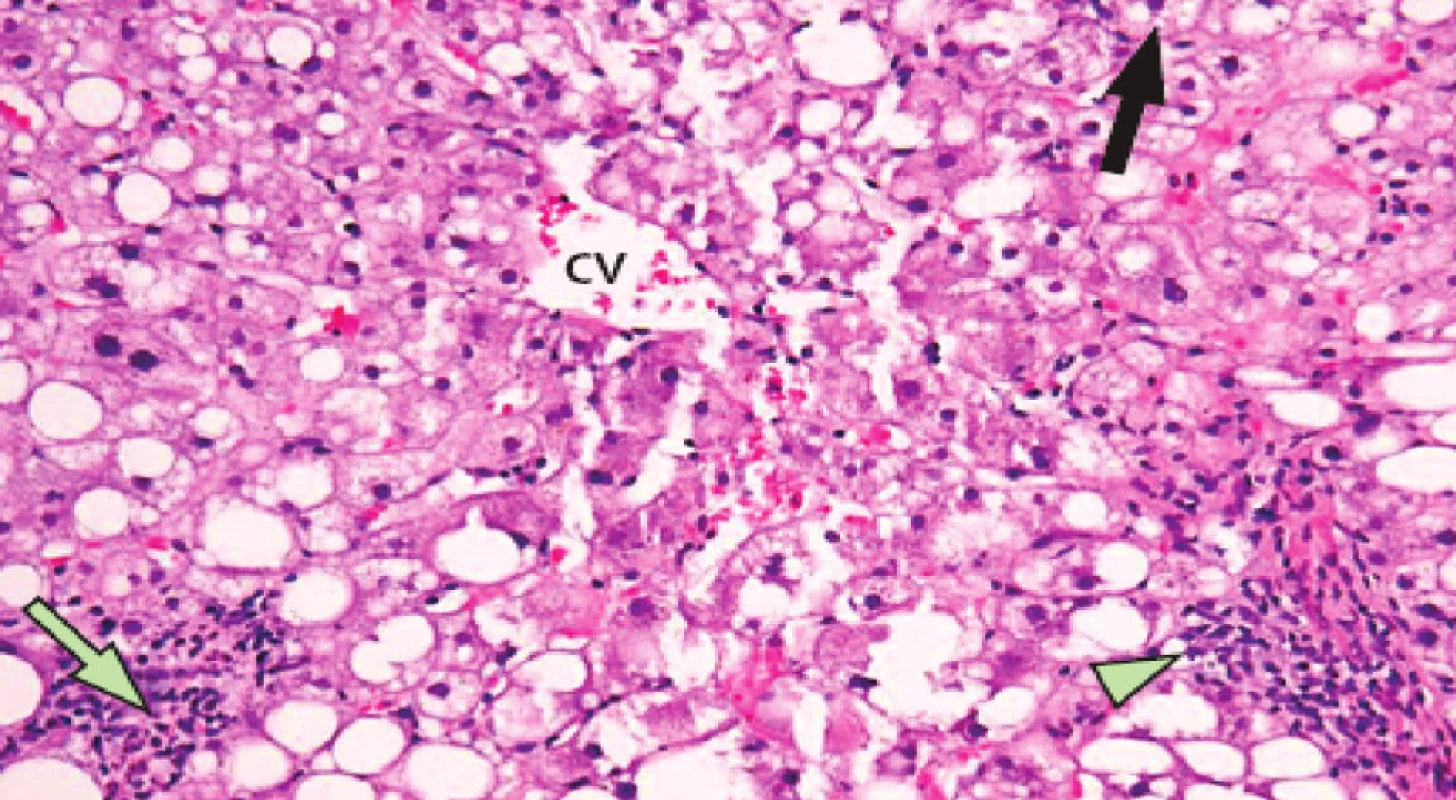
Obr. 5. Projev hepatotoxicity neoadjuvantní chemoterapie – sinusoidální poškození 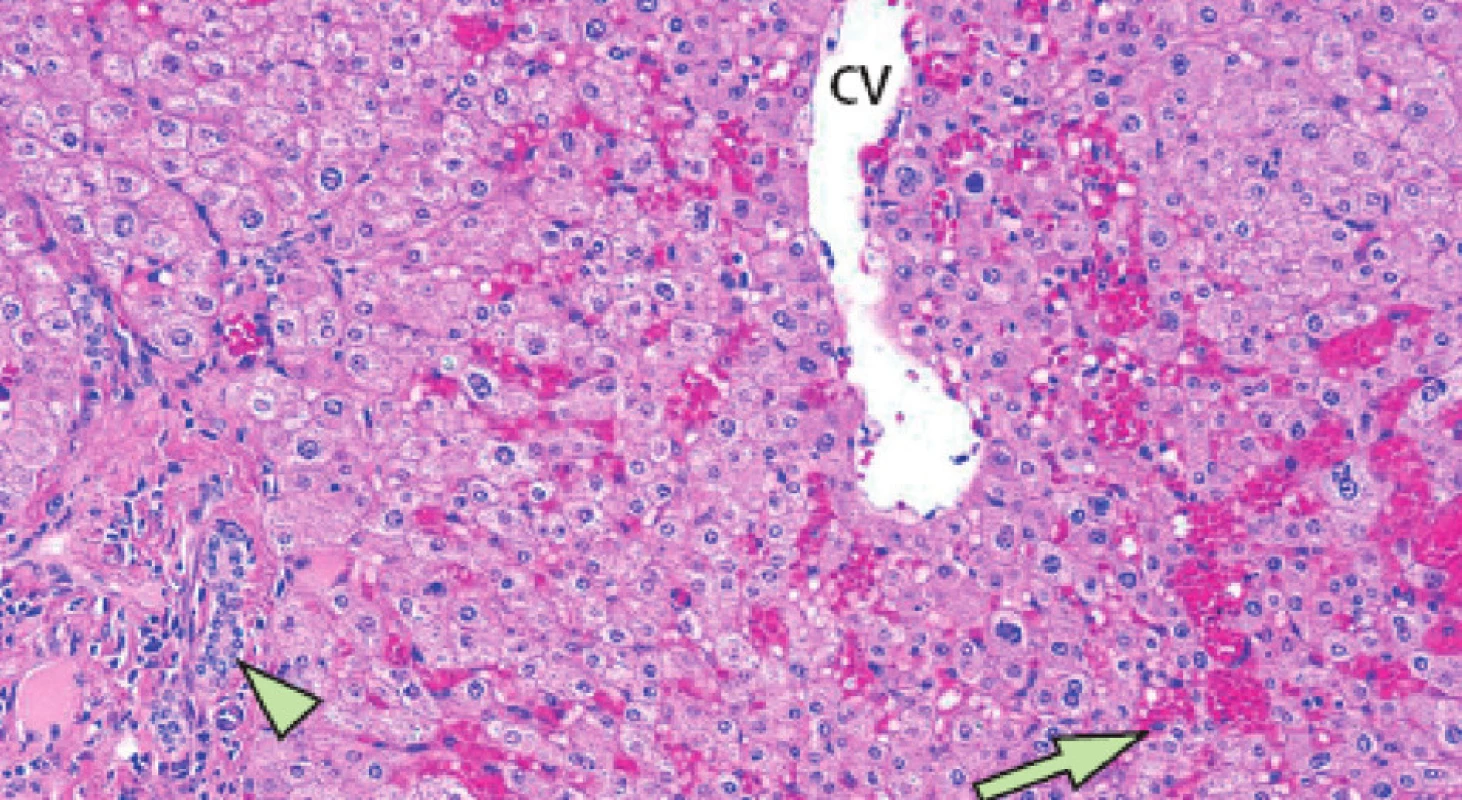
Režimy s oxaliplatinou jsou spojeny s vyšší četností veno-okluzivního onemocnění. Projevují se především hemorhagickými nekrózami a vznikem degenerativní modulární hyperplazie. Makroskopicky se tyto změny označují jako tzv. „blue liver“. Tyto změny zásadně neovlivňují mortalitu, ale mohou vést k většímu pooperačnímu krvácení a nutnosti podávání krevních derivátů. Režimy s irinotekanem jsou spojeny s vyšší četností výskytu steatózy a steatohepatitidy, která by mohla mít vliv na pooperační mortalitu nemocných [18]. Ukazuje se, že přidání cíleně působících biologických léků (bevacizumab, cetuximab) významně neovlivní profil nežádoucích účinků předoperační léčby. Monoklonální protilátka bevacizumab ovlivňující angiogenezi má specifické projevy toxicity, jako jsou krvácení, narušení procesu hojení a možné narušení regeneračních procesů jater. Při analýze proveditelnosti a bezpečnosti resekčních výkonů nebylo doloženo riziko krvácení nebo poruch hojení při aplikaci bevacizumabu před resekcí. Zda bevacizumab narušuje jaterní regeneraci po embolizaci portální žíly, není jednoznačně doloženo. Vzhledem k delšímu plazmatickému poločasu bevacizumabu (20 hodin) je doporučován 6–8týdenní interval mezi ukončením bevacizumabu a chirurgickou intervencí. Některé výsledky ukazují na možnost zkrácení intervalu na pět týdnů bez nárůstu rizika komplikací. V některých sděleních se uvažuje o možnosti snížení incidence a intenzity s oxaliplatinou spojeného jaterního poškození. Nutná je validace v prospektivních studiích. Režim chemoterapie má větší vliv na dosažení objektivní léčebné odpovědi než celková doba podávání. Na konferenci ASCO – GIT v lednu 2009 prezentovala výzkumná skupina z MD Anderson Cancer Center v Houstonu vyšší počet kompletních léčebných odpovědí při předoperační biochemoterapii kombinací FOLFOX plus bevacizumab (5-fluorouracil a oxaliplatina) ve srovnání se samostatnou chemoterapií FOLFOX. Ve skupině nemocných, kteří dostali 9 a více cyklů chemoterapie, byl výskyt sinusoidalního poškození (steatohepatitida) vyšší než u skupiny léčené menším počtem cyklů chemoterapie (26 % vs. 42 %), obdobný byl i výskyt jaterní insuficience (4 % vs. 11 %). Prodloužená doba chemoterapie je tak na základě multivariační analýzy nezávislým prediktorem rizika pooperační jaterní insuficience [20](Obr. 6).
Obr. 6. Vliv počtu cyklů na pooperační morbiditu 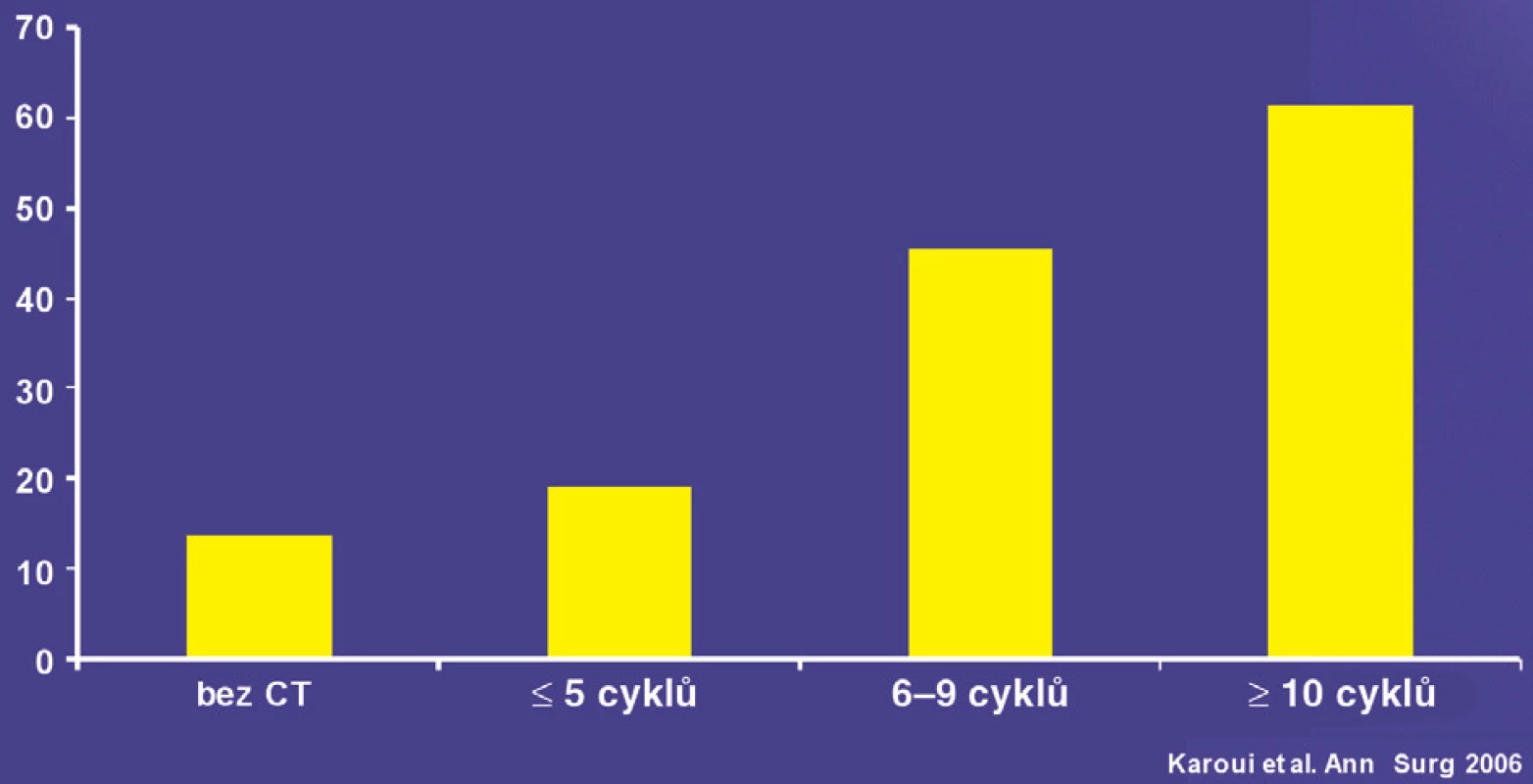
Závěr
Rozhodujícím faktorem pro léčebný výsledek je časný záchyt onemocnění. Nárůst záchytů časných stadií se dá očekávat při dalším rozvoji skríninkových programů v této oblasti, kterým je v poslední době věnována mimořádná pozornost. Jedině tak může být naplněna vize onkologické léčby budoucnosti – plná vyléčitelnost časných stadií onemocnění. Režimy a trvání adjuvantní léčby jsou v současnosti definovány na základě výsledků randomizovaných studií fáze III. Nejlepší cestou ke správnému výběru adjuvantní léčby je co nejširší využití laboratorních prediktorů. Identifikace molekulárních prediktorů pokračuje rychleji než jejich uplatnění v klinické praxi. Není vyloučené, že v budoucnosti pro rozdílná stadia časného onemocnění (stadium II a III) budou využitelné rozdílné skupiny prediktivních biomarkerů [21].
Výběr a načasování optimálního režimu neoadjuvantní léčby mají stále řadu neznámých a je zde poměrně široká paleta víceméně rovnocenných možností:
Konvenční kombinovaná chemoterapie :
dublety i.v. (FOLFOX, FOLFIRI)
Konvenční kombinovaná chemoterapie :
triplety i.v. (FOLFOXIRI)
Kombinovaná biochemoterapie:
FOLFOX + bevacizumab
FOLFOX + cetuximab (pozn. pouze u nemutovaného KRAS onkogenu)
FOLFOX + panitumumab (pozn. pouze u nemutovaného KRAS onkogenu, zatím není v této indikaci registrován)
FOLFIRI + bevacizumab
FOLFIRI + cetuximab (pozn. pouze u nemutovaného KRAS onkogenu)
FOLFIRI + panitumumab (pozn. pouze u nemutovaného KRAS onkogenu, zatím není v této indikaci registrován)
selektivní intrahepatální chemoterapie (doporučena přednostně v klinických studiích na specializovaných pracovištích
Výběr léčebného postupu podléhá rozhodnutí mezioborové týmové skupiny (molekulární patolog, gastroenterolog, radiolog, chirurg, onkolog, event. další). Bez této spolupráce nelze stanovit strategii léčby, která bude pro jednotlivého pacienta optimální.
Výsledky onkologické péče v České republice jsou na evropské úrovni. V mezioborové spolupráci je onkologie ve vyspělých zemích stále o krok dál.
Použité zkratky
FOLFOX : 5-fluorouracil, leukovorin, oxaliplatina
FOLFIRI: 5-fluorouracil, leukovorin, irinotekan
FOLFOXIRI: 5-fluorouracil, leukovorin, oxaliplatina, irinotekan
Prof. MUDr. Luboš Petruželka, CSc.
Onkologická klinika 1. LF UK a ÚVN-VFN
a Ústav radiační onkologie NNB
U nemocnice 2
120 00 Praha 2
e-mail: lubos.petruzelka@seznam.cz
Zdroje
1. Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics.CA Cancer J Clin 2009,55 : 74–108.
2. www.svod.cz
3. Petruželka L. Kolorektální karcinom. In: Marek J.: Farmakoterapie vnitřních chorob. V. vydání, 2010.
4. Educational book ASCO 2011.
5. O’Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst 2004;96 : 1420–1425.
6. Petruželka L. Jak dál v léčbě kolorektálního karcinomu. Postgraduální medicina 2009.
7. Sargent D, Sobrero A, Grothey A, et al. Evidence for cure by adjuvant therapy in colon cancer: observations based on individual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol 2009;27 : 872–877.
8. Kubala E, Petruželka L, Sedláčková E. Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak? Rozhledy v chirurgii 2009.
9. Winer E, Gralow J, Diller L, et al. Clinical Cancer Advances 2008: Major Research Advances in Cancer Treatment, Prevention, and Screening. A Report From the American Society of Clinical Oncology. J Clin Oncol 2009;27 : 812–826.
10. Wolmark N, Yothers G, O’Connell MJ, et al. A phase III trial comparing mFOLFOX6 to mFOLFOX6 plus bevacizumab in stage II or III carcinoma of the colon: results of NSABP protocol C-08. Program and abstracts of Annual Meeting of the American Society of Clinical Oncology 2009; abstr. LBA4.
11. Ohlsson B, et al. Acta Oncologica 2003;42 : 816–826.
12. Hubbard JM, Alberts SROV. Treatment of liver-limited metastatic colorectal cancer. In: Cancer. Annual Advances in Oncology. Vol 2 eds. DeVita VT Jr., Lawrence TS, Rosenberg SA, Wolters Kluwer 2011.
13. Minigawa M, Makuuchi M, et al. Extension of the frontiers of surgical indications in the treatment of liver metastases from colorectal cancer: long term results. Ann Surg 2000;231 : 487–499.
14. De Jong MC, Pulitano C, et al. Rates and patterns of reccurence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1699 patients. Ann Surg 2009;250 : 440–448.
15. Petruželka L. Indikace indukční systémové léčby jaterních metastáz. Postgraduální medicína 2010;12(3).
16. Van Cutsem E, Nowacki M, Lang I, et al. Randomized phase III study of irinotecan and 5-FU/FA with or without cetuximab in the first-line treatment of patients with metastatic colorectal cancer (mCRC): the CRYSTAL trial. Program and abstracts of the American Society of Clinical Oncology Annual Meeting 2007; abstr. 4000.
17. Bismuth H, Adam R, Levi F, et al. Resection of nonresectable liver metastases from colorectal cancer after neoadjuvant chemotherapy. Ann Surg 1996;224 : 509–520.
18. DeVita VT Jr., Lawrence TS, Rosenberg SA. Cancer. Annual advanced in Oncology, 2011, Wolters Kluwer.
19. Nordlinger B, et al. Combination of surgery nad chemotherapy and the role of targeted agents in the treatment of patients with colorectal liver metastase: recommendation from an exper panel. Ann Oncol 2009;20 : 985–992.
20. Zorzi D, Kishi Y, Maru DM, et al. Effect of extended preoperative chemotherapy on pathologic response and postoperative liver insufficiency after hepatic resection for colorectal liver metastase.
21. Roth A, Tejpar S, Yan P, et al. Correlation of molecular markers in colon cancer with stage-specific prognosis: Results of the translational study on the PETACC 3 - EORTC 40993-SAKK 60-00 trial. 2009 Gastrointestinal Cancers Symposium, abst. 288.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Kolorektální karcinomČlánek Bodná poranění u dětí
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Močový katetr jako rizikový faktor vzniku urologických komplikací po TEP kolenního kloubu – retrospektivní analýza
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Proč je dobré zachránit Rozhledy v chirurgii
- Bodná poranění u dětí
- 15th Annual meeting European society of Surgery
- Kolorektální karcinom v ČR – data minulá a budoucí
- Kolorektální karcinom
- Chirurgická léčba kolorektálního karcinomu
- Pohled na současnou bariatricko-metabolickou chirurgii
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Chirurgická léčba kolorektálního karcinomu
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání