-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný význam biologických a nebiologických eliminačních metod v léčbě akutního selhání jater
Current Benefit of Biological and Non-biological Methods in the Treatment of Acute Liver Failure
Background:
There was an active interest in development of liver assist device in the last two decades. Using these devices to bridge patients with acute hepatic failure (AHF) to ortotopic liver transplantation (OLTx) or to liver regeneration might decrease the mortality rate. Several liver support systems have been described in different stages of experimental or clinical examination.Methods:
PubMed (1986–2008) was searched using the keywords „artifitial livers“, „liver support“, „bioartifitial liver“ and „cell transplantation“. The own experience presenting by authors are the conclusions of their publications.Results and discussion:
Biological liver support (BAL) uses hepatocytes can support theoretically both detoxification and biosynthesis. Experimental study confirmed significant decrease in some of AHF metabolites. Nevertheless, randomized study didn’t show any improvement in patient’s survival. Source of viable hepatocytes and sufficient bioreactor capacity are some of unsolved problems. Nonbiological liver support as a plasma exchange, hemodialysis, hemofiltration, albumin dialysis or adsorbent recycling systems eliminate some of toxins, but other specific liver functions can’t replace. MARS® and Prometheus® devices have been used successfully in treatment of AHF by human. However, the absence of randomized study still lasts. These devices remove some of toxins and cytokines unselectively and are also limited by adsorber capacity. Selective plasma filtration therapy and hybrid liver support systems which combine both of management advances present the possible solution. Authors themselves confirmed by application of both methods a significant decrease of bilirubin level. Intracranial pressure declines only by use of non-biological device – Prometheus®.Conclusion:
Effective liver assist device that gains a survival approval hasn’t been developed till now. In confrontation with other current used cure possibilities, BAL didn’t propose the original expectations. On the other hand, the non-biological devices seem to be perspective and their contribution has been proved by prospective studies. The randomized study is still absent. Authors’ experiences confirm this trend.Key words:
acute hepatic failure – artifitial liver – non-biological liver support – liver support
Autoři: O. Ryska 1; T. Pantoflíček 2; E. Lásziková 3; J. Pražák 4; M. Ryska 2
Působiště autorů: Chirurgická klinika 1. LF UK a IPVZ, FN Bulovka, Praha, přednosta: prof. MUDr. F. Antoš, CSc. 1; Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc. 2; Oddělení anesteziologie a resuscitace ÚVN Praha, primář: MUDr. B. Jurenka 3; Klinika anesteziologie, resuscitace a intenzivní péče 2. LF UK, přednosta: prof. MUDr. K. Cvachovec, CSc. Centrum buněčné terapie a tkáňových náhrad, 2. LF UK, hlavní řešitel: prof. MUDr. E. Syková, DrSc. 4
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 6, s. 291-296.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
V posledních dvou desetiletí lze pozorovat velké úsilí ve vývoji eliminačních metod použitelných v léčbě akutního selhání jater (ASJ), které by umožnily zlepšit přežití pacienta pod dobu regenerace jaterního parenchymu nebo do doby nálezu vhodného dárce jater k transplantaci. Existuje celá řada eliminačních metod, jejichž využití je v různých stadiích experimentálního či klinického testování.Metodika:
K literární rešerši bylo použito vyhledávače PubMed. Vyhledávané termíny byly omezeny na biologické a nebiologické eliminační metody. Z vlastních experimentálních zkušeností autorů byly použity závěry publikací.Výsledky a diskuse:
Biologické eliminační metody, založené na využití hepatocytů, mohou teoreticky zajistit jak detoxikaci, tak i syntetické funkce jater. Experimentální studie na zvířatech prokázaly snížení některých markerů ASJ. Provedená randomizovaná studie však neprokázala prodloužení života nemocných. Nedořešeným problémem u bioelimiace je zdroj funkčních hepatocytů a dostatečná kapacita bioreaktoru. Nebiologické metody, jako je výměna plazmy, hemodialýza, hemofiltrace, albuminová dialýza nebo systémy založené na adsorpci, odstraní sice některé toxiny, avšak ostatní specifické jaterní funkce suplementovat nedokáží. Systémy MARS® a Prometheus® byly s úspěchem použity v léčbě ASJ u člověka. Randomizovaná studie zatím provedena nebyla. Nebiologické metody mnohdy neselektivně odstraňují některé toxiny či cytokiny a jsou limitovány kapacitou adsorbérů. Východiskem mohou být systémy založené na selektivní plazmatické filtraci či hybridní systémy, které spojují funkce obou metod.
Autoři v experimentu na praseti prokázali signifikantní snížení hladiny bilirubinu u obou metod, signifikantní snížení intrakraniálního tlaku pouze u metody nebiologické s použitím přístroje Prometheus®.Závěr:
Efektivní eliminační metodu zlepšující přežití pacientů s ASJ se doposud nepodařilo vyvinout. Při srovnání současných možností podpory funkcí selhávajících jater lze konstatovat, že očekávané výsledky biologické eliminační metody do klinické praxe zatím nepřinesly. Užití nebiologických metod se v současné době jeví jako perspektivní a jejich přínos se prokazuje na prospektivních studiích. K jejich zhodnocení je však třeba provést randomizované studie. Vlastní experimentální zkušenosti autorů tento trend potvrzují.Klíčová slova:
akutní selhání jater – bioartificial liver – nebiologické eliminace – Prometheus®ÚVOD
Akutní selhání jater (ASJ) představuje velmi závažné onemocnění s vysokou mortalitou. Je ve většině případů charakterizováno rychlým výpadkem jaterních funkcí s rozvojem koagulopatie a encefalopatie s hrozícím ireverzibilním poškozením mozku [1]. Onemocnění může progredovat do multiorgánového selhání nebo nezvládnutelné infekce. Při konzervativní terapii dosahuje přežití vzhledem k výskytu fatálních infekčních komplikací pouhých 10–40 % [2]. Jedinou současnou metodou, která zlepšuje přežití, je ortotopická transplantace jater (TJ). Akutní provedení TJ však naráží na nedostatek kadaverózních jaterních štěpů. V době, po kterou pacient čeká na vhodného dárce jaterního štěpu či po kterou může dojít ke spontánní regeneraci jaterního parenchymu, je pacient akutně ohrožen na životě. Současné možnosti, jak pacienta přes toto období převést (tzv. „bridging“), jsou limitovány. V posledních letech proto dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivnější bridging, a tím zlepšily šanci nemocného s ASJ přežít.
I. BIOLOGICKÉ ELIMINAČNÍ METODY
Myšlenka „umělých jater“ (BAL – bioartifitial liver) vznikla zhruba před 50 lety, kdy Sorrentino prokázal, že čerstvá jaterní tkáň syntetizuje ureu z chloridu amonného a metabolizuje ketony [3]. Trvalo ovšem dalších 20 let, než dostala bioartificiální játra podobu zařízení s extrakorporálním oběhem, do kterého byla zapojena kapsle s živými izolovanými nádorovými buňkami hepatomu. V následujících 30 letech se zabývala touto problematikou celá řada center a byly vyvinuty různé způsoby bioeliminace od prosté extrakorporální perfuze jater [4] přes transplantaci jaterních buněk [5] až k propracovaným BAL.
Transplantace hepatocytů
Metoda transplantace hepatocytů se začala experimentálně používat v polovině sedmdesátých let a byla vyzkoušena i v klinickém experimentu. Existuje celá řada způsobů, jak hepatocyty do organismu vpravit. Provádí se tzv. hepatizace sleziny, buňky je možné aplikovat do poškozených jater nebo je zabalené v polymeru vložit přímo do peritoneální dutiny [6, 7]. Mohou být použity buňky čerstvé, po rozmražení či enkapsulované. Výsledky těchto postupů však nejsou příliš přesvědčivé a přínosné byly jen u některých vrozených metabolických poruch [5].
BAL
Principem je mimotělní krevní oběh, ze kterého je separována plazma a ta je perfundována přes jaterními buňkami osazená dutá vlákna uložená v bioreaktoru. V soustavě je zapojen většinou oxygenátor, případně aktivní uhlí či pryskyřice, která pomáhá v procesu detoxifikace. Samotné jaterní buňky kromě detoxikace (nahrazují selhávající cytochrom P450) plní ještě funkci syntetickou (proteosyntéza, glukoneogeneze, ureogeneze) (Obr. 1).
Obr. 1. Schéma zapojení systému BAL. Fig. 1. The BAL system integration scheme. 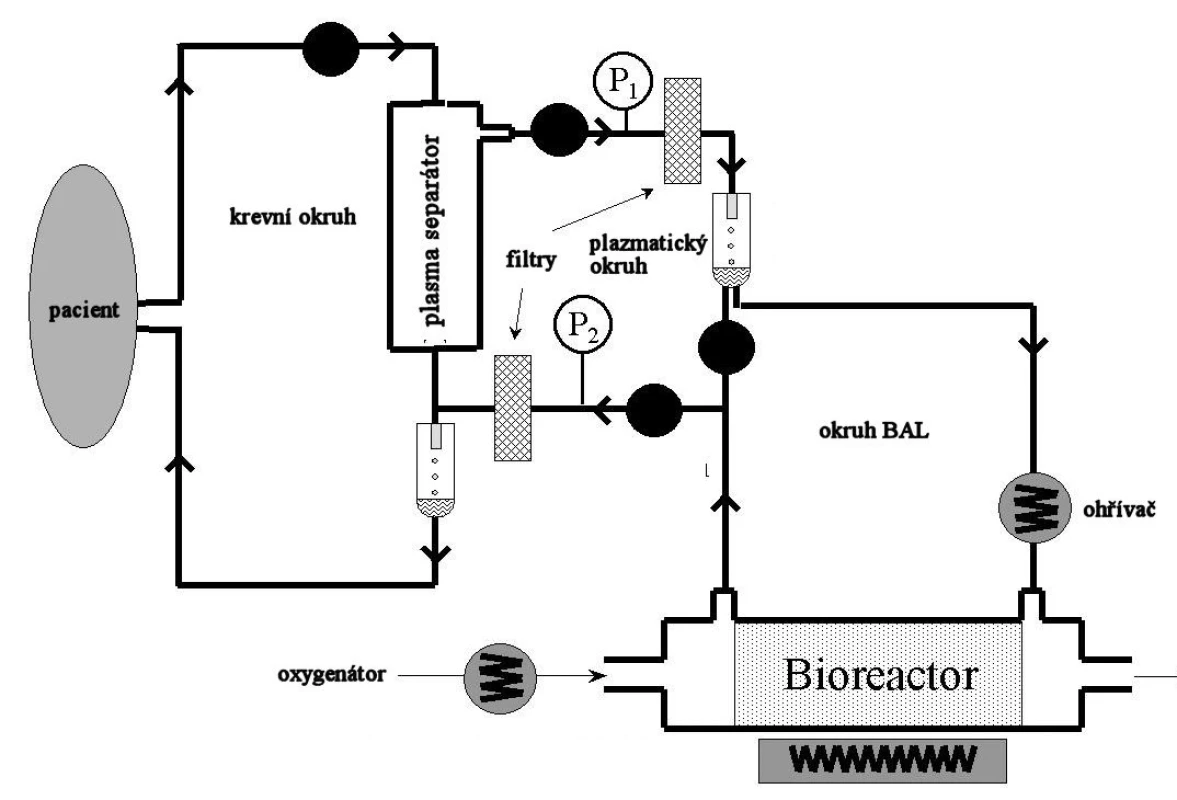
V dnešní době jsou nejpoužívanější systémy ELAD (Extracorporeal liver assist device), HepatAssist® a MELS (medular extracorporeal liver system) [8, 9, 10]. Tyto systémy se osvědčily jak v experimentu na zvířatech, tak i ojediněle v experimentu klinickém (Obr. 2, 3).
Obr. 2. Schéma zapojení systému ELAD (převzato z www.vitaltherapies.com). Fig. 2. The ELAD system integration scheme (adopted from www.vitaltherapies.com). 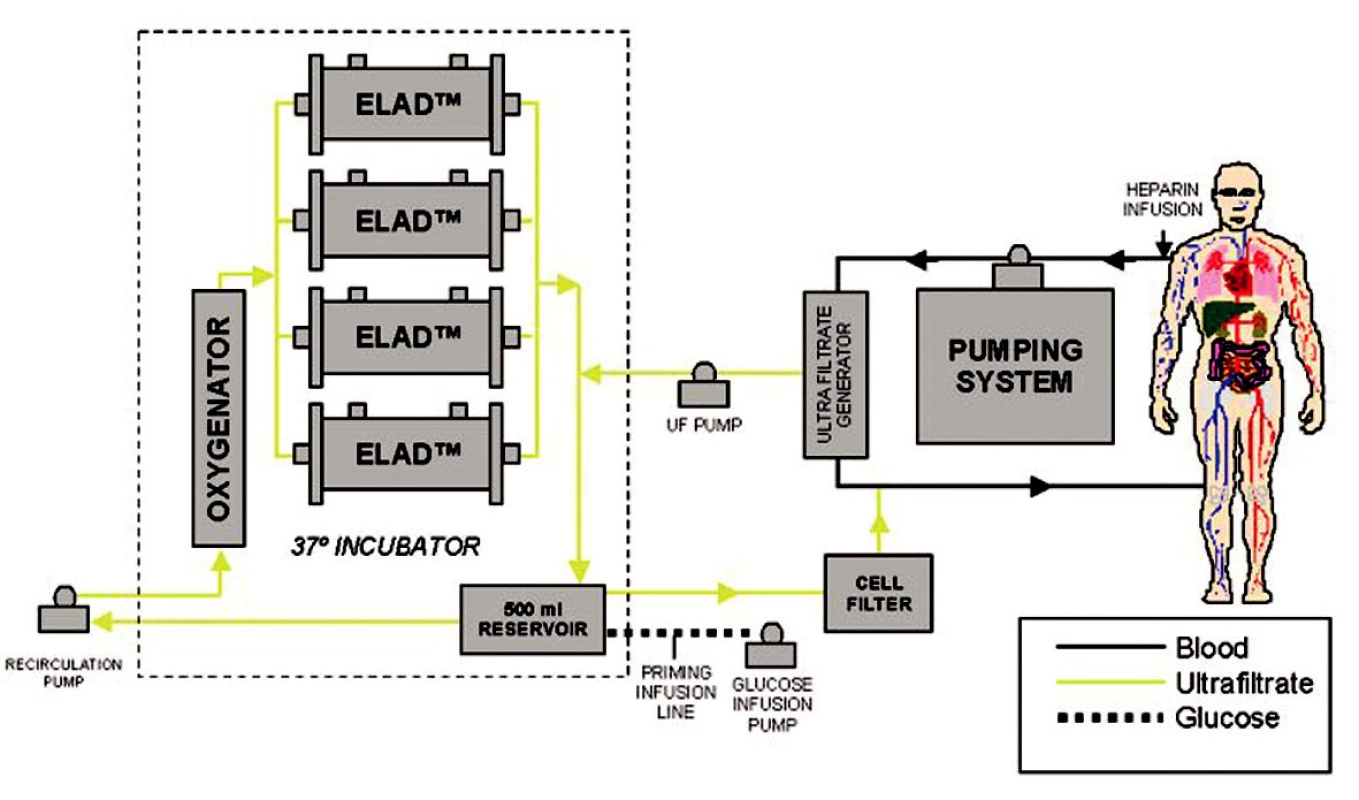
Obr. 3. Schéma zapojení systému HepatAssist® (převzato z informačního letáku). Fig. 3. The HepatAssist® system integration scheme (adopted from its information leaflet). 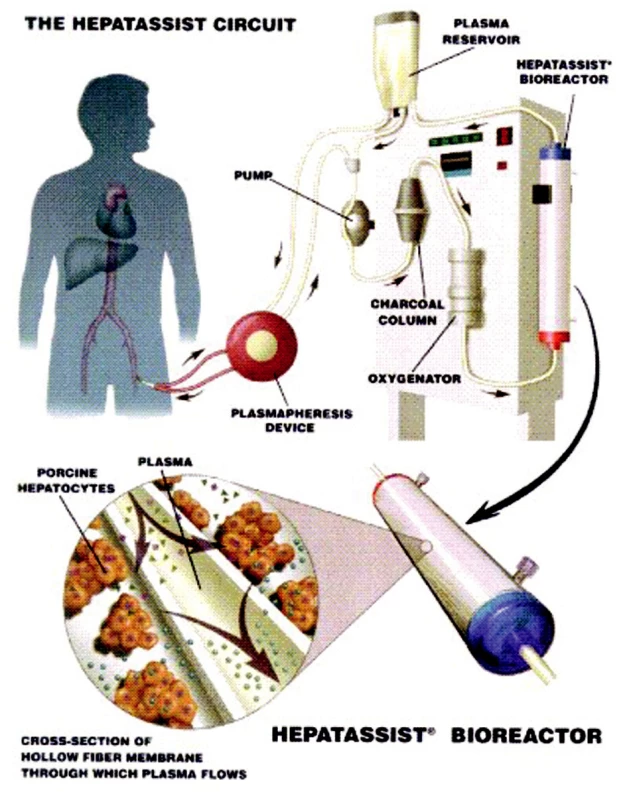
Experimentálně byl prokázán jejich vliv na snížení intrakraniálního tlaku (ICP), sérových hladin bilirubinu, amoniaku a transamináz. Největší klinická multicentrická studie byla provedena systémem HepatAssist® na skupině 171 pacienta s ASJ (85 léčených a 86 v kontrolní skupině bez léčby) při použití porcinních hepatocytů. Výsledek však nesplnil očekávání: snížení mortality před TJ u pacientů s otravou hepatotoxickým jedem a u pacientů s fulminantním průběhem ASJ nebylo signifikantní. Nebylo prokázáno ani signifikantní zlepšení 30denního přežití u těchto nemocných [11].
Navíc se ukázaly problémy s klinickým využitím BAL. I když nebylo prokázáno nebezpečí přenosu prasečích retrovirů (PERV – porcine endogenous retrovirus), obavy spojené s použitím porcinních hepatocytů mnohdy přetrvávají [12]. Obtížně řešitelná je také dostupnost požadovaného množství hepatocytů. Kryoprezervace hepatocytů, která by umožnila jejich rychlé použití, vede k výraznému snížení viability a tím i účinnosti bioeliminace. Na straně druhé jsou některé problémy s BAL v budoucnosti patrně řešitelné. Slibným zdrojem buněk by mohly být pluripotentní zárodečné buňky. Pro možnou diferenciaci v hepatocyty je možné použít několik buněčných populací. Jde o hematopoetické, mezenchymální zárodečné buňky a dále o tzv. oválné buňky (HLSC – human liver-derived stem cells) získané přímo z jaterního parenchymu. Jejich přítomností je někdy vysvětlována obrovská regenerační schopnost jater [13].
Z výše uvedeného plyne, že klinické použití bioeliminačních metod nelze v krátké době očekávat. Podmínkou je vyřešení zásadních problémů spojených se získáváním dostatečného množství zdravých a funkčních hepatocytů, se zkrácením a zjednodušením jejich přípravy, prodloužením doby jejich použitelnosti a se zvýšením kapacity bioreaktorů.
II. NEBIOLOGICKÉ ELIMINAČNÍ METODY
Principem nebiologických eliminačních metod je odstranění toxinů způsobujících ireverzibilní poškození mozku pacienta. Tato myšlenka vznikla na počátku padesátých let minulého století a vycházela z předpokladu, že jde o malé molekuly, které je možné odstranit hemodialýzou (HD), hemofiltrací či různými absorbéry [14, 15, 16]. Dnes však víme, že škála látek ovlivňujících průběh ASJ, je daleko širší. Vedle nízkomolekulárních látek, jako jsou amoniak, fenoly a volné žlučové kyseliny, to jsou i prozánětlivé mediátory (cytokiny, anafylatoxiny), vazoaktivní látky a inhibitory buněčného růstu (transforming growth factor 1 – TGF1). Rozptyl molekulární hmotnosti těchto látek je obrovský, od 500 Da až do 100 kDa. Řada z nich je navíc vázána na plazmatické bílkoviny [17]. Z tohoto pohledu není překvapením, že původně využívané metody neovlivnily přežití pacientů a byly záhy vystřídány terapeutickou náhradou plazmy či celé krve [18]. Tyto postupy sice zaručují snížení hladiny uvedených látek v oběhu, avšak nesou s sebou celou řadu nevýhod v podobě posttransfuzní reakce: vznik hypokalcemie, hypotermie, metabolické acidózy a plicního edému. Dále vedou k úbytku koagulačních faktorů a ke snížení exprese růstového faktoru hepatocytů (hepatocyte gowth factor – HGF), jehož nedostatek přispívá k progresi ASJ. Další nevýhodou jsou i vysoké náklady. Všechna tato negativa zapříčinila odklon od těchto metod směrem k léčbě založené na principu adsorpce.
MARS®
Prvním dokonalejším adsorbčním zařízením je systém MARS® (Molecular Adsorbent Recycling System), který byl poprvé experimentálně použit počátkem devadesátých let minulého století [19]. Principem tohoto zařízení je okruh s cirkulujícím roztokem albuminu, který přes semipermeabilní, pro albumin nepropustnou, membránu difuzí přejímá z krve pacienta toxiny vázané na albumin [20]. Vzhledem k tomu, že 60–80 % bilirubinu je vázáno právě na albumin, snižuje MARS®u nemocných s ASJ signifikantně hladinu bilirubinu [21]. Tato metoda byla použita k léčbě ASJ u tisíců pacientů, avšak randomizovaná studie prokazující efektivitu této léčby doposud chybí. Hlavním důvodem jsou obtíže s přípravou designu průkazné klinické studie. Bez ohledu na tuto skutečnost se MARS® osvědčil při léčbě hepatorenálního syndromu, cholestatického postižení jater a některých otrav hepatotoxickými látkami. Jeho nevýhodou jsou poměrně vysoké náklady při opakování léčby.
Prometheus®
Na podobném principu je sestrojen i eliminační systém Prometheus® (FPSA – Fractionated plasma separation and adsorbtion), který kombinuje albuminovou dialýzu s hemodialýzou. Nevyžaduje nákladné doplňování albuminového okruhu. Z krve očištěné high-flux hemodialýzou je separována plazma, která prochází dvěma adsorbéry (Prometh 01, Prometh 02). Prometh 01 propouští molekuly do velikosti 250 kD. Tím dochází k adsorpci žlučových kyselin, aromatických aminokyselin, fenolických substancí a toxinů. Prometh 02 – se styren-divinylbenzen kopolymerem s prostorovou sítí 100 μm, vychytává negativně nabité ligandy (nekonjugovaný bilirubin). Nosičem toxinů je zde albumin pacienta a tudíž ho není nutné do systému dodávat.
Ze srovnání obou nebiologických systémů vychází lépe Prometheus®, a to v resorpci látek jak rozpustných ve vodě, tak i vázaných na albumin [22] (Obr. 4).
Obr. 4. Schematické znázornění principu eliminace v systému MARS® a Prometheus® (převzato z informačního letáku). Fig. 4. Schematic imaging of the MARS® and Prometheus® system elimination principles (adopted from their information leaflets). 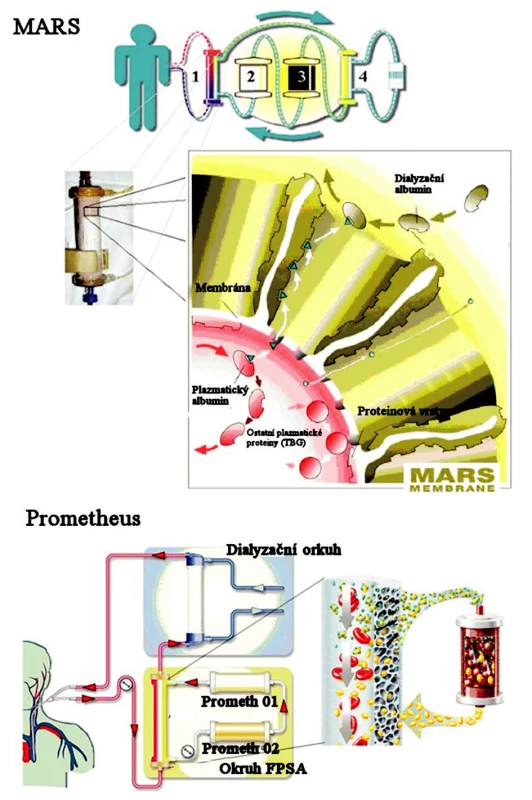
Jednou z původně vyzdvihovaných výhod systému Prometheus® byla i možnost jeho užití jako prosté hemodialýzy. Pracoviště, které si tento přístroj zakoupilo, mělo tedy vlastně 2 systémy v jednom. Užití Promethea jen pro hemodialýzu je však nejenom nákladnější, ale může pacienty ohrozit indukovanou koagulopatií. Během testování in vitro byl totiž zjištěn signifikantní úbytek proteinu C na výstupu z adsorberu Prometh 02 až o 52 %. Klinicky se takto navozená koagulopatie manifestovala nejčastěji jako trombóza arterio-venózního shuntu [23].
U přístroje Prometheus® je nejdůležitější, že určil trend nebiologické eliminace směrem k výraznému zjednodušení.
SEPET
Nejnovějšími nebiologickými eliminačními metodami jsou systémy SPAD (Single-pass albumin dialysis) a SEPET® (Selective plasma filtration therapy), jejichž základem jsou dutá vlákna tvořená z high-flux membrány, která je částečně propustná pro albumin [24]. Systém SEPET® vychází z nových poznatků o významu některých již zmiňovaných látek (HGF, TGF1, Il-6 a jiných prozánětlivých interleukinů) v patofyziologii ASJ [25]. Většina těchto látek má molekulovou hmotnost menší než 100 kDa. Membrána tohoto selektivního filtru je tudíž koncipována tak, aby byla volně propustná pro tyto nízkomolekulární látky, stejně tak jako pro další endotoxiny (lipid A) a anafylatoxiny (C3a). Naopak membrána je nepropustná pro některé imunoglobuliny (IgG, IgM), v limitovaném množství propouští albumin a koagulační faktory [17]
Výsledkem experimentální studie s použitím této eliminační metody prováděné na prasečím chirurgickém devaskularizačním modelu ASJ je signifikantní snížení amoniaku, aromatických aminokyselin, prozánětlivých cytokinů (IL-6, IL-18, IL1, TNF) a TGF1. Naopak propustnost pro albumin a většinu koagulačních faktorů a HGF je menší než 30 %.
Během šestihodinové léčby pomocí SEPET se vyprodukuje přibližně 2 500 ml ultrafiltrátu, což odpovídá 1,6–2 litrům plazmy, kterou je možné při klinickém použití snadno substituovat [17]. Membrána je nepropustná pro imunoglobuliny, což ovlivňuje pozitivně průběh ASJ. Tento systém, na rozdíl od přístroje MARS®, nepočítá s filtrací bilirubinu, jehož cytotoxický efekt je nyní považován za sporný. Dokonce existují data hovořící o jeho antiapoptotické aktivitě [26].
Systém SEPET® tak představuje jednoduchou, ne příliš nákladnou a efektivní podpůrnou metodu v léčbě ASJ. V současné době probíhá randomizovaná studie, která by měla prokázat účinnost tohoto systému.
VLASTNÍ ZKUŠENOSTI
Problematikou zhodnocení přínosu eliminačních metod v experimentu se kolektiv autorů zabývá již 6 let. Prvním úkolem bylo zavedení modelu ASJ na zvířeti. Podmínky jsme si stanovili dvě: zvolené laboratorní zvíře by se mělo svou anatomií co nejvíce blížit člověku a ASJ by mělo svým rozvojem odpovídat nejpravděpodobnějšímu průběhu selhání jater v humánní medicíně. Z těchto důvodů jsme zvolili chirurgický devaskularizační model ASJ s provedením portokavální anastomózy u prasete, který se nám podařilo standardizovat, jak co do provedení [27, 28], tak i do monitorace [29, 30]. Za nejdůležitější marker ASJ jsme považovali hodnotu intrakraniálního tlaku (ICP), dále hladinu bilirubinu, amoniaku a koagulačních faktorů. Hodnotu hladin transamináz jsme v souladu s literaturou nepovažovali za rozhodující [31].
Nejprve jsme se rozhodli zhodnotit biologickou eliminační léčbu. Zvolili jsme přístroj O. liver Performer fy Rand (Itálie) s bioreaktorem izolovaných hepatocytů.
Po nácviku izolace hepatocytů jsme provedli bioeliminaci na sestavě 10 prasat s ASJ průměrné váhy 30 kg. Prokázali jsme signifikantní snížení hladiny bilirubinu v experimentální skupině, nicméně signifikantní snížení ICP ve srovnání s kontrolní skupinou nikoliv (32). Pro nebiologickou eliminační léčbu ASJ jsme použili systém frakcionované plazmatické separace a adsorpce (FPSA), přístroj Prometheus® firmy Fresenius (Německo) (Obr. 5) u skupiny 14 prasat průměrné váhy 37 kg. Prokázali jsme signifikantní snížení jak hladiny bilirubinu, tak i hodnot ICP, které nedosahovaly úrovně, u které by došlo k ireverzibilnímu poškození mozku v experimentální skupině zvířat [33, 34].
Obr. 5. Prometheus® firmy Fresenius (Německo) 
ZÁVĚR
Efektivní eliminační metodu zlepšující přežití pacientů s ASJ se doposud nepodařilo vyvinout. Při srovnání současných možností podpory funkcí selhávajících jater lze konstatovat, že očekávané výsledky biologické eliminační metody do klinické praxe zatím nepřinesly. Užití nebiologických metod se v současné době jeví jako perspektivní a jejich přínos je prokázán na prospektivních studiích. K jejich zhodnocení je však třeba provést studie randomizované. Vlastní experimentální zkušenosti autorů tento trend potvrzují. Prokázali u ASJ v experimentu s nebiologickým podpůrným systémem Prometheus® signifikantní snížení jak hladiny bilirubinu, tak i hodnot intrakraniálního tlaku. Přínos eliminační léčby ASJ či jaterní dysfunkce po velkých jaterních resekcích doposud prokázán nebyl.
Každý z přístupů, biologický či nebiologický, k eliminaci při ASJ přináší svá pro i proti. Nabízí se tedy myšlenky tyto systémy spojit. Vznikají tak tzv. hybridní systémy, jejichž někteří zástupci (MELS, HepatAssist-2) jsou již v experimentálním testování. Otázkou je, zda obrovská složitost takového systému nebude limitovat jeho klinické využití.
MUDr. O. Ryska
Biskupcova 89
130 00 Praha 3
e-mail: ondrejryska@centrum.cz
Zdroje
1. Bernuau, J., Rueff, B., Bernhamou, J. P. Fulminant and subfulminant liver failure. Definitions and causes. Semin Liver Dis 6 : 97–106, 1986.
2. Trey, C., Davidson, C. S. The management of fulminant hepatic failure. Prog. Liver Dis., 3, 1970 : 282–298.
3. Sorrentino, F. Prime ricerche per la realizzatione di n fegato arftificiale. Chirurgie Patologica Sperimentale, 1956, 4, 1401.
4. Abouns, G. M., et al. Succesful ex vivo liver perfusion system for hepatic failure panding liver regeneration or liver transplantation. Transplant. Proc., 33, 1962–1964.
5. Lie, T. S. Treatmen of acute hepatic failure by extracorporeal hemoperfusion over human and baboon liver. In: Artificial liver support, 268-273 (Eds. Brunner G and Schmidt FW), Berlin: Springer.
6. Mitry, R. R., Hughes, R. D., Aw, M. M., et al. Human hepatocyte isolation and relationship of cell viability to early graft function. Cell Transplant., 2003; 12(1): 69–74.
7. Gupta, S. Hepatocyte transplantation. J. Gastroenterol. Hepatol., 2002, Dec; 17 Suppl. 3: S287–S293.
8. Nagaki, M., Naito, T., Ohnishi, H. Effects of plasma from patients with fulminant hepatic failure on function of primary rat hepatocytes in three-dimensional culture. Liver Int., 2005, Oct; 25(5): 1010–1017.
9. Naruse, K. Artificial liver support: future aspects. J. Artif .Organs., 2005; 8(2): 71–76.
10. Sosef, M. N., Abrahamse, L. S. L., van de Kerkhove, M. P., et al. Assesment of the AMC – bioartificial liver in the anhepatic pig. Transplantation, 73, 2002 : 204–209.
11. Demetriou, A. A., Brown, R. S., Busutil, R. W., et al. Prospective, randomized, multicentr, controlled trial of a bioartifitial liver in treating of acute liver failure. World J. Gastroenterol., 2001, 7, 706.
12. Paradis, K., Langford, G., Long, Z., et al. Search for crossspecies transmission of porcine endogenous retrovirus in patients treated with living pig tissue. Science, 1999, 286, 1236.
13. Dahlie, M. H., Popp, F. C., Larsen, S., et al. Stem cell therapy of the liver – fusion or fiction? Liver Transpl., 2004, Apr; 10(4): 471–479.
14. Denis, J., Opolon, P., Nusinovici, V., et al. Treatment of ence-phalopathy during fulminant hepatic failure by harmodialysis with jigh permeability membrane. Gut, 1978, 19, 787.
15. Rifai, et al. Liver replacement therapy. Reliable indications in acute liver failure. Internist, 2003, 44, 1485–1490.
16. Horák, J., Sulková, S. Junctions of hepatology and nephrology. Cas. Lek. Cesk., 2004; 143(7): 459–464.
17. Rozga, J., Umehara, Y., Trofimenko, A. A novel plasma filtration therapy for hepatic failure: preclinical studies, Ther. Apher. Dial., 2006, Apr; 10(2): 138–144.
18. Sabin, S., Merritt, J. A. Treatment of hepatic coma in cirhosis by plasmapheresis and plasma infusion (plasma exchange). Ann. Intern. Med., 1968, 68, 1.
19. Stange, J., Ramlow, W., Mitzner, S., et al. Dialysis against a recycled albumin solution enables the removal of albumin-bound toxins. Artif. Organs, 1993, Sep; 17(9): 809–813.
20. Stange, J., Mitzner, S. R., Risler, T., et al. Molecular adsorbent recycling system (MARS): clinical results of a new membrane-based blood purification system for bioartificial liver support. Artif. Organs, 1999, Apr; 23(4): 319–330.
21. Jalan, R., Sen, S., Steiner, C., et al. Extracorporeal liver support with molecular adsorbents recirculating system in patients with severe acute alcoholic hepatitis. J. Hepatol., 2003, Jan; 38(1): 24–31.
22. Laleman, W., Wilmer, A., Evenepoel, P., et al. Effect of the molecular adsorbent recirculating system and Prometheus® devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit. Care, 2006; 10(4): R108.
23. Meijers, B. K., Verhamme, P., Nevens, F., et al. Major coagulation disturbances during fractionated plasma separation and adsorption. Am. J. Transplant., 2007, Sep; 7(9): 2195–2199. Epub 2007 Jul 19.
24. Peszynski, P., Klammt, S., Peters, E., et al. Albumin dialysis: single pass vs recirculation (MARS). Liver, 2002, 22, Suppl. 40.
25. Tsubouchi, H., Hirono, S., Godha, E., et al. Clinical significance of human hepatocyte growth factor in blood from patients with fulminant hepatic failure. Hepatology, 1989, 9, 875.
26. Granato, A., Gores, G., Vilei, M. T., et al. Bilirubin inhibits bile acid inducted apoptosis in rat hepatocyte. Gut, 2003, 52, 1774–1778.
27. Ryska, M., Kieslichova, E., Pantoflíček, T., Ryska, O., et al. Devascularization Surgical Model of Acute Liver Failure in Minipigs. Eur. Surg. Res., 2004; 36; 179–184 (IF).
28. Ryska, M., Kieslichová, E., Pantoflíček, T., Ryska, O., Zazula, R., Skibová, J. Model akutního selhání jater u miniprasete z hlediska chirurga a anesteziologa. Rozhl. Chir., 2004, 83 : 436–442.
29. Kieslichová, E., Ryska, M., Pantoflíček, T., Ryska, O., Zazula, R., Skibová, J. Hemodynamic Parameters in a Surgical Devascularization Model of Fulminant Hepatic Failure in the Minipig. Phys. Res., 54, 2005 : 485–490.
30. Ryska, M., Kieslichová, E., Pantoflíček, T., Ryska, O., Zazula, R., Skibová, J., Hájek, M. Chirurgický model akutního selhání jater u laboratorního miniprasete. Čes. Slov. Gastroent. Hepatol., 2004, 58 : 83–88.
31. Newsome, P. N., Plevris, J. N., Nelson, L. J., et al. Animal models of fulminant hepatic failure:A critical evaluation. Liver Transplant., 2000;1 : 21–31.
32. Ryska, M., Kieslichová, E., Pantoflíček, T., Ryska, O., Koblihová, E., Tcherentsová, E. Bioeliminace v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Čes. Slov. Gastroent. Hepatol., 2006; 60 : 157–162.
33. Ryska, M., Lásziková, E., Pantoflíček, T., Ryska, O., Pražák, J., Koblihová, E., Skibová, J. Prometheus v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Čes. Slov. Gastroent. Hepatol., 2007; 61 : 297–303.
34. Ryska, M., Lasziková, E., Pantoflíček, T., Ryska, O., Pražák, J., Koblihová, E., Skibová, J. Prométheus Significantly Decreases Intracranial Pressure on Acute Liver Failure. Experimental Study. Liver transplantation – in press.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Leiomyom přední stěny břišní
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- CT nálezy etylizovaných pacientov po ľahkom kraniocerebrálnom poranení
- Miniinvazivní chirurgie spontánního pneumotoraxu – indikace a operační technika
- Současný význam biologických a nebiologických eliminačních metod v léčbě akutního selhání jater
- Infekce chirurgického místa po operacích na aborální části GIT
- Ruptura aneuryzmatu břišní aorty do dolní duté žíly
- Leiomyom přední stěny břišní
- Cystický feochromocytóm, imitujúci cystu pečene
- Short bowel syndróm a limity resekčnej chirurgie tenkého čreva
- Chronická rana ako prekanceróza (Marjolinov ulkus)
- Mezioborová spolupráce plastické a rekonstrukční chirurgie a ortopedie při ošetřování končetinových traumat. Souborný referát
- Ventrálna hernia spojená s morbídnou obezitou – kedy operovať?
- Jubilant – prof. MUDr. Bohumil Potrusil, CSc.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Short bowel syndróm a limity resekčnej chirurgie tenkého čreva
- Cystický feochromocytóm, imitujúci cystu pečene
- Ventrálna hernia spojená s morbídnou obezitou – kedy operovať?
- Miniinvazivní chirurgie spontánního pneumotoraxu – indikace a operační technika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



