-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výsledky transperitoneální laparoskopické nefrektomie pro renální adenokarcinom
Outcomes of Transperitoneal Laparoscopic Nephrectomy for Renal Adenocarcinoma
Laparoscopic radical nephrectomy (LRN) is method of choice in malignant renal tumors (RCC) stage T1-3. Procedure has proved to be technically safe with low post-operative morbidity and standard oncological results, provided the patients are secondaries free in the time of surgery, and there was no positive margin in resected tissue. There was no recurrence even after 6 years of follow-up. The most influential variables regarding the survival of patients postoperatively were: presence of metastases in the time of surgery p < 0.0001, pathological grade p < 0.001, stage p < 0.018 and p < 0.046, respectively, if the tumors were 4 cm and bigger. It could be concluded, that laparoscopic way of removing the tumor with the kidney has proved the same oncological results even in the mid-term follow-up, if compared with classical open surgery done lege artis.
Key words:
laparoscopy – renal tumors – survival
Autoři: L. Šafařík; K. Novák; M. Babjuk; Martin Pešl
; P. Macek; J. Dvořáček
Působiště autorů: Urologická klinika 1. LF UK Praha, přednosta: prof. MUDr. J. Dvořáček
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 11, s. 601-604.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Laparoskopická radikální nefrektomie (LRN) je metodou volby u zhoubných nádorů ledvin (RCC) stadií T1-3. Jde o operaci z technického hlediska bezpečnou, s malou pooperační morbiditou a standardnímí onkologickými výsledky, pokud operovaní nemají v době operace již metastázy a během operace je odstraněn nádor do zdravé tkáně bez pozitivního okraje. Nebyla zjištěna recidiva nádoru ani v období sledování 6 let po operaci. Největší vliv na přežití pacientů měly zjištěné metastázy v době operace p < 0,0001, grading nádoru p < 0,001, patologický staging p < 0,018, resp. p < 0,046, pokud šlo o rozdělení na nádory do 4 cm a větší. Lze tedy uzavřít, že laparoskopický způsob odstranění ledviny s nádorem i ve střednědobém sledování neprokázal odlišné onkologické výsledky od klasické otevřené operace provedené lege artis.
Klíčová slova:
laparoskopie – nádory ledvin – přežitíÚVOD
Adenokarcinom ledviny (RCC) je zhoubný nádor, který představuje 2–3 % ze všech zhoubných nádorů v rozvinutých zemích světa. Přírůstek incidence v Evropě a ve světě představuje 2 % ročně a vyšší podíl přírůstku malých nádorů se přikládá faktu, že se za posledních 10 let v rozvinutých zemích mnohem častěji používá ultrasonografie a CT vyšetření břicha, a to i v případech, kdy zprvu na tento typ nádoru není podezření. O vysokém maligním potenciálu tohoto nádoru svědčí, že před 10 lety bylo v zemích evropské unie zjištěno 30 000 nových případů tohoto nádoru a 15 000 nemocných zemřelo v důsledku této diagnózy [1]. Etiologie, jako dosud u většiny zhoubných nádorů, není známá, ale jako rizikové faktory se často uvádí obezita, kouření a kupodivu i léčba antihypertenzivními léky [2, 3]. Nádor se nejčastěji vyskytuje v 7. dekádě a poměr výskytu u mužů a žen je cca 1,5 : 1.
Laparoskopická radikální nefrektomie (LapRN) se již stala standardním přístupem pro operaci nádorů stadia T1 (do 4 cm), ale podle zkušeností operujícího je v dnešní době možné operovat i nádory mnohem větší [4, 5]. Na našem pracovišti jsme se zaměřili na vyhodnocení výsledků především z hlediska přežití nemocných, výskytu metastáz a rizikově prognostických faktorů zjištěných na základě patologického stagingu a gradingu u nemocných po operaci.
MATERIÁL A METODA
Na naší klinice se používá transperitoneální laparoskopický přístup k operaci nádorů ledvin již od roku 2002, i když první transperitoneální nefrektomie byla provedena 7. 3. 2000 pro benigní onemocnění. Jde o standardní přístup, kdy v kapnoperitoneu 12 – 14 cm Hg vlevo zakládáme 3 porty (2x 10mm, 1x 5mm) a vpravo 4 (port pro elevaci jater). Kapnoperitoneum je zjednáno běžně Veressovou jehlou, v případě, že nemocný má v místě nadbřišku jizvu po předchozí otevřené operaci, pak postupujeme Hassonovou technikou [6]. Po odpreparování případných růstů po předchozích operacích je otevřeno zadní peritoneum a vyhledán hilus ledviny. Arterie, a pokud možno i vena, jsou klipovány svorkami Hem-o-lock – 2 svorky centrálně, 1 periferně a cévy jsou přerušeny, další preparace ve vrstvě je standardní jako u otevřené nefrektomie [7]. Ledvina je odstraněna i s tukovým obalem, přičemž v převážné většině případů je odstraněna i ipsilaterální nadledvina. Je to zejména v případech, kdy nádor je > T1a (4 cm), nádor je v horní polovině ledviny nebo je-li nádor v blízkosti renální žíly. Ledvina je vyjmuta spojením 2 nejbližších portů a na 2–4 dny je vložen sací drén. Po operaci jsou nemocní sledováni v půlročních intervalech pomocí ultrasonografie nebo CT na místo možné lokální recidivy, u větších nádorů je kontrolován i kostní scan a je prováděn snímek hrudníku. U nemocných se stadiem T2 a více je prováděno i základní biochemické vyšetření. Výsledky přežití byly vyhodnoceny pomocí Kaplanovy-Meierovy metody, vliv jednotlivých charakteristik souboru na přežití pomocí regrese Cox proportional hazard a korelace Mannovým-Whitneyovým testem.
VÝSLEDKY
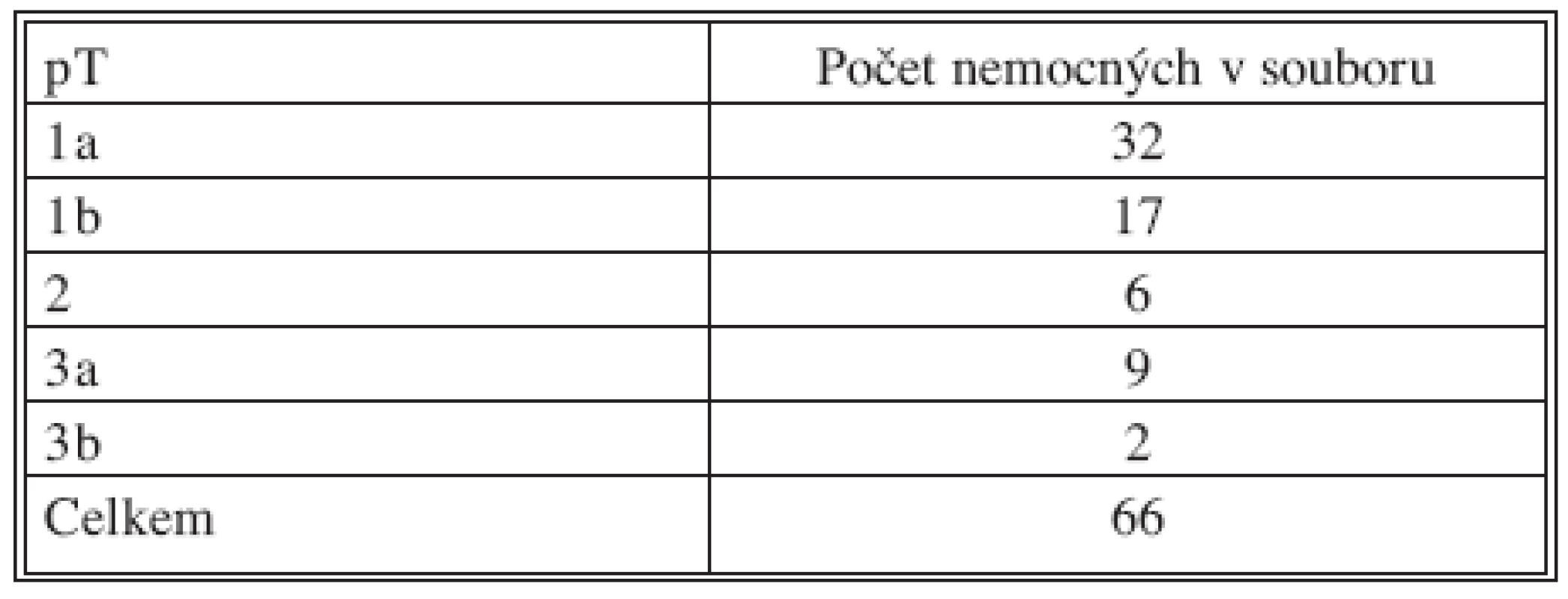
V období od června 2002 do července 2008 (73 měsíců) bylo pro RCC celkem operováno 66 nemocných, z toho 44 mužů a 22 žen (2 : 1). Průměrný věk byl 60,3 roku, (muži 59, ženy 62,9). Ledvina s nádorem byla odstraněna 29x vpravo, 37x vlevo (1 : 1,27). Celkem 49 nemocných mělo nádor stadia T1 (do 7 cm v průměru), přičemž 32 nemocných mělo nádor T1a (do 4 cm), 17 T1b (do 7 cm) a 19 nádor větší, případně s prorůstáním do renální žíly (28,7 %). Přehled o lokální pokročilosti nádoru (staging) podává tabulka 1. Průměrný čas operace byl 160 minut (69–315). Šest nemocných (9 %) mělo již před operací zjištěné metastázy (4 v kostech a 2 v plicích) a všichni tito nemocní v důsledku své nemoci po operaci zemřeli v různě dlouhém intervalu. Průměrná doba hospitalizace byla 6,9 dne (3–17), přičemž o délce hospitalizace často nerozhodovaly jen medicínsky nutné důvody. Během operace bylo ve 2 případech nutné provést konverzi na otevřený výkon (3 %). Z dalších komplikací jsme 3x zaznamenali větší hematom v lůžku (4,5 %), který si 1x vyžádal následnou operační laparoskopickou revizi (odsátí koagul a drén), 2x byl nemocný léčen jen antibiotiky a vyčkalo se do resorpce hematomu při celkové oběhové stabilitě nemocného.
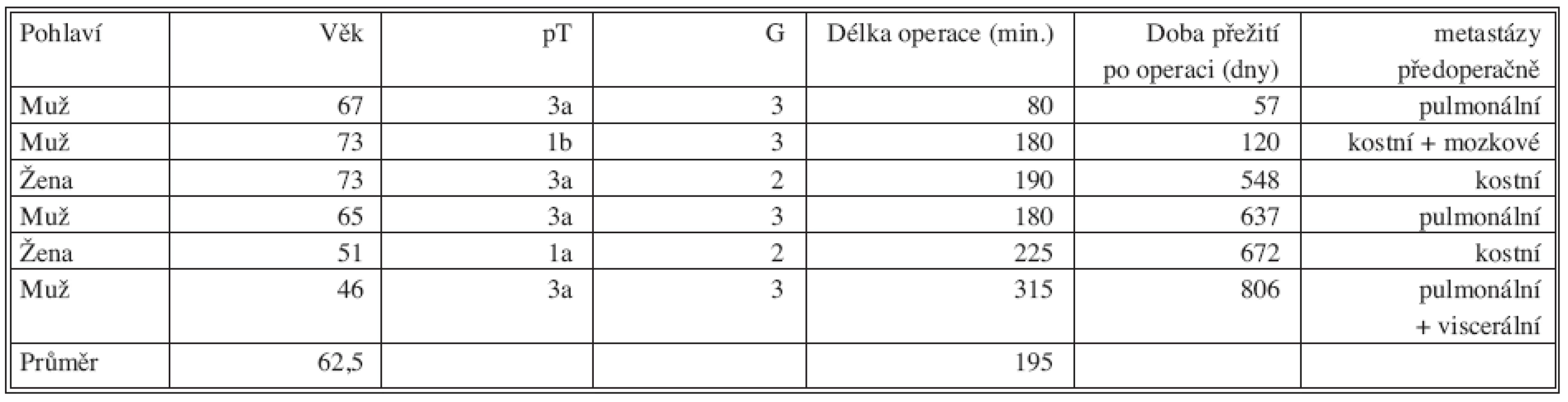
Přežití nemocných po operaci znázorňuje Kaplanova-Meierova křivka (Graf 1), ze které je patrné, že po 73 měsících od začátku provádění tohoto typu operace přežívá 85 % nemocných. Detailní přehled charakteristik zemřelých podává tabulka 2. Medián přežití všech nemocných, kteří na svůj nádor zemřeli je 1,6 roku, přičemž je důležité, že všichni zemřelí měli prokázané metastázy již před operací (p < 0,0001). Největší vliv na přežití/úmrtí má biologický grading nádoru G (p < 0,001), dále patologický staging pT (p < 0,018) a konečně zda byl nádor stadia pT1 nebo větší (p < 0,046). Naopak vliv na přežití nemá pohlaví (p < 0,999), věk (p < 0,494), postižená strana (p < 0,21) a doba hospitalizace (p < 0,759). Vše na 95% hladině významnosti. Dosud jsme nikdy nezaznamenali lokální recidivu po operaci adenokarcinomu ledviny laparoskopickou cestou, a to jak v místě původního nádoru, tak i v místě jizvy v břišní stěně, kudy ledvinu s nádorem odstraňujeme. Přitom ani v jednom z případů jsme nepoužili sáček na preparát, do kterého bychom ledvinu před jejím odstraněním z těla vložili. Všichni nemocní s metastázami prodělali po operaci adjuvantní léčbu interferonem/interleukinem, případně byl podán Vinblastin.
DISKUSE
Technika laparoskopické radikální nefrektomie je v současné době dobře propracovaná a ve zkušených rukách nepředstavuje peroperační ani onkologické riziko pro pacienta [8, 9, 10]. Jak je patrné ze souboru, kromě malých nádorů (T1) je možné odstraňovat i nádory větší než 7 cm (téměř jedna třetina) všech operovaných, a to s velmi dobrým výsledkem z hlediska dlouhodobého přežití. Technika operace je již dobře propracována a většina pracovišť dává přednost transperitoneálnímu přístupu, podobně jako u otevřených operací, neboť je přímý přístup k cévnímu hilu. Ten je ošetřitelný plastickými zámkovými svorkami (jako v našem případě), případně endostaplery, jejichž cena je mnohem vyšší. Pokud je žíla příliš široká na svorku, je možné ji zúžit ligaturou a přes zúžené místo pak dát 1–2 svorky [11].
Častým argumentem proti laparoskopické technice bývá delší operační čas. V našem souboru je průměrný operační čas 160 minut, což je přes 2,5 hodiny. Tento ukazatel je však velmi hrubý. Jak je patrné, nejkratší nefrektomie trvala jen málo minut přes hodinu, na druhou stranu byli často operováni nemocní, kteří již byli po jedné, a více předchozích otevřených operacích (nejčastěji cholecystektomie). Rozrušování adhezí, případně preparace v oblasti ledvinného hilu, kde v žíle je trombus (2x) je časově náročnější a urychlit se příliš nedá. Nejdéle operovaný muž (315 min.) měl velký nádor ledviny a metastázu v kontralaterální nadledvině, která byla vyjmuta následně. Při adjuvantní terapii přežil nejdéle ze všech zemřelých na generalizaci (> 2 roky). Obezita nebývá překážkou operace, přestože vyhledání hilových cév v bohaté tukové tkáni může trvat delší dobu. Ta se pak „ušetří“ na době šití rány.
Statistické zhodnocení prokázalo, že nejvýznamněji ovlivňovaly prognózu nemocného přítomné metastázy již v době operace. Všichni nemocní s metastázami zaznamenali progresi po operaci a zemřeli v intervalu do 2,5 roku (max. 806 dní), přičemž se v místě původního nádoru se nikdy recidiva nevyskytla. Evropské Guidelines uvádějí jen jednu randomizovanou studii, která prokázala statisticky významný rozdíl v přežití u nemocných s imunoterapií u metastazujícího RCC v případě předchozí cytoreduktivní nefrektomie, ale rozdíl byl jen 5,8 měsíce [12]. Druhým nejsilnějším prediktorem prognózy nemocných byl histopatologický grading nádoru (G) a patologický staging (pT). Hraniční z hlediska přežití bylo rozdělení na nádory pT1 a větší. Tyto zkušenosti byly zjištěny i jinými autory [13]. Ze souboru je patrné, že nádory pT1 a i b mají velmi dobrou prognózu z hlediska přežití, ale v případě výskytu metastáz v době diagnózy, ani nízké stadium lokální pokročilosti a absence pooperační recidivy v místě odstraněné ledviny nezachrání nemocného před špatným koncem (Tab. 2). Pokud je ledvina odstraněna s nádorem vcelku, tj. nádor je uzavřen s ledvinou v tukovém pouzdru, není třeba se obávat jeho lokální diseminace. Sami jsme nezaznamenali ani jeden případ recidivy nádoru v ráně, přestože nepoužíváme extrakční sáček na ledvinu.
Z hlediska možnosti operovat i velké nádory ledvin, stadia T2 – T3 je nejdůležitější zkušenost operujícího. Jedině osobní zkušenost v řešení případných komplikací může oprávnit operatéra indikovat i velké nádory k laparoskopii. Z tohoto důvodu může zkušený operatér indikovat LapRN pro menší nádor u jinak velmi interně rizikového nemocného, u něhož delší doba kapnoperitonea by mohla ohrozit jeho životní funkce. Za příznivých okolností lze operaci k poslednímu kožnímu stehu zvládnout do 1 hodiny. Nepřítomnost pooperačního ileu a malá bolestivost je pak u takového nemocného velkou výhodou. Téměř 17 % odstraněných nádorů stadia T3a,b bez lokální recidivy dává prostor pro indikaci i poměrně pokročilého onemocnění. Nádory stadia T1a by měly být v dnešní době vždy zvažovány k provedení laparoskopické resekce ledviny, neboť bezpečná sutura dutého systému a možnost použití tkáňových lepidel nám v současné době poskytuje vysokou záruku bezpečnosti při těchto mnohem náročnějších operacích [14]. U laparoskopických resekcí a případně nefrektomiích pro T1 nádor může být zváženo ponechání nadledviny. Jde o doporučení Evropských urologických standardů (Guidelines 2008) na základě klinických nerandomizovaných studií (stupeň B). Nádor by však měl být malý a omezený na dolní polovinu ledviny. U větších nádorů (T2), stejně tak i u nádorů v oblasti horního pólu ledviny může jít o riskantní záležitost, neboť lymfatická síť nadledviny komunikuje s Gerotovou fascií a mnohé nádory vyšších stadií vykazují při následném histologickém vyšetření angioinvazivitu. Podle nové stratifikace (2007) pokročilých nádorů T3 a T4 přítomnost RCC v nadledvině samotné znamená medián přežití 24 měsíců a pokud je zřejmá i cévní invaze pak kumulativní riziko stoupá a medián přežití je jen 11 měsíců [15]. Vzhledem k tomu, že sami jsme měli možnost ve více než 10 případech operovat synchronní kontralaterální nebo metachronní ipsilaterální metastázy RCC v nadledvinách při jejich ponechání, pak se zdá spíše logické u nádorů nad 7 cm (T2) se přidržet původního konceptu „radikální“ nefrektomie, i když prováděné laparoskopicky – LapRN [16, 17].
ZÁVĚR
Radikální nefrektomie pro adenokarcinom ledviny by dnes měla být prováděna prakticky jen laparoskopickou cestou vzhledem k bezpečnosti této techniky a pooperačnímu komfortu nemocného. Výjimku tvoří jen velké nádory T4 a prorůstání nádoru do dolní duté žíly. Indikace nemocných s předoperačně zjištěnými metastázami je relativní a jak je patrné z tohoto souboru, prognóza generalizovaného onemocnění není dobrá. To se však týká i nemocných operovaných klasicky otevřenou cestou. V těchto případech jsou zřejmě rozhodující další subcelulární faktory malignity, které nemůže samotná operace nahradit (TNF, CD44, VEGF aj.), ať je provedená jakýmkoli způsobem. Důležité je, že při laparoskopii se zpravidla dají jednotlivé roviny preparace sledovat s větším rozlišením a drobnější krevní i lymfatické cévy lze pečlivěji ošetřit termokoagulací nebo svorkami, takže výsledná onkologická „čistota“ může být v podobě nepřítomnosti lokální recidivy pravidlem.
MUDr. Libor Šafařík, CSc., FEBU
Na Vrších 372
252 29 Lety
e-mail: lsafarik@hotmail.com
Zdroje
1. European Association of Urology. Guidelines. 2008 Edition, Guidelines on Renal Cell Carcinoma.
2. Lindblad, P. Epidemiology of renal carcinoma. Scan. J. Surg., 2004; 93(2): 88–96.
3. Pischon, T., Lahmann, P. H., Boeing, H., et al. Body size and risk of renal cell carcinoma in the European prospective investigation into Cancer and Nutrition (EPIC). Int. J. Cancer, 2006; 118(3): 728–738.
4. Gong, E. M., Lyon M. B., Orvieto, M. A., et al. Laparoscopic radical nephrectomy: comparison of clinical stage T1 and T2 renal tumors. Urology, 2006; 68(6), 1183–1187.
5. Cadeddu, J. A., Ono, Y., Clayman, R. V., et al. Laparoscopic nephrectomy for renal cancer: evaluation of efficacy and safety – a multicenter experience. Urology, 1998; 52 : 773–777.
6. Hasson, H. M. Open laparoscopy. Biomed. Bull., 1984, 5(1), 1–6.
7. Ponsky, L., Cherullo, E., Moinzadeh, A., et al. The Hem-o-lok clip is safe for laparoscopic nephrectomy: a multi-institutional review. Urology, 2008; 71(4): 593–596.
8. Feder, M. T., Patel M. B., Melman, A., et al. Comparison of open and laparoscopic nephrectomy in obese and nonobese patients: outcomes stratified by body mass index. J. Urol., 2008; 80(1): 79–83.
9. Msezane, L. P., Katz, M. H., Gofrit, O. N., et al. Hemostatic agents and instruments in laparoscopic renal surgery. J. Endourol., 2008; 22(3): 403–408.
10. Berger, A. D., Kanofsky, J. A., O‘Malley, R. L., et al. Transperitoneal laparoscopic radical nephrectomy for large (more than 7 cm) renal masses. Urology, 2008; 71(3): 421–424.
11. Hage, J. J. On the origin and evolution of the Roeder knot and loop-a geometrical review. Surg. Laparosc. Endosc. Percutan Tech., 2008; 18(1): 1–7. Review.
12. Flanigan, R. C., Mickisch, G., Sylvester, R., et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: a combined analysis. J. Urol., 2004; 171(3): 1071–1076.
13. Zubac, D. P., Bostad, L., Gestblom, C., et al. Renal cell carcinoma: a clinicopathological follow-up study after radical nephrectomy. Scand. J. Urol. Nephrol., 2007; 41(3): 191–197.
14. Hidas, G., Kastin, A., Mullerad, M., et al. Sutureless nephron-sparing surgery: use of albumin glutaraldehyde tissue adhesive (BioGlue). Urology, 2006; 67(4): 697–700.
15. Ficcara, V., Galfano, A., Guillé, F., et al. A new staging system for locally advanced (pT3-4) renal cell carcinoma: a multicenter European study including 2,000 patients. J. Urol., 2007 Aug; 178(2): 418–424; discussion 423–424.
16. Ito, K., Mizuguchi, Y., Sato, A., et al. Clinical evaluation for adrenal metastasis of renal cell carcinoma in a single institute. Nippon Hinyokika Gakkai Zasshi., 2008; 99(4): 584–592.
17. Breda, A., Konijeti, R., Lam, J. S. Patterns of recurrence and surveillance strategies for renal cell carcinoma following surgical resection. Expert Rev. Anticancer Ther., 2007; 7(6): 847–862.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Miniinvazivní chirurgie v České republice
- Závislost úbytku hmotnosti na velikosti neožaludku po laparoskopické bandáži žaludku
- Biliárny ileus – naďalej reálna komplikácia cholecystolitiázy
- První výsledky studie bipolární RFITT koagulace vyšších vyšších stadií hemoroidální nemoci
- Operační léčba zlomenin diafýzy humeru
- Použití biodegradabilních materiálů v léčbě kostních cyst u dětí
- Hybridní roboticky asistovaná operace, aortobifemorální bypass s rekonstrukcí kýly v jizvě
- Kontinentní nálevové stoma u dětí s dysfunkcí pánevních orgánů
- Terapie lymfokély po transplantaci ledviny
- Výsledky transperitoneální laparoskopické nefrektomie pro renální adenokarcinom
- Poranění růstové zóny proximální tibiální epifýzy v dětském věku a možnosti její léčby
- K životnímu jubileu docenta MUDr. Jana Bedrny, CSc., emeritního přednosty chirurgické kliniky v Hradci Králové
- Odpověď na komentář prof. Adamce, Rozhl. Chir., 2008, roč. 87, č. 7, s. 387 k článku „Cévní chirurgie nebo endovaskulární léčba“ autorů Čertík B., Třeška V., et al., Rozhl. Chir., 2006, roč. 85, č. 12, s. 609–612.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Použití biodegradabilních materiálů v léčbě kostních cyst u dětí
- Biliárny ileus – naďalej reálna komplikácia cholecystolitiázy
- Operační léčba zlomenin diafýzy humeru
- Miniinvazivní chirurgie v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání