-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný pohled na diagnostiku a léčbu karcinomu slinivky břišní
Current review of the diagnosis and treatment of pancreatic cancer
Pancreatic cancer has dismal prognosis. Its incidence in the Czech Republic is rising and it is currently the fourth most common cause of cancer related death. The most common presenting symptom is painless jaundice. Other symptoms include vomiting, epigastric pain, anorexia or diabetes mellitus. Diagnosis is based on imaging methods (ultrasound, CT, endosonography). The most significant tumor marker is CA 19-9, which is important both in the diagnostic process as well as in the follow-up. Surgical resection is the most significant treatment method and the only potentially curative method. Adjuvant and palliative chemotherapy improve quality of life and prolong patient survival. Locally advanced and disseminated disease has worse prognosis. The mean survival of patients with unresectable tumour is 6 to 10 months, mean survival after radical resection is 16 to 20 months. Therefore it is necessary to finish the diagnostic process and commence appropriate treatment in a specialized centre as soon as possible.
Key words:
pancreatic cancer, partial pancreaticoduodenectomy, jaundice, prognosis.
Autoři: F. Čečka 1; B. Jon 1; Z. Šubrt 1,2; M. Kaška 1; A. Ferko 1,2
Působiště autorů: Chirurgická klinika LF UK v Hradci Králové a FN, Hradec Králové Přednosta kliniky: prof. MUDr. Alexander Ferko, CSc. 1; Katedra válečné chirurgie Fakulta vojenského zdravotnictví, Hradec Králové Univerzity obrany Brno Vedoucí katedry: doc. MUDr. Leo Klein, CSc. 2
Vyšlo v časopise: Prakt. Lék. 2010; 90(10): 618-621
Kategorie: Diagnostika
Souhrn
Karcinom slinivky břišní je onemocnění se závažnou prognózou. Jeho incidence v současné době stoupá a v České republice se řadí na čtvrté místo mezi příčiny úmrtí na nádorové onemocnění. Nejčastěji se projeví bezbolestným ikterem, mezi další příznaky patří zvracení, bolesti v epigastriu, hubnutí, nechutenství nebo nově vzniklý diabetes mellitus. Diagnostika je založena na zobrazovacích metodách (UZ, CT, EUS). Nejvýznamnější onkomarker v diagnostice a sledování v rámci dispenzarizace je karbohydrát antigen 19-9 (CA 19-9). V léčbě má zásadní význam chirurgická resekce, která je jediná potenciálně kurativní metoda. Adjuvantní nebo paliativní chemoterapie zlepšuje kvalitu života a prodlužuje přežití pacientů. Lokálně pokročilé nebo diseminované onemocnění má horší prognózu. Medián přežití pacientů s neresekabilním karcinomem je 6–10 měsíců, po radikální resekci je přibližně 16–20 měsíců. Proto je nutné při podezření na karcinom slinivky břišní pacienty co nejdříve odeslat na specializovaná pracoviště, dokončit diagnostiku a zahájit léčbu.
Klíčová slova:
karcinom slinivky břišní, parciální duodenopankreatektomie, ikterus, prognóza.Úvod
Duktální adenokarcinom představuje devadesát procent všech primárních nádorů slinivky břišní, ostatní histologické nálezy jsou méně časté. Jedná se o nejčastější malignitu podjaterní oblasti, méně často nacházíme cholangiogenní karcinom distálního choledochu, adenokarcinom Vaterovy papily, nebo karcinom duodena. Jedná se o devastující onemocnění, které vede ke smrti většiny pacientů během jednoho roku, pouze asi 2–5 % pacientů přežívají 5 let. Hlavním problémem je pozdní diagnostika, nízká resekabilita a agresivní biologická povaha nádoru. Cílem tohoto sdělení je shrnout současné poznatky o diagnostice a léčbě karcinomu slinivky břišní.
Epidemiologie a rizikové faktory
Incidence karcinomu slinivky břišní v České republice má vzestupnou tendenci (Graf 1) a v současné době převyšuje incidenci karcinomu žaludku. Podle Národního onkologického registru byla v roce 2006 hlášena hrubá incidence karcinomu slinivky břišní 19,2 na 100 000 za rok u mužů a 17,9 na 100 000 za rok u žen. Mortalita byla 17,7 na 100 000 za rok u mužů a 18,2 na 100 000 za rok u žen. Mortalita dosahuje přibližně stejných hodnot jako incidence, což značí dlouhodobě infaustní prognózu. V České republice se karcinom slinivky břišní řadí na čtvrté místo mezi příčiny úmrtí na nádorové onemocnění – za bronchogenní karcinom, nádory prostaty u mužů, nádory prsu u žen a kolorektální karcinom (1).
Graf 1. Vzestup incidence karcinomu slinivky břišní v České republice. Incidence udávaná na 100 000 obyvatel za rok. 
Obecně incidence maligních nádorů slinivky břišní dosahuje maxima v Severní Americe a Evropě, zatímco v zemích Afriky, Střední a Jižní Ameriky, Asie a Oceánie dosahuje významně nižších hodnot (1).
Nejvýznamnějším rizikovým faktorem karcinomu slinivky břišní je věk. Onemocnění je raritní v prvních třech dekádách, incidence dosahuje maxima v sedmé a osmé dekádě. Střední věk při stanovení diagnózy je přibližně 65 let. 80 % pacientů je starších 60 let (2). Mezi nejvýznamnější enviromentální rizikové faktory patří kouření. Kuřáci mají 2–3x vyšší kumulativní riziko vzniku karcinomu slinivky břišní (3). Mezi další rizikové faktory patří chronická pankreatitida (4), diabetes mellitus (5), obezita (6), dieta s vysokým podílem živočišných tuků (7), expozice některým chemikáliím, např. organickým rozpouštědlům a některým kovům (kadmium, chrom) (1, 8).
Při vzniku karcinomu slinivky břišní hraje významnou roli také genetická predispozice. Příbuzní pacientů s karcinomem slinivky břišní sami mají vyšší riziko vzniku karcinomu (9). Samotná zvýšená konzumace alkoholických nápojů nebyla prokázána jako rizikový faktor vzniku karcinomu slinivky břišní (10). Pokud je mírné zvýšení rizika popisováno, tak je lze přičíst nikotinismu konzumentů alkoholu (11). Souvislost mezi zvýšenou konzumací alkoholických nápojů a vznikem karcinomu slinivky břišní může být také pouze zprostředkovaná skrze chronickou pankreatitidu, která je samostatným rizikovým faktorem. Souvislost karcinomu slinivky břišní s konzumací kávy nebyla prokázána (7).
Symptomatologie a diagnostika
Karcinom slinivky břišní se nejčastěji vyskytuje v hlavě, to až v 70 %, v těle a v kaudě asi ve 30 %. Nádor lokalizovaný v hlavě slinivky se nejčastěji projeví vznikem bezbolestného ikteru (v 70–80 %). Nádor může způsobit stenózu duodena v 10–20 % případů a následně se může projevit tlakovými bolestmi v epigastriu, pocity plnosti po jídle, nauzeou nebo zvracením. Bolesti v zádech se objeví asi u 25 % pacientů, vznikají drážděním nervových pletení v retroperitoneu a jsou většinou známkou pokročilého onemocnění. Nádory lokalizované v těle a kaudě mají zpravidla lokální příznaky méně vyjádřené a diagnostikují se později. K celkovým příznakům patří hubnutí, nechutenství, zvýšená únava nebo náhle vzniklý diabetes mellitus (12). Výjimečně se jedná o náhodný nález (13). Typické pro karcinom slinivky břišní je, že příznaky se objevují pozdě. Nádor je v době diagnózy resekabilní pouze asi u 20 % pacientů. Příčinou neresekability bývá nejčastěji invaze nádoru do horních mezenterických cév nebo do jaterní tepny, metastatické postižení jater a diseminace nádoru po peritoneu.
Diagnostika karcinomu slinivky břišní je mnohdy obtížná, je nutné použít kombinaci více metod. Zejména je mimořádně obtížné diagnostikovat karcinom v terénu chronické pankreatitidy.
Abdominální ultrasonografie (UZ) je zpravidla první vyšetření, které může odhalit infiltraci pankreatu, dilataci žlučových cest nebo metastatické postižení jater. Samotný UZ není dostatečně přesná metoda (14).
Provedení počítačové tomografie (CT) s intravenózním podáním kontrastní látky je zásadní vyšetřovací metodou (15). CT dokáže určit vztah nádoru k horním mezenterickým cévám (Obr. 1), k portální žíle, ukáže lymfadenopatii.
Obr. 1. CT s kontrastní látkou i.v a p.o. Karcinom hlavy slinivky břišní, šipka ukazuje vztah nádoru a vena mesenterica superior. 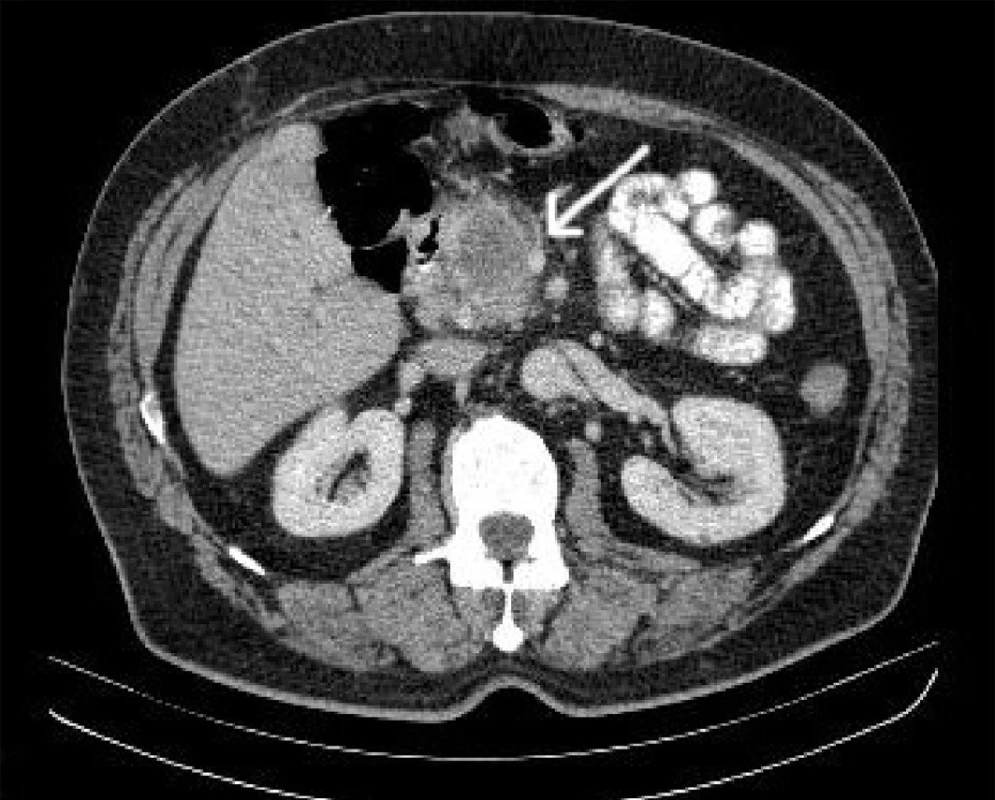
V případě malých nádorů nebo nejasností na CT je indikována endoskopická ultrasonografie (EUS). Ta využívá vysokofrekvenčních sond, které umožňují detekovat i malé nádory nezobrazené na CT. EUS je metodou, která má nejvyšší senzitivitu při lokoregionálním stagingu (16). Další výhodou je možnost cílené biopsie.
Endoskopická retrográdní cholangio-pankreatikografie (ERCP) je zpravidla indikována pro obstrukční ikterus. Je to metoda nejen diagnostická, ale i terapeutická, v případě potřeby se může provést drenáž žlučových cest. Při ERCP můžeme nalézt stenózu žlučových cest a pankreatického vývodu a prestenotickou dilataci obou vývodných systémů (double duct sign) až v 80 % případů. Při tomto vyšetření je možno též odebrat kartáčkovou cytologii z obou vývodných systémů. Senzitivita je udávána okolo 30–60 % a specificita dosahuje 100 % (16).
Magnetická rezonance (MRI) s provedením cholangiopankreatogramu (MRCP) v dnešní době nahrazuje diagnostickou část ERCP. MRI se také indikuje při kontraindikaci intravenózního podání kontrastní látky při CT.
Rutinní angiografie se v diagnostice tumorů slinivky břišní již neuplatňuje. Může se použít např. při podezření na anomální tepenné zásobení slinivky břišní a jater, z nichž nejčastější je stenóza truncus coeliacus (17).
Nejvýznamnější onkomarker v diagnostice karcinomu slinivky břišní je karbohydrát antigen 19-9 (CA 19-9). Jeho senzitivita je 70–90 % a specificita až 90 % (18). CA 19-9 není vhodný jako screeningový marker pro karcinom slinivky břišní. Jeho hladina může být zvýšena též u pacientů s chronickou pankreatitidou, biliární obstrukcí nemaligní etiologie nebo malignitami jiné lokalizace. CA 19-9 se nejvíce uplatní v rámci dispenzarizace jako ukazatel dynamiky onemocnění v pooperačním období. Může se uplatnit také jako pomocný ukazatel neresekability nádoru nebo jako ukazatel prognózy pacientů (19).
Předoperační odběr biopsie je indikován v případě nejasných nálezů na zobrazovacích metodách nebo v případě plánované onkologické léčby diseminovaného onemocnění. Předoperační biopsie není nutná v případě jasné indikace k operaci. Tessler ukázal, že kombinace ztráty hmotnosti o více než 9 kg, sérové koncentrace bilirubinu nad 51 µmol/l a vyšší sérové koncentrace CA 19-9 má 100% specificitu k predikci malignity i bez předoperační biopsie (20).
Terapie
Radikální chirurgická resekce je jediná potenciálně kurativní metoda léčby karcinomu slinivky břišní. Pooperační letalita se pohybuje do 5 %. Bylo prokázáno, že provedení operace ve specializovaném centru přináší lepší krátkodobé výsledky (vyšší resekabilita nádoru, nižší pooperační letalita i morbidita) i dlouhodobé výsledky (delší medián přežití) (21, 22).
Radikální resekce je možná přibližně u 20 % pacientů. Neresekabilita nádorů je dána lokálním prorůstáním nádoru do horních mezenterických cév, jaterní tepny, metastatickým postižením jater nebo diseminací po peritoneu. Při limitovaném prorůstání nádoru do horní mezenterické žíly je možná resekce nádoru spolu s resekcí žíly (23). Nebylo prokázáno, že extenzivní lymfadenektomie prodlužuje přežití (24).
Pro nádory hlavy slinivky je indikována parciální duodenopankreatektomie dle Whippla (DPE). Její pylorus-zachovávající modifikace podle Traverso-Longmira byla poprvé publikována v roce 1978 (25). Nebyly prokázány rozdíly mezi klasickou resekcí dle Whippla a pylorus-zachovávající modifikací stran pooperační letality, morbidity nebo dlouhodobého přežití (26). Klasická Whipplova operace má nižší incidenci zpomaleného vyprazdňování žaludku (DGE), na druhou stranu modifikace dle Traverso-Longmira je spojována s vyšším nárůstem hmotnosti pacientů po operaci a vyšší kvalitou života (26).
Pro nádory těla a kaudy slinivky je indikována levostranná resekce se splenektomií (27) (Obr. 2). Totální duodenopankreatektomie (TDPE) je indikována pro multifokální nádor zasahující hlavu i tělo nebo kaudu nebo v případě, že při DPE je pozitivní resekční linie v krčku. Při odstranění celé slinivky samozřejmě dochází ke vzniku sekundárního diabetu, který je často těžko kompenzovatelný.
Obr. 2. CT s kontrastní látkou i.v. Karcinom kaudy slinivky břišní s infiltrací hilu sleziny (šipka). 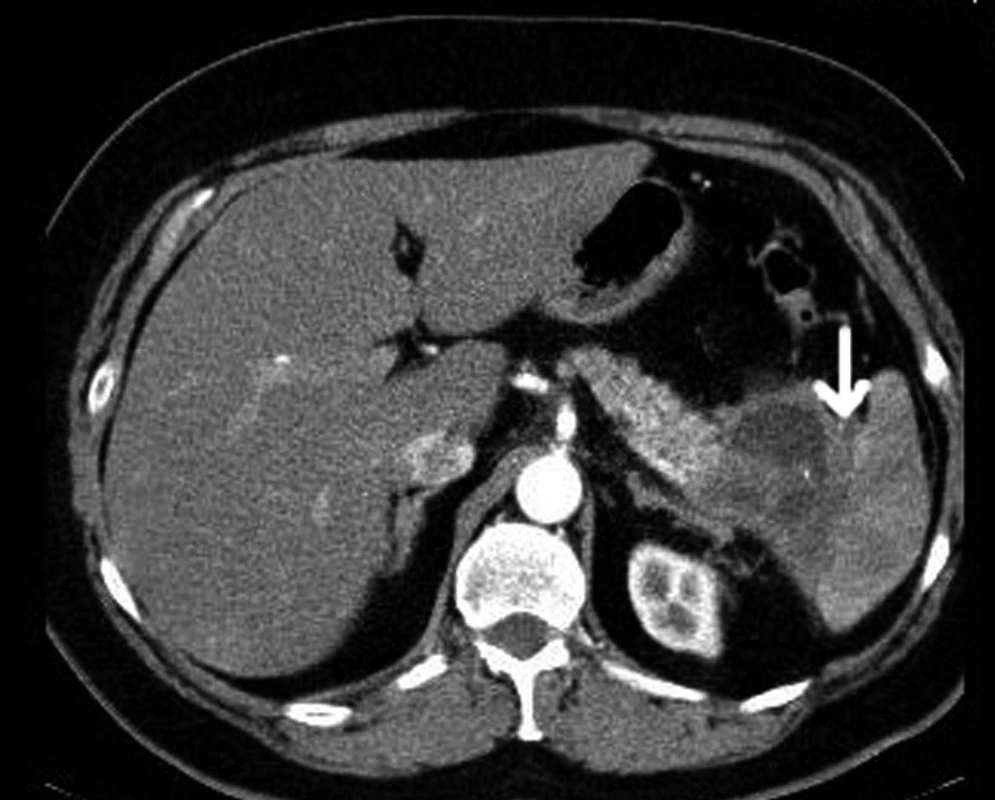
Pokud je při laparotomii zjištěn neresekabilní nádor, pak je indikována paliativní operace (28). Cílem paliativní terapie je odstranit či zmírnit symptomy onemocnění a zlepšit kvalitu života. Paliativní chirurgická léčba zahrnuje gastro-entero anastomózu, bilio-digestivní spojku (29) nebo splanchnikektomii (30). Pokud je neresekabilní nádor zjištěn již v diagnostickém procesu před provedením laparotomie, pak je spíše preferována paliativní endoskopická nebo radiologická intervence (29, 31). Nicméně v poslední době někteří autoři preferují chirurgickou exploraci a eventuelně chirurgický paliativní výkon pokud není jasná kontraindikace resekce (např. rozsáhlé metastatické postižení jater nebo diseminace po peritoneu), a to z několika důvodů:
- resekabilitu nádoru je možno definitivně posoudit až při chirurgické exploraci podjaterní krajiny,
- možnost chirurgického provedení bilio-digestivní anastomózy, gastro-entero anastomózy a terapie bolesti intervencí na ganglion coeliacum v jedné době,
- pokles morbidity a letality paliativních operací v současné době,
- nevýhodou endoskopické paliace je nutnost výměny endoskopicky zavedených stentů při jejich obstrukci (32).
Při volbě paliativního výkonu, chirurgického nebo endoskopického, je nutné postupovat individuálně a vzít v úvahu všechny faktory, z nichž nejdůležitější jsou celkový stav pacienta a předpokládaná délka přežití (33).
Karcinom slinivky břišní patří k nádorům relativně chemorezistentním a radiorezistentním. Nicméně bylo prokázáno, že chemoterapie zlepšuje kvalitu života a prodlužuje přežití pacientů (34). Základním cytostatikem je 5-fluorouracil. Z dalších cytostatik se používá gemcitabin. I když je účinnost léčby 5-fluorouracilem poměrně nízká, jde o dobře tolerovanou léčbu. Gemcitabin má také poměrně příznivý profil nežádoucích účinků, dominuje hematologická toxicita (35).
Další možností ad adjuvantní léčby je radioterapie. Maximální dávka ozáření je limitována radiosenzitivitou okolních tkání (mícha, ledvina, játra, žaludek, tenké střevo). Nicméně přínos adjuvantní radioterapie je stále nejasný a dosud nebylo dosaženo konsenzu v použití radioterapie v léčbě karcinomu slinivky břišní (34, 36, 37)
Adjuvantní terapie doplňuje základní modalitu léčby, což je chirurgická resekce. Cílem adjuvance je zničení zbývajících nádorových buněk, které nebyly odstraněny při chirurgické resekci. Bylo prokázáno, že adjuvantní chemoterapie prodlužuje přežití a zlepšuje kvalitu života pacientů po resekci (36, 38).
Paliativní chemoterapie je indikována u neresekabilních nádorů, jejím cílem je zlepšit kvalitu života pacientů. Chemoterapie je ukončena při známkách progrese nádoru nebo při nezvladatelné cytotoxicitě terapie (39).
Přežití pacientů s primárně resekabilním nádorem po neoadjuvantní terapii a resekci je podobné jako přežití pacientů po primární resekci a adjuvantní terapii. Proto neoadjuvantní terapie u pacientů s resekabilním karcinomem slinivky nemá přínos a nepatří mezi standardní metody léčby (40). U primárně neresekabilních nádorů po neoadjuvantní terapii dosahuje resekabilita až 33 % a po resekci mají pacienti podobné přežití jako po primární resekci (40). Proto by pacienti s dobrou odpovědí na neoadjuvantní terapii měli podstoupit chirurgickou exploraci (41).
Symptomatická terapie pacientů s karcinomem slinivky břišní je významnou součástí terapie. Je indikována pro pacienty v horším celkovém stavu a po selhání primární terapie u všech pacientů. Mezi nejčastější obtíže pacientů patří nádorová kachexie a bolesti. Dále je nutné zajistit drenáž žlučových cest a střevní průchodnost, viz výše.
Prognóza
Z hlediska prognózy je přežití pacientů s karcinomem slinivky břišní celkově tristní. Resekabilita dosahuje pouze přibližně 20 %. Pětileté přežití pacientů po radikální resekci je 25–30 % při negativních uzlinách a nulové u pacientů s pozitivními uzlinami (42). Lepší přežití je u pacientů s karcinomem Vaterovy papily (43).
Medián přežití pacientů s neresekabilním karcinomem je 6–10 měsíců, po radikální resekci je přibližně 16-20 měsíců. Ani pokroky v chirurgické technice, včetně regionální resekce pankreatu nepřinesly žádané zlepšení přežití (24).
Závěr
Diagnóza karcinomu slinivky břišní je závažná, vede ke smrti většiny pacientů do jednoho roku. Karcinom slinivky břišní má velmi agresivní biologickou povahu, rychle progreduje a metastazuje do spádových lymfatických uzlin a do jater. Lokálně pokročilý a metastazující nádor má horší prognózu. Proto je nutné při podezření na karcinom slinivky břišní co nejdříve dokončit diagnostiku a po potvrzení diagnózy zahájit léčbu, přičemž chirurgická resekce je jediná potenciálně kurativní metoda léčby.
Práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví České republiky MZO 00179906.
MUDr. Filip Čečka
Chirurgická klinika LF UK a FN,
Hradec Králové
Sokolská 581,
500 05 Hradec Králové
Email: filip.cecka@seznam.cz
Zdroje
1. Šálek, C. Nové poznatky k epidemiologii nádorů pankreatu. Bull HPB 2004, 12, 3, s. 86-90.
2. Li, D., Morris, J.S., Liu, J. et al. Body mass index and risk, age of onset, and survival in patients with pancreatic cancer. JAMA 2009, 301, 24, p. 2553-2562.
3. Mulder, I., Van Genugten, M.L., Hoogenveen, R.T. et al. The impact of smoking on future pancreatic cancer: a computer simulation. Ann. Oncol. 1999, 10 Suppl 4, p. 74-78.
4. Lowenfels, A.B., Maisonneuve, P., Cavallini, G. et al. Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. N. Engl. J. Med. 1993, 328, 20, p. 1433-1437.
5. Fisher, W. Diabetes: risk factor for the development of pancreatic cancer or manifestation of the disease? World J. Surg. 2001, 25, 4, p. 503-508.
6. Michaud, D.S., Giovannucci, E., Willett, W.C. et al. Physical activity, obesity, height, and the risk of pancreatic cancer. JAMA 2001, 286, 8, p. 921-929.
7. Hart, A.R., Kennedy, H., Harvey, I. Pancreatic cancer: a review of the evidence on causation. Clin. Gastroenterol. Hepatol. 2008, 6, 3, p. 275-282.
8. Schwartz, G., Reis, I. Is cadmium a cause of human pancreatic cancer? Cancer Epidemiol. Biomarkers Prev. 2000, 9, 2, p. 139-145.
9. Ghadirian, P., Liu, G., Gallinger, S. et al. A. Risk of pancreatic cancer among individuals with a family history of cancer of the pancreas. Int. J. Cancer 2002, 97, 6, p. 807-810.
10. Michaud, D.S., Giovannucci, E., Willett, W.C. Coffee and alcohol consumption and the risk of pancreatic cancer in two prospective United States cohorts. Cancer Epidemiol. Biomarkers Prev. 2001, 10, 5, p. 429-437.
11. Ye, W., Lagergren, J., Weiderpass, E. Alcohol abuse and the risk of pancreatic cancer. Gut 2002, 51, 2, p. 236-239.
12. Lillemoe, K.D., Yeo, C., Cameron, J.L. Pancreatic cancer: State-of-the-art care. CA Cancer J. Clin. 2000, 50, 4, p. 241-268.
13. Winter, J.M., Cameron, J.L., Lillemoe, K.D. et al. Periampullary and pancreatic incidentaloma: a single institution’s experience with an increasingly common diagnosis. Ann. Surg. 2006, 243, 5, p. 673-680.
14. Michl, P., Pauls, S., Gress, T.M. Evidence-based diagnosis and staging of pancreatic cancer. Best Pract. Res. Clin. Gastroenterol. 2006, 20, 2, p 227-251.
15. Zhao, W.Y., Luo, M., Sun, Y.W. et al. Computed tomography in diagnosing vascular invasion in pancreatic and periampullary cancers: a systematic review and meta-analysis. Hepatobiliary Pancreat. Dis. Int. 2009, 8, 5, p. 457-464.
16. Soriano, A., Castells, A., Ayuso, C. et al. Preoperative staging and tumor resectability assessment of pancreatic cancer: prospective study comparing endoscopic ultrasonography, helical computed tomography, magnetic resonance imaging, and angiography. Am. J. Gastroenterol. 2004, 99, 3, p. 492-501.
17. Farma, J.M.,Hoffman, J.P. Nonneoplastic celiac axis occlusion in patients undergoing pancreaticoduodenectomy. Am. J. Surg. 2007, 193, 3, p. 341-344.
18. Liao, Q., Zhao, Y.P., Yang, Y.C. et al. Combined detection of serum tumor markers for differential diagnosis of solid lesions located at the pancreatic head. Hepatobiliary Pancreat. Dis. Int. 2007, 6, 6, p. 641-645.
19. Zhang, S., Wang, Y. M., Sun, C. D. et al. Clinical value of serum CA19-9 levels in evaluating resectability of pancreatic carcinoma. World J. Gastroenterol. 2008, 14, 23, p. 3750-3753.
20. Tessler, D.A., Catanzaro, A., Velanovich, V. et al. Predictors of cancer in patients with suspected pancreatic malignancy without a tissue diagnosis. Am. J. Surg. 2006, 191, 2, p. 191-197.
21. Joseph, B., Morton, J.M., Hernandez-Boussard, T. et al. Relationship between hospital volume, system clinical resources, and mortality in pancreatic resection. J. Am. Coll. Surg. 2009, 208, 4, p. 520-527.
22. Sosa, J.A., Bowman, H.M., Gordon, T.A. et al. Importance of hospital volume in the overall management of pancreatic cancer. Ann. Surg. 1998, 228, 3, p. 429-438.
23. Yekebas, E.F., Bogoevski, D., Cataldegirmen, G. et al. En bloc vascular resection for locally advanced pancreatic malignancies infiltrating major blood vessels: perioperative outcome and long-term survival in 136 patients. Ann. Surg, 2008, 247, 2, p. 300-309.
24. Riall, T.S., Cameron, J.L., Lillemoe, K.D. et al. Pancreaticoduodenectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma—part 3: update on 5-year survival. J. Gastrointest. Surg. 2005, 9, 9, p. 1191-1204.
25. Traverso, L.W.,Longmire, W.P., Jr. Preservation of the pylorus in pancreaticoduodenectomy. Surg. Gynecol. Obstet. 1978, 146, 6, p. 959-962.
26. Diener, M.K., Knaebel, H.P., Heukaufer, C. A systematic review and meta-analysis of pylorus-preserving versus classical pancreaticoduodenectomy for surgical treatment of periampullary and pancreatic carcinoma. Ann. Surg. 2007, 245, 2, p. 187-200.
27. Kleeff, J., Diener, M.K., Z’graggen, K. et al. Distal pancreatectomy: risk factors for surgical failure in 302 consecutive cases. Ann. Surg. 2007, 245, 4, p. 573-582.
28. Sohn, T.A., Lillemoe, K.D., Cameron, J.L. et al. Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J. Am. Coll. Surg. 1999, 188, 6, s. 658-666.
29. Andtbacka, R.H., Evans, D.B., Pisters, P.W. Surgical and endoscopic palliation for pancreatic cancer. Minerva Chir. 2004, 59, 2, p. 123-136.
30. Bradley, E.L., Bem, J. Nerve blocks and neuroablative surgery for chronic pancreatitis. World J. Surg. 2003, 27, 11, p. 1241-1248.
31. Smith, A.C., Dowsett, J.F., Russell, R.C. et al. Randomised trial of endoscopic stenting versus surgical bypass in malignant low bile duct obstruction. Lancet 1994, 344, 8938, p. 1655-1660.
32. Köninger, J., Moritz, N., Wente, M.N. et al. Surgical palliation in patients with pancreatic cancer. Langenbecks Arch. Surg. 2007, 392, 1, p. 13-21.
33. Gaidos, J., Draganov, P. Treatment of malignant gastric outlet obstruction with endoscopically placed self-expandable metal stents. World J. Gastroenterol. 2009, 15, 35, p. 4365-4371.
34. Shah, A.P., Strauss, J.B., Abrams, R.A. Review and commentary on the role of radiation therapy in the adjuvant management of pancreatic cancer. Am. J. Clin. Oncol. 2010, 33, 1, p. 101-106.
35. Rudloff, U., Maker, A. V., Brennan, M.F., Allen, P.J. Randomized clinical trials in pancreatic adenocarcinoma. Surg. Oncol. Clin. N. Am. 2010, 19, 1, p. 115-150.
36. Neoptolemos, J., Stocken, D.D., Friess, H. et al. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N. Engl. J. Med. 2004, 350, 12, p. 1200-1210.
37. Regine, W.F., Winter, K., Abrams, R.A. et al. Fluorouracil vs gemcitabine chemotherapy before and after fluorouracil-based chemoradiation following resection of pancreatic adenocarcinoma: a randomized controlled trial. JAMA 2008, 299, 9, p. 1019-1026.
38. Oettle, H., Post, S., Neuhaus, P. et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007, 297, 3, p. 267-277.
39. Duffy, A., Kummar, S. Metastatic pancreatic adenocarcinoma: current standards, future directions. Am. J. Ther. 2010, 17, 1, s. 79-85.
40. Gillen, S., Schuster, T., Meyer zum Büschenfelde, C. et al. Preoperative/neoadjuvant therapy in pancreatic cancer: A systematic review and meta-analysis of response and resection percentages. PLoS Medicine 2010, 7, 4, p. 267.
41. Morganti, A., Massaccesi, M., La Torre, G. et al. A systematic review of resectability and survival after concurrent chemoradiation in primarily unresectable pancreatic cancer. Ann. Surg. Oncol. 2010, 17, 1, p. 194-205.
42. Yeo, C., Cameron, J.L., Lillemoe, K.D. et al. Pancreaticoduodenectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma, part 2. Ann. Surg. 2002, 236, 3, p. 355-368.
43. Yeo, C.J., Cameron, J.L., Sohn, T.A. et al. Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann. Surg. 1997, 226, 3, p. 248-257.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Burn-out syndrom u lékařůČlánek Jubilea
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2010 Číslo 10- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
-
Evoluce a evoluční teorie pro lékaře
X. Sebeuvědomování - Celoživotní vzdělávání všeobecných praktických lékařů v ČR a e-learning
-
Co by měl praktický lékař vědět o pitné vodě?
II. část: Zdravotní rizika spojená s vodou - Dušnost ve stáří podmíněná onemocněním plic
- Burn-out syndrom u lékařů
- Vyznamenání na Pražském hradě
- Měření kvality života odinných pečovatelů
- Některé speciální otázky týkající se používání institutu „dříve projevených přání pacienta“
- Profesionální uspokojení lékařů a sester ve všeobecných praxích
- Konzumace alkoholu a situace v České republice
- Ze života odborných společností ČLS JEP
- Adrenální karcinom – úskalí diagnostiky
- Současný pohled na diagnostiku a léčbu karcinomu slinivky břišní
- Miniportréty slavných českých lékařů Profesor MUDr. Václav Jedlička – patologický anatom
- Šance pro čtyři miliony životů Robert G. Edwards získal letošní Nobelovu cenu za lékařství a fyziologii
- Držitelé Nobelovy ceny za fyziologii a medicínu
- Jubilea
-
Evoluce a evoluční teorie pro lékaře
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dušnost ve stáří podmíněná onemocněním plic
- Burn-out syndrom u lékařů
- Současný pohled na diagnostiku a léčbu karcinomu slinivky břišní
- Celoživotní vzdělávání všeobecných praktických lékařů v ČR a e-learning
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



