-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Monozygotní dvojčata v asistované reprodukci
Monozygotic twins in assisted reproduction treatment
Introduction:
By definition, monozygotic (MZ) twins arise from one single zygote splitting into two separate individuals. MZ twinning is rare in nature, occurring in approximately 0.4% of all births. The incidence following assisted reproduction varies between 0.2% and 12.5%. Factors which appear to influence MZ twinning may be intrinsic factors (age, skewed X chromosome inactivation and inherited defects in zona pellucida proteins) and extrinsic factors (ovulation induction, artificial breach of the zona pellucida, embryo culture conditions and transfer of blastocyst stage embryos).Materials and methods:
In this retrospective cohort study, including data from January 2000 to August 2009, we analyzed the incidence of MZ twin pregnancies in a cohort of consecutive IVF treatment cycles with ICSI, PGD and egg donation.Results:
Of 1 255 pregnancies, 25 (1.99%) were MZ twins. In all these cases Day 5 embryos were transferred. The majority of transferred embryos were expanding and hatching blastocysts. Compared to the entire set, higher number of oocytes were gained in the MZ twins group (16.9 vs. 14.9) and the patients were of lower age (29.5 vs. 32.4). Over the last three years, an increasing tendency in MZD per pregnancy ratio was noted; 2.80% (year 2007), 3.33% (year 2008) a 3.39% (part of year 2009).Conclusions:
The incidence of MZ twin pregnancies in assisted reproduction treatment conceptions is several-fold higher compared to pregnancies after spontaneous conception. Due to an incomplete detection the true incidence of MZ twin pregnancies is probably even higher. We found association between the incidence of MZ twins and lower maternal age, higher number of obtained oocytes, ovarian stimulation and transfer of high quality blastocysts.Key words:
monozygotic – twins – monochorionic – assisted reproductive treatment
Autoři: E. Oráčová; P. Trávník
; G. Tauwinklová
; K. Veselá; L. Hromadová; J. Veselý
Působiště autorů: Sanatorium REPROMEDA s. r. o., Brno 1; Výzkumný ústav veterinárního lékařství, v. v. i., Brno 2
Vyšlo v časopise: Prakt Gyn 2010; 14(3): 133-136
Kategorie: Původní práce
Souhrn
Úvod:
Monozygotní dvojčata (MZD) vznikají z jedné zygoty rozdělením embrya. U spontánních těhotenství se MZD vyskytují v 0,4 %. Incidence MZD po metodách asistované reprodukce se pohybuje od 0,2 % do 12,5 %. Příčina vzniku není doposud jasná. Mezi vnitřní faktory související s MZD je řazen vyšší věk, odlišná inaktivace X chromozomu a vrozené defekty proteinů zona pellucida (genetické faktory). Jako vnější faktory související s MZD jsou uváděny ovariální stimulace, mikromanipulační metody narušující zonu pellucidu, transfer blastocyst a kultivační podmínky.Materiál a metody:
Retrospektivní studie monozygotních dvojčat zjištěných od ledna 2000 do srpna 2009 z cyklů v programu IVF s použitím metod ICSI, PGD i darování oocytů.Výsledky:
Z 1 255 gravidit bylo zjištěno 25 (1,99 %) monozygotních dvojčat. Ve všech případech se jednalo o transfer embryí po pětidenní kultivaci. Mezi transferovanými embryi převažovaly expandované a hatchující blastocysty. Oproti celému souboru pacientek byl v této skupině zjištěn nižší věk pacientek (29,5 vs 32,4) a vyšší počet získaných oocytů (16,9 vs 14,9). Během posledních tří let byla zaznamenána vzrůstající tendence v počtu zjištěných MZD na graviditu, a to 2,8 % (rok 2007), 3,33 % (rok 2008) a 3,39 % (část roku 2009).Závěr:
Incidence MZD v asistované reprodukci je několikrát vyšší než po spontánní koncepci. Skutečná incidence MZD je pravděpodobně vyšší než zjištěná v důsledku neúplného záchytu. Našli jsme souvislost výskytu monozygotních dvojčat s nižším maternálním věkem, vyšším počtem oocytů, ovariální stimulací a transferem kvalitních blastocyst.Klíčová slova:
monozygotní – dvojčata – monochoriální – asistovaná reprodukceÚvod
Techniky asistované reprodukce (AR) jsou široce používány po celém světě a jsou velmi úspěšné při léčbě neplodnosti. I přes velkou úspěšnost a široké použití AR přetrvávají obavy týkající se bezpečnosti, hlavně pokud jde o zvýšení podílu mnohočetných gravidit. Většina vícečetných těhotenství po AR jsou dizygotní, spojená s přenosem více embryí. Dvojčata jsou klasifikována jako dizygotní (DZD) pokud vznikají ze dvou individuálních embryí (různý genotyp). Mnoho publikací naznačuje zvýšení monozygotních dvojčat (MZD) v souvislosti s technikami AR. MZD vznikají oddělením buněk jednoho embrya (stejný genotyp), které zformují dvě nebo několik skupin. MZD se dále klasifikují podle chorionicity a amnionicity, které jsou dány stadiem vývoje, ve kterém dojde k rozdělení embrya. Pokud se embryo rozdělí do 4. dne po oplození, vznikají bichoriální biamniální (BCBA) dvojčata neodlišitelná sonograficky od DZD. Pokud dojde k rozdělení mezi 4. a 8. dnem, vznikají dvojčata monochoriální biamniální (MCBA) a při rozdělení po 8. dni vznikají monochoriální monoamniální (MCMA) dvojčata. Rozdělení po 12. dni způsobí vznik spojených (siamských) dvojčat. BCBA tvoří asi 25–30% a MCBA asi 70–75% z MZD těhotenství a MCMA tvoří jen asi 1–2% z živě narozených plodů [1]. Ve srovnání s jednočetnou graviditou mají všechna dvojčetná těhotenství větší riziko nepříznivého ukončení, zejména porodu nezralého plodu.
U spontánních početí bez stimulace se MZD vyskytují vzácně v 0,4–0,45% [2,3]. Případ MZD po in vitro fertilizaci (IVF) byl poprvé publikován v roce 1984 [4]. Uváděná incidence MZD po metodách asistované reprodukce se dnes pohybuje od 0,2–12,5%. Po samotné ovariální stimulaci se udává zvýšená incidence MZD na 1,2–2% [3,5–7]; při kultivaci do blastocysty až na 13% [8–12].
Příčina vzniku MZD není doposud jasná. Mezi faktory související s MZD bývá řazen vyšší věk, odlišná inaktivace X chromozomu a vrozené defekty proteinů zona pellucida (genetické faktory), ovariální stimulace, mikromanipulační metody narušující zonu pellucidu, transfer blastocyst a kultivační podmínky [13].
V této práci jsme se pokusili najít spojitost různých technik používaných v AR s výskytem MZD zpětným zhodnocením všech dostupných dat IVF cyklů prováděných v našem centru v letech 2000–2009.
Materiál a metodika
Předložená práce je retrospektivní studií výskytu monozygotních dvojčat zjištěných od ledna 2000 do srpna 2009 po metodách AR. Stimulace ovarií gonadotropiny probíhala buď v dlouhém protokolu za použití GnRH agonistů, nebo v krátkém protokolu s použitím GnRH antagonistů. Získané oocyty byly oplozovány klasickou inseminací, nebo metodou injekce spermie do vajíčka (ICSI). Kultivace embryí probíhala v sekvenčních médiích Quinn‘s Advantage Medium (SAGE) nebo Sydney IVF Medium (COOK) do dne 5 při 37 °C a v 6% CO2. V případě preimplantační genetické diagnostiky (PGD) byla 3. dne provedena biopsie blastomer embryí v biopsačním médiu (MediCult). Klinická gravidita byla definována jako přítomnost srdeční aktivity vaginální ultrazvukovou sondou v 6.–7. týdnu těhotenství, kdy byl také hodnocen počet gestačních váčků a plodů. Kritériem pro klasifikaci dvojčat jako monozygotních bylo ultrasonografické zjištění společného choria nebo přítomnost většího počtu implantovaných embryí, než bylo transferováno.
Výsledky
Z 1 255 gravidit bylo zjištěno 25 (1,99%) monozygotních dvojčat. Ve všech případech se jednalo o transfer embryí po pětidenní kultivaci bez kryokonzervace. Mezi transferovanými embryi převažovaly ve skupině monozygotních dvojčat expandované a hatchující blastocysty (tab. 1). Oproti celému souboru pacientek byl v této skupině zjištěn nižší věk pacientek (29,5 vs 32,4) a vyšší počet získaných oocytů (16,9 vs 14,9). Během posledních tří let byla zaznamenána mírně vzrůstající tendence v počtu zjištěných MZD na graviditu, a to 2,8% (rok 2007), 3,33% (rok 2008) a 3,39% (leden až srpen 2009). Monochoriální dvojčata byla zjištěna po oplození bez mikromanipulace (5×), po PGD (3×) i u darování oocytů (4×). Po kryoembryotransferu a po transferu embryí 3. den jsme nezaznamenali žádné MZD. Všechna zjištěná MZD byla kultivována v médiích SAGE, více jich bylo zaznamenáno po stimulaci v dlouhém protokolu a po transferu blastocyst. Nezjistili jsme zvýšený výskyt MZD při použití mikromanipulačních technik ICSI a PGD (tab. 2). Ve čtyřech případech se jednalo o dvojčetné těhotenství, ve dvaceti případech o trojčetné a v jednom o čtyřčetné těhotenství. U pěti pacientek (devět plodů) došlo ke spontánní redukci monozygotních těhotenství na jednočetná. U jedenácti pacientek byla provedena fetoredukce buď obou monozygotních zárodků, nebo třetího samostatného zárodku. Zredukováno bylo 20 plodů. Celkem v šesti případech došlo k samovolnému potratu všech plodů (11 zárodků), z toho dvakrát po provedené fetoredukci. Z porozených plodů bylo 20 ženského a 11 mužského pohlaví (6× ženská MZD, 2× mužská MZD). Porod u vícečetných těhotenství proběhl dříve než porod jednoho plodu, dřívějšímu termínu porodu také odpovídala nižší porodní hmotnost dětí z vícečetných těhotenství (tab. 3). Jeden plod zemřel po porodu a jeden plod byl porozen mrtvý. U tohoto plodu byl zjištěn aberantní karyotyp [14].
Tab. 1. Vývojová stadia embryí transferovaných v případech MZD. 
Tab. 2. Výskyt MZD při použití různých technik AR. 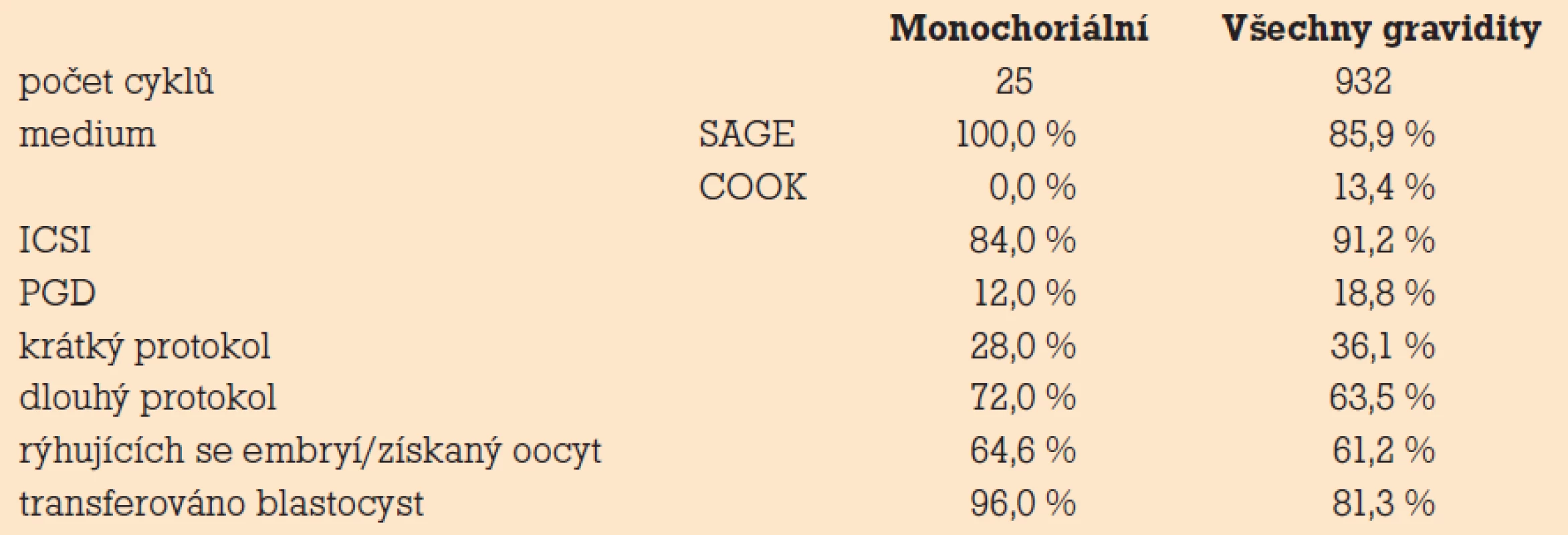
Tab. 3. Termín porodu a porodní hmotnost v případech MZD. 
Diskuze
Během daného období jsme zjistili 1,99% monochoriálních dvojčat v našem souboru, což odpovídá obecně uváděné zvýšené incidenci po metodách AR oproti spontánním těhotenstvím. Ve všech případech MZD byla transferována embrya 5. dne bez předchozí kryokonzervace, převažovala stadia expandované a hatchující blastocysty. Všechna embrya, ze kterých vznikla MZD, byla kultivována v sekvenčních médiích SAGE. Překvapivě málo se ví o mechanizmech vzniku nebo o rizikových faktorech působících v časném embryonálním vývoji, které dávají vznik MZD.
Transfer blastocyst obecně zlepšuje pregnancy rate (PR) ve srovnání s transferem buněčných embryí [15,16], nicméně mnoho prací předpokládá, že transfer blastocyst pravděpodobně zvyšuje incidenci MZD [10–12,17–21]. Steinman předpokládá, že delší expozice blastocyst nižším koncentracím kalcia v kultivačním prostředí predisponuje embryoblast k rozdělení destabilizací mezibuněčných vazeb [22]. Menezo a Sakkas zase předpokládají vliv větší koncentrace glukózy v sekvenčních médiích, která vede ke vzniku většího množství volných radikálů indukujících selektivní apoptózu vedoucí k oddělení embryoblastu a vzniku MZD [23]. Prodloužená kultivace v suboptimálních podmínkách může způsobit metabolický stres zeslabující buněčné adheze a přerušující komunikaci mezi blastomerami. To vede k formování dvou oddělených embryoblastů a zvýšení incidence MZD [12]. Chida již v roce 1990 publikoval přítomnost dvou oddělených embryoblastů ještě před hatchingem v 0,6 a 3,1% pro in vivo a in vitro oplozovaná myší embrya [24]. Meintjes et al publikovali trojčetné těhotenství po transferu dvou blastocyst, z toho jedna měla dva oddělené embryoblasty [25]. Dále Payne et al publikovali u dvou embryí z 26 dvě oddělené oblasti embryoblastu [26]. Většina autorů předpokládá vznik druhé oblasti embryoblastu ektopickou adhezí a následnou proliferací buněk embryoblastu na opačnou stranu trofektodermové stěny, následující blastocélový kolaps s následnou reexpanzí blastocysty [27–29]. Dále se také uvažuje potenciální vliv zony pellucidy (ZP) při hatchingu (mechanické rozdělení, přerušení embryoblastu) na výskyt MZD. Některými autory bylo pozorováno spontánní rozdělení na dvě kompletní embrya během hatchingu in vitro [28,29]. Nedá se předpokládat, že jde o exkluzivní mechanizmus vzniku MZD, jelikož i po transferu blastocyst bez ZP byl zjištěn výskyt MZD [30,31].
Pokud jde o věk matky, dřívější práce uváděly vyšší riziko MZD u žen s věkem nad 35 let [22,32]. My jsme naopak zjistili vyšší incidenci u mladších žen, což je ve shodě s prací Knopman et al, kde byla zjištěna vyšší incidence MZD u žen pod 35 let (3,1%) v programu darování oocytů (3,3%) a při prodloužené kultivaci (2,6%) [33]. V této práci také ve shodě s našimi výsledky nebyla nalezena vyšší incidence MZD při použití mikromanipulačních technik. Existují publikace udávající vyšší riziko MZD po užití mikromanipulačních technik [18,32,34–36], ale i práce, které nenalezly asociaci mezi vyšším výskytem MZD a mikromanipulačními technikami [7,11,12,37,38]. Nezaznamenali jsme zvýšený výskyt MZD ani po PGD. Stejně tak Verpoest et al uvádí incidenci MZD po PGD 1,5% a bez PGD 2,1% [13]. Naopak Haimov-Kochman et al zjistili vyšší výskyt MZD na těhotenství po PGD 7,7% oproti cyklům bez PGD 0,48% MZD [39].
Vícečetná těhotenství jsou charakteristická zvýšeným výskytem jak fetálních, tak maternálních komplikací. Fetální komplikace zahrnují opožděný vývoj, zvýšený výskyt fetálních ztrát, vyšší výskyt vrozených vývojových vad, předčasný porod (nezralost plodů a z ní vyplývající morbidita plodů) i perinatální ztráty. Matky s vícečetným těhotenstvím trpí častěji těhotenskou nevolností a zvracením, hypertenzí a preeklampsií [40]. Placentální uspořádání je důležitý faktor ovlivňující jak výsledek MZD těhotenství, tak výskyt komplikací závisejících převážně na stupni placentálního sdílení. MZD mohou mít od kompletně odděleného amnia a choria po jedno amnion i chorion sdílené oběma plody. Výskyt fetálních komplikací je podobný u DZD a bichoriálních MZD, avšak těhotenství s monochoriálními dvojčaty jsou náchylná k dalším komplikacím. Většina monochoriálních dvojčat má cévní anastomózy a sdílení krevního zásobování může způsobit twin to twin transfusion syndrom. Výskyt syndromu je uváděn v 10–20% monochoriálních těhotenství [41]. Podmínky charakterizované nerovnoměrným sdílením maternálního krevního zásobení končí nerovnoměrným fetálním růstem a fetální mortalitou v 80 i více% neléčených případů [42]. MCMA těhotenství přinášejí také vyšší riziko pupečníkových uzlů [43]. Rizika spojená s monochoriálními dvojčaty ve vícečetném těhotenství jsou tak vysoká, že jsme v případě nálezu tří a více plodů u našich pacientů vždy doporučovali provedení fetoredukce [44].
Závěr
Dokumentovaná incidence MZD v asistované reprodukci je čtyřikrát vyšší než po spontánní koncepci. Skutečná incidence MZD je pravděpodobně ještě vyšší, jelikož sonograficky nejsou zjištěna BCBA MZD, která tvoří čtvrtinu i více případů spontánních MZD. Vznik MZD bude pravděpodobně spojen s více faktory, jako jsou embryonální vývoj nebo implantace, mechanické rozdělení časného embrya i změny v kultivačních podmínkách. Ve skutečnosti je zřejmě zapojena kombinace faktorů, některé faktory jsou pravděpodobně důležitější. Nelze vyloučit genetické faktory spojené s rodinným výskytem a predispozicí k MZD [45]. V našem souboru jsme našli souvislost výskytu monozygotních dvojčat s nižším maternálním věkem, vyšším počtem získaných oocytů, typem ovariální stimulace a transferem blastocyst ve srovnání s transferem méně pokročilých stadií.
Doručeno do redakce: 16. 9. 2010
Přijato po recenzi: 30. 9. 2010
RNDr. Eva Oráčová, Ph.D.1,2
prof. MUDr. Pavel Trávník, DrSc.1
Mgr. Gabriela Tauwinklová1
MUDr. Kateřina Veselá, Ph.D.1
MUDr. Lenka Hromadová1
MUDr. Jan Veselý, CSc.1
1Sanatorium REPROMEDA s.r.o., Brno
2Výzkumný ústav veterinárního lékařství, v.v.i., Brno
eoracova@repromeda.cz
Zdroje
1. Hall JG. Twinning. Lancet 2003; 362(9385): 735–743.
2. MacGillivray I. Epidemiology of twin pregnancy. Seminars in Perinatology 1986. 10 : 4–8.
3. Derom C, Vlietinck R, Derom R et al. Increased monozygotic twinning rate after ovulation induction. Lancet 1987; 1(8544): 1236–1238.
4. Yovich JL, Stanger JD, Grauaug A et al. Monozygotic twins from in vitro fertilization. Fertil Steril 1984; 41(6): 833–837.
5. Alikani M, Cekleniak NA, Walters E et al. Monozygotic twinning following assisted conception: an analysis of 81 consecutive cases. Hum Reprod 2003; 18(9): 1937–1943.
6. Derom C, Leroy F, Vlietinck R et al. High frequency of iatrogenic monozygotic twins with administration of clomiphene citrate and a change in chorionicity. Fertil Steril 2006; 85(3): 755–757.
7. Schachter M, Raziel A, Friedler S et al. Monozygotic twinning after assisted reproductive techniques: a phenomenon independent of micromanipulation. Hum Reprod 2001; 16(6): 1264–1269.
8. Sheiner E, Har-Vardi I, Potashnik G. The potential association between blastocyst transfer and monozygotic twinning. Fertil Steril 2001; 75(1): 217–218.
9. Jain JK, Boostanfar R, Slater CC et al. Monozygotic twins and triplets in association with blastocyst transfer. J Assist Reprod Genet 2004; 21(4): 103–107.
10. Wright V, Schieve LA, Vahratian A et al. Monozygotic twinning associated with day 5 embryo transfer in pregnancies conceived after IVF. Hum Reprod 2004; 19(8): 1831–1836.
11. Behr B, Fisch JD, Racowsky C et al. Blastocyst-ET and monozygotic twinning. J Assist Reprod Genet 2000; 17(6): 349–351.
12. Milki AA, Jun SH, Hinckley MD et al. Incidence of monozygotic twinning with blastocyst transfer compared to cleavage-stage transfer. Fertil Steril 2003; 79(3): 503–506.
13. Verpoest W, Van Landuyt L, Desmyttere S et al. The incidence of monozygotic twinning following PGD is not increased. Hum Reprod 2009; 24(11): 2945–2950.
14. Tauwinklova G, Gaillyova R, Travnik P et al. Monozygotic twins with discordant karyotypes following preimplantation genetic screening and single embryo transfer: case report. J Assist Reprod Genet 2010. [Epub ahead of print]
15. Wilson M, Hartke K, Kiehl M et al. Integration of blastocyst transfer for all patients. Fertil Steril 2002; 77(4): 693–696.
16. Papanikolaou EG, Camus M, Kolibianakis EM et al. In vitro fertilization with single blastocyst-stage versus single cleavage-stage embryos. N Engl J Med 2006; 354(11): 1139–1146.
17. Moayeri SE, Behr B, Lathi RB et al. Risk of monozygotic twinning with blastocyst transfer decreases over time: an 8-year experience. Fertil Steril 2007; 87(5): 1028–1032.
18. Skiadas CC, Missmer SA, Benson CB et al. Risk factors associated with pregnancies containing a monochorionic pair following assisted reproductive technologies. Hum Reprod 2008; 23(6): 1366–1371.
19. Sharara FI, Abdo G. Incidence of monozygotic twins in blastocyst and cleavage stage assisted reproductive technology cycles. Fertil Steril 2010; 93(2): 642–645.
20. Chang HJ, Lee JR, Jee BC et al. Impact of blastocyst transfer on offspring sex ratio and the monozygotic twinning rate: a systematic review and meta-analysis. Fertil Steril 2009; 91(6): 2381–2390.
21. Vitthala S, Gelbaya TA, Brison DR et al. The risk of monozygotic twins after assisted reproductive technology: a systematic review and meta-analysis.. Hum Reprod Update 2009; 15(1): 45–55. Review.
22. Steinman G. Mechanisms of twinning. II. Laterality and intracellular bonding in monozygotic twinning in in vitro fertilization. J Reprod Med 2001; 46 : 473–479.
23. Ménézo YJ, Sakkas D. Monozygotic twinning: is it related to apoptosis in the embryo? Hum Reprod 2002; 17(1): 247–248.
24. Chida S. Monozygous double inner cell masses in mouse blastocysts following fertilization in vitro and in vivo. J In Vitro Fert Embryo Transf 1990; 7(3): 177–179.
25. Meintjes M, Guerami AR, Rodriguez JA et al. Prospective identification of an in vitro-assisted monozygotic pregnancy based on a double-inner-cell-mass blastocyst. Fertil Steril 2001; 76: S172–S173.
26. Payne D, Okuda A, Wakatsuki Y et al. Time-lapse recording identifies human blastocysts at risk of producing monozygotic twins. Hum Reprod 2007; 22(Supplement 1): i9–i10.
27. Aston KI, Peterson CM, Carrell DT. Monozygotic twinning associated with assisted reproductive technologies: a review. Reproduction 2008; 136(4): 377–386.
28. Van Langendonckt A, Wyns C, Godin PA et al. Atypical hatching of a human blastocyst leading to monozygotic twinning: a case report. Fertil Steril 2000; 74(5): 1047–1050.
29. Behr B, Milki A.Visualization of atypical hatching of a human blastocyst in vitro forming two identical embryos. Fertil Steril 2003; 80(6): 1502–1503.
30. Frankfurter D, Trimarchi J, Hackett R et al. Monozygotic pregnancies from transfers of zona-free blastocysts. Fertil Steril 2004; 82(2): 483–485.
31. Kawachiya S, Shimada N, Miyauchi O et al. Incidence of monozygotic twinning after single embryo transfers. Hum Reprod 2008; 23(Suppl 1): i47.
32. Abusheikha N, Salha O, Sharma V et al. Monozygotic twinning and IVF/ICSI treatment: a report of 11 cases and review of the literature. Hum Reprod Update 2000; 6(4): 396–403.
33. Knopman J, Krey LC, Lee J et al. Monozygotic twinning: an eight-year experience at a large IVF center. Fertil Steril 2010; 94(2): 502–510.
34. Saito H, Tsutsumi O, Noda Y et al. Do assisted reproductive technologies have effects on the demography of monozygotic twinning? Fertil Steril 2000; 74(1): 178–179.
35. Schieve LA, Meikle SF, Peterson HB et al. Does assisted hatching pose a risk formonozygotic twinning in pregnancies conceived through in vitro fertilization? Fertil Steril 2000; 74(2): 288–294.
36. Tarlatzis BC, Qublan HS, Sanopoulou T et al. Increase in the monozygotic twinning rate after intracytoplasmic sperm injection and blastocyst stage embryo transfer. Fertil Steril 2002; 77(1): 196–198.
37. Elizur SE, Levron J, Shrim A et al. Monozygotic twinning is not associated with zona pellucida micromanipulation procedures but increases with high-order multiple pregnancies. Fertil Steril 2004; 82 : 500–501.
38. Yanaihara A, Yorimitsu T, Motoyama H et al. Monozygotic multiple gestation following in vitro fertilization: analysis of seven cases from japan. J Exp Clin Assist Reprod 2007; 4 : 4.
39. Haimov-Kochman R, Daum H, Lossos F et al. Monozygotic multiple gestation after intracytoplasmic sperm injection and preimplantation genetic diagnosis. Fertil Steril 2009; 92(6): 2037.e11–17.
40. Rao A, Sairam S, Shehata H. Obstetric complications of twin pregnancies. Best Practice a Research. Best Pract Res Clin Obstet Gynaecol 2004; 18 : 557–576.
41. Harkness UF, Crombleholme TM. Twin–twin transfusion syndrome: where do we go from here? Seminars in Perinatology 2005; 29(5): 296–304.
42. Fieni S, Gramellini D, Piantelli G et al. Twin-twin transfusion syndrome: a review of treatment option. Acta Bio-Medica 2004; 75 (Suppl 1): 34–39.
43. Dickinson JE. Monoamniotic twin pregnancy: a review of contemporary practice. Aust N Z J Obstet Gynaecol 2005; 45(6): 474–478.
44. Hromadová L, Trávník P, Veselá K et al. Těhotenské ztráty po metodách asistované reprodukce. Prakt Gyn 2009; 13(2): 93–98.
45. Shapiro LR, Zemek L, Schulman MJ. Genetic etiology for monozygotic twinning. Birth Defects Orig Art 1978; series XIV: 219–225.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Úvodní slovoČlánek Borderline ovariální tumory
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2010 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Úvodní slovo
- AFM (Atomic Force Microscopy) zobrazení spermií poškozených oxidačním stresem
- Borderline ovariální tumory
- Elektivní single embryo transfer
- Monozygotní dvojčata v asistované reprodukci
- Muži hovoří o asistované reprodukci
- Postižení kardiovaskulárního systému u žen s Turnerovým syndromem, kardiovaskulární rizika spojená s těhotenstvím
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Borderline ovariální tumory
- Monozygotní dvojčata v asistované reprodukci
- Elektivní single embryo transfer
- Postižení kardiovaskulárního systému u žen s Turnerovým syndromem, kardiovaskulární rizika spojená s těhotenstvím
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



