-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika akutní pyelonefritidy u dětí a význam zobrazovacích metod
Detection of an acute pyelonephritis in children – a value of imaging methods
The aim of this article is to give an overview of imaging methods involved in the diagnosis of acute pyelonephritis and to present possible novel perspectives in accuracy in imaging inflammatory changes of kidneys. Urinary tract infections (UTI) are the second most common childhood disease after inflammatory upper and lower respiratory tract illness. Acute pyelonephritis (APN) is defined by clinical and laboratory characteristics: fever above 38 °C, elevated inflammatory parameters (C-reactive protein, white blood cell count), elevated leukocyte count in urine and positive urine culture. Currently, imaging methods – ultrasound (USG), static renal scintigraphy (DMSA) and magnetic resonance imaging (MRI) – are also used to diagnose inflammatory changes and scars in the kidney parenchyma at present. DMSA scans were found to be more sensitive than USG and have been accepted as a gold standard method for demonstrating acute renal parenchymal inflammatory lesions in the diagnosis of febrile UTI. Gadolinium-enhanced MRI has been found to be reliable in detection of acute pyelonephritic lesions in comparison with DMSA and can discriminate acute pyelonephritis and chronic scarring. In recent prospective study, comparing DMSA and diffusion-weighted magnetic resonance imaging (DWI) in children > 3 years of age with acute pyelonephritis the DWI confirmed acute inflammatory changes in all 31 patients (100 % percent) mostly unilateral, and the DMSA detected inflammatory lesions in 22 children (71 %). The DWI examination was performed without contrast agent and without general anesthesia. Further studies are required to use DWI for selection of patients at risk, particularly young children.
Keywords:
acute pyelonephritis – ultrasound – diffusion-weighted magnetic resonance imaging (DWI) – static renal scintigraphy (DMSA)
Autoři: Alice Bosáková 1; Michal Hladík 1; Radim Kočvara 2; Zdeněk Doležel 3
Působiště autorů: Klinika dětského lékařství, Fakultní nemocnice Ostrava 1; Urologická klinika, Všeobecná fakultní nemocnice Praha 2 2; Pediatrická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno, ČR 3
Vyšlo v časopise: NuklMed 2019;8:22-28
Kategorie: Přehledová práce
Souhrn
Cílem tohoto sdělení je podat přehled zobrazovacích metod podílejících se na diagnostice akutní pyelonefritidy. Infekce močových cest (IMC) je po zánětlivých onemocněních horního a dolního respiračního traktu druhé nejčastěji se vyskytující onemocnění v dětském věku. Akutní pyelonefritida (APN) je definována klinickými a laboratorními změnami: horečka nad 38 °C, zvýšení hodnot CRP, leukocytóza, leukocyturie a signifikantní bakteriurie. V současné době se na diagnostice zánětlivých změn a jizev v parenchymu ledvin podílejí i zobrazovací metody – ultrazvuk (USG), statická scintigrafie ledvin (DMSA) a magnetická rezonance (MRI). DMSA byla přijata jako zlatý standard pro diagnostiku akutních zánětlivých lézí v parenchymu ledvin při APN a byla vyhodnocena jako citlivější metoda než USG. Bylo zjištěno, že MRI s gadoliniem je spolehlivější při detekci akutních pyelonefritických lézí ve srovnání s DMSA a může rozlišit akutní pyelonefritidu a chronickou jizvu. V roce 2018 byla publikována práce, která uvádí, že difúzně vážená magnetická rezonance (DWI) ve 100 % zachytila zánětlivou infiltraci v renálním parenchymu u dětí s APN starších 3 let ve srovnání se 71 % záchytu zánětlivých změn na DMSA. DWI vyšetření bylo provedeno bez kontrastní látky a bez celkové anestézie. U rizikové skupiny dětí do tří let zatím nebylo provedeno srovnání DWI a DMSA, musí být předmětem další studie.
Klíčová slova:
akutní pyelonefritida – ultrazvuk (USG) – difúzně vážená magnetická rezonance (DWI) – statická scintigrafie ledvin (DMSA)
Úvod
IMC se definuje jako přítomnost bakterií v uropoetickém traktu, který je obvykle u zdravého jedince sterilní (s výjimkou asymptomatické bakteriurie). Nejčastěji se IMC manifestuje v kojeneckém věku, a to častěji u chlapců, s narůstajícím věkem dítěte pak významně převládají dívky, což souvisí s anatomií a fyziologií ženského genitálu. 1 V močových cestách mohou být přítomny kromě nejčastěji se vyskytujících bakterií i plísně a viry, které se ale vyskytují vzácněji. Většina mikroorganismů vyvolávajících močové infekce pochází z fekální nebo periuretrální flóry. Mikrobiologicky se na vzniku IMC z uropatogenů uplatňuje obvykle jeden druh bakterie, nejčastěji gramnegativní bakterie – Escherichia coli. Při přítomnosti anatomických či funkčních anomálií se podíl Escherichia coli na vzniku infekce snižuje a rozšiřuje se spektrum jiných močových patogenů (Klebsiella, Enterobacter, Pseudomonas aeruginosa, Proteus mirabilis či Enterococcus faecalis a jiné), stoupá i počet smíšených infekcí. Při nozokomiálních infekcích jsou časté plísně – zejména Candida albicans nebo Aspergillus spp. Predisponovaní k močovým infekcím jsou rovněž pacienti se zavedenými močovými katetry a děti, které jsou pravidelně cévkovány. 1,2
APN – histologicky znamená zánět ledvinného intersticia – je akutní tubulointersticiální nefritida bakteriálního původu s postižením tkáně ledvin a vývodného systému. Infiltrace intersticia polymorfonukleárními leukocyty a uvolnění jejich lytických působků jesou spojeny s poškozením tkáně ledvin a jsou pravděpodobně hlavní příčinou tvorby jizev v parenchymu ledviny. Stupeň postižení ledvin závisí na rozsahu akutního zánětu a tkáňového poškození v prvních 2–5 dnech akutní infekce, infiltraci v parenchymu ledvin lze zjistit již v průběhu několika hodin po začátku infekce. 1,2
Většina APN probíhá jako nekomplikovaná infekce, v některých případech se však mohou vyvinout chronické změny (jizvy v parenchymu). Rozsáhlé pozánětlivé jizvení parenchymu ledvin může vést k destrukci ledviny a v případě oboustranného postižení k postupnému snižování jejich funkce s přechodem do chronické renální insuficience. 1 Tvorba jizev je charakteristická v časném dětském věku při fyziologicky rychlém růstu ledvin 3–5 a snižuje se s rostoucím věkem dítěte.
Akutní i chronická pyelonefritida se často vyskytuje u dětí, u nichž je z různých příčin ovlivněn odtok moče. Nález parenchymových jizev při zobrazování pomocí DMSA s časovým odstupem po APN spolu s detekcí vrozených nebo získaných strukturálních abnormit ledvin a močových cest vyčleňuje rizikovou skupinu dětí, u které může docházet ke snížení ledvinné funkce.
K diagnostice akutních a chronických zánětlivých změn a vrozených vývojových vad uropoetického systému se vedle USG a DMSA uplatňuje i MRI.
Symptomatologie, klinická a laboratorní diagnostika
Febrilní infekce močových cest a ledvin – APN – je definována klinickými a laboratorními charakteristikami: horečka nad 38 °C, třesavka, zvýšení hodnot CRP, leukocytóza, FW vyšší než 25 mm/hod, leukocyturie a signifikantní bakteriurie. Při podezření na močovou infekci je možné urychlit diagnostiku vyšetřením moče diagnostickými papírky. Pozitivní nález nitritů a leukocytové esterázy významně zvyšuje podezření na infekci močových cest. 6
Rozhodující laboratorní ukazatel APN je signifikantní bakteriurie. Posuzování množství mikrobů v 1 ml moče je závislé na způsobu odběru moče. Metodou volby je ve všech věkových skupinách odběr moče ze středního proudu, přesnější alternativou je vyšetření cévkované moče, případně moče získané suprapubickou punkcí.
Sonografické vyšetření
USG je považována za základní neinvazivní zobrazovací metodu k průkazu patologického nálezu uropoetického systému.
USG je využívána již v prenatálním období, následně je používána při vyšetření dětí všech věkových kategorií k diagnostice vrozených vývojových vad či vad získaných.
Dle doporučených postupů Americké pediatrické akademie je vhodné provádět renální ultrasonografii po každé první infekci močových cest u dětí. 7
Pracovní skupina dětské nefrologie při České pediatrické společnosti a Evropská urologie-společnost pro dětskou urologii (EAU/ESPU) 6 doporučuje vyšetření USG ledvin a močového měchýře u každého hospitalizovaného dítěte s podezřením nebo s jasnou APN, a to co nejdříve, event. u ambulantně vyšetřovaného dítěte s podezřením na močovou infekci. U cystitidy nemusí být USG vyšetření provedeno, je doporučeno ho provést při její recidivě.
Součástí USG vyšetření je změření velikosti obou ledvin a porovnání s referenčními hodnotami Dinkelova grafu. V současné době díky vysoké rozlišovací schopnosti sonografických přístrojů je možné i zachycení zánětlivých změn v parenchymu ledviny. Akutní zánětlivé změny v parenchymu ledviny při APN jsou na USG zobrazeny zvětšením ledviny s prosáknutím parenchymu ledviny – změnou echogenity parenchymu ledviny při srovnání s druhou, zdravou ledvinou. V případě oboustranného zánětu jsou ledviny delší a širší při porovnání s referenčními hodnotami, patrny jsou ložiskové nebo difúzní změny v echogenitě parenchymu – hyperechogenní nebo hypoechogenní ložiska. Při APN je zhoršeno rozlišení centrálního echokomplexu až vymizení jeho diferenciace v celé ledvině nebo jen v její části. (Obr. 1, 2) Někdy lze prokázat i absces ledviny. Naopak menší ledvina, která neroste, může být příznakem svrašťující se ledviny.
Obr. 1. USG ledvin: zvětšení levé ledviny se setřením diferenciace centrálního echokomplexu korespondující se zánětlivými změnami v parenchymu ledviny během akutní fáze pyelonefritidy (A) ve srovnání se zdravou pravou ledvinou (B). 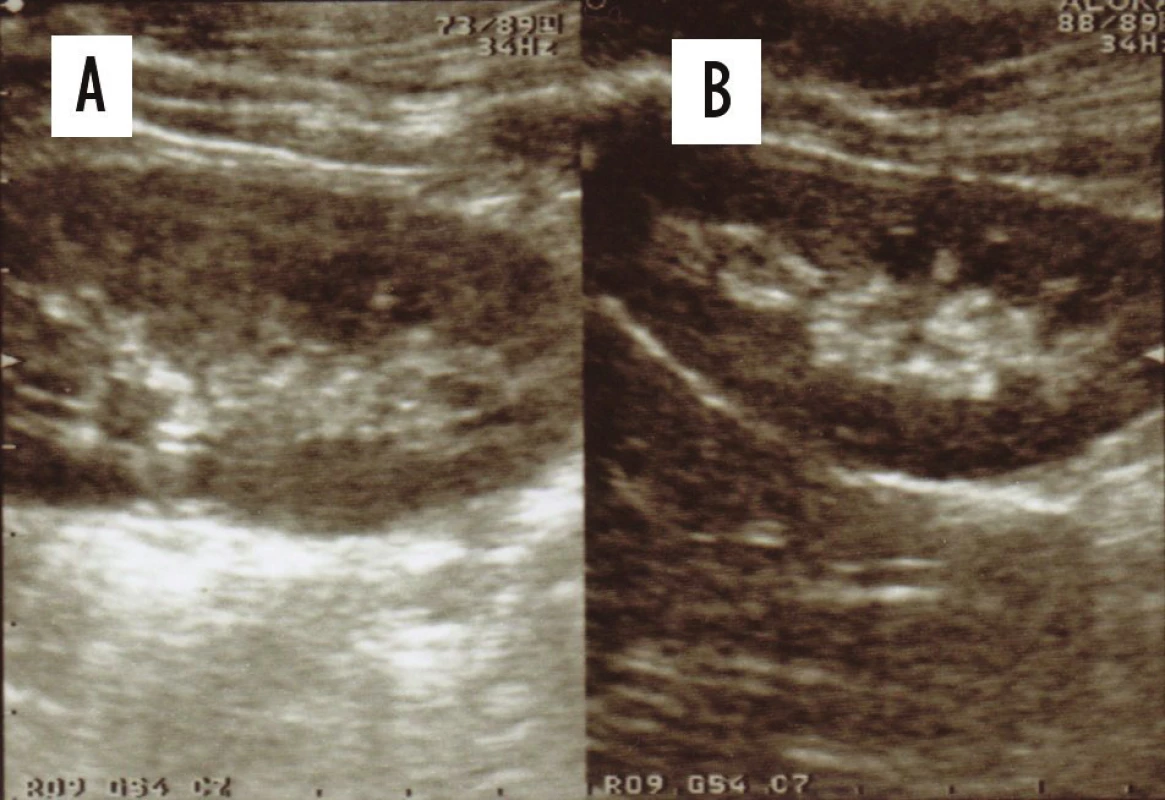
Obr. 2. Akutní pyelonefritida v dolní části ledviny – vymizení centrálního echokomplexu a prosáknutí ledviny v její dolní části. 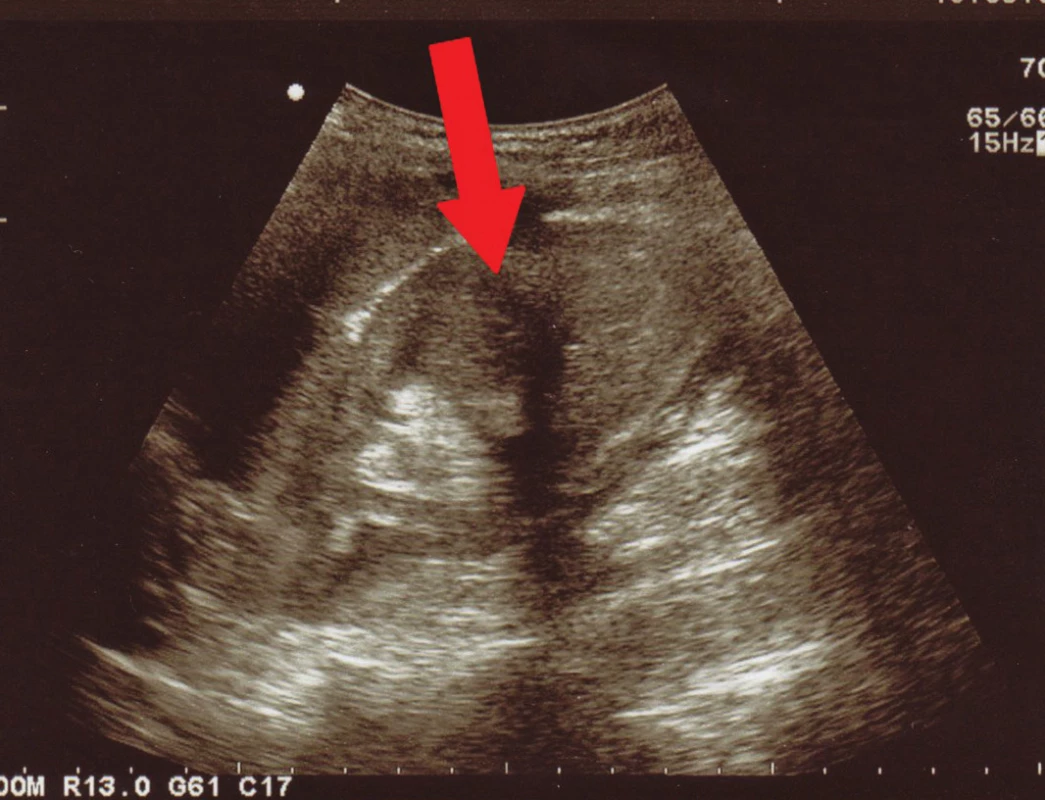
Vyhodnocení zánětlivých změn při APN u kojenců a malých batolat může být zatíženo chybou způsobenou pohybem dítěte, struktura ledvin je rovněž méně přehledná při nedostatečném zavodnění dítěte. Při terapii antibiotiky dochází postupně ke zmenšování zánětlivé infiltrace v parenchymu ledviny, čímž je zhoršen i průkaz zánětu při USG vyšetření.
Statická scintigrafie ledvin
DMSA je radionuklidové vyšetření, které slouží k zobrazení funkčního renálního parenchymu a k průkazu jeho kvalitativního i kvantitativního poškození.
Hlavními indikacemi k vyšetření je průkaz tvarových anomálií ledvin, detekce ektopického uložení ledvin, zhodnocení separované funkce ledvin, průkaz hypofunkce až afunkce a diagnostika akutní pyelonefritidy.
Statická scintigrafie ledvin s použitím radiofarmaka 99mTc-dimerkaptosukcinylové kyseliny prokazuje zánětlivé změny v parenchymu ledviny v akutní fázi pyelonefritidy, s časovým odstupem po akutní epizodě detekuje případné postpyelonefritické jizvy v renálním parenchymu.
V průběhu vyšetření je radiofarmakum kumulováno v parenchymu ledviny, maxima dosahuje za 2–6 hod. po aplikaci, radiační dávka se pohybuje přibližně kolem 1 mSv. 8 V případě ložiskových i difúzních patologických procesů bývá homogenita distribuce radiofarmaka narušena a projeví se jako defekt akumulace radiofarmaka v parenchymu ledviny (Obr. 3), na rozdíl od fyziologického nálezu s pravidelným rozložením radiofarmaka. (Obr. 4) Významný je průkaz poruchy funkce ledvin v časovém odstupu po akutním zánětu ledvin, včetně průkazu postpyelonefritických jizev v ledvinném parenchymu. (Obr. 5)
Obr. 3. DMSA: ložiskové snížení akumulace radiofarmaka v parenchymu levé ledviny korespondující se zánětlivými změnami při APN. Vyšetření provedeno 4. den od stanovení dg. APN. 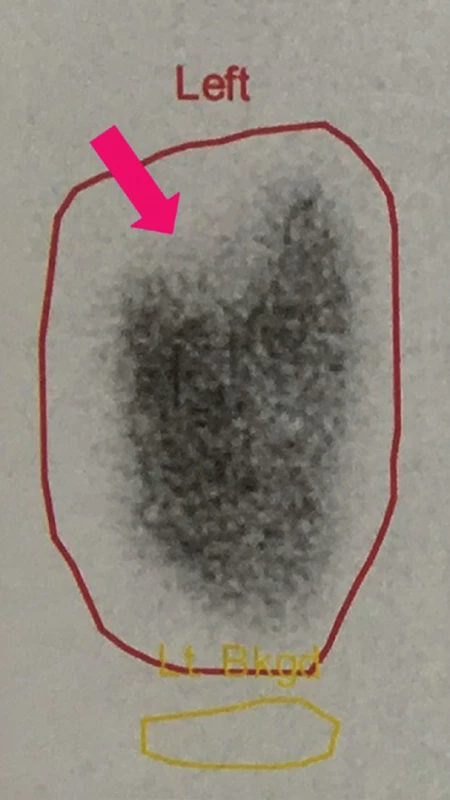
Obr. 4. DMSA: fyziologický nález. 
Obr. 5. DMSA: jizva v parenchymu levé ledviny při kontrolním vyšetření po 6 měsících. 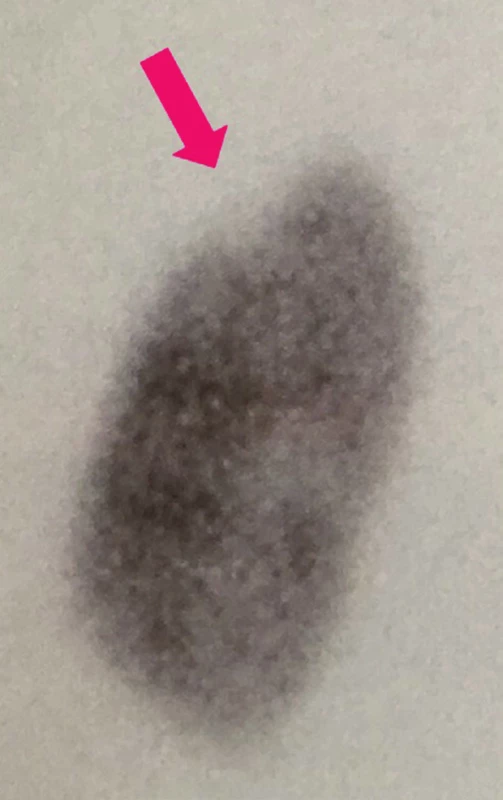
Změny distribuce radiofarmaka v parenchymu ledviny při vyšetření DMSA v akutní fázi APN byly poprvé popsány již v roce 1972. 9,10 Experimentální studie prokázaly, že DMSA, pokud je přímo srovnávána s histopatologií, je velmi spolehlivá pro detekci a lokalizaci zánětlivých změn v parenchymu ledvin u APN. 11 Akutní parenchymové změny byly popsány u 50–91 % pacientů s APN. 12,13 Nález na DMSA je pozitivní v počáteční fázi zánětlivé odpovědi v důsledku ischémie tkáně. Akutní zánětlivé změny v parenchymu jsou reverzibilní a ve většině případů nevedou k jizvení ledvin. 12,14,15 DMSA se považuje za citlivější metodu než USG a počítačová tomografie (CT), 15 proto byla přijata jako „zlatý standard“ k průkazu akutních zánětlivých změn v parenchymu ledvin při diagnostice APN. 16
V případě negativního nálezu akutních parenchymových změn na DMSA není nutno indikovat další zobrazovací metody (zejména invazivní mikční cystouretrografii – tzv. Top Down přístup) ani kontrolní statickou scintigrafii ledvin. 17 V případě pozitivního nálezu na DMSA v akutní fázi APN je dle současných doporučených postupů indikována u dětí kontrolní DMSA po 6 měsících po proběhlé APN k detekci jizev. 18,19 Nevýhodou DMSA je intravenózní aplikace radiofarmaka, výsledky mohou být ovlivněny i neklidem dítěte během vyšetření.
Magnetická rezonance
MRI s kontrastní látkou (gadolinium) byla popsána jako spolehlivější metoda při diagnostice akutních zánětlivých pyelonefritických změn v parenchymu ledvin ve srovnání s DMSA. 20,21 Výsledek zobrazení MRI je v mnoha ohledech přesnější než CT. MRI může nahradit některé invazivní metody používané k diagnostice vrozených vývojových vad. Výhodou metody je možnost zvýraznit některé struktury kontrastní látkou k průkazu anatomických a funkčních změn uropoetického systému. Vyšetření není spojeno s radiační zátěží.
V roce 1985 byla popsána speciální metoda difúzně vážená magnetická rezonance (DWI), která je založena na detekci molekulárních vibrací způsobených difúzí. Volný pohyb protonů je snížen v přítomnosti zánětu, difúze je narušena, což se projeví na snímku změnou v postižené oblasti (hypersignální léze). 22 Vyšetření je možno provádět nativně bez podání kontrastní látky. DWI se stala standardem v onkologii a v dalších oborech k diagnostice a vyšetření funkce tkáně v různých orgánech včetně mozku, chrupavky a jater. 22 DWI byla použita k identifikaci abnormálních střevních segmentů a posouzení aktivity zánětlivých střevních onemocnění. 23 Zánětlivé léze ledvin se projevují na DWI skenech jako bodové, nepravidelné nebo klínovité oblasti restrikce difúze různých velikostí (jako hypersignální léze) (Obr. 6) a na mapě ADC (apparent diffusion coefficient) jako léze s nízkou intenzitou signálu. 24 Fyziologický nález DWI je na Obr. 7
Obr. 6. DW-MRI: víceložiskové zánětlivé změny v parenchymu ledviny v akutní fázi pyelonefritidy (světlé–bílé hypersignální oblasti). 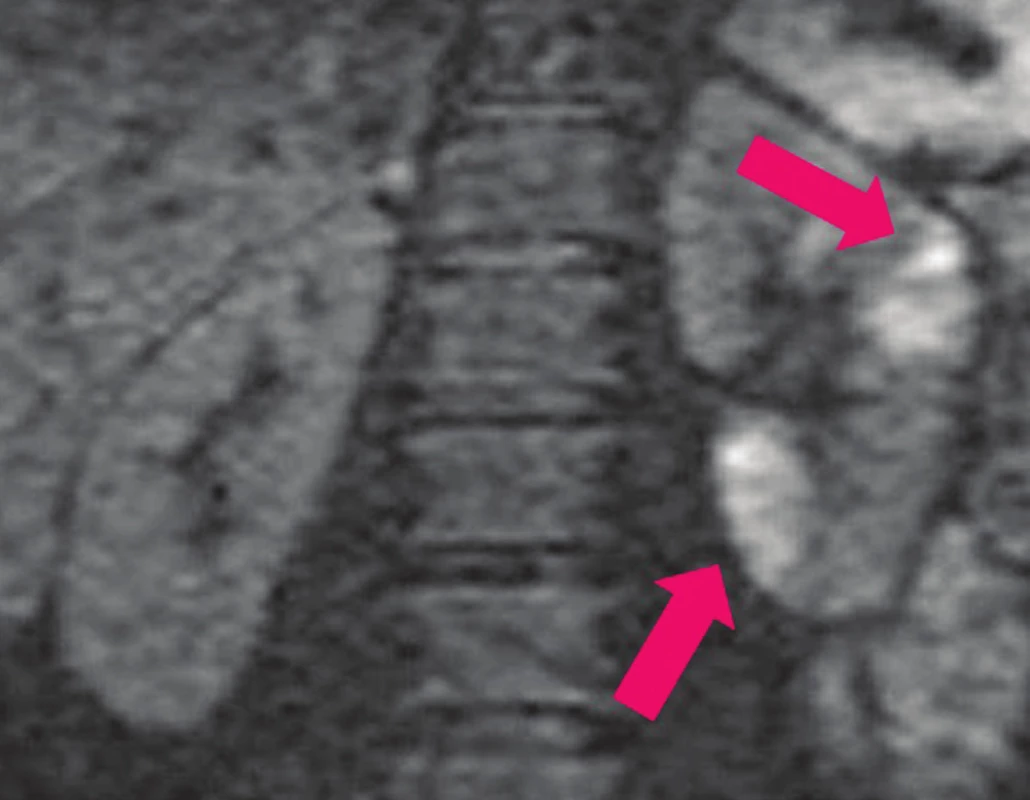
Obr. 7. DW-MRI: fyziologický – negativní nález. 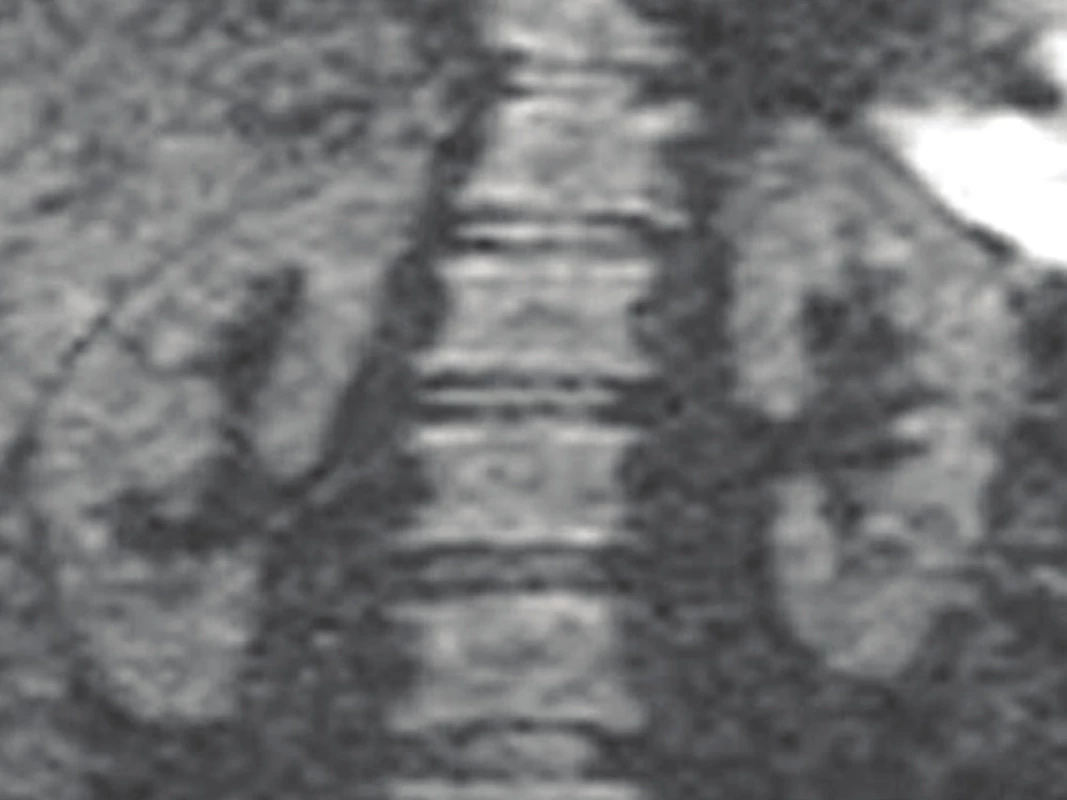
V roce 2004 byla popsána metoda DWI umožňující posuzovat normální renální parenchym a odchylky od normy u různých onemocnění ledvin (hydronefróza, jednoduché renální cysty, benigní a maligní nádory). 25 V roce 2013 a následujících letech byla metoda DWI použita k diagnostice akutních zánětlivých lézí v renálním parenchymu. Tato metoda prokázala srovnatelné výsledky s MRI s aplikací kontrastní látky a prokázala rovněž vyšší citlivost než CT bez kontrastu nebo s kontrastem. 24,26-28 Renální atrofie a jizvy byly definovány jako fokální defekt nebo zúžení parenchymu na DWI. 3,19 (Obr. 8)
#555677
Srovnání zobrazovacích metod
Dle dostupných literárních údajů má USG vyšetření nízkou senzitivitu pro detekci akutních zánětlivých změn v parenchymu ledvin ve srovnání s DMSA. Rozsah senzitivity USG je uváděn mezi 5–47 %.
Cílem naší studie publikované v roce 2018 19 bylo sledování akutních a chronických změn v parenchymu ledvin u APN při USG vyšetření, planární DMSA a DWI. Do souboru 31 dětí byly zařazeny děti s první atakou APN bez předchozího zjištění vrozené vývojové vady urotraktu či jiné patologie. Při USG vyšetření byly zaznamenány zánětlivé infiltrace u 26 dětí z 31 vyšetřených. Častěji se vyskytovaly v levé ledvině (13 dětí) než v pravé ledvině (11 dětí), oboustranně byl zánět zachycen u 2 dětí, u 5 dětí byl USG nález negativní. Kontrolní USG vyšetření bylo provedeno za 6 měsíců po akutní fázi. Při kontrolním vyšetření byly nalezeny jizvy u 4 dětí (u 2 dětí v pravé a u 2 dětí v levé ledvině), u 1 dítěte nebylo vyšetření provedeno a zbývajících 26 dětí mělo negativní nález. Shoda prvního a kontrolního USG nálezu byla zjištěna u 2/31 dětí.
Dále byly vyhodnoceny akutní změny v ledvinné tkáni v průběhu APN při vyšetření DWI bez použití kontrastní látky a výsledky byly porovnány s výsledky planární DMSA (nepublikovaná data). DWI detekovala akutní zánětlivé změny u všech pacientů (100 %). 25 dětí mělo jednostranné změny (11 vlevo, 14 vpravo) a 6 dětí mělo oboustranné změny. Záchyt zánětlivých změn při vyšetření DMSA byl prokázán u 22/31 dětí (71 %) v akutní fázi APN.
Citlivost pro detekci akutních zánětlivých lézí byla tedy 71 % pro DMSA a 100 % pro DWI. Na základě McNemarova testu byl rozdíl statisticky významný (p = 0,002). Vícečetné léze byly častěji pozorovány u DWI (v 84 %) oproti DMSA (ve 40 %) a výskyt oboustranných lézí byl podobný. Tyto výsledky vedly k závěru, že DWI je citlivější metodou pro diagnostiku APN a vykazuje větší rozsah lézí než DMSA.
MRI byla také použita ke kontrolnímu vyšetření vývoje ledvinné atrofie a zjizvení. Kavanagh a kol. 3 zjistili, že MRI s využitím T1 vážených sekvencí je rychlá, přesná a neinvazivní metoda pro hodnocení renálních jizev po první epizodě febrilní infekce močových cest ve srovnání s DMSA. Do studie bylo zařazeno 37 dětí. 10 z nich mělo jizvy na MRI a na DMSA, 3 děti měly jizvy na DMSA, ale ne na MRI a 3 měly jizvy na MRI, ale ne na DMSA. 3 Vyšší výskyt jizev lze vysvětlit kratší dobou mezi febrilní infekcí močových cest a radiologickým hodnocením (průměr 4 měsíce) místo doporučených 6 měsíců. 7,9,28,29 Dle studie Bosákové a kol. 19 byl sledován záchyt jizev jak na DWI, tak na DMSA s odstupem 6 měsíců po APN. Výsledky byly porovnány a byl hodnocen jejich vztah k akutním lézím. Na rozdíl od akutních lézí byla frekvence jizev u vyšetřených dětí podobně nízká na DWI i na DMSA – 5 pacientů. Celkový počet jizev byl v 7 případech z 31 sledovaných dětí, 5krát na DWI a 5krát na DMSA, u 3 dětí byla shoda – měly jizvy na DWI i na DMSA. Anatomická lokalizace zánětlivých změn byla shodná na DWI i na DMSA a lokalizace jizev odpovídala původním akutním lézím na DWI i na DMSA. Nižší výskyt jizev mohl být ovlivněn vyšším věkem pacientů (3–18 let, průměrně 11,5 let), ve kterém je renální parenchym odolnější vůči tvorbě jizev. 30
Výhoda vyšetření DWI spočívá v tom, že se provádí bez kontrastní látky a není spojena s radiační zátěží, která je přítomna při vyšetření DMSA s dávkou kolem 1 mSv v závislosti na aplikované aktivitě radiofarmaka. 3,13 Vyšetření DWI trvá 8–10 minut a lze je provádět bez celkové anestézie u dětí starších 3 let. Ložiska zánětu jsou při DWI přesně určena včetně jejich rozsahu. Nevýhodou DWI je vyšší cena než DMSA (2,5krát).
Nedostatkem DMSA je ionizující záření, špatná vizualizace kalichopánvičkové anatomie a omezená specificita, což podporuje hledání alternativních diagnostických technik. 8,9,29
Výsledky práce Bosákové a kol. 19 ukázaly, že DWI je citlivější metodou pro detekci akutních lézí renálního parenchymu při první atace akutní pyelonefritidy. (Obr. 9, 10) Nálezy mohou být limitovány věkem pacientů (všichni probandi byli starší než 3 roky).
#555695
Obr. 8. Negativní DMSA (A) a četná zánětlivá ložiska na DW-MRI (B) v akutní fázi. 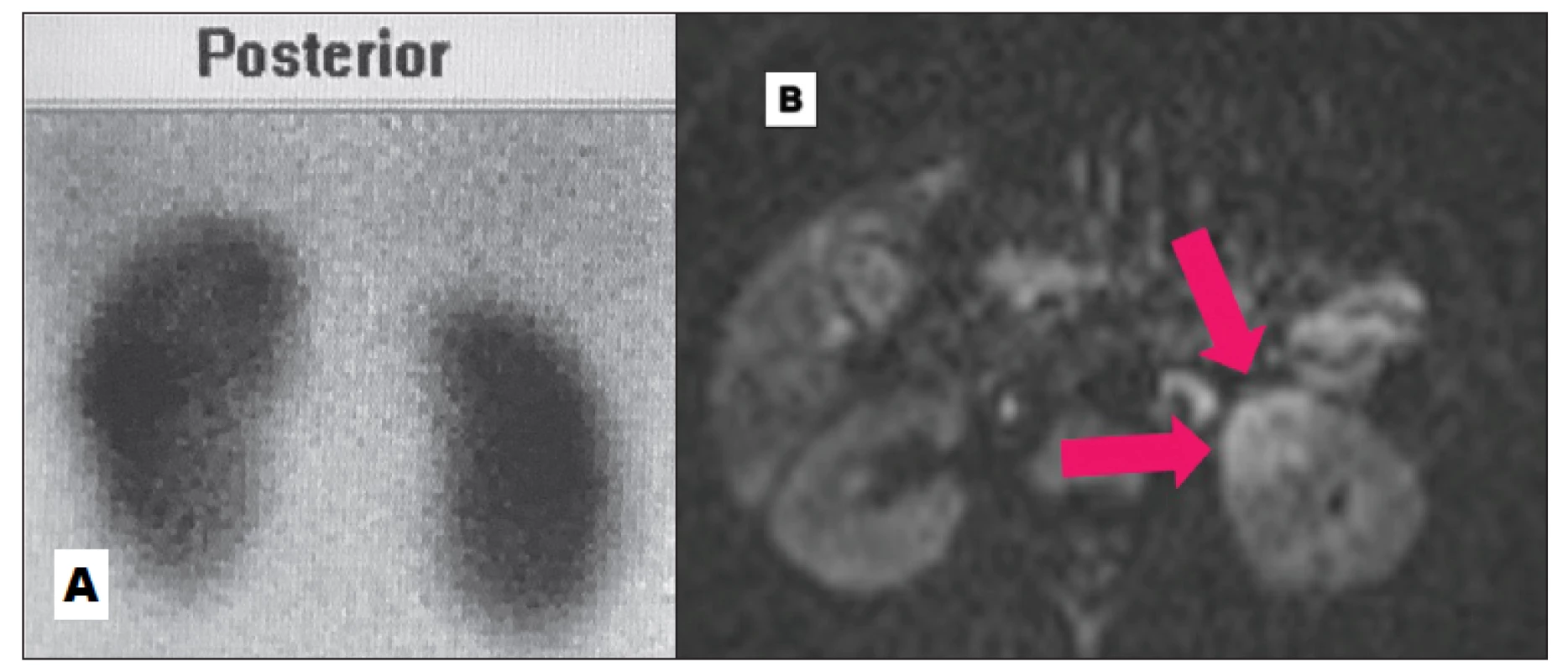
Hlavní otázkou tedy zůstává, jak rozlišit akutní léze, které se rozvinou do jizvy, a jak je možno tomuto procesu zabránit. Zatím není známa odpověď a to je i důvod, proč provedení DMSA není doporučeno během akutní fáze u pacientů s první atakou APN v rutinní praxi. 18 Na druhé straně abnormální nálezy na DMSA byly spojeny s vysokým stupněm vezikoureterálního refluxu, což vedlo k výše zmíněnému Top-Down přístupu. 17,31,32
Závěr
USG je rychlá, levná, bezpečná a snadno dostupná zobrazovací metoda. Diagnostika APN však vyžaduje velké zkušenosti a praxi vyšetřující osoby a je negativně ovlivněna možným pohybem a nespoluprací dítěte, struktura ledvin je rovněž méně přehledná při nedostatečném zavodnění dítěte. Dle dostupných literárních údajů má USG nízkou senzitivitu pro detekci akutních zánětlivých změn v parenchymu ledvin ve srovnání s DMSA.
Zlatým standardem k průkazu akutních zánětlivých změn v parenchymu ledvin při diagnostice APN je dosud DMSA, která je zatížena radiační zátěží a ve srovnání s DWI poskytuje méně zřetelnou vizualizaci kalichopánvičkové anatomie. DWI je však dražší než DMSA. Parametry DMSA může také zlepšit jiná metoda snímání (použití pin-hole kolimátoru nebo SPECT), která může zachytit více parenchymových lézí než snímání planární. 13,33
DWI umožňuje rychlé nekontrastní zobrazování akutních zánětlivých lézí v renálním parenchymu s vyšší citlivostí než DMSA bez nutnosti anestézie u dětí starších 3 let. Přispívá k potvrzení diagnózy APN v klinicky nejasných případech a poskytuje přesnější informace o rozsahu akutního parenchymového postižení. V tomto případě může DWI nahradit DMSA.
Trvalé jizvy renálního parenchymu vznikají především v kojeneckém a batolecím věku, méně často u starších dětí. U rizikové skupiny dětí do tří let zatím nebylo provedeno srovnání DWI a DMSA, posouzení parametrů DWI v této věkové skupině musí být předmětem další studie. U této věkové kategorie je třeba počítat s nutností sedace nebo anestézie.
K praktickému využití DWI budou nutné další studie k výběru rizikových pacientů, tj. k rozlišení, které akutní léze se stanou klinicky významnými a rozvinou se do jizvy.
Poděkování kolegům, kteří se podíleli na vyšetřování dětí na odborných pracovištích. Děkuji panu doc. MUDr. Hladíkovi, Ph.D., panu doc. MUDr. Kočvarovi, CSc., FEAPU a panu prof. Doleželovi, CSc. za odbornou pomoc při přípravě publikace.
Obr. 1 a 2 – archiv autora, obr. 3–10 – archiv zdravotnického zařízení.
Zdroje
- Dzúrik R, Šašinka M, Mydlík M et al. Nefrológia.Vyd 1. Bratislava, Herba, 2004, 877 p
- Tesař V, Schück O. Klinická nefrologie 1. vyd. Praha, Grada, 2006, 650 p
- Kavanagh EC, Ryan S, Awan A et al. Can MRI replace DMSA in the detection of renal parenchymal defects in children with urinary tract infections? Pediatr Radiol 2005 : 35;275-281
- Glauser MP, Meylan P, Bille J. The inflammatory response and tissue damage. The example of renal scars following acute renal infection. Pediatr Nephrol 1987 : 1;615-622
- Piepsz A, Blaufox MD, Gordon I et al. Consensus on renal cortical scintigraphy in children with urinary tract infection. Scientific Committee of Radionuclides in Nephrourology. Semin Nucl Med 1999 : 29;160-174
- Stein R, Dogan HS, Hoebeke P et al. Urinary Tract Infections in Children: EAU/ESPU Guidelines. Eur Urol 2015 : 67;546-558
- Roberts KB. Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011 : 128;595-610
- Smith T, Evans K, Lythgoe MF et al. Radiation dosimetry of technetium-99m-DMSA in children. J Nucl Med 1996 : 37;1336-1342
- Ilarslan NE, Fitöz ÖS, Öztuna DG et al. The role of tissue harmonic imaging ultrasound combined with power Doppler ultrasound in the diagnosis of childhood febrile urinary tract infections. Turk pediatri ars. 2015 : 50;90-95
- Davies ER, Roberts M, Roylance J et al. The renal scintigram in pyelonephritis. Clin radiol 1972 : 23;370-376
- Rushton HG, Majd M, Chandra R et al. Evaluation of 99mtechnetium-dimercapto-succinic acid renal scans in experimental acute pyelonephritis in piglets. J Urol 1988 : 40;1169-1174
- Rushton HG, Majd M. Dimercaptosuccinic acid renal scintigraphy for the evaluation of pyelonephritis and scarring: a review of experimental and clinical studies. J Urol 1992 : 148;1726-1732
- Yen TC, Chen WP, Chang SL et al. Technetium-99m-DMSA renal SPECT in diagnosing and monitoring pediatric acute pyelonephritis. J Nucl Med 1996 : 37;1349-1353
- Hoberman A, Charron M, Hickey RW et al. Imaging Studies after a First Febrile Urinary Tract Infection in Young Children. N Engl J Med 2003 : 348;195-202
- Majd M, Nussbaum Blask AR, Markle BM et al. Acute pyelonephritis: comparison of diagnosis with 99mTc-DMSA, SPECT, spiral CT, MR imaging, and power Doppler US in an experimental pig model. Radiology. 2001 : 218;101-108
- Majd M, Rushton HG. Renal cortical scintigraphy in the diagnosis of acute pyelonephritis. Semin Nucl Med 1992 : 22;98-111
- Shih BF, Tsai JD, Tsao CH et al. Reappraisal of the effectiveness of 99mTc-dimercaptosuccinic acid scans for selective voiding cystourethrography in children with a first febrile urinary tract infection. Kaohsiung J Med Sci 2014 : 30;608-612
- Montini G, Zucchetta P, Tomasi L et al. Value of Imaging Studies After a First Febrile Urinary Tract Infection in Young Children: Data From Italian Renal Infection Study 1. Pediatrics [online]. 2009 : 123;e239-e246 [cit. 2019-01-02]. Dostupné na: http://pediatrics.aappublications.org/cgi/doi/10.1542/peds.2008-1003
- Bosakova A, Salounova D, Havelka J et al. Diffusion-weighted magnetic resonance imaging is more sensitive than dimercaptosuccinic acid scintigraphy in detecting parenchymal lesions in children with acute pyelonephritis: a prospective study. J Pediatr Urol 2018 : 14; doi: 10.1016/j.jpurol.2018.02.014
- Lonergan GJ, Pennington DJ, Morrison JC et al. Childhood pyelonephritis: comparison of gadolinium-enhanced MR imaging and renal cortical scintigraphy for diagnosis. Radiology. 1998 : 207,377-384
- Weiser AC, Amukele SA, Leonidas JC et al. The role of gadolinium enhanced magnetic resonance imaging for children with suspected acute pyelonephritis. J Urol. 2003 : 169;2308-2311
- Chilla GS, Tan CH, Xu C et al. Diffusion weighted magnetic resonance imaging and its recent trend-a survey. Quant Imaging Med Surg 2015 : 5;407–422
- Morani AC, Smith EA, Ganeshan D et al. Diffusion-weighted MRI in pediatric inflammatory bowel disease. AJR. AJR Am J Roentgenol 2015:,204;1269-1277
- Rathod SB, Kumbhar SS, Nanivadekar A et al. Role of diffusion-weighted MRI in acute pyelonephritis: a prospective study.Acta Radiol 2015 : 56;244-249
- Cova M, Squillaci E, Stacul F et al. Diffusion-weighted MRI in the evaluation of renal lesions: preliminary results. Br J Radiol 2004 : 77;851-857
- De Pascale A, Piccoli GB, Priola SM et al. Diffusion-weighted magnetic resonance imaging: new perspectives in the diagnostic pathway of non-complicated acute pyelonephritis. Eur Radiol 2013 : 23;3077-3086
- Faletti R, Cassinis MC, Fonio P et al. Diffusion-weighted imaging and apparent diffusion coefficient values versus contrast-enhanced MR imaging in the identification and characterisation of acute pyelonephritis. Eur Radiol 2013 : 23;3501-3508
- Vivier PH, Sallem A, Beurdeley M et al. MRI and suspected acute pyelonephritis in children: comparison of diffusion-weighted imaging with gadolinium-enhanced T1-weighted imaging. Eur Radiol 2014 : 24;19-25
- Stokland E, Hellström M, Jakobsson B et al. Imaging of renal scarring. Acta Paediatr Suppl 1999 : 88;13-21
- Benador D, Benador N, Slosman D et al. Are younger children at highest risk of renal sequelae after pyelonephritis? Lancet 1997 : 349;17-19
- Shiraishi K, Yoshino K, Watanabe M et al. Risk factors for breakthrough infection in children with primary vesicoureteral reflux. J Urol 2010 : 183;1527-1531
- Lee MD, Lin CC, Huang FY et al. Screening young children with a first febrile urinary tract infection for high-grade vesicoureteral reflux with renal ultrasound scanning and technetium-99m-labeled dimercaptosuccinic acid scanning. J Pediatr 2009 : 54;797-802
- Táborská K. Současné trendy v provedení statické scintigrafie ledvin u dětí s akutní pyelonefritidou. Ces Radiol 2013;67 : 291-295
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2019 Číslo 2- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
- Časná regrese nádoru jako marker celkového přežití v 1. linii léčby mCRC
-
Všechny články tohoto čísla
- Ventilačně-perfUzní scintigrafie plic stanovisko Výboru ČSN M k provádění vyšetření
- Diagnostika akutní pyelonefritidy u dětí a význam zobrazovacích metod
- CT plicní angiografie v diagnostickém algoritmu pacienta s recidivou embolie do plicnice a chronickým selháním ledvin
- Detekce ascitu při kostní scintigrafii
- Nukleární medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- CT plicní angiografie v diagnostickém algoritmu pacienta s recidivou embolie do plicnice a chronickým selháním ledvin
- Diagnostika akutní pyelonefritidy u dětí a význam zobrazovacích metod
- Detekce ascitu při kostní scintigrafii
- Ventilačně-perfUzní scintigrafie plic stanovisko Výboru ČSN M k provádění vyšetření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



