-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba nemetastatického kastračně refrakterního karcinomu prostaty
Current treatment of non-metastatic castration-refractory prostate cancer
Background: Non-metastatic castration-refractory prostate cancer (nmCRPC) is defined by increasing serum prostate specific antigen (PSA) levels despite androgen deprivation therapy in the absence of metastases on standard imaging methods including CT of the chest, abdomen and pelvis, and bone scan. Patients with nmCRPC and short PSA doubling time (PSAdt) are at high risk of developing early metastatic disease. Objectives: The objective of this review is to summarize current data on the treatment of nmCRPC. The current data support the efficacy of three novel androgen receptor targeted agents (ARTA), darolutamide, apalutamide and enzalutamide. Conclusions: The design and eligibility criteria of the three key studies with darolutamide, apalutamide and enzalutamide were similar. Patients were required to have a PSAdt < 10 months. The study allowed the participation of patients with local lymphadenopathy (below the aortic bifurcation level) of < 2 cm in the ARAMIS (darolutamide) and SPARTAN (apalutamide) studies and < 1.5 cm in the PROSPER (enzalutamide) study. All of these studies have shown prolongation of metastasis-free survival as well as improved overall survival in the active arms. Prolonging the time to metastasis in patients with nmCRPC is an important therapeutic objective in itself, as skeletal metastases are associated with disease symptoms, such as bone pain. The evidence of extended survival reinforces the indication of ARTA in nmCRPC therapy. The early inclusion of ARTA in the treatment algorithms for prostate cancer raises questions about sequencing of subsequent systemic therapies. The use of advanced imaging methods such as PET using a labeled prostate specific membrane antigen ligand is also discussed. However, according to the current consensus, the findings of distant metastases using these next-generation imaging methods do not change the diagnosis of nmCRPC, if no distant lesions are detected by conventional staging.
Keywords:
castration-refractory prostate cancer – androgen antagonists – antineoplastic agents – drug toxicity – survival
Autoři: Tomáš Büchler
Působiště autorů: Onkologická klinika 1. LF UK a FTN Praha
Vyšlo v časopise: Klin Onkol 2021; 34(3): 185-191
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2021185Souhrn
Východiska: Nemetastatický kastračně refrakterní karcinomem prostaty (non-metastatic castration refractory prostate cancer – nmCRPC) je definován rostoucí hladinou prostatického specifického antigenu (PSA) v séru navzdory androgenové deprivaci při negativním výsledku standardních zobrazovacích metod (CT hrudníku, břicha a malé pánve a scintigrafie skeletu). Pacienti s nmCRPC a krátkým zdvojovacím časem PSA (PSA doubling time – PSAdt) mají vysoké riziko časného vzniku metastatického onemocnění. Cíl: Cílem práce je poskytnout klinicky zaměřený přehled současné léčby nmCRPC a její indikace. V současnosti máme data o účinnosti tří nových hormonálních antagonistů ze skupiny léků cílených na androgenový receptor (androgen receptor targeted agents – ARTA) – darolutamidu, apalutamidu a enzalutamidu. Závěr: Metodika a kritéria pro zařazení pacientů do studií s darolutamidem, apalutamidem a enzalutamidem byly podobné. Pacienti museli mít PSAdt < 10 měsíců. Studie umožňovala účast pacientů s lokální lymfadenopatií (pod úrovní bifurkace aorty) < 2 cm ve studiích ARAMIS (darolutamid) a SPARTAN (apalutamid) a < 1,5 cm ve studii PROSPER (enzalutamid). Ve všech uvedených studiích bylo prokázáno prodloužení doby do vzniku vzdálených, symptomatických nebo radiologicky zjistitelných metastáz a také prodloužení celkového přežití. Prodloužení doby do vzniku metastáz u pacientů s nmCRPC je samo o sobě významným léčebným cílem, protože vznik metastáz ve skeletu je spojen s příznaky, hlavně bolestmi v kostech. Prokázané prodloužení celkového přežití samozřejmě tuto časnou indikaci ARTA ještě posiluje. Časné zařazení ARTA do léčebných algoritmů pro karcinom prostaty vyvolává otázky stran sekvenace následné systémové léčby. Diskutuje se rovněž o použití pokročilých zobrazovacích metod, jako je např. PET s využitím značeného ligandu prostatického specifického membránového antigenu. Nález vzdálených metastáz v rámci těchto vyšetření při negativitě konvenčního stagingu však podle dosavadního konsenzu nemění diagnózu nmCRPC.
Klíčová slova:
kastračně refrakterní karcinom prostaty – antagonisté androgenu – protinádorová léčiva – toxicita léčiv – míra přežití
Úvod
Karcinom prostaty je celosvětově nejčastějším nádorem u mužů. Jeho výskyt se zvyšuje se stárnutím populace. Incidence v roce 2018 u nás byla 152/ 100 000 mužů (7 938 nově zachycených případů), mortalita 29/ 100 000 (1 540) mužů. Za posledních 10 let se incidence výrazně zvýšila (zlepšené metody záchytu, zejména testováním prostatického specifického antigenu (PSA)) – z 5 459 případů v roce 2008 na 7 938 případů v roce 2018. Absolutní mortalita je však stacionární. Mortalita korigovaná na demografické rozložení světové populace v ČR dokonce klesá. S karcinomem prostaty nebo jeho anamnézou žilo podle posledních dostupných údajů v roce 2017 v ČR 61 667 mužů s věkovým mediánem 72 let [1–3]. Nejde tedy zdaleka jen o nemoc starších mužů, jak se ještě stále traduje.
Nejdůležitějším faktorem podporujícím množení a přežívání buněk karcinomu prostaty je testosteron. Na snížení hladiny testosteronu nebo blokádu jeho receptorů je zaměřena běžně používaná hormonální léčba, ať už v podobě androgenové deprivace (androgen-deprivation therapy – ADT) zahrnující agonisty a antagonisty gonadoliberinu (hormonu uvolňujícího LH) jako novější léky ze skupiny léků cílených na androgenový receptor (androgen receptor-targeting agents – ARTA), např. abirateron, enzalutamid, darolutamid či apalutamid, nebo antiandrogeny starší generace (bikalutamid, flutamid).
U části nemocných léčených ADT po čase dochází k progresi nádoru. Tato další fáze nemoci se nazývá kastračně refrakterní karcinom prostaty (castration-refractory prostate cancer – CRPC). I ve fázi CRPC si však buňky karcinomu prostaty zachovávají citlivost na některé hormonální manipulace. CRPC je tedy karcinom prostaty progredující biochemicky (zvyšují se hladiny PSA) nebo radiologicky při kastrační hladině testosteronu v séru. Metastatický CRPC (mCRPC) je definován přítomností metastáz detekovaných pomocí konvenčních zobrazovacích technik, jako je CT a/ nebo scintigrafie skeletu využívající technecia-99m, příp. MR. CRPC bez průkazu metastáz uvedenými radiologickými metodami je kategorizován jako nemetastatický CRPC (nmCRPC). Pacienti s nmCRPC tedy zahrnují nemocné s lokoregionální recidivou nebo progresí a pacienty se vzdálenými metastázami, které nelze identifikovat běžnými zobrazovacími metodami – protože jsou buď příliš malé, nebo se nachází v obtížně zobrazitelných oblastech, např. v kostní dřeni. Soudě podle dostupných údajů se tyto skupiny na populaci s nmCRPC podílejí přibližně stejnou mírou [4].
Počet pacientů s CRPC lze jen odhadovat, protože tato fáze nemoci není v registrech speciálně označena. Avšak specifická mortalita na karcinom prostaty úzce koreluje se vznikem CRPC [5]. Pokud je 90 % úmrtí na karcinom prostaty způsobeno CRPC a prevalenci CRPC budeme považovat za přibližně stacionární, nových pacientů s CRPC může být ročně v ČR přibližně 1 300–1 400 [1]. Scher et al [5] odhadují, že až 86 % pacientů progreduje do stadia mCRPC ze stadia nmCRPC, avšak jejich metodika ignoruje možnost generalizace lokalizovaného karcinomu prostaty do stadia metastatického kastračně senzitivního onemocnění (mCSPC) a následně mCRPC, kdy nemocní nikdy neprojdou fází nmCRPC.
Léky ze skupiny ARTA byly původně určeny jen nemocným s mCRPC. Novější klinické studie však ukazují, že léčba ARTA účinkuje i v časnějších fázích onemocnění, tedy i u pacientů s metastatickým kastračně senzitivním karcinomem prostaty (mCSPC) a u nmCRPC [6–8].
Tab. 1. Očekávaný medián přežití u pacientů s kastračně refrakterním karcinomem prostaty [9]. ![Očekávaný medián přežití u pacientů s kastračně refrakterním karcinomem
prostaty [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/85e465321587f4f67515292882e40e82.jpeg)
CRPC – kastračně refrakterní karcinom prostaty Prognózu nemocných v různé fázi onemocnění podle přítomnosti metastáz ukazuje tab. 1 [9]. Riziko vzniku detekovatelných a/ nebo symptomatických metastáz u nmCRPC je 34 % ročně [5]. Pacienti s nmCRPC a rychle rostoucím PSA, tj. s krátkým zdvojovacím časem PSA (PSA doubling time – PSAdt) mají vysoké riziko vzniku metastatického onemocnění a související vysoké riziko morbidity a mortality. U pacientů s nmCRPC medián doby do první kostní metastázy při PSAdt < 10 měsíců byl 26 měsíců a celkové přežití bylo 44,8 měsíců [10].
Standardním postupem u těchto pacientů s nmCRPC bylo až donedávna sledování s opakovaným testováním PSA a opakováním restagingu při jeho významnějším nárůstu [11,12]. Pacienti v těchto situacích často sami požadují léčbu a někteří lékaři občas přidávali k ADT bikalutamid, i bez důkazu o jeho prospěchu.
Přehled klinických studií u nmCRPC
V současnosti máme data o účinnosti tří hormonálních antagonistů v léčbě nmCRPC – darolutamidu, apalutamidu a enzalutamidu. Design jejich registračních studií a zařazovací kritéria pro tři studie s uvedenými léky byly podobné. Zařazovací kritéria do uvedených studií jsou diskutována níže. Ve všech uvedených studiích bylo prokázáno prodloužení doby do vzniku metastáz a také prodloužení celkového přežití [6–8, 13–15]. Prodloužení doby do vzniku metastáz u pacientů s nmCRPC je samo o sobě významným léčebným cílem, protože vznik metastáz je spojen s příznaky, hlavně s bolestmi v kostech. Prokázané prodloužení celkového přežití samozřejmě tuto časnou indikaci ARTA ještě posiluje. Shrnutí designu a hlavních výsledků všech tří uvedených studií je uvedeno v tab. 2.
Tab. 2. Shrnutí designu a výsledků randomizovaných klinických studií s léky cílenými na androgenový receptor u pacientů s nemetastatickým kastračně refrakterním karcinomem prostaty. 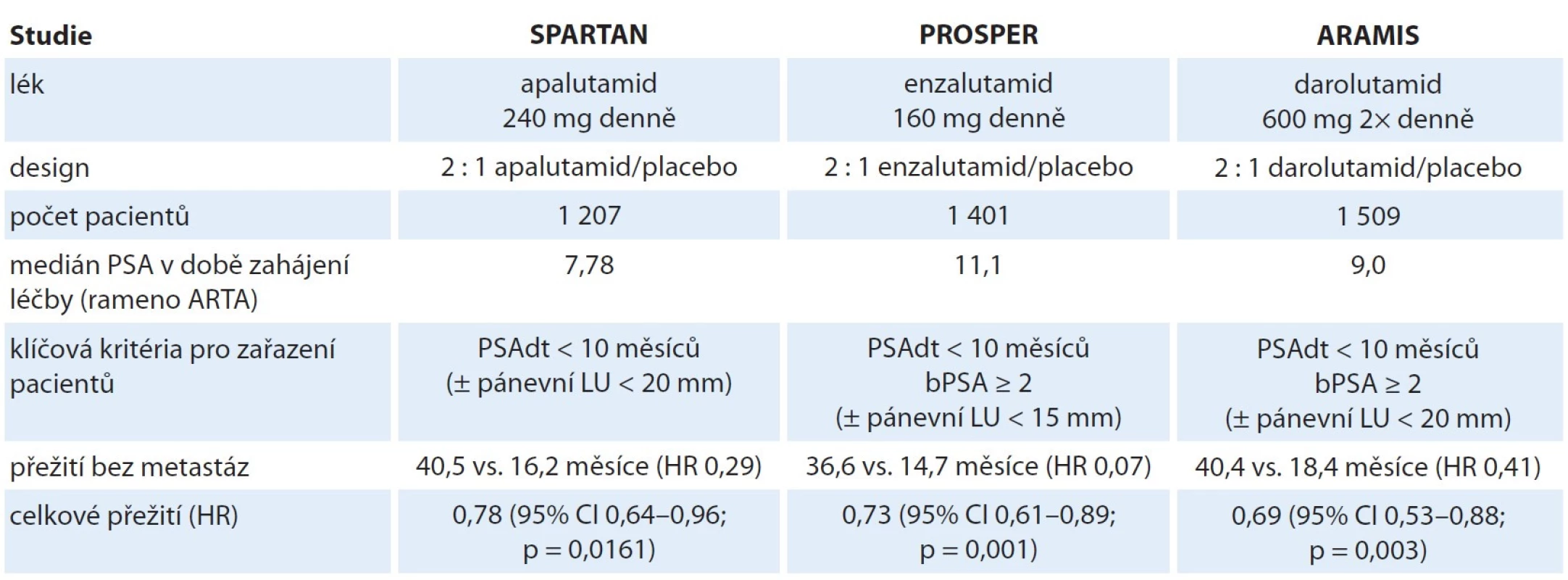
ARTA – lék cílený na androgenový receptor, bPSA – hladina PSA v krvi, CI – interval spolehlivosti, HR – poměr rizik, LU – lymfatická uzlina, PSA – prostatický specifický antigen, PSAdt – zdvojovací čas PSA Je zjevné, že dosažené výsledky jsou velmi konzistentní napříč zkoumanými léky. V metaanalýze randomizovaných studií pro nmCRPC, což je nová indikace ARTA, publikované autory Di Nunno et al [16] vedlo podávání ARTA enzalutamidu, darolutamidu a apalutamidu k výraznému zlepšení přežití bez metastáz v celkové populaci i v klíčových podskupinách.
Bezpečnost léčby ARTA
Přehled nežádoucích příhod ve studiích u pacientů s nmCRPC je přehledně uveden v tab. 3. Celkově lze říct, že nebyly zjištěny nové bezpečnostní signály a toxicita léčby je akceptovatelná. Přesto je pro běžnou praxi důležité upozornit na toxicitu kardiovaskulární, a to vzhledem k populaci léčených pacientů a předpokládanému dlouhému trvání léčby. Kardiovaskulární choroby jsou velmi významnou příčinou morbidity a mortality pacientů s karcinomem prostaty. Androgenní deprivace a léčba ARTA prokazatelně zvyšují riziko kardiovaskulárních komplikací.
Tab. 3. Nežádoucí události všech stupňů toxicity ve studiích nemetastatického kastračně refrakterního karcinomu prostaty. 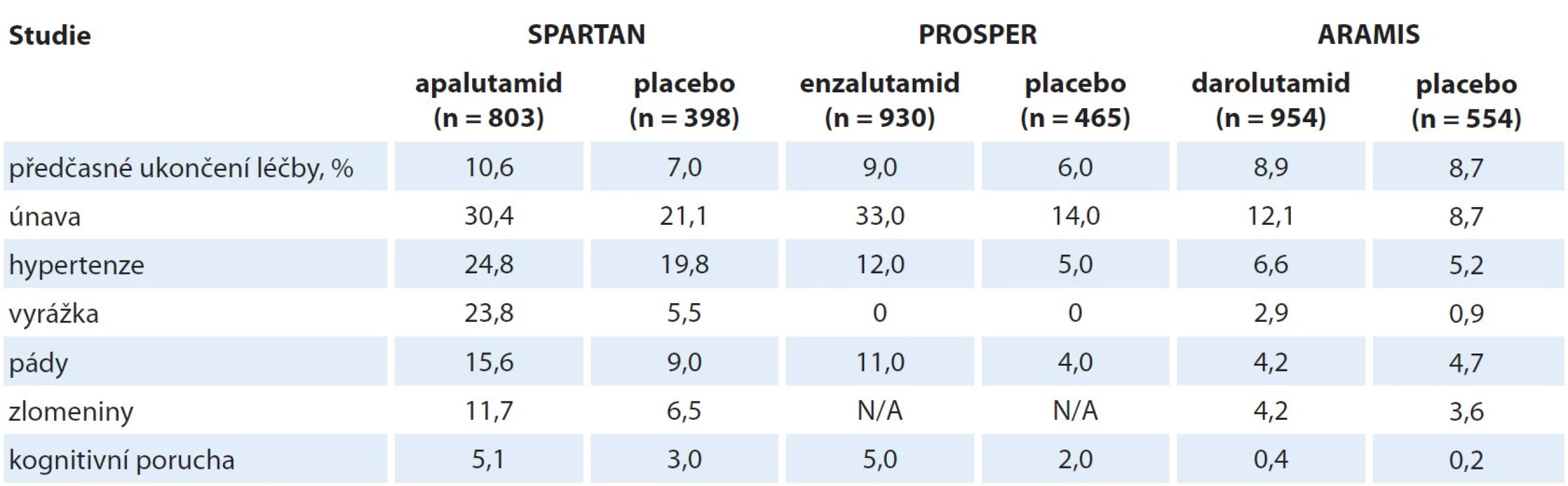
N/A – údaj není k dispozici V již zmiňované metaanalýze randomizovaných studií u nmCRPC dosáhlo relativní riziko pro kardiovaskulární příhody u ARTA vs. placebo hodnoty 2,442 (95% CI 1,391–4,288). Pro hypertenzi stupně 3–4 dosáhlo relativní riziko hodnoty 1,389 (95% CI 1,067–1,808). Byly zaznamenány jisté rozdíly mezi jednotlivými léky: léčba apalutamidem byla provázena vyšším rizikem pádů a zlomenin, darolutamid a enzalutamid měly vyšší kardiovaskulární toxicitu. U pacientů s nmCRPC je tedy nutné při nasazení léčby ARTA brát v úvahu jejich kardiovaskulární nežádoucí účinky, a to tím spíše, že se jedná o muže bez zjevných metastáz, a tudíž s očekávaným dlouhým přežitím [16].
Lu-Yao et al [17] uvádí, že 6měsíční celková mortalita u pacientů léčených ARTA v prechemoterapeutické indikaci činila 18 % u pacientů léčených abirateronem a 17 % u pacientů léčených enzalutamidem. Dominantní příčinou této časné mortality byly právě kardiovaskulární příhody [17]. Důležitým zjištěním je, že riziko kardiovaskulárních komplikací je 2–3násobné u pacientů léčených ARTA po chemoterapii ve srovnání s prechemoterapeutickou indikací.
Pro reálnou klinickou praxi je důležité, že do randomizovaných studií nemohli být zařazováni muži s klinicky významným kardiovaskulárním onemocněním (recentní infarkt myokardu, angina pectoris, městnavé srdeční selhání, klinicky významné komorové arytmie a nekontrolovaná hypertenze). V běžné praxi lze tudíž očekávat vyšší výskyt kardiovaskulární toxicity než v randomizovaných studiích a jejich metaanalýzách.
Existují podrobná doporučení pro diagnostiku a léčbu kardiovaskulárních rizik u pacientů s karcinomem prostaty léčených ADT [18]. Tato doporučení lze rozšířit i na pacienty zahajující léčbu ARTA. Před zahájením ADT by pacienti měli být kardiologicky přešetřeni a měla by být zahájena terapie zaměřená na neléčené nebo nedostatečně léčené metabolické rizikové faktory. Pozornost je nutné věnovat angině pectoris, městnavému srdečnímu selhání, onemocnění chlopní, arytmiím a hypertenzi. Všichni pacienti by měli mít vyšetřen krevní tlak, lipidový panel a metabolický profil (iontogram, jaterní testy, funkce ledvin, kalcium, glykémie), HbA1c a měl by být proveden elektrokardiogram. Pacienti se známkami městnavého srdečního selhání nebo strukturální srdeční nemoci by měli podstoupit echokardiografické vyšetření. Nejvyšší riziko kardiovaskulárních příhod je během prvních 6 měsíců od zahájení ADT nebo léčby ARTA. Zpočátku se proto doporučují vyšetření každé 3 měsíce s odběry metabolického profilu, lipidového panelu a s měřením krevního tlaku.
Při optimalizaci životosprávy a medikace se doporučuje postupovat podle schématu ABCDE původně navrženého pro pacientky s karcinomem prsu [19]. Zkratka ABCDE znamená: A – edukace (awareness) a aspirin, B – krevní tlak (blood pressure), C – cholesterol a cigarety, D – diabetes a strava (diet), E – cvičení (exercise). Pacienti by měli být poučeni, aby nepodceňovali bolest na hrudi (zejména tu s náhlým nástupem a typickým charakterem a iradiací), námahovou dušnost, únavu, nevolnosti, pocení, závratě nebo bolesti hlavy [18,19].
Indikace ARTA u pacientů s nmCRPC
Indikace ARTA u pacientů s nmCRPC se opírá o vstupní kritéria studií SPARTAN, PROSPER a ARAMIS. Ve všech uvedených studiích byl nmCRPC definován jako CRPC se vzestupem PSA, ale bez známek vzdálené diseminace na konvenčním stagingu zahrnujícím CT břicha, hrudníku a malé pánve (příp. cíleně i jiných oblastí) a techneciové scintigrafie skeletu.
Pacienti museli splňovat běžná kritéria CRPC, tedy kastrační hodnotu testosteronu (< 1,72 nmol/ l) a kritérium biochemické progrese: tři po sobě následující vzestupy PSA v odběrech provedených s odstupem minimálně 1 týdne. Výsledné zvýšení PSA má být 2× o 50 % nad nejnižší hodnotu naměřenou u daného pacienta, současně poslední hodnota PSA je > 2 µg/ l. Odběry mají být provedeny min. 4 týdny po vysazení antiandrogenu.
Prokázání metastáz pouze pomocí PET/ CT s použitím značeného cholinu, fluciklovinu, natriumfluoridu nebo ligandu prostatického membránového specifického antigenu (PSMA) není v současnosti překážkou ve stanovení diagnózy nmCRPC.
Ač byla ve studiích SPARTAN, PROSPER a ARAMIS použita jako cut-off pro zařazení pacienta hodnota PSA 2 µg/ l, definice PCWG3 snížila tuto hodnotu na 1 µg/ l a tato se nyní používá v řadě probíhajících klinických studií [20].
V uvedených studiích bylo jednotně použito kritéria podle PSAdt ≤ 10 měsíců. PSAdt se standardně počítá pomocí lineárního regresního modelu. Pro výpočet je doporučeno použít nejméně tři po sobě jdoucí hodnoty PSA s každou hodnotou ≥ 0,2 ng/ dl. Měla by být zahrnuta nejnovější hodnota PSA během ADT. Interval mezi první a poslední hodnotou PSA by měl být 8 týdnů až 12 měsíců [20]. Optimálním nástrojem pro výpočet PSAdt jsou online kalkulátory [21].
Tab. 4. Zastoupení jednotlivých typů následující léčby u nemocných s progresí ve studiích nemetastatického kastračně refrakterního karcinomu prostaty (procenta z počtu pacientů podstupujících další aktivní systémovou léčbu karcinomu prostaty). 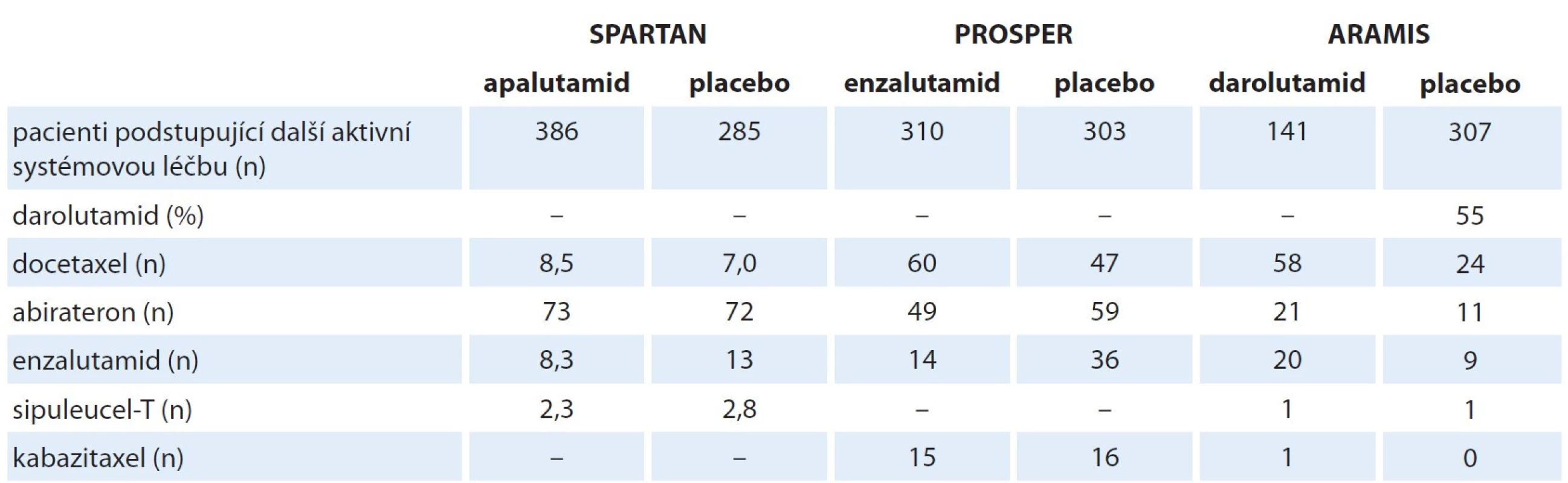
Studie ARAMIS a SPARTAN umožňovaly léčbu nemocných s pánevní lymfadenopatií ≤ 20 mm v krátkém průměru, studie PROSPER ≤ 15 mm, pokud splňovali další podmínky.
Mezi pacienty nmCRPC tedy patří muži po radikální léčbě lokalizovaného karcinomu prostaty, kam patří např. radikální prostatektomie, radikální radioterapie nebo radikální prostatektomie s následnou salvage radioterapií, u nichž je pro biochemický relaps nasazena ADT, ale PSA nadále stoupá bez prokázání vzdálených metastáz konvenčním stagingem. Dále sem budou patřit pacienti se stoupajícím PSA během adjuvantní ADT, která se obvykle používá po radioterapii nemocných s vysokým rizikem.
Druhou skupinou, která byla ve studiích SPARTAN, ARAMIS a PROSPER relativně četná, jsou pacienti, kteří neprodělali lokoregionální léčbu karcinomu prostaty, byli primárně léčeni ADT a dochází u nich k vzestupu PSA opět s negativním výsledkem konvenčního stagingu. Těchto pacientů je v naší praxi relativně málo. Z jakého důvodu u pacientů ve studiích nebyla lokoregionální léčba provedena, nevíme; procento těchto pacientů však výrazně závisí na regionu – jako důvod se tedy nabízí různý přístup ke zdravotní péči. Benefit z léčby ARTA v parametru celkového přežití však nebyl absencí lokoregionální léčby ovlivněn [22].
Vzhledem k tomu, že se jedná o indikaci protinádorové léčby obvykle bez morfologického průkazu rekurence nádoru a že hladiny PSA jsou obvykle nízké (tab. 2), je nutné při změnách PSA vyloučit nenádorové příčiny elevace PSA (prostatitida, cystitida, vyšetření per rectum, katetrizace močového měchýře, cystoskopie, zvýšená námaha nebo cvičení 1–2 dny před testem). Výše uvedené příčiny nenádorové elevace PSA samozřejmě přichází v úvahu jen u pacientů, kteří nejsou po radikální prostatektomii. Navíc asi u 0,3–0,4 % pacientů se vzestupem PSA po radikální léčbě z nedetekovatelných hodnot na detekovatelné je tento jev spojen s přítomností heterofilních protilátek reagujících s testem kvantifikujícím PSA. Proč tyto protilátky u některých pacientů vznikají, není objasněno a předpokládá se expozice zvířecím antigenům přímým kontaktem nebo snad i jídlem u predisponovaných osob [23]. Správné použití výše doporučených algoritmů a definicí by riziko falešné pozitivity PSA mělo eliminovat.
Sekvenace následující léčby
Jak tedy sekvenovat terapii u pacientů, kteří jsou pro nmCRPC léčeni ARTA a dojde u nich k radiologické progresi? O čistě biochemické progresi není potřeba uvažovat, protože není důvodem ke změně léčby. Zpravidla je tento pacient nadále asymptomatický nebo jen s minimálními symptomy onemocnění. Vzhledem k absenci závažných symptomů nemoci není ještě indikovaná chemoterapie. Jednou z možností je nasadit další lék typu ARTA. Podle recentní metaanalýzy je odpověď PSA významně lepší u sekvence abirateron-enzalutamid oproti sekvenci opačné (HR 0,21; p < 0,001). Naproti tomu nebyl zaznamenán statisticky významný rozdíl mezi těmito sekvencemi stran celkového přežití (HR 0,77; p = 0,055) [24]. Uvedená metaanalýza se nicméně zabývá podáním těchto léků u mCRPC a neřeší situaci, kde je jeden z nich podán pro nmCRPC. Navíc samozřejmě abirateron pro podání u nmCRPC nemá registraci ani data z randomizovaných studií. Autoři zároveň upozorňují na krátkou odpověď na druhý ARTA a toto je i zkušenost z klinické praxe. Většina expertů proto u mCRPC nedoporučuje sekvenci ARTA-ARTA a přiklání se k vložení jiné modality (zpravidla chemoterapie) do léčebné sekvence (tedy ARTA-chemo-ARTA). Toto doporučení je podpořeno i výsledkem studie CARD, kde po progresi na ARTA fungovala lépe chemoterapie kabazitaxel než další ARTA [25]. Z tab. 4 je nicméně evidentní, že kromě studie s darolutamidem byl většinou další léčbou u nemocných s nmCRPC a následnou progresí další lék ze skupiny ARTA. Nemocného lze tedy podle současné praxe indikovat k dalšímu ARTA v prechemoterapeutické indikaci pro mCRPC [26].
O otázce radikální stereotaktické radioterapie u pacientů s omezeným rozsahem metastatického onemocnění a s tím souvisejícími indikacemi pokročilých zobrazovacích metod, jako je PET s cholinem, fluciklovinem, natriumfluoridem nebo PSMA ligandem, pojednávám níže.
Novou, zatím hypotetickou možností je pulzní podání testosteronu. K progresi do fáze kastrační refrakterity dochází tím, že si nádorové buňky vyvinou částečnou rezistenci na androgenní deprivaci. Jedním z mechanizmů, které se v tomto procesu uplatňují, je adaptivní vysoká exprese androgenových receptorů buňkami karcinomu prostaty. Preklinické a již i časné klinické studie ukazují, že za těchto podmínek by mohl buňky karcinomu prostaty paradoxně likvidovat testosteron v suprafyziologických hladinách. Tento léčebný přístup se označuje jako bipolární androgenní terapie (BAT). Termín „bipolární“ znamená, že zde dochází v rámci 4týdenního cyklu ke střídání dvou extrémů – suprafyziologických hladin testosteronu po jeho léčebném podání – a opětovnému návratu ke kastračním hladinám [27].
Studie TRANSFORMER publikovaná v únoru 2021 byla první randomizovaná studie porovnávající BAT proti enzalutamidu u pacientů s metastatickým CRPC a progresí na abirateronu [28]. Primárním cílem studie bylo zjistit přežití bez klinické nebo radiologické progrese (progression-free survival – PFS). Pacienti (n = 195) byli náhodně přiřazeni (1 : 1) k užívání testosteron-cypionátu v dávce 400 mg intramuskulárně každých 28 dní nebo enzalutamidu v běžné dávce 160 mg denně. Léčba byla podávaná do klinické nebo radiologické progrese nebo závažné toxicity. PFS dosáhlo shodně 5,7 měsíce v obou ramenech (HR 1,14; 95% CI 0,83–1,55; p = 5,42). Podobné bylo i celkové přežití (overall survival – OS).
Pacienti po progresi na prvním zkoušeném léku dostali lék druhý. Význam BAT se ukázal právě po tomto překřížení ramen. Pacienti se sekvencí BAT→enzalutamid dosáhli významného zlepšení zkoumaných parametrů oproti sekvenci enzalutamid→BAT. PFS2 pro BAT→enzalutamid bylo 28,2 vs. 19,6 měsíce pro enzalutamid→BAT (HR 0,44; 95% CI 0,22–0,88). Celkové přežití u nemocných přecházejících z BAT na enzalutamid dosáhlo 37,1 měsíce ve srovnání se 30,2 měsíci u pacientů se sekvencí BAT→enzalutamid. Nežádoucí účinky BAT byly mírné, jednalo se hlavně o návaly horka, citlivost prsou, gynekomastii a bolesti svalů [28]. Zařazení BAT do sekvence tedy pravděpodobně senzitizuje nádorové buňky k další terapii ARTA. K validaci těchto výsledků je samozřejmě nutná větší randomizovaná studie. Testosteron-cypionát v ČR jako lék k dispozici není, používá se však jako zakázané anabolikum. Zda jej v této indikaci lze nahradit jiným injekčním testosteronem, není známo.
Postavení pokročilých zobrazovacích metod založených na PET v diagnostice nmCRPC
V současnosti se jako nejcitlivější zobrazovací metoda u karcinomu prostaty využívá PET-CT s radioaktivním galiem (⁶⁸Ga) značeným ligandem PSMA [29]. PSMA PET-CT je metoda, která se pro svoji vysokou senzitivitu a specificitu osvědčila při diagnostice místa recidivy karcinomu prostaty po radikální léčbě. U nemocných s PSA < 0,5 překonává jiné zobrazovací metody vč. cholinového a fluciklovinového PET-CT. V této indikaci ji doporučují guidelines Evropské urologické společnosti [30]. Podle nedávno publikované studie PSMA PET-CT nalezne metastázy u 98 % pacientů splňujících kritéria nmCRPC s PSAdt ≤ 10 měsíců. Z těchto pacientů mělo 44 % onemocnění omezeno na pánev (24 % na prostatu nebo lůžko prostaty) a 55 % mělo vzdálené metastázy [4].
Vyšetření PSMA PET-CT by potenciálně mohlo přesněji definovat pacienty, kteří budou mít prospěch z radikální léčby, a to vč. radikální léčby oligometastatického onemocnění, které je u karcinomu prostaty obvykle definováno přítomností 3–5 metastáz podle konvenčních zobrazovacích metod [31]. Studie jsou však většinou malé a retrospektivní. Kastračně refrakterní onemocnění je navíc nezávislým rizikovým faktorem spojeným s horšími výsledky léčby oligometastatického onemocnění ve srovnání s kastračně senzitivním karcinomem [32–34]. Je také nutno uvážit, že studie radikální léčby oligometastatického onemocnění používaly k jejich identifikaci konvenčního stagingu. PSMA PET-CT je zatím jen perspektivní metodou k lepšímu výběru pacientů pro tuto léčbu, a to na základě výsledků jedné z mála prospektivních studií ORIOLE [35]. Pozice PSMA PET-CT jako části teranostického postupu (strategie cíleně kombinující diagnostiku a terapii) s následujícím podáním terapeuticky značeného PSMA ligandu v algoritmu léčby CRPC zatím není jasná.
Z uvedených důvodů je intenzivně diskutovaným problémem, zda u pacientů s nmCRPC indikovat provedení PSMA PET-CT, nebo se spokojit s výsledky konvenčního stagingu. Léčebný postup u pacientů s metastázami prokázanými jen PSMA PET-CT je kontroverzní a současná doporučení National Comprehensive Cancer Network přímo uvádí, že nejlepší strategií u těchto pacientů si panel není jist [25]. Evropská doporučení PSMA PET-CT v této indikaci neuvádí [30].
Závěr
Onemocnění nmCRPC je definováno biochemickou progresí při absenci metastáz zjistitelných konvenčním stagingem bez ohledu na výsledek zobrazování nové generace, jako je PET-CT na bázi cholinu, fluciklovinu, natriumfluoridu či PSMA ligandu. V současnosti máme data o účinnosti tří hormonálních antagonistů typu ARTA – darolutamidu, apalutamidu a enzalutamidu – v léčbě pacientů s nmCRPC a krátkým PSAdt. Ve všech uvedených studiích bylo konzistentně prokázáno prodloužení doby do vzniku metastáz a také prodloužení OS. Studie prokázaly vysokou bezpečnost léčby ARTA, nicméně v klinické praxi je třeba věnovat zvýšenou pozornost zejména kardiovaskulárním následkům této léčby.
Obdrženo/Submitted: 4. 4. 2021
Přijato/Accepted: 15. 4. 2021doc. MUDr. Tomáš Büchler, Ph.D.
Onkologická klinika
1. LF a FTN Praha
Vídeňská 800
140 59 Praha
e-mail: tomas.buchler@ftn.cz
Zdroje
- Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: http/ / www.svod.cz. 2005.
- Krejčí D, Svobodová I, Pehalová L et al. Novotvary. [online]. Dostupné z: https:/ / www.uzis.cz/ index.php?pg=record&id=8352.
- Dusek L, Muzik J, Maluskova D et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2014; 27(6): 406–423. doi: 10.14735/ amko2014406.
- Fendler WP, Weber M, Iravani A et al. Prostate-specific membrane antigen ligand positron emission tomography in men with nonmetastatic castration-resistant prostate cancer. Clin Cancer Res 2019; 25(24): 7448–7454. doi: 10.1158/ 1078-0432.CCR-19-1050.
- Scher HI, Solo K, Valant J et al. Prevalence of prostate cancer clinical states and mortality in the United States: estimates using a dynamic progression model. PLoS One 2015; 10(10): e0139440. doi: 10.1371/ journal.pone.0139440.
- Hussain M, Fizazi K, Saad F et al. Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2018; 378(26): 2465–2474. doi: 10.1056/ NEJMoa1800536.
- Fizazi K, Shore N, Tammela TL et al. Darolutamide in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2019; 380(13): 1235–1246. doi: 10.1056/ NEJMoa1815671.
- Smith MR, Saad F, Chowdhury S et al. Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med 2018; 378(15): 1408–1418. doi: 10.1056/ NEJMoa1715546.
- Afshar M, Evison F, James ND et al. Shifting paradigms in the estimation of survival for castration-resistant prostate cancer: a tertiary academic center experience. Urol Oncol 2015; 33(8): 338. doi: 10.1016/ j.urolonc.2015.05.003.
- Smith MR, Saad F, Oudard S et al. Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer: exploratory analyses by baseline prostate-specific antigen doubling time. J Clin Oncol 2013; 31(30): 3800–3806. doi: 10.1200/ JCO.2012.44.6716.
- Luo J, Beer TM, Graff JN. Treatment of nonmetastatic castration-resistant prostate cancer. Oncology (Williston Park) 2016; 30(4): 336–344.
- Saad F, Bögemann M, Suzuki K et al. Treatment of nonmetastatic castration-resistant prostate cancer: focus on second-generation androgen receptor inhibitors. Prostate Cancer Prostatic Dis 2021. [in press]. doi: 10.1038/ s41391-020-00310-3.
- Sternberg CN, Fizazi K, Saad F et al. Enzalutamide and survival in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2020; 382(23): 2197–2106. doi: 10.1056/ NEJMoa2003892.
- Fizazi K, Shore N, Tammela TL et al. Nonmetastatic, castration-resistant prostate cancer and survival with darolutamide. N Engl J Med 2020; 383(11): 1040–1049. doi: 10.1056/ NEJMoa2001342.
- Smith MR, Saad F, Chowdhury S et al. Apalutamide and overall survival in prostate cancer. Eur Urol 2021; 79(1): 150–158. doi: 10.1093/ annonc/ mdz397.
- Di Nunno V, Mollica V, Santoni M et al. New hormonal agents in patients with nonmetastatic castration-resistant prostate cancer: meta-analysis of efficacy and safety outcomes. Clin Genitourin Cancer 2019; 17(5): e871–e877. doi: 10.1016/ j.clgc.2019.07.001.
- Lu-Yao G, Nikita N, Keith SW et al. Mortality and hospitalization risk following oral androgen signaling inhibitors among men with advanced prostate cancer by pre-existing cardiovascular comorbidities. Eur Urol 2020; 77(2): 158–166. doi: 10.1016/ j.eururo.2019.07. 031.
- Levine GN, D’Amico AV, Berger P et al. Androgen-deprivation therapy in prostate cancer and cardiovascular risk: a science advisory from the American Heart Association, American Cancer Society, and American Urological Association: endorsed by the American Society for Radiation Oncology. Circulation 2010; 121(6): 833–840. doi: 10.1161/ CIRCULATIONAHA.109.192695.
- Bhatia N, Santos M, Jones LW et al. Cardiovascular effects of androgen deprivation therapy for the treatment of prostate cancer: ABCDE steps to reduce cardiovascular disease in patients with prostate cancer. Circulation 2016;133(5): 537–541. doi: 10.1161/ CIRCULATIONAHA.115.012519.
- Scher HI, Morris MJ, Stadler WM et al. Trial design and objectives for castration-resistant prostate cancer: updated recommendations from the prostate cancer clinical trials working group 3. J Clin Oncol 2016; 34(12): 1402–1418. doi: 10.1200/ JCO.2015.64.2702.
- https:/ / www.mskcc.org/ nomograms/ prostate/ psa_doubling_time.
- Fallah J, Zhang L, Weinstock C et al. An FDA pooled analysis: characteristics and outcomes of patients with nonmetastatic castration-resistant prostate cancer, based on prior history of prostatectomy and/ or radiation therapy. [online]. Available from: https:/ / doi.org/ 10.1200/ JCO.2021.39.6_suppl.197.
- Anderson CB, Pyle AL, Woodworth A et al. Spurious elevation of serum PSA after curative treatment for prostate cancer: clinical consequences and the role of heterophilic antibodies. Prostate Cancer Prostatic Dis 2012; 15(2): 182–188. doi: 10.1038/ pcan.2011.58.
- Mori K, Miura N, Mostafaei H et al. Sequential therapy of abiraterone and enzalutamide in castration-resistant prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2020; 23(4): 539–548. doi: 10.1038/ s41391-020-0222-6.
- de Wit R, de Bono J, Sternberg CN et al. Cabazitaxel versus abiraterone or enzalutamide in metastatic prostate cancer. N Engl J Med 2019; 381(26): 2506–2518. doi: 10.1056/ NEJMoa1911206.
- National Comprehensive Cancer Network. Prostate cancer, version 2.2021. [online]. Available from: https:/ / www.nccn.org/ professionals/ physician_gls/ pdf/ prostate_blocks.pdf.
- Schweizer MT, Antonarakis ES, Wang H et al. Effect of bipolar androgen therapy for asymptomatic men with castration-resistant prostate cancer: results from a pilot clinical study. Sci Transl Med 2015; 7(269): 269ra2. doi: 10.1126/ scitranslmed.3010563.
- Denmeade SR, Wang H, Agarwal N et al. TRANSFORMER: a randomized phase II study comparing bipolar androgen therapy versus enzalutamide in asymptomatic men with castration-resistant metastatic prostate cancer. J Clin Oncol 2021; 39(12): 1371–1382. doi: 10.1200/ JCO.20.02759.
- Hofman MS, Lawrentschuk N, Francis RJ et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020; 395(10231): 1208–1216. doi: 10.1016/ S0140-6736(20)30314-7.
- EAU - EANM - ESTRO -ESUR - ISUP - SIOG guidelines on prostate cancer. [online]. Available from: https:/ / uroweb.org/ wp-content/ uploads/ EAU-EANM-ESTRO_ESUR_ISUP_SIOG-Guidelines-on-Prostate-Cancer.pdf.
- Navrátil J, Poprach A, Lakomý R et al. Oligometastatic prostate cancer. Klin Onkol 2019; 32(2): 97–100. doi: 10.14735/ amko201997.
- Franzese C, Di Brina L, D’Agostino G et al. Predictive factors for survival outcomes of oligometastatic prostate cancer patients treated with metastases-directed therapy: a recursive partitioning-based analysis. J Cancer Res Clin Oncol 2019; 145(10): 2469–2479. doi: 10.1007/ s00432-019-03007-w.
- Triggiani L, Alongi F, Buglione M et al. Efficacy of stereotactic body radiotherapy in oligorecurrent and in oligoprogressive prostate cancer: new evidence from a multicentric study. Br J Cancer 2017; 116(12): 1520–1525. doi: 10.1038/ bjc.2017.103.
- Rogowski P, Roach M 3rd, Schmidt-Hegemann N-S et al. Radiotherapy of oligometastatic prostate cancer: a systematic review. Radiat Oncol 2021; 16(1): 50. doi: 10.1186/ s13014-021-01776-8.
- Phillips R, Shi WY, Deek M et al. Outcomes of observation vs stereotactic ablative radiation for oligometastatic prostate cancer: The ORIOLE phase 2 randomized clinical trial. JAMA Oncol 2020; 6(5): 650–659. doi: 10.1001/ jamaoncol.2020.0147.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Léčba nemetastatického kastračně rezistentního karcinomu prostaty
- Sociální faktory mají vliv na průběh a prognózu maligní nemoci
- Léčba nemetastatického kastračně refrakterního karcinomu prostaty
- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Mechanobiologie kancerogeneze
- COVID-19 a onkologické ochorenie
- Genetické a epigenetické základy radiorezistence nádorových buněk prostaty
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- Využití PET/ CT s markerem hypoxie (18F-FMISO) v plánování radioterapie
- Lipozomální irinotekan – nová možnost systémové léčby karcinomu pankreatu
- Aktuality z odborného tisku
- Životné jubileum doc. MU Dr. Juraja Kaušitza, CSc.
- Jubileum prvej dámy radiačnej onkológie na Slovensku – MUDr. Eva Siracká, DrSc.
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- COVID-19 a onkologické ochorenie
- Mechanobiologie kancerogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



