-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radikální reiradiace rekurentních nádorů hlavy a krku s využitím zevní radioterapie
Radical external beam reirradiation of recurrent head and neck cancer
Background: Recurrent head and neck carcinomas represent a therapeutic challenge for the surgeons as well as for the treating radiation oncologists. Despite advances in the treatment of newly diagnosed head and neck carcinomas, relapses occur very frequently and contribute significantly to patient mortality. External beam reirradiation is still considered to be a controversial therapeutic intervention. Historically, in the era of 2 - and 3-dimensional conformal radiotherapy, its narrow therapeutic ratio has long led to a general concern that the potential benefit could not sufficiently outweigh the high risk associated with the treatment. The unfavorable therapeutic ratio, however, could be positively influenced by the use of modern techniques of intensity-modulated radiation therapy (IMRT), volumetric-modulated arc therapy (VMAT), stereotactic body radiation therapy (SBRT) and heavy-ion radiotherapy (protons, carbon ions). Purpose: The purpose of this review is to create a practical tool for clinical decision-making on the type of patient suitable for reirradiation and the exact type of radiotherapy technique with respect to its expected therapeutic effect, toxicity profile and availability throughout the institutions. In the introductory section, selection of patients is defined with an emphasis on factors that significantly affect overall survival and may be particularly useful in shared decision-making approach within multidisciplinary teams. Furthermore, the text deals with the individual types of external beam radiotherapy techniques (IMRT, SBRT, heavy-ion radiotherapy) with a clear summary of therapeutic outcomes and toxicity from published scientific evidence that had a significant impact on clinical practice.
Keywords:
head and neck cancer – recurrence – external beam radiotherapy – reirradiation – toxicity
Autoři: M. Švajdová 1,2; T. Kazda 2; P. Dubinský 3,4; P. Šlampa 2
Působiště autorů: Klinika radiačnej a klinickej onkológie ÚVN Ružomberok, Slovenská republika 1; Klinika radiační onkologie LF MU a MOÚ Brno, Česká republika 2; Východoslovenský onkologický ústav, a. s., Košice, Slovenská republika 3; Fakulta zdravotníctva, Katolícka univerzita, Ružomberok, Slovenská republika 4
Vyšlo v časopise: Klin Onkol 2021; 34(2): 103-112
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2021103Souhrn
Východiska: Recidivující nádory hlavy a krku jsou terapeutickou výzvou pro chirurgy i pro radiační onkology. Navzdory velkému pokroku v primární léčbě těchto nádorů se recidivy vyskytují velmi často a významně přispívají k mortalitě pacientů. Reiradiace externím paprskem je stále považována za kontroverzní léčebnou intervenci, jejíž úzký terapeutický poměr v éře dvou - a trojrozměrné konformní radioterapie dlouhodobě vedl k obavám, že potenciální benefit nedokáže dostatečně vyvážit vysoké riziko iatrogenního poškození. Nepříznivý terapeutický poměr lze pozitivně ovlivnit použitím moderních technik radioterapie s modulovanou intenzitou svazku (intensity-modulated radiation therapy – IMRT), volumetricky modulované radioterapie (volumetric-modulated arc therapy – VMAT), stereotaktické ablativní radioterapie (stereotactic body radiation therapy – SBRT) a radioterapie těžkými částicemi (protony, uhlíkové ionty). Cíl: Cílem tohoto přehledového článku je vytvoření praktické pomůcky pro klinické rozhodování o typu pacienta vhodného k reiradiaci a ozařovací technice s ohledem na její očekávaný léčebný efekt, profil toxicity a dostupnost na jednotlivých pracovištích. Úvodem článku je definována selekce pacientů s důrazem na faktory, které zásadním způsobem ovlivňují celkové přežití a mohou být zvláště užitečné při rozhodování v multidisciplinárních týmech. Dále text pojednává o typech jednotlivých technik externí radioterapie (IMRT, SBRT, ozařování těžkými částicemi) s přehledným souhrnem terapeutických výsledků a toxicity z vědeckých prací, které zásadním způsobem ovlivnily klinickou praxi.
Klíčová slova:
nádory hlavy a krku – recidiva – externí radioterapie – reiradiace – toxicita
Úvod do problematiky
Navzdory pokroku v multimodální léčbě zhoubných nádorů je nejčastější příčinou úmrtí pacientů s dlaždicobuněčným karcinomem hlavy a krku (head and neck squamous cell cancer – HNSCC) lokální či regionální recidiva onemocnění [1–3]. Incidence lokálně regionálních recidiv a duplicitních nádorů v oblasti hlavy a krku je podle různých zdrojů udávána u 15–50 % přežívajících pacientů [4–9]. U resekabilních onemocnění je dlouhodobě uznávaným zlatým standardem záchranná chirurgická léčba, ale podíl takto léčených rekurentních karcinomů hlavy a krku (recurrent head and neck carcinoma – rHNC) činí přibližně pouze 20 % [10]. Pooperační reiradiace může pozitivně ovlivnit délku remise onemocnění při pozorné selekci pacientů [11,12]. Až 80 % recidiv je v době stanovení diagnózy inoperabilních, a to nejen z anatomických příčin; častým důvodem nemožnosti chirurgické intervence je špatný celkový výkonnostní stav, ale i nesouhlas ze strany pacienta [10]. Reiradiace (překrývání nových ozařovaných polí s předchozími, kde byla v minulosti aplikována radikální radioterapie s pooperačním nebo kurativním záměrem) tak představuje terapeutickou alternativu pro pacienty, kteří nejsou vhodnými kandidáty pro chirurgickou léčbu, a při pozorné selekci může vést k dlouhodobému přežívání [12]. Téměř všechny dostupné důkazy o léčebném efektu a toxicitě reiradiace pocházejí z retrospektivních studií a jsou silně zkreslené nedostatkem kontrolních ramen. Tento fakt striktně limituje schopnost jasně interpretovat dostupné vědecké poznatky. Exaktní postavení reiradiace v léčbě rHNC proto i v éře moderních ozařovacích technik zůstává nejasné. Pacientům s rHNC tak lze nabídnout několik léčebných možností s minimální oporou prospektivních dat. Implementací konformních, vysoce precizních technik radioterapie s modulovanou intenzitou svazku (intensity-modulated radiation therapy – IMRT), volumetricky modulované radioterapie (volumetric-modulated arc therapy – VMAT) a stereotaktické ablativní radioterapie (stereotactic body radiation therapy – SBRT) do klinické praxe je možné očekávat zlepšení dávkové distribuce v tumoru, resp. jeho lůžku, při šetření okolních zdravých tkání, což by mohlo zásadně vylepšit terapeutický poměr reiradiace.
Zdůvodnění reiradiace
Reiradiace může pacientovi přinést několik zásadních výhod. Při pečlivé selekci a nepřítomnosti vzdálených metastáz je možné dosažení druhé kompletní remise s dlouhodobou lokální a regionální kontrolou (locoregional control – LRC) onemocnění. Úspěšná LRC u rHNC zásadním způsobem pozitivně ovlivňuje i bezpříznakové přežití (disease-free survival – DFS) a celkové přežití (overall survival – OS). V retrospektivní analýze 105 pacientů s rHNC autorů Lee et al [13] bylo pozorováno signifikantní zlepšení 2letého OS u těch pacientů, kteří dosáhli úspěšné LRC po reiradiaci, ve srovnání s pacienty, u kterých bylo pozorováno postterapeutické lokální či regionální selhání (locoregional failure – LRF) (2leté OS 56 vs. 21 %; p < 0,001). Dostupná vědecká data přinesla poznatky o zlepšení kvality života po reiradiaci [14–17], hlavně ve smyslu zmenšení bolesti a zlepšení žvýkacích funkcí, polykání a celkové tělesné aktivity, a to i u pacientů s pokročilým onemocněním, špatným výkonnostním stavem a velmi nepříznivou prognózou.
Selekce pacientů
Indikace reiradiace při recidivujícím nebo duplicitním nádoru hlavy a krku teoreticky přichází v úvahu u velkého množství pacientů, kteří jsou potenciálně vhodnými kandidáty pro kurativní léčebnou intervenci. Jen malá podskupina těchto pacientů však bude mít reálný klinický benefit z této léčby. Terapeutické selhání po předchozí radioterapii je obvykle způsobeno radiorezistentní biologií recidivujících onemocnění podmíněných existencí radiorezistentního klonu nádorových buněk. Pokusy o zlepšení léčebných výsledků pomocí souběžné chemoterapie nebo hyperfrakcionace přinesly pouze minimální úspěch [18,19]. Limitujícím faktorem je i velmi vysoké (až 29%) riziko závažné (stupně ≥ 3) toxicity [20]. Přesto je riziko progrese nebo úmrtí v důsledku rHNC přibližně 4× vyšší než riziko závažné toxicity [21].
Při samotné selekci pacientů je nejužitečnější pomůckou prognostický skórovací systém (recursive partitioning analysis – RPA) odvozený analýzou 412 pacientů s rHNC, kterou publikovali Ward et al v roce 2018 [21]. Jedná se o konzistentní soubor pacientů s recidivami dlaždicobuněčných karcinomů hlavy a krku (96 %) léčených reiradiací s kurativním záměrem výhradně s použitím techniky IMRT. Bylo identifikováno několik faktorů, které měly významný vliv na OS. Pacienti byli stratifikováni do tří podskupin, ve kterých byly pozorovány odlišné, ale zároveň homogenní hodnoty OS. Skupina I zahrnovala pacienty s časovým odstupem > 2 roky po předchozí radikální radioterapii (RT) s resekabilním onemocněním (nezávisle na resekčních okrajích). Ve skupině II byli pacienti > 2 roky po předchozí radikální RT s neresekabilním onemocněním nebo ≤ 2 roky po RT bez přítomnosti orgánové dysfunkce (závislosti na perkutánní endoskopické gastrostomii – PEG – nebo tracheostomické kanyle). Ve skupině III byli pacienti ≤ 2 roky po RT, s orgánovou dysfunkcí. Hodnoty 2letého OS byly 61,9, 40 a 16,8 % pro skupiny I, II a III. Medián přežití ve skupině III byl 8 měsíců, přičemž žádný z pacientů nedosáhl přežívání > 4 roky (p < 0,001) [12].
Dalším faktorem s významným vlivem na OS byla anatomická lokalizace recidivy [12], přičemž negativní vliv na přežívání měly především recidivy v oblasti dutiny ústní (HR 2,9; 95% CI 1,7–4,9; p < 0,0001) a orofaryngu (HR 1,9; 95% CI 1,2–3,2; p < 0,006). Zhoršené skóre Karnofského výkonnostního stavu (Karnofsky performance status – KPS) bylo rovněž negativním prognostickým faktorem OS (> 70 vs. ≤ 70; HR 0,6; 95% CI 0,4 – 0,9; p < 0,025). Přežití pacientů nebylo ovlivněno věkem, pohlavím, anamnézou kouření, přítomností komorbidit, podáním chemoterapie – CHT (v minulosti nebo indukční chemoterapie před reiradiací) a překvapivě ani T - a N-kódem rekurence [12].
V pracích jiných autorů s menším počtem pacientů bylo OS významně ovlivněno rozsahem recidivy i podáním CHT v minulosti [22]. Velký rozsah lokálního onemocnění podstatně zhoršoval specifické přežívání, přičemž přesná anatomická lokalizace rekurence neměla na OS žádný vliv. Medián DFS byl 5 měsíců u pacientů, kteří v minulosti podstoupili CHT, ve srovnání s 24,5 měsíce u pacientů, kteří CHT nedostali (p < 0,001) [22].
Několik autorů doporučuje časový interval ≥ 6 měsíců od předchozí RT jako základní indikační kritérium pro reiradiaci [11,18,23], přičemž riziko závažné toxicity v čase klesá a pravděpodobnost úspěšné LRC se zvyšuje [24]. Trend k lepšímu OS byl pozorován u duplicitních nádorů v porovnání s rekurentními [12,19,25]. U metachronních recidiv s výskytem > 6 měsíců po léčbě (chirurgické, onkologické) bylo pozorováno signifikantně lepší OS ve srovnání se synchronními recidivami s výskytem < 6 měsíců po předchozí terapii [26,27].
Dalším důležitým indikačním kritériem je objem tumoru [28,29]. V retrospektivní studii autorů Chen et al [29] byla velikost plánovacího cílového objemu (planning target volume – PTV) jediným prediktivním parametrem LRC, přičemž při PTV < 27 cm3 bylo pozorováno 2leté OS až 80 %. Tento fakt je nutné vzít v úvahu při indikaci reiradiace velkých nebo multifokálních recidiv.
Velmi důležité je i zahrnutí klinických jednotek, které jsou v současnosti považovány za kontraindikace reiradiace. Pacienti s osteoradionekrózou mandibuly, chondronekrózou laryngu nebo hemodynamicky významnou stenózou a. carotis (AC) jsou obecně považováni za nevhodné k reiradiaci. Přesto při definitivní kontraindikaci pacienta k reiradiaci by se tyto patologické procesy měly nacházet v anatomické lokalitě, která má být ozařována. Jedinou absolutní kontraindikací reiradiace by tak měla být předchozí RT navozená myelopatie a nesouhlas pacienta.
Závěrem lze konstatovat, že třemi základními selekčními kritérii pro reiradiaci by měly být: čas od předchozí RT, operabilita a přítomnost orgánové dysfunkce. Pacienti s recidivami ≤ 6 měsíců od RT, s velkým rozsahem onemocnění především v oblasti dutiny ústní velmi pravděpodobně nebudou mít žádný benefit z reiradiace a méně toxickou léčebnou alternativu pro ně představuje aplikace paliativní systémové léčby. Naopak pacienti > 2 roky po RT, s lokalizací recidivy malého rozsahu v oblasti nosohltanu nebo lebeční báze, ve výborném celkovém stavu bez předchozí závažné toxicity jsou typickými kandidáty k reiradiaci a je u nich možné zvažovat i finančně nákladné techniky ozařování těžkými částicemi.
Pooperační reiradiace
Záchranná chirurgická léčba je dlouhodobě uznávaným zlatým standardem a její indikace musí být pečlivě zvážena u každého pacienta s rHNC. Léčebného úspěchu v podobě dlouhodobé kontroly onemocnění po záchranné operaci je možné dosáhnout v 25–45 % [30,31]. Po kompletní resekci včasných rekurencí karcinomu glotického laryngu tato hodnota dosahuje až 80 % [22].
Indikace pooperační reiradiace je kontroverzní především kvůli riziku kumulativní závažné toxicity, přesto může být racionální v klinických situacích, kdy je vysoké riziko vzniku další recidivy (R1 resekce, extrakapsulární šíření uzlinové metastázy (extracapsular extension – ECE), lymfangioinvaze, perineurální šíření) [11,32–34]. I při kompletním odstranění recidivy s negativními resekčními okraji existuje riziko vzniku dalšího, obvykle opět lokálního relapsu, a to až v 59 % [35]. V několika nerandomizovaných studiích hodnotících bezpečnost postoperační reiradiace se současně aplikovanou CHT byly hodnoty 3letého a 4letého OS 48 a 43 % [36,37]. Definitivní důkaz o bezpečnosti a efektivitě postoperační souběžné chemoradioterapie přinesla prospektivní randomizovaná studie fáze III Groupe d‘Étude des Tumours Tête et Cou (GETTEC) a Groupe d‘Oncologie Radiotherapie Tête et Cou (GORTEC) [11]. Po makroskopickém odstranění tumoru a vyloučení pacientů s reziduální nádorovou nemocí (R2 resekce) bylo 130 pacientů ekvivalentně randomizováno do dvou ramen. V prvním rameni byla indikována observace a ve druhém rameni pacienti podstoupili reiradiaci trojrozměrnou konformní radioterapií (3-D conformal radiotherapy – 3-D CRT) (medián dávky 60 Gy / 30 frakcích) v kombinaci s 5-fluorouracilem (5-FU) a hydroxyureou. Plánovací ozařovaný objem byl omezen výlučně na předoperační rozsah onemocnění (gross tumor volume – GTV) bez elektivního ozařování krku. Pacienti v rameni s observací měli signifikantně horší LRC (HR 2,73; 95% CI 1,66–4,51; p < 0,0001) i DFS (HR 1,68; 95% CI 1,13–2,50; p < 0,01). Pro zajímavost, přidání CHT k reiradiaci podpořilo pouze lokální léčebný efekt; frekvence vzdálených metastáz byla překvapivě vyšší v rameni s CHT (15 %) než u observace (7,6 %) a riziko regionálního selhání bylo v rameni s CHT pouze mírně snížené [11]. Rozdíly v OS nedosáhly statistického významu (p = 0,50), ale 2letá incidence závažné toxicity byla v rameni s chemoradioterapií až 4× vyšší oproti observaci (39 vs. 10 %) [11].
V metaanalýze 16 studií Merlotti et al [38] identifikovali 522 pacientů s rHNC podstupujících postoperační reiradiaci. Byly pozorovány velmi variabilní hodnoty 2letého OS (24–81 %) a 2letého LRC (21–100 %), což autoři zdůvodnili velkou heterogenitou léčených pacientů ve smyslu histologických typů a stadií. Za hraniční minimální cut-off dávku postoperační RT byla stanovena hranice > 50 Gy [38]. Moderní techniky IMRT s využitím obrazově řízené RT (image-guided radiation therapy – IGRT) by měly být vždy upřednostněny před 3-D CRT, avšak optimální frakcionační režim zatím není znám [39]. Dávka reiradiace v postoperační indikaci je typicky 50–60 Gy, přičemž by měla být zohledněna přítomnost rizikových faktorů (R1, ECE), dávka předchozí RT, dávkově-objemové histogramy jednotlivých rizikových orgánů (organs at risk – OaR) a časový interval od předchozí RT. Ve skupině 115 pacientů s rHNC (42,6 % podstoupilo záchrannou resekci) Salama et al identifikovali dávku reiradiace a aplikaci tripletu CHT (cisplatina, paklitaxel, gemcitabin) jako nezávislé prognostické faktory LRC, OS i přežití bez progrese, přičemž za hraniční minimální cut-off hodnotu dávky ozařování byla stanovena hranice ≥ 58 Gy [40]. Některé studie potvrdily hypotézu, že eskalace dávky ≥ 60 Gy může zlepšit LRC i OS [33,41]. V retrospektivní studii 505 pacientů s rHNC (49,1 % podstoupilo záchrannou operaci) profylaktická reiradiace přilehlých lymfatických uzlin nepřinesla zlepšení 2letého OS ani LRF, a to bez ohledu na přítomnost uzlinových postižení [41]. Přesto několik kooperativních skupin doporučuje elektivní ozařování přilehlých lymfatických uzlin (LU), pokud nebyly ozářeny v minulosti. Tento léčebný postup ale nesplňuje kritéria definice reiradiace, jedná se pouze o marginální překrývání ozařovaných polí.
Indikace reiradiace lůžka tumoru dávkou 50–60 Gy může být racionální v případě přítomnosti rizikových faktorů (RF), jakými jsou: R1 resekce, ECE, lymfangioinvaze a perineurální šíření. Přidání souběžné chemoterapie k reiradiaci velmi pravděpodobně nesníží riziko vzniku metastatické choroby a určitě nezlepší OS. Vzhledem k vysokému riziku závažné toxicity je pooperační reiradiace po kompletním odstranění recidivy bez RF nedostatečně odůvodněnou intervencí a nelze ji doporučit jako standardní léčebný postup.
Reiradiace inoperabilních recidiv
Relativně vysoké procento rHNC je technicky inoperabilních vzhledem k časté multifokalitě a velkému rozsahu rekurencí. Nemožnost chirurgické intervence dále podporuje přítomnost metastatické choroby v době diagnózy lokálního relapsu, nevyhovující KPS a nesouhlas pacienta [42]. Pro tuto podskupinu pacientů představuje reiradiace jedinou léčebnou možnost s kurativním potenciálem [43].
Dávka ≥ 66 Gy do oblasti GTV u neresekabilních recidiv je asociována se zlepšením LRC i OS [41]. Eskalace dávky ≥ 66 Gy nesnižuje riziko 2letého distálního selhání ve srovnání s dávkou 60–65,9 Gy (22,8 vs. 24,3 %; p = 0,559) [41].
Ani v této klinické situaci elektivní ozařování krčních LU nezlepšuje efekt léčby, naopak tento přístup dále podporuje nárůst závažné toxicity [41]. Z tohoto důvodu jsou současná doporučení pro rozsah PTV omezena pouze na dobře vizualizované GTV s 5–10 mm koncentrickým lemem (v závislosti na přesnosti denního nastavení a používání IGRT). Při retrospektivním anatomickém mapování lokálního selhání u pacientů po reiradiaci dávkou 68 Gy pro neresekabilní recidivu bylo až 96 % relapsů lokalizovaných v oblasti předchozího GTV [44].
Radikální reiradiace bez souběžné systémové léčby přinesla variabilní výsledky LRC, DFS i OS s akceptovatelnou toxicitou [45–49]. Udávané hodnoty 1letého, 2letého, 3letého a 5letého OS byly 39–51,1 %, 27–33 %, 22 % a 11 %. Závažná toxicita se vyskytla v 18–75 % případů, což opět zdůrazňuje nutnost pozorné selekce pacientů z důvodu léčby s nejistým výsledkem.
Při interpretaci důkazů, které přinesly nerandomizované studie fáze II, je nutná značná opatrnost. Data pocházející z těchto studií jsou limitována, zkreslena malým počtem pacientů, krátkým časovým intervalem jejich sledování a faktem, že žádná z nich neobsahuje kontrolní rameno. Tyto studie obvykle zahrnují pacienty léčené s kurativním i paliativním záměrem variabilní dávkou 50–70 Gy, a navíc velké procento respondentů reiradiaci ukončilo předčasně z důvodu vysoké toxicity.
Dvě prospektivní studie fáze II zjišťovaly efekt radikální reiradiace externím paprskem v kombinaci s dvojicí cytostatik. Ve studii RTOG 96–10 byla použita kombinace 5-FU a hydroxyurey s mediánem přežití 8,5 měsíce a 2letým OS 15,2 % [19]. Ve studii RTOG 99-11 byla k reiradiaci přidána kombinace cisplatiny a paklitaxelu s mediánem přežití 12,1 měsíce, 2letým OS v 25,9 % a závažnou toxicitou až v 78 % [18].
V klinické situaci neresekabilního rHNC neexistuje žádný vědecký důkaz o tom, že reiradiace přináší výhodu v celkovém přežití ve srovnání s paliativní chemoterapií [50]. Prospektivní randomizovaná studie fáze III RTOG 04–21, která hledala odpověď na tuto otázku, byla předčasně ukončena pro malý nábor pacientů [51].
Konvenční normofrakcionovaná re-iradiace GTV s lemem 5–10 mm v dávce ≥ 66 Gy bez elektivního ozařování krčních LU je při nemožnosti chirurgické intervence alternativním léčebným postupem s teoretickou možností dlouhodobého přežívání. Podání souběžné CHT je racionální především u těch pacientů, kteří ji neabsolvovali v minulosti, přičemž nejefektivnějším režimem je kombinace cisplatiny a paklitaxelu. Dublet cytostatické léčby velmi pravděpodobně zvýší riziko závažné toxicity i riziko úmrtí, proto by měl být vyhrazen pouze pro pacienty ve výborném výkonnostním stavu a bez přítomnosti orgánové dysfunkce.
Výběr ozařovací techniky
V současné době je k dispozici několik technik radioterapie externím paprskem, které lze indikovat při potřebě reiradiace. Kromě fotonových technik IMRT, VMAT a SBRT existují důkazy o bezpečnosti a efektivitě ozařování těžkými částicemi (protony, uhlíkovými ionty). Každá z těchto technik má mírně odlišný profil toxicity, což je nutné respektovat a zohlednit při jejich indikaci. Standardní indikace částicového ozařování je limitována vysokou cenou této léčby a nedostupností v mnoha zemích.
IMRT
Moderní techniky IMRT poskytují velké množství potenciálních výhod: vyšší konformitu, lepší dávkovou distribuci, nižší radiační zátěž OaR a nižší toxicitu léčby. Zatím neexistuje důkaz o tom, že IMRT poskytuje výhodu v přežití oproti méně konformní 3-D CRT [13,45,52]. V retrospektivní analýze Lee et al [13] srovnávali léčebný efekt reiradiace s využitím IMRT s non-IMRT technikami u 105 konsekutivních pacientů, kteří v minulosti podstoupili RT s mediánem dávky 62 Gy. Při použití multivariační analýzy měli pacienti ozáření technikou IMRT signifikantně lepší přežití bez lokální progrese (locoregional progression-free survival – LRPFS) než pacienti léčení non-IMRT technikami (2leté LRPFS 52 % pro IMRT vs. 20 % pro non-IMRT; HR 0,37; 95% CI 0,19–0,76; p < 0,006). Jiné dostupné jednoramenné retrospektivní studie fáze II, ve kterých byla při reiradiaci rHNC indikována IMRT, udávají variabilní medián přežití 15–28,6 měsíce, 1leté, 2leté a 5leté OS 56–65 %, 40–58 % a 22 % a závažnou akutní a pozdní toxicitu 6–57 % a 15–48 % [13,23,44,45,52–54] (tab. 1). Frekvence obávané ruptury AC (carotid artery blowout syndrome – CABS) je 2,6 % a neovlivňuje ji ani předchozí záchranná operace, ani podání souběžné systémové léčby; jediným faktorem asociovaným s významným zvýšením CABS je akcelerovaná hyperfrakcionace [55].
Tab. 1. Reiradiace s využitím radioterapie s modulovanou intenzitou svazku. 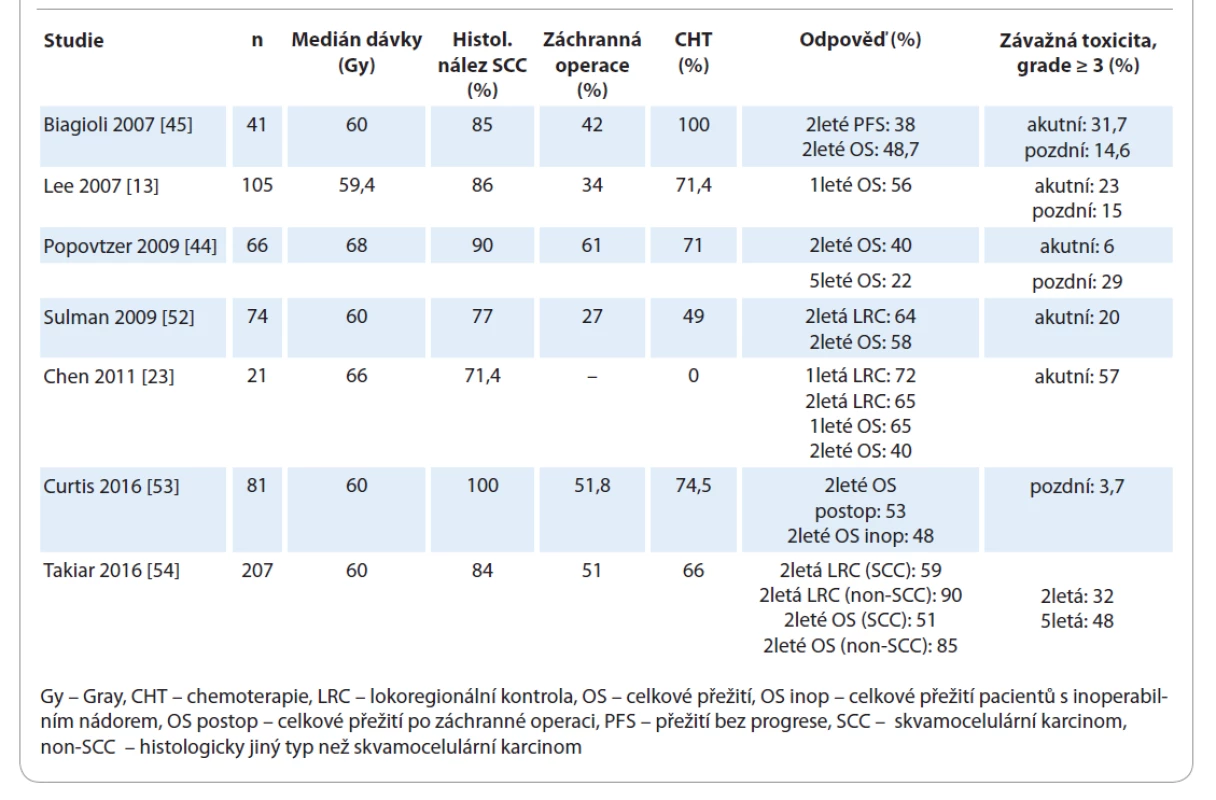
Reiradiace s využitím IMRT tak může být efektivní léčebnou intervencí s akceptovatelným profilem toxicity a s potenciálem dosažení dlouhodobé kontroly onemocnění v postoperační indikaci i u inoperabilních recidiv.
SBRT
Stereotaktická ablativní radioterapie je atraktivní formou moderní, vysoce precizní fotonové radioterapie externím paprskem a poskytuje několik zásadních radiobiologických výhod v mnoha klinických situacích [56].
Samotným principem stereotaktické RT je ozáření ablativní dávkou v několika, typicky ≤ 5 frakcích, což umožňuje zkrácení celkové doby léčby ve srovnání s technikami, které využívají normofrakcionaci [57]. Mezi cílovým objemem a okolními tkáněmi a orgány vzniká strmý dávkový spád, což snižuje celkovou radiační zátěž OaR v těsné blízkosti PTV. Mechanizmus účinku SBRT nebyl dosud zcela objasněn. Publikované vědecké práce naznačují, že redukce velikosti tumoru po ablativních dávkách RT do značné míry závisí na T-lymfocytární buněčné odpovědi [58]. Aktivace T-lymfocytů v regionálních LU je po ablativních dávkách extrémně hypofrakcionované RT dramaticky zvýšená, což vede k eradikaci tumorózní tkáně způsobem závislým na CD8+ T-lymfocytech. Imunitní odpověď navozená ablativními dávkami RT může být dále potencována imunoterapií a tato hypotéza je v současném klinickém výzkumu velmi atraktivní. Aktuálně probíhající randomizovaná studie fáze II „Keystroke“ (NCT03546582) hodnotí léčebnou odpověď přidáním pembrolizumabu k SBRT u inoperabilních rHNC, které byly v minulosti léčeny radikální RT [59].
Přesné postavení SBRT v léčbě rHNC není jednoduché definovat. Anatomicky se jedná o velmi komplexní oblast s množstvím kritických orgánů, u nichž dosud nebyl stanoven toleranční limit pro vysokou dávku v jednotlivé frakci. Konvenčně frakcionované a levnější techniky IMRT prokázaly dobrou efektivitu v léčbě rHNC a umožňují i ozařování přilehlých LU v těsné blízkosti tumorózního ložiska. Efektivitu a bezpečnost SBRT v léčbě rHNC hodnotilo několik klinických studií [60–66,68,71,76,81–83] (tab. 2). Jedná se o nerandomizované studie fáze II s limitovaným počtem pacientů a aplikovanou dávkou18–44 Gy v 3–6 frakcích. Medián přežití byl 10–12 měsíců, 1leté a 2leté OS bylo 40–47,5 % a 22–33 % a závažná toxicita se vyskytovala variabilně v 6–50 % případů.
Tab. 2. Reiradiace s využitím stereotaktické ablativní radioterapie. 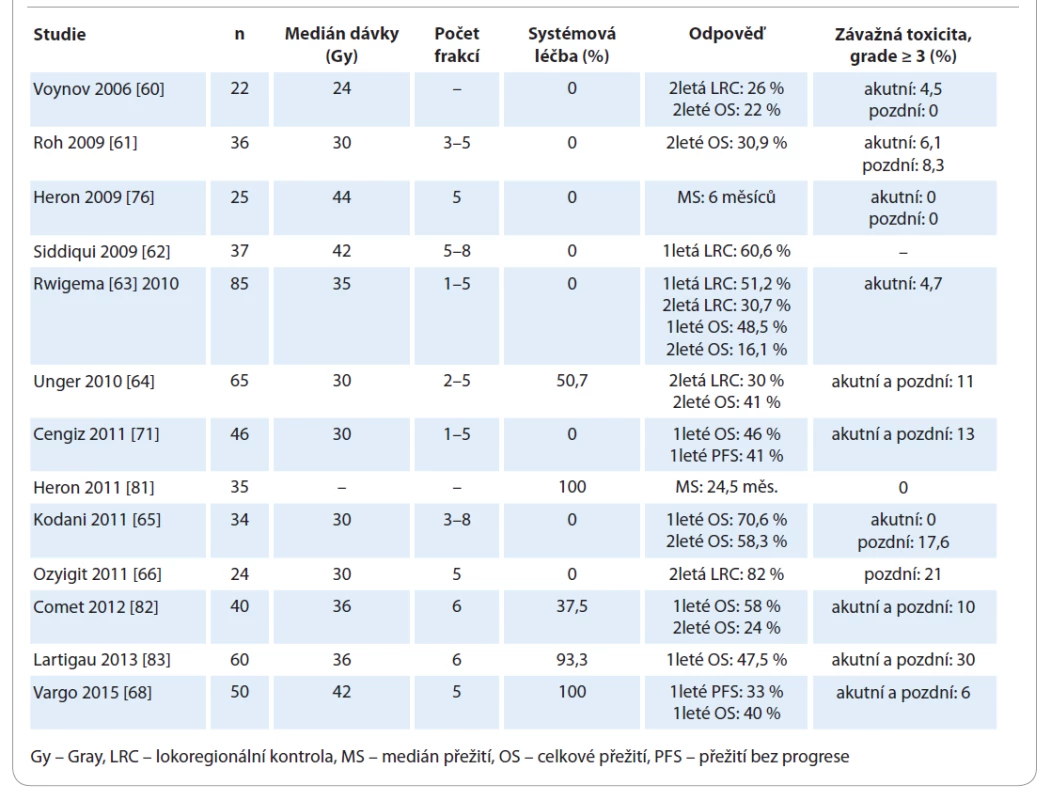
Dostupné důkazy o závažné akutní toxicitě v reiradiaci rHNC s využitím SBRT zdůrazňují potřebu pečlivé selekce pacientů. V několika retrospektivních studiích je při reiradiaci technikou SBRT udávána závažná akutní toxicita stupně ≥ 4 až u 28,6 % pacientů s výskytem CABS v 14–17 % [65,71]. Všichni pacienti, u kterých se vyskytl CABS, měli regionální recidivu do oblasti krčních LU a dávka do oblasti AC u nich činila typicky 30–31 Gy. Ruptura AC se vyskytla v případech, kdy tumor obkružoval > 50 % obvodu cévy, a tam, kde byla AC ozařována 100 % preskribované dávky. Jednoduchou strategií pro snížení incidence CABS je aplikace SBRT v dávce 35 Gy v 4–6 frakcích obden [72]. Je známých i několik teorií o stabilizaci AC pomocí lalokové rekonstrukce nebo zavedením endovaskulárního stentu před reiradiací, ale tyto hypotetické intervence nebyly zatím ověřeny, proto je nelze rutinně doporučit [73,74].
V retrospektivní studii 291 pacientů léčených SBRT pro rHNC se Ling et al [75] pokusili identifikovat prediktory závažné akutní a pozdní toxicity. Pacienti léčení SBRT pro izolovanou uzlinovou rekurenci měli nejnižší riziko pozdní toxicity. Naopak pacienti s recidivami lokalizovanými v oblasti hypofaryngu a laryngu měli až 50% riziko závažné akutní i pozdní toxicity. Hraniční cut-off hodnotou, za kterou signifikantně stoupalo riziko závažné toxicity, byla dávka > 44 Gy v 5–6 frakcích [75].
Optimální dávka a frakcionační režim nebyly zatím přesně stanoveny [76]. V retrospektivní analýze 300 pacientů s rHNC byla dávka 35–45 Gy v 5 frakcích asociována se signifikantním zlepšením LRC i OS ve srovnání s dávkou < 30 Gy v 5 frakcích [77]. Při samotném procesu konturování je doporučena koregistrace s PET/CT za účelem precizní delineace GTV. Několik prací přineslo důkazy o tom, že GTV vytvořené fúzí s PET/CT je výrazně menší, což by mohlo přinést i snížení rizika závažné toxicity spojené s SBRT [78–80].
Design historicky prvních studií hodnotících bezpečnost a efektivitu SBRT v léčbě rHNC nezahrnoval aplikaci souběžné systémové léčby. Několik studií fáze II přineslo důkazy o bezpečnosti a efektivitě cetuximabu v této indikaci [14,81–83]. Přidání cetuximabu k SBRT může zlepšit dvouletou LRC i OS ve srovnání se samostatnou SBRT [81]. Aktuálně probíhající studie fáze II hodnotí potenciální zlepšení OS přidáním docetaxelu u pacientů s rekurentními HNSCC léčených SBRT souběžně s cetuximabem [81].
Ideálním kandidátem pro reiradiaci technikou SBRT je pacient s izolovanou rekurencí do oblasti krčních LU s GTV < 25 cm3 především v případech, kdy tumor neprorůstá do stěny velkých cév a nachází se v dostatečné vzdálenosti od nich. Naopak pacient s lokálním relapsem karcinomu laryngu bude velmi pravděpodobně nevhodným kandidátem k SBRT i u GTV < 25 cm3 kvůli vysokému riziku závažné toxicity při očekávaném dlouhodobém přežívání [85]. Dávka 35–45 Gy v 5 frakcích poskytuje podobné léčebné výsledky jako konvenčně frakcionovaná IMRT se zkrácením celkového času léčby, což v sobě zahrnuje také množství logistických výhod (zkrácení doby hospitalizace, nižší ekonomické náklady na dojíždění ze strany pacienta).
IMRT vs. SBRT
Mnoho radiačních onkologů si při indikaci reiradiace pro rHNC klade otázku, zda může modernější a konformnější technika SBRT přinést i zlepšení LRC a přežívání, případně s nižší toxicitou ve srovnání s protrahovanou technikou IMRT. V retrospektivní analýze 414 pacientů s neresekabilními rHNC byli při reiradiaci použity techniky IMRT (52,4 %) a SBRT (47,2 %) [67]. Medián celkové doby léčby byl 43 dní pro IMRT a 10 dní pro SBRT (p < 0,01). Medián OS byl 13,3 měsíce (95% CI 10,5–16,9) pro pacienty léčené IMRT a 7,8 měsíce (95% CI 6,8–9,8) při použití SBRT. Při analýze dat s implementací RPA, kterou publikoval Ward et al [12], byl ve skupině II (n = 353) pozorovaný jednoznačný benefit v přežívání pro techniku IMRT (2leté OS 39,1 % pro IMRT a 18,6 % pro SBRT; p < 0,001). Ve skupině III byl pozorován trend k lepšímu OS opět ve skupině pacientů léčených IMRT (2leté OS 16,2 % pro IMRT a 3,6 % pro SBRT; p = 0,042). Indikace protrahované normofrakcionované reiradiace s využitím IMRT je v této skupině pacientů sporná; racionálnější alternativou může být zkrácený hypofrakcionovaný režim IMRT, tzv. „quad shot“ (3,7 Gy 2× denně dva konsekutivní dny po sobě, 2–4 cykly s časovým odstupem 14–28 dní) [15–17], nebo využití extrémní hypofrakcionace časově méně náročné SBRT.
V podskupině pacientů s recidivami velkého rozsahu (T3, T4 kód nebo objem tumoru > 25 cm3) bylo OS při použití IMRT významně statisticky zlepšené oproti SBRT, a to bez ohledu na to, zda aplikovaná dávka SBRT byla ≥ 35 Gy (p < 0,001) nebo < 35 Gy (p < 0,001) [67]. V případě recidiv tumorů histologicky odlišných od HNSCC (non-SCC) o objemu < 25 cm3 bylo pozorováno signifikantní zlepšení LRC při léčbě SBRT s mediánem dávky 40 Gy v 5 frakcích [68].
V retrospektivní studii Vargo et al [67] bylo velmi důležité srovnání toxicit pro obě léčebné techniky. Závažná akutní toxicita se vyskytla v 16,6 % při použití IMRT a v 11,7 % u SBRT, ale tento rozdíl nedosáhl statistického významu (p = 0,15). Akutní toxicita stupně ≥ 4 byla vyšší pro IMRT než pro SBRT (5,1 vs. 0,5 %, p < 0,01). Pozorovaná incidence závažné pozdní toxicity byla bez statisticky významného rozdílu pro obě techniky (12,4 % pro IMRT a 11,6 % pro SBRT; p = 0,69). Úmrtí v příčinné souvislosti s léčbou se vyskytla v 1,8 % u pacientů léčených IMRT a v 0,5 % u pacientů léčených SBRT (p = 0,42). Při racionální interpretaci získaných dat o toxicitě je nutné podotknout, že až 82 % pacientům léčeným IMRT v této studii byla současně podána cisplatina, zatímco pacienti léčení SBRT platinový derivát nedostávali, nejčastější aplikovanou systémovou léčbou byl v tomto případě cetuximab (53,3 %) [67]. Rozdíl v toxicitě mohl být způsoben právě odlišným typem aplikované systémové léčby.
Indikace konkrétní techniky do značné míry závisí na dostupnosti a zkušenosti v rámci jednotlivých pracovišť a zemí, ale vzhledem k podstatně rozdílnému celkovému času léčby je v terapeutickém procesu nezbytné zohlednit i preference pacienta [85].
Reiradiace těžkými částicemi
Ve srovnání s externími technikami ozařování na bázi fotonů charakterizuje radioterapii těžkými částicemi vynikající dávková distribuce, vyšší přenos lineární energie (linear energy transfer – LET) a vyšší relativní biologická efektivita (relative biological effectiveness – RBE). Hodnota RBE běžně uváděná pro protony je 1,1 [86]. Obecně akceptovaná hodnota RBE pro uhlíkové ionty používané k léčebným účelům je odhadována přibližně na 2,5–3 [87]. Komplexní poškození DNA je charakteristické pro hustě ionizující částice s vysokým LET a obvykle vede k vytvoření shluků více typů lézí DNA, které se nacházejí ve vzájemné těsné blízkosti, což znemožňuje reparaci poškozené DNA a podporuje aktivaci apoptózy nádorových buněk [88]. Vzhledem k ojedinělému mechanizmu účinku tak lze očekávat i zlepšení terapeutických výsledků u radiorezistentních rHNC, především při terapii uhlíkovými ionty, jejichž RBE je vyšší.
Reiradiace těžkými částicemi získává stále větší popularitu mezi radiačními onkology, kteří se pokoušejí zjistit, zda může mít tento druh léčby vyšší efekt a nižší toxicitu ve srovnání s fotonovou radioterapií. Nizozemská dozimetrická studie ROCOCO in silico porovnávala plány pro reiradiaci použitím techniky VMAT, protonové radioterapie s modulovanou intenzitou svazku (intensity-modulated proton therapy – IMPT) a uhlíkové radioterapie s modulovanou intenzitou svazku (intensity-modulated ion therapy – IMIT) u pacientů s rHNC [89]. Při použití IMPT a IMIT byla pozorována signifikantní redukce střední dávky (Dmean) v OaR ve srovnání s VMAT. Střední dávka v OaR byla redukována o 86 % pro IMPT a o 100 % pro IMIT. Nejvýznamnější dozimetrický benefit byl pozorován u párových kontralaterálních orgánů (AC, arytenoid, příušní a submandibulární žláza), míchy a mozkového kmene [89].
Reiradiace těžkými částicemi by mohla usnadnit eskalaci dávky do oblasti tumoru za současného významného šetření OaR [90]. Dostupné důkazy o bezpečnosti a efektivitě těchto technik zahrnují pouze retrospektivní analýzy a studie fáze II bez kontrolních ramen, s limitovaným množstvím pacientů. Medián přežití v těchto pracích byl 16,5–26,1 měsíce, hodnoty 1letého a 2letého OS byly 65,2–95,9 % a 32,7–65,2 %. Incidence závažné akutní a pozdní toxicity byla pozorována v 3,1–30 % a 8,7–37,5 % případů [90–97] (tab. 3).
Tab. 3. Reiradiace s využitím těžkých částic. 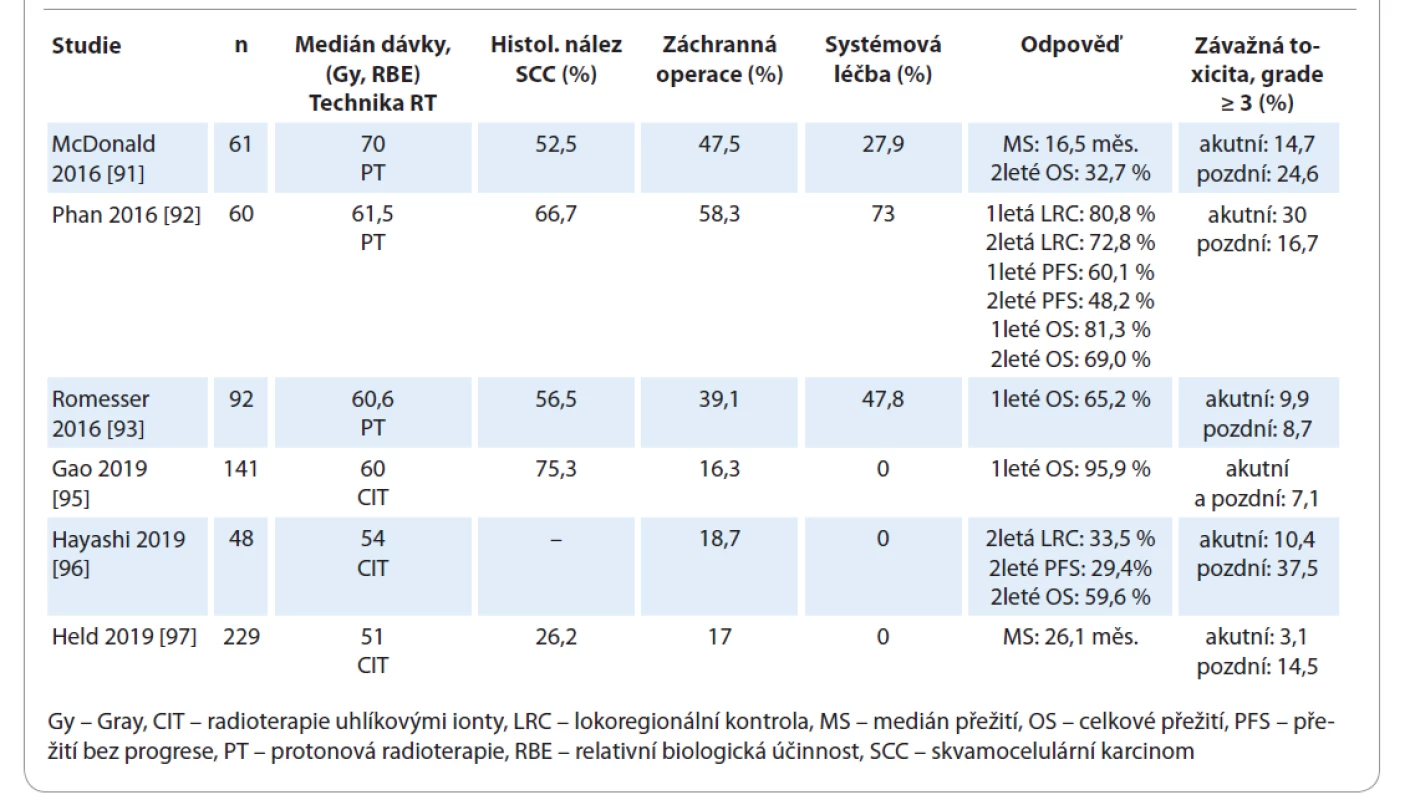
Předběžné výsledky reiradiace těžkými částicemi se zdají být příznivé z hlediska bezpečnosti i akutní toxicity, ale zatím nevyřešená otázka pozdní toxicity, vysoká cena a nedostupnost této léčby v mnoha zemích znemožňují širší implementaci těchto technik do standardní klinické praxe [85].
Závěr
Přesnou úlohu reiradiace v léčbě rHNC není jednoduché stanovit ani v éře moderních konformních technik externí radioterapie. Velkým dilematem léčby zůstává úzký terapeutický poměr, o čemž je nutné s pacientem komunikovat a poučit ho o pravděpodobnosti léčebného úspěchu za cenu poměrně vysokého rizika závažných vedlejších účinků.
U pacientů, u kterých bylo dosaženo dlouhodobé kontroly onemocnění po reiradiaci a byl jim diagnostikován další lokální relaps, se otevírá otázka bezpečnosti a efektivity opakovaného, v pořadí třetího, cyklu ozařování. Při známém faktu, že lokálně regionální progrese je nejčastější příčinou úmrtí pacientů s HNSCC, nejsou překvapením ani snahy o dosažení LRC v této podskupině pacientů. Medián přežití pacientů, kteří podstoupili další cyklus ozařování po předchozí reiradiaci, je 10 měsíců a incidence závažné toxicity je až 45 % [98].
Potenciace terapeutického efektu imunoterapií by mohla přinést slibné léčebné výsledky v budoucnosti, proto je velmi vítána účast pacientů v klinických studiích s podobným designem. Zásadní je i bližší definice pacientů s rHNC, kteří by měli být vhodnými kandidáty pro léčbu imunoterapií; odpovědi na tyto otázky jsou zatím předmětem klinického výzkumu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Michaela Švajdová
Klinika radiačnej a klinickej onkológie
ÚVN Ružomberok
Považská 1380/2
034 01 Ružomberok
Slovenská republika
e-mail: svajdovam@uvn.sk
Obdrženo/Submitted: 7. 10. 2020
Přijato/Accepted: 15. 11. 2020
Zdroje
1. Coatesworth AP, Tsikoudas A, MacLennan K. The cause of death in patients with head and neck squamous cell carcinoma. J Laryngol Otol 2002; 116 (4): 269–271. doi: 10.1258/0022215021910726.
2. Lambrecht M, Dirix P, Van den Bogaert W et al. Incidence of isolated regional recurrence after definitive (chemo) radiotherapy for head and neck squamous cell carcinoma. Radiother Oncol 2009; 93 (3): 498–502. doi: 10.1016/j.radonc.2009.08.038.
3. Baxi SS, Pinheiro LC, Patil SM et al. Causes of death in long-term survivors of head and neck cancer. Cancer 2014; 120 (10): 1507–1513. doi: 10.1002/cncr.28588.
4. Bourhis J, Le Maître A, Baujat B et al. Individual patients‘ data meta-analyses in head and neck cancer. Curr Opin Oncol 2007; 19 (3): 188–194. doi: 10.1097/CCO.0b013e3280f01010.
5. Brockstein B, Haraf DJ, Rademaker AW et al. Patterns of failure, prognostic factors and survival in locoregionally advanced head and neck cancer treated with concomitant chemoradiotherapy: a 9-year, 337 patient, multi-institutional experience. Ann Oncol 2004; 15 (8): 1179–1186. doi: 10.1093/annonc/mdh308.
6. Cooper JS, Zhang Q, Pajak TF et al. Long-term follow--up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 2012; 84 (5): 1198–1205. doi: 10.1016/j.ijrobp.2012.05.008.
7. Lippman S, Hong W. Second malignant tumors in head and neck squamous carcinoma: The overshadowing threat for patients with early-stage disease. Int J Radiat Oncol Biol Phys 1989; 17 (3): 691–694. doi: 10.1016/0360-3016 (89) 90126-0.
8. Chao KS, Ozyigit G, Tran BN et al. Patterns of failure in patients receiving definitive and postoperative IMRT for head-and-neck cancer. Int J Radiat Oncol Biol Phys 2003; 55 (2): 312–321. doi: 10.1016/s0360-3016 (02) 03940-8.
9. Leon X, Del Prado Venegas M, Orus C et al. Metachronous second primary tumours in the aerodigestive tract in patients with early stage head and neck squamous cell carcinomas. Eur Arch Otorhinolaryngol 2005; 262 (11): 905–909. doi: 10.1007/s00405-005-0922-5.
10. McDonald MW, Lawson J, Garg MK et al. ACR appropriateness criteria retreatment of recurrent head and neck cancer after prior definitive radiation expert panel on radiation oncology-head and neck cancer. Int J Radiat Oncol Biol Phys 2011; 80 (5): 1292–1298. doi: 10.1016/j.ijrobp.2011.02.014.
11. Janot F, de Raucourt D, Benhamou E et al. Randomized trial of postoperative reirradiation combined with chemotherapy after salvage surgery compared with salvage surgery alone in head and neck carcinoma. J Clin Oncol 2008; 26 (34): 5518–5523. doi: 10.1200/JCO.2007.15.0102.
12. Ward MC, iaz N, Caudell JJ et al. Refining patient selection for reirradiation of head and neck squamous carcinoma in the IMRT era: a multi-institution cohort study by the MIRI Collaborative. Int J Radiat Oncol Biol Phys 2018; 100 (3): 586–594. doi: 10.1016/j.ijrobp.2017.06.012.
13. Lee N, Chan K, Bekelman JE et al. Salvage re-irradiation for recurrent head and neck cancer. Int J Radiat Oncol Biol Phys 2007; 68 (3): 731–740. doi: 10.1016/j.ijrobp.2006.12.055.
14. Vargo JA, Ferris RL, Ohr J et al. A prospective phase 2 trial of reirradiation with stereotactic body radiation therapy plus cetuximab in patients with previously irradiated recurrent squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 2015; 91 (3): 480–488. doi: 10.1016/j.ijrobp.2014.11.023.
15. Lok BH, Jiang G, Gutiontov S et al. Palliative head and neck radiotherapy with the RTOG 8502 regimen for incurable primary or metastatic cancers. Oral Oncol 2015; 51 (10): 957–962. doi: 10.1016/j.oraloncology.2015.07.011.
16. Ma J, Lok BH, Zong J et al. Proton Radiotherapy for Recurrent or Metastatic Head and Neck Cancers with Palliative Quad Shot. Int J Part Ther 2018; 4 (4): 10–19. doi: 10.14338/IJPT-18-00003.1.
17. Corry J, Peters LJ, Costa ID et al. The ‚QUAD SHOT‘ – a phase II study of palliative radiotherapy for incurable head and neck cancer. Radiother Oncol 2005; 77 (2): 137–142. doi: 10.1016/j.radonc.2005.10.008.
18. Langer CJ, Harris J, Horwitz EM et al. Phase II study of low-dose paclitaxel and cisplatin in combination with split-course concomitant twice-daily reirradiation in recurrent squamous cell carcinoma of the head and neck: results of Radiation Therapy Oncology Group Protocol 9911. J Clin Oncol 2007; 25 (30): 4800–4805. doi: 10.1200/JCO.2006.07.9194.
19. Spencer SA, Harris J, Wheeler RH et al. Final report of RTOG 9610, a multi-institutional trial of reirradiation and chemotherapy for unresectable recurrent squamous cell carcinoma of the head and neck. Head Neck 2008; 30 (3): 281–288. doi: 10.1002/hed.20697.
20. Dionisi F, Fiorica F, D‘Angelo E et al. Organs at risk‘s tolerance and dose limits for head and neck cancer re-irradiation: a literature review. Oral Oncol 2019; 98 : 35–47. doi: 10.1016/j.oraloncology.2019.08.017.
21. Ward MC, Lee NY, Caudell JJ. A competing risk nomogram to predict severe late toxicity after modern reirradiation for squamous carcinoma of the head and neck. Oral Oncol 2019; 90 : 80–86. doi: 10.1016/j.oraloncology.2019.01.
22. Goodwin WJ Jr. Salvage surgery for patients with recurrent squamous cell carcinoma of the upper aerodigestive tract: when do the ends justify the means? Laryngoscope 2000; 110 (3 Pt 2 Suppl 93): 1–18. doi: 10.1097/000 05537-200003001-00001.
23. Chen AM, Phillips TL, Lee NY. Practical considerations in the re-irradiation of recurrent and second primary head-and-neck cancer: who, why, how, and how much? Int J Radiat Oncol Biol Phys 2011; 81 (5): 1211–1219. doi: 10.1016/j.ijrobp.2011.06.1998.
24. Tanvetyanon T, Padhya T, McCaffrey J et al. Prognostic factors for survival after salvage reirradiation of head and neck cancer. J Clin Oncol 2009; 27 (12): 1983–1991. doi: 10.1200/JCO.2008.20.0691.
25. Spencer SA, Harris J, Wheeler RH et al. RTOG 96–10: reirradition with concurrent hydroxyurea and 5-fluorouracil in patients with squamous cell cancer of the head and neck. Int J Radiat Oncol Biol Phys 2001; 51 (5): 1299–1304. doi: 10.1016/s0360-3016 (01) 01745-x.
26. Di Martino E, Sellhaus B, Hausmann R et al. Survival in second primary malignancies of patients with head and neck cancer. J Laryngol Otol 2002; 116 (10): 831–838. doi: 10.1258/00222150260293664.
27. Rennemo E, Zätterström U, Boysen M. Impact of second primary tumors on survival in head and neck cancer: an analysis of 2,063 cases. Laryngoscope 2008; 118 (8): 1350–1356. doi: 10.1002/lary.20189.
28. De Crevoisier R, Bourhis J, Domenge C et al. Reirradiation for unresectable head and neck carcinoma: experience at the Gustave-Roussy institute in a series of 169 patients. J Clin Oncol 1998; 16 (11): 3556–3562. doi: 10.1200/JCO.1998.16.11.3556.
29. Chen AM, Farwell GD, Luu Q et al. Prospective trial of high-dose reirradiation using daily image guidance with intensity-modulated radiotherapy for recurrent and second primary head-and-neck cancer. Int J Rad Oncol Biol Phys 2011; 80 (3): 669–676. doi: 10.1016/j.ijrobp.2010.02.023.
30. Parsons JT, Mendenhall WM, Stringer SP et al. Salvage surgery following radiation failure in squamous cell carcinoma of the supraglottic larynx. Int J Radiat Oncol Biol Phys 1995; 32 (3): 605–609. doi: 10.1016/0360-3016 (95) 00527-6.
31. Bachar GY, Goh C, Goldstein DP et al. Long-term outcome analysis after surgical salvage for recurrent tonsil carcinoma following radical radiotherapy. Eur Arch Otorhinolaryngol. 2010; 267 (2): 295–301. doi: 10.1007/s00405-009-1070-0.
32. Milano MT, Vokes EE, Salama JK et al. Twice-daily reirradiation for recurrent and second primary head-and-neck cancer with gemcitabine, paclitaxel, and 5-fluorouracil chemotherapy. Int J Radiat Oncol Biol Phys 2005; 61 (4): 1096–1106. doi: 10.1016/j.ijrobp.2004.08.029.
33. Langendijk JA, Bourhis J. Reirradiation in squamous cell head and neck cancer: recent developments and future directions. Curr Opin Oncol 2007; 19 (3): 202–209. doi: 10.1097/CCO.0b013e3280f00ff8.
34. Salama JK, Vokes EE. Concurrent chemotherapy and re-irradiation for locoregionally recurrent head and neck cancer. Semin Oncol 2008; 35 (3): 251–261. doi: 10.1053/j.seminoncol.2008.03.010.
35. Zafereo ME, Hanasono MM, Rosenthal DI et al. The role of salvage surgery in patients with recurrent squamous cell carcinoma of the oropharynx. Cancer 2009; 115 (24): 5723–5733. doi: 10.1002/cncr.24595.
36. De Crevoisier R, Domenge C, Wibault P et al. Full dose reirradiation combined with chemotherapy after salvage surgery in head and neck carcinoma. Cancer 2001; 91 (11): 2071–2076. doi: 10.1002/1097-0142 (20010601) 91 : 11<2071:: aid-cncr1234>3.0.co; 2-z.
37. Kasperts N, Slotman BJ, Leemans CR et al. Results of postoperative reirradiation for recurrent or second primary head and neck carcinoma. Cancer 2006; 106 (7): 1536–1547. doi: 10.1002/cncr.21768.
38. Merlotti A, Mazzola R, Alterio D et al. What is the role of postoperative re-irradiation in recurrent and second primary squamous cell cancer of head and neck? A literature review according to PICO criteria. Crit Rev Oncol Hematol 2017; 111 : 20–30. doi: 10.1016/j.critrevonc.2017.01.008.
39. Chen YJ, Kuo JV, Ramsinghani NS et al. Intensity modulated radiotherapy for previously irradiated recurrent head and neck cancer. Med Dosim 2002; 27 (2): 171–176. doi: 10.1016/s0958-3947 (02) 00100-0.
40. Salama JK, Vokes EE, Chmura SJ et al. Long-term outcome of concurrent chemotherapy and reirradiation for recurrent and second primary head-and-neck squamous cell carcinoma. Int J Radiat Oncol Biol Phys 2006; 64 (2): 382–391. doi: 10.1016/j.ijrobp.2005.07.005.
41. Caudell JJ, Ward MC, Riaz N et al. Volume, dose, and fractionation considerations for IMRT-based reirradiation in head and neck cancer: a multi-institution analysis. Int J Radiat Oncol Biol Phys 2018; 100 (3): 606–617. doi: 10.1016/j.ijrobp.2017.11.036.
42. Mabanta SR, Mendenhall WM, Stringer SP et al. Salvage treatment for neck recurrence after irradiation alone for head and neck squamous cell carcinoma with clinically positive neck nodes. Head Neck 1999; 21 (7): 591–594. doi: 10.1002/ (sici) 10970347 (199910) 21 : 7<591:: aid-hed1>3.0.co; 2-y.
43. Maddalo M, Bonomo P, Belgioia L et al. Re-irradiation with curative intent in patients with squamous cell carcinoma of the head and neck: a national survey of usual practice on behalf of the Italian Association of Radiation Oncology (AIRO). Eur Arch Otolaryngol 2018; 275 (2): 561–567. doi: 10.1007/s00405-017-4853-8.
44. Popovtzer A, Gluck I, Chepeha DB et al. The pattern of failure after reirradiation of recurrent squamous cell head and neck cancer: implications for defining the targets. Int J Radiat Oncol Biol Phys 2009; 74 (5): 1342–1347. doi: 10.1016/j.ijrobp.2008.10.042.
45. Biagioli MC, Harvey M, Roman E et al. Intensity-modulated radiotherapy with concurrent chemotherapy for previously irradiated, recurrent head and neck cancer. Int J Radiat Oncol Biol Phys 2007; 69 (4): 1067–1073. doi: 10.1016/j.ijrobp.2007.04.057.
46. Dawson LA, Myers LL, Bradford CR et al. Conformal re-irradiation of recurrent and new primary head-and-neck cancer. Int J Radiat Oncol Biol Phys 2001; 50 (2): 377–385. doi: 10.1016/s0360-3016 (01) 01456-0.
47. Grimard L, Esche B, Lamothe A et al. Interstitial low--dose-rate brachytherapy in the treatment of recurrent head and neck malignancies. Head Neck 2006; 28 (10): 888–895. doi: 10.1002/hed.20422.
48. Langendijk JA, Kasperts N, Leemans CR et al. A phase II study of primary reirradiation in squamous cell carcinoma of head and neck. Radiother Oncol 2006; 78 (3): 306–312. doi: 10.1016/j.radonc.2006.02.003.
49. Goldstein DP, Karnell LH, Yao M et al. Outcomes following reirradiation of patients with head and neck cancer. Head Neck 2008; 30 (6): 765–770. doi: 10.1002/hed.20786.
50. Creak AL, Harrington K, Nutting C. Treatment of recurrent head and neck cancer: Re-irradiation or chemotherapy? Clin Oncol (R Coll Radiol) 2005; 17 (3): 138–147. doi: 10.1016/j.clon.2004.10.008.
51. Wong SJ, Machtay M, Li Y. Locally recurrent, previously irradiated head and neck cancer: concurrent re-irradiation and chemotherapy, or chemotherapy alone? J Clin Oncol 2006; 24 (17): 2653–2658. doi: 10.1200/JCO.2005.05.3850.
52. Sulman EP, Schwartz DL, Le TT et al. IMRT reirradiation of head and neck cancer-disease control and morbidity outcomes. Int J Radiat Oncol Biol Phys 2009; 73 (2): 399–409. doi: 10.1016/j.ijrobp.2008.04.021.
53. Curtis KK, Ross HJ, Garrett AL et al. Outcomes of patients with loco-regionally recurrent or new primary squamous cell carcinomas of the head and neck treated with curative intent reirradiation at Mayo Clinic. Radiat Oncol 2016; 11 : 55. doi: 10.1186/s13014-016-0630-x.
54. Takiar V, Garden AS, Ma D et al. Reirradiation of head and neck cancers with intensity modulated radiation therapy: outcomes and analyses. Int J Radiat Oncol Biol Phys 2016; 95 (4): 1117–1131. doi: 10.1016/j.ijrobp.2016.03.015.
55. McDonald MW, Moore MG, Johnstone PA. Risk of carotid blowout after reirradiation of the head and neck: a systematic review. Int J Radiat Oncol Biol Phys 2012; 82 (3): 1083-1089. doi: 10.1016/j.ijrobp.2010.08.029.
56. Baliga S, Kabarriti R, Ohri N et al. Stereotactic body radiotherapy for recurrent head and neck cancer: A critical review. Head Neck 2017; 39 (3): 595–601. doi: 10.1002/hed.24633.
57. Timmerman RD, Herman J, Cho LC. Emergence of stereotactic body radiation therapy and its impact on current and future clinical practice. J Clin Oncol 2014; 32 (26): 2847–2854. doi: 10.1200/JCO.2014.55.4675.
58. Lee Y, Auh SL, Wang Y et al. Therapeutic effects of ablative radiation on local tumor require CD8+ T cells: changing strategies for cancer treatment. Blood 2009; 114 (3): 589–595. doi: 10.1182/blood-2009-02-206870.
59. SBRT +/ - pembrolizumab in patients with local-regionally recurrent or second primary head and neck carcinoma (KEYSTROKE). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03546582.
60. Voynov G, Heron DE, Burton S et al. Frameless stereotactic radiosurgery for recurrent head and neck carcinoma. Technol Cancer Res Treat 2006; 5 (5): 529–535. doi: 10.1177/153303460600500510.
61. Roh KW, Jang JS, Kim MS et al. Fractionated stereotactic radiotherapy as reirradiation for locally recurrent head and neck cancer. Int J Radiat Oncol Biol Phys 2009; 74 (5): 1348–1355. doi: 10.1016/j.ijrobp.2008.10.013.
62. Siddiqui F, Patel M, Khan M et al. Stereotactic body radiation therapy for primary, recurrent, and metastatic tumors in the head-and-neck region. Int J Radiat Oncol Biol Phys 2009; 74 (4): 1047–1053. doi: 10.1016/j.ijrobp.2008.09.022.
63. Rwigema JC, Heron DE, Ferris RL et al. Fractionated stereotactic body radiation therapy in the treatment of previously-irradiated recurrent head and neck carcinoma: updated report of the University of Pittsburgh experience. Am J Clin Oncol 2010; 33 (3): 286–293. doi: 10.1097/COC.0b013e3181aacba5.
64. Unger KR, Lominska CE, Deeken JF et al. Fractionated stereotactic radiosurgery for reirradiation of head-and-neck cancer. Int J Radiat Oncol Biol Phys 2010; 77 (5): 1411–1419. doi: 10.1016/j.ijrobp.2009.06.070.
65. Kodani N, Yamazaki H, Tsubokura T et al. Stereotactic body radiation therapy for head and neck tumor: disease control and morbidity outcomes. J Radiat Res 2011; 52 (1): 24–31. doi: 10.1269/jrr.10086.
66. Ozyigit G, Cengiz M, Yazici G et al. A retrospective comparison of robotic stereotactic body radiotherapy and three-dimensional conformal radiotherapy for the reirradiation of locally recurrent nasopharyngeal carcinoma. Int J Radiat Oncol Biol Phys 2011; 81 (4): 263–268. doi: 10.1016/j.ijrobp.2011.02.054.
67. Vargo JA, Ward MC, Caudell JJ et al. A Multi-institutional comparison of SBRT and IMRT for definitive reirradiation of recurrent or second primary head and neck cancer. Int J Radiat Oncol Biol Phys 2018; 100 (3): 595–605. doi: 10.1016/j.ijrobp.2017.04.017.
68. Vargo JA, Ferris RL, Ohr J et al. A prospective phase 2 trial of reirradiation with stereotactic body radiation therapy plus cetuximab in patients with previously irradiated recurrent squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 2015; 91 (3): 480–488. doi: 10.1016/j.ijrobp.2014.11.023.
69. Beitler JJ, Zhang Q, Fu KK et al. Final results of local-regional control and late toxicity of RTOG 9003: a randomized trial of altered fractionation radiation for locally advanced head and neck cancer. Int J Radiat Oncol Biol Phys 2014; 89 (1): 13–20. doi: 10.1016/j.ijrobp.2013.12.027.
70. Brown JM, Carlson DJ, Brenner DJ et al. The tumor radiobiology of SRS and SBRT: are more than the 5 R’s involved? Int J Radiat Oncol Biol Phys 2014; 88 (2): 254–262. doi: 10.1016/j.ijrobp.2013.07.022.
71. Cengiz M, Ozyigit G, Yazici G et al. Salvage reirradiaton with stereotactic body radiotherapy for locally recurrent head-and-neck tumors. Int J Radiat Oncol Biol Phys 2011; 81 (1): 104–109. doi: 10.1016/j.ijrobp.2010.04.027.
72. Yazici G, Sanli TY, Cengiz M et al. A simple strategy to decrease fatal carotid blowout syndrome after stereotactic body reirradiation for recurrent head and neck cancers. Radiat Oncol 2013; 8 : 242. doi: 10.1186/1748-717X-8-242.
73. Bates MC, Shamsham FM. Endovascular management of impending carotid rupture in a patient with advanced head and neck cancer. J Endovasc Ther 2003; 10 (1): 54–57. doi: 10.1177/152660280301000112.
74. Chmura SJ, Milano MT, Haraf DJ. Reirradiation of recurrent head and neck cancers with curative intent. Semin Oncol 2004; 31 (6): 816–821. doi: 10.1053/j.seminoncol.2004.09.003.
75. Ling DC, Vargo JA, Ferris RL et al. Risk of severe toxicity according to site of recurrence in patients treated with stereotactic body radiation therapy for recurrent head and neck cancer. Int J Radiat Oncol Biol Phys 2016; 95 (3): 973–980. doi: 10.1016/j.ijrobp.2016.02.049.
76. Heron DE, Ferris RL, Karamouzis M et al. Stereotactic body radiotherapy for recurrent squamous cell carcinoma of the head and neck: results of a phase I dose-escalation trial. Int J Radiat Oncol Biol Phys 2009; 75 (5): 1493–1500. doi: 10.1016/j.ijrobp.2008.12.075.
77. Vargo JA, Moiseenko V, Grimm J et al. Head and neck tumor control probability: radiation dose-volume effects in stereotactic body radiation therapy for locally recurrent previously-irradiated head and neck cancer: report of the AAPM Working Group. Int J Radiat Oncol Biol Phys 2018; S0360–3016 (18) 30107-X. doi: 10.1016/j.ijrobp.2018.01.044. Online ahead of print.
78. Deantonio L, Beldi D, Gambaro G et al. FDG-PET/CT imaging for staging and radiotherapy treatment planning of head and neck carcinoma. Radiat Oncol 2008; 3 : 29. doi: 10.1186/1748-717X-3-29.
79. Moule RN, Kayani I, Moinuddin SA et al. The potential advantages of (18) FDG PET/CT-based target volume delineation in radiotherapy planning of head and neck cancer. Radiother Oncol 2010; 97 (2): 189–193. doi: 10.1016/j.radonc.2010.04.025.
80. Wang K, Heron DE, Clump DA et al. Target delineation in stereotactic body radiation therapy for recurrent head and neck cancer: A retrospective analysis of the impact of margins and automated PET-CT segmentation. Radiother Oncol 2013; 106 (1): 90–95. doi: 10.1016/j.radonc.2012.11.008.
81. Heron DE, Rwigema JC, Gibson MK et al. Concurrent cetuximab with stereotactic body radiotherapy for recurrent squamous cell carcinoma of the head and neck: a single institution matched case-control study. Am J Clin Oncol 2011; 34 (2): 165–172. doi: 10.1097/COC.0b013e3181dbb73e.
82. Comet B, Kramar A, Faivre–Pierret M et al. Salvage stereotactic reirradiation with or without cetuximab for locally recurrent head-and-neck cancer: a feasibility study. Int J Radiat Oncol Biol Phys 2012; 84 (1): 203–209. doi: 10.1016/j.ijrobp.2011.11.054.
83. Lartigau EF, Tresch E, Thariat J et al. Multi institutional phase II study of concomitant stereotactic reirradiation and cetuximab for recurrent head and neck cancer. Radiother Oncol 2013; 109 (2): 281–285. doi: 10.1016/j.radonc.2013.08.012.
84. Stereotactic body radiation therapy (SBRT) with cetuximab +/ – docetaxel followed by adjuvant cetuximab +/ – docetaxel in recurrent, previously-irradiated squamous cell carcinoma of the head and neck (SCCHN). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02057107.
85. Svajdova M, Dubinsky P, Kazda T. Radical external beam reirradiation in the treatment of recurrent head and neck cancer: critical review. Head Neck 2021; 43 (1): 354-366. doi: 10.1002/hed.26485.
86. Paganetti H. Significance and implementation of RBE variations in proton beam therapy. Technol Cancer Res Treat 2003; 2 (5): 413–426. doi: 10.1177/153303 460300200506.
87. Weyrather WK, Debus J. Particle beams for cancer therapy. Clin Oncol 2003; 15 (1): S23–S28. doi: 10.1053/clon. 2002.0185.
88. Asaithamby A, Hu B, Chen DJ. Unrepaired clustered DNA lesions induce chromosome breakage in human cells. Proc Natl Acad Sci USA 2011; 108 (20): 8293–8298. doi: 10.1073/pnas.1016045108.
89. Eekers DBP, Roelofs E, Jelen U et al. Benefit of particle therapy in re-irradiation of head and neck patients. Results of a multicentric in silico ROCOCO trial. Radiother Oncol 2016; 121 (3): 387–394. doi: 10.1016/j.radonc.2016.08.020.
90. Cheng Q, Roelofs E, Ramaekers B et al. EP-1480: development and validation of a proton decision support system comparing dose, toxicity and cost-effectiveness. Radiother Oncol 2016; 118 (2): 281–285. doi: 10.1016/j.radonc.2015.12.029.
91. McDonald MW, Zolali-Meybodi O, Lehnert SJ et al. Reirradiation of recurrent and second primary head and neck cancer with proton therapy. Int J Radiat Oncol Biol Phys 2016; 96 (4): 808–819. doi: 10.1016/j.ijrobp.2016.07.037.
92. Phan J, Sio TT, Nguyen TP et al. Reirradiation of head and neck cancers with proton therapy: outcomes and analyses. Int J Radiat Oncol Biol Phys 2016; 96 (1): 30–41. doi: 10.1016/j.ijrobp.2016.03.053.
93. Romesser PB, Cahlon O, Scher ED et al. Proton beam reirradiation for recurrent head and neck cancer: multi-institutional report on feasibility and early outcomes. Int J Radiat Oncol Biol Phys 2016; 95 (1): 386–395. doi: 10.1016/j.ijrobp.2016.02.036.
94. Verma V, Rwigema JM, Malyapa RS et al. Systematic assessment of clinical outcomes and toxicities of proton radiotherapy for reirradiation. Radiother Oncol 2017; 125 (1): 21–30. doi: 10.1016/j.radonc.2017.08.005.
95. Gao J, Hu J, Guan X et al. Salvage carbon-ion radiation therapy for locoregionally recurrent head and neck malignancies. Scientific Reports 2019; 9 (1): 4259. doi: 10.1038/s41598-019-39241-y.
96. Hayashi K, Koto M, Ikawa H et al. Feasibility of Re-irradiation using carbon ions for recurrent head and neck malignancies after carbon-ion radiotherapy. Radiother Oncol 2019; 136 : 148–153. doi: 10.1016/j.radonc.2019.04.007.
97. Held T, Windisch P, Akbaba S et al. Carbon ion reirradiation for recurrent head and neck cancer: a single-institutional experience. Int J Radiat Oncol Biol Phys 2019; 105 (4): 803–811. doi: 10.1016/j.ijrobp.2019.07.021.
98. Xu AJ, Luo L, Leeman JE et al. Beyond reirradiation: Efficacy and safety of three or more courses of radiation for head and neck malignancies. Clin Transl Radiat Oncol 2020; 23 : 30–34. doi: 10.1016/j.ctro.2020.04.009.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Radikální reiradiace rekurentních nádorů hlavy a krku s využitím zevní radioterapie
- Význam 18F-FDG-PET vyšetření v léčbě adenokarcinomu jícnu a gastroezofageální junkce – přehled
- FDG-PET/ CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra
- Posuzování zdravotního stavu pro účely dávek a služeb sociálního zabezpečení u osob s karcinomem plic a ekonomický dopad tohoto onemocnění na sociální zabezpečení v České republice
- Cielená liečba Xp11 translokačného renálneho karcinómu
- Zriedkavý histopatologický nález po pľúcnej resekcii u dieťaťa
- Výskyt dvoch histopatologicky odlišných malígnych nádorov
- Význam 177Lu-PSMA v léčbě kastračně-rezistentního karcinomu prostaty
- Postižení dutiny ústní onkologických a hematoonkologických pacientů
- Onkologické důsledky epidemie COVID-19
- Metastáza spinálního procesu u pacienta s EGFR mutovaným plicním adenokarcinomem
- Aktuality z odborného tisku
- Reiradiace u nádorů hlavy a krku
- Onemocnění asociované s IgG4
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Onemocnění asociované s IgG4
- Postižení dutiny ústní onkologických a hematoonkologických pacientů
- FDG-PET/ CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra
- Význam 18F-FDG-PET vyšetření v léčbě adenokarcinomu jícnu a gastroezofageální junkce – přehled
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



