-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Maligní nádory peritonea – úvod do problematiky
Malignant Peritoneal Tumors – Introduction
This article provides an introduction to peritoneal tumors, which are the subject of a series of review papers published in Issue 5 (2019) of Klinicka onkologie. Many malignant peritoneal tumors are characterized by production of mucinous and gelatinous masses, multiple peritoneal disability, so-called peritoneal carcinomatosis, and various grades of malignancy depending on their origin, staging, and histological type. Malignant peritoneal tumors are rare and their clinical symptomatology is nonspecific and varies according to the extent of disability. Diagnosis, particularly in the initial asymptomatic stages, is very complicated and often impossible, and tumors are often diagnosed by chance during other operations. Malignant peritoneal tumors were regarded as incurable and lethal for a long time; however, this view has changed over the past three decades. The Sugarbaker method, a combination of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy, was introduced in the 1990s. Postoperative cytostatic lavage is usually performed in specific cases. Classifications for the extent of disease and completeness of cytoreduction were established. Studies repeatedly confirmed the efficacy of this treatment for peritoneal malignancy. The combination of an aggressive surgical approach and intraperitoneal chemotherapy not only enhances quality of life, but also prolongs progression-free survival and overall survival in selected patients. Specialized centers for treatment of peritoneal malignancy were established based on results from the Czech Republic and around the world. These centers provide complex care, including specific surgical interventions and follow-up, for selected patients with primary and secondary peritoneal malignancy.
Keywords:
peritoneal tumors – peritoneal metastases – cytoreductive surgery – intraperitoneal chemotherapy
Autoři: Petr Bartoška 1; František Antoš 1; Libor Nemec 2; David Hoskovec 3; Petr Dytrych 3; Miroslav Levý 4; Dušan Klos 5; Jiří Tomášek 6
Působiště autorů: Chirurgická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 1; Klinika operační onkologie, Masarykův onkologický ústav, Brno 2; I. chirurgická klinika 1. LF UK a VFN v Praze 3; Chirurgická klinika 1. LF UK a Thomayerovy nemocnice, Praha 4; I. chirurgická klinika LF UP a FN Olomouc 5; Klinika komplexní onkologické péče, LF MU a Masarykův onkologický ústav, Brno 6
Vyšlo v časopise: Klin Onkol 2019; 32(5): 324-328
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2019324Souhrn
Článek je úvodem do problematiky peritoneálních nádorů, kterým se věnují přehledové práce publikované v čísle 5 (2019) časopisu Klinická onkologie. Zhoubné peritoneální nádory jsou často charakterizovány produkcí hlenu a gelových hmot, mnohočetným postižením peritonea – tzv. peritoneální karcinomatózou a různým stupněm malignity, v závislosti na původu, rozsahu a histologickém typu onemocnění. Výskyt tohoto typu nádorového onemocnění je vzácný, klinické projevy jsou nespecifické a mohou se velice odlišovat v závislosti na rozsahu postižení. Diagnostika je zvláště v počátečních asymptomatických stadiích onemocnění velmi obtížná, nezřídka nemožná. K jejímu stanovení dochází často náhodně, až během jiné operace. Tyto nádory byly dlouho považovány za nádory inkurabilní, s infaustní prognózou. Tento názor doznal v posledních 30 letech zásadních změn. V 90. letech 20. století byla do klinické praxe zavedena Sugarbakerem metoda cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie. Ve specifických případech byla rozšířena i o pooperační cytostatickou laváž. Byla vytvořena klasifikace rozsahu onemocnění a efektivity chirurgického zákroku. Výsledky opakovaně potvrdily účinnost této metody při léčbě peritoneálních malignit. Kombinace agresivního chirurgického přístupu s intraperitoneální chemoterapií může tedy nejen zvýšit kvalitu života, ale i prodloužit období bez progrese onemocnění a celkové přežití. Na základě dosažených výsledků byla založena centra zaměřená na léčbu peritoneálních malignit ve světě i u nás, ve kterých je vybraným pacientům s primárními i sekundárními peritoneálními nádory poskytována komplexní péče, vč. specifických chirurgických zákroků a dispenzarizace.
Klíčová slova:
peritoneální nádory – peritoneální metastázy – cytoredukční chirurgie – intraperitoneální chemoterapie
Úvod
Pobřišnice (peritoneum), zaujímající plochu 1,5–2 m2, je serózní blána tvořená jednovrstevným plochým epitelem mezodermového původu (mezotelem) a tenkou vrstvou pojiva, která vystýlá dutinu břišní a pánevní (parietální peritoneum) a pokrývá jejich orgány (viscerální peritoneum). Výskyt nádorů pobřišnice je relativně vzácný, ale vzhledem k jejich problematické neinvazivní diagnostice neexistují přesné epidemiologické údaje. Epiteliální nádory se na peritoneu vyskytují častěji než mezenchymální a sekundární nádory častěji než primární (tab. 1) [1]. Mnohočetné nádorové postižení peritonea se označuje jako peritoneální karcinomatóza, tento termín poprvé použil Sampson v roce 1931 při popisu peritoneálních metastáz ovariálního karcinomu [2]. Nejčastější příčinou peritoneální karcinomatózy je implantačně probíhající metastatický rozsev při karcinomu tlustého střeva a konečníku, žaludku či vaječníku. Historicky byla přítomnost nádorových depozit na peritoneu vnímána jako inkurabilní stav s rychlou progresí a s infaustní prognózou. V posledních desetiletích se tento názor zásadně mění díky inovativním léčebným strategiím a novým chirurgickým technikám [3].
Tab. 1. Nádory peritonea [1]. ![Nádory peritonea [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e8a40014b2424d102a146cd343b9b6b9.png)
NET – neuroendokrinní tumor, MANEC – smíšený adenoneuroendokrinní karcinom, GIST – gastrointestinální stromální tumor Symptomatologie peritoneálních nádorů
Symptomatologie peritoneálních nádorů je nespecifická, obvykle odpovídá rozsahu onemocnění – od asymptomatického průběhu s minimálním klinickým nálezem po ascites, hmatné rezistence ve stěně a dutině břišní a různě rozvinuté příznaky střevní a ureterální obstrukce.
Diagnostika peritoneálních nádorů
Diagnostika peritoneálních nádorů zobrazovacími metodami je obtížná, platí to zejména pro limitované postižení pobřišnice. Efektivita konvenčních zobrazovacích vyšetření je nízká – senzitivita počítačové tomografie (computed tomography – CT) se pohybuje kolem 30 % při vysoké specificitě (69–99 %). U většího peritoneálního postižení může CT s kontrastem prokázat ztluštění peritonea, infiltraci omenta a ascites. Obvykle je ale nález na CT podhodnocen a peroperační nálezy bývají rozsáhlejší [4,5]. Přínosná může být někdy magnetická rezonance (magnetic resonance imaging – MRI), popř. v kombinaci s pozitronovou emisní tomografií / počítačovou tomografií (PET/CT), pro diagnostiku peritoneální infiltrace nemá ale vyšší výpovědní hodnotu než CT. Pro posouzení průchodnosti trávicího traktu je vedle endoskopických vyšetření možné použít i další dynamické zobrazovací vyšetřovací metody, jako je kupříkladu CT kolografie nebo CT či MRI enterografie. V současnosti zůstává zlatým standardem pro diagnostiku peritoneálních nádorů diagnostická laparoskopie/laparotomie s biopsií peritonea, a to navzdory tomu, že se jedná o diagnostickou metodu invazivní.
Klasifikace peritoneálního rozsevu
Staging peritoneálních nádorů je obtížný, pro stanovení možností účinné léčby je nezbytná kvantifikace rozsahu peritoneálního postižení, která se v současnosti provádí nejčastěji stanovením PCI (peritoneal cancer index) peroperačně [6] – v průběhu laparotomie či laparoskopie. Odhad PCI pomocí předoperačního CT (CT-PCI) a MRI (MRI-PCI) je poměrně nepřesný ve smyslu podhodnocení.
PCI rozděluje dutinu břišní do třinácti abdominopelvických regionů vč. čtyř regionů tenkého střeva, s možností nabývat hodnot od 0–3. Maximální dosažitelná hodnota PCI je tedy 39 (obr. 1). Z kalkulace PCI se odvíjí strategie chirurgické léčby, lze z něj také odhadnout výskyt pooperačních komplikací i celkovou prognózu.
Obr. 1. Peritoneal cancer index. 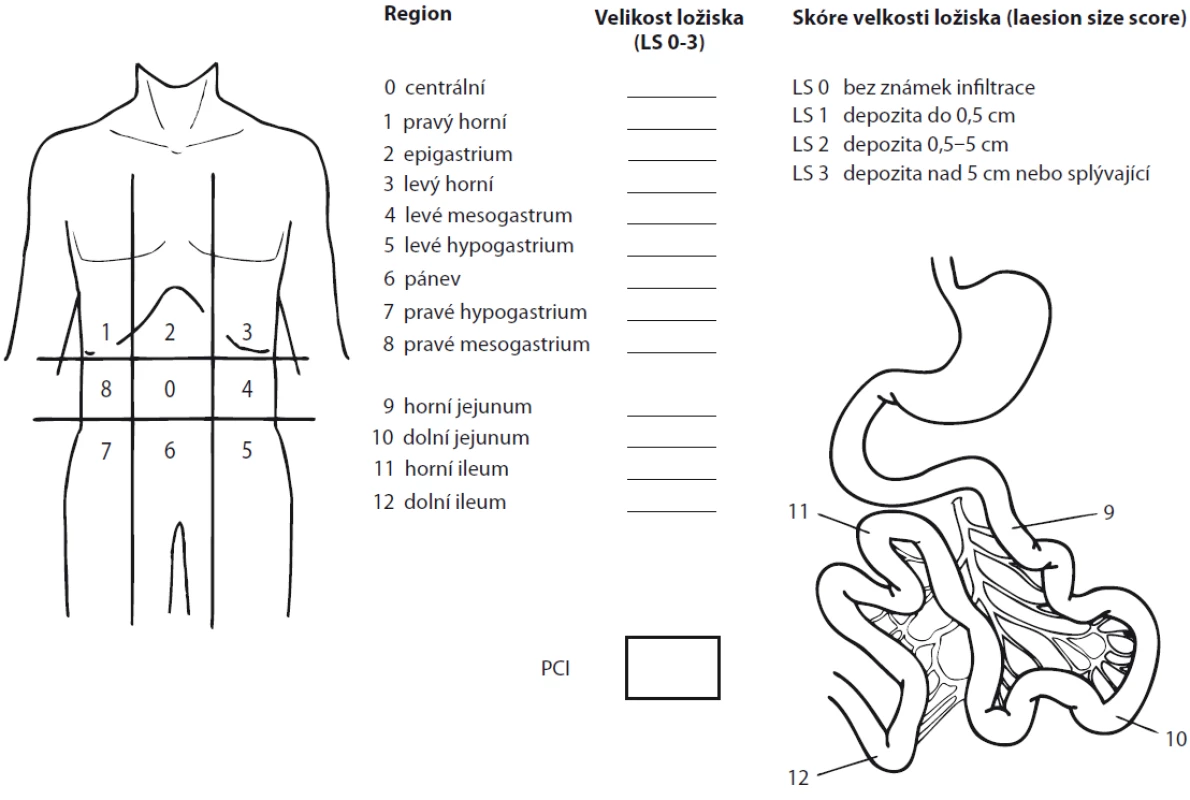
Principy lokální léčby peritoneálních nádorů
S odkazem na původní práci Spratta et al [7] v 80. letech 20. století klinicky odzkoušel a popsal léčebnou metodu kombinující chirurgickou cytoredukci (cytoreductive surgery – CRS) s hypertermickou intraperitoneální chemoterapií (hyperthermic intraperitoneal chemotherapy – HIPEC) Sugarbaker z Washingtonu. Sugarbaker je právem pokládán za otce a průkopníka metody a zároveň za živoucí legendu neúnavně předávající své dlouholeté terapeutické zkušenosti novým chirurgickým generacím. Sugarbakerova metoda kombinuje makroskopickou a mikroskopickou destrukci nádorových hmot: CRS odstraňuje všechna viditelná ložiska, cílem HIPEC je likvidace reziduálních depozit lokálním účinkem zahřátého chemoterapeutika aplikovaného ve vyšší koncentraci než při podání intravenózním. Teplota lavážovacího roztoku s chemoterapeutikem se pohybuje okolo 42 °C, což zajišťuje jeho vyšší cytotoxický účinek a hlubší průnik chemoterapeutika do postižených tkání. Z dalších metod intraperitoneálně aplikované chemoterapie se používá nejčastěji časná pooperační intraperitoneální chemoterapie (early postoperative intraperitoneal chemotherapy – EPIC), kdy se normotermicky aplikuje chemoterapeutikum ve dnech bezprostředně následujících po operačním výkonu, a relativně nově i PIPAC (pressurized intraperitoneal aerosol chemotherapy), kdy se do dutiny břišní normotermicky aplikuje během laparoskopie chemoterapeutikum ve formě aerosolu vyso-kotlakým injektorem. Při správné indikaci přináší kombinace CRS s intraperitoneální chemoterapií vybraným nemocným s peritoneálními nádory nepochybné zlepšení kvality života a prodloužení doby bez příznaků onemocnění i celkového přežití.
Postupem času se léčebná strategie CRS/HIPEC rozšířila celosvětově, autoritou v problematice peritoneálních nádorů je v současnosti Mezinárodní skupina léčby malignit peritoneálního povrchu (The Peritoneal Surface Oncology Group International – PSOGI). Ta doporučuje CRS a HIPEC jako standard v léčbě peritoneálního mezoteliomu, pseudomyxomu peritonea a peritoneální karcinomatózy malého a středního rozsahu u kolorektálního karcinomu. V případě peritoneálních metastáz karcinomu ovaria a žaludku je podle PSOGI možné CRS a intraperitoneální chemoterapii u vybraných nemocných úspěšně použít, k její standardizaci je ale zapotřebí vyčkat na výsledky probíhajících klinických studií. Obecně by se CRS měla provádět jen u těch pacientů, u nichž není postiženo více než šest regionů a jejichž PCI nepřevyšuje hodnotu 20. Výjimkou je pseudomyxom peritonea, kde může PCI dosahovat hodnot vyšších, u peritoneálních metastáz kolorektálního karcinomu a karcinomu žaludku je naopak doporučovaná hodnota PCI nižší. Limitujícím faktorem úspěšnosti CRS je postižení tenkého střeva – u pacientů, jejichž nález je natolik pokročilý, že nelze provést střevní resekci pro vysoké riziko vzniku syndromu krátkého střeva, se CRS považuje za nevhodnou. Laparoskopická CRS je dnes považována v určitých případech za proveditelnou a bezpečnou, předpokládá se, že její význam se bude v budoucnosti dále zvyšovat [8].
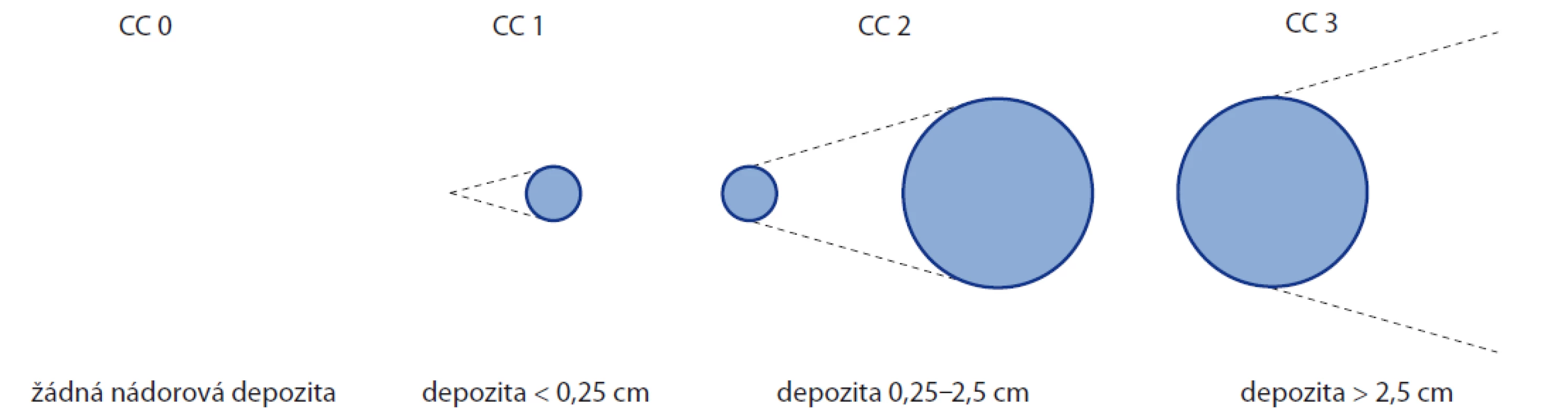
Pro popis radikality cytoredukčního výkonu se většinou neužívá jinak všeobecně přijatá „R klasifikace“ AJCC/UICC (American Joint Committee on Cancer / Union for International Cancer Control) [9] hodnotící nepřítomnost či makroskopickou nebo mikroskopickou přítomnost nádorového rezidua po ukončení operace (R0, R1, R2), ale tzv. CC score (completeness of cytoreduction after surgery) [10] kvantifikující velikost makroskopicky zjevných reziduálních nádorových ložisek po provedeném cytoredukčním výkonu (obr. 2). Cílem radikální chirurgické léčby je dosažení CC score 0/1, které vykazuje nejlepší terapeutické výsledky – důvodem je předpoklad, že nádorová rezidua do 2,5 mm jsou celkem spolehlivě ničena pomocí HIPEC [11–13].
Morbidita a mortalita cytoredukce a intraperitoneální chemoterapie
Kompletní CRS s intraperitoneálně podanou chemoterapií u pokročilého peritoneálního postižení představuje mnohahodinový výkon zahrnující vedle peritonektomie zpravidla resekce orgánů dutiny břišní a nutnost následného (i vícečetného) obnovení kontinuity trávicí trubice, což je pochopitelně spojeno s vyšší mírou operačního rizika, nežli je tomu u operačních výkonů menšího rozsahu. Z literárních údajů zřetelně vyplývá, že nové zavedení metody cytoredukční léčby s HIPEC je na daném pracovišti spojeno s vyšší četností pooperačních komplikací [14]. Komplikace kombinovaného CRS a HIPEC výkonu vychází jednak z toxicity použitého cytostatika a jednak z komplikací samotného operačního výkonu. Z chirurgických komplikací jsou to nejčastěji střevní perforace, píštěle a abscesy, pooperační ileus, krvácení, raný infekt či sepse, objevit se mohou ale i píštěle pankreatické a biliární. Z extraabdominálních komplikací se vyskytují nejčastěji respirační infekce, toxicita použitého chemoterapeutika vede cca v 11 % případů k dřeňovému útlumu a leukopenii, v 6–8 % případů působí chemoterapeutikum nefrotoxicky [15,16].
K minimalizaci komplikací přispívá vhodná selekce pacientů, adekvátní perioperační péče, a především zdokonalování operační techniky – s narůstajícím počtem výkonů pooperační morbidita i mortalita klesá, learning curve se pohybuje okolo 100 výkonů [17]. Aktuální studie uvádějí morbiditu a mortalitu CRS/HIPEC v deseti mezinárodních velkoobjemových centrech v rozsahu 12–52 %, resp. 0,9–5,8 % [18].
Systémová léčba peritoneálních nádorů
S výjimkou ovariálních karcinomů a primárního peritoneálního karcinomu má systémová chemoterapie v léčbě většiny peritoneálních nádorů limitovanou účinnost, což se připisuje především existenci tzv. plazma-peritoneální bariéry a dále specificky nízkému krevnímu zásobování pobřišnice omezujícímu průnik intravenózně podaného chemoterapeutika do nádorové peritoneální infiltrace [19].
Návrh dispenzarizace po CRS/HIPEC:
- sledování v centrech provádějících CRS + HIPEC (onkochirurgem zpravidla doživotně, onkologem v případě kompletní remise obvykle 10 let – v souladu s doporučením České onkologické společnosti);
- sledování klinického a nutričního stavu pacienta, laboratorní kontroly vč. nádorových markerů;
- v pravidelných intervalech zobrazovací a endoskopická vyšetření k monitoraci remise a vyloučení relapsu a extraperitoneální manifestace onemocnění.
Závěr podle konsenzu PSOGI:
- CRS/HIPEC se považují za standardní terapeutické metody u pseudomyxomu peritonea, peritoneálního mezoteliomu a malého a středního peritoneálního postižení u kolorektálního karcinomu;
- CRS/HIPEC se u vysoce selektovaných pacientů může uplatnit i v léčbě peritoneálních metastáz žaludečního a ovariálního karcinomu, což ověřují probíhající klinické studie;
- CRS a HIPEC by se neměly provádět u pacientů, u kterých nelze provést kompletní nebo téměř kompletní resekci všech peritoneálních depozit;
- CRS a HIPEC by se neměly provádět u pacientů se závažnými komorbiditami;
- léčebná strategie pacientů s peritoneálními nádory by měla být diskutována v multidisciplinárním týmu cytoredukčních center, mimo něž by se CRS a HIPEC neměly provádět.
Podpořeno MZ ČR – RVO (NNB, 00064211; MOÚ, 00209805; VFN, 00064165; TN, 00064190; FNOl, 00098892).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 7. 8. 2019
MUDr. Petr Bartoška
Chirurgická klinika Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: bartoska.petr@centrum.cz
Zdroje
1. Di Giorgio A, Pinto E (eds). Treatment of peritoneal surface malignancies. Springer-Verlag Italia 2015.
2. Sampson JA. Implantation peritoneal carcinomatosis of ovarian origin. Am J Pathol 1931; 7 (5): 423–444.
3. Klos D, Riško J, Stašek M et al. Současné postavení cytoredukční chirurgie (CRS) a intraperitoneální hypertermické chemoterapie (HIPEC) v multimodální léčbě nádorů peritoneálního povrchu. Cas Lek Cesk 2018; 157 (8): 419–428.
4. Yan TD, Haveric N, Carmignani CP et al. Abdominal computed tomography scans in the selection of patients with malignant peritoneal mesothelioma for comprehensive treatment with cytoreductive surgery and perioperative intraperitoneal chemotherapy. Cancer 2005; 103 (4): 839–849. doi: 10.1002/cncr.20836.
5. Koh JL, Yan TD, Glenn D et al. Evaluation of preoperative computed tomography in estimating peritoneal cancer index in colorectal peritoneal carcinomatosis. Ann Surg Oncol 2009; 16 (2): 327–333. doi: 10.1245/s10434-008-0234-2.
6. Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat Res 1996; 82 (3): 359–374.
7. Spratt JS, Adcock RA, Muskovin M et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res 1980; 40 (2): 256–260.
8. Passot G, Bakrin N, Isaac S et al. Postoperative outcomes of laparoscopic vs open cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy for treatment of peritoneal surface malignancies. Eur J Surg Oncol 2014; 40 (8): 957–962. doi: 10.1016/j.ejso.2013.10.002.
9. Wittekind C, Compton C, Quirke P et al. A uniform residual tumor (R) classification: integration of the R classification and the circumferential margin status. Cancer 2009; 115 (15): 3483–3488. doi: 10.1002/cncr.24320.
10. Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat Res 1996; 82 : 359–374. doi: 10.1007/978-1-4613-1247-5_23.
11. Sugarbaker PH. Peritonectomy procedure. Ann Surg 1995; 221 (1): 29–42. doi: 10.1097/00000658-199501000-00004.
12. Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome. Eur J Surg Oncol 2001; 27 (3): 239–243. doi: 10.1053/ejso.2000.1038.
13. Sugarbaker PH. New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome? Lancet Oncol 2006; 7 (1): 69–76. doi: 10.1016/S1470-2045 (05) 70539-8.
14. Franko J, Shi Q, Meyers JP et al. Prognosis of patients with peritoneal metastatic colorectal cancer given systemic therapy: an analysis of individual patient data from prospective randomised trials from the Analysis and Research in Cancers of the Digestive System (ARCAD) database. Lancet Oncol 2016; 17 (12): 1709–1719. doi: 10.1016/S1470-2045 (16) 30500-9.
15. Ansari N, Chandrakumaran K, Dayal S et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours. Eur J Surg Oncol 2016; 42 : 1035–1041. doi: 10.1016/j.ejso.2016.03.017.
16. Mehta SS, Gelli M, Agarwal D et al. Complications of cytoreductive surgery and HIPEC in the treatment of peritoneal metastasis. Indian J Surg Oncol 2016; 7 (2): 225–229. doi: 10.1007/s13193-016-0504-6.
17. Kusamura S, Moran BJ, Sugarbaker PH et al. Multicentre study of the learning curve and surgical performance of cytoreductive surgery with intraperitoneal chemotherapy for pseudomyxoma peritonei. Br J Surg 2014; 101 (13): 1758–1765. doi: 10.1002/bjs.9674.
18. Baratti D, Kusamura, Pietrantonio F et al. Progress in treatments for colorectal cancer peritoneal metastases during the years 2010–2015. A systematic review. Crit Rev Oncol Hematol 2016; 100 : 209–222. doi: 10.1016/ j.critrevonc.2016.01.017.
19. van der Speeten K, Stuart OA, Sugarbaker PH. Using pharmacologic data to plan clinical treatments for patients with peritoneal surface malignancy. Curr Drug Discov Teachnol 2009; 6 (1): 72–81.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Peritoneální nádoryČlánek Pseudomyxom peritoneaČlánek LymfangioleiomyomatózaČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Peritoneální nádory
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Aktuality z odborného tisku
- Onkologie v obrazech
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání