-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAlopecie a poškození vlasů indukované onkologickou terapií
Alopecia and Hair Damage Induced by Oncological Therapy
Damage and loss of hair (alopecia) is a predictable adverse event of oncological therapy. It can be caused by chemotherapy, radiotherapy, or targeted and hormonal therapy. From the point of view of patients with malignant disease, hair loss is one of the most feared side effects and adversely affects their mental health. Hair loss can be diffuse, complete, partial, or regional. Worsening of hair quality, cutaneous inflammation, and scarring can also occur. Eyelashes, eyebrows, and body hair can also be lost. Alopecia is mostly reversible, but permanent damage can occur depending on the type, overall length, and dose of oncological treatment and other factors. The risk of alopecia is high with high-dose docetaxel, doxorubicin, and cyclophosphamide, but low with platinum chemotherapy, melphalan, and capecitabin. Targeted therapy and immunotherapy can cause immune-mediated alopecia such as alopecia areata and scarring alopecia as well as paradoxically hypertrichosis and trichomegaly. Physical and pharmacological approaches can be used to prevent and treat alopecia; however, their effectiveness and availability are limited. Modern radiotherapy scalp-sparing methods minimize hair loss. Good results have been obtained with scalp cooling, which reduces the toxic effects of cytostatic agents on hair follicles during short infusion regimens. Several systems cool the scalp to less than 22°C. Minoxidil accelerates hair regrowth and is used as a topical therapy. Psychological support and provision of cosmetically acceptable head coverings are also very important.
Keywords:
radiotherapy – side effects – Quality of life – alopecia – Hormonal therapy – hirsutism
Autoři: Hana Jedličková 1; Samuel Vokurka 2; Radovan Vojtíšek 2; Anna Malečková 3
Působiště autorů: Dermatovenerologické oddělení, FN Brno 1; Onkologická a radioterapeutická klinika LF UK a FN Plzeň 2; Biomedicínské centrum, Ústav histologie a embryologie, LF UK v Plzni 3
Vyšlo v časopise: Klin Onkol 2019; 32(5): 353-359
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2019353Souhrn
Poškození a ztráta vlasů (alopecie) jsou předvídatelným nežádoucím účinkem onkologické léčby. Mohou být způsobeny chemoterapií či radioterapií v oblasti hlavy a krku, příp. i cílenou a hormonální léčbou. Ztráta vlasů patří k nejobávanějším nežádoucím účinkům léčby z pohledu pacientů, kteří se současně vyrovnávají s realitou onkologického onemocnění. Ztráta vlasů může být difuzní, kompletní, částečná nebo ložisková, dochází též ke zhoršení kvality vlasů, příp. zánětu a jizvení pokožky. Výpadek postihuje i řasy, obočí i ochlupení těla. Alopecie je většinou reverzibilní, může ale dojít i k trvalému poškození v závislosti na typu, celkové délce, dávce onkologické léčby a řadě dalších individuálních faktorů. Zvýšené riziko alopecie mají vysoké dávky docetaxelu, doxorubicinu, cyklofosfamidu, nízké riziko je spojeno s preparáty platiny, melfalanem, kapecitabinem. U cílené terapie a imunoterapie pozorujeme imunitně podmíněné alopecie, jako je alopecie areátní a jizvící, ale paradoxně i hypertrichózu a trichomegalii. Existují možnosti fyzikální i farmakologické prevence a léčby alopecie, jejich účinnost a dostupnost je však limitována. Výpadek vlasů se daří redukovat u moderních metod radioterapie, které šetří oblast kštice. Dobré výsledky má chlazení kštice během krátkých infuzních režimů, které omezuje toxický účinek cytostatika na vlasový folikul. K dispozici je několik chladicích systémů s ochlazením pokožky pod 22 °C. V lokální terapii se používá minoxidil, který urychluje zarůstání kštice. Velmi důležitá je psychologická podpora a dostupnost kosmeticky přijatelných náhrad.
Klíčová slova:
alopecie – radioterapie – hormonální léčba – nežádoucí účinky – kvalita života – hirsutizmus
Úvod
Poškození a ztráta vlasů (alopecie) jsou předvídatelným nežádoucím účinkem onkologické léčby s významným dopadem na kvalitu života pacienta. Postižení může být způsobeno chemoterapií, radioterapií v oblasti hlavy a krku, příp. i dalšími metodami onkologické terapie. Ztráta vlasů může být difuzní, kompletní nebo ložisková, dochází též ke zhoršení kvality vlasů, příp. zánětu a jizvení pokožky, výpadek může postihovat řasy, obočí i ochlupení těla. Alopecie je většinou reverzibilní, může ale dojít i k trvalému poškození v závislosti na typu, celkové délce a dávce onkologické léčby. V českém onkologickém písemnictví (časopis Klinická onkologie) nebyla tato problematika podle našeho vědomí doposud prezentována a obecně nebývá častým námětem publikací, jakkoliv je alopecie často zmiňována jako charakteristická komplikace chemoterapie.
Struktura vlasu
Vlasový folikul (obr. 1) vzniká z vychlípení fetální epidermis a dermálního mezenchymu, který vytvoří vlasovou papilu. Folikul tvoří funkční jednotku s mazovou žlázou a hladkým svalem musculus arrector pili, v axilární a pubické oblasti i s apokrinními žlázkami. Počet folikulů se po narození nemění. Ve folikulu se tvoří tři typy vlasů: prenatálně fetální lanugo; postnatálně terminální vlas – silný, s dření, pigmentem a papilou v subcutis; velusový vlas – tenčí, kratší, s řídkým pigmentem a bez dřeně, s papilou v koriu. Vlasový folikul má několik částí: dolní bulbus s aktivně se dělící matrix, která produkuje vlas, s papilou s cévním zásobením; suprabulbární část; istmus mezi připojením svalu a ústím mazové žlázy a nad ním infundibulum (ústí). V istmu se nachází důležitá struktura – vlasový hrbolek, který obsahuje kmenové buňky nutné pro obnovu vlasu. Terminální vlas má několik vrstev: dřeň, kortex a kutikulu, která přechází ve vnitřní vlasovou pochvu s vlastní kutikulou, vrstvami Huxleyovou a Henleovou, na kterou navazuje vnější vlasová pochva krytá PAS (periodic acid schiff) pozitivní hyalinní vrstvou. Celý folikul je obalen vnější vazivovou pochvou.
Obr. 1. Histologická stavba vlasového folikulu, mikrofotografi e, měřítka vpravo dole 50 μm (foto A. Malečková). 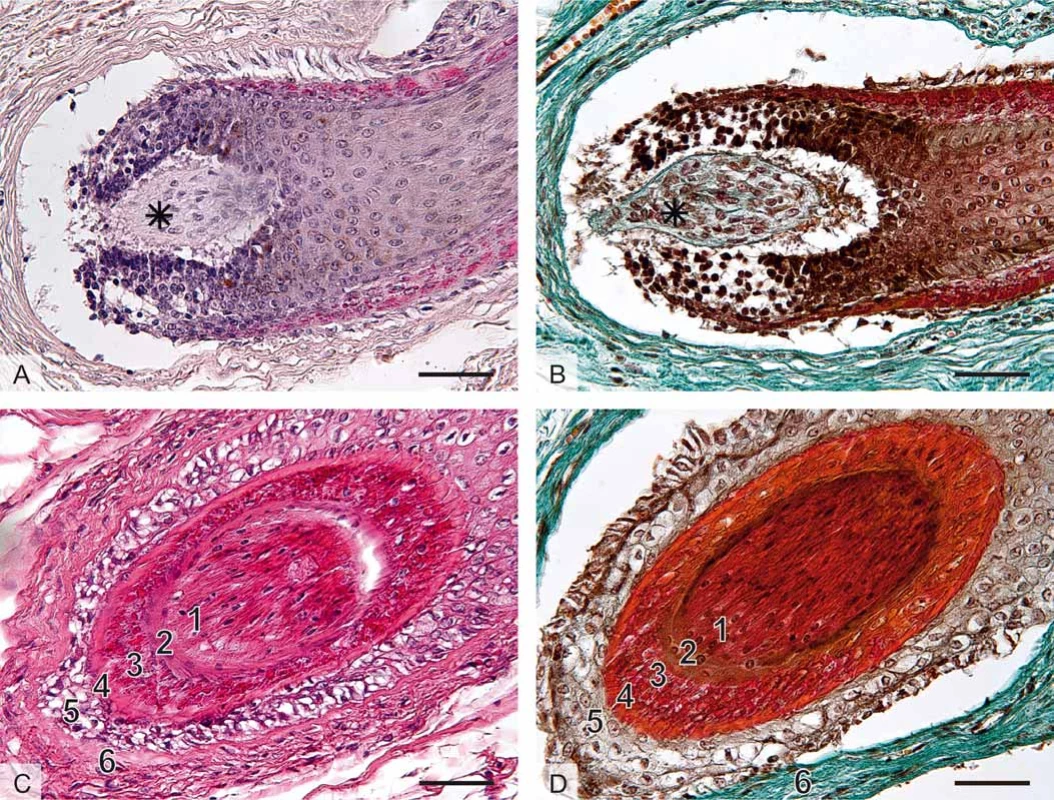
A. Histologický řez oblastí vlasové cibulky (bulbus pili), axilla, barvení hematoxylin a eozin.
B. Barvení trichrom. Na podélném řezu je zachycena vlasová cibulka (bulbus) – ztluštělý epitelový začátek vlasu (chlupu), který představuje zárodečnou oblast vlasového (chlupového) folikulu a samotného vlasu (chlupu). Cibulka obsahuje mitoticky se dělící buňky keratinocyty a melanocyty. Vlasová papila (hvězdička) představuje vchlípení řídkého kolagenního vaziva do cibulky. Papila obsahuje nervová zakončení a kapilární kličku důležitou pro cévní zásobení cibulky.
C. Příčný řez vlasovým folikulem, labium majus, barvení hematoxylin a eozin.
D. Axilla, barvení trichrom: 1) terminální vlas, 2) kutikula pochvy, 3) Huxleyova vrstva, 4) Henleova vrstva, 5) vnější epitelová pochva, 6) vazivová pochva.Rozlišujeme několik typů ochlupení: vlasy (capilli), vousy (barbae), chloupky v podpaží (hirci), ochlupení pohlavní (pubes). Dále řasy (cilia), obočí (supercilia), chloupky v nose (vibrissae), uších (tragi), ochlupení ostatního povrchu (velusový vlas). Pouze dlaně, plosky, rty, labia minora, klitoris, glans penis a pupek nemají ochlupení. U dospělého jedince je v kštici asi 100–150 tisíc vlasů, denně za normálních podmínek vypadne 90–150 vlasů. Normální vlas povyroste asi o 0,3 mm denně.
Vlas prochází vlasovým cyklem, který má čtyři části: anagen, katagen, telogen a exogen. Anagen je růstová část cyklu trvající 2–5 let (průměr 1 000 dní) a ve zdravé kštici by mělo být 80–90 % vlasů v anagenní fázi. Katagen je přechodné období, které trvá cca 10 dní, kdy vlas přestává růst a dochází k masivní apoptóze buněk v dolní části folikulu. Telogen je klidová fáze trvající 3 měsíce, ve které se nachází 10–15 % vlasů a kdy dochází ke kompletnímu odloučení vlasu od pochev dolní části folikulu a posouvání směrem k infundibulu. Zároveň se již formuje zárodek nové papily a nového bulbu. V exogenu (teloptosis) vlas vypadává.
Hodnocení intenzity alopecie
Ztráta vlasů se hodnotí různými způsoby. Často užívaná je škála podle Deanové nebo hodnocení podle manuálů NCI-CTC AE (National Cancer Institute Common Terminology Criteria for Adverse Events), příp. kritéria Světové zdravotnické organizace pro nežádoucí účinky protinádorové terapie (tab. 1) [1–4]. Jako poškození mírné se prakticky hodnotí ztráta vlasů do 50 %, kdy začíná být již patrná, ale prořídnutí lze ještě začesat a není nutné používat paruky či pokrývky hlavy [2,4,5].
Tab. 1. Kritéria hodnocení závažnosti alopecie. 
Chemoterapií indukovaná alopecie
Chemoterapie zasahuje do křehké rovnováhy vlasového cyklu několika způsoby. Cytotoxické látky poškozují především rychle se dělící buňky matrix vlasového bulbu, což vede k zástavě růstu vlasu, disrupci a odloučení vlasového stvolu v suprabulbární části a anagennímu výpadku vlasů. Mírnější poškození dělících se buněk u nižších dávek vede ke ztenčení vlasu (Pohlův-Pinkusův fenomén) v době chemoterapie a pozdějšímu ulomení v infundibulu [6]. Kmenové buňky v istmu jsou v klidové fázi, proto nemusí být poškozeny a po ukončení chemoterapie jsou zdrojem buněk pro obnovený růst vlasů. Pokud jsou však poškozeny, vlasový cyklus se neobnoví a dochází k trvalé alopecii.
Chemoterapie s největší pravděpodobností alopecie bývá využívána především při léčbě germinálních nádorů, karcinomů prsu, ovaria, sarkomů, akutních leukemií a lymfomů. Přesné určení rizikovosti jednotlivých cytostatik, příp. i protokolů ve vztahu k alopecii nebývá vždy dostatečně prostudováno, a tedy ani definováno, údaje jednotlivých pozorování mohou být zatíženy různou mírou nepřesnosti nebo variability, přičemž se na rozvoji alopecie může podílet i celá řada dalších individuálních faktorů. Kromě typu chemoterapie závisí výpadek vlasů na velikosti dávky a kombinaci cytostatik v protokolu, na intervalech a délce podávání. Vliv má i věk, předchozí poškození vlasů a přidružená onemocnění (např. androgenní alopecie), onemocnění štítné žlázy nebo chemoterapie v minulosti (obr. 2 s difuzním efluviem kombinované etiologie).
Obr. 2. Difuzní efluvium kombinované etiologie (foto H. Jedličková). 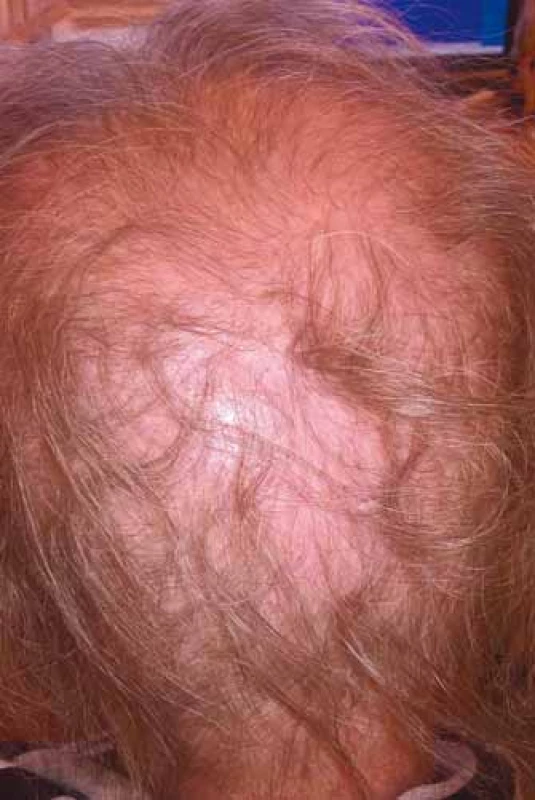
Mezi cytostatika s vysokým rizikem výpadku vlasů (nad 50 % incidence) lze řadit kromě protokolů vysokodávkované chemoterapie v rámci transplantací krvetvorných buněk především doxorubicin, epirubicin, paklitaxel a docetaxel, dále ifosfamid, temozolomid, vyšší dávky cyklofosfamidu, mechloretamin, lomustin, dakarbazin, ale také etoposid a irinotekan. Nižší riziko (do 50 %) se udává pro bleomycin, cabazitaxel, ixabepilon, eribulin, fluorouracil, gemcitabin, metotrexát, mitomycin, mitoxantron, idarubicin, topotekan, floxuridin a vinca alkaloidy. Výpadek vlasů téměř nezpůsobuje nebo s rizikem do 10 % fludarabin, kladribin, kapecitabin, bendamustin, melfalan p. o., cisplatina, karboplatina a oxaliplatina (tab. 2) [4,7].
Tab. 2. Vybraná cytostatika a pravděpodobnost alopecie [4,7]. ![Vybraná cytostatika a pravděpodobnost
alopecie [4,7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/70200a52f3b40568f1691e5bbca79e9b.png)
Trvalá totální alopecie je rizikem u intenzivní terapie germinálních tumorů a karcinomu prsu, kde podle některých studií může dosahovat až 30 %. Může se objevit v rámci transplantací krvetvorných buněk, po vysokodávkované chemoterapii s busulfanem, cyklofosfamidem, thiotepou, karboplatinou. Ireverzibilní alopecii působí např. docetaxel v dávkách vyšších než 75 mg/m2 [4,8].
Vlasy začínají vypadávat asi týden po zahájení chemoterapie, u 2-a 3týdenních režimů je do 4 týdnů výpadek kompletní. Výpadek vlasů je nejrychlejší v místech, kde bývají řidší vlasy (temeno, vertex), což je stejné jako u androgenní alopecie, a může být i ložiskový. Vlasový cyklus se obnovuje záhy po ukončení chemoterapie, zarůstání pak do 3–6 měsíců. U týdenních režimů je výpadek pomalejší, vlasy mohou začít zarůstat již před ukončením chemoterapie. Obnovené vlasy mohou mít jinou i lepší kvalitu, mohou zkudrnatět (obr. 3), získat jiný odstín, růst bílé i v horizontálních pruzích (fenomén praporku u metotrexátu). Tyto změny bývají reverzibilní. Řasy, obočí a ostatní ochlupení mohou vypadávat později, zpravidla i rychleji zarůstají. Časté je zhoršení kvality vlasů, prořídnutí a šedivění s odstupem měsíců od terapie [9].
Obr. 3. Změna kvality vlasů po chemoterapii – kudrnatost (foto H. Jedličková). 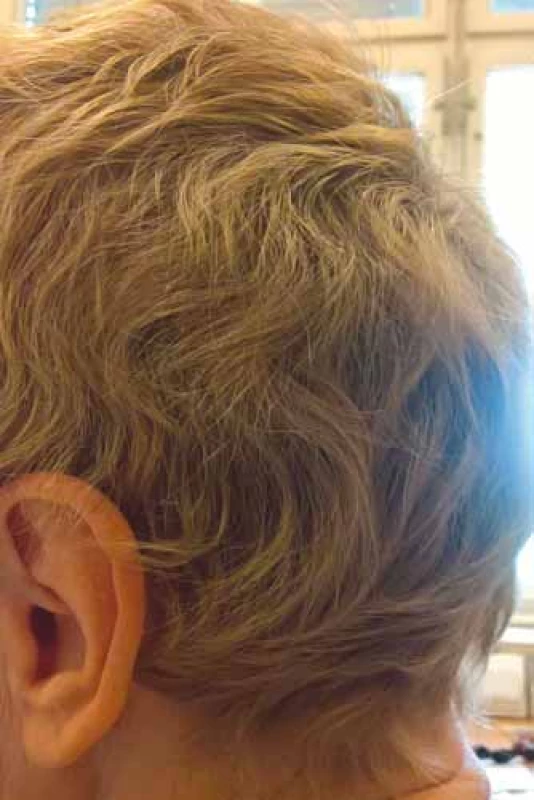
Poškození vlasů u cílené terapie a imunoterapie
Molekuly cílené terapie mohou způsobovat difuzní prořídnutí vlasů a alopecie pak bývá velmi často v případě léčby s vis-modegibem (až 64 %) a vemurafenibem (až 45 %), ale způsobuje ji významně i sorafenib (14–67 %), regorafenib (až 24 %), dabrafenib (až 22 %), objevit se může i v případě léčby s ribociklibem a palbociklibem v kombinaci s hormonální terapií [4]. Jizvící alopecie (obr. 4) vzniká imunitním zánětem, který nenávratně destruuje folikul. Je popsána i jako nežádoucí účinek dlouhodobé terapie inhibitory receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) cetuximabem, gefitinibem a erlotinibem [8]. Riziko alopecie v případě imunoterapie (anti-PD-1/PD-L1, anti-CTLA4) bývá do 2 % a v případě ipilimumabu byla popsána alopecia areata – nejčastější typ imunologicky podmíněné alopecie [4,7,10].
Obr. 4. Alopecie jizvící, pokročilé stadium (foto H. Jedličková). 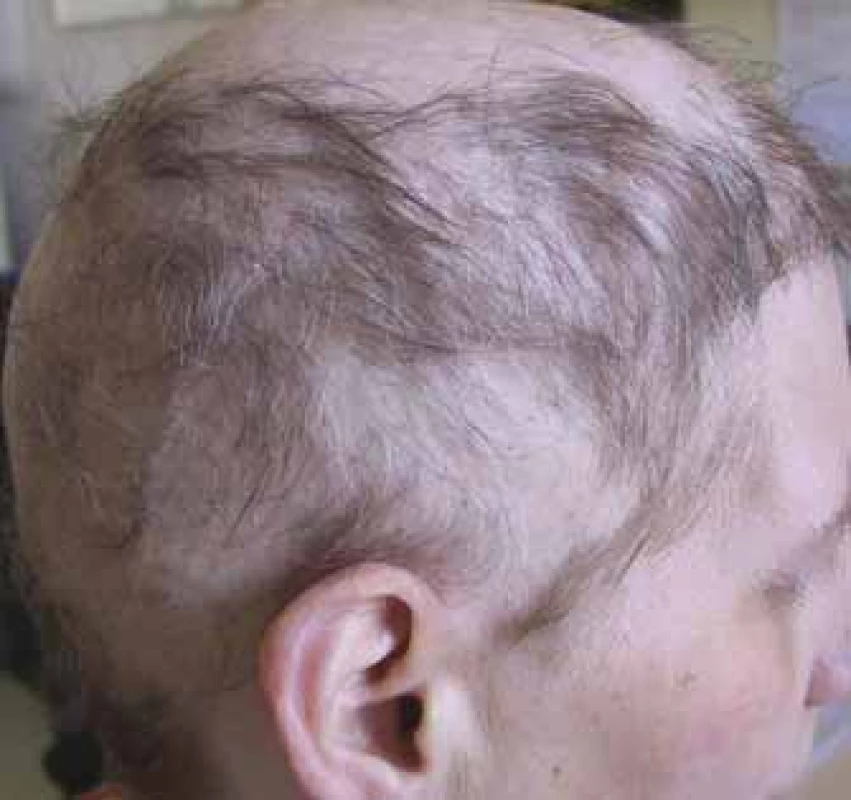
Poškození vlasů u hormonální terapie
Kortikosteroidy ve středních dávkách růst vlasů podporují a jsou využívány v terapii imunitně podmíněných alopecií. Výpadkem ale může pacient reagovat při vysokých dávkách kortikoidů, prořídnutím a ztenčením vlasů pak při dlouholeté terapii. Účinky hormonální terapie se také kombinují s předchozí chemoterapií. Prořídnutí vlasů se dále objevuje při léčbě s antiestrogeny (tamoxifen) a inhibitory aromatázy a úbytek vlasů je podobný jako u androgenní alopecie [8].
Radioterapie
Radioterapie poškozuje dělící se matrix vlasu, anagenní vlas je velmi citlivý na ozáření a dochází k anagennímu efluviu, předčasnému katagenu a následně telogennímu efluviu [11,12].
Dočasné nebo trvalé vypadávání vlasů se začíná zpravidla objevovat za 2–3 týdny při konvenční frakcionaci a je omezeno na ozařovanou oblast. Stupeň a eventuální reverzibilita alopecie závisí na celkové aplikované dávce radioterapie a rovněž na typu použitého záření. Dávka působící trvalou alopecii je značně individuální. Není-li však alopecie trvalá, začínají vlasy opět růst přibližně za 1–3 měsíce po skončení radioterapie. Nenastane-li nový růst do 6 měsíců, zpravidla již vlasy nenarostou.
Při radioterapii primárních mozkových nádorů a mozkových metastáz se v dnešní době standardně využívají vysoce konformní techniky radioterapie, ať už se jedná o klasickou 3D konformní radioterapii, radioterapii s modulovanou intenzitou svazku, objemově modulovanou radioterapii kyvem, anebo o stereotaktickou radiochirurgii či radioterapii. Tyto techniky umožňují přesnější dodání dávky do hlubších cílových struktur a umožňují více šetřit oblast kštice, takže výpadek vlasů bývá mírnější, lokalizovaný a nemusí být nutně trvalý [13]. Standardně používané fotonové záření také má charakteristický kůži šetřící efekt, kdy je maximum dávky deponováno v určité hloubce (v závislosti na energii záření) pod místem vstupu svazku záření, což dále vede k možné redukci vzniku alopecie [7]. Příkladem výše uvedených skutečností může být výsledek studie, ve které byla použita technika ozáření celého mozku s šetřením hippokampu a ve které nedošlo v období 1–2 měsíců po radioterapii k žádnému výpadku vlasů [14]. V jiné studii s radioterapií primárních mozkových nádorů s šetřením kštice bylo popsáno riziko vzniku akutní alopecie u dávky 16 Gy na oblast kštice 49 %, u dávky 30 Gy pak bylo toto riziko 80 %, přesto však u 87 % pacientů došlo po 6 měsících od ukončení léčby k uspokojivému narůstání vlasů [15].
Abnormální růst vlasů, hirsutizmus, hypertrichóza
Hypertrichózu, zvláště v obličeji, příp. i hirsutizmus působí typicky léčba s kortikosteroidy. Hirsutizmus byl ale popsán také u EGFR inhibitorů, u kterých je popisován i abnormální růst vlasů, bývá pozorována trichomegalie, nadměrná délka a kroucení řas i obočí (obr. 5), i když zároveň může docházet k prořídnutí kštice. Změna barvy vlasů a kudrnacení byla popsána u sunitinibu, pazopanibu, EGFR inhibitorů, BRAF inhibitorů, inhibitorů Brutonovy tyrozin kinázy a také při léčbě s anti-CTLA-4 a anti-PD-1/PD-L1 [4,16,17].
Obr. 5. Trichomegalie při terapii inhibitory EGFR (foto H. Jedličková, archiv Dermatovenerologického oddělení, FN Brno). 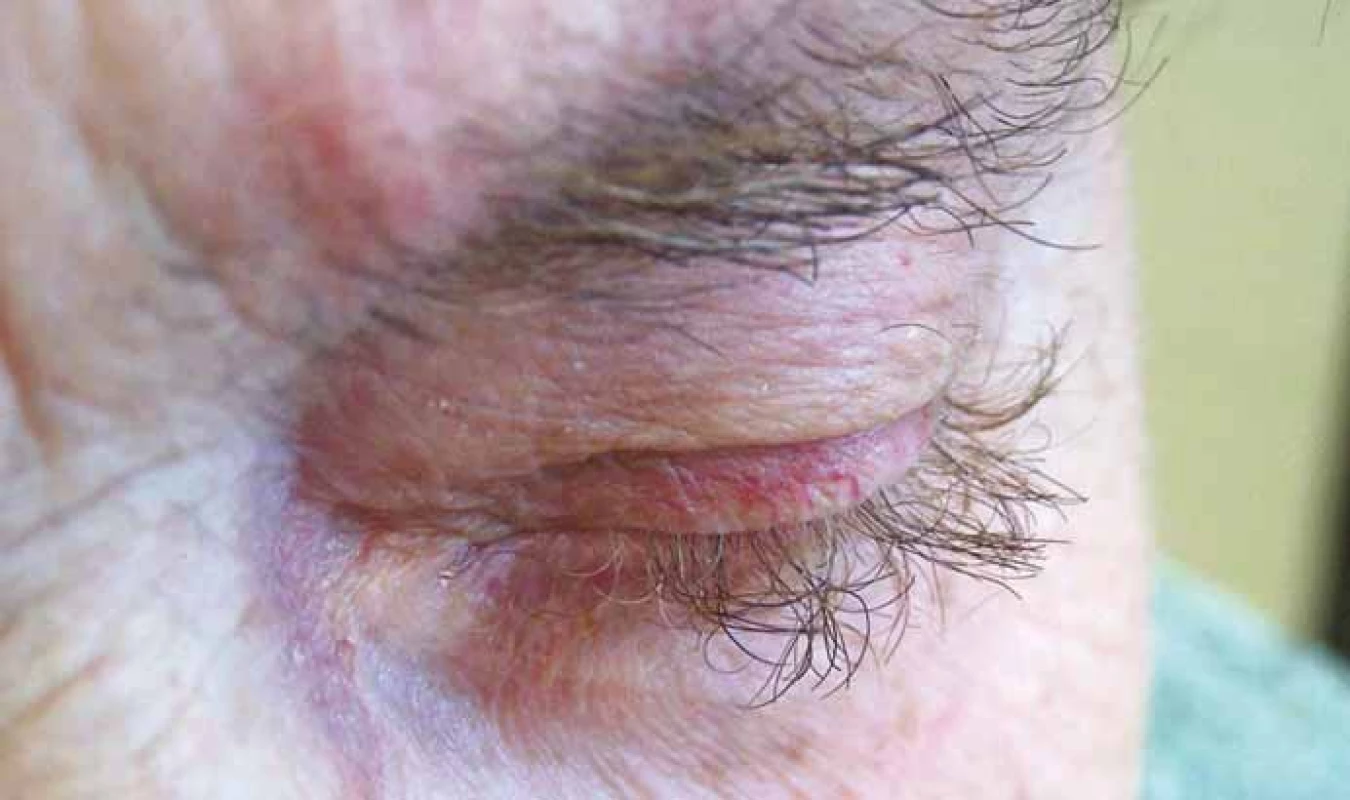
Terapie alopecie
Výhled alopecie je deprimující zvláště pro ženy, pro které znamená ztrátu atraktivity a sebevědomí, prohlubuje depresi z vážné diagnózy, nese společenské stigma onkologického onemocnění. I řada mužů pociťuje nepříznivý dopad ztráty vlasů – cítí se zranitelnější a infantilní. Jen malá část pacientů vnímá ztrátu vlasů jako nutné zlo v cestě za vyléčením [10]. Léčba alopecie v současnosti má bohužel jen omezené možnosti.
Podpůrná opatření
Je důležité s pacienty prodiskutovat hrozící ztrátu vlasů ještě před zahájením onkologické léčby a s ohledem na její charakter a připravit je i na možnost případné ztráty trvalé. Před zahájením chemoterapie není vhodné vlasy odbarvovat, kulmovat a používat trvalou, protože tyto úpravy narušují strukturu vlasu a poškození může být výraznější. K mytí je vhodné používat šetrné dětské šampony. Doporučuje se před chemoterapií s předpokládanou ztrátou vlasů ostříhat vlasy na krátko, aby rozdíl nebyl pro okolí tak nápadný a výpadek byl méně technicky a psychicky zatěžující. Vhodné je již s předstihem doporučit pacientkám specializovanou prodejnu paruk, aby si vybraly svůj přirozený odstín a střih. Paruky se mohou doplňovat nebo nahrazovat šátky, klobouky apod.
Fyzikální terapie
Ochlazení pokožky kštice snižuje krevní průtok kůží asi o 20 %, tím se snižuje expozice vlasové cibulky cytostatiku, jeho vstřebání do folikulu a zpomaluje se metabolická aktivita folikulu [4]. Jedná se tedy o princip ochrany využívaný i v případě prevence mukozitidy dutiny ústní především při krátké aplikaci vysokodávkovaného melfalanu u transplantací krvetvorných buněk [18]. K dispozici jsou v současnosti chladicí systémy DigniCap a Paxman a dále manuální chladicí čepičky, na které se ještě nasazuje izolační pokrývka. Systémy s chladicím roztokem mohou být použity u dvou pacientek zároveň, lépe udržují teplotu v požadovaném rozmezí. Manuální čepičky se chladí v mrazničce, po prohřátí při použití se vyměňují a teplota tak výrazně kolísá. Teplota chlazení by měla být pod 22 °C, někteří autoři doporučují pod 15 °C [7]. Nutné je začít chlazení již 0,5 hod před začátkem chemoterapie a pokračovat dle jejího typu ještě další 1,5–2 hod po ukončení. Metoda tedy není vhodná pro režimy trvající více hodin, dále není vhodná u onkologických onemocnění s velkým množstvím cirkulujících nádorových buněk (leukemie, lymfomy), kontraindikována je u onemocnění z chladových aglutininů a kryoglobulinemie. Nežádoucími účinky jsou pocit chladu, bolest hlavy, pocit těžké hlavy, bolest pokožky, migrény, chladová kopřivka. Ve většině případů jsou tyto nežádoucí účinky zvládnutelné. Riziko možného metastatického postižení kštice se ukazuje jako velmi nízké [19]. Efekt se hodnotí obtížně vzhledem k různým typům protokolů chemoterapie, metodice chlazení i cílovým hodnoceným charakteristikám. Relativně nejlepší výsledky a nejvíce zkušeností jsou s chlazením pokožky hlavy během aplikace antracyklinů a taxanů u karcinomu prsu, ale použití je možné i u dalších solidních malignit. Chlazení také zřejmě snižuje pravděpodobnost trvalé alopecie u režimů s cyklofosfamidem a docetaxelem [5]. Ve studii SCALP u žen s karcinomem prsu stadia I–II léčených chemoterapií s taxany, antracykliny nebo oběma byla úspěšná ochrana před alopecií (ztráta vlasů do 50 %) pozorována v případě chlazení u 50,5 % žen, s obecně horšími výsledky (16 %) při léčbě zahrnující antracykliny [20]. V jiné recentní studii u 131 pacientek byla ztráta vlasů do intenzity méně než 50 % pozorována v případě zajištění chlazení u 71 % pacientek léčených taxany nebo taxany s antracykliny [21]. Obecně metoda chlazení kštice zabrání totální alopecii přibližně u 50–80 % pacientek, u většiny dosáhne stupeň poškození hodnoty 0–2 na škále dle Deanové [1,22,23]. Výbor České onkologické společnosti (ČOS) ve svém stanovisku ze dne 26. 6. 2018 v závěru uvádí: „Chlazení hlavy během chemoterapie je bezpečnou a relativně účinnou metodou k prevenci alopecie u pacientů léčených chemoterapií. Celkový výsledek onkologické léčby není ovlivněn. Tato léčba není široce dostupná a její provozování klade zvýšené organizační, personální a časové nároky na provoz onkologického stacionáře. Z těchto důvodů ČOS doporučuje aplikaci chlazení hlavy v režimu nadstandardní péče. Nedostupnost této metody rozhodně nesmí vést k nedoporučení nebo odkladu indikované chemoterapie“ [24]. Metodu nehradí pojišťovna, v současnosti je k dispozici na několika málo onkologických pracovištích v ČR.
Farmakologická terapie
Ve fázích zkoušek a studií jsou snahy například o ovlivnění výpadku vlasu ochranou folikulu nebo zastavením vlasového cyklu, v případě radioterapií indukované alopecie byl zkoušen i botulotoxin [8]. Nejčastěji se doporučuje minoxidil jako přípravek používaný u androgenní alopecie, který prodlužuje anagenní fázi vlasového cyklu a zabraňuje miniaturizaci folikulu. Zdá se, že účinek na alopecii indukovanou chemoterapií nemá, vlasy ale při minoxidilu pomaleji vypadávají a rychleji zarůstají [7]. Kalcitriol, metabolit vitamínu D, který se využívá v léčbě psoriázy, měl ochranný efekt na vlasový výpadek u krys, u člověka se však efekt zatím neprokázal [7]. Latanoprost a bimatoprost jsou prostaglandiny primárně používané v terapii glaukomu. Bimatoprost 0,03% v očních kapkách nebo gelu je také schválen v několika zemích k léčbě hypotrichózy očních řas a ve studii Glasera et al byl po chemoterapii pozorován efekt zlepšení po 4 měsících léčby s bimatoprostem u 37,5 vs. 16 % pacientů v případě užívání pouze vehikula [25]. Na zvířecích modelech se zkoumala také účinnost alfa-tokoferolu, topického cyklosporinu, interleukinu-1, inhibitorů cyklin dependentních kináz, růstových faktorů fibroblastů, keratinocytů, epidermálního růstového faktoru a řady dalších [7,10].
Chirurgická terapie
Individuálně je možno uvažovat i o trans-plantaci vlasů či plastické rekonstrukci především při poškození v souvislosti s radioterapií [8].
Závěr
Alopecie patří mezi klasické nežádoucí účinky onkologické terapie, která s ohledem na svůj charakter může poškodit vlas reverzibilně i ireverzibilně. Mechanizmy poškození vlasu sahají od toxického akutního i chronického poškození dělících se buněk vlasové matrix přes hormonální ovlivnění růstu a maturace až k imunitním vlivům molekul cílené léčby a imunoterapie. Existují možnosti fyzikální i farmakologické terapie, které částečně umožní nepříznivý dopad onkologické léčby redukovat, nicméně jejich účinnost a dostupnost v běžné praxi je limitována. Ačkoli je ve většině případů ztráta vlasů nebolestivá a dočasná, je často nemocnými hodnocena jako nejvýznamnější nežádoucí účinek onkologické léčby, je proto vhodné hledat a zdokonalovat stávající postupy prevence a léčby ztráty vlasů a možnosti cílené ochrany vlasového folikulu.
Podpořeno projektem institucionálního výzkumu MZ ČR (FNPL, 00669806); programem rozvoje vědních oborů Univerzity Karlovy (Progres Q39); Národním programem udržitelnosti I (NPU I) č. LO1503 poskytovaným Ministerstvem školství, mládeže a tělovýchovy a projektem SVV 260390/2017 Univerzity Karlovy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 8. 8. 2019
prof. MUDr. Samuel Vokurka, Ph.D.
Onkologická a radioterapeutická klinika FN Plzeň
alej Svobody 80
323 00 Plzeň
e-mail: vokurka@fnplzen.cz
Zdroje
1. Dean JC, Salmon SE, Griffith KS. Prevention of doxorubicin-induced hair loss with scalp hypothermia. N Engl J Med 1979; 301 (26): 1427–1429. doi: 10.1056/NEJM197912273012605.
2. Common Terminology Criteria for Adverse Events (CTCAE). Version 5.0. U.S. Department of health and human services, National Institutes of Health, National Cancer Institute, 2017. [online]. Available from: https: //ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.5x11.pdf.
3. World Health Organization. (1979). WHO handbook for reporting results of cancer treatment. Geneva: World Health Organization. [online]. Available from: www.who.int/iris/handle/10665/37200.
4. Freites-Martinez A, Shapiro J, Goldfarb S et al. CME Part 1: Hair disorders in patients with cancer. J Am Acad Dermatol 2019; 80 (5): 1179–1196. doi: 10.1016 /j.jaad.2018.03.055.
5. Breed WP, Van den Hurk CJ, Peerbooms M. Presentation, impact and prevention of chemotherapy-induced hair loss: scalp cooling potentials and limitations. Expert Rev Dermatol 2011; 6 (1): 109–125. doi: 10.1586/edm.10.76.
6. Adya KA, Inamadar AC, Palit A et al. Light microscopy of the hair: a simple tool to “untangle” hair disorders. Int J Trichol 2011; 3 : 46–56. doi: 10.4103/0974-7753.82124.
7. Rugo S, Lacouture ME, Payne AS. Chemotherapy-induced alopecia. [online]. Available from: https: //www.uptodate.com/contents/chemotherapy-induced-alopecia.
8. Freites-Martinez A, Shapiro J, van den Hurk C et al. CME Part 2: Hair disorders in cancer survivors. J Am Acad Dermatol 2019; 80 (5): 1199–1213. doi: 10.1016/ j.jaad.2018.03.056.
9. Kang D, Kim IR, Choi EK et al. Permanent chemotherapy-induced alopecia in patients with breast cancer: a 3-year prospective cohort study. Oncologist 2019; 24 (3): 414–420. doi: 10.1634/theoncologist.2018-0184.
10. Chon SY, Champion RW, Geddes ER et al. Chemotherapy-induced alopecia. J Am Acad Dermatol 2012; 67 (1): 37–47. doi: 10.1016/j.jaad.2011.02.026.
11. Ali SY, Singh G. Radiation-induced alopecia. Int J Trichology 2010; 2 (2): 118–119. doi: 10.4103/0974-7753.77528.
12. Malkinson FD, Keane JT. Radiobiology of the skin: review of some effects on epidermis and hair. J Invest Dermatol 1981; 77 (1): 133–138. doi: 10.1111/1523-1747.ep12479347.
13. Hynková L, Šlampa P, Jančálek R. Radioterapie v léčbě mozkových metastáz. Neurol pro praxi 2016; 17 (5): 293–297.
14. Mahadevan A, Sampson C, LaRosa S et al. Dosimetric analysis of the alopecia reventing effect of hippocampus sparing whole brain radiation therapy. Radiat Oncol 2015; 10 : 245. doi: 10.1186/s13014-015-0555-9.
15. Scoccianti S, Simontacchi G, Talamonti C et al. Scalp-sparing radiotherapy to minimize alopecia in patients with primary brain cancer. The Green Journal. [online]. Available from: www.thegreenjournal.com/article/S0167-8140 (17) 31080-0/pdf.
16. Dueland S, Sauer T, Lund-Johansen F et al. Epidermal growth factor receptor inhibition induces trichomegaly. Acta Oncol 2003; 42 (4): 345–346. doi: 10.1080/02841860310006038.
17. Zheng H, Zhang H, Zhang T et al. Trichomegaly and scalp hair changes following treatment with erlotinib in pulmonary adenocarcinoma patients: a case report and literature review. Exp Ther Med 2016; 12 (3): 1287–1292. doi: 10.3892/etm.2016.3460.
18. Vokurka S. Mukozitida dutiny ústní a gastrointestinálního traktu u pacientů po chemoterapii – aktuální přehled. Klin Onkol 2007; 20 (1): 23–28.
19. Rugo HS, Melin SA, Voigt J. Scalp cooling with adjuvant/neoadjuvant chemotherapy for breast cancer and the risk of scalp metastases: systematic review and meta-analysis. Breast Cancer Res Treat 2017; 163 (2): 199–205. doi: 10.1007/s10549-017-4185-9.
20. Nangia J, Wang T, Osborne C et al. Effect of a scalp cooling device on alopecia in women undergoing chemotherapy for breast cancer: the SCALP randomized clinical trial. JAMA 2017; 317 (6): 596–605. doi: 10.1001/jama.2016.20939.
21. Vasconcelos I, Wiesske A, Schoenegg W. Scalp cooling successfully prevents alopecia in breast cancer patients undergoing anthracycline/taxane-based chemotherapy. Breast 2018; 40 : 1–3. doi: 10.1016/j.breast.2018. 04.012.
22. Friedrichs K, Carstensen MH. Successful reduction of alopecia induced by anthracycline and taxane containing adjuvant chemotherapy in breast cancer – clinical evaluation of sensor-controlled scalp cooling. Springerplus 2014; 3 : 500. doi: 10.1186/2193-1801-3-500.
23. Rugo HS, Klein P, Melin SA et al. Association between use of a scalp cooling device and alopecia after chemotherapy for breast cancer. JAMA 2017; 317 (6): 606–614. doi: 10.1001/jama.2016.21038.
24. Büchler T. Chlazení hlavy během chemoterapie jako prevence alopecie. Stanovisko České onkologické společnosti. Příloha zápisu ze schůze výboru ČOS ČLS J.E.P. ze dne 26.6.2018. [online]. Dostupné z: https: //www.linkos.cz/ceska-onkologicka-spolecnost-cls-jep/stanoviska-cos/priority-a-stanoviska-cos/chlazeni-hlavy-behen-chemoterapie-jako-prevence-alopecie-stanovisko-ceske-onkolo/.
25. Glaser DA, Hossain P, Perkins W et al. Long-term safety and efficacy of bimatoprost solution 0,03% application to the eyelid margin for the treatment of idiopathic and chemotherapy-induced eyelash hypotrichosis: a randomized controlled trial. Br J Dermatol 2015; 172 (5): 1384–1394. doi: 10.1111/bjd.13443.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Peritoneální nádoryČlánek Pseudomyxom peritoneaČlánek LymfangioleiomyomatózaČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Peritoneální nádory
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Aktuality z odborného tisku
- Onkologie v obrazech
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



