-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
BMI a pravděpodobnost vzniku endometriálního adenokarcinomu u českých žen – případová studie
BMI and Odds of Endometrial Adenocarcinoma in Czech Women – a Case Control Study
Introduction: The incidence of malignant tumors of the uterine body is increasing in the Czech Republic. Endometrial adenocarcinoma is one of the most frequent morphological types. Obesity or even overweight is a risk factor for the development of this disease. More accurate stratification of risk relative to body mass index (BMI) has not yet been determined in the Czech Republic, although the risk of overweight (BMI 25–29.9) has been reported in one study as comparable to that of first or second degree obesity (BMI 30–30.9).
Patients and methods: The study population included 376 women of Caucasian race diagnosed with endometrial adenocarcinoma, with BMI measured simultaneously, in 2005–2017. A control group consisted of an equal number of age-matched women not diagnosed with any oncological or gynecological disease. These two files were statistically processed.
Results: Odds (OR, 95% CI) relative to normal weight women, overweight women were at 2.26-times higher odds of endometrial adenocarcinoma, and women with obesity were at 5.18-8.67-, and 24.70-times higher odds, depending on the severity of obesity.
Conclusion: The hypothesis that overweight represents same risk for the development of endometrial adenocarcinoma, as lower degrees of obesity was not verified. However overweight is serious risk for endometrial adenocarcinoma development. The odds of endometrial adenocarcinoma is correlated with increasing BMI and in the population studied is higher than reported previously for all endometrial carcinoma subtypes.
This work was carried out with the support of an internal grant of Krajská zdravotní, a.s., for the years 2017–2019: IGA217129002.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 29. 4. 2019
Accepted: 22. 7. 2019
Keywords:
obesity – overweight – endometrial (endometrioid) adenocarcinoma – czech women – body mass index – odds – endometrial (endometrioid) carcinoma
Autoři: Michal Tichý 1,2; Hana Ptáčková 1; Dominika Plančíková 3; Marek Majdan 3; Martina Chodacká 4
Působiště autorů: Gastroenterologické oddělení, Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Nutriční ambulance, Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 2; Katedra verejného zdravotníctva, Fakulta zdravotníctva a sociálnej práce, Trnavská univerzita v Trnave 3; Onkologické oddělení, Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 4
Vyšlo v časopise: Klin Onkol 2019; 32(4): 281-287
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2019281Souhrn
Úvod: Incidence zhoubných nádorů těla děložního je v České republice na vzestupu. Endometriální adenokarcinom se z jednotlivých možných morfologických typů vyskytuje nejčastěji. Obezita, případně i nadváha jsou uznávanými rizikovými faktory vzniku tohoto onemocnění. Přesnější stratifikace rizika ve vztahu k body mass indexu (BMI) nebyla dosud v české populaci blíže zkoumána. Ojedinělá předchozí práce naznačovala možnost vysokého rizika již u nadváhy s BMI 25–29,9 srovnatelného s obezitou 1., resp. 2. stupně (BMI 30–30,9) dle Světové zdravotnické organizace.
Soubor pacientů a metody: U 376 žen kavkazské rasy byl v období let 2005–2017 diagnostikován endometriální adenokarcinom a současně bylo možno dohledat, resp. určit BMI v té době. Dále byl vytvořen kontrolní soubor žen ze stejného období a shodného věkového složení, u nichž se nevyskytovalo onkologické nebo gynekologické onemocnění a bylo možno určit BMI. Následně bylo provedeno statistické zpracování získaných dat.
Výsledky: Šance na onemocnění (OR, 95% CI) onemocnění je oproti ženám s normální hmotností u žen s nadváhou 2,26násobně vyšší, u žen s obezitou toto riziko dále narůstá na 5,18 a dále na 8,67–24,70násobek dle stupně obezity.
Závěr: Nepotvrdil se předpoklad, že prostá nadváha představuje stejné riziko jako obezita nižších stupňů. Nicméně i nadváha představuje poměrně významné riziko pravděpodobnosti vzniku endometriálního adenokarcinomu. Šance vzniku onemocnění v závislosti na nadměrném BMI je v daném souboru pro endometriální adenokarcinom vyšší, nežli je literárně uváděno pro endometriální karcinom zahrnující všechny podtypy.
Klíčová slova:
endometriální adenokarcinom – české ženy – nadváha – obezita – Body Mass Index – pravděpodobnost – endometriální karcinom
Úvod
Incidence onkologických onemocnění děložního těla v ČR zvolna stále narůstá (31,8 v roce 2010 a 37,5 v roce 2017) a převyšuje jak standardizovanou incidenci světovou (18,1), tak i evropskou (25,7) [1]. Drtivý podíl přitom připadá na nádory vycházející ze sliznice [2], karcinom děložního těla je tak jedním z nejčastějších onkologických onemocnění žen [3]. Z pohledu histologie a molekulární patologie bývá karcinom děložního těla dělen dle klasifikace Světové zdravotnické organizace (World Health Organisation – WHO) na dva podtypy, které obsahují celkem devět, resp. třináct histopatologických jednotek vč. variant [4]. Zatímco typ I, tvořící přibližně 80 % případů onemocnění, je reprezentovaný endometriálním adenokarcinomem (endometrial/endometrioid adenocarcinoma – EA) a je obecně asociován s endometriální hyperplazií, typ II pak všeobecně souvisí s atrofií endometriální tkáně [5–8]. Jsou však zmiňovány určité regionální rozdíly v zastoupení EA ze všech karcinomů endometria (endometrial/endometrioid carcinoma – EC). Kupříkladu pro USA je udáváno až 90 % [9], na rozdíl od Tunisu, kde má zastoupení kolem 67 % [10]. Toto onemocnění je dáváno do souvislosti s životním stylem v postindustriální společnosti [11], potažmo se socioekonomickým postavením [12].
Jako rizikové faktory byly identifikovány časná menarche, nuliparita, pozdní menopauza, obezita, diabetes mellitus a etnický původ [13–18]. Nicméně někteří autoři mají za to, že asociace mezi diabetem a EC je modifikována body mass indexem (BMI), a poukazují na skutečnost, že hlavní roli hraje přítomná hyperinzulinemie [19] a dále také inzulinová rezistence a odpověď systému IGF-I/IGFBP (inzulinu podobný růstový faktor / inzulinu podobný růstový faktor vázající protein) [16]. Na druhou stranu však byly publikovány poznatky dokládající nezávislost rizikového faktoru hyperinzulinemie na přítomnosti obezity [20]. Také je možno zaznamenat názor, že II. typ EC není plně estrogen-independentní [21], což bylo dříve bez větších výhrad přijímáno [6,22]. Novější práce [23] považují na základě metaanalýzy řady studií rizikové faktory pro oba typy EC za shodné. Neplatí to však zcela jednoznačně pro asijskou rasu, jak upozorňuje recentní práce japonských autorů z roku 2018 [24].
Obezita jako nezávislý rizikový faktor pro vznik EC byla prokázána analýzou celé řady databází [25]. Nárůst incidence EC v ekonomicky rozvinutých zemích je přisuzován právě nárůstu obezity v populaci jejich obyvatel. V zemích Evropské unie byla nadváha či obezita v roce 2000 asociována téměř se 40 % nově diagnostikovaných EC [26]. V populacích, kde dochází k nárůstu BMI, vzrůstá i incidence EC [27]. Metaanalýza 40 studií z roku 2015 [28] přisuzuje nadváze relativní riziko (RR) 1,34 a odds ratio (OR) 1,43 a obezitě RR 2,54 a OR 3,33. Za nadváhu je v souladu s definicí WHO považován BMI v rozmezí 25,0–29,9 a za obezitu 30,0 a více. Obezita je dále tříděna na 1., 2. a 3. stupeň dle BMI 30,0–34,99; 35,0–39,99 a 40 a více [29]. V posledních letech pro asijskou rasu bývají používána modifikovaná kritéria BMI 23,0–24,9 pro nadváhu a 25,0 a více pro obezitu [30]. Historicky jedněmi z prvních, kteří poukazovali na riziko obezity pro vznik EC, byli němečtí autoři v roce 1980 [31]. V anglofonní odborné literatuře prvá systematická sdělení věnující se vztahu obezity a výskytu EC jsou z posledních dekád minulého století a pocházejí zejména z Číny [32] a USA [33]. V práci ze severoamerického území je udáváno pro BMI 26,1–30,0 protektivní RR 0,7 a ve sdělení šanghajských autorů pro BMI 23,0–25,2 pak je RR 1,3. Etnickému původu a bližší stratifikaci nadváhy a obezity je věnována náležitá pozornost až v pracích pozdějších. V metaanalytickém sdělení [23] přezkoumávajícím studie s celkem více než 14 000 případy EC bez etnického rozlišení je pro BMI 25–30 udáváno OR 1,11–1,57 dle histologické specifikace, resp. pro BMI 30–35 / 35–40 / nad 40 pak 1,71–2,56 / 1,80–4,75 / 2,85–7,17, přičemž nejvyšší udávané hodnoty v každé skupině připadly na EA, tedy na nejfrekventovanější histologický typ v těchto studiích. V multietnické studii [34] zahrnující přes 50 000 účastnic bylo pro bílou rasu stanoveno RR dle BMI při diagnostice onemocnění takto: nadváha 1,22 a obezita (BMI 30 a více) 2,75. V rámci Evropské unie, před jejím rozšířením o ČR, zahrnující cca 14 000 případů, avšak bez etnické diferenciace je udáváno RR pro nadváhu 1,59 a pro obezitu bez další stratifikace 2,52 [26]. Některé práce poukazují na větší korelaci mezi nárůstem BMI a stoupajícím RR před menopauzou než po ní [21,35]. Vyšší nežli normální hodnota BMI při zjištění onemocnění nemá negativní dopad na životní prognózu, rizikovými faktory jsou spíše věk a přítomnost diabetu mellitu a BMI pod 25 [36,37]. Také některé histologické typy (zejména serózní adenokarcinom) spadající do II. typu EC mají signifikantně horší prognózu 5letého přežití oproti ostatním morfologickým typům EC [38]. Nárůst incidence nutně nemusí korelovat s nárůstem mortality v jednotlivých etnických skupinách (v USA je incidence u bílých nehispánek 27 a u černošek 25,4, přičemž mortalita je 4,3 vs. 8,3) [39]. Není však jisté, zdali je to dáno genetickou determinací, či se jedná o výsledek jiných faktorů (vzdělání, socioekonomické postavení atd.).
V roce 2015 byla publikována práce českých autorů analyzující 197 případů EA ve vztahu k BMI, v níž bylo zjištěno, že nadváha je v souboru zastoupena stejně jako obezita 1. nebo 2. stupně [40]. Tato skutečnost vedla k myšlence realizovat případovou studii pro EA v ČR, neboť uvedená distribuce by přinášela poněkud jiný, bohužel méně příznivý pohled na vztah rizika nadváhy a vzniku EA, resp. EC jako celku.
Soubor pacientů a použité metody
V nemocničním informačním systému (NIS) v Masarykově nemocnici v Ústí nad Labem bylo identifikováno přibližně 1 200 žen, u nichž byla v letech 2005–2017 uváděna v rámci hospitalizace diagnóza C54 (zhoubný nádor těla děložního) a C55 (zhoubný novotvar dělohy, bez bližšího určení) dle Mezinárodní statistické klasifikace nemocí ve verzi 10 [41]. Následně byly vyřazeny pacientky, u nichž se nedalo na základě histologického nálezu konfirmovat onemocnění EA. Podíl EA na všech EC byl blízký 90 %. Dále byly ze souboru vyřazeny ty případy, u nichž se nejednalo o recentní onemocnění, ale pouze o anamnestický údaj nebo hospitalizaci pro následnou péči. Tak bylo získáno 534 případů nově vzniklých onemocnění EA ve sledovaném období 13 let. Poté bylo z dostupné dokumentace (NIS) zjišťováno BMI u těchto žen, což se zdařilo u 376 žen. U zbývajících nebylo BMI uvedeno nebo jej nebylo možno z uvedených antropometrických údajů váhy a výšky spolehlivě určit. Pouze 50 žen bylo mladších 50 let, tedy bylo ve věku, kdy by nebylo možno předpokládat menopauzu. Počet porodů byl u těchto žen obvykle zaznamenán. Všechny ženy přináležely ke kavkazské rase.
Jako kontrolní soubor byly zvoleny ženy, které byly v Masarykově nemocnici v Ústí nad Labem hospitalizovány pro úraz a současně neměly žádnou onkologickou nebo gynekologickou diagnózu uváděnou v NIS. Náhodně bylo vybráno cca 3 000 žen ze sledovaného období, které splňovaly uvedené podmínky. U nich byla rovněž v dokumentaci ověřena diagnóza, resp. ověřeno vyloučení diagnóz nežádoucích z pohledu komparace, a následně zjištěno BMI, pakliže to bylo možné. Dále byly vyloučeny nemnohé ženy jiné než kavkazské rasy a tím se soubor redukoval na přibližně 2 000 případů. V této skupině se ukázalo jako velmi obtížné pro neúplnost dat sledovat počet donošených gravidit, pročež od tohoto bylo upuštěno.
Oba soubory byly seřazeny dle věku v době vzniku onemocnění a pro každou ženu s EA byla přiřazena kontrola stejného věku tvořená ženou s úrazem, bez onkologického či gynekologického onemocnění. V případě vícero žen stejného stáří se tyto přiřazovaly postupně, tak jak byly obě tyto skupiny z registru vygenerovány. Stávající počet kontrol se ukázal být dostačující, pro žádnou ženu s EA věkově shodná kontrola nechyběla. Distribuce případů a shodně i kontrol dle věkových kategorií je patrná z grafu 1.
Graf 1. Distribuce případů i kontrol dle věku. 
Získané údaje byly statisticky zpracovány pro jednotlivé kategorie BMI (podváha, normální hmotnost, nadváha, obezita 1. stupně, obezita 2. stupně, obezita 3. stupně) a byl stanoven příslušný podíl pravděpodobnosti (OR) a interval spolehlivosti (95% CI) spolu s korelačním koeficientem (p).
Tento výzkumný záměr spolu s výše popsanou metodikou byl schválen lokální Etickou komisí Krajské zdravotní, a. s., Masarykovy nemocnice v Ústí nad Labem, o.z., pod číslem jednacím 268/18.
Výsledky
Původní předpoklad autorů, že prostá nadváha by mohla přinášet u žen kavkazské rasy žijících na území ČR stejné riziko vzniku EA jako obezita 1. nebo 2. stupně, se neprokázal, stratifikaci šance na toto onemocnění dle BMI přináší tab. 1.
Tab. 1. Stratifikace šance na onemocnění endometriálním adenokarcinomem v závislosti na kategorii BMI. 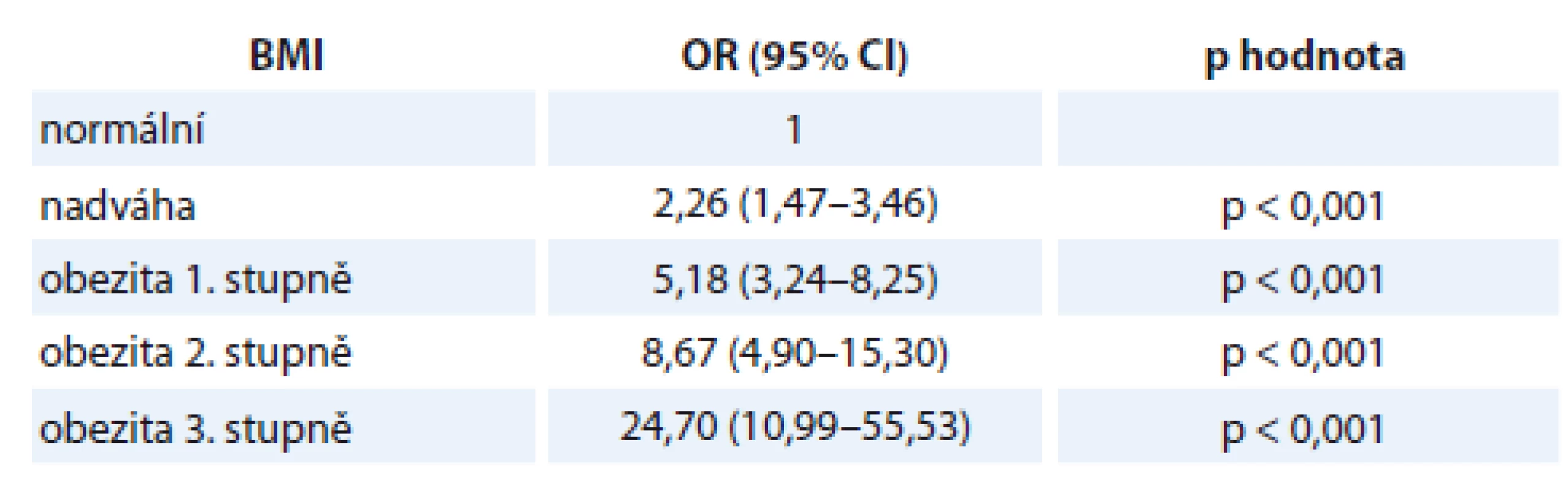
BMI – body mass index, OR – odds ratio, CI – interval spolehlivosti Z této tabulky je zřejmé, že šance na vznik onemocnění oproti ženám s normální hmotností je u žen s nadváhou 2,26násobně vyšší, ale u žen s obezitou tato dále narůstá na 5,18 a dále na 8,67 až 24,70násobek dle stupně obezity. V případě podváhy je oproti normální hmotnosti OR 1,04 s nesignifikantní p hodnotou. Tedy nedostatečná hmotnost u žen nepřináší vyšší riziko onemocnění EA oproti ženám s normální hmotností.
Pokud by se BMI analyzoval jako kontinuální proměnná, tak OR je 0,99992 (95% CI 0,9996–1,0002). Pokud budeme hodnotit riziko vzniku EA postupným porovnáváním jednotlivých kategorií BMI vůči sobě, tak s přibývající obezitou je nárůst rizika vzniku EA zřetelný, což dokládají i hodnoty v tab. 2–4.
Tab. 2. Šance na onemocnění endometriálním adenokarcinomem žen s nadváhou vůči ženám obézním. 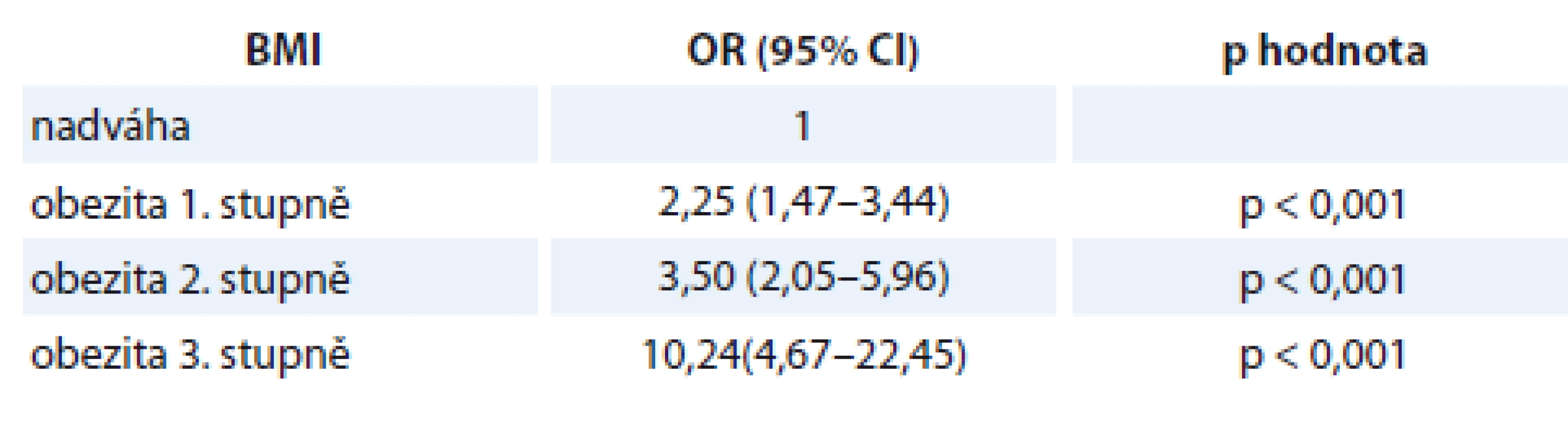
BMI – body mass index, OR – odds ratio, CI – interval spolehlivosti Tab. 3. Šance na endometriální adenokarcinom u žen s obezitou 1. stupně vůči ženám s obezitou vyššího stupně. 
BMI – body mass index, OR – odds ratio, CI – interval spolehlivosti Tab. 4. Šance na endometriální adenokarcinom u žen s obezitou 2. stupně vůči ženám s obezitou 3. stupně. 
BMI – body mass index, OR – odds ratio, CI – interval spolehlivosti Z výše uvedených dat je zřejmé, že posun o jednu kategorii BMI výše v čase stanovení diagnózy přináší přibližně zdvojnásobení až ztrojnásobení rizika vzniku EA u těchto žen.
Distribuce případů a kontrol dle kategorií BMI je zachycena v grafu 2.
Graf 2. Distribuce případů a kontrol dle kategorií body mass index. 
Diskuze
Získané výsledky by mohly být ovlivněny souběžným výskytem dalších rizikových faktorů EA. V případě nuliparity lze konstatovat, že nízká plodnost udávaná pro populaci českých žen [42] se může nějakou měrou podílet na vyšších hodnotách incidence EA oproti globálnímu výskytu, ve vztahu k západoevropské populaci však patrně nikoliv, neb uváděná plodnost je v tomto regionu obdobná. Na základě dostupných parciálních dat (ženy s EA) není žádný důvod se domnívat, že ve zkoumaných souborech českých žen by měl být podstatný rozdíl v nuliparitě oproti běžné české populaci, data však pro jejich neúplnost nebylo možno spolehlivě ověřit. Věk menarche českých žen a nástup menopauzy u nich se nevymyká z údajů udávaných pro země s obdobným socioekonomickým statusem [43]. Zdali v daných souborech zcela koresponduje s běžnou populací českých žen, nebylo možno ověřit, navíc situaci komplikuje i problematika případné hormonální substituce. Přítomnost diabetu je považována za nikoliv primární riziko [19]. Vliv kouření nebyl sledován, stejně jako konzumace alkoholu. V obou případech by byl patrně nutný přepočet na kumulovanou expozici v čase propuknutí onemocnění a spolehlivost údajů nutných k výpočtu uváděných v dokumentaci je přinejmenším sporná, pakliže vůbec dostupná.
Z povahy případové studie jsou k dispozici poměry rizik (OR) ve sledovaných souborech. Přepočet na RR není možný, poněvadž nejsou k dispozici data o očekávaném výskytu v jednotlivých BMI kategoriích, a to pro každý populační ročník zvlášť. Proto i některé citované práce nerozlišují při stanovování RR důsledně jednotlivé BMI kategorie a nepracují s konkrétním věkem pacientek, ale pouze s očekávaným zastoupením osob s nadváhou a obezitou v populaci několika věkových dekád dle pohlaví [26]. Že to přináší jistá interpretační úskalí, je zřejmé. V případě porovnání s pracemi uvádějícími OR [23,28] jsou hodnoty poměru rizik u českých žen vyšší (tab. 5).
Tab. 5. OR u českých žen a v metaanalytických studiích 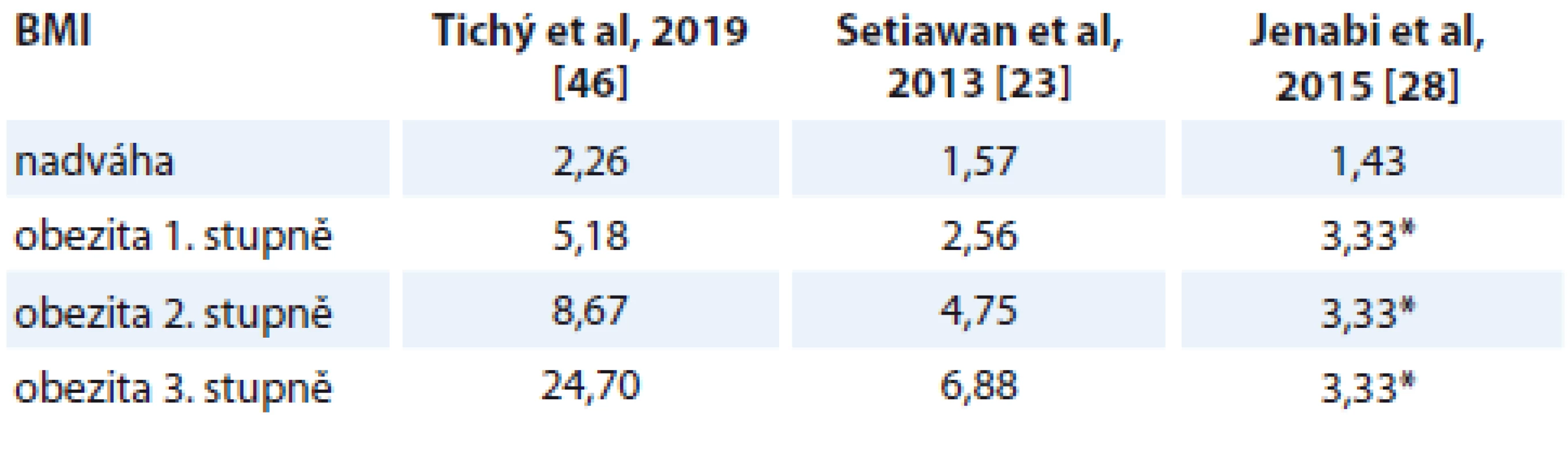
OR – odds ratio, BMI – body mass index, * bez rozlišení stupně Příčina vyšších hodnot OR u českých žen s BMI nad normu ve srovnání s jinými sděleními si zasluhuje zamyšlení. Otázkou může být, do jaké míry má na uváděné antropometrické hodnoty vliv, jakým způsobem byla tato data získávána, zdali ze záznamů z fyzikálního vyšetření nebo prostým sdělením pacientek či jinou metodou. Dalším potenciálním faktorem majícím vliv na zjištěné údaje, vezme-li se v potaz distribuce BMI v populaci žen ve vazbě na věk (např. pro ČR [44]), je metoda tvorby kontrolního souboru, tedy v tom případě, kdy není z pohledu věkové struktury zcela identický s porovnávaným výchozím souborem, což v případě metaanalytických studií vycházejících ze studií různého typu je vcelku očekávaný jev, byť vhodným způsobem zpracování dat nenabývá obvykle většího významu. Do metaanalýz bývají rovněž zařazeny studie z různých kontinentů, což může snižovat průměrnou hodnotu OR s ohledem na zastoupení jednotlivých ras. V případě výše uváděné studie Setiawan et al [23] je u případových studií zastoupení bělošek 0–100 % s průměrem 85,4 %. Pozoruhodná je rozdílná distribuce výskytu EA v závislosti na BMI patrná z grafů 3 a 4, kdy je zřejmé, že v české populaci je jeho výskyt u osob s obezitou výrazně vyšší.
Graf 3. Body mass index a endometriální adenokarcinom dle Setiawan et al [23]. ![Body mass index a endometriální
adenokarcinom dle Setiawan et al [23].](https://pl-master.mdcdn.cz/media/image_pdf/369cad23abc73d4bcb1aad3ab7f33293.png?version=1566204608)
Tab. 6. Body mass index a endometriální adenokarcinom dle Tichý et al [46]. ![Body mass index a endometriální
adenokarcinom dle Tichý et al [46].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/98c932ce49627c6d7c7a38c1015ffe8b.png)
Hodnoty OR jsou však nižší i v práci švédských autorů [45] dominantně analyzujících kavkazskou rasu, kteří však kategorie BMI člení poněkud jinak – OR 1,5 pro BMI 28–29,99; OR 2,9 pro BMI 30–33,99; OR 6,3 pro BMI 34 a vyšší. Zdá se, že nejzásadnější rozdíl spočívá v tom, že většina studií vč. těch použitých v komparaci [28] pracuje s údaji pro všechny EC, a nikoliv jen pro EA, jako je to v případě prezentované studie. S nárůstem BMI je tedy patrně spojena vyšší pravděpodobnost výskytu EA nežli pro EC jako celek, a to zejména při extrémních hodnotách (BMI nad 40). Poměrné zastoupení jednotlivých subtypů EC je geograficky různé [9,10], dominantní je však EA, v případě zde popisované studie je jeho zastoupení přibližně 90 %. I proto je porovnání alespoň rámcově vůbec možné. Příčina rozdílných hodnot OR tedy zůstává do jisté míry i tak nadále nejasná.
Závěr
Nadváha a obezita jsou u českých žen v sledovaném souboru významným rizikovým faktorem vzniku EA, a to vyšším, nežli je obecně udáváno pro EC. Ženy s nadváhou mají riziko pravděpodobnosti onemocnění 2,264násobně vyšší nežli ženy s normálním BMI. S nárůstem BMI na hodnoty obezity 1.–3. stupně se riziko s přechodem do vyšší kategorie vždy přibližně zdvojnásobuje až ztrojnásobuje (OR pro obezitu 1. stupně 5,18; pro obezitu 2. stupně 8,67 a obezitu 3. stupně pak 24,70). Původní předpoklad, že prostá nadváha by přinášela stejné riziko pravděpodobnosti jako obezita 1., resp. 2. stupně, se tak nepotvrdil. Není důvod se domnívat, že zjištěné údaje nelze extrapolovat na celou ČR. Jelikož u žen v české populaci je průměrná hodnota BMI nadále na vzestupu [44], tak je nutno patrně počítat i s neklesající, naopak spíše stoupající incidencí EA v příštích letech. Pouze úspěšná prevence cílená k eliminaci nadnormálního BMI v populaci by mohla tento trend zastavit.
Práce byla realizována za podpory interního grantu Krajské zdravotní, a.s., pro léta 2017–2019: IGA217129002.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Michal Tichý, Ph.D., MPH
Krajská zdravotní, a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 3316/12A
400 11 Ústí nad Labem-město
e-mail: michal.tichy@kzcr.eu
Obdrženo: 29. 4. 2019
Přijato: 22. 7. 2019
Zdroje
1. Zdravotnická ročenka České republiky 2017. Praha: ÚZIS 2018 : 44.
2. Novotvary 2016. Praha: ÚZIS 2017 : 100.
3. Linkos.cz. Česká onkologická společnost ČLS JEP. [online]. Dostupné z: https: //www.linkos.cz/lekar-a-multidisciplinarni-tym/kongresy/po-kongresu/databaze-tuzemskych-onkologickych-konferencnich-abstrakt/epidemiologie-gynekologickych-nadoru/.
4. Kurman RJ (ed). WHO classification of tumours of female reproductive organs. 4th ed. Lyon: International Agency for Research on Cancer 2014 : 222–233.
5. Emons GF, Fleckenstein G, Hinney B et al. Hormonal interactions in endometrial cancer. Endocr Relat Cancer 2000; (7): 227–242.
6. Sherman ME. Theories of endometrial carcinogenesis: a multidisciplinary approach. Mod Pathol 2000; (13): 295–308. doi: 10.1038/modpathol.3880051.
7. Bokhman JV. Two pathogenetics types of endometrial carcinoma. Gynecol Oncol 1983; (15): 10–17.
8. Deligdisch L, Cohen CJ. Histologic correlates and virulence implications of endometrial carcinoma associated with adenomatosus hyperplasia. Cancer 1985; 56 (6): 1452–1455. doi: 10.1002/1097-0142 (19850915) 56 : 6<1452:: aid-cncr2820560637>3.0.co; 2-d.
9. Altekruse SF, Kosary CL, Krapcho M et al. SEER cancer statistic review, 1975–2007. Bethesda: National Cancer Institute 2010.
10. Missaoui NJ, Jaidene L, Abdelkader AB et al. Cancer of corpus uteri in Tunisia: epidemiological and clinicopathological features. Asian Pac J Cancer Prev 2011; 12 (2): 461–464.
11. Parkin DM, Whelan DM, Ferlay J et al (eds.) Cancer incidence in five continents. Lyon: IARC Scientific Publication 1997 : 143.
12. Elwood JM, Cole P, Rothman KJ et al. Epidemiology of endometrial cancer. J Natl Cancer Inst 1977; 59 (4): 1055–1060. doi: 10.1093/jnci/59.4.1055.
13. Setiawan VW, Pike MC, Karageorgi S et al. Age at last birth in relation to risk of endometrial cancer: pooled analysis in the epidemiology of endometrial cancer consortium. Am J Epidemiol 2012; 176 (4): 269–278. doi: 10.1093/aje/kws129.
14. Nichols HB, Trentham-Dietz A, Hampton JM et al. From menarche to menopause: tends among US women born from 1912 to 1969. Am J Epidemiol 2006; 164 (10): 1003–1011. doi: 10.1093/aje/kwj282.
15. Karageorgi S, Hankinson SE, Kraft P et al. Reproductive factors and postmenopausal hormone use in relation to endometrial cancer risk in the Nurses’ Health Study cohort 1976–2004. Int J Cancer 2010; 126 (1): 208–216. doi: 10.1002/ijc.24672.
16. Kaaks R, Lukanova A, Kurzer MS. Obesity, endogenous hormones, and endometrial cancer risk: a syntetic review. Cancer Epidemiol Biomarkers Prev 2002; 11 (12): 1531–1543.
17. Jamison PM, Noone AM, Ries LA et al. Trends in endometrial cancer incidence by race and histology with correlation for the prevalence of hysterectomy, SEER 1992 to 2008. Cancer Epidemiol Biomarkers Prev 2013; 22 (2): 233–241. doi: 10.1158/1055-9965.EPI-12-0996.
18. Dossus L, Allen N, Kaaks R et al. Reproductive risk factors and endometrial cancer: the European Prospective Investigation into Cancer and Nutrition. Int J Cancer 2010; 127 (2): 442–451. doi: 10.1002/ijc.25050.
19. Shoff SM, Newcomb PA. Diabetes, body size, and risk of endometrial cancer. Am J Epidemiol 1998; 148 (3): 234–240. doi: 10.1093/oxfordjournals.aje.a009630.
20. Cust AE, Allen NE, Rinaldi S et al. Serum levels of C-peptide, IGFBP-1 and IGFBP-2 end endometrial cancer risk: results from the Europea Prospective Investigation into Cancer and Nutrition. Int J Cancer 2007; 120 (12): 2656–2664. doi: 10.1002/ijc.22578.
21. Gao Y, Dai X, Chen L et al. Body mass index is positively associated with endometrial cancer in Chinese women, especially prior to menopause. J Cancer 2016; 7 (9): 1169–1173. doi: 10.7150/jca.15037.
22. Emons G, Fleckenmstein G, Hinney B et al. Hormonal interactions in endometrial cancer. Endocr Relat Cancer 2002; 7 (4): 227–242.
23. Setiawan VW, Yang HP, Pike MC et al. Type I and II endometrial cancers: have they different risc factors? J Clin Oncol 2013; 31 (20): 2607–2618. doi: 10.1200/JCO. 2012.48.2596.
24. Kawachi A, Shimazu T, Budhathoki S et al. Association of BMI and height with the risk of endometrial cancer, overall and histological subtype: a population-based prospective cohort study in Japan. Eur J Cancer Prev 2019; 28 (3): 196–202. doi: 10.1097/CEJ.0000000000000 449.
25. Renehan AG, Tyson M, Egger M et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371 (9612): 569–578. doi: 10.1016/S0140-6736 (08) 60 269-X.
26. Bergström A, Pisani P, Tenet V et al. Overweight as an avoidable cause of cancer in Europe. Int J Cancer 2001; 91 (3): 421–430. doi: 10.1002/1097-0215 (200002) 9999 : 9999<:: aid-ijc1053>3.0.co; 2-t.
27. Alshahrani S, Soliman AS, Hablas A et al. Change in uterine cancer incidence rates in Egypt. Obstet Gynecol Int 2018; 2018 : 3632067. doi: 10.1155/2018/3632 067.
28. Jenabi E Poorolajal J. The effect of body mass index on endometrial cancer: a meta-analysis. Public Health 2015; 129 (7): 872–880. doi: 10.1016/j.puhe.2015.04.017.
29. WHO.int. World Health Organization. [online]. Available from: https: //www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.
30. World Health Organization Western Pacific Region. International Association for the Study of Obesity, International Obesity Task Force. Redefining obesity and its treatment. Published by Health Communications Australia Pty 2000. [online]. Available from: http: //www.wpro.who.int/nutrition/ documents/docs/Redefiningobesity. pdf.
31. Ortner A, Klammer J, Sattler K. Zur Epidemiologie des Endometriumkarzinoms. Geburtshilfe Frauenheilkd 1980; 40 (7): 624–634. doi: 10.1055/s-2008-1037223.
32. Shu XO, Brinton LA, Zheng W. Relation of obesity and body fat distribution to endometrial cancer in Shanghai, China. Cancer Research 1992; 52 (14): 3865–3870.
33. Swanson CA, Potischman N, Wilbanks GD et al. Relation of endometrial cancer risk to past and contemporary body size and body fat distribution. Cancer Epidemiol Biomarkers Prev 1993; 2 (4): 321–327.
34. Park SL, Goodman MT, Zhang ZF et al. Body Size, adult BMI gain and endometrial cancer risk: the multiethnic cohort. Int J Cancer 2010; 126 (2): 490–499. doi: 10.1002/ijc.24718.
35. Iatrakis G, Zervoudis S, Saviolakis A et al. Women younger than 50 years with endometrial cancer. Eur J Gynaecol Oncol 2006; 27 (4): 399–400.
36. Lindemann K, Cvancarova M, Eskild A. Body mass index, diabetes and survival after diagnosis of endometrial cancer: a report from the HUNT-survey. Gynecol Oncol 2015; 139 (3): 476–480. doi: 10.1016/j.ygyno.2015.09. 088.
37. Vu M, Seagle B, Abdullah A et al. Body mass index among women with endometrial cancer. Gynecol Oncol 2015; 139 (3): 587. doi: 10.1016/j.ygyno.2015.09.032.
38. Cameselle-Teijeiro JF, Valdés-Pons J, Cameselle-Cortizo L et al. Tumours of the uterine corpus: a histopathological and prognostic evaluation preliminary of 429 patients. J Clin Med Exp Images 2017; 1 : 011–019. doi: 10.29328/journal.jcmei.1001004.
39. seer.cancer.gov. SEER Cancer Statistics Review Table 7.11. National Cancer Institute. [online]. Available from: https: //seer.cancer.gov/csr/1975_2015/results_merged/sect_07_ corpus_uteri.pdf#search= uterus.
40. Tichy M, Majdan M, Lastuvka J et al. BMI represents a higher risk of endometrial adenocarcinoma: a cross-sectional study. Abstract S69. In: Malajsian Journal of Nutrition 2015; 21 (Suppl). 9th Asia Pacific Conference on Clinical Nutrition. Malaysia: Kuala Lumpur 2015.
41. MKN-10. Mezinárodní statistická klasifikace nemocí a přidružených zdravotních problémů: desátá revize. Praha: Ústav zdravotnických informací a statistiky ČR 2017.
42. The World Factbook. Central Inteligence Agency. [online]. Available from: https: //www.cia.gov/library/publications/the-world-factbook/rankorder/2127rank.html.
43. Thomas F, Renaud F, Benefice E et al. International variability of ages at menarche and menopause: patterns an main determinants. Hum Biol 2001; 73 (2): 271–290.
44. Evropské výběrové šetření o zdravotním stavu v ČR – EHIS CR. Aktuální informace č. 70/2010. Praha: ÚZIS 2010 : 1–11.
45. Weiderpass E, Persson I, Adami HO et al. Body size in different periods of life, diabetes mellitus, hypertension, and risk of postmenopausal endometrial cancer (Sweden). Cancer Causes Control 2000; 11 (2): 185–192.
46. Tichý M, Ptáčková H, Plančíková D et al. BMI a pravděpodobnost vzniku endometriálního adenokarcinomu u českých žen – případová studie. Klin Onkol 2019; 32 (47): 32 (4): 281–287. doi: 10.14735/amko2019281.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Farmakoekonomické studie a procesy HTA při hodnocení nákladů a benefitů nákladné inovativní léčby u nás i ve světě
- Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
- Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu
- Metody klasické a molekulární cytogenetiky vhodné pro biodozimetrii osob s profesionální expozicí karcinogenům
- Exprese ncRNA spojené s P21 aktivovaná poškozením DNA u karcinomu močového měchýře
- BMI a pravděpodobnost vzniku endometriálního adenokarcinomu u českých žen – případová studie
- The Pharmacoeconomic Analysis of Cetuximab and Panitumumab in the 1st Line Treatment of mCRC in Real Clinical Practice in the Czech Republic
- Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
- Úloha radioterapie při metastázách lebky u folikulárního karcinomu štítné žlázy
- Onkologická kazuistika – kdy je vhodný čas na integraci paliativní péče?
- Aplikovat jeden cyklus nebo jednu sérii chemoterapie?
- Urgentní chirurgická léčba GIST ezofago-gastrické junkce u pacienta s obrovskou hiátovou kýlou
- Zemřel prof. MUDr. Josef Koutecký, DrSc., zakladatel dětské onkologie
- Proposed Strategies for Improving Adherence to Tyrosine Kinase Inhibitors in Patients with Chronic Myeloid Leukaemia
- Onkologie v obrazech Kožní toxicita při cílené léčbě generalizovaného melanomu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu
- Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
- Onkologická kazuistika – kdy je vhodný čas na integraci paliativní péče?
- Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



