-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
The Importance of MITF Signaling Pathway in the Regulation of Proliferation and Invasiveness of Malignant Melanoma
Background:
Malignant melanoma is one of the most aggressive types of cancers. Melanoma is derived from pigment-producing cells, melanocytes, which are characterized by a specific survival mechanism. Microphthalmia-associated transcription factor (MITF-M) plays a role in the metabolism of melanoma and is involved in the regulation of the expression of multiple genes mediating processes such as melanogenesis, proliferation, differentiation, and melanocyte survival. The expression of this transcription factor in melanocytes is activated by several signaling pathways, and reduced expression or function of MITF-M can cause the dysregulation of anti-apoptotic mechanisms. MITF-M is also involved in matrix metalloproteinase 14 (MMP14) activity, which is responsible for shape changes in melanocytes and increases in their motility and invasiveness. Very low levels of expression of MITF-M are found in human melanocytes with an invasive phenotype, indicating that this transcription factor acts as a suppressor of the metastatic process. Cancer cells with low expression of cytosolic/nuclear β-catenin have a small amount of MITF-M 14 that is insufficient to inhibit MMP transcription. The enzyme catalyzes the degradation of laminin and fibronectin, thereby changing the shape of melanocytes, which leads to their increased mobility and invasiveness.Aims:
This review describes the regulatory pathway of MITF-M activation, its involvement in the proliferation of transformed melanocytes, and its role in increasing the invasiveness of malignant melanoma. A detailed understanding of the MITF-M signaling pathway is highly topical and could help to develop new diagnostic and therapeutic applications for patients with malignant melanoma.Key words:
neoplastic cell transformation – melanoma – MITF transcription factor
This work was supported by grant projects VEGA 1/0115/14 and VEGA 1/0873/16.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
4. 12. 2015Accepted:
14. 6. 2016
Autoři: P. Urban; M. Rabajdová; B. Veliká; I. Špaková; B. Bolerázska; M. Mareková
Působiště autorů: Ústav lekárskej a klinickej biochémie, LF UPJŠ v Košiciach, Slovenská republika
Vyšlo v časopise: Klin Onkol 2016; 29(5): 347-350
Kategorie: Přehledy
doi: https://doi.org/10.14735/amko2016347Souhrn
Východiská:
Malígny melanóm je jedným z najagresívnejších druhov rakoviny. Melanóm primárne vzniká z pigment produkujúcich buniek melanocytov, ktoré sa vyznačujú špecifickými mechanizmami prežívania. Kľúčové postavenie v metabolizme melanómu má transkripčný faktor asociovaný s mikroftalmiou (microphthalmia-associated transcription factor – MITF-M). MITF-M sa zapája do regulácie expresie veľkého počtu génov riadiacich procesy melanogenézy, proliferácie, diferenciácie a prežitia melanocytov. Expresia tohto transkripčného faktora v melanocytoch je aktivovaná niekoľkými signálnymi cestami, pričom blokovanie jeho expresie, alebo funkcie môže znamenať poruchu v regulácii antiapoptotických mechanizmov. MITF-M taktiež ovplyvňuje aktivitu matrixovej metaloproteinázy 14 (matrix metalloproteinase – MMP14), ktorá je zodpovedná za zmenu tvaru melanocytov a za zvýšenie ich pohyblivosti a invazivity. V ľudských melanocytoch s invazívnym fenotypom bola zistená veľmi nízka hladina expresie MITF-M, čo naznačuje že tento transkripčný faktor pôsobí ako supresor metastatického procesu. V rakovinových bunkách s nízkou hladinou expresie cytozolového/nukleárneho β-katenínu, vzniká malé množstvo proteínu MITF-M, ktorý nedokáže inhibovať transkripciu MMP 14. Tento enzým katalyzuje degradáciu laminínu a fibronektínu, čím dochádza k zmene tvaru melanocytov, k zvýšemiu ich pohyblivosti a invazivity.Ciele:
Táto prehľadová práca popisuje regulačnú dráhu aktivácie MITF-M, jeho zapojenie do proliferácie transformovaných melanocytov ako aj jeho úlohu pri zvyšovaní invazivity malígneho melanómu. Detailné pochopenie mechanizmov fungovania signálnej dráhy MITF-M je vysoko aktuálnou témou a môže pomôcť pri vývoji nových tak diagnostických, ako aj terapeutických aplikácií pri liečbe pacientov s malígnym melanómom.Kľúčové slová:
transformácia neoplastických buniek – melanóm – transkripčný faktor MITFÚvod
Malígny melanóm je jedným z najagresívnejších druhov rakoviny. Melanóm primárne vzniká z pigment produkujúcich buniek melanocytov, ktoré sa vyznačujú špecifickými mechanizmami prežívania. Pôsobia hlavne proti viacerým karcinogénnym faktorom, vrátane UV žiarenia a vysoko reaktívnych medziproduktov melanogenézy [1]. Tieto zložité mechanizmy oddiaľujúce bunkovú smrť účinkujú jednak v zdravých melanocytoch ako aj v transformovaných bunkách melanómu. Kľúčové postavenie v metabolizme melanómu má transkripčný faktor asociovaný s mikroftalmiou (microphthalmia associated transcription factor – MITF), ktorý stojí v centre transkripčnej regulácie od embryonálneho vývoja normálnych melanocytov, ich diferenciácie, udržania identity až po prežívanie nielen normálnych, ale aj nádorových melanocytov. V súčasnosti je známych viac ako 40 cieľových génov MITF, ktorých účinky sú častokrát antagonistické [2]. Tento prehľadový článok popisuje regulačnú dráhu aktivácie MITF-M, jeho zapojenie do proliferácie transformovaných melanocytov ako aj jeho úlohu pri zvyšovaní invazivity malígneho melanómu.
Úloha MITF pri vzniku malígneho melanómu
MITF je nukleárny proteín charakteristický pre embryonálny vývoj a postnatálnu životaschopnosť melanocytov. Gén kódujúci tento transkripčný faktor bol lokalizovaný na treťom chromozóme, konkrétne na pozícii 3p14.2-3p14.1 [3]. Proteín MITF existuje celkovo v 12 zostrihových izoformách (označovaných A, B, C, H a M) a každá je exprimovaná zo svojho, tkanivovo špecifického, promótora. Všetky izoformy obsahujú devät exónov a odlišujú sa len prvým exónom, zostrihnutým ku spoločnému druhému exónu. Poloha ostatných exónov je už vo všetkých izoformách rovnaká. Pre melanocyty je špecifická izoforma MITF-M, ktorá je exprimovaná iba v pigmentových a v melanómových bunkách [4]. MITF-M obsahuje viacero špecifických domén (obr. 1) [5]. V centrálnej časti molekuly proteín MITF obsahuje zásaditú oblasť s motívom helix-slučka-helix-leucínový zips (basic helix-loop-helix-leucine zipper – bHLH LZ), ktorá je zodpovedná za väzbu na DNA a dimerizáciu proteínu. MITF-M pozostáva zo 419 aminokyselín a zapája sa do regulácie expresie veľkého počtu génov zapojených do melanogenézy, proliferácie, diferenciácie a prežitia melanocytov.
Obr. 1. Štruktúra proteínu MITF-M a regulácia jeho aktivity. 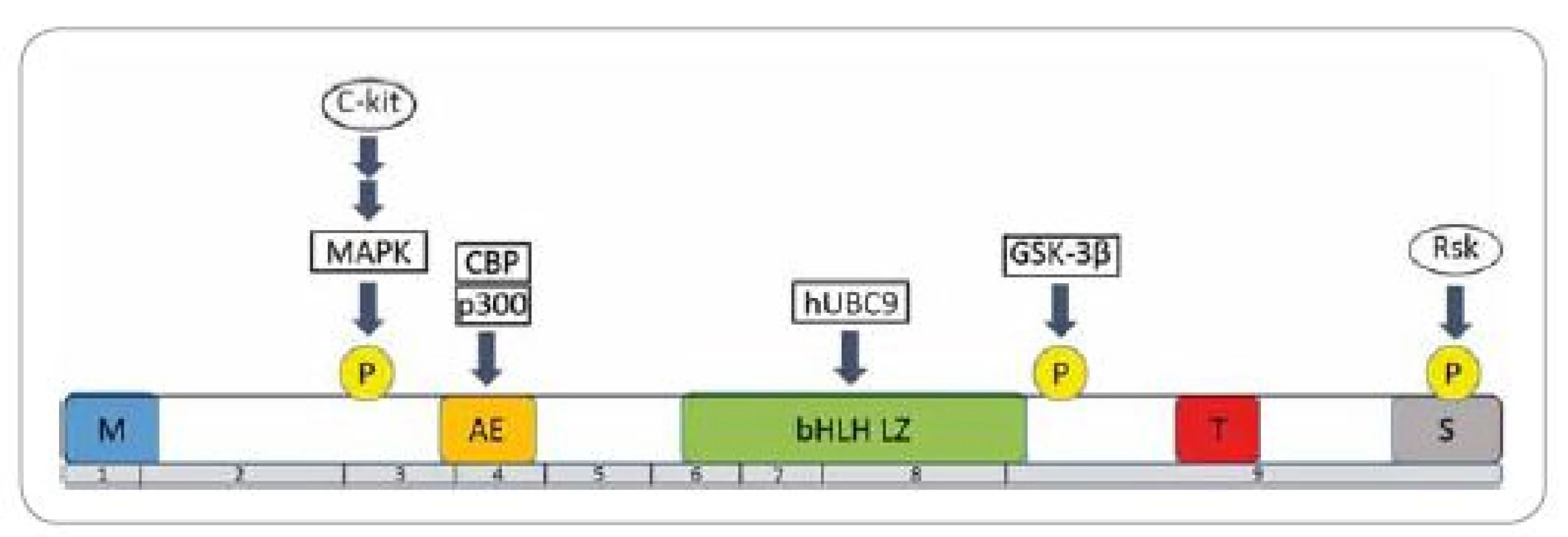
Viaceré signálne proteíny pôsobia priamou fosforyláciou serínových zvyškov na pozícii 73, 298 a 409, čím dochádza k aktivácii MITF-M. Čísla pod štruktúrou popisujú poradie exónov v géne MITF-M. Oblasti M, T, S sú bohaté na metionín, treonín, resp. serín so slabšou transkripčnou aktivitou. Naopak domény AE a pHLH ZL znamenajú transkripčne veľmi aktívne oblasti. Upravené podľa [5]. Priamym cieľom sú gény pre tyrozinázu (tyrosinase – TYR), s tyrozínkinázou asociovaným proteínom 1 (tyrosinase-related protein 1 – TYRP1) a dopachróm tautomerázu (dopachrome tautomerase – DCT), ktoré ovplyvňujú melanogenézu. MITF súčasne ovplyvňuje expresiu génov pre premelanozómový proteín 17 (premelanosome protein 17 – Pmel 17) a osteoartritický proteín 1 (osteoarthritis protein 1 – OA1), čím reguluje transfer melanozómov [6].
Expresia MITF-M v melanocytoch je aktivovaná niekoľkými transkripčnými cestami (napr. cez Pax3 proteín alebo pomocou transkripčného faktora CREB). Tieto transkripčné faktory obsahujú väzbové miesta v blízkosti promótora MITF. Preto sa MITF-M považuje za cieľ pre génovú terapiu, pričom blokovanie expresie alebo funkcie MITF môže znamenať poruchu v regulácii antiapoptotických dráh v melanómových bunkách [7]. Jedným z regulátorov expresie MITF-M je aj receptor pre melanokortín 1 (melanocortin 1 receptor – MC1R). Tento receptor v aktívnom stave vykazuje funkciu G proteínu, ktorý zvyšuje hladinu cyklického adenozínmonofosfátu (cyclic adenosine monophosphate – cAMP). Akumulácia cAMP vedie k aktivácii proteínu viažúceho cAMP odpovedajúceho úseku (cAMP response element-binding protein – CREB), čím sa zvýši expresia MITF-M, čo následne reguluje aktiváciu génov podieľajúcich sa na syntéze melanínu. Plne aktívne alely génu MC1R umožňujú syntézu tmavého pigmentu – eumelanínu, zatiaľ čo alelická varianta s oslabenou aktivitou zodpovedá za tvorbu červeného pigmentu – feomelanínu, ktorý môže mať i fotosenzibilizačné účinky a prispieva k vzniku a vývoju karcinognézy primárneho melanómu [8].
Úloha MITF-M pri regulácii proliferácie
MITF-M taktiež zohráva významnú úlohu pri proliferácii melanocytov [9]. Tento transkripčný faktor je nevyhnutný pre prežívanie a diferenciáciu melanoblastov a melanocytových kmeňových buniek [10]. Prostredníctvom zvýšenej expresie cyklín dependentných inhibítorov p21Cip1 a p16INK4a sa MITF-M zapája do regulácie bunkového cyklu [11]. Zníženie aktivity MITF-M vedie k ukončeniu bunkového cyklu v G1 fáze, reorganizácii aktínového cytoskeletu a k zvýšeniu expresie matrixových metaloproteináz, čo vedie k zvýšeniu invazívneho potenciálu melanocytov. MITF-M preto vystupuje ako regulátor proliferácie a diferenciácie normálnych melanocytov, ktorého aktivita môže byť narušená genetickými aj epigenetickými zmenami, čo môže indukovať malígnu transformáciu. Aktivita MITF-M je taktiež regulovaná mikroprostredím nádoru, ako aj vnútrobunkovou hladinou špecifických miRNA, ktoré znižujú množstvo primárneho transkriptu jeho degradáciou [12]. MITF-M tiež pôsobí ako faktor zabraňujúci starnutiu melanocytov (schéma 1) [13]. Pri inhibícii expresie alebo aktivity MITF-M dochádza k predčasnému starnutiu buniek prostredníctvom zvýšenej aktivity p53. Aktivácia p53 je priamym dôsledkom degradačnej kaskády indukovanej poškodením DNA. Vznikajú rôzne mitotické poruchy, čo vedie k nekróze alebo apoptóze [14].
Schéma 1. Úloha MITF-M pri regulácii starnutia melanocytov. 
Upravené podľa [13]. Predčasné starnutie buniek je charakteristické pre premalígne lézie, ale neobjavuje sa pri léziách malígnych. Z uvedených faktov vyplýva, že sledovanie aktivity a expresie inhibítorov bunkového cyklu (p16INK4a, p21CIP1 a p27KIP1) môže pomôcť pri hľadaní nových vhodných prognostických markerov použiteľných aj na rozlíšenie jednotlivých štádií malígneho melanómu [15].
MITF-M a invazivita nádoru
Nádorovo transformované melanocyty patria medzi extrémne pohyblivé a invazívne bunky. Podobne ako pri iných typoch nádorov sa invazivita zvyšuje prostredníctvom remodelácie extracelulárneho matrixu reguláciou proteázovej aktivity matrixových metaloproteináz (matrix metaloproteinases – MMP) alebo zmenou tvaru buniek [16]. Jednu z hlavných úloh pri zvýšení invazivity melanocytov zohráva aktivácia kanonickej Wnt (wingless/integrated) signálnej dráhy, ktorá využíva k prenosu signálu β-katenín, ktorý sa v bunke podieľa na tvorbe adherentných spojov medzi bunkami a ukotvuje aktínové vlákna cytoskeletu. β-katenín je nevyhnutný pre prežívanie a proliferáciu zdravých melanocytov [17]. Regulácia aktivity tohto proteínu závisí na jeho fosforylácii. Ak je β-katenín fosforylovaný cez kinázu glykogén syntázy-3 β (glycogen synthase kinase-3β – GSK-3β) dochádza k jeho ubikvitinácii a následnej proteazomálnej degradácii. Pri aktivácii signálnej dráhy Wnt však nedochádza k fosforylácii, ale k akumulácii β-katenínu v cytozole. Po dosiahnutí hraničnej koncentrácie sa presúva do jadra, kde aktivuje transkripciu špecifických génov, ako napr. MITF-M [18]. V bunkách metastázujúcich melanocytov bola dokázaná Wnt dráhou indukovaná zvýšená hladina transkripcie MITF-M a jeho cieľových génov [19]. Znižovanie expresie β-katenínu v bunkách melanómu zvyšuje ich invazivitu [20]. V ľudských melanocytoch s invazívnym fenotypom bola zistená veľmi nízka hladina expresie MITF-M, čo naznačuje, že tento transkripčný faktor pôsobí ako supresor metastatického procesu [21]. V rakovinových bunkách s nízkou hladinou expresie cytozolového/nukleárneho β-katenínu vzniká malé množstvo proteínu MITF-M, ktorý nedokáže inhibovať transkripciu MMP 14. Tento enzým katalyzuje degradáciu laminínu a fibronektínu, čím dochádza k zmene tvaru melanocytov, k zvýšemiu ich pohyblivosti a invazivity [22]. MITF-M je teda považovaný za jeden z kľúčových komponentov regulácie tvorby a šírenia metastáz malígneho melanómu.
Záver
Doposiaľ publikované štúdie naznačujú, že aktivácia MITF-M predstavuje jeden zo základaných mechanizmov, ktorý integruje špecifické vnútrobunkové signalizácie podieľajúce sa na bunkovej diferenciácii, proliferácii a prežívaní melanocytov. Syntéza enzýmov a štruktúrnych proteínov zapojených do melanogenézy je koordinovaná už na transkripčnej úrovni. Okrem pigmentácie upravuje aktivácia MITF-M aj proliferáciu a invazívnosť zhubných melanocytov, hlavne reguláciou transkripcie génov zapojených do týchto procesov. Zablokovanie transkripčného faktora MITF-M a niektorých jeho aktivátorov má inhibičné účinky na neotransformáciu melanómových buniek. Tento experimentálny prístup je ešte významnejší vzhľadom na vznik rezistencie pri použití súčasných chemických inhibítorov. Preto je štúdium a detailné porozumenie signálnej dráhe MITF-M vysoko aktuálne a môže prispieť k vývoju nových diagnostických postupov využiteľných následne aj pri monitorovaní pacientov s malígnym melanómom.
Práca bola podporená grantovými projekty VEGA 1/0115/14 a VEGA 1/0873/16.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. Ing. Mária Mareková, CSc.
Ústav lekárskej a klinickej biochémie LF UPJŠ v Košiciach
Trieda SNP 1
040 11 Košice
Slovenská Republika
e-mail: maria.marekova@upjs.sk
Obdržané: 4. 12. 2015
Prijaté: 14. 6. 2016
Zdroje
1. Su TR, Lin JJ, Tsai CC et al. Inhibition of melanogenesis by gallic acid: possible involvement of the PI3K/Akt, MEK/ERK and Wnt/β-catenin signaling pathways in B16F10 cells. Int J Mol Sci 2013; 14 (10): 20443–20458. doi: 10.3390/ijms141020443.
2. Maddodi N, Jayanthy A, Setaluri V. Shining light on skin pigmentation: the darker and the brighter side of effects of UV radiation. Photochem Photobiol 2012; 88 (5): 1075–1082. doi: 10.1111/j.1751-1097.2012.01138.x.
3. Paillerets BB, Lesueur F, Bertolotto C. A germline oncogenic MITF mutation and tumor susceptibility. Eur J Cell Biol 2014; 93 (1–2): 71–75. doi: 10.1016/j.ejcb.2013.10.002.
4. Hartman ML, Czyz M. Pro-survival role of MITF in melanoma. J Invest Dermatol 2015; 135 (2): 352–358. doi: 10.1038/jid.2014.319.
5. Shibahara S, Takeda K, Yasumoto K et al. Microphthalmia--associated transcription factor (MITF): multiplicity in structure, function, and regulation. J Invest Dermatol Symp Proc 2001; 6 (1): 99–104.
6. Vachtenheim J, Ondrušová L. MITF expression levels in melanoma cells contribute to cell invasion and proliferation. Exp Dermatol 2015; 24 (7): 481–484. doi: 10.1111/exd.12724.
7. Eccles MR, He S, Ahn A et al. MITF and PAX3 play distinct roles in melanoma cell migration; outline of a „genetic switch“ theory involving MITF and PAX3 in proliferative and invasive phenotypes of melanoma. Front Oncol 2013; 11 (3): 229. doi: 10.3389/fonc.2013.00229.
8. Agnarsdottir M, Ponten F, Garno H et al. MITF expression in cutaneous malignant melanoma. J Mol Biomark Diagn 2012; 3 (4): 128. doi: 10.4172/2155-9929.1000128.
9. Steingrimsson E, Copeland NG, Jenkins NA. Melanocytes and the microphthalmia transcription factor network. Annu Rev Genet 2004; 38 : 365–411.
10. Nishimura EK, Granter SR, Fisher DE. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science 2005; 307 (5710): 720–724.
11. Loercher AE, Tank EM, Delston RB et al. MITF links differentiation with cell cycle arrest in melanocytes by transcriptional activation of INK4A. J Cell Biol 2005; 168 (1): 35–40.
12. Gajos-Michniewicz A, Duechler M, Czyz M. MiRNA in melanoma-derived exosomes. Cancer Lett 2014; 347 (1): 29–37. doi: 10.1016/j.canlet.2014.02.004.
13. Carreira S, Goodall J, Denat L. Mitf regulation of Dia1 controls melanoma proliferation and invasiveness. Genes Dev 2006; 20 (24): 3426–3439.
14. Giuliano S, Ohanna M, Ballotti R et al. Advances in melanoma senescence and potential clinical application. Pigment Cell Melanoma Res 2011; 24 (2): 295–308. doi: 10.1111/j.1755-148X.2010.00820.x.
15. Giuliano S, Cheli Y, Ohanna M. Microphthalmia-associated transcription factor controls the DNA damage response and a lineage-specific senescence program in melanomas. Cancer Res 2010; 70 : 3813–3822. doi: 10.1158/0008-5472.CAN-09-2913.
16. Sabeh F, Shimizu-Hirota R, Weiss SJ. Protease-dependent versus-independent cancer cell invasion programs: three-dimensional amoeboid movement revisited. J Cell Biol 2009; 185 (1): 11–19. doi: 10.1083/jcb.200807195.
17. Hari L, Brault V, Kléber M et al. Lineage-specific requirements of β-catenin in neural crest development. J Cell Biol 2002; 159 (5): 867–880.
18. Zeng X, Huang H, Tamai K et al. Initiation of Wnt signaling: control of wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development 2008; 135 (2): 367–375.
19. Dansky WE, Curley DP, Santhanakrishnan M et al. β-catenin signaling controls metastasis in Braf-activated Pten-deficient melanomas. Cancer Cell 2011; 20 (6): 741–754. doi: 10.1016/j.ccr.2011.10.030.
20. Arozarena I, Bischof H, Gilby D et al. In melanoma, beta-catenin is a suppressor of invasion. Oncogene 2011; 30 (45): 4531–4543. doi: 10.1038/onc.2011.162.
21. Hoeck KS, Eichhoff OM, Schlegel NC et al. In vivo switching of human melanoma cells between proliferative and invasive states. Cancer Res 2008; 68 (3): 650–656. doi: 10.1158/0008-5472.CAN-07-2491.
22. Sahai E, Marshall CJ. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis. Nat Cell Biol 2003; 5 (8): 711–719.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek Aktuality z odborného tiskuČlánek Imunologická sekce ČOSČlánek Melanom plosky nohy
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- O limitech, pokroku, hybridech a sebekontrole v onkologii
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Glycin-N-metyltransferáza a nádorová onemocnění prostaty
- Prognostické a prediktivní faktory u adenokarcinomu pankreatu
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Exprese ABC transportérů Pgp, MRP1 a MRP3 u maligních a benigních změn vaječníků
- Kombinovaná léčba recidivujícího maligního schwannomu
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
- Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
- Everolimus v léčbě neuroendokrinních nádorů plicního a gastrointestinálního původu – výsledky studie RADIANT-4
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 5 – Hyperkalemie. Indikace umělé výživy. Kazuistika 5 - Společnost SANDOZ/EBEWE získala cenu za přínos k bezpečnému nakládání s léky
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- Informace z České onkologické společnosti
- Sentinel Lymph Node in Thin and Thick Melanoma
- Imunologická sekce ČOS
- Melanom plosky nohy
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 5 – Hyperkalemie. Indikace umělé výživy. Kazuistika 5 - Melanom plosky nohy
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



