-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Extravazace cytostatik – prevence a doporučené postupy
Extravasation of Cytostatic Drugs – Prevention and Best Practices
Extravasation is the leakage of a drug (intended primarily for intravenous administration) into tissues surrounding the vascular system. The damage to surrounding varies depending on the nature and volume of extravasation. Cytostatic extravasation is associated with poor outcomes for patients. This paper summarizes the types of risk associated with cytostatic extravasation, and the preventative measures that can be used when such an event occurs. We also provide information on potential treatments. However, justification for their use has only been substantiated in papers with different levels of significance and these papers are not available in all countries. We summarize current international recommendations for actions to be taken in the event of extravasation.
Key words:
extravasation – cytostatic agents – soft tissues injuries – antidotes – catheterization
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
23. 6. 2015Accepted:
9. 1. 2016
Autoři: V. Maňásek
Působiště autorů: Společnost pro porty a permanentní katetry, Praha Onkologické oddělení, Komplexní onkologické centrum Nový Jičín, Nemocnice Nový Jičín, a. s.
Vyšlo v časopise: Klin Onkol 2016; 29(2): 93-99
Kategorie: Přehled
doi: https://doi.org/10.14735/amko201693Souhrn
Extravazace představuje situaci, kdy dojde k úniku léčiva (určeného primárně k nitrožilní aplikaci) mimo cévní systém do okolních tkání. Dochází k poškození okolních struktur různé intenzity dle charakteru extravazátu a jeho objemu. Nejhorší bývají následky v případě extravazace některých cytostatik. V článku jsou shrnuty druhy rizikových cytostatik, možnosti prevence a opatření, která je nutno provést v případě, že k takové epizodě dojde. Máme k dispozici i několik specifických antidot, která však nejsou ve všech zemích dostupná, a opodstatnění pro jejich podání je navíc podloženo vědeckými články různé hladiny významnosti. Shrnujeme aktuální mezinárodní doporučení pro postup v případě extravazace.
Klíčová slova:
extravazace – cytostatika – poranění měkkých tkání – antidota – kanylaceÚvod
Jako extravazaci (nebo též paravazaci) popisujeme stav, kdy dochází k úniku léčiva (určeného primárně k nitrožilní aplikaci) mimo cévní systém do okolních tkání [1]. Podle druhu, intenzity a lokality paravazátu se odvíjí míra poškození tkáně. Po aplikaci vysoce rizikových léčiv může výjimečně dojít i k výrazné mutilaci vyžadující chirurgické ošetření, v extrémních případech rezultující i k amputaci končetiny.
Incidence paravazace
Údaje o výskytu extravazace jsou nedostatečné vzhledem k absenci centralizovaného registru. Odhaduje se, že výskyt se pohybuje mezi 0,01 a 7 %, jak uvádějí různé publikace [2 – 8]. Některé údaje naznačují, že incidence klesá, pravděpodobně díky širšímu využívání permanentních centrálních vstupů a zlepšení péče o katetry. Jedna retrospektivní studie potvrdila, že celková incidence byla 10krát méně častá v roce 2002 než o 15 let dříve (0,01 vs. 0,1 %; p = 0,001) [9]. Údaje o paravazaci při aplikaci do centrálního žilního přístupu jsou omezené a spíše se opíráme o kazuistická sdělení.
Léčiva riziková pro paravazaci
Mezi nejrizikovější látky, které mohou pacienta v případě paravazace výrazně poškodit, patří nepochybně cytostatika.
Podle potenciálu působit poškození tkání se cytostatika dělí dle doporučení European Society of Medical Oncology (ESMO) na vezikanty, iritanty a nonvezikanty. Používá se i podrobnější dělení na vezikanty, exfolianty, iritanty, látky způsobující zánět a látky neutrální [2]. Z praktického hlediska se však osvědčilo dělení dle ESMO.
Vezikanty neboli zpuchýřující cytostatika dělíme podle toho, dochází‑li po paravazaci k vazbě léčiva na deoxyribonukleovou kyselinu (DNA), nebo nikoliv. Toto dělení má velký praktický význam, neboť opatření při úniku cytostatika s vazbou na DNA se liší od postupů, které jsou doporučeny při extravazaci látky nevážící se na DNA. Vazba na DNA je vždy spojena s větším poškozením tkání, neboť extravazovaná látka se neresorbuje a poškození je trvalé. Do skupiny cytostatik vážících se na DNA patří alkylační cytostatika (mechloretamin, bendamustin), antracykliny (doxorubicin, daunorubicin, epirubicin, idarubicin) a protinádorová antibiotika (dactinomycin, mitomycin, mitoxantron). Je známo, že právě paravazace antracyklinů může vést k rozsáhlé nekróze tkání, která vyžaduje chirurgickou intervenci. Rozvoj nekrózy po extravazaci doxorubicinu ilustruje obr. 1. Do skupiny vezikantů, které se však na DNA nevážou, patří především vinca alkaloidy (vinkristin, vinblastin, vindesin, vinorelbin), taxany (docetaxel, paclitaxel) a trabectedin. Poškození tkáně po extravazaci docetaxelu znázorňuje obr. 2 a 3. Celá řada dalších cytostatik má potenciál rovněž poškozovat přilehlé tkáně, řadíme je do skupiny tzv. iritantů, nicméně poškození není nikdy tak závažné jako v případě vezikantů (tab. 1).
Obr. 1. Nekróza po extravazaci doxorubicinu. 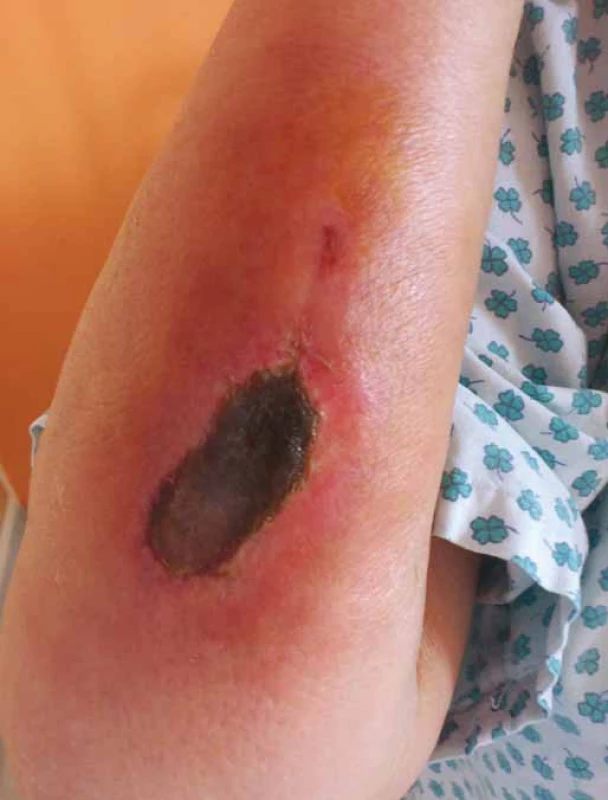
Obr. 2. Extravazace docetaxelu. 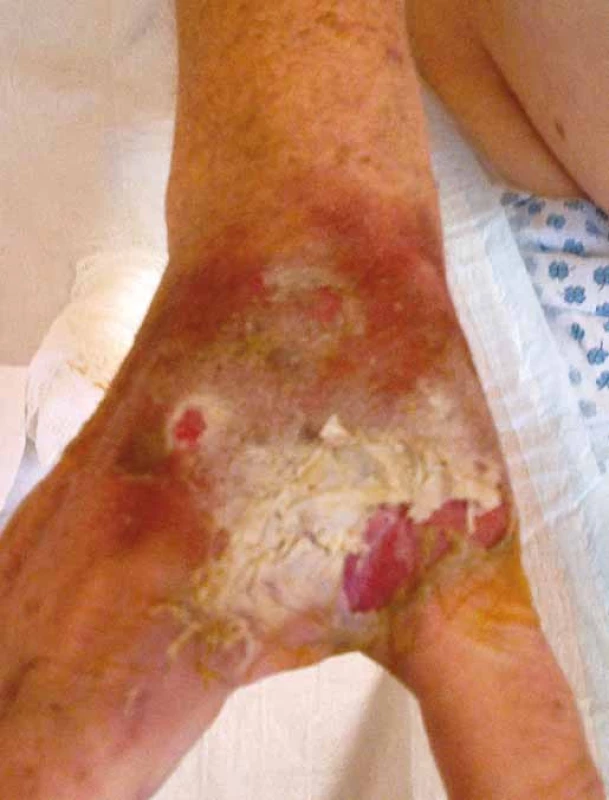
Obr. 3. Extravazace docetaxelu. 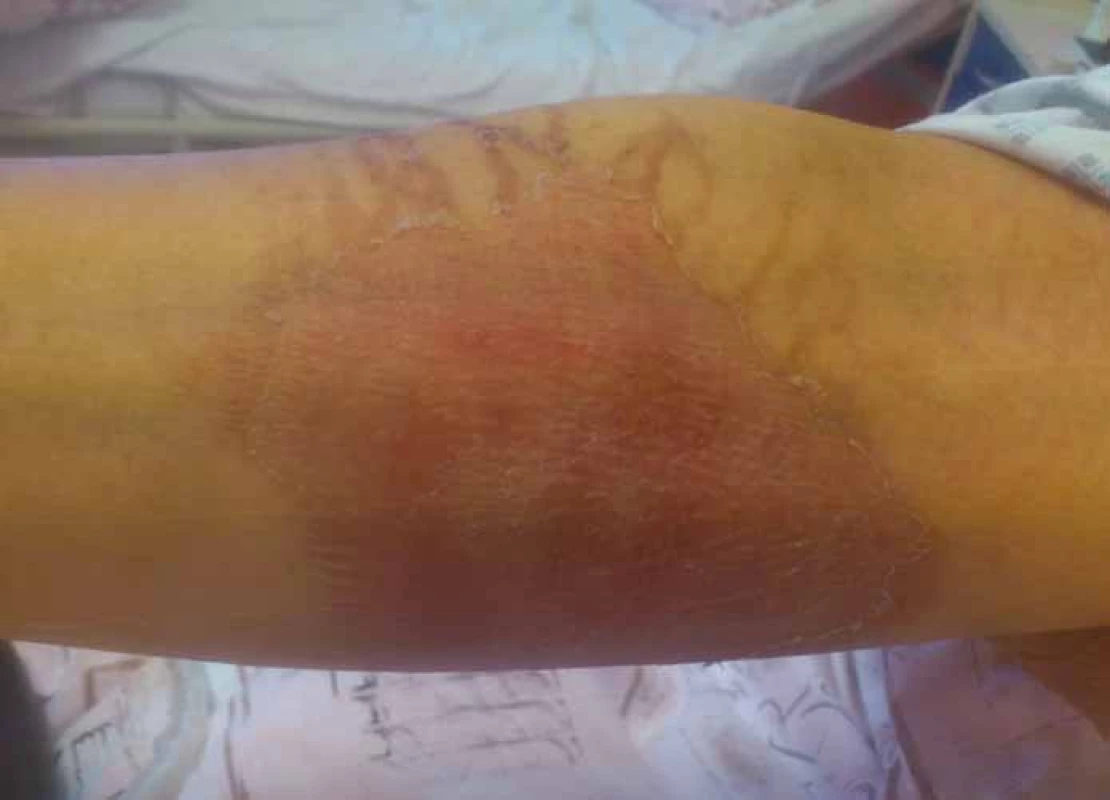
Tab. 1. Dělení cytostatik podle potenciálu působit poškození tkání na vezikanty, iritanty a nonvezikanty. Dle [1]. ![Dělení cytostatik podle potenciálu působit poškození tkání na vezikanty, iritanty a nonvezikanty. Dle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2aefdb915fb413b7d97d9907dc4d27d3.png)
U pacienta podstupujícího protinádorovou léčbu je tedy často optimální podání léčiv do centrálního řečiště. Dle standardů „2011 Infusion Nurses Standards of Practice“ (INS) je striktně doporučeno podávat do centrálního řečiště především „zpuchýřující cytostatika“. V případě, že jsou cytostatika podávána do periferní žíly, měla by se střídat místa aplikace při každém cyklu a vést dokumentace o místech podání, aby nedocházelo k opakované aplikaci ve stejné lokalitě.
Celá řada dalších léčiv má však vlastnosti, které je řadí do skupiny látek, které působí iritaci, příp. i nekrózy v případě paravazace. Je známo, že látky s pH pod 4,1 a nad 9,0 způsobují poškození endotelu. Dle INS je proto doporučeno aplikovat léčivo centrálním katetrem v případě, že je pH vyšší než 9,0 nebo nižší než 5,0. Obdobné doporučení platí pro látky s osmolaritou vyšší než 600 mOsm/ l. Některá léčiva mohou poškozovat venózní endotel v důsledku chemické struktury, což vede k rozvoji flebitidy. Příkladem je nafcillin nebo erytromycin.
Rizikové faktory pro paravazaci
V případě, že jsou u pacienta přítomny rizikové faktory pro extravazaci, je na místě zvážit zavedení centrálního žilního vstupu [5,8,10]. Mezi tyto rizikové faktory patří především drobné a fragilní periferní žíly, tvrdé a sklerotické žíly, rizikové jsou prominující, ale pohyblivé žíly (např. u seniorů). K podezření na nedostatečnost periferního žilního systému nás může nabádat anamnéza častých venepunkcí nebo předchozí chemoterapie, predispozice k insuficienci cirkulace (Raynaudův syndrom, symptomatický diabetes mellitus, cévní onemocnění, lymfedém, syndrom horní duté žíly). Rizikový bude vždy pacient s vyšší tendencí ke krvácení, zvýšenou cévní propustností nebo koagulopatií. Spíše technickým problémem je mnohdy obezita pacienta. Vyskytuje‑li se u nemocného neuropatie, je třeba počítat se sníženou schopností zaznamenat případnou paravazaci, a to především v případě prolongované aplikace infuze. Obtíže mohou nastat rovněž u aplikace osobám, u kterých je komunikační problém (mentální retardace, děti), což může zabránit včasné identifikaci extravazace.
Opatření minimalizující riziko extravazace
Je‑li léčivo podáváno do periferní žíly, je nutné splnit několik podmínek, aby byla aplikace co nejméně riziková [11].
Základem úspěchu je optimální výběr vhodného místa pro venepunkci. Volíme široké žíly předloktí, měli bychom se vyhnout oblastem nad klouby, neměla by se používat volární strana zápěstí a dolní končetiny. Rovněž nejsou doporučeny žíly ve fossa antecubiti a na dorzu ruky, a to obzvlášť pro aplikaci zpuchýřujících cytostatik. Zásadou je nepíchat do lymfedému anebo se punkce vyvarovat v případě, že existuje oprávněné riziko vzniku lymfedému (např. po exenteraci axily apod.).
Opatrnost je třeba při výběru vhodného žilního vstupu. Křidélková jehla, tzv. motýlek, není kupříkladu vhodná pro aplikaci zpuchýřujících cytostatik. Je doporučeno použít flexibilní kanylu – „flexilu“. K prolongované aplikaci zpuchýřujících cytostatik (např. po dobu 12 – 24 hod) pak užít centrální vstup.
Je nutné provádět kontrolní opatření během zajištění žilního vstupu. Nezbytná je jistota správného umístění kanyly v žilním lumen, o čemž se ujistíme přítomností venózního návratu při aspiraci. V průběhu aplikace je nutné sledování místa vpichu za účelem časného odhalení případné paravazace. Doporučuje se proplach 10 – 20 ml fyziologického roztoku po každé aplikaci, a to i mezi jednotlivými cytostatiky, opakovaně zkoušet aspirovat, sledovat pacienta během aplikace. Bolusové dávky zpuchýřujícího cytostatika mohou být podány současně s aplikací kompatibilní infuze.
V případě, že je rizikové léčivo podáváno v pravidelných intervalech (např. 1krát za tři týdny při chemoterapii s antracykliny), je vhodné vést záznam o místě předchozí venepunkce a aplikace. Optimální je postupovat centripetálně, tedy od zápěstí směrem ke kubitě při každé další aplikaci, tedy při každém dalším cyklu, aby cytostatikum nepronikalo do oblasti poškozené endoteliální venózní výstelky. Ze stejného důvodu by měla být periferní linka k aplikaci zpuchýřujícího cytostatika zavedena proximálně od lokality, kde byla provedena venepunkce za účelem odběru krve před chemoterapií [11].
Nejlepší prevencí periferní paravazace je zavedení centrálního žilního vstupu. Pro déletrvající léčbu máme k dispozici intravenózní port, tunelizovanou centrální kanylu a centrální katetr implantovaný z periferie (PICC). Společnost pro porty a permanentní katetry definovala kritéria pro výběr konkrétního druhu žilního vstupu v onkologii [12,13] a každý pacient, který je indikován ke střednědobé nebo dlouhodobé systémové terapii, by měl mít inzertován permanentní žilní vstup [14].
Diagnóza paravazace a diferenciální diagnóza
Mezi časné symptomy paravazace patří bolest v místě aplikace, pálení, trhání, tepání, svědění, otok, zarudnutí. Mezi pozdní symptomy řadíme nekrózy a ulcerace. Největší riziko pozdních reakcí je v případě paravazace vezikantů s vazbou na DNA, kdy dochází k prolongovanému poškození tkání a nekróza se rozvíjí s odstupem dní a týdnů. O události je proto třeba provést detailní záznam a pacienta zvát na pravidelné kontroly. Mezi příznaky zvyšující podezření na paravazaci však patří i absence krevního návratu při aspiraci, odpor při aplikaci, přerušování volné aplikace infuze.
Lokální reakce připomínající paravazaci se mohou vyskytnout u některých cytostatik i při správné aplikaci (erytém, urtika, svědění). Patří mezi ně asparagináza, cisplatina, daunorubicin, doxorubicin, epirubicin, fludarabin, mechloretamin nebo melfalan. Chemickou flebitidu (venózní zánět, často doprovázený trombózou nebo sklerózou) způsobuje amsakrin, karmustin, cisplatina, dacarbazin, epirubicin, 5 - fluorouracil (v kontinuální infuzi v kombinaci s cisplatinou), gemcitabin, mechloretamin, vinorelbin [11]. V případě suspekce na paravazaci nesmí být vstup ihned odstraněn, neboť nejprve musí být provedena specifická opatření, která shrnuje schéma 1.
Schéma 1. Postup při extravazaci. Dle [1]. ![Schéma 1. Postup při extravazaci. Dle [1].](https://pl-master.mdcdn.cz/media/image/6ded9452f5b6460865756f8a7a955d29.png?version=1537794504)
Postup při extravazaci
V případě, že došlo k úniku zpuchýřujícího cytostatika s vazbou na DNA, je nutné urgentní ohraničení extravazátu a neutralizace. Snažíme se docílit vazokonstrikce přikládáním studených obkladů. Je nutné vyvarovat se obkladu s alkoholem. Naopak, jde‑li o vezikanty bez vazby na DNA, je cílem léčebných opatření disperze a diluce extravazátu, čehož docílíme teplými obklady a použitím látek napomáhajících resorpci. U vinca alkaloidů a taxanů se používá hyaluronidáza, která napomáhá disperzi cytostatika a redukuje poškození tkání. Existují některá doporučení pro použití specifických antidot, jejichž podání je však kontroverzní a jednotlivá pracoviště mají vypracované vlastní doporučené postupy, které se mnohdy liší. Je třeba si uvědomit, že mnoho z nich je považováno za neúčinné, ba dokonce mohou způsobit další poškození extravazované oblasti. Mnohé z těchto látek navíc v mnoha evropských zemích nejsou běžně k dispozici [6,8,15]. Například u doxorubicinu jeden z výrobců v případě extravazace doporučuje ukončení infuze a zahájení nitrožilní aplikace dexrazoxanu, a to nejpozději do 6 hod po extravazaci. Je‑li dexrazoxan kontraindikován, doporučuje výrobce místní aplikaci 99% dimetylsulfoxidu (DMSO) do oblasti o velikosti 2krát větší, než je postižená plocha (čtyři kapky na plochu povrchu kůže o velikosti 10 cm²) [16]. Použití specifických antidot u některých cytostatik shrnuje tab. 2.
Tab. 2. Použití specifických antidot u některých cytostatik. Dle [1,17,35]. ![Použití specifických antidot u některých cytostatik. Dle [1,17,35].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b03a5b53174035c7a2dbb175d708b38c.png)
Specifická antidota
Specifické antidotum pro extravazát je vždy uvedeno v SPC podaného přípravku. U antracyklinů a mitomycinu C jsou data o efektu DMSO a dexrazoxanu, u cisplatiny a mechloretaminu je některými autory doporučováno podání thiosulfátu sodného, u vinca alkaloidů a paclitaxelu je doporučováno podání hyaluronidázy [17].
Topické kortikoidy
Pouze v jedné jednoramenné klinické studii s 53 pacienty byl náznak příznivého efektu podkožních injekcí hydrokortizonu s následnou topickou aplikací betametazonu na snížení rozsahu nekrózy [18]. Nicméně v retrospektivní analýze 175 případů extravazace bylo nutné provést chirurgický debridement až u 46 % pacientů, kteří dostávali kortikoidy. Oproti tomu ve skupině bez aplikace kortikoidů bylo chirurgické ošetření nutné jen v 13 % [6,15]. V této souvislosti se podání podkožních kortikoidů všeobecně nedoporučuje. Nicméně např. v doporučení Kooperativní lymfomové skupiny ČR z roku 2014 je zmínka nejen o užití topických kortikoidů, ale i o podání kortikoidů systémově a podkožně, což jen dokládá nejednotnost v postupech [19]. Pouze jeden z výrobců doxorubicinu má ve svém doporučení pro použití topických kortikoidů v rámci řešení epizody extravazace.
Thiosulfát sodný
Na animálních modelech byl prokázán protektivní efekt intradermální injekce thiosulfátu po paravazaci mechloretaminu (zpuchýřující cytostatikum). Je substrátem pro alkylaci mechloretaminem a brání tak alkylaci a pokračující destrukci podkožní tkáně. Pokud však byl podáván intravenózně, kožní toxicitě se nezabránilo [20]. Aktuálně je doporučení podat okamžitě podkožně 2 ml 1/ 6 molárního roztoku (4 ml 10% thiosulfátu sodného + 6 ml aqua pro injectione), aplikují se 2 ml roztoku na každý miligram mechloretaminu v paravazátu. V ČR je možné zažádat o vydání thiosulfátu cestou Toxikologického informačního střediska při Klinice pracovního lékařství 1. LF UK a VFN v Praze (tis@vfn.cz), obecně je určen k terapii intoxikace kyanidy.
DMSO
DMSO proniká tkání při topické aplikaci a působí jako „scavanger“, vychytává tedy volné radikály, urychluje clearance extravazátu z tkání. Přes počáteční nepříznivé výsledky pomocí léčby s DMSO na zvířecích modelech [21] byla v roce 1980 provedena prospektivní pilotní studie u 20 pacientů, ve které byl prokázán klinický přínos v případě extravazace antracyklinů [22]. DMSO byl aplikován bezprostředně po extravazaci s nanesením na oblast o dvojnásobné ploše než místo postižení. Aplikace byla prováděna 2krát denně po dobu 14 dnů a ve všech případech se zabránilo rozvoji nekrózy, která by vyžadovala chirurgický zákrok.
V roce 1995 byla prezentována data 144 pacientů [4], u kterých byl DMSO použit po extravazaci různých cytostatik – doxorubicin (n = 11), epirubicin (n = 46), mitomycin (n = 5), mitoxantron (n = 13), cisplatina (n = 44), karboplatina (n = 6), ifosfamid (n = 14) a fluouracil (n = 5). V prvních 10 min po extravazaci byl topicky aplikován 99% DMSO u 84 % pacientů. Pouze u jednoho pacienta po paravazaci epirubicinu se vyskytla ulcerace. V současnosti je 99% DMSO určen pro lokální aplikaci po paravazaci antracyklinů a mitomycinu. První dávka je aplikována optimálně do 10 min po paravazaci, následně 2 – 3krát denně po dobu min. 1 týdne. V ČR byl ještě nedávno dostupný DMSO pouze v nižší, 15% koncentraci v kombinaci s dexpanthenolem a heparinum natricum v přípravku Dolobene, aktuálně však dostupný není. Ani v komerčně dostupných přípravcích v zahraničí nepřesahuje koncentrace DMSO 50 %. I přesto je však např. v souhrnu údajů o doxorubicinu výrobcem doporučován 99% DMSO [16], přičemž v ČR je tato látka vedena jako chemikálie, nikoliv léčivo.
Dexrazoxan
Dexrazoxan byl úspěšně použit ke snížení srdeční toxicity u pacientů podstupujících chemoterapii s antracykliny (studie u žen s pokročilým karcinomem prsu) [23]. Efekt je dán vazbou železa s redukcí vzniku komplexů antracyklin‑železo tvořících kardiotoxické radikály [24]. Langer et al [25] prokázali, že systémové podání dexrazoxanu zabránilo na myším modelu vytvoření defektu, a to v případě podání 3 hod po extravazaci antracyklinu.
Dvě prospektivní jednoramenné klinické studie prokázaly, že intravenózní dexrazoxan zabránil vážnému poškození tkání po extravazaci antracyklinů. Z 54 pacientů zahrnutých do studie bylo nutné provést chirurgický debridement pouze u jednoho (1,8 %). Dexrazoxan byl podáván nitrožilně po dobu tří dní (1 000, 1 000 a 500 mg/ m2), s iniciální dávkou nejpozději 6 hod po extravazaci [26,27]. Podání dexrazoxanu bylo dobře tolerováno. Mezi nejčastější nežádoucí účinky patřila hematologická toxicita, elevace transamináz, nevolnost a bolest v místě infuze dexrazoxanu [28]. U pacientů s clearance kreatininu s hodnotami < 40 ml/ min by měla být dávka dexrazoxanu snížena na 50 %. Zároveň nemá být současně s infuzí dexrazoxanu aplikován DMSO, studené obklady by měly být odstraněny 15 min před a během podávání. Je doporučeno podat dexrazoxan intravenózně do velké žíly v oblasti vzdálené od místa extravazace, optimálně na kontralaterální končetině. V ČR není aktuálně dexrazoxan registrován, nicméně jeden z výrobců ve svém SPC na aplikaci dexrazoxanu odkazuje, ostatní výrobci jsou opatrnější, a to až do té míry, kdy je např. doporučeno pouze chlazení samotné [16].
Hyaluronidáza
Hyaluronidáza je enzym, který degraduje kyselinu hyaluronovou, a tím zlepšuje absorpci extravazovaného léčiva. Snížením viskozity intercelulární matrix štěpením kyseliny hyaluronové dochází k odbourávání mezibuněčné hmoty a zvýšení permeability vazivových tkání [29]. V roce 1994 bylo provedeno úspěšně testování po paravazaci vinca alkaloidů [30]. V ČR je hyaluronidáza běžně dostupná. Mezi terapeutické indikace určené výrobcem patří léčba zánětlivých stavů pohybového aparátu, při kombinaci s lokálními anestetiky urychluje nástup účinku, čehož je využíváno i v očním lékařství, kdy jsou zlepšeny podmínky pro operativní zákroky na oku. Předchází‑li aplikace hyaluronidázy subkutánnímu nebo intramuskulárnímu podání léčiv, která nelze aplikovat intravenózně, urychlí se tím nástup jejich účinku a zvýší se jejich vstřebávání. V porodnictví zvyšuje aplikace do oblasti hráze při počátku porodu flexibilitu měkkých tkání porodních cest [31]. Aktivita enzymu ve tkáních přetrvává minimálně po dobu 12 hod. V SPC přípravku s hyaluronidázou není exaktně stanoven postup pro použití v případě extravazace, nicméně obecně je doporučeno podání do 1 hod po parazavaci. Obvyklá dávka je 1 ml (150 IU) hyaluronidázy na 1 ml extravazátu. V 1 ml aqua pro injectione je naředěno 150 – 1 500 IU hyaluronidázy, 0,4 ml může být podáno kanylou těsně před odstraněním, zbylé množství se aplikuje do okolí paravazátu podkožně. Optimální je užití jehly o velikosti 25 G nebo 27 G a požadovaný objem podat v pěti dávkách do okolí paravazátu. Na každou aplikaci je vhodné užít jinou jehlu. Je dostupné balení 10 ampulí à 150 IU, cena ampulky vychází cca na 110 – 130 Kč.
Chirurgická léčba těžkého poškození tkání
Chirurgický debridement je indikován v případě, že se nekróza nehojí a/ anebo bolest trvá déle než 10 dní. Z dostupných dat je zřejmé, že pouze jedna třetina extravazací vede k rozvoji ulcerací [32]. Chirurgické zákroky jsou rezervovány pro případy těžkých extravazací anebo pro pacienty, u nichž konzervativní léčba nebyla provedena adekvátně. Zákrok spočívá v široké a dostatečně hluboké excizi, dočasném krytí a následném provedením plastické rekonstrukce připraveným kožním štěpem. Podkožní „wash ‑ out“, tedy „vymývání“, je chirurgická technika, která byla poprvé testována u 13 pacientů, kteří nebyli léčeni žádnou jinou metodou. Průměrný interval pro subkutánní „vymývání“ byl 345 min a u žádného z pacientů se nerozvinula nekróza v průběhu sledovaného období tří měsíců [33]. Vzhledem k omezeným zkušenostem není možné tuto techniku všeobecně doporučit, měla by být prováděna na pracovištích se zkušenostmi s těmito procedurami.
Extravazace při aplikaci do centrálního žilního přístupu
Extravazace léčiv podávaných přes centrální kanylu je vzácná komplikace. V nedávné sérii 815 pacientů došlo k této komplikaci v 0,24 % případů [34]. Dojde‑li k paravazaci, roztok se může hromadit v mediastinu, pohrudnici nebo v podkožní oblasti hrudníku a krku. Nejčastějším příznakem extravazace je akutní hrudní bolest. Diagnóza musí být založena na klinických příznacích a potvrzena některou zobrazovací metodou, obvykle se provádí CT hrudníku. Doporučení o postupu při paravazaci jsou vytvořena na základě kazuistik. Postup by měl zahrnovat zastavení infuze a aspiraci prostřednictvím ponechaného centrálního žilního katetru, a to největší množství roztoku, jak je to jen možné. V případě, že došlo k extravazaci antracyklinu, je vhodné použít dexrazoxan. I když ve většině hlášených případů byla dána přednost konzervativní léčbě, může být přistoupeno rovněž k chirurgické intervenci s cílem odstranění zbytku paravazátu. Jako doporučené přídatné postupy lze doporučit podání antibiotik, intravenózních kortikoidů a analgetik, a to k tlumení příznaků mediastinitidy nebo pleuritidy.
Závěr
Extravazace cytostatik představuje nepříjemnou komplikaci protinádorové terapie, která může mít závažné nevratné důsledky. Proto je nutné dodržovat zásady bezpečné aplikace cytostatik, mezi něž patří správný výběr žíly, kterou je léčivo aplikováno, a zajištění permanentního žilního vstupu, je‑li indikován. V případě, že k extravazaci dojde, je vhodné postupovat podle doporučení, která jsou jasně specifikována pro konkrétní druhy cytostatik. Stěžejní je znát cytostatika, která způsobují největší poškození (vezikanty), a dle tendence k vazbě na DNA zahájit opatření, která mají za cíl extravazát buďto ohraničit a zamezit jeho dalšímu šíření, anebo naopak provádět postupy, které vedou k disperzi léčiva v podkoží s usnadněním jeho resorpce a eliminace. Lze tak předejít vážnému poškození pacienta, anebo přinejmenším následky významně zmírnit.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 23. 6. 2015
Přijato: 9. 1. 2016
MUDr. Viktor Maňásek
Onkologické oddělení
Komplexní onkologické centrum
Nemocnice Nový Jičín, a. s.
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: viktor.manasek@nnj.agel.cz
Zdroje
1. Fidalgo JA, Fabregat LG, Cervantes A et al. Management of chemotherapy extravasation: ESMO ‑ EONS clinical practice guidelines. Eur J Oncol Nurs 2012; 16(5): 528 – 534.
2. Allwood M, Stanley A, Wright P (eds). The cytotoxics handbook. 4th ed. UK: Radcliffe Medical Press Inc 2002.
3. Larson DL. Treatment of tissue extravasation by antitumor agents. Cancer 1982; 49(9): 1796 – 1799.
4. Bertelli G, Gozza A, Forno GB et al. Topical dimethylsulfoxide for the prevention of soft tissue injury after extravasation of vesicant cytotoxic drugs: a prospective clinical study. J Clin Oncol 1995; 13(11): 2851 – 2855.
5. Mader I, Fürst ‑ Weger P, Mader R (eds). Extravasation of cytotoxic agents; compendium for prevention and management. 2nd ed. New York: Springer Verlag 2009.
6. Schulmeister L. Extravasation management: clinical update. Semin Oncol Nurs 2011; 27(1): 82 – 90. doi: 10.1016/j.soncn.2010.11.010.
7. Olver IN, Schulmeister L. Extravasation. In: Olver IN (ed.). The MASCC Textbook of Cancer Supportive Care and Survivorship. Heidelberg: Springer 2011.
8. European Oncology Nursing Society (EONS) [online]. Extravasation Guidelines 2007. Available from: http://www.cancernurse.eu/documents/EONSClinicalGuidelinesSection6–en.pdf#search=”extravasation.
9. Langstein HN, Duman H, Seelig D et al. Retrospective study of the management of chemotherapeutic extravasation injury. Ann Plast Surg 2002; 49(4): 369 – 374.
10. WOSCAN Cancer Nursing and Pharmacy Group [online]. Chemotherapy Extravasation Guideline2009. Available from: http://www.beatson.scot.nhs.uk/content/mediaassets/doc/Extravasation%20guidance.pdf.
11. Wangström Y, Marquiles A. European Oncology Nursing Society extravasation guidelines. Eur J Oncol 2008; 12(4): 357 – 361. doi: 10.1016/j.ejon.2008.07.003.
12. Maňásek V, Soumarová R, Kociánová I et al. Žilní vstupy v onkologii. Klin Onkol 2012; 25(1): 9 – 16.
13. Maňásek V. Žilní přístupy pro střednědobou a dlouhodobou protinádorovou léčbu. Onkologie 2015; 9(5): 260.
14. Gallieni M, Pittiruti M, Biffi R. Vascular access in oncology patients. CA Cancer J Clin 2008; 58(6): 323 – 346. doi: 10.3322/CA.2008.0015.
15. Langer SW, Sehested M, Jesen PB. Anthracycline extravasation: a comprehensive review of experimental and clinical treatments. Tumori 2009; 95(3): 273 – 282.
16. Sukl.cz [internetová stránka]. Státní ústav pro kontrolu léčiv. Dostupné z: http://www.sukl.cz/modules/medication/search.php?data[search_for]=doxorubicin&data[code]=&data[atc_group]=L01DB01&data[material]=&data[path]=&data[reg]=&data[radio]=none&data[rc]=&data[chbox][0]=braill‑yes&data[chbox][1]=braill‑no&data[chbox][2]=braill‑def&data[with_adv]=0&data[listing]=20&search=Vyhledat&page=3.
17. Mechl Z, Brančíková D. Nežádoucí účinky protinádorové léčby a jejich léčba. Med Pro Praxi 2009; 6(6): 325 – 329.
18. Tsavaris NB, Karagiaouris P, Tzannou I et al. Conservative approach to the treatment of chemotherapy‑induced extravasation. J Dermatol Surg Oncol 1990; 16(6): 519 – 522.
19. Belada D, Trněný M (eds) a kolektiv autorů Kooperativní lymfomové skupiny. Diagnostické a léčebné postupy u nemocných s maligními lymfomy. 8. doplněné a přepracované vydání. Hradec Králové: HK CREDIT s.r.o 2014.
20. Dorr RT, Soble M, Alberts DS. Efficacy of sodium thiosulfate as a local antidote to mechloretamine skin toxicity in mouse. Cancer Chemother Pharmacol 1988; 22(4): 299 – 302.
21. Dorr RT, Alberts DS. Failure of DMSO and vitamin E to prevent doxorubicin skin ulceration in the mouse. Cancer Treat Rep 1983; 67(5): 499 – 501.
22. Olver IN, Aisner J, Hament A et al. A prospective study of topical dimethyl sulfoxide for treating anthracycline extravasation. J Clin Oncol 1988; 6(11): 1732 – 1735.
23. Wiseman LR, Spencer CM. Dexrazosane. A review of its use as a cardioprotective agent in patients receiving anthracycline‑based chemotherapy. Drugs 1998; 56(3): 385–403.
24. Hensley ML, Schuchter LM, Lindley C et al. American Society of Clinical Oncology clinical guidelines for the use of chemotherapy and radiotherapy protectants. J Clin Oncol 1999; 17(10): 3333 – 3335.
25. Langer SW, Sehested M, Jensen P. Treatment of anthracycline extravasation with dexrazoxane. Clin Cancer Res 2000; 6(9): 3680 – 3686.
26. Langer SW, Thougaard AV, Sehested M. Treatment of experimental extravasation of amrubicin, liposomal doxorubicin, and mitoxantrone with dexrazoxane. Cancer Chemother Pharmacol 2012; 69(2): 573 – 576. doi: 10.1007/s00280‑011‑1794 ‑ 6.
27. Mouridsen HT, Langer SW, Buter J et al. Treatment of anthracycline extravasation with Savene (dexrazoxane): results from two prospective clinical multicentre studies. Ann Oncol 2007; 18(3): 546 – 550.
28. Langer SW. Treatment of anthracycline extravasation from centrally inserted venouos catheters. Oncol Rev 2008; 2 : 114 – 116.
29. Disa JJ, Chang RR, Muci SJ et al. Prevention of adriamycin‑induced full ‑ thickness skin loss using hyaluronidase infiltration. Plast Reconstr Surg 1998; 101(2): 370 – 374.
30. Bertelli G, Dini D, Forno GB et al. Hyaluronidase as an antidote to extravasation of vinca alkaloids: clinical results. J Cancer Res Clin Oncol 1994; 120(8): 505 – 506.
31. Sukl.cz [internetová stránka]. Státní ústav pro kontrolu léčiv. Dostupné z: http://www.sukl.cz/modules/medication/detail.php?code=0200245&tab=texts.
32. Tsavaris N, Komitsopoulou P, Karagiaouris P et al. Prevention of tissue necrosis due to accidental extravasation of cytostatic drugs by a conservative approach. Cancer Chemother Pharmacol 1992; 30(4): 330 – 333.
33. Steiert A, Hille U, Burke W et al. Subcutaneous wash ‑ out procedure (SWOP) for the treatment of chemotherapeutic extravasations. J Plast Reconstruct Aesthet Surg 2011; 64(2): 240 – 247. doi: 10.1016/j.bjps.2010.04.040.
34. Narducci F, Jean ‑ Laurent M, Boulanger L et al. Totally implantable venous access port systems and risk factors for complications: a one‑year prospective study in a cancer centre. Eur J Surg Oncol 2011; 37(10): 913 – 918. doi: 10.1016/j.ejso.2011.06.016.
35. Guarneri V, Conte PF. Acute and subacute toxicities of medical anticancer treatment. In: Handbook of Cancer Diagnosis and Treatment evaluation. ESMO 2009; 91 – 107.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Novinky v adjuvantní terapii neseminomů stadia I
- Comment – Active Surveillance vs. Adjuvant Therapy in Clinical Stage I Non-seminomatous Germ Cell Testicular Cancer
- Kvalita života měřená jako změna v čase u českých žen s karcinomem prsu
- Shoda a neshoda klinické a patologické TNM klasifikace u karcinomu orofaryngu – vliv na prognózu a výsledky léčby
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
- Role BRAF/ MEK inhibice u metastazujícího maligního melanomu – kazuistika
- Papilárny karcinóm štítnej žľazy u dvojročného dieťaťa
- Informace z České onkologické společnosti
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 2 – Hyponatremie. Energie. Kazuistika 2 - Aktuality z odborného tisku
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
-
Sekvence adenom - karcinom v polypu tlustého střeva s mutací
p53 - SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Máme se bát predátorských časopisů?
- Proč Klinická onkologie nikdy nebyla a nebude predátorský časopis?
- Vyhlášení výsledků soutěže O nejlepší práci v roce 2015
- Extravazace cytostatik – prevence a doporučené postupy
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Extravazace cytostatik – prevence a doporučené postupy
- Protinádorový efekt rybího oleje – mýtus, nebo realita?
- Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii
-
Sekvence adenom - karcinom v polypu tlustého střeva s mutací
p53
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



