-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
Chimeric Antigen Receptor T-cells – Gene Therapy of the Future for Malignant Diseases?
Chimeric antigen receptors are synthetic, genetically modified receptors of T-cells. The introduction of chimeric antigen receptors into autologous patient T-cells can redirect the lymphocytes to specific antigen targets on the surface of malignant cells. This has recently emerged as an intriguing therapy approach in both hematologic malignancies and later also in solid tumors. Various chimeric antigen receptor designs and manufacturing processes were developed and seem to have a strong impact on the activity of chimeric antigen receptor T-lymphocytes and thereby the therapy success. The individual variables are currently being tested in numerous clinical trials. In this review, I will briefly describe the principle, basic structure and construction of chimeric antigen receptor T-lymphocytes.
Key words:
chimeric antigen receptor – CAR‑T-cells – gene therapy – immunotherapy – neoplasms
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
1. 9. 2015Accepted:
16. 9. 2015
Autoři: M. Šmída
Působiště autorů: CEITEC – Středoevropský technologický institut, MU, Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 44-47
Kategorie: Obecná část
doi: https://doi.org/10.14735/amko20154S44Souhrn
Chimérické antigenní receptory jsou syntetické, geneticky upravené receptory T lymfocytů. Jejich transfer do autologních T lymfocytů pacienta dokáže tyto lymfocyty cíleně naprogramovat proti specifickým antigenům vyskytujícím se na povrchu maligních buněk. Tento princip se v současnosti rozvinul jako potenciálně slibný přístup v terapii nejprve hematologických malignit a později i solidních nádorů. Byly vyvinuty různé strategie v designu chimérických antigenních receptorů a jejich transferu do T lymfocytů a zdá se, že tyto faktory mají velký dopad na aktivitu výsledných modifikovaných T lymfocytů a následně i na úspěšnost léčby. Jednotlivé proměnné v designu se v současnosti intenzivně testují v nespočetných klinických studiích. V tomto přehledu stručně popíši základní princip a strukturu chimérických antigenních receptorů a postup generování T lymfocytů nesoucích chimérický antigenní receptor.
Klíčová slova:
chimérický antigenní receptor – CAR-T lymfocyty – genová terapie – imunoterapie – nádorová onemocněníVývoj chimérického antigenního receptoru
Imunoterapie nádorových onemocnění přitahuje již nějakou dobu pozornost vědců a lékařů, jelikož nabízí možnost dlouhotrvajících remisí a potenciálně kompletní zničení nemoci. Jednotlivé přístupy zahrnují např. adoptivní transfer nádor infiltrujících T lymfocytů spojený s jejich extrakcí a expanzí ex vivo nebo aplikace monoklonálních protilátek. Rutinně se aplikují (a v klinických studiích nadále testují) protilátky proti povrchovým antigenům specifickým pro nádorové buňky nebo protilátky blokující molekuly jako PD ‑ 1 nebo CTLA ‑ 4, jež se vyskytují na povrchu T lymfocytů a negativně regulují jejich aktivaci. Tyto metody se ovšem setkávají s řadou překážek, jako je náročnost kultivace nádor infiltrujících lymfocytů, tolerance imunitního systému vůči autoantigenům a nutnost prezentace antigenu v komplexu s hlavním histokompatibilním systémem (major histokompatibility complex – MHC).
Chimérický antigenní receptor (CAR) představuje kombinaci protilátky a T buněčného receptoru (T-cell receptor – TCR) [1,2]. Jde o spojení části protilátky vázající antigen s funkčními doménami TCR signálních drah. CAR tak kombinuje v jedné molekule schopnost protilátek rozeznat a vázat antigen se schopností signálních domén aktivovat T lymfocyt [3,4]. CAR receptory jsou schopny na rozdíl od klasického TCR rozeznat a vázat molekuly v nativním stavu na povrchu cílových buněk [5]. Genetická modifikace autologních T lymfocytů pomocí CAR konstruktů tak umožňuje T lymfocytům vázat nádorově specifické povrchové antigeny nezávisle na procesování antigenu uvnitř buňky a prezentaci antigenu na MHC komplexu a překonává tak problém s MHC kompatibilitou a výše zmíněné překážky jiných imunoterapeutických postupů [6].
V průběhu vývoje CARs se zjistilo, že když se ke CAR receptoru připojí více signálních domén stimulujících T lymfocyty, lze dosáhnout větší efektivity takto modifikovaných T lymfocytů. První doménou přidanou ke CAR receptoru byla intracelulární část kostimulační molekuly CD28. Lymfocyty déle přežívají v periferii, ale ne dostatečně dlouho na to, aby mohly zabít všechny nádorové buňky. Teprve přidání další molekuly, CD137 (4 - 1BB), by mělo zajistit dostatečnou perzistenci in vivo a vyšší protinádorovou aktivitu [7,8].
Jako první byly CARs testovány na hematologických malignitách. Tyto mají několik výhod: 1. na rozdíl od většiny solidních nádorů je známá celá řada povrchových antigenů exprimovaných specificky na hematologických buňkách; 2. lze snadno monitorovat průběh léčby a odebírat hematologické nádorové buňky a 3. T lymfocyty přirozeně migrují do hematologických orgánů, jako je kostní dřeň či lymfatické uzliny. V současnosti se ovšem aplikace CAR ‑ T lymfocytů rozšiřuje i na celou plejádu solidních nádorů. Proces výroby a aplikace CAR ‑ T lymfocytů zahrnuje separaci T lymfocytů z krve pacienta a selekci požadované populace. Poté je do buněk vnesen vektor kódující CAR receptor pro příslušný povrchový nádorový antigen a takto geneticky upravené T lymfocyty jsou selektovány a expandovány do populace čítající biliony buněk. Ty jsou následně opět vpraveny do pacienta. Úspěšnost této terapie závisí především na míře exprese CAR receptoru, aktivitě CAR ‑ T lymfocytů a délce jejich perzistence v krvi pacienta. Tyto parametry jsou ovlivňovány několika různými faktory, z nichž hlavní roli hrají pravděpodobně samotná struktura CAR receptoru a způsob jeho transferu do autologních T lymfocytů.
Struktura chimérických antigenních receptorů
Extracelulární část CAR receptoru většinou představuje jednořetězcová variabilní část protilátky, konkrétně variabilní část lehkého plus variabilní část těžkého řetězce navzájem spojené linkerem (obr. 1). Tyto variabilní části pocházejí většinou z myších nebo humanizovaných protilátek, popř. jsou uměle syntetizovány a screenovány pomocí fágových knihoven [9]. Na rozdíl od klasického TCR, kde je specifita a aktivace T lymfocytu striktně dána úzkým rozsahem afinity TCR, CARs mají mnohem vyšší a širší rozmezí afinity zaručující vazbu na antigen, aniž by docházelo k nespecifické kros ‑ reaktivitě. Z preklinických studií se zdá, že prostorová lokalizace vazebného epitopu má větší efekt na aktivitu CAR než rozdíly v jeho afinitě [10]. Také délka, flexibilita a původ kloubu mezi extracelulární a transmembránovou částí jsou důležité faktory pro správnou aktivitu CAR [11 – 13]. V současnosti neexistují žádná obecná pravidla regulující design CAR proti cílovým molekulám, a je proto nutné testovat jednotlivé proměnné v designu empiricky. Doposud bylo vyvinuto několik generací CARs [3,4]. Jednotlivé generace CAR jsou zpravidla rozlišovány podle použitých intracelulárních signálních domén nutných pro aktivaci T lymfocytu. První generace CARs zahrnuje jako signální doménu pouze řetězec CD3 zeta. Druhá generace obsahuje navíc i jednu kostimulační doménu odvozenou buď od molekuly CD28, nebo 4 - 1BB. Třetí generace CARs obsahuje dvě kostimulační domény jako CD28 nebo 4-1BB plus doménu dalších kostimulačních molekul. Současné klinické studie se zabývají především testováním CARs druhé a třetí generace, které dosahují delší perzistence CAR ‑ T lymfocytů v krvi pacienta a vyšší lymfocytární aktivity. Také transmembránová doména a kloub spojující tuto část s extracelulárním řetězcem mohou hrát důležitou roli při interakci s antigenem, tvorbě imunologické synapse a asociaci CAR s jinými proteiny důležitými pro tvorbu robustního signálu nutného pro plnou aktivaci buňky. Většinou se používá transmembránová část a kloub z molekuly CD8α nebo CD28. Ovšem byly testovány i různě modifikované klouby z FcR oblasti a bylo zjištěno, že jsou schopny vázat Fc receptory a aktivovat buňky vrozeného imunitního systému [11 – 13].
Obr. 1. Struktura chimérického antigenního receptoru (CAR). 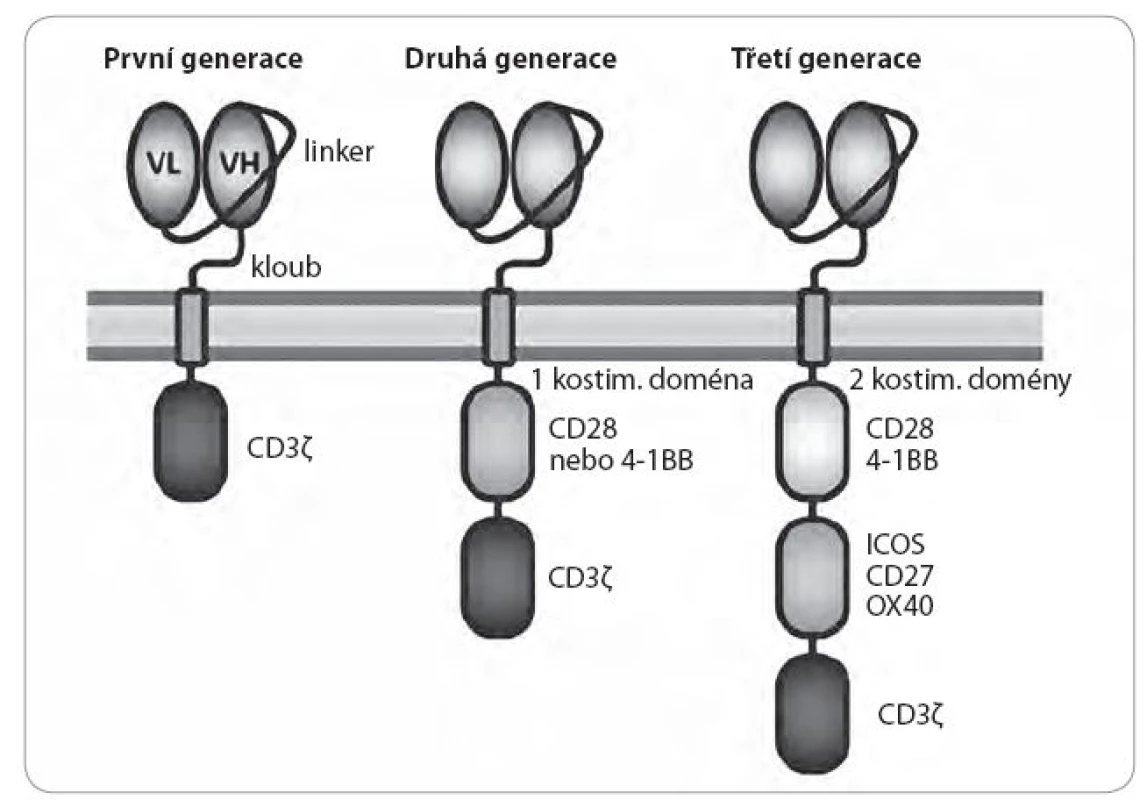
Extracelulární část sestává z variabilní části lehkého (VL) a těžkého (VH) imunoglobulinového řetězce navzájem spojenými linkerem. Tato část je kloubem spojena s transmembránovou doménou. Jednotlivé generace CARs se liší přítomností různých signálních domén v intracelulární části receptoru. Produkce CAR‑ T lymfocytů
Důležitým aspektem při přípravě CAR ‑ T lymfocytů je způsob bezpečného a účinného vložení CAR receptoru do autologních T lymfocytů. V současnosti je testováno několik různých metod pro vnesení CAR konstruktu do expandovaných T lymfocytů pacienta [14]. Každý z těchto systémů má své výhody a nevýhody, co se týče míry exprese CARs v buňkách, bezpečnosti systému a finanční náročnosti. Původně byla používána DNA transfekce, jelikož je to technika levná a nehrozí riziko inzerční mutageneze jako v případě virové infekce. Na druhé straně ovšem dosahuje relativně nízké efektivity transferu genu, a proto vyžaduje dlouhodobou kultivaci a selekci transfekovaných lymfocytů pomocí antibiotik. Dlouhodobá kultivace přitom není prospěšná pro aktivitu a perzistenci transfekovaných buněk a vnesené geny pro rezistenci mohou navíc tvořit imunogenní produkty. Užití transpozonových vektorů obsahujících element pro integraci (např. tzv. Sleeping Beauty transpozon) může vést k účinnějšímu integrování transgenu [15 – 17]. Tento systém se nyní testuje v různých klinických studiích a zdá se, že vede k účinnějšímu transferu genu a jeho déle trvající expresi [18]. Nejčastěji užívaným systémem vnesení CAR konstruktu je infekce lymfocytů pomocí γ ‑ retrovirů. Retroviry lze jednoduše připravit a navíc jsou schopny velmi účinně a permanentně transdukovat lymfocyty. Předběžné výsledky navíc ukazují, že z hlediska integrace do genomu je retrovirová infekce do primárních lidských lymfocytů bezpečná [19]. Nevýhodou retroviru může potenciálně být utlumení exprese CARs z důvodu utlumení LTR oblasti integrovaného retrovirového konstruktu. V jistém kontextu se toto ovšem může stát výhodou terapie. Pravděpodobně bezpečnější než retroviry z hlediska místa integrace je infekce pomocí lentivirových vektorů, které jsou také schopny efektivně a stabilně transdukovat T lymfocyty [20]. Použití specifických promotorů ve spojitosti s lentivirovými vektory dosahuje stabilní exprese CAR konstruktů na povrchu transdukovaných T lymfocytů a déle trvající perzistenci funkčních CAR ‑ T lymfocytů in vivo.
Také způsoby kultivace T lymfocytů a její délka mohou být důležitým faktorem přispívajícím ke kvalitě konečného produktu CAR ‑ T lymfocytu. Obyčejně se používá expanze lymfocytů pomocí stimulace anti‑TCR protilátkami plus podpůrnými cytokiny, což udržuje centrální paměťový fenotyp T lymfocytů, nebo pomocí umělých antigen ‑ prezentujících buněk [21,22]. Expandované CAR ‑ T lymfocyty jsou poté vpraveny zpět do pacienta a je monitorována délka jejich perzistence v periferii, aktivita a progres nemoci.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michal Šmída, Ph.D.
CEITEC – Středoevropský technologický institut, MU
Kamenice 753/5
625 00 Brno
e-mail: michal.smida@ceitec.muni.cz
Obdrženo: 1. 9. 2015
Přijato: 16. 9. 2015
Zdroje
1. Gross G, Waks T, Eshhar Z. Expression of immunoglobulin‑T ‑ cell receptor chimeric molecules as functional receptors with antibody‑type specificity. Proc Natl Acad Sci U S A 1989; 86(24): 10024 – 10028.
2. Irving BA, Weiss A. The cytoplasmic domain of the T cell receptor zeta chain is sufficient to couple to receptor‑associated signal transduction pathways. Cell 1991; 64(5): 891 – 901.
3. Cartellieri M, Bachmann M, Feldmann A et al. Chimeric antigen receptor ‑ engineered T cells for immunotherapy of cancer. J Biomed Biotechnol 2010; 2010 : 956304. doi: 10.1155/ 2010/ 956304.
4. Maus MV, Grupp SA, Porter DL et al. Antibody ‑ modified T cells: CARs take the front seat for hematologic malignancies. Blood 2014; 123(17): 2625 – 2635. doi: 10.1182/ blood ‑ 2013 ‑ 11 ‑ 492231.
5. Eshhar Z, Waks T, Bendavid A et al. Functional expression of chimeric receptor genes in human T cells. J Immunol Methods 2001; 248(1 – 2): 67 – 76.
6. Rossig C, Brenner MK. Genetic modification of T lymphocytes for adoptive immunotherapy. Mol Ther 2004; 10(1): 5 – 18.
7. Milone MC, Fish JD, Carpenito C et al. Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo. Mol Ther 2009; 17(8): 1453 – 1464. doi: 10.1038/ mt.2009.83.
8. Carpenito C, Milone MC, Hassan R et al. Control of large, established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains. Proc Natl Acad Sci U S A 2009; 106(9): 3360 – 3365. doi: 10.1073/ pnas.0813101106.
9. Sadelain M, Brentjens R, Rivière I. The basic principles of chimeric antigen receptor design. Cancer Discov 2013; 3(4): 388 – 398. doi: 10.1158/ 2159 ‑ 8290.CD ‑ 12 ‑ 0548.
10. Haso W, Lee DW, Shah NN et al. Anti‑CD22-chimeric antigen receptors targeting B ‑ cell precursor acute lymphoblastic leukemia. Blood 2013; 121(7): 1165 – 1174. doi: 10.1182/ blood ‑ 2012 ‑ 06 ‑ 438002.
11. Hudecek M, Lupo ‑ Stanghellini MT, Kosasih PL et al. Receptor affinity and extracellular domain modifications affect tumor recognition by ROR1 - specific chimeric antigen receptor T cells. Clin Cancer Res 2013; 19(12): 3153 – 3164. doi: 10.1158/1078 ‑ 0432.CCR‑13 ‑ 0330.
12. Hombach A, Hombach AA, Abken H. Adoptive immunotherapy with genetically engineered T cells: modification of the IgG1 Fc ‚spacer‘ domain in the extracellular moiety of chimeric antigen receptors avoids ‚off ‑ target‘ activation and unintended initiation of an innate immune response. Gene Ther 2010; 17(10): 1206 – 1213. doi: 10.1038/ gt.2010.91.
13. Hombach A, Heuser C, Gerken M et al. T cell activation by recombinant FcepsilonRI gamma‑chain immune receptors: an extracellular spacer domain impairs antigen ‑ dependent T cell activation but not antigen recognition. Gene Ther 2000; 7(12): 1067 – 1075.
14. Kalos M, June CH. Adoptive T cell transfer for cancer immunotherapy in the era of synthetic biology. Immunity 2013; 39(1): 49 – 60. doi: 10.1016/ j.immuni.2013.07.002.
15. Dupuy AJ, Akagi K, Largaespada DA et al. Mammalian mutagenesis using a highly mobile somatic Sleeping Beauty transposon system. Nature 2005; 436(7048): 221 – 226.
16. Huang X, Wilber AC, Bao L et al. Stable gene transfer and expression in human primary T cells by the Sleeping Beauty transposon system. Blood 2006; 107(2): 483 – 491.
17. Maiti SN, Huls H, Singh H et al. Sleeping beauty system to redirect T ‑ cell specificity for human applications. J Immunother 2013; 36(2): 112 – 123. doi: 10.1097/ CJI.0b013e3182811ce9.
18. Singh H, Manuri PR, Olivares S et al. Redirecting specificity of T ‑ cell populations for CD19 using the Sleeping Beauty system. Cancer Res 2008; 68(8): 2961 – 2971. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 07 ‑ 5600.
19. Scholler J, Brady TL, Binder ‑ Scholl G et al. Decade ‑ long safety and function of retroviral ‑ modified chimeric antigen receptor T cells. Sci Transl Med 2012; 4(132): 132ra53. doi: 10.1126/ scitranslmed.3003761.
20. Biffi A, Bartolomae CC, Cesana D et al. Lentiviral vector common integration sites in preclinical models and a clinical trial reflect a benign integration bias and not oncogenic selection. Blood 2011; 117(20): 5332 – 5339. doi: 10.1182/ blood ‑ 2010 ‑ 09 ‑ 306761.
21. Maus MV, Thomas AK, Leonard DG et al. Ex vivo expansion of polyclonal and antigen ‑ specific cytotoxic T lymphocytes by artificial APCs expressing ligands for the T ‑ cell receptor, CD28 and 4-1BB. Nat Biotechnol 2002; 20(2): 143 – 148.
22. Kaneko S, Mastaglio S, Bondanza A et al. IL‑7 and IL‑15 allow the generation of suicide gene ‑ modified alloreactive self ‑ renewing central memory human T lymphocytes. Blood 2009; 113(5): 1006 – 1015. doi: 10.1182/ blood ‑ 2008 ‑ 05 ‑ 156059.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



