-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunoterapie renálního karcinomu
Immunotherapy for Renal Cell Carcinoma
Background:
Renal cell carcinoma is characterised by chemo and radioresistance. Although drugs targeting angiogenesis and intracellular signaling have become the mainstay of systemic therapy for renal cell carcinoma in the last decade, latest immunotherapeutic approaches have achieved promising results.Aim:
To review the development of immunotherapy for renal cell carcinoma, especially the results of published studies using novel immunotherapeutic agents including checkpoint inhibitors.Results:
It has long been known that nonspecific immunotherapy may result in long term complete remission in a small number of patients. Advances in immunology have led to the renewal of interest in the use of anticancer immunotherapy for metastatic renal cell carcinoma. Promising results in phase I and II studies have been achieved using monoclonal antibodies against PD ‑ 1 receptor and its ligand. Studies comparing immunotherapy to standard targeted therapies are ongoing.Key words:
renal cell carcinoma – immunology – immunotherapy
Supported by grant VES 2015 15-34678A from the Agency for Healthcare Research, Ministry of Health, Czech Republic.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
20. 7. 2015Accepted:
17. 8. 2015
Autoři: T. Büchler
Působiště autorů: Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 64-68
Kategorie: Speciální část
doi: https://doi.org/10.14735/amko20154S64Souhrn
Východiska:
Renální karcinom je charakteristický chemo ‑ a radiorezistencí. V posledním desetiletí se v systémové léčbě renálního karcinomu uplatnily léky zaměřené proti angiogenezi a intracelulární signalizaci.Cíl:
Poskytnout přehled vývoje imunoterapie u renálního karcinomu s důrazem na poslední publikované výsledky, jichž bylo dosaženo s novou generací imunologických léků.Závěr:
Již dlouho je známo, že u malého počtu pacientů může nespecifická imunoterapie vést k dlouhodobé kompletní remisi. Pokroky v imunologii vedly k obnovenému zájmu o využití protinádorové imunoterapie v léčbě metastatického renálního karcinomu. Nejlepších výsledků ve studiích fáze I a II dosahují monoklonální protilátky proti receptoru PD ‑ 1 a jeho ligandu. Studie srovnávající imunoterapii se standardní cílenou léčbou probíhají.Klíčová slova:
renální karcinom – imunologie – imunoterapieÚvod
Karcinom ledvin (renal cell carcinoma – RCC) tvoří asi 2 – 3 % všech maligních nádorů v dospělosti. V roce 2012 byla incidence nádoru ledviny 28,9 a mortalita 10,5 případu na 100 000 obyvatel [1,2]. Incidence RCC v ČR je z neznámých důvodů nejvyšší na světě. Histologicky se ve většině případů jedná o adenokarcinom, jehož nejčastějším podtypem je světlobuněčný adenokarcinom.
V patogenezi sporadických RCC hraje významnou roli snížení exprese nebo funkce proteinu Von ‑ Hippel Lindau (VHL), které jsou způsobené inaktivační mutací nebo hypermetylací jeho promotoru. Dysfunkci VHL lze nalézt u 83 % všech případů RCC a u 88 % případů světlobuněčného RCC.
VHL se podílí na buněčné a tkáňové reakci na hypoxii. Za normálních podmínek při dostatku kyslíku je VHL součástí komplexu degradujícího HIF ‑ α (hypoxia ‑ inducible factor ‑ α). Jeho mutace vede k nadměrné přítomnosti HIF ‑ α a podobným metabolickým změnám, k jakým dochází během hypoxie. Výsledkem je vysoce vaskularizovaný nádor, stimulace invazivního růstu a metastazování. Zároveň dochází k expresi molekul, které lze využít v imunoterapii jako antigen asociovaný s nádorem, např. karboanhydrázy IX (CA IX) (obr. 1).
Obr. 1. Následky ztráty funkce VHL u renálního karcinomu 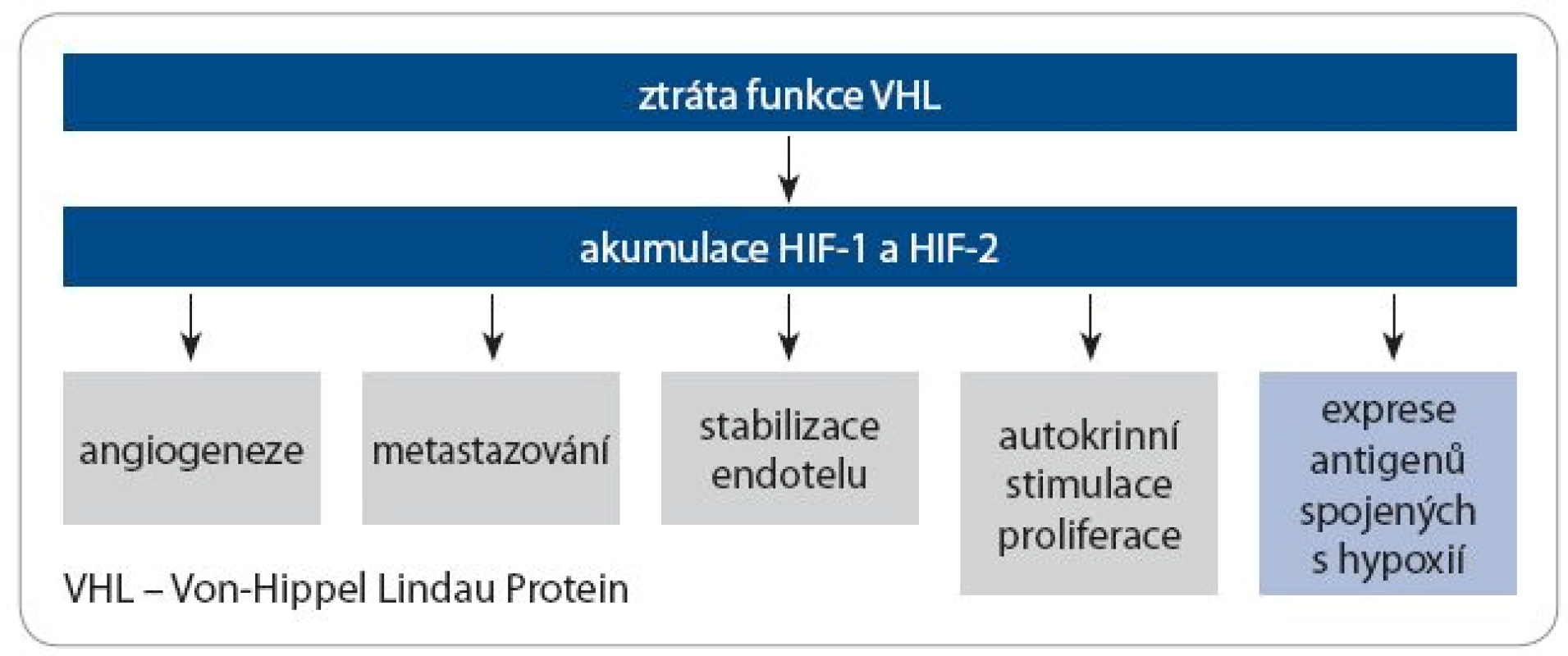
Část z těchto následků zvýšené exprese HIF ‑ α je zprostředkována molekulou VEGF (vascular endothelial growth factor) přes její receptor na povrchu nádorových buněk a buněk vaskulatury (endotelových buněk a pericytů). Méně je známo, že VEGF hraje i roli v imunologických procesech (tab. 1) [3,4]. Inhibitory dráhy VEGF působí jednak na nádorové buňky (stimulují apoptózu a brání jejich proliferaci), jednak na buňky mikroprostředí nádoru (inhibice nádorové angiogeneze).
Tab. 1. Mechanizmy, jimiž může VEGF přispívat k imunodeficienci navozené nádorem negativní regulace prezentace antigenů dendritickými buňkami [4]. ![Mechanizmy, jimiž může VEGF přispívat k imunodeficienci navozené nádorem negativní regulace prezentace antigenů dendritickými buňkami [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9fbc0031f8f0755b0b36e375f5968263.jpg)
Podíl imunitního systému na jejich léčebném efektu ovšem nelze vyloučit vzhledem k imunosupresivní aktivitě VEGF.
Druhým hlavním cílem biologické léčby metastatického RCC (mRCC) je proteinová kináza mTOR (mammalian target of rapamycin), důležitá součást mnoha metabolických a signálních drah. mTOR hraje také roli v imunitě a inhibitory mTOR byly původně vyvinuty k prevenci odvrhnutí štěpu při orgánových transplantacích. Inhibice signalizace mTOR zvyšuje aktivitu protinádorových paměťových lymfocytů, ale zároveň i aktivitu regulačních T lymfocytů [5]. Zatím není známo, nakolik se imunologické procesy podílejí na protinádorovém efektu inhibitorů mTOR.
Metody
Vyhledávání v PubMed bylo provedeno pomocí klíčových slov immunotherapy AND (renal cell carcinoma). Další odkazy na zdrojové publikace byly získány prohlédnutím referencí relevantních původních a přehledových článků. Odkazy na práce prezentované na odborných sympoziích ASCO (American Society of Medical Oncology) a ESMO (European Society for Medical Oncology) byly získány z databází Google Scholar a ASCO Abstracts.
Výsledky a diskuze
Nespecifické imunoterapeutické postupy
Spontánní regrese renálního karcinomu
Spontánní regrese metastáz RCC je raritní jev, který je nicméně dobře zdokumentovaný v řadě publikovaných kazuistik. Spontánní regrese mohou být následkem protinádorových imunitních procesů, i když přímé důkazy chybí. Předpokládá se, že ke spontánní regresi může dojít u 1 % případů mRCC, zejména u nádorů světlobuněčné histologie. Spontánní regrese u mRCC bývají dlouhodobé. Není známo, zda je možné tyto procesy podpořit podáním cílených (nebo jiných) léků [6 – 8].
Léčba cytokiny
Imunoterapie cytokiny interferon α (IFN ‑ α) a interleukin‑2 (IL‑2) se v léčbě mRCC používala od 80. let 20. století. Zatímco nízké dávky cytokinů prodlužovaly přežití pacientů s příznivými prognostickými faktory, neměly kurativní potenciál. Terapie vysokodávkovaným IL‑2 však u malé části nemocných s mRCC navodila dlouhodobé kompletní remise („vyléčení“). Širší využití těchto léčebných postupů v praxi narazilo na absenci prediktivních faktorů pro úspěšnou léčbu a vysokou morbiditu a mortalitu spojenou s léčbou.
V době nástupu cílené léčby proti VEGFR a mTOR byla léčba cytokiny v podstatě opuštěna, kromě jejich indikace v kombinaci s monoklonální protilátkou proti VEGF bevacizumabem.
Nedostatečný účinek nespecifické imunoterapie se nyní přikládá příliš široké aktivaci imunitního systému, u něhož se projeví, a mohou dokonce dominovat i pronádorové imunologické mechanizmy jako zvýšení frekvence regulačních T lymfocytů a snížení frekvence cirkulujících myeloidních a plazmocytoidních dendritických buněk [9,10].
Transplantace alogenních hematopoietických buněk
Pro léčbu metastatických solidních nádorů lze využít reakci štěpu proti nádoru (graft vs. tumor effect) po alogenní transplantaci krvetvorných buněk. Klinické studie byly prováděny zejména u nemocných s melanomem a karcinomem ledviny. Ve studii publikované Carvallem et al z 19 pacientů s mRCC po selhání cytokinové léčby dosáhli čtyři nemocní kompletní remise [11]. Všechny odpovědi nastaly u pacientů se světlobuněčným mRCC. Střední doba do nástupu nádorové regrese byla pět měsíců od nemyeloablativní transplantace. Pravděpodobnost regrese nádoru bylo vyšší u nemocných, u nichž bylo možné vysadit imunosupresivní medikaci (cyklosporin A), a těch, kteří dosáhli kompletního dárcovského chimerizmu.
Imunoterapie expandovanými lymfocyty infiltrujícími nádor
Lymfocyty infiltrující nádor (tumor ‑ infiltrating lymphocytes – TIL) jsou heterogenní populací. Jejich část reaguje s nádorovými antigeny. U RCC proběhla dokonce randomizovaná studie, v níž se TIL získané z resekátu neselektivně expandovaly ex vivo pomocí IL‑2 s následnou reinfuzí pacientům. Do této studie bylo zařazeno 178 pacientů. Nemocní v kontrolní skupině dostali placebovou infuzi, v obou ranenech byl kromě toho aplikován IL‑2 ve středních dávkách. Podání TIL ovšem nezlepšilo přežívání, ani nepřineslo zmenšení nádoru oproti kontrolní léčbě IL‑2 samotným [12]. Tato imunoterapeutická strategie byla tudíž opuštěna. Dnes jsme schopni populaci TIL přesně analyzovat a víme, že podíl pronádorově působících typů lymfocytů může být i vyšší než podíl lymfocytů protinádorových, a může se dokonce zvýšit expanzí ex vivo.
Nové imunoterapeutické postupy
Terapie zaměřená na receptor PD‑ 1
Programmed death ‑ 1 (PD ‑ 1) je receptor nacházející se na cytotoxických T lymfocytech. Jeho vazba s ligandem PD ‑ L1 exprimovaným (kromě jiného) nádorovými buňkami RCC inhibuje protinádorovou celulární imunitní odpověď. Inhibice T lymfocytů zprostředkovaná receptorem PD ‑ 1 je jedním z hlavních mechanizmů imunologického úniku nádorových buněk.
U RCC byla prokázána spojitost mezi vysokou expresí PD ‑ L1 nádorovými buňkami, přítomností cirkulujících PD ‑ 1(+) lymfocytů a pokročilým stadiem nádoru. Přerušení interakce PD ‑ 1 a PD ‑ L1 je možné pomocí monoklonálních protilátek proti jedné nebo druhé uvedené molekule a jeho následkem je u části pacientů obnovení protinádorové imunity [13].
Dosud největší studie u RCC byla publikována v roce 2014. pacienti s mRCC a progresí po cílené léčbě zaměřené proti VEGF (34 % z těchto pacientů bylo předléčeno i inhibitory mTOR) dostali v této studii fáze II nivolumab, plně humanizovanou monoklonální protilátku proti PD ‑ 1, ve třech různých dávkových schématech (0,3, 2 nebo 10 mg/ kg intravenózně à 3 týdny). Přežití bez progrese (progression-free survival – PFS) dosáhlo v těchto skupinách 2,7, 4,0 a 4,2 měsíce; celkové přežití (overall survival – OS: 18,2, 25,5 a 24,7 měsíce). OS dosahující až dva roky v této skupině pacientů svědčí pro účinnost této léčby. Terapie fungovala o něco lépe v podskupině nemocných s expresí PD ‑ L1 nad 5 %, kteří tvořili asi čtvrtinu souboru [14].
Další zajímavou molekulou je MPDL-3280A, modifikovaná humánní monoklonální protilátka typu IgG1 proti PD ‑ L1 s odstraněnou funkcí Fc domény. Tato molekula zabraňuje vazbě PD ‑ L1 na inhibiční receptory PD ‑ 1 a CD80 (B7.1) na aktivovaných T lymfocytech. MPDL3280A se zkouší i v kombinaci s bevacizumabem. Přehled těchto a dalších publikovaných nebo prezentovaných výsledků studií fáze I a II je uveden v tab. 2.
Tab. 2. Výsledky studií s protilátkami proti PD-1, PD-L1 a CTLA-4 u mRCC – uvedené jsou jen studie s vyšším počtem zařazených pacientů umožňující získat představu o klinické účinnosti terapie. 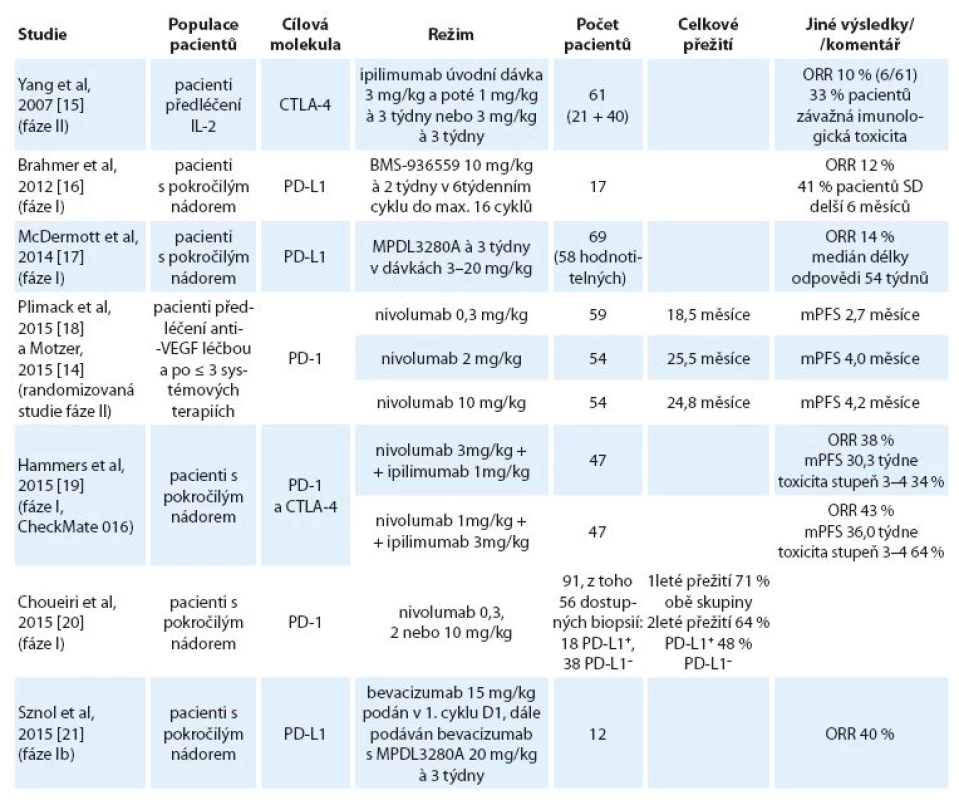
mRCC – metastatický renální karcinom, CTLA-4 – cytotoxic T-lymphocyte-associated protein 4, IL-2 – interleukin-2, PD-1 – program med death-1, PD-L1 – programmed death-1 ligand, ORR – celkové procento odpovědí, tj. součet celkových a částečných odpovědí, mPFS – medián přežití bez progrese Zcela novou informací z července 2015 je skutečnost, že studie fáze III CheckMate 025 srovnávající nivolumab s everolimem u nemocných s progresí na léčbě anti‑VEGF preparáty byla předčasně zastavena, protože pacienti léčení nivolumabem (3 mg/ kg) měli lepší OS než pacienti léčení everolimem v kontrolním rameni. Do této randomizované studie bylo zařazeno 821 pacientů. Definitivní výsledky ještě nebyly publikovány ani prezentovány na konferencích, lze však předpokládat, že povedou ke změně standardu léčby mRCC.
Zda bude exprese PD ‑ L1 prediktivním markerem u mRCC, je zatím otázkou. Zatímco výsledky anti‑PD ‑ 1 léčby jsou o něco lepší u pacientů s PD ‑ L1 pozitivními nádory, prospěch z léčby zřejmě mají i ostatní nemocní. Navíc stanovování exprese PD ‑ L1 je metodologicky nedostatečně zvládnuto – např. u standardních fixovaných preparátů v parafínu dochází k postupné degradaci tohoto markeru.
Protilátky proti CTLA-4
Inhibiční receptor CTLA-4 (cytotoxic T‑lymphocyte‑associated protein 4) má klíčovou úlohu v periferní toleranci T buněk pro antigeny asociované s nádorem. Blokáda CTLA-4 vede k obnovení protinádorové reaktivity imunitního systému a regresi nádorů u některých pacientů.
Protilátka proti CTLA-4 ipilimumab je zaměřená zejména proti regulačním T lymfocytům a již dnes je standardem v terapii melanomu. U mRCC výsledky zatím nelze hodnotit jako slibné – ve studii fáze II dosáhlo parciální regrese jen 10 % pacientů (6 ze 61), ale až u 33 % nemocných se vyskytla imunitní toxicita stupňů 2 – 4 a dva pacienti zemřeli na střevní perforaci [15].
Vysoká toxicita byla zaznamenána i ve studii kombinující anti‑PD ‑ 1 protilátku nivolumab s ipilimumabem (tab. 2) [17].
Protinádorové vakcíny
Ve studii fáze II byla prováděna aktivní imunizace pomocí dendritických buněk naložených mRNA amplifikovanou z nádoru pacienta (preparát nazvaný AGS ‑ 003). Vakcína byla podávána souběžně s TKI sunitinibem. U 21 pacientů bylo dosaženo mediánu PFS 11,2 měsíce a mediánu OS 30,2 měsíce, což převyšuje výsledky obvykle dosahované se samotným sunitinibem. Aktivita AGS ‑ 003 - specifických cytotoxických T lymfocytů korelovala s lepším OS. Toxicita vakcíny byla mírná – kožní reakce v místě podání, dočasná bolestivost lokálních lymfatických uzlin a chřipkovité potíže [22].
Monoklonální protilátky proti antigenům asociovaných s nádorem
Girentuximab je chimérická monoklonální protilátka typu IgG1 proti CA IX, molekule spojené s hypoxií nebo také s dysregulací hypoxických drah, k níž dochází u RCC. Ve studii fáze III nazvané ARISER zkoumali Belldegrun et al adjuvantní léčbu girentuximabem u pacientů s vysoce rizikovým, kompletně resekovaným RCC. Efekt léčby girentuximabem nebyl prokázán u všech pacientů, ale zjistilo se, že se stoupající antigenovou denzitou CA IX se účinnost adjuvantní terapie touto molekulou zvyšuje. U nemocných s vysokou expresí CA IX (asi 17 – 33 % pacientů s RCC podle různých kritérií a věku) měla léčba klinicky i statisticky významný účinek s prodloužením doby do relapsu z 51 měsíců v ramenu s placebem na 74 měsíců v ramenu s aktivní léčbou. Pokud se výsledky potvrdí, půjde o první úspěšnou systémovou léčbu snižující riziko rekurence RCC alespoň u části pacientů [23].
Závěr
RCC je považovaný za nádor dobře ovlivnitelný imunoterapií. Podílejí se na tom zejména změny imunofenotypu nádorových buněk následkem charakteristických mutací v drahách souvisejících s buněčnou reakcí na hypoxii. Nespecifická imunoterapie cytokiny vede u RCC jen k mírnému prodloužení doby přežití nemocných. Hlavní naděje se nyní upírají k novým typům imunoterapeutické léčby, zejména protilátkám proti PD ‑ 1 a PD ‑ L1. Podle předběžných výsledků klinické studie by se v blízké budoucnosti mohla stát jedna z těchto molekul, nivolumab, novým standardem terapie 2. linie. Probíhají další studie srovnávající imunoterapie se standardní cílenou léčbou u mRCC.
Práce byla podpořena grantem VES 2015 15-34678A Agentury pro zdravotnický výzkum České republiky.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Tomáš Büchler, Ph.D.
Onkologická klinika
1. LF UK a Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Obdrženo: 20. 7. 2015
Přijato: 17. 8. 2015
Zdroje
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [monograph on the Internet]. Masarykova univerzita, Česká republika; 2005 [citováno 2015 June 29]. Dostupný z: http:/ / www.svod.cz.
2. Dušek L, Mužík J, Malúšková D et al. Incidence a mortalita nádorových onemocnění v České republice. Klin Onkol 2014; 27(6): 406 – 423. doi: 10.14735/ amko2014406.
3. Terme M, Colussi O, Marcheteau E et al. Modulation of immunity by antiangiogenic molecules in cancer. Clin Dev Immunol 2012; 2012 : 492920. doi: 10.1155/ 2012/ 492920.
4. Shrimali RK, Yu Z, Theoret MR et al. Antiangiogenic agents can increase lymphocyte infiltration into tumor and enhance the effectiveness of adoptive immunotherapy of cancer. Cancer Res 2010; 70(15): 6171 – 6180. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 10 ‑ 0153.
5. Wang Y, Sparwasser T, Figlin R et al. Foxp3+ T cells inhibit antitumor immune memory modulated by mTOR inhibition. Cancer Res 2014; 74(8): 2217 – 2228. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 13 ‑ 2928.
6. Bumpus HC. The apparent disappearance of pulmonary metastasis in a case of hypernephroma following nephrectomy. J Urol 1928; 20 : 185 – 191.
7. Melichar B, Vanecková J, Morávek P et al. Spontaneous regression of renal cell carcinoma lung metastases in a patient with psoriasis. Acta Oncol 2009; 48(6): 925 – 927. doi: 10.1080/ 02841860902882451.
8. Rothermundt CA, Omlin A, Gillessen S. Sunitinib with-drawal phenomenon or spontaneous regression in renal cell cancer. Ann Oncol 2009; 20(6): 1144 – 1146. doi: 10.1093/ annonc/ mdp239.
9. van der Vliet HJ, Koon HB, Yue SC et al. Effects of the administration of high‑dose interleukin‑2 on immunoregulatory cell subsets in patients with advanced melanoma and renal cell cancer. Clin Cancer Res 2007; 13(7): 2100 – 2108.
10. Ahmadzadeh M, Rosenberg SA. IL‑2 administration increases CD4+ CD25(hi) Foxp3+ regulatory T cells in cancer patients. Blood 2006; 107(6): 2409 – 2414.
11. Carvallo C, Childs R. Nonmyeloablative stem cell transplantation as immunotherapy for kidney cancer and other metastatic solid tumors. Cytotechnology 2003; 41(2 – 3): 197 – 206. doi: 10.1023/ A:1024839225920.
12. Figlin RA, Thompson JA, Bukowski RM et al. Multicenter, randomized, phase III trial of CD8(+) tumor ‑ infiltrating lymphocytes in combination with recombinant interleukin‑2 in metastatic renal cell carcinoma. J Clin Oncol 1999; 17(8): 2521 – 2529.
13. Bedke J, Kruck S, Gakis G et al. Checkpoint modulation – a new way to direct the immune system against renal cell carcinoma. Hum Vaccin Immunother 2015; 11(5): 1201 – 1208. doi: 10.1080/ 21645515.2015.1016657.
14. Motzer RJ, Rini BI, McDermott DF et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J Clin Oncol 2015; 33(13): 1430 – 1437. doi: 10.1200/ JCO.2014.59.0703.
15. Yang JC, Hughes M, Kammula U et al. Ipilimumab (anti‑CTLA4 antibody) causes regression of metastatic renal cell cancer associated with enteritis and hypophysitis. J Immunother 2007; 30(8): 825 – 830.
16. Brahmer JR, Tykodi SS, Chow LQ et al. Safety and activity of anti‑PD ‑ L1 antibody in patients with advanced cancer. N Engl J Med 2012; 366(26): 2455 – 2465. doi: 10.1056/ NEJMoa1200694.
17. McDermott DF, Sznol M, Sosman JA et al. Immune correlates and long term follow up of a phase Ia study of MPDL3280A, an engineered PD ‑ L1 antibody, in patients with metastatic renal cell carcinoma (mRCC). Ann Oncol 2014; 25 (Suppl 4): iv280.
18. Plimack ER, Hammers HJ, Rini BI. Updated survival results from a randomized, dose‑ranging phase II study of nivolumab (NIVO) in metastatic renal cell carcinoma (mRCC). J Clin Oncol 2015; 33 (Suppl): abstr. 4553.
19. Hammers HJ, Plimack ER, Infante JR et al. Expanded cohort results from CheckMate 016: A phase I study of nivolumab in combination with ipilimumab in metastatic renal cell carcinoma (mRCC). J Clin Oncol 2015; 33 (Suppl): abstr. 4516.
20. Choueiri TK, Fishman NM, Escudier B. Immunomodulatory activity of nivolumab in metastatic renal cell carcinoma (mRCC): association of biomarkers with clinical outcomes. J Clin Oncol 2015; 33 (Suppl): abstr. 4500.
21. Sznol M, McDermott DF, Fields Jones S. Phase Ib evaluation of in combination with bevacizumab (bev) in patients (pts) with metastatic renal cell carcinoma (mRCC). J Clin Oncol 2015; 33 (Suppl 7): abstr. 410.
22. Amin A, Dudek AZ, Logan TF et al. Survival with AGS ‑ 003, an autologous dendritic cell‑based immunotherapy, in combination with sunitinib in unfavorable risk patients with advanced renal cell carcinoma (RCC): phase 2study results. J Immunother Cancer 2015; 3 : 14. doi: 10.1186/ s40425 ‑ 015 ‑ 0055 ‑ 3.
23. Belldegrun AS, Chamie K, Kloepfer P et al. ARISER: a randomized double blind phase III study to evaluate adjuvant cG250 treatment versus placebo in patients with high‑risk ccRCC – results and implications for adjuvant clinical trials. J Clin Oncol 2013; 31 (Suppl): abstr. 4507.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



