-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
Significance of Minimal Residual Disease in Chronic Lymphocytic Leukemia
Newly introduced highly effective treatment options increase the importance of minimal residual disease measurement in chronic lymphocytic leukemia. Minimal residual disease is gaining interest mainly as a predictive marker; however, clinical significance of minimal residual disease in chronic lymphocytic leukemia in many different situations remains unresolved. Factors with a possible impact on the clinical significance of minimal residual disease are as follows: technique for minimal residual disease quantification, treatment regimen, peripheral blood vs. bone marrow analysis or time ‑ point for sampling. Highly sensitive methods now available to evaluate minimal residual disease can detect a single chronic lymphocytic leukemia cell in 10–4 – 10–5 leukocytes using either allele ‑ specific oligonucleotide polymerase chain reaction or multicolor flow cytometry. Minimal residual disease quantification as a surrogate marker to assess treatment efficacy in routine hematological practice has to be further evaluated.
Key words:
chronic lymphocytic leukemia – minimal residual disease – prognostic factors – flow cytometry – progression‑free survival
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
29. 7. 2015Accepted:
4. 8. 2015
Autoři: M. Doubek
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN BrnoCEITEC – Středoevropský technologický institut, MU, Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 3): 16-21
doi: https://doi.org/10.14735/amko20153S16S příchodem nových a vysoce účinných léčebných postupů do terapie chronické lymfocytární leukemie nabývá na významu analýza minimální reziduální nemoci. Minimální reziduální nemoc získává u chronické lymfocytární leukemie význam jako prediktivní faktor, nicméně její důležitost je v mnoha klinických situacích stále nejasná. Roli minimální reziduální nemoci ovlivňují především tyto faktory: metoda použitá k detekci minimální reziduální nemoci, léčebný režim, vyšetření z periferní krve vs. kostní dřeně nebo časový bod, kdy byl proveden odběr vzorku na analýzu minimální reziduální nemoci.
Souhrn
S příchodem nových a vysoce účinných léčebných postupů do terapie chronické lymfocytární leukemie nabývá na významu analýza minimální reziduální nemoci. Minimální reziduální nemoc získává u chronické lymfocytární leukemie význam jako prediktivní faktor, nicméně její důležitost je v mnoha klinických situacích stále nejasná. Roli minimální reziduální nemoci ovlivňují především tyto faktory: metoda použitá k detekci minimální reziduální nemoci, léčebný režim, vyšetření z periferní krve vs. kostní dřeně nebo časový bod, kdy byl proveden odběr vzorku na analýzu minimální reziduální nemoci. Vysoce senzitivní metody, které dnes ke kvantifikaci minimální reziduální nemoci používáme, dosahují citlivosti 10– 4 – 10– 5. Jde o metody ASO‑PCR (allele ‑ specific oligonucleotide polymerase chain reaction) a vícebarevnou průtokovou cytometrii. Postavení minimální reziduální nemoci v běžné hematologické praxi není bohužel stále ještě jasně definováno.
Klíčová slova:
chronická lymfocytární leukemie – minimální reziduální nemoc – prognostické faktory – průtoková cytometrie – přežití bez progreseÚvod
Chronická lymfocytární leukemie (CLL) je stále i přes značné pokroky v určení prognózy nemoci a pokroky v její terapii v posledních 15 letech považována za nevyléčitelné onemocnění, tedy s výjimkou alogenní transplantace krvetvorných buněk [1]. Ale i přesto se ukazuje, že nové možnosti léčby, především nové typy kombinované chemoimunoterapie, dokáží u nemocných s CLL navodit hlubokou léčebnou odpověď. Čím větší masu maligních buněk se podaří odstranit, tím větší je pravděpodobnost prodloužené doby do progrese nemoci (progression‑free survival – PFS) a celkového přežití (overall survival – OS).
K detekci reziduálních leukemických buněk (minimální reziduální nemoc – MRN) u nemocných s výbornou léčebnou odpovědí je zapotřebí použít citlivé metody. Zatím ale není zcela jasné, zda i u CLL bude detekce MRN tak významná, jako je tomu v případě akutní promyelocytární leukemie [2,3], akutní lymfoblastické leukemie [4,5], akutní myeloidní leukemie [6] a samozřejmě chronické myeloidní leukemie [7]. Jisté je, že eradikace MRN je nezbytnou podmínkou pro vyléčení hematologické malignity, nicméně každá negativita MRN se automaticky nerovná vyléčení, což je u CLL zřejmější snad ještě více než u ostatních leukemií (graf 1) [8 – 11].
Podrobně se sledování MRN u CLL věnuje řada prací, včetně českých [12]. V roce 2010 byl k tomuto tématu publikován zevrubný přehled pražských autorů [13]. Tato práce si klade za cíl na přehled pražských autorů navázat předložením nových poznatků o postavení detekce MRN u CLL. Stále totiž v této oblasti není jasno. Základní otázka, která se týká MRN u CLL, zní i v dnešní době značných pokroků v oblasti biologie a léčby CLL takto: Má léčba CLL směřovat k eradikaci MRN? A pokud ano, v jakých případech?
Metody detekce MRN u CLL
Ke zjištění MRN u CLL je zapotřebí metod, které jsou citlivější než konvenční cytologie, histologie či základní analýza průtokovou cytometrií.
V současné době jsou ke sledování MRN u CLL využívány tyto metody: ASO‑PCR (allele ‑ specific oligonucleotide polymerase chain reaction) s primery individuálně navrženými pro každého pacienta a průtoková cytometrie [14 – 18]. Dříve používané polymerázové řetězové reakce (PCR) s využitím konsenzuálních (consenzus, univerzálních) primerů k určení klonality IgH řetězců se pro nízkou senzitivitu již nepoužívá [13]. Vzhledem k absenci specifického molekulárně genetického markeru (jaké představují např. fúzní geny či mutace genů akutní myeloidní leukemie, chronické myeloidní leukemie nebo akutní promyelocytární leukemie) nemohou být tyto aberace ke sledování MRN u CLL využity. Metody sledování MRN u CLL jsou v podstatě shodné s metodami používanými pro detekci MRN u akutní lymfoblastické leukemie [5].
Graf 1. Schéma chování MRN po léčbě CLL. 
MRN – minimální reziduální nemoc, CLL – chronická lymfocytární leukemie Průtoková cytometrie
Průtokovou cytometrií (FCM) byly původně CLL buňky identifikovány jen na základě koexprese znaků CD5 a CD19 [19]. Toto vyšetření je ale značně nepřesné [14]. Velmi citlivou detekci MRN může poskytnout analýza čtyřbarevnou FCM, která umožní detekovat jednu nádorovou buňku až z 10– 4 – 10– 5 leukocytů [16,17]. Pracovní skupina ERIC (Evropská výzkumná iniciativa pro CLL) navrhla čtyřbarevné kombinace monoklonálních protilátek umožňující identifikaci CLL buněk s limitem detekce 0,01 % z leukocytů pro CLL s typickým imunofenotypem (přesnost 96,7 %, senzitivita 91,1 % a specificita 98,8 %). Předpokladem k dosažení uvedených parametrů je ale naměření dostatečného počtu událostí (500 000 leukocytů na zkumavku) a důkladná znalost charakteristiky „gatovaných“ populací CLL buněk umožňující správné vyhodnocení [16]. Srovnatelných výsledků lze dosáhnout při užití doporučených klonů jednotlivých monoklonálních protilátek. Antigeny, proti kterým jsou monoklonální protilátky při testování MRN pomocí čtyřbarevné FCM namířeny, ukazuje tab. 1. Ve snaze snížit pracnost a časovou náročnost prováděného vyšetření byl opět z popudu ERIC zveřejněn standardizovaný přístup ke sledování MRN pomocí šestibarevné FCM [17] a v současné době se pracuje na přípravě publikace o sledování MRN pomocí osmibarevné FCM (odesláno k publikování, osobní komunikace).
Tab. 1. Antigeny, proti kterým jsou namířeny monoklonální protilátky při testování MRN pomocí čtyřbarevné průtokové cytometrie [16]. ![Antigeny, proti kterým jsou namířeny monoklonální protilátky při testování MRN pomocí čtyřbarevné průtokové cytometrie [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b475fa8ad42d814f304a7b79b331f413.jpg)
Osmibarevnou FCM detekci MRN u CLL navrhlo rovněž brněnské pracoviště [18]. Osmibarevná FCM měla 100% shodu se čtyřbarevnou FCM a silně korelovala rovněž s výsledky ASO‑PCR v reálném čase (r = 0,94).
Výsledkem FCM analýzy je stanovení procenta CLL buněk z leukocytů s uvedením limitu detekce pro dané měření (podstatné zejména u MRN negativních výsledků).
Největšími výhodami sledování MRN pomocí FCM jsou rychlost vyšetření, fakt, že pro vyšetření není nutné mít vstupní vzorek pacienta (znalost vstupního imunofenotypu je ale vhodná především u pacientů s atypickým imunofenotypem), a to, že metodiku lze s minimálními úpravami aplikovat na jakýkoliv průtokový cytometr s možností vícebarevné analýzy.
Polymerázová řetězová reakce
Technika detekce MRN pomocí konsenzuálních primerů pro jednotlivé IgVH rodiny má relativně nízkou senzitivitu (10– 3) a je považována za překonanou [13]. Díky sekvenačnímu vyšetření přestavby IgVH (gen pro těžký řetězec imunoglobulinů) identifikované při diagnóze však máme možnost sledovat reziduální maligní populaci s vysokou senzitivitou a specifitou pomocí individuálních, pacient ‑ specifických primerů (ASO‑PCR). Příprava eseje je založena na navržení klon ‑ specifických primerů a vyklonování standardu, který je v průběhu času používán k přesné kalibraci eseje. Každou esej je nutné před použitím otestovat pro detekční limit senzitivity [12,13,20]. Použije‑li se jako templát DNA, dosahuje senzitivita analýzy MRN hodnoty 10– 4, což odpovídá senzitivitě detekce MRN pomocí FCM. Při použití RNA (cDNA) jako templátu lze senzitivitu detekce MRN zvýšit až o 3 – 4 řády. Nevýhodou práce s RNA je ale fragilita této molekuly s nutností rychlejšího transportu do laboratoře. Detaily molekulárně genetické analýzy byly popsány v řadě publikací [20,21].
Samozřejmou součástí analýzy MRN pomocí FCM či PCR je kontrola kvality (vzájemné korelace, mezilaboratorní kontroly s výměnou vzorků, optimalizace vyhodnocování již naměřených dat v případě FCM).
Klinický význam sledování MRN u CLL
Výsledky klinických studií
O významu dosažení MRN negativity u CLL pro prodloužení PFS nás informuje už práce z roku 2003, v níž bylo dokumentováno, že konsolidace alemtuzumabem vede k navození negativity MRN u 38 % pacientů a PFS nemoci u těchto nemocným je významně delší než PFS u pacientů s přetrvávající MRN pozitivitou [22]. Ke stejným výsledkům dospěly i další studie používající alemtuzumab v konsolidační léčbě CLL [23,24]. Studie Montilla et al prokázala navíc význam negativity MRN pro prodloužení OS [24]. Rovněž rituximab přidaný k léčbě CLL jako maintenance vedl k navýšení počtů negativit MRN [25,26]. Přidání rituximabu do udržovací terapie CLL vedlo k dosažení 70 % MRN negativních remisí. U MRN negativních pacientů pak bylo zjištěno delší PFS (77 vs. 36 % ve 2,5 letech) a dokonce i OS (89 vs. 72 % ve 3 letech) [25].
V rámci klinických studií s novými kombinacemi chemoimunoterapie, novými monoklonálními protilátkami či novými léky jako jsou inhibitory signálních drah B buněčného receptoru (BCR signalizace) je analýza MRN prováděna v současné době téměř rutinně. Seznam vybraných studií [27 – 33], u nichž bylo prováděno měření MRN, podává tab. 2.
Tab. 2. Vybrané klinické studie, u nichž bylo prováděno měření MRN. 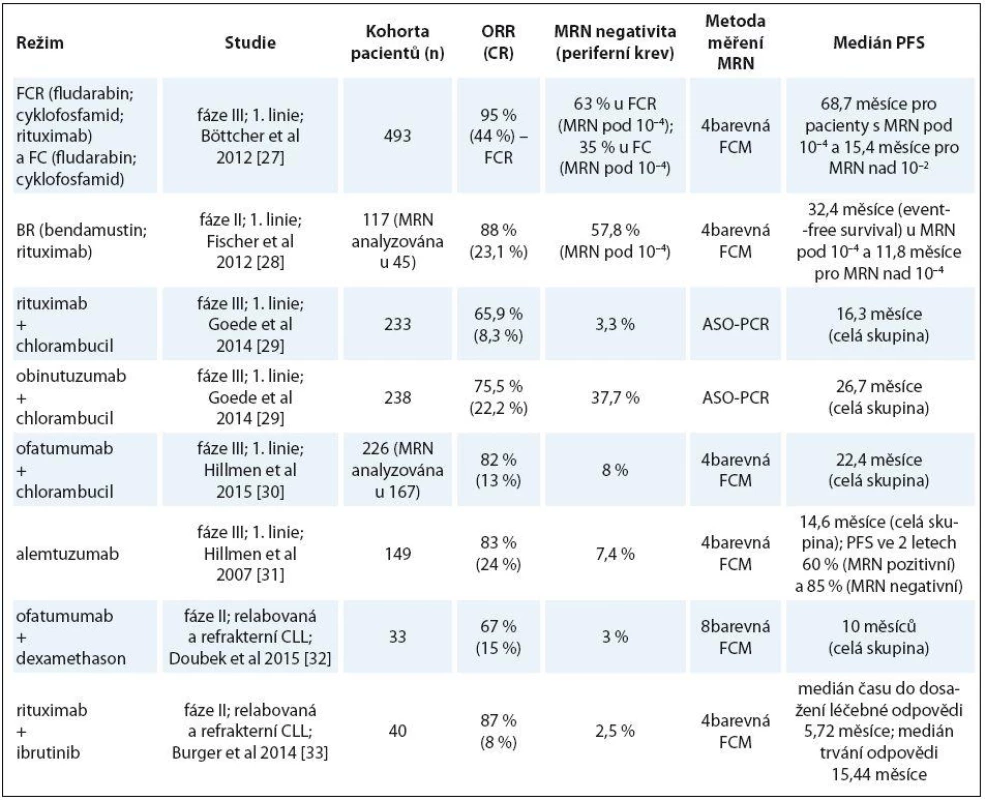
MRN – minimální reziduální nemoc, ASO-PCR – allele-specifi c oligonucleotide-PCR, CR – kompletní remise, FCM – průtoková cytometrie, ORR – celková léčebná odpověď, PFS – přežití bez progrese, CLL – chronická lymfocytární leukemie Uvedené klinické studie [27 – 33] ukazují, že MRN negativity bývá daleko častěji dosahováno u nemocných léčených chemoimunoterapií než u nemocných léčených novými inhibitory BCR signalizace, ať již v monoterapii nebo v kombinaci s rituximabem. Nemocní léčení inhibitory BCR signalizace v monoterapii dosahují především parciálních remisí. V případě použití ibrutinibu, jednoho z inhibitorů BCR signalizace, v monoterapii dochází navíc u pacientů s CLL k lymfocytóze, která hodnocení MRN může komplikovat [34]. Je ale pravda, že výsledky těchto studií nelze dobře srovnávat (soubory pacientů jsou odlišné, dávkování a terapeutická schémata jsou naprosto rozdílná, hodnocení léčebné odpovědi je prováděno v jiných časových intervalech a měření MRN využívá různých metod).
Senzitivita MRN je vyšší při vyšetření kostní dřeně ve srovnání s periferní krví [27], většina hodnocení MRN v běžné praxi ale probíhá z periferní krve.
Allogenní transplantace
I přes povzbuzující data uvedená výše má i v současné běžné hematologické praxi analýza MRN u CLL nezpochybnitelné místo jen u pacientů po alogenní transplantaci krvetvorných buněk [1,35 – 37]. Alogenní transplantace představuje v současné době jediný potenciálně kurativní přístup k léčbě CLL a jejím prostřednictvím lze dosáhnout dlouhodobého vymizení MRN dokonce u pacientů s nežádoucími prognostickými znaky [1,35 – 37]. Na základě nové pozitivity MRN po alogenní transplantaci krvetvorných buněk lze indikovat léčbu již v případě tohoto počínajícího relapsu, což je rozdíl oproti konvenčně léčeným pacientům, u nichž se relapsy detekované na základě MRN neléčí (neléčí se ani hematologické relapsy, nesplňují‑li standardní kritéria zahájení terapie) [38,39].
Význam měření MRN u CLL pro běžnou praxi
Doporučený postup pro diagnostiku a terapii CLL Mezinárodní pracovní skupiny pro CLL (International Workshop on CLL) zatím neuvádí měření MRN jako nutnou podmínku hodnocení léčebné odpovědi, avšak doporučují zařadit sledování MRN do klinických studií, jejichž cílem je dosáhnout co nejhlubší a nejdéle trvající léčebné odpovědi, a samozřejmě použít ke sledování MRN po alogenní transplantaci [40].
V současné době je ale již nezpochybnitelné, že dosažení negativity MRN je příznivý nezávislý prediktivní faktor CLL (alespoň co se týká PFS). Aktuálně je ve schvalovacím procesu doporučení Evropské lékové agentury (EMA), který umožní v rámci klinických studií využití měření MRN jako náhradní cíl místo sledování PFS, což může významně zrychlit proces klinického hodnocení. Není však dořešena otázka, zda velký selekční tlak, který vyvíjíme s cílem dosáhnout MRN negativity u většiny nemocných, nevede rovněž k selekci malignějších klonů nemoci, a tedy i k daleko agresivnějšímu a obtížněji léčitelnému průběhu následného relapsu onemocnění [41]. Navíc toxicita intenzivnější terapie může být rovněž nezanedbatelná [23,24].
Česká skupina pro chronickou lymfocytární leukemii i Česká leukemická skupina pro život proto v současnosti vydávají následující doporučení, které se týká MRN u CLL: Sledování MRN v periferní krvi či kostní dřeni metodami s citlivostí minimálně 10– 4 (pomocí FCM nebo ASO‑PCR) je vhodné zvážit u nemocných léčených intenzivní léčbou (např. kombinované fludarabinové režimy, alemtuzumab, režimy s novými monoklonálními protilátkami a alogenní transplantace). Dosud se nejedná o vyšetření povinné, ale význam MRN v budoucnu pravděpodobně významně vzroste. Vhodné je především u pacientů po alogenní transplantaci krvetvorných buněk [38,39].
Závěr
Na základě výše uvedených informací je možné otázku analýzy MRN u CLL shrnout následovně:
- Dosažení MRN negativity u CLL je možné, a to nejen po alogenní transplantaci krvetvorných buněk.
- Vyšetření MRN z kostní dřeně má větší senzitivitu než z periferní krve.
- MRN negativity je častěji dosahováno pomocí chemoimunoterapie než s využitím nových molekul, jako jsou inhibitory BCR signalizace [33,42], zatím ale není jasné, bude‑li mít tento fakt nějaký význam pro osud nemocných a běžnou klinickou praxi.
- Řada prací ukazuje, že dosažení MRN negativity prodlužuje nemocným PFS (dle některých menších prací i OS). MRN tak může být použito jako další prediktivní marker u CLL.
- Na druhou stranu nová MRN pozitivita po předešlé negativitě se u pacientů s CLL neléčí (s výjimkou pacientů po alogenní transplantaci krvetvorných buněk), a tak pravidelné měření MRN po terapii nepřináší nemocným v běžné hematologické praxi zatím žádnou výhodu.
- Dosud není dořešena otázka, zda snaha po co nejvyšším procentu dosažených MRN negativit pomocí intenzivní terapie nepovede také ke zvýšení tlaku, jenž bude mít za následek daleko větší selekci malignější klonů CLL, a tedy daleko agresivnější průběh relapsu nemoci po takovéto léčbě.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Michael Doubek, Ph.D.
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20625 00 Brno
e-mail: mdoubek@fnbrno.cz
Obdrženo: 29. 7. 2015
Přijato: 4. 8. 2015
Zdroje
1. Krejčí M, Doubek M, Brychtová Y et al. Fludarabine with cytarabine followed by reduced ‑ intensity conditioning and allogeneic hematopoietic stem cell transplantation in patients with poor ‑ risk chronic lymphocytic leukemia. Ann Hematol 2013; 92(2): 249 – 254. doi: 10.1007/ s00277 ‑ 012 ‑ 1579 ‑ y.
2. Gallagher RE, Yeap BY, Bi W et al. Quantitative real ‑ time RT‑PCR analysis of PML‑RAR alpha mRNA in acute promyelocytic leukemia: assessment of prognostic significance in adult patients from intergroup protocol 0129. Blood 2003; 101(7): 2521 – 2528.
3. Diverio D, Rossi V, Avvisati G et al. Early detection of relapse by prospective reverse transcriptase ‑ polymerase chain reaction analysis of the PML/ RARalpha fusion gene in patients with acute promyelocytic leukemia enrolled in the GIMEMA ‑ AIEOP multicenter „AIDA“ trial. GIMEMA ‑ AIEOP Multicenter „AIDA“ Trial. Blood 1998; 92(3): 784 – 789.
4. Zhou J, Goldwasser MA, Li A et al. Quantitative analysis of minimal residual disease predicts relapse in children with B‑lineage acute lymphoblastic leukemia in DFCI ALL Consortium Protocol 95 – 01. Blood 2007; 110(5): 1607 – 1611.
5. Šálek C, Folber F, Froňková E et al. Early MRD response as a prognostic factor in adult patients with acute lymphoblastic leukemia. Eur J Haematol. In press 2015. doi: 10.1111/ ejh.12587.
6. Doubek M, Palasek I, Pospisil Z et al. Detection and treatment of molecular relapse in acute myeloid leukemia with RUNX1 (AML1), CBFB, or MLL gene translocations: frequent quantitative monitoring of molecular markers in different compartments and correlation with WT1 gene expression. Exp Hematol 2009; 37(6): 659 – 672. doi: 10.1016/ j.exphem.2009.03.004.
7. Hochhaus A, Reiter A, Saussele S et al. Molecular heterogeneity in complete cytogenetic responders after interferon‑alpha therapy for chronic myelogenous leukemia: low levels of minimal residual disease are associated with continuing remission. German CML Study Group and the UK MRC CML Study Group. Blood 2000; 95(1): 62 – 66.
8. Bosch F, Ferrer A, López ‑ Guillermo A et al. Fludarabine, cyclophosphamide and mitoxantrone in the treatment of resistant or relapsed chronic lymphocytic leukaemia. Br J Haematol 2002; 119(4): 976 – 984.
9. Rawstron AC, Kennedy B, Evans PA et al. Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy. Blood 2001; 98(1): 29 – 35.
10. Moreton P, Kennedy B, Lucas G et al. Eradication of minimal residual disease in B ‑ cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23(13): 2971 – 2979.
11. Wierda W, O‘Brien S, Wen S et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23(18): 4070 – 4078.
12. Skuhrová Francová H, Tichý B, Malinová K et al. Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR. Transfuze Hematol Dnes 2009; 15 : 197–203.
13. Bezdíčková L, Špaček M, Peková S Kozák T. Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam. Transfuze Hematol dnes 2010; 16 (Suppl 1): 97 – 101.
14. Rawstron AC, Kennedy B, Evans PA et al. Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy. Blood 2001; 98(1): 29 – 35.
15. Böttcher S, Ritgen M, Pott C et al. Comparative analysis of minimal residual disease detection using four ‑ color flow cytometry, consensus IgH‑PCR, and quantitative IgH PCR in CLL after allogeneic and autologous stem cell transplantation. Leukemia 2004; 18(10): 1637 – 1645.
16. Rawstron AC, Villamor N, Ritgen M et al. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukaemia. Leukemia 2007; 21(5): 956 – 964.
17. Rawstron AC, Böttcher S, Letestu R et al. Improving efficiency and sensitivity: European Research Initiative in CLL (ERIC) update on the international harmonised approach for flow cytometric residual disease monitoring in CLL. Leukemia 2013; 27(1): 142 – 149. doi: 10.1038/ leu.2012.216.
18. Stehlíková O, Chovancová J, Tichý B et al. Detecting minimal residual disease in patients with chronic lymphocytic leukemia using 8 - color flow cytometry protocol in routine hematological practice. Int J Lab Hematol 2014; 36(2): 165 – 171. doi: 10.1111/ ijlh.12149.
19. Vuillier F, Claisse JF, Vandenvelde C et al. Evaluation of residual disease in B ‑ cell chronic lymphocytic leukemia patients in clinical and bone ‑ marrow remission using CD5 – CD19 markers and PCR study of gene rearrangements. Leuk Lymphoma 1992; 7(3): 195 – 204.
20. Peková S, Bezdíčková L, Smolej L et al. Quantitation of minimal residual disease in patients with chronic lymphocytic leukemia using locked nucleic acid ‑ modified, fluorescently labeled hybridization probes and real ‑ time PCR technology. Mol Diagn Ther 2007; 11(5): 325 – 335.
21. Karkare S, Bhatnagar D. Promising nucleic acid analogs and mimics: characteristic features and applications of PNA, LNA, and morpholino. Appl Microbiol Biotechnol 2006; 71(5): 575 – 586.
22. O‘Brien SM, Kantarjian HM, Thomas DA et al. Alemtuzumab as treatment for residual disease after chemotherapy in patients with chronic lymphocytic leukemia. Cancer 2003; 98(12): 2657 – 2663.
23. Wendtner CM, Ritgen M, Schweighofer CD et al. German CLL Study Group (GCLLSG). Consolidation with alemtuzumab in patients with chronic lymphocytic leukemia (CLL) in first remission – experience on safety and efficacy within a randomized multicenter phase III trial of the German CLL Study Group (GCLLSG). Leukemia 2004; 18(6): 1093 – 1101.
24. Montillo M, Tedeschi A, Miqueleiz S et al. Alemtuzumab as consolidation after a response to fludarabine is effective in purging residual disease in patients with chronic lymphocytic leukemia. J Clin Oncol 2006; 24(15): 2337 – 2342.
25. Del Poeta G, Del Principe MI, Consalvo MA et al. The addition of rituximab to fludarabine improves clinical outcome in untreated patients with ZAP ‑ 70 - negative chronic lymphocytic leukemia. Cancer 2005; 104(12): 2743 – 2752.
26. Del Poeta G, Del Principe MI, Buccisano F et al. Consolidation and maintenance immunotherapy with rituximab improve clinical outcome in patients with B ‑ cell chronic lymphocytic leukemia. Cancer 2008; 112(1): 119 – 128.
27. Böttcher S, Ritgen M, Fischer K et al. Minimal residual disease quantification is an independent predictor of progression‑free and overall survival in chronic lymphocytic leukemia: a multivariate analysis from the randomized GCLLSG CLL8 trial. J Clin Oncol 2012; 30(9): 980 – 988. doi: 10.1200/ JCO.2011.36.9348.
28. Fischer K, Cramer P, Busch R et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30(26): 3209 – 3216. doi: 10.1200/ JCO.2011.39.2688.
29. Goede V, Fischer K, Busch R et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370(12): 1101 – 1110. doi: 10.1056/ NEJMoa1313984.
30. Hillmen P, Robak T, Janssens A et al. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): a randomised, multicentre, open ‑ label phase 3 trial. Lancet 2015; 385(9980): 1873 – 1883. doi: 10.1016/ S0140 ‑ 6736(15)60027 ‑ 7.
31. Hillmen P, Skotnicki AB, Robak T et al. Alemtuzumab compared with chlorambucil as first‑line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25(35): 5616 – 5623.
32. Doubek M, Brychtova Y, Panovska A et al. Ofatumumab added to dexamethasone in patients with relapsed or refractory chronic lymphocytic leukemia: results from a phase II study. Am J Hematol 2015; 90(5): 417 – 421. doi: 10.1002/ ajh.23964.
33. Burger JA, Keating MJ, Wierda WG et al. Safety and activity of ibrutinib plus rituximab for patients with high‑risk chronic lymphocytic leukaemia: a single‑arm, phase 2 study. Lancet Oncol 2014; 15(10): 1090 – 1099. doi: 10.1016/ S1470 ‑ 2045(14)70335 ‑ 3.
34. Byrd JC, Brown JR, O‘Brien S et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371(3): 213 – 223. doi: 10.1056/ NEJMoa1400376.
35. Esteve J, Villamor N, Colomer D et al. Stem cell transplantation for chronic lymphocytic leukemia: different outcome after autologous and allogeneic transplantation and correlation with minimal residual disease status. Leukemia 2001; 15(3): 445 – 451.
36. Ritgen M, Stilgenbauer S, von Neuhoff N et al. Graft ‑ versus ‑ leukemia activity may overcome therapeutic resistance of chronic lymphocytic leukemia with unmutated immunoglobulin variable heavy‑chain gene status: implications of minimal residual disease measurement with quantitative PCR. Blood 2004; 104(8):2600 – 2602.
37. Moreno C, Villamor N, Colomer D et al. Clinical significance of minimal residual disease, as assessed by different techniques, after stem cell transplantation for chronic lymphocytic leukemia. Blood 2006; 107(11): 4563 – 4569.
38. Smolej L, Doubek M, Špaček M et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukémie (CLL). Transf Hematol dnes 2013; 19 : 61 – 68.
39. Doubek M, Mayer J (eds). Postupy diagnostiky a léčby leukemií a jejich infekčních komplikací u dospělých pacientů. Doporučení České leukemické skupiny – pro život (CELL). 2. vyd. Brno: Česká leukemická skupina – pro život: 162.
40. Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia (IWCLL) updating the National Cancer Institute ‑ Working Group (NCI ‑ WG) 1996 guidelines. Blood 2008; 111(12): 5446 – 5456. doi: 10.1182/ blood ‑ 2007 ‑ 06 ‑ 093906.
41. Panovská A, Smolej L, Lysák D et al. The outcome of chronic lymphocytic leukemia patients who relapsed after fludarabine, cyclophosphamide, and rituximab. Eur J Haematol 2013; 90(6): 479 – 485. doi: 10.1111/ ejh.12106.
42. Furman RR, Sharman JP, Coutre SE et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370(11): 997 – 1007. doi: 10.1056/ NEJMoa1315226.
Štítky
Dětská onkologie Hematologie a transfuzní lékařství Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Současné možnosti imunoterapie nádorových onemocnění
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Editorial
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



