-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Hodgkin´s Lymhoma – the Treatment Aproaches Development and Current Trends
Hodgkin’s lymphoma is a relatively rare malignant disease, mostly affecting younger adults. It represents one of the most curable disease among all lymphomas and other malignant diseases of adult age, with curability more than 80%. The progress of curability and long term survival demonstrates the development of oncologic approach during the last few decades, depicted in this article, particularly by introduction of combined modality treatment (chemotherapy and radiotherapy), progress in radiotherapy technique, implementation of high intensity regimens for advanced stages and use of novel drugs as well. Because of high curability rate and young age of most of the patients, late toxic effects are of significant relevance. The ongoing clinical research is focused on better prognostic stratification offering the patients more individualized treatment by risk and response disease evaluation, aiming to reduce toxicity while maintaining high curability and introduction of novel, less toxic drugs and their use in early phases of treatment.
Key words:
Hodgkin’s lymphoma – induction chemotherapy – salvage therapy – combined modality therapy – hematopoietic stem cell transplantation – positron-emission tomography – brentuximab vedotin – nivolumab
This study was supported by grants of Internal Grant Agency of the Czech Ministry of Health No. NT13072-4/2012 and NT12193-5/2011.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
27. 9. 2015Accepted:
1. 10. 2015
Autoři: J. Kořen; M. Trněný
Působiště autorů: I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 3): 87-94
doi: https://doi.org/10.14735/amko20153S87Souhrn
Hodgkinův lymfom je relativně vzácné zhoubné onemocnění, které postihuje převážně mladší dospělé jedince. Z hlediska prognózy patří v dnešní době mezi jeden z nejlépe léčitelných typů lymfomů, ale i nádorů dospělého věku vůbec, s dosažením vyléčení u více než 80 % všech pacientů. Toto onemocnění dobře demonstruje, jak zlepšení onkologických přístupů v průběhu posledních několika dekád, popsané v tomto článku, vedlo ke zlepšení kurability a celkového dlouhodobého přežívání. V případě této choroby to bylo zejména zavedením kombinace modalit léčby (kombinovaná chemoterapie a radioterapie), pokrokem v technologii radioterapie, zavedením intenzivnější chemoterapie pro pokročilá onemocnění a v poslední době i použitím nových léků. Vzhledem k vysokému procentu vyléčitelnosti a mladému věku většiny pacientů představují pozdní toxické účinky významné téma. Další pokrok, ke kterému směřuje klinický výzkum, je tedy zaměřen na větší prognostickou individualizaci léčby, snahu o další redukci intenzity léčby při zachování její vysoké účinnosti a zavedení nových, méně toxických léků nejen do léčby málo početných relabujících a rezistentních forem, ale i do časnějších fází léčby.
Klíčová slova:
Hodgkinův lymfom – indukční chemoterapie – záchranná léčba – léčba s kombinací modalit – transplantace krvetvorných buněk – pozitronová emisní tomografie – brentuximab vedotin – nivolumabEpidemiologie
Incidence Hodgkinova lymfomu (HL) je 2 – 3 případy na 100 000 obyvatel za rok. O něco častěji jsou postiženi muži než ženy (3 : 2). Typický je hlavní vrchol incidenční křivky z hlediska věku mezi 20 a 35 lety. V pozdějším věku incidence opět mírně narůstá a dosahuje druhého vrcholu kolem 60 let věku, většinu pacientů ale tvoří mladší dospělí. U příbuzných pacientů s HL v 1. linii existuje asi 3krát vyšší riziko výskytu této nemoci, než je populační. Vyšší riziko je u jednovaječných dvojčat, mladších příbuzných, sourozenců, zejména stejného pohlaví, nižší riziko pak pro rodiče a starší příbuzné. Zřejmá je asociace s prodělanou infekcí EBV (virus Epstein-Barrové), často lze v nádorových buňkách HL prokázat přítomnost genetického materiálu EBV, který hraje roli při vzniku této choroby. U osob, které prodělaly manifestní infekci (infekční mononukleózu) je zvýšené riziko vzniku HL, nicméně naprostá většina osob, která byla infikována EBV (do 30 let věku kolem 95 % populace), obvykle bezpříznakově, nikdy HL neonemocní. V řadě případů navíc EBV v nádorových buňkách není prokazatelný. Lze předpokládat, že tato souvislost mezi infekcí EBV a vznikem HL je odpovědná i za typickou manifestaci v mladším dospělém věku.
Klasifikace a biologie
Na základě morfologie, imunofenotypu, ale i klinického chování a přístupu k léčbě rozlišuje aktuální platná klasifikace lymfoidních malignit dvě základní entity HL. Nodulární lymfocytárně predominantní Hodkginův lymfom (NLPHL), který se vyskytuje asi v 5 % případů, a klasický Hodgkinův lymfom (cHL), který představuje asi 95 % všech případů. V rámci cHL rozlišujeme na základě morfologie (způsob nádorového růstu, přítomnost fibrózy, složení buněčného pozadí tumoru) čtyři podtypy: modulárně sklerotický (65 %), smíšeně buněčný (25 %), bohatý na lymfocyty (4 %) a s deplecí lymfocytů (1 %). Tyto podtypy cHL mají i určité specifické klinické rysy (obvyklejší místa postižení, frekvence EBV pozitivity, výskyt B příznaků), mají však stejný imunofenotyp nádorových buněk a neliší se ani v terapeutickém přístupu.
Na rozdíl od většiny ostatních nádorů tvoří vlastní nádorové buňky u cHL pouze kolem 1 % všech buněk nádorové tkáně, morfologicky rozlišujeme mononukleární blastické tzv. Hodgkinovy buňky a dvou ‑ a vícejaderné buňky Reed ‑ Sternberga (HRS). Většinu buněk nádoru pak tvoří buňky reaktivního pozadí (T i B lymfocyty, histiocyty, eozinofily, plazmatické buňky, fibroblasty). Vzhledem k řídkému výskytu vlastních nádorových buněk a jejich nejistému imunofenotypu nebyl po dlouhou dobu zcela jasný jejich liniový původ. U nádorových buněk NLPHL charakteru mírně atypických polyploidních imunoblastů, tzv. LP buněk, se pravidelně vyskytují povrchové B buněčné antigeny (CD20, CD79) i další markery buněk germinálního centra (GC), jako bcl ‑ 6, tedy jejich původ v B lymfocytech byl nepochybný. Pro HRS buňky (Hodgkinovy a Reed ‑ Sternbergovy) cHL je ovšem typická pouze exprese antigenů, které nejsou liniově specifické (CD15, CD30). Až v 90. letech 20. století byl díky mikrodisekčním technikám a molekulární genetice (single cell PCR) definitivně prokázán původ nádorových buněk HL v germinálních B buňkách zásluhou klonálně specifické rearanže genu pro imunoglobulinový řetězec v nádorových buňkách [1]. Prakticky ve všech případech cHL lze prokázat somatické mutace rearanžovaných úseků genu pro IgVH, což svědčí pro jejich původ v zárodečných centrech po aktivaci antigenem. U většiny HRS buněk dochází ke vzniku nefunkčních somatických mutací IgV genu (nonsense mutace, ztráta afinity k antigenu). Za fyziologických podmínek vede nefunkční somatická mutace IgVH k rychlé apoptóze v zárodečném centru. Předpokládá se proto, že většina HRS buněk vzniká z preapoptotických B buněk zárodečného centra. Jakým způsobem unikají HRS buňky apoptóze není zcela jasné, podílet se na tom může např. vliv latentní infekce EBV. Asi ve 40 % HRS buněk je detekovatelný latentní membránový protein kódovaný virem Epstein‑Barrové (LMP1), který napodobuje funkci aktivovaného receptoru CD40. To vede k deregulaci signální cesty NF ‑ κB, která je kritická pro přežití HRS buněk. V HRS buňkách byla prokázána deregulace v řadě transkripčních faktorů, kromě signální cesty NF ‑ κB i např. JAK/ STAT, na které se podílí exprese některých cytokinů (IL-13, IL‑21) a další faktory [2]. V patofyziologii vzniku a rozvoje HL hraje zásadní úlohu i vliv mikroprostředí i interakce s ostatními reaktivními buňkami v nádorové tkáni. V tomto ohledu hrají dominantní roli T lymfocyty, které tvoří obvykle většinu buněčné populace tumoru a představují rovněž většinu buněk, které jsou s buňkami LP i HRS v přímém kontaktu. Zdá se, že tyto interakce jsou důležité pro přežití HRS buněk a jejich únik před imunitní reakcí organizmu. Buňky HRS rovněž exprimují PD ligandy 1 a 2, které přes aktivaci PD ‑ 1 (programmed death receptor) na povrchu T buněk inhibují jejich protinádorovou aktivitu. Jedním z nadějných léků testovaných v klinických studiích v současné době v léčbě HL je i monoklonální protilátka (nivolumab), která blokuje PD ‑ 1 receptor a zvyšuje tak T buňkami zprostředkovanou protinádorovou imunitní reakci.
Klinický obraz
Nejčastější manifestací HL je u mladších dospělých jedinců nebolestivé hmatné zvětšení lymfatických uzlin v oblasti krku nebo nadklíčku (60 – 80 %), méně často v oblasti třísel (5 – 15 %). Další typická prezentace je zjištění mediastinální expanze (až 60 % pacientů) na zobrazovacích metodách. Mediastinální postižení je nezřídka zachyceno jako bulky tumor (často nad 10 cm), který se může projevovat jenom minimálními příznaky, může však být asociován s přítomností pleurálního nebo perikardiálního výpotku, v nichž obvykle nelze při cytologickém vyšetření zachytit nádorovou populaci. Méně často je spojen s dalšími příznaky, jako kašel, bolestivost, vzácně se syndromem z komprese horní duté žíly. Frekvence postižení jednotlivých uzlinových a mimouzlinových lokalit je uvedena v tab. 1.
Tab. 1. Frekvence postižení jednotlivých uzlinových a mimouzlinových lokalit. 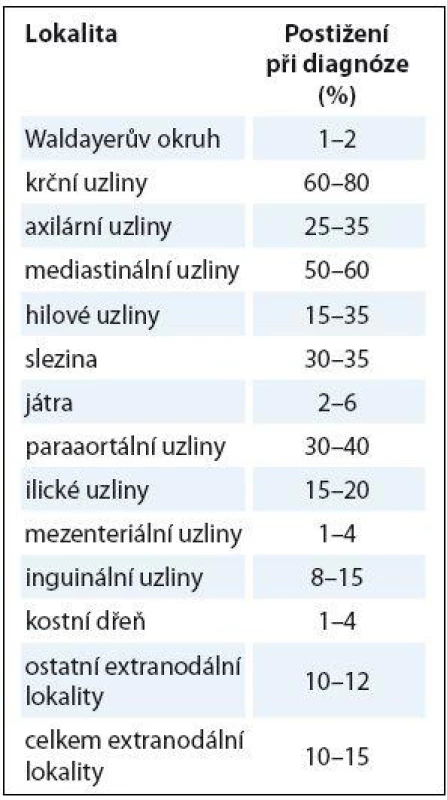
Celkové příznaky jsou u HL poměrně časté, jsou přítomny asi u jedné třetiny pacientů a často předcházejí delší dobu stanovení diagnózy. Mezi typické příznaky patří horečky, často cyklické, tzv. Pelova ‑ Ebsteinova typu, zvýšené, zejména noční, pocení, hubnutí, svědění, únava. Alkoholová bolest se udává jako poměrně specifický příznak pro HL, avšak je velmi vzácná, typicky silná, vzniká několik minut po napití se alkoholu, byť v malé dávce, ale je lokalizována do oblasti postižených uzlin. Další možné příznaky vyplývají z postižení extranodálních lokalit. Může se vyskytnout bolest kostí při jejich postižení, někdy provázená i symptomatickou hyperkalcemií, bolestivost v podžebří při postižení jater, sleziny, cytopenie při infiltraci kostní dřeně (KD), vzácně jsou popisovány paraneoplastické neurologické syndromy či reaktivní změny na kůži (urtika, ichtyóza, erytema nodosum, multiforme, hyperpigmengtace).
Diagnostika, určení klinického stadia
Ke stanovení přesné diagnózy – podtypu lymfomu – je nezbytná exstirpace celé zvětšené uzliny nebo reprezentativního vzorku postižené tkáně a kompletní histologické vyšetření včetně imunohistochemie na pracovišti s dostatečnou zkušeností v diagnostice hematologických malignit. Pouhá jehlová biopsie obvykle neumožní přesné stanovení diagnózy.
Detailní anamnéza a klinické vyšetření jsou nezbytné ke zhodnocení klinického stavu, závažnosti komorbidit, rizik protinádorové léčby. Věk pacienta, přítomnost B symptomů (horečky, pocení, hubnutí) a celkový stav kondice (performance status) bezprostředně ovlivňují rozhodnutí o léčebné strategii. Dále zejména onemocnění srdce, plic, ledvin nebo jater mohou podmiňovat modifikaci chemoterapie. Funkční vyšetření srdce echokardiograficky a pomocí EKG a funkční vyšetření plic včetně difuzní kapacity pro výměnu krevních plynů jsou důležitá pro indikaci potenciálně kardiotoxických a pneumotoxických cytostatik u většiny pacientů.
Pro určení klinického stadia jsou nejdůležitější zobrazovací metody. Standardní celotělové vyšetření pomocí CT je v dnešní době u HL již většinou nahrazeno hybridním vyšetřením PET/ CT. PET je realizován pomocí FDG, tedy radionuklidem navázaným na glukózu (fluorin‑18 - fluoro‑2 - deoxy ‑ D ‑ glukóza). HL patří mezi tzv. pravidelně FDG ‑ PET avidní tumory, senzitivita této metody je pro určení klinického stadia vyšší než při použití klasického CT (95 vs. 80 %). Ještě cennější je použití PET/ CT při hodnocení výsledku na konci léčby, kde oproti CT dokáže odlišit relativně častá fibrózní rezidua původní masy tumoru od viabilní nádorové tkáně. Vyšetření KD pomocí trepanobiopsie, vzhledem k nízké incidenci postižení KD u HL a vysoké citlivost PET vyšetření, dnes není považováno za obligatorní.
Určení klinického stadia vychází z Ann ‑ Arbor klasifikace (tab. 2).
Tab. 2. Určení klinického stadia dle Ann-Arbor klasifikace. 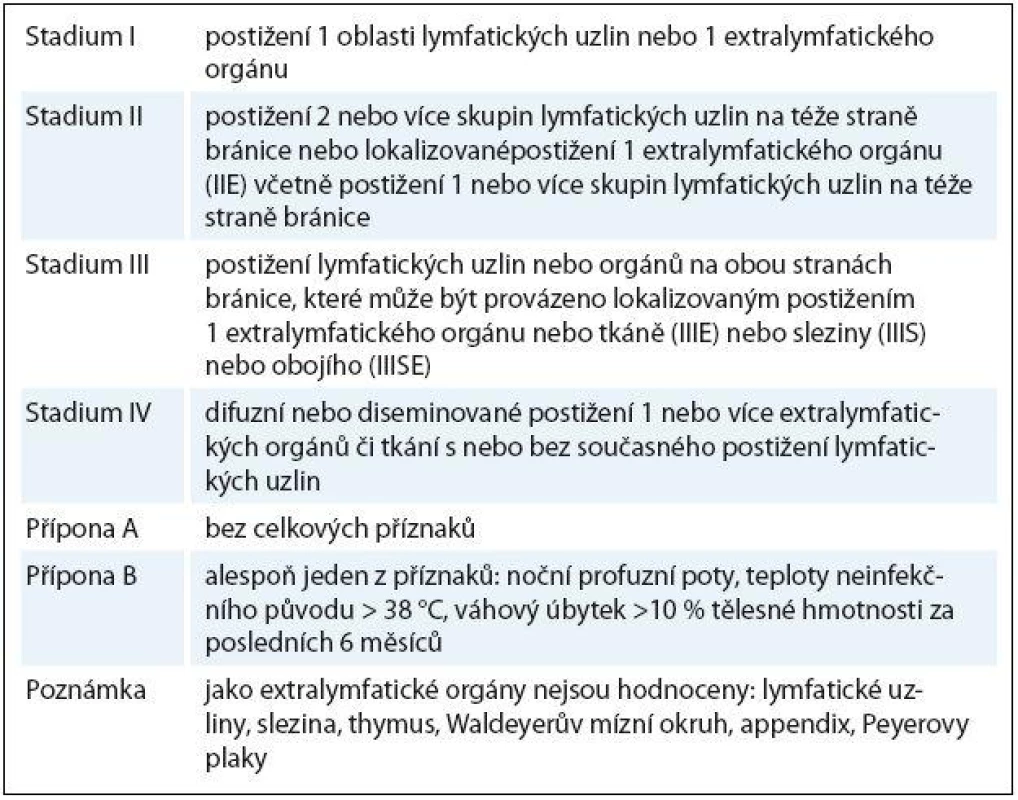
Prognostické skupiny
Z hlediska volby primární léčby se podle rozsahu onemocnění a přítomnosti dalších prognostických faktorů rozlišují tři skupiny. Časná příznivá stadia (klinické stadium I a II dle Ann Arbor klasifikace), tedy bez žádného rizikového faktoru, časná nepříznivá stadia, kdy je přítomen alespoň jeden rizikový faktor, a pokročilá stadia (klinické stadium III a IV). Stanovení rizikových faktorů pro časná stadia se poněkud liší mezi jednotlivými hlavními světovými skupinami, což činí výsledky jednotlivých klinických studií těchto skupin obtížněji srovnatelné. V běžné klinické praxi v ČR většina pracovišť používá systém rizikových faktorů podle Německé skupiny pro Hodgkinův lymfom (German Hodgkin Study Group – GHSG). GHSG navíc řadí klinické stadium IIB s masivní mediastinální masou a/ nebo s extranodálním postižením mezi pokročilá stadia. Srovnání definice rizikových faktorů pro časná stadia nejvýznamnějších skupin uvádí tab. 3.
Tab. 3. Srovnání definice rizikových faktorů pro časná stadia nejvýznamnějších skupin. 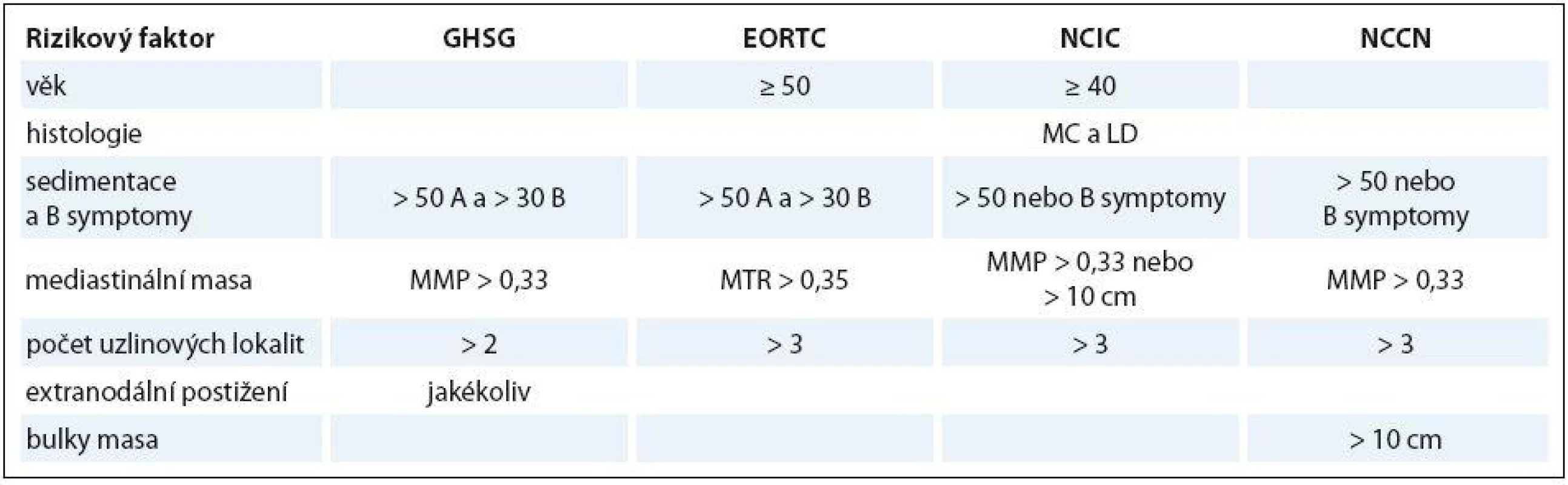
GHSG – German Hodgkin Study Group, EORTC – European Organization for the Research and Treatment of Cancer, NCIC – National Cancer Institute Canada, MC – smíšená buněčnost, LD – lymfocytární deplece, MMP – poměr max. šíře mediastina a max. šíře hrudníku, MTR – poměr maximální šíře mediastina a hrudníku v úrovni Th5-6 Pro stratifikaci rizika u pokročilých stadií byl na základě statistické analýzy souboru 5 000 pacientů sestrojen Mezinárodní prognostický systém (International prognostic system – IPS) (tab. 4), který obsahuje sedm faktorů. Každý z nich zhoršuje prognózu z hlediska přežití bez selhání léčby (freedom from treatment failure – FFTF) v pěti letech o sedm procentních bodů. Je důležité podotknout, že vychází z analýz pacientů léčených standardní chemoterapií (ABVD – adriamycin, bleomycin, vinblastin, dakarbazin a srovnatelné), při použití intenzifikované chemoterapie eskalovaný (eskal.) BEACOPP se jeho význam částečně smazává.
Tab. 4. Mezinárodní prognostický systém (IPS). 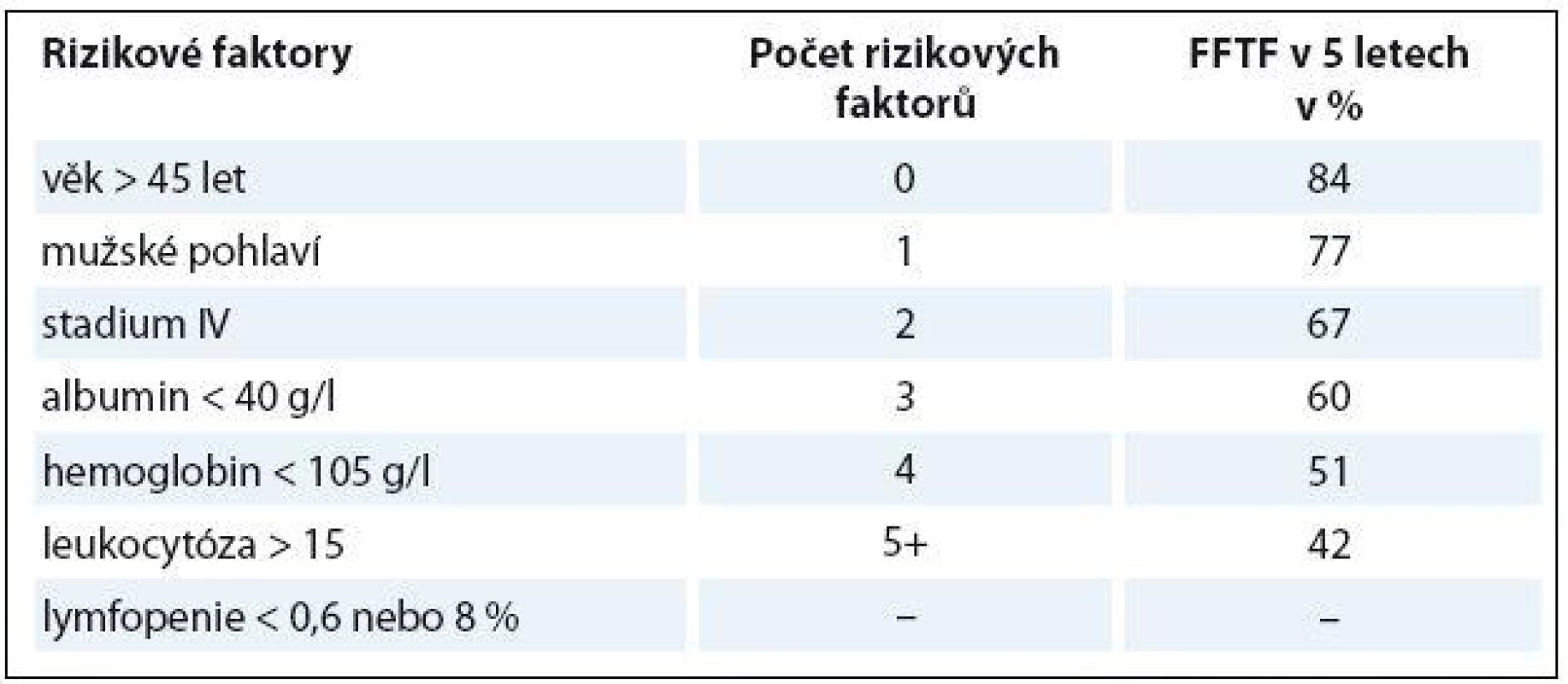
Léčba časných příznivých stadií
Přístup k léčbě pacientů s časným stadiem HL se za poslední čtyři dekády zásadně změnil. V 70. letech 20. století představoval standardní přístup pro pacienty s klinickými stadii I a IIA samostatnou extenzivní radioterapii. Tento postup ale vedl k relativně vysoké rekurenci onemocnění (25 – 30 %) mimo ozařovanou oblast, i když většina pacientů byla úspěšně léčena následnou chemoterapií. Navíc extenzivní radioterapie představuje vysoké riziko pozdních nežádoucích účinků, zejména sekundárních malignit. Další vývoj vedl k zavedení kombinace léčebných modalit, začlenění chemoterapie a redukci objemu a dávek radioterapie. Benefit použití kombinované léčby oproti samotné extenzivní radioterapii byl prokázán v několika randomizovaných studiích. Bylo dosaženo zlepšení přežití bez selhání léčby asi o 15 – 20 % [3,4]. Nejobvyklejším režimem chemoterapie, který je používán léčbě časných stadií, je ABVD, který je dobře tolerovaný, představuje nižší riziko z hlediska dlouhodobých komplikací v porovnání s původními režimy (sekundární akutní leukemie, neplodnost). Při použití kombinované léčby bylo možno nahradit extenzivní radioterapie modernější a šetrnější technikou ozáření postiženého pole (involved field – IF), které představuje nižší riziko pozdních komplikací. Při vysoké účinnosti kombinované léčby a riziku pozdní toxicity řada studií porovnávala v randomizovaných studiích různý počet cyklů a dávku radioterapie ve snaze nalézt ideální rovnováhu mezi dostatečnou účinností a dlouhodobou bezpečností léčby. Studie HD10 německé skupiny (GHSG) porovnávala dva a čtyři cykly ABVD a IF RT 20 a 30 Gy ve čtyřech různých ramenech u velkého souboru 1 190 pacientů, přežití bez události (event‑free survival – EFS) a celkové přežití (overall survival – OS) v osmi letech bylo 87, resp. 95 % a nelišilo se signifikantně v jednotlivých ramenech [5]. Na základě této studie lze považovat léčbu dvěma cykly ABVD a IF RT 20 Gy u dobře definované skupiny pacientů, pomocí rizikových faktorů podle GHSG, za standardní postup u časných příznivých stadií.
Ve snaze získat nové prognostické informace použitelné pro další stratifikaci léčby se ukázalo jako velmi cenné průběžné hodnocení odpovědi na úvodní chemoterapii pomocí PET vyšetření (tzv. interim PET), provedené po 2 – 3 cyklech chemoterapie, které je schopno predikovat prognózu přežití bez progrese (progression‑free survival – PFS) lépe než dosud používané prognostické faktory [6].
V Evropě v posledních letech proběhly dvě klinické studie s recentně publikovanými výsledky, které randomizovaly pacienty mezi standardní kombinovanou léčbu a chemoterapii samotnou podle výsledku PET po 2 – 3 cyklech chemoterapie.
Ve studii RAPID britské skupiny pro stadia IA a IIA bez mediastinálního bulky tumoru, kde byl PET proveden po třech cyklech ABVD, byli PET pozitivní pacienti léčeni 4. cyklem ABVD a IF RT, PET negativní byli randomizováni mezi skupinu s IF RT a skupinu bez další léčby. Mezi PET negativními po 3. cyklu bylo PFS ve třech letech pro skupinu s IF RT oproti skupině bez další léčby 94,6 vs. 90,8 %. Absolutní rozdíl PFS činil 3,8 %, statisticky však nebyla prokázána non‑inferiorita experimentálního postupu (vynechání radioterapie při dosažení PET negativity po třech cyklech ABVD) [7]. Přesto lze konstatovat, že pacienti s negativním PET vyšetřením po chemoterapii mají velmi dobrou prognózu i bez použití radioterapie a lze u nich uvažovat o větší individualizaci léčby s ohledem na dlouhodobé toxické účinky radioterapie, obzvláště u mladších jedinců.
Studie H10 organizovaná EORTC pro časná příznivá (H10F) a časná nepříznivá (H10U) stadia randomizovala pacienty mezi standardní kombinaci ABVD + IF RT a experimentální větev na základě PET výsledku po dvou cyklech ABVD. PET negativní pacienti dostali další dva cykly (H10F), resp. čtyři cykly (H10U) ABVD, v případě PET pozitivity byla léčba intenzifikována pomocí režimu eskal. BEACOPP a INRT. Interim analýza prokázala PFS v jednom roce u H10F 100 % u standardní větve a 95 % u samotné chemoterapie, u H10U byl PFS 97,3 % u standardní větve vs. 94,7 % v případě samotné chemoterapie [8]. Vzhledem k tomu, že rozdíl byl pro obě skupiny signifikantní ve prospěch standardní větve zahrnující radioterapii, bylo doporučeno další nábor do studie zastavit.
Obě studie tedy přinesly srovnatelné výsledky, na jejichž základě lze odvodit, že u časných stadií HL konsolidační radioterapie u PET negativních pacientů po samotné chemoterapii přináší redukci selhání léčby v řádu jednotek procent (4 – 5 %), tedy výrazná většina pacientů je vyléčena již samotnou chemoterapií. Definitivní závěry z hlediska dlouhodobého OS a pozdních nežádoucích účinků radioterapie bude možné hodnotit až po dlouhodobějším sledování.
Léčba časných nepříznivých stadií
Pacienti s časným onemocněním (klinické stadium I a II) a s rizikovými faktory jsou léčeni standardně kombinací chemoterapie a radioterapie. Podobně jako v předchozí skupině byl klinický výzkum v posledních dekádách zaměřen na identifikaci ideální dávkové intenzity chemoterapie jak z hlediska počtu cyklů, tak i intenzity jednotlivých režimů, a dále rozsahu a dávky radioterapie.
Při porovnání extenzivní a lokalizované radioterapie po předchozí chemoterapii nebyl prokázán rozdíl ve výsledcích léčby v několika klinických studiích [9,10], extenzivní radioterapie byla ale zatížena větší akutní toxicitou i vyšší incidencí sekundárních malignit.
Kromě standardního režimu ABVD byly testovány dávkově intenzifikované chemoterapie ve snaze snížit procento selhání léčby u této skupiny časných stadií s horší prognózou.
Studie HD11, organizovaná GHSG, zaměřená na intenzitu chemoterapie a rovněž dávku radioterapie, porovnávala čtyři cykly ABVD + 20 nebo 30 Gy IF RT a čtyři cykly bazální BEACOPP + 20 nebo 30 Gy IF RT. V pěti letech byl PFS 86 % a OS 94,5 %, bez signifikantního rozdílu mezi jednotlivými rameny, na hranici inferiority byly výsledky FFTS (přežití bez selhání léčby) ve skupině 4krát ABVD + 20 Gy [11].
Podobné výsledky prokázala i studie H9 - U organizovaná EORTC. V ní byli pacienti randomizováni mezi čtyři a šest cyklů ABVD a čtyři cykly bazálního BEACOPP (bleomycin, etoposid, adriamycin, cyklofosfamid, vinkristin, prokarbazin, prednison), všichni pacienti následně podstoupili IF RT 30 Gy. Mezi skupinami nebyl v této studii prokázán staticky signifikantní rozdíl ve výsledcích léčby [12].
V další německé studii HD14 však bylo prokázáno statisticky významné zlepšení PFS ve větvi při použití více intenzifikované chemoterapie 2krát eskal. BEACOPP + 2krát ABVD oproti standardnímu rameni 4krát ABVD, 95,4 vs. 89 %. V obou ramenech následovala IF RT 30 Gy. OS bylo v pěti letech stejné (97 %) [13].
Na základě klinických studií lze považovat za standardní léčbu v této skupině podání čtyř cyklů ABVD a IF RT 30 Gy nebo dvou cyklů eskal. BEACOPP + dvou cyklů ABVD a IF RT 30 Gy, se zohledněním věku, celkového stavu a komorbidit.
Léčba pokročilých stadií
Základem primární léčby pokročilého HL je kombinovaná chemoterapie. Do 60. let minulého století bylo dlouhodobé přežití těchto pacientů léčených jednotlivými cytostatiky kolem 5 %. První historicky úspěšný kombinovaný režim, který byl použit poprvé v roce 1964, byl MOPP (mechloretamin, vinkristin, prokarbazin, prednison), jenž dosahoval asi 50% kurability [14]. Byla to první účinná systémová léčba, která dokázala vyléčit toto onemocnění v pokročilých stadiích, byla ale zatížena poměrně výraznou pozdní toxicitou (neplodnost, myelodysplazie) a vysokým procentem relapsů.
Režim ABVD (adriamycin, bleomycin, vinblastin, dakarbazin), který byl zaveden o něco později, prokázal lepší účinnost z hlediska kontroly choroby i OS a dobrou toleranci [15].
V další generaci klinických studií byly testovány různé hybridní a alternující režimy, které ale neprokázaly lepší účinnost než samotné ABVD a jejich toxicita byla obvykle větší [16].
Nadějné výsledky přinesl režim Stanford V v klinické studii fáze II: u 142 pacientů bylo dosaženo v pěti letech FFTF 89 % a OS 96 %. V dalších randomizovaných studiích ale nebyla potvrzena jeho superiorita oproti ABVD [17].
Na základě matematického modelování vyvinula německá skupina protokol BEACOPP ve variantách s bazálními a eskalovanými dávkami cyklofosfamidu, etoposidu a adriamycinu a dále obsahující bleomycin, vinkristin, prokarbazin a prednison. Obě tyto varianty BEACOPP v počtu osmi cyklů byly porovnány ve velké randomizované studii HD9 (GHSG) se standardní léčbou té doby, osmi cykly alternujícího režimu COPP/ ABVD. BEACOPP eskal. přinesl signifikantní zlepšení 10letého FFTP (82 vs. 64 %) i OS (75 vs. 86 %) oproti COPP/ ABVD, tato léčba ale přináší větší akutní (zejména cytopenie, infekce) i pozdní toxicitu (zejména vyšší riziko sekundárních akutních leukemií (3 %) a infertilitu) [18]. Proto se další generace studií zaměřily na redukci toxicity při zachování vysoké účinnosti.
Studie HD15 (GHSG), která randomizovala 2 196 pacientů do tří ramen, 8krát BEACOPP eskal., 6krát BEACOPP eskal., 8krát BEACOPP bazální podávaný ve zkráceném intervalu 14 dní, prokázala statisticky významné zlepšení kontroly nemoci i OS, tak i větší bezpečnost při použití šesti cyklů BEACOPP eskal. oproti osmi cyklům BEACOPP eskal., PFS v pěti letech bylo 90,3 vs. 85,6 % oproti OS 95,3 vs. 91,9 % [19]. Významně menší procento pacientů bylo po chemoterapii indikováno ke konsolidační radioterapii než ve studii HD9 (11 vs. 70 %), což je podmíněno tím, že ve studii HD15 byla radioterapie provedena jen u pacientů s PET pozitivním reziduem.
Přímé porovnání ABVD a BEACOPP proběhlo v několika menších randomizovaných studiích, které potvrdily signifikantní benefit kontroly nemoci ve prospěch BEACOPP v rozmezí 12 – 18 % a OS asi o 4 – 8 %, ale bez statistické signifikance [20].
V současné době neexistuje mezinárodní shoda na standardním režimu pro pokročilá stadia. Ve prospěch intenzifikovaného BEACOPP hovoří dosažení vyléčení u většího počtu pacientů, problém je vyšší toxicita a vyšší riziko závažných pozdních nežádoucích účinků. Oproti tomu ABVD je lépe tolerováno, ale vyléčí méně pacientů. Otázkou zůstává, zda tento rozdíl může být z hlediska OS kompenzován účinnou záchranou léčbou v případě selhání primoterapie.
Na základě studie HD15 považujeme za standardní postup mimo klinické studie u pokročilých stadií 6krát BEACOPP eskal. s následnou radioterapií na případné PET pozitivní reziduum. U pacientů starších 60 let šest cyklů ABVD.
Lze očekávat, že další vývoj v léčbě pokročilých stadií bude směřovat k větší individualizaci léčby na základě hodnocení rizikových faktorů a kvality odpovědi a dále začleněním nových, vysoce účinných a méně toxických léků, jako je anti‑CD30 protilátka brentuximab vedotin (BV), která je mimo jiné v současné době testována v klinické studii fáze III v primoléčbě pokročilých stadií. Aktuálně probíhá i řada klinických studií s přístupem adaptovaným na výsledek PET vyšetření, provedeným obvykle po prvních dvou cyklech chemoterapie. Jsou založeny na principu eskalace či deeskalace intenzity léčby podle průběžného hodnocení odpovědi na léčbu.
Nodulární lymfocytárně predominantní varianta HL
Nodulární lymfocytárně predominantní varianta HL (NLPHL) se vyznačuje řadou klinických specifik, která ovlivňují i přístup k léčbě. Onemocnění se chová obvykle indolentně, má ale větší tendenci k relapsům, přesto je jeho dlouhodobá prognóza dobrá. Pacienti umírají i na pozdní nežádoucí účinky opakované léčby. Ve většině případů jsou oproti cHL pacienti diagnostikováni v časném stadiu (80 %), často bez rizikových faktorů. V případě lokalizovaných forem bez rizikových faktorů lze použít samotnou IF RT. Pokud se jedná o postižení jedné uzliny, která je kompletně exstirpována, je opodstatněné i pouhé sledování. Pro časná nepříznivá a pokročilá stadia se doporučuje postupovat jako u cHL s použitím chemoterapie ABVD. Vzhledem k pozitivitě CD20 v nádorových buňkách lze použít i kombinaci s rituximabem. V případě relapsu jsou terapeutické varianty radioterapie v případě dosud neozářené oblasti, další chemoterapie (R ‑ CHOP, R ‑ COP), případně rituximab v monoterapii. Vysokodávkovaná léčba s autologní transplantací krvetvorných buněk (ASCT) obvykle není indikována. Vzhledem k vyššímu riziku transformace do agresivního B ‑ NHL u této jednotky je důležitá histologická verifikace v případě rekurence choroby.
Léčba refrakterní a relabující (R/ R) nemoci
Pacienty, u nichž selhává primární terapie, lze z hlediska prognózy rozdělit do tří skupin. V případě nedosažení kompletní remise úvodní léčbou, nebo relapsem do tří měsíců od jejího ukončení hovoříme o primárně progresivním či refrakterním onemocnění. Jeho prognóza je nejhorší, pomocí konvenční chemoterapie lze dosáhnout dlouhodobé kontroly nemoci jen zřídka. Dále rozlišujeme relapsy časné, do 12 měsíců od ukončení léčby, které mají obdobně špatnou prognózu, a relapsy pozdní, po roce a déle od dosažení první remise.
Zlepšení výsledků léčby R/ R forem bylo dosaženo pomocí konsolidace vysokodávkovanou chemoterapií s podporou autologních krvetvorných buněk (ASCT). Existují ale jen dvě randomizované studie porovnávající konvenční chemoterapii proti ASCT, obě demonstrují signifikantní zlepšení přežití ve smyslu EFS, FFTF ve skupině s ASCT, zlepšení OS nebylo statisticky významně v těchto studiích demonstrováno. Dlouhodobé přežití bez známek choroby se po ASCT pohybuje kolem 50 % [21,22].
V léčbě 2. linie se používá řada režimů, převážně založených na platině (DHAP, ESAP, ICE, GDP) s ORR (overall response rate, součet dosažených parciálních a kompletních remisí) v rozmezí 60 – 89 %, neexistují žádné ramdomizované srovnávací studie, na základě kterých by bylo možné doporučit určitý režim. V posledních letech se objevily zajímavé výsledky při použití některých novějších režimů, jako GVD (gemcitabin, vinorelbin, lipozomální doxorubicin) [23] nebo bendamustinu [24]. Jako přípravný režim před ASCT se obvykle používá BEAM (BICNU, etoposid, cytosinarabinosid, melfalan).
Byla identifikována řada rizikových faktorů, které lze určit v okamžiku relapsu a které mohou sloužit k určité adaptaci léčebné strategie. Mezi ně patří relaps do 12 měsíců, klinická stadia III a IV, anémie, extranodální postižení, B symptomy. Další významný prognostický faktor je odpověď na záchrannou chemoterapii. V analýze publikované Sirohim et al bylo pětileté OS u pacientů v kompletní remisi, parciální remisi a s rezistentní chorobou 79, 59 a 17 %, PFS 69, 44 a 14 % [25]. V několika analýzách byl prokázán i silný prognostický význam PET nálezu před ASCT [26].
Ve snaze o dosažení lepšího výsledku u R/ R forem při použití ASCT byl testován v randomizované studii HD ‑ R2 (GHSG) postup s použitím vysokodávkované sekvenční chemoterapie po úvodních dvou cyklech DHAP v experimentální větvi, před ASCT. Tento postup ale nevedl ke zlepšení celkových výsledků léčby a byl zatížen větší toxicitou [27].
Použití tandemové ASCT pro pacienty stratifikované podle rizika testovala studie H96. Výsledky naznačují, že u prognosticky nepříznivých forem R/ R HL, jako je primárně progresivní onemocnění či kumulace rizikových faktorů (relaps do jednoho roku, KS III, IV, relaps v ozařované oblasti), může tandemová transplantace přinést zlepšení v OS, v pěti letech byl OS 57 vs. 30 – 40 % v historických kontrolách [28].
V případě choroby relabující po ASCT je možné u mladších pacientů indikovat provedení alogenní transplantace jako poslední možnosti, kterou lze považovat za kurativní přístup. Výsledky tohoto postupu ale nejsou uspokojivé. Po standardním myeloablativním přípravném režimu byla zaznamenána vysoká peritransplantační mortalita dosahující až 50 %, dlouhodobě přežívá jen kolem 20 % pacientů [29]. Při použití režimů s redukovanou intenzitou (RIC) je mortalita na výkon kolem 15 %, ale dochází k častým relapsům (až u 60 %) a dlouhodobé OS je kolem 40 % [30].
Další pokrok v léčbě R/ R forem se dá tedy spíše očekávat díky novým lékům, které jsou v současné době testovány nebo již zavedeny do léčby pro vybrané situace v léčbě HL.
Nové léky
Nejvýznamnější z této skupiny nových léků je v současné době BV. Jedná se o monoklonální protilátku anti‑CD30 konjugovanou s mikrotubulárním toxinem (monometyl auristatin E), která představuje cílenou a relativně málo toxickou léčebnou modalitu. Přípravek byl v roce 2014 registrován i v ČR pro léčbu pacientů s R/ R, u kterých selhává ASCT nebo nejsou schopni ASCT a prodělali alespoň dvě linie léčby pro R/ R onemocnění. Vysoká účinnost tohoto léku byla zaznamenána již v klinické studii fáze II, hodnoceno bylo 102 pacientů relabujících po ASCT, tedy s velmi špatnou prognózou. ORR byl 75 %, kompletní remise 34 %, medián trvání kompletní remise 29 měsíců [31].
Vzhledem k pozoruhodným výsledkům u R/ R forem probíhá rozsáhlé testování BV v dalších fázích léčby pomocí klinických studií, jako součást salvage před ASCT, jako indukce před alogenní transplantací krvetvorných kmenových buněk (alloSCT) u refrakterních forem a rovněž i v rámci primární léčby (ABVD vs. BV + AVD u KS III a IV). V loňském roce byla publikována průběžná data studie AETHERA, kde byl BV testován v randomizované, placebem kontrolované studii u rizikových pacientů jako konsolidační léčba po ASCT, po dobu jednoho roku. Odhadované PFS ve dvou letech bylo 65 a 45 % ve větvi s BV, resp. s placebem, rozdíl byl signifikantní. Hlavní toxicitu představuje senzorická polyneuropatie (36 %), obvykle reverzibilní [32]. Na základě této studie se předpokládá rozšíření registrace i o tuto indikaci.
Další nový lék, který v úvodních fázích klinického testování prokázal vysokou účinnost u R/ R forem HL, je nivolumab, anti‑PD1 protilátka posilující T buněčnou imunitní protinádorovou reakci. Ve skupině 23 R/ R pacientů s HL (78 % po ASCT, 78 % po léčbě BV) bylo dosaženo ORR 87 %, z toho 17 % kompletní remise, 13 % stabilní choroby [33]. Klinické testování s tímto nadějným lékem dále probíhá v různých klinických studiích.
Závěr
Přes vysokou účinnost primární léčby HL pomocí konvenčních technik chemoterapie a radioterapie, které se zřejmě blíží hranici svých možností účinnosti u této choroby, zůstává řada oblastí a otázek stále otevřených k dalšímu zkoumání. Vzhledem k pozdním nežádoucím účinkům, které zhoršují kvalitu života a představují riziko pro OS, je vývoj zaměřen na větší individualizaci léčby, lepší stratifikace rizika, jednak použitím PET adaptovaných přístupů, jednak například i větším poznáním biologie nádoru a jeho prognostických souvislostí. Další pokrok lze očekávat i zásluhou neustálého zlepšování technologie radioterapie a zejména zavedením nových vysoce účinných léků do standardní léčby.
Práce byla podpořena granty IGA MZ ČR č. NT13072-4/2012 a NT12193-5/2011.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jan Kořen
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.koren@vfn.cz
Obdrženo: 27. 9. 2015
Přijato: 1. 10. 2015
Zdroje
1. Küppers R, Rajewsky K, Zhao M et al. Hodgkin disease: Hodgkin and Reed ‑ Sternberg cells picked from histological sections show clonal immunoglobulin gene rearrangements and appear to be derived from B cellsat various stages of development. Proc Natl Acad Sci U S A 1994; 91(23): 10962 – 10966.
2. Schmitz R, Stanelle J, Hansmann ML et al. Pathogenesis of classical and lymphocyte ‑ predominant Hodgkin lymphoma. Annu Rev Pathol 2009; 4 : 151 – 174. doi: 10.1146/ annurev.pathol.4.110807.092209.
3. Engert A, Franklin J, Eich HT et al. Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine plus extended ‑ field radiotherapy is superior to radiotherapy alone in early favorable Hodgkin’s lymphoma: final results of the GHSG HD7 trial. J Clin Oncol 2007; 25(23): 3495 – 3502.
4. Hagenbeek A, Eghbali H, Ferme C et al. Three cycles of MOPP/ ABV hybrid and involved ‑ field irradiation is more effective than subtotal nodal irradiation in favorable supradiaphragmatic clinical stage I – II Hodgkin’s dinase. Blood 2000; 96: A575.
5. Engert A, Plütschow A, Eich HT et al. Reduced treatment intensity in patients with early‑stage Hodgkin’s lymphoma. New Engl J Med 2010; 363(7): 640 – 652. doi: 10.1056/ NEJMoa1000067.
6. Hutchings M, Loft A, Hansen M et al., FDG ‑ PET after two cycles of chemotherapy predicts treatment failure and progression‑free survival in Hodgkin lymphoma. Blood 2006; 107(1): 52 – 59.
7. Radford J, Illidge T, Counsell N et al. Results of a trial of PET directed therapy for early stage Hodgkin’s lymphoma. New Engl J Med 2015; 372(17): 1598 – 1607. doi: 10.1056/ NEJMoa1408648.
8. Raemaekers JM, André MP, Federico M et al. Omitting radiotherapy in early positron emission tomography ‑ negative stage I/ II Hodgkin lymphoma is associated with an increased risk of early relapse: clinical results of the preplanned interim analysis of the randomized EORTC/ LYSA/ FIL H10 trial. J Clin Oncol 2014; 32(12): 1188 – 1194. doi: 10.1200/ JCO.2013.51.9298.
9. Eghbali H, Raemaekers J, Carde P. The EORTC strategy in the treatment of Hodgkin‘s lymphoma. Eur J Haematol Suppl 2005; (66): 135 – 140.
10. Engert A, Schiller P, Josting A et al. Involved ‑ field radiotherapy is equally effective and less toxic compared with extended ‑ field radiotherapy after four cycles of chemotherapy in patients with early‑stage unfavorable Hodgkin‘s lymphoma: results of the HD8 trial of the German Hodgkin‘s Lymphoma Study Group. J Clin Oncol 2003; 21(19): 3601 – 3608.
11. Eich HT, Diehl V, Engert A et al. Intensified chemotherapy and dose‑reduced involved ‑ field radiotherapy in patients with early unfavorable Hodgkin‘s lymphoma: final analysis of the German Hodgkin Study Group HD11 trial. J Clin Oncol 2010; 28(27): 4199 – 4206. doi: 10.1200/ JCO.2010.29.8018.
12. Noordijk EM, Thomas J, Fermé C et al. First results of the EORTC ‑ GELA H9 randomized trials: the H9 - F trial (comparing 3 radiation dose levels) and H9 - U trial (comparing 3 chemotherapy schemes) in patients with favorable or unfavorable early stage Hodgkin’s lymphoma (HL). J Clin Oncol 2005 ASCO Annual Meeting Proceedings 2005; 23 (part I of II): 16S.
13. von Tresckow B, Plütschow A, Engert A et al. Dose‑intensification in early unfavorable Hodgkin‘s lymphoma: final analysis of the German Hodgkin Study Group HD14 trial. J Clin Oncol 2012; 30(9): 907 – 913. doi: 10.1200/ JCO.2011.38.5807.
14. DeVita VT Jr, Simon RM, Hubbard SM et al. Curability of advanced Hodgkin‘s disease with chemotherapy. Long‑term follow‑up of MOPP‑treated patients at the National Cancer Institute. Ann Intern Med 1980; 92(5): 587 – 595.
15. Santoro A, Bonadonna G, Valagussa P et al. Long‑term results of combined chemotherapy ‑ radiotherapy approach in Hodgkin’s disease: superiority of ABVD plus radiotherapy versus MOPP plus radiotherapy. J Clin Oncol 1987; 5(1): 27 – 37.
16. Johnson PW, Radford JA, Cullen MH et al. Comparison of ABVD and alternating or hybrid multidrug regimens for the treatment of advanced Hodgkin’s lymphoma: results of the United Kingdom Lymphoma Group LY09 Trial (ISRCTN97144519). J Clin Oncol 2005; 23(36): 9208 – 9218.
17. Hoskin PJ, Lowry L, Horwich A et al. Randomized comparison of the Stanford V regimen and ABVD in the treatment of advanced Hodgkin’s lymphoma: United Kingdom National Cancer Research Institute Lymphoma Group Study ISRCTN 64141244. J Clin Oncol 2009; 27(32): 5390 – 5396. doi: 10.1200/ JCO.2009.23.3239.
18. Engert A, Diehl V, Franklin J, et al. Escalated‑dose BEACOPP in the treatment of patients with advanced‑stage Hodgkin’s lymphoma: 10 years of follow‑up of the GHSG HD9 study. J Clin Oncol 2009; 27(27): 4548 – 4554. doi: 10.1200/ JCO.2008.19.8820.
19. Engert A, Haverkamp H, Kobe C et al. Reduced intensity of chemotherapy and PET ‑ guided radiotherapy in patients with advanced stage Hodgkin lymphoma (HD15 trial): a randomised, open ‑ label, phase 3 non‑inferiority trial. Lancet 2012; 379(9828): 1791 – 1799. doi: 10.1016/ S0140 ‑ 6736(11)61940 ‑ 5.
20. Skoetz N, Trelle S, Rancea M et al. Effect of initial treatment strategy on survival of patients with advanced‑stage Hodgkin’s lymphoma: a systematic review and network meta‑analysis. Lancet Oncol 2003; 14(10): 943 – 952. doi: 10.1016/ S1470 ‑ 2045(13)70341 ‑ 3.
21. Linch DC, Winfield D, Goldstone AH et al. Dose intensification with autologous bone ‑ marrow transplantation in relapsed and resistant Hodgkin‘s disease: results of a BNLI randomised trial. Lancet 1993; 341(8852): 1051 – 1054.
22. Schmitz N, Pfistner B, Diehl V et al. Aggressive conventional chemotherapy compared with high‑dose chemotherapy with autologous haemopoietic stem ‑ cell transplantation for relapsed chemosensitive Hodgkin‘s disease: a randomised trial. Lancet 2002; 359(9323): 2065 – 2071.
23. Bartlett NL, Niedzwiecki D, Johnson JL et al. Gemcitabine, vinorelbine, and pegylated liposomal doxorubicin (GVD), a salvage regimen in relapsed Hodgkin‘s lymphoma: CALGB 59804. Ann Oncol 2007; 18(6): 1071 – 1079.
24. Moskowitz AJ, Hamlin PA Jr, Perales MA. hase II study of bendamustine in relapsed and refractory Hodgkin lymphoma. J Clin Oncol 2013; 31(4): 456 – 460. doi: 10.1200/ JCO.2012.45.3308.
25. Sirohi B, Cunningham D, Powles R et al. Long‑term outcome of autologous stem ‑ cell transplantation in relapsed or refractory Hodgkin‘s lymphoma. Ann Oncol 2008; 19(7): 1312 – 1319. doi: 10.1093/ annonc/ mdn052.
26. Mocikova H, Pytlik R, Markova J et al. Pre‑transplant positron emission tomography in patients with relapsed Hodgkin lymphoma. Leuk Lymphoma 2011; 52(9): 1668 – 1674. doi: 10.3109/ 10428194.2011.573889.
27. Josting A, Müller H, Borchmann P et al. Dose intensity of chemotherapy in patients with relapsed Hodgkin‘s lymphoma. J Clin Oncol 2010; 28(34): 5074 – 5080. doi: 10.1200/ JCO.2010.30.5771.
28. Morschhauser F, Brice P, Fermé C et al. Risk‑adapted salvage treatment with single or tandem autologous stem ‑ cell transplantation for first relapse/ refractory Hodgkin‘s lymphoma: results of the prospective multicenter H96 trial by the GELA/ SFGM study group. J Clin Oncol 2008; 26(36): 5980 – 5987. doi: 10.1200/ JCO.2007.15.5887.
29. Peniket AJ, Ruiz de Elvira MC, Taghipour G et al. An EBMT registry matched study of allogeneic stem cell transplants for lymphoma: allogeneic transplantation is associated with a lower relapse rate but a higher procedure‑related mortality than autologous transplantation. Bone Marrow Transplant 2003; 31(8): 667 – 678.
30. Sureda A, Canals C, Arranz R et al. Allogeneic stem cell transplantation after reduced intensity conditioning in patients with relapsed or refractory Hodgkin’s lymphoma. Results of the HDR ‑ ALlO study – a prospective clinical trial by the Grupo Español de Linfomas/ Trasplante de Médula Osea (GEL/ TAMO) and the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Haematologica 2012; 97(2): 310 – 317. doi: 10.3324/ haematol.2011.045757.
31. Younes A, Gopal AK, Smith SE et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin‘s lymphoma. J Clin Oncol 2012; 30(18): 2183 – 2189. doi: 10.1200/ JCO.2011.38.0410.
32. Moskowitz C, Nadamanee A, Masszi T et al. The Aethera Trial: results of a Randomized, double‑blind, placebo ‑ controlled phase 3 study of brentuximab vedotin in the treatment of patients at risk of progression following autologous stem cell transplant for Hodgkin lymphoma. Blood 2014; 124(21).
33. Ansell SM, Lesokhin AM, Borrello I et al. PD ‑ 1 blockade with nivolumab in relapsed or refractory Hodgkin‘s lymphoma. N Engl J Med 2015; 372(4): 311 – 319. doi: 10.1056/NEJMoa1411087.
Štítky
Dětská onkologie Hematologie a transfuzní lékařství Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Současné možnosti imunoterapie nádorových onemocnění
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Editorial
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



