-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNa MRI založené 3D plánování brachyradioterapie karcinomů děložního hrdla – naše zkušenosti s použitím uterovaginálního aplikátoru Vienna Ring MR‑ CT
MRI Based 3D Brachytherapy Planning of the Cervical Cancer – Our Experiences with the Use of the Uterovaginal Vienna Ring MR ‑ CT Applicator
Background:
Uterovaginal brachytherapy planning is conventionally based on the use of two orthogonal X‑ray projections. Currently, there is a large development of 3D brachytherapy planning based on the fusion of CT and MRI, which takes into account the extent of the tumor and the location of organs at risk. In this work, we evaluated the dosimetric data and first clinical results in patients with inoperable cervical cancer using MRI/ CT compatible applicator enabling 3D planning.Patients and Methods:
Between June 2012 and March 2013, we performed 52 uterovaginal applications in 13 patients with inoperable cervical cancer using Vienna Ring MR ‑ CT applicator. Planning was carried out by the fusion of MRI and CT. Target volumes and organs at risk delineation were carried out on the basis of GEC ‑ ESTRO and ABS recommendations as well as doses reporting.Results:
Overall radiotherapy duration was 37 – 52 days with median of 45 days. The median total dose delivered to the HR CTV was 88 Gy (70.7 – 97.9) EQD2. The median single dose in brachytherapeutic applications was D90 = 6.45 Gy (3.2 – 9.82). The median total doses delivered to the rectum, sigmoid colon and bladder were D2ccrectum = 64.2 Gy (54.3 – 74.1), D2ccsigmoid = 68.6 Gy (57 – 74.7) a D2ccbladder = 73.9 Gy (58.3 – 92.6). In 11 patients (84.6%), complete locoregional remission was achieved, in the remaining two patients (15.4%), partial locoregional remission was achieved. Twelve patients (92.3%) had complete regression of the tumor in the cervix, one patient (7.7%) developed metastatic spread to the liver. Yet we did not observe manifestations of a higher degree of toxicity than the first grade, both GI and GU. Late GI toxicity was manifested in two patients (15.4%) and late GU toxicity was manifested in five patients (38.5%).Conclusion:
3D brachytherapy planning of inoperable cervical cancer using the fusion of MRI and CT conclusively raises the possibility of the dose escalation to the tumor and significantly spares the surrounding organs at risk. Subsequently, this way of planning leads to better local control of the disease and to lower radiation morbidity.Key words:
cancer of the cervix – brachytherapy – radiotherapy planning – magnetic resonance imaging – uterovaginal applicator
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
4. 8. 2013Accepted:
5. 9. 2013
Autoři: R. Vojtíšek 1; F. Mouryc 1; D. Čechová 1; R. Ciprová 1; J. Ferda 2
; J. Fínek 1
Působiště autorů: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2
Vyšlo v časopise: Klin Onkol 2014; 27(1): 45-51
Kategorie: Původní práce
Souhrn
Východiska:
Plánování uterovaginální brachyterapie je konvenčně založeno na použití dvou ortogonálních rentgenových snímků. V současné době dochází k rozvoji 3D plánování brachyterapie založeného na fúzi CT a MRI vyšetření, které bere do úvahy individuální rozsah tumoru a uložení kritických orgánů. V této práci hodnotíme dozimetrické údaje a první klinické výsledky u pacientek s neoperovaným cervikálním karcinomem při použití MRI/ CT kompatibilního aplikátoru umožňujícího 3D plánování.Soubor pacientů a metody:
V období 6/ 2012 – 3/ 2013 jsme provedli 52 uterovaginálních aplikací u 13 pacientek s inoperabilním cervikálním karcinomem pomocí uterovaginálního aplikátoru Vienna Ring MR ‑ CT. Plánování proběhlo podle fúze CT a MRI vyšetření pánve. Konturace cílových objemů a kritických struktur byla prováděna na základě doporučení GEC ‑ ESTRO a ABS, stejně tak jako vykazování dávek.Výsledky:
Celkové trvání radioterapie bylo 37 – 52 dnů s mediánem 45 dnů. Medián celkové dávky aplikované do HR CTV byl 88 Gy (70,7 – 97,9) EQD2. Medián jednotlivé dávky při brachyterapeutických aplikacích byl D90 = 6,45 Gy (3,2 – 9,82). Medián celkové dávky aplikované do rekta, sigmoidea a močového měchýře, byl D2ccrektum = 64,2 Gy (54,3 – 74,1), D2ccsigmoideum = 68,6 Gy (57 – 74,7) a D2ccmočový měchýř = 73,9 Gy (58,3 – 92,6). U 11 pacientek (84,6 %) bylo dosaženo kompletní lokoregionální remise, u zbývajících dvou pacientek (15,4 %) bylo dosaženo parciální lokoregionální remise. U 12 pacientek (92,3 %) došlo ke kompletní regresi tumoru na čípku, u jedné pacientky (7,7 %) došlo k metastatickému rozsevu v játrech, tedy k progresi onemocnění. Zatím pozorujeme maximálně projevy 1. stupně toxicity, a to jak GI, tak GU. Pozdní GI toxicita se projevila u dvou pacientek (15,4 %) a pozdní GU toxicita se projevila u pěti pacientek (38,5 %).Závěr:
3D plánování brachyterapie neoperovaných nádorů děložního čípku pomocí fúze MRI a CT vyšetření přináší jednoznačně možnost dávkové eskalace na oblast tumoru a významným způsobem šetří okolní rizikové orgány. Ve svém důsledku vede tento způsob plánování k lepší lokální kontrole onemocnění a k nižší postradiační morbiditě.Klíčová slova:
nádory děložního čípku – brachyterapie – plánování radioterapie – magnetická rezonance – uterovaginální aplikátorÚvod
Karcinom děložního hrdla je v České republice 8. nejčastějším nádorovým onemocněním u žen, jehož incidence v roce 2010 byla 18,53/ 100 000 a mortalita 7,16/ 100 000 pacientek. Za posledních 15 let došlo pouze k mírnému snížení těchto epidemiologických ukazatelů (v roce 1995 byla incidence 21,87/ 100 000 a mortalita 9,73/ 100 000) [1]. Standardizované terapeutické onkogynekologické postupy vycházejí z klasických prognostických faktorů, jako je velikost nádoru, hloubka stromální invaze, histopatologický typ nádoru, metastatické postižení lymfatických uzlin a šíření nádoru do parametrií [2].
Brachyterapie je v léčbě cervikálních karcinomů indikována po zevní radioterapii u všech lokálně a lokoregionálně pokročilých stadií (FIGO stadia IB2 – IVA). Samostatná brachyterapie může být použita jako primární léčebná metoda u časných stadií (IA – IB1). Od stadia IB1 by měla být radioterapie kombinována, nejsou‑li přítomné kontraindikace, s konkomitantně podávanou chemoterapií [3,4].
Plánování intrakavitární uterovaginální brachyterapie používající uterinní tandem a vaginální ovoidy či ring je konvenčně založeno na použití dvou ortogonálních rentgenových snímků, což je koncept vytvořený před cca 40 lety [5]. Od roku 1985 se používají standardizované specifikační dávkové body navržené v ICRU reportu 38 [6]. V dnešní době širokého využívání moderních zobrazovacích metod se již tento postup nejeví jako zcela optimální, neboť předpis dávky do konvenčního virtuálního bodu A a vykazování dávek v referenčních bodech pro kritické orgány (rektum a močový měchýř) nemůže ze své podstaty korespondovat s individuálním rozsahem tumoru a uložením kritických orgánů, což následně vede buď k poddávkování části cílového objemu, anebo k vyššímu zatížení rekta a močového měchýře [5,7]. Proto také dochází k rozvoji 3D plánování brachyterapie založeného na CT vyšetření anebo na fúzi CT a MRI vyšetření. Samotné CT vyšetření je limitované špatným měkkotkáňovým kontrastem a omezenou schopností rozeznat vlastní tumor od normální cervikální, uterinní a parametriální tkáně. V tomto smyslu je vyšetření MRI mnohem senzitivnější [5]. První publikované klinické výsledky demonstrují pozitivní dopad 3D plánování brachyterapie na lokoregionální kontrolu onemocnění a na redukci pozdní postradiační morbidity [8 – 10]. Lze rovněž očekávat 10 – 20% prodloužení přežití u pacientek s lokálně pokročilým tumorem, pokud je vhodně a správně použita technika brachyterapie založené na MRI vyšetření [9].
Cílem této práce je seznámit čtenáře s našimi zkušenostmi s 3D plánováním uterovaginální brachyterapie a s prvními léčebnými výsledky a projevy postradiační toxicity při použití nového typu MRI kompatibilního aplikátoru pro intrakavitární brachyterapii cervikálních karcinomů – typ Vienna Ring MR ‑ CT.
Soubor pacientů a metody
Soubor pacientek
V období 6/ 2012 – 3/ 2013 jsme na Onkologickém a radioterapeutickém oddělení FN Plzeň provedli celkem 52 uterovaginálních aplikací, a to celkem u 13 pacientek s inoperabilním karcinomem děložního hrdla. Medián věku pacientek byl 55 let (rozpětí 31 – 73 let), v osmi (61,5 %) případech se jednalo o FIGO (International Federation of Gynaecology and Obstetrics) stadium IIIB, čtyři (30,8 %) pacientky byly diagnostikovány ve stadiu IIBa jedna (7,7 %) pacientka ve stadiu IVB. Ve většině případů se jednalo o dlaždicobuněčný karcinom (12 pacientek, 92,3 %), v jednom případě (7,7 %) byl diagnostikován adenokarcinom (tab. 1). Všechny pacientky podepsaly informovaný souhlas s léčbou.
Tab. 1. Charakteristika souboru (n = 13). 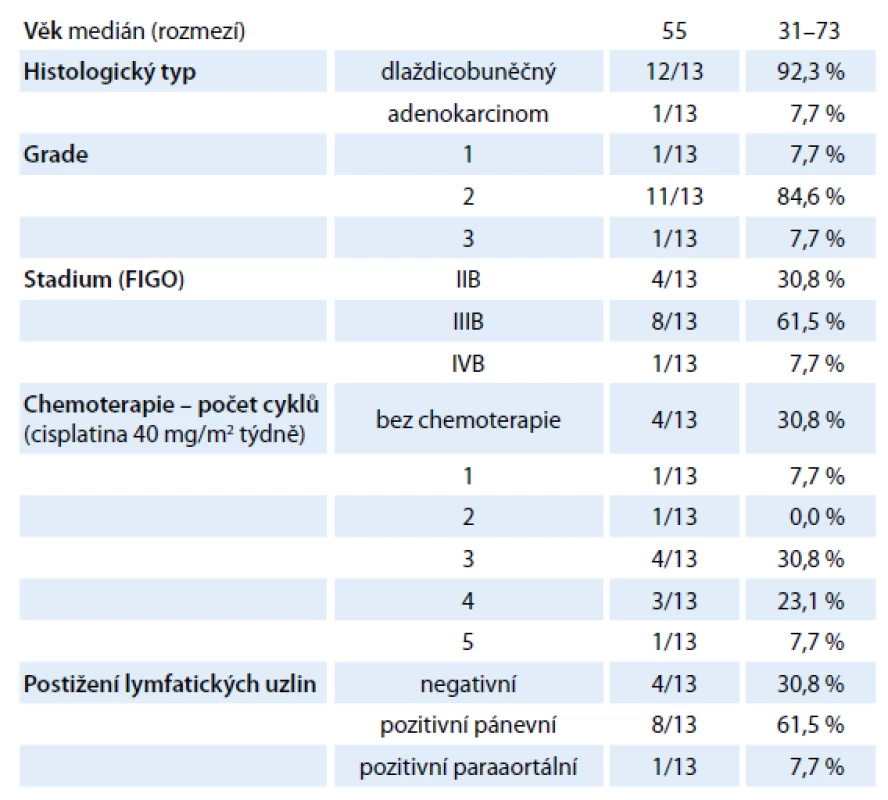
Radioterapie
U všech 13 pacientek (100 %) byla brachyterapie kombinována se zevní radioterapií. Všechny pacientky měly rovněž provedené MRI vyšetření pánve v rámci stagingu onemocnění ještě před zahájením zevní radioterapie. Plánování zevní radioterapie probíhalo podle kontrastního CT vyšetření břicha a pánve, pacientky zaujímaly supinační polohu. Konturaci cílových objemů a rizikových orgánů jsme prováděli podle obecných ICRU doporučení [11,12] a podle specifických doporučení RTOG pro radikální radioterapii cervikálních karcinomů [13]. Použili jsme techniku 3D CRT (3D conformal radiotherapy, 3D konformní radioterapie). Plánovaná dávka ze zevní radioterapie byla 45 – 50,4 Gy na oblast pánve, event. paraaortálních uzlin, při reziduálním nálezu na parametriích byla dávka do této oblasti zvýšena o 10 – 16 Gy.
V devíti případech (69 %) byla radioterapie potencována konkomitantně podávanou chemoterapií (cisplatina 40 mg/ m2 týdně) (tab. 1).
Aplikace brachyterapie
Všechny pacientky podstoupily buď v celkové anestezii, anebo v analgosedaci nejprve zavedení močového katetru a poté zavedení uterovaginálního aplikátoru Vienna Ring MR ‑ CT (Nucletron, Veenendal, Nizozemí) (obr. 1) do děložní dutiny a proximální části pochvy, následně absolvovaly nativní CT vyšetření pánve na CT simulátoru (Brilliance CT Big Bore, Philips), tloušťka řezů byla 1 mm. Ihned poté absolvovaly MRI vyšetření pánve na MRI přístroji s magnetickou indukcí 3 T (SKYRA, Siemens Healthcare, Erlangen, Německo) v obvyklých sekvencích (nativně v T2 TSE ax., sag., T2 TIRM cor, T1 TSE FS tra a DWI ax. a po aplikaci extracelulární kontrastní látky i.v. v T1 VIBE dynamicky) (obr. 2), obě vyšetření byla provedena s aplikátory in situ. Před CT vyšetřením byl močový měchýř vyprázdněn pomocí močového katetru, poté jsme do něj instilovali 30 ml zředěné kontrastní látky (Iomeron 150 inj. sol.) a močový katetr jsme zaklampovali. Po vyšetření jsme katetr opět uvolnili.
Obr. 1. Uterovaginální aplikátor Vienna Ring MR-CT. 
Obr. 2. T2 sekvence MRI vyšetření s uterovaginálním aplikátorem – sagitální rovina. V děložním čípku patrný hyperintenzivní tumor, pochva vyplněná tamponádou. 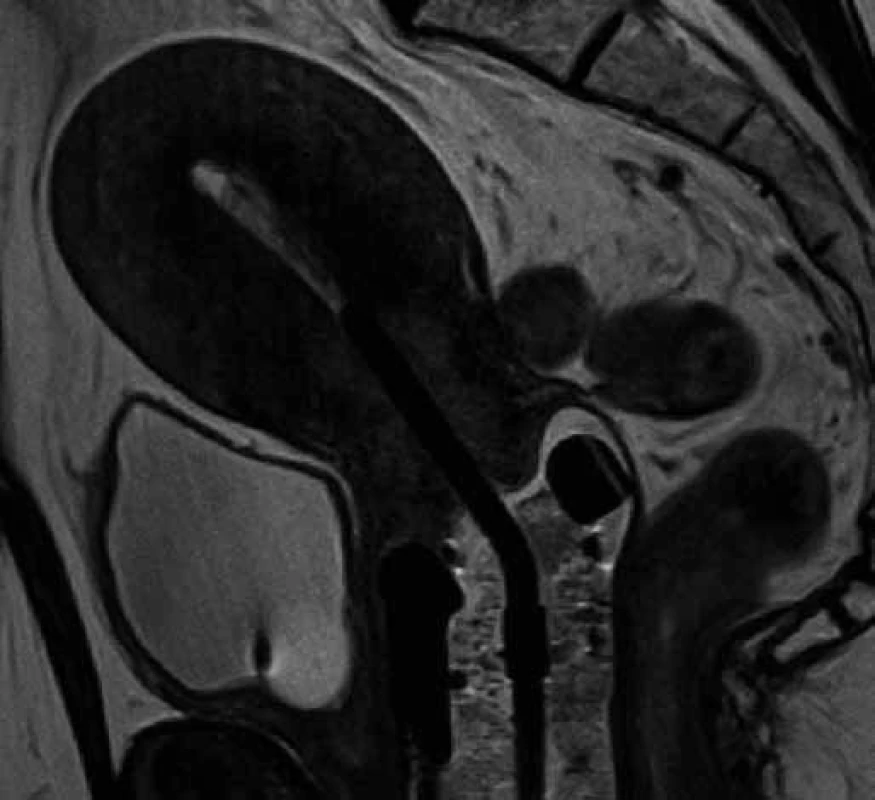
Plánování léčby
Konturace cílových objemů a kritických struktur byla prováděna na základě doporučení, která vydala v roce 2005 gynekologická pracovní skupina GEC ‑ ESTRO (Groupe Européen de Curiethérapie – European Society for Radiotherapy and Oncology) [14,15] a která rovněž převzala ABS (American Brachytherapy Society) [3,16]. Data z CT vyšetření sloužila ke konturaci rizikových orgánů (rektum, sigmoideum a močový měchýř) a lokalizaci aplikátorů. Zakreslení cílových objemů jsme prováděli v T2 sekvencích MRI vyšetření. HR CTV (high-risk clinical target volume) je definován jako reziduální makroskopická nemoc v době brachyterapie (obr. 3). Zahrnuje v sobě GTV (gross tumor volume), celý cervix a extracervikální porci tumoru v době brachyterapie. Patologická reziduální tkáň, palpovatelná indurace, reziduální „šedé zóny“ [10] (střední intenzita signálu v T2 váženém obraze MRI, která je pokládána za patologickou a topograficky odpovídá rozsahu tumoru v době diagnózy) v parametriích, děložním těle, vagině, rektu nebo měchýři by měly rovněž být zahrnuty do tohoto objemu. IR (intermediate risk) CTV je definován jako reziduální mikroskopická nemoc a odpovídá původnímu rozsahu tumoru v době diagnózy. Předepsaná dávka byla 6 Gy na 100% izodózu, ale v rámci dávkové optimalizace při každé jednotlivé frakci byla dávka vykazovaná ve formě D90 (dávka, která pokrývá 90 % cílového objemu) vždy taková, abychom ve výsledném součtu dávkového zatížení kritických orgánů pokud možno nepřekročili toleranční dávky udávané ve formě D2cc (minimální dávka v nejvíce ozářených 2 cm3 tkáně přiléhající k aplikátoru), a to konkrétně pro rektum a sigmoideum 75 Gy a pro močový měchýř 90 Gy [3,14 – 16]. Žádné dávkové limity nebyly určeny pro pochvu. Všechny dávky jsme vykazovali v takové formě, která odpovídala dávce při konvenční frakcionaci, a to s ohledem na typ hodnocené tkáně, tedy ve formě EQD2 (ekvivalentní forma odpovídající konvenční frakcionaci à 2 Gy). Pro účely přepočtu dávek jsme používali lineárně kvadratický model s hodnotami α/ β = 10 pro nádor a α/ β = 3 pro kritické orgány [17].
Obr. 3. Konturace cílového objemu podle MRI vyšetření. Zelená barva – HR CTV, modrá – aplikátor, oranžová – močový měchýř, hnědá – sigmoideum. 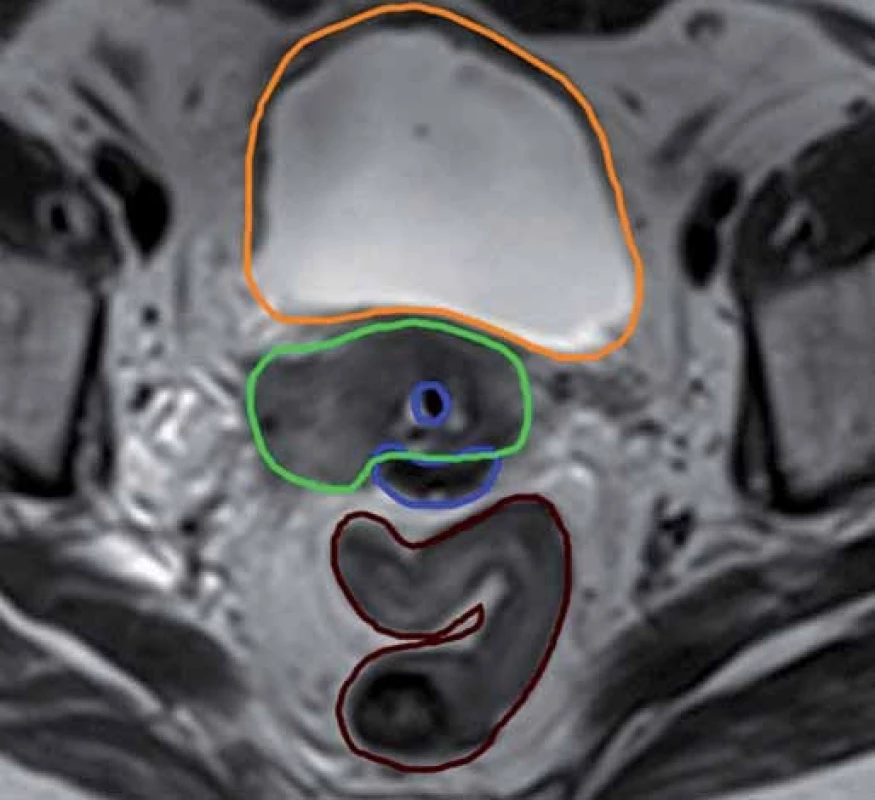
Pro plánování brachyterapie jsme použili plánovací systém Oncentra Masterplan (Nucletron, Veenendal, Nizozemí) (obr. 4) a brachyterapeutické aplikace byly prováděny pomocí HDR afterloadingového přístroje MicroSelectron (Nucletron, Veenendal, Nizozemí), kde je zdrojem 192Ir (iridium).
Obr. 4. 3D dávková distribuce vypočtená podle CT matice (plánovací systém Oncentra Masterplan). Červená barva – HR CTV; zelená – předepsaná dávka, 100% izodóza; modrá – aplikátor; světle hnědá – rektum; tmavě hnědá – sigmoideum; oranžová – močový měchýř. 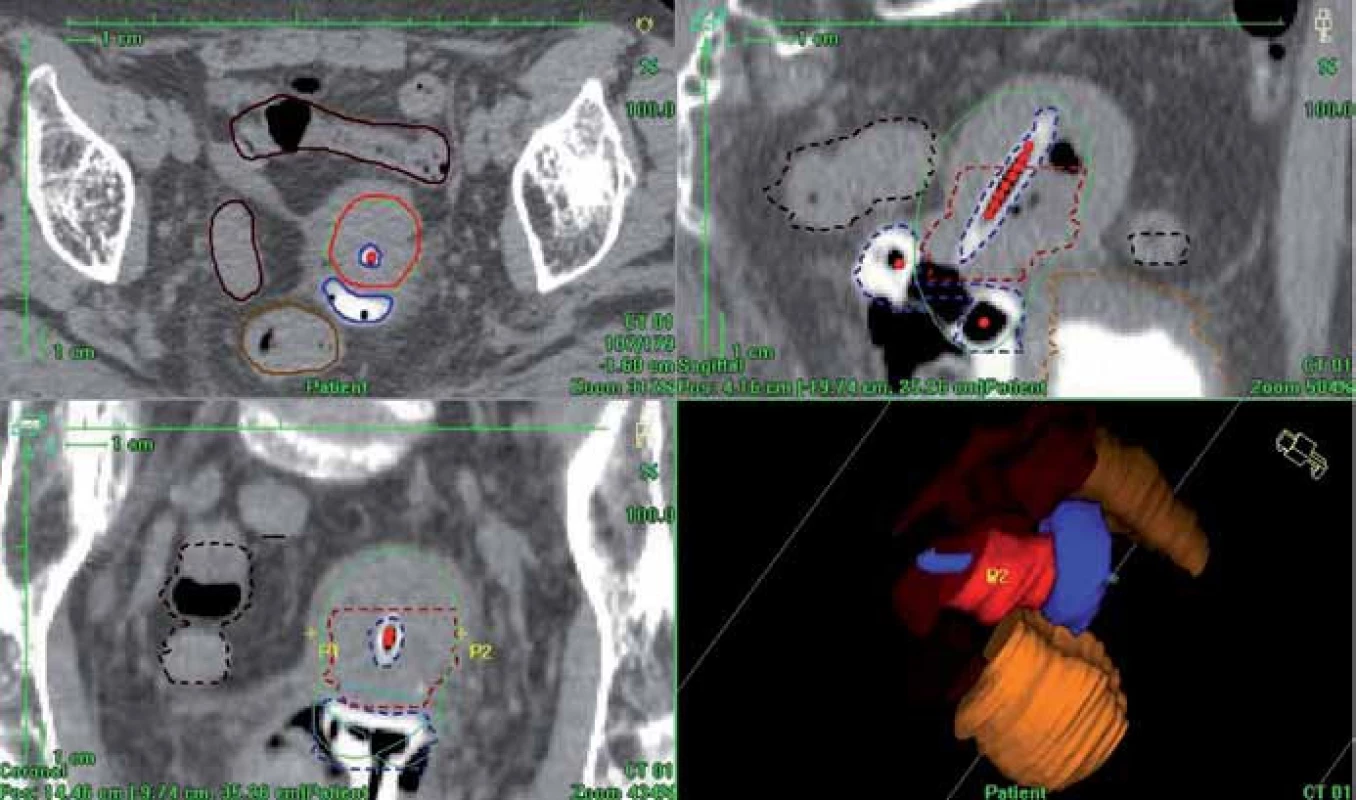
Sledované parametry
Sledovali jsme následující parametry – celková doba léčby, celková aplikovaná dávka do HR CTV, D90 při každé aplikaci brachyterapie, D2cc pro rektum, sigmoideum a močový měchýř, léčebná odpověď a projevy pozdní gastrointestinální a genitourinární toxicity podle Fox Chase modifikace skórovacího systému RTOG/ LENT [18,19]. Jako pozdní toxicita byly definovány obtíže, které se objevily po více než 90 dnech od ukončení ozáření, nebo obtíže, které se vyvinuly během léčby a přetrvávaly déle než 90 dnů po jejím ukončení. Kompletní remise (complete remission – CR) byla definována jako gynekologický nález bez patologie a bez známek tumoru na CT, PET/ CT či MRI vyšetření. Sledování probíhá na našem oddělení formou komplexního gynekologického vyšetření každé tři měsíce a formou MRI vyšetření (u lokálně pokročilého onemocnění) a CT nebo PET/ CT vyšetření (u lokoregionálně pokročilého onemocnění) každých šest měsíců (první vyšetření za tři měsíce od ukončení léčby).
Výsledky
Celkové trvání radioterapie bylo 37 – 52 dnů s mediánem 45 dnů. Všechny pacientky absolvovaly léčbu podle plánu, kromě jedné pacientky, která nepodstoupila poslední plánovanou aplikaci brachyterapie z důvodu interkurentně probíhající těžké akutní bronchitidy.
Dozimetrické výsledky
Medián celkové aplikované dávky (ze zevní radioterapie a brachyterapie) do HR CTV byl 88 Gy (70,7 – 97,9) EQD2. Medián jednotlivé dávky brachyterapeutických aplikací byl D90 = 6,45 Gy (3,2 – 9,82).
Medián celkové dávky aplikované do kritických orgánů, tedy rekta, sigmoidea a močového měchýře, opět z kombinace zevní radioterapie a brachyterapie, byl D2ccrektum = 64,2 Gy (54,3 – 74,1), D2ccsigmoideum = 68,6 Gy (57 – 74,7) a D2ccmočový měchýř = 73,9 Gy (58,3 – 92,6).
Léčebná odpověď
Medián follow‑up byl 32 týdnů (17 – 56). U všech 13 pacientek (100 %) bylo dosaženo lokoregionální remise onemocnění, přičemž u 11 z nich (84,6 %) byla remise kompletní, zbývající dvě pacientky (15,4 %) dosáhly pouze parciální lokoregionální remise. Co se týká lokální odpovědi, tak kompletní regrese tumoru na děložním hrdle byla dosažena u 12 pacientek (92,3 %). I přes lokoregionální kompletní remisi došlo u jedné pacientky (7,7 %) k metastatickému rozsevu v játrech, tedy k progresi onemocnění.
Toxicita
Co se týká projevů pozdní toxicity, tak zatím pozorujeme maximálně projevy 1. stupně toxicity, a to jak gastrointestinální, tak genitourinární. Pozdní GI toxicita se projevila u 2/ 13 (15,4 %) pacientek a pozdní GU toxicita se projevila u 5/ 13 (38,5 %) pacientek. U 6/ 13 (46,2 %) pacientek byly pozorovány synechie proximální části poševní sliznice.
Diskuze
Hlavní výhodou 3D plánování brachyterapie pomocí fúze MRI a CT vyšetření je zobrazení rozsahu nádoru v době diagnózy a zejména v době aplikace brachyterapie a možnost definování individuálního klinického cílového objemu ve vztahu k aplikátoru a rizikovým orgánům, který také bere v úvahu odpověď nádoru na zevní radioterapii. Konvenční předpis dávky do virtuálního bodu A podle konceptu ICRU Reportu 38 [5] není konzistentní s individuálním rozsahem tumoru, což vede buď k poddávkování části cílového objemu, anebo k vyššímu zatížení okolních zdravých tkání. Navíc tento koncept neposkytuje dávkově objemové informace o cílovém objemu a rizikových orgánech, mezi které nepočítá sigmoideum, které se však rovněž významným způsobem podílí na pozdní gastrointestinální toxicitě [20]. 3D plánování dovoluje hodnocení individuální dávkové distribuce v cílových objemech a rizikových orgánech [5].
Předpoklad, že zvýšení dávky aplikované do cílového objemu při přísném dodržování dávkově objemových limitů rizikových orgánů (při plánování pomocí fúze MRI a CT) povede k lepší lokální kontrole [21], potvrdili rakouští autoři Dimopoulos et al [10], kteří popisují 3letou lokální kontrolu 96 % u pacientek, které obdržely dávku D90 (EQD2) do HR CTV vyšší než 87 Gy, a to bez ohledu na rozsah nádoru a odpověď na zevní radioterapii. Tato excelentní lokální kontrola se odráží ve zlepšeném celkovém přežití, ovšem pouze u tumorů větších než 5 cm. Pötter et al [9] popisují zlepšení celkového přežití ve třech letech u pacientek s tumorem nad 5 cm léčených 3D brachyterapií oproti těm se stejně velkým tumorem, ovšem léčených konvenční 2D brachyterapií (58 % vs 28 %; p = 0,003). Nádorově specifické přežití ve třech letech činilo 62 % oproti 40 % (p = 0,07) u tumorů větších než 5 cm, opět ve prospěch 3D plánování. Je nutné dodat, že u pacientek, u kterých byla prokázána pokročilá reziduální choroba v době brachyterapie (29 případů), která by tímto nebyla dostatečně přístupná klasické intrakavitární brachyterapii, byla přidána ještě intersticiální aplikace jehlami.
Jsme si vědomi krátkého follow‑up (medián 32 týdnů), přesto si troufáme tvrdit, že časná léčebná odpověď má určitou prediktivní hodnotu týkající se kontroly onemocnění. U 12 pacientek (92,3 %) jsme pozorovali kompletní regresi tumoru na děložním hrdle a u 11 pacientek (84,6 %) bylo dosaženo kompletní remise lokoregionální. U jedné pacientky bylo dosaženo pouze částečné odpovědi na děložním hrdle a v pánevních uzlinách, jednalo se však iniciálně o velmi pokročilý nález – tumor infiltroval oboustranně parametria ke stěně pánevní a rovněž cirkulárně infiltroval pochvu až do její dolní třetiny. U další pacientky bylo dosaženo kompletní remise lokální, ovšem s perzistující lymfadenopatií v pánvi, která byla následně exstirpována s nálezem perzistujícího metastatického postižení. Tato pacientka odmítla konkomitantně podávanou chemoterapii. I přes lokoregionální remisi došlo také u jedné pacientky k metastatickému rozsevu v játrech – jednalo se o pacientku iniciálně ve stadiu IVB, která taktéž odmítla konkomitantní podání chemoterapie.
Co se týká údajů o pozdní gastrointestinální a genitourinární toxicitě, tak existuje pouze málo literárních údajů detailněji hodnotících tuto problematiku. Ve starších studiích hodnotících efekt radiochemoterapie v léčbě cervikálních tumorů je popisován relativně vysoký stupeň postradiační GI toxicity (více než G3 v 10 – 28 %) [22 – 24]. Jednalo se o soubory pacientek, jejichž brachyterapeutické aplikace byly plánovány konvenčně, tedy ve 2D. Lze tedy předpokládat, že stávající dávkově objemové limity byly v mnoha případech překročeny. V jiné práci autorů Pöttera et al [8] popisují na souboru 48 pacientek léčených kombinací zevní radioterapie a na MRI založené 3D HDR BRT dva případy s genitourinární toxicitou G4 (CTC), žádný případ G3 toxicity a žádnou pacientku s projevy gastrointestinální toxicity G3 – 4. Maximum genitourinární toxicity se projevilo na poševní sliznici – 85 % pacientek mělo projevy suchosti a atrofie poševního epitelu, částečné synechie nebo stenózu horní části pochvy. To vše při mediánu follow‑up 40 měsíců. Zmíněné dva případy s GU toxicitou (močový měchýř) G4 měly při zpětném hodnocení daleko překročené toleranční limity (D2cc byl 137 a 182 Gya/ b3EQD2) podle aktuálních doporučení GEC ESTRO.
Validnější hodnocení pozdní toxicity našeho souboru zatím není možné z důvodu krátkého follow‑up, neboť je zřejmé, že některé projevy pozdní toxicity se mohou projevit s odstupem několika let. Zatím se neobjevily projevy vyššího stupně toxicity než G1, a to jak gastrointestinální, tak i genitourinární. Pouze u jedné pacientky byly překročeny toleranční limity na močový měchýř (92,6 Gy EQD2), ve všech ostatních případech byly limity u všech kritických orgánů dodrženy. Neočekáváme tedy výraznější projevy pozdní toxicity.
Za velmi významný prognostický faktor je považováno celkové trvání léčby [25,26], které by v optimálním případě nemělo být delší než osm týdnů (56 dnů), neboť jakékoliv prodloužení trvání léčby vede k poklesu lokální kontroly a přežití v průměru o 1 % na den [3,27,28]. V našem souboru byl medián celkového trvání léčby 45 dnů a u žádné pacientky nebylo trvání léčby delší než zmíněných 56 dnů (maximum bylo 52 dnů).
Při brachyterapii neoperovaných cervikálních karcinomů je možné použít několik druhů uterovaginálních aplikátorů. Základem každého z nich by měl být uterinní tandem a ten může být kombinovaný s vaginálními ovoidy, ringem nebo vaginálním cylindrem. Každý systém má určité preferenční indikace, výhody a nevýhody. Kupříkladu tandem s vaginálním cylindrem jsou vhodné pouze pro pacientky se stenózou horní části pochvy, způsobující neschopnost umístit ovoidy nebo ring, anebo pro případy s povrchovým postižením dolní části pochvy (mimo dosah ostatních aplikátorů), jehož tloušťka je menší než 5 mm. Tandem a ring zase vedou k poněkud užší dávkové distribuci než ovoidy a mohou také vést k vyšší vaginální dávce. Je to ovšem ideální technika pro pacientky s malými (vyrovnanými) poševními klenbami. Tandem a vaginální ovoidy se dobře hodí pro případy s barrel ‑ shaped děložním čípku [3].
Na našem pracovišti jsme v posledních 10 letech preferenčně používali tandem v kombinaci s ovoidy (MRI/ CT nekompatibilní), ale abychom byli schopni plánovat léčbu pomocí MRI vyšetření, pořídili jsme si kombinovaný intrakavitární a intersticiální aplikátor Vienna Ring, tvořený tandemem a ringem, který je MRI/ CT kompatibilní. Pro získání prvních zkušeností s 3D plánováním jsme ho zatím využívali pouze pro intrakavitární aplikace.
Tento kombinovaný intrakavitární a intersticiální brachyterapeutický aplikátor Vienna Ring byl vytvořen zejména pro objemné cervikální tumory přesahující 25 mm od osy v cervikálním kanále a 35 mm v rovině ringu [29], neboť tyto vzdálenosti již nemohou být pokryty pomocí samostatného intrakavitárního přístupu, bereme‑li do úvahy dávkové limity rizikových orgánů. V těchto situacích (obvykle tedy u pacientek s objemnými tumory v době brachyterapie, s objemnými stadii IIB/ IIIB s malou odpovědí v oblasti parametrií anebo v případě nepříznivé topografie) je vhodné využití kombinace intrakavitární brachyterapie s intersticiální aplikací titanových jehel [30]. Při použití jehel lze 100% izodózu posunout až na 35 mm od osy tandemu. Tento přístup dovoluje zvýšení pokrytí cílového objemu, léčeného objemu a celkové dávky bez zvýšení dávky v kritických strukturách. Vienna Ring aplikátor zajišťuje lepší kontrolu zavedení jehel než za pomoci jiných druhů aplikátorů, protože je zde kratší vzdálenost mezi ringem a cílovým objemem, což vede k přesnému a reprodukovatelnému zavedení [31]. Při použití tohoto aplikátoru slouží ring jako „templát“ a poskytuje fixní geometrii mezi tandemem a jehlami. V blízké budoucnosti samozřejmě také plánujeme využívat možnosti intersticiální aplikace jehel ke zlepšení konformity dávkové distribuce u indikovaných případů.
V budoucnu bude zřejmě také možné používat k plánování pomocí MRI vyšetření i jiné roviny než klasickou transverzální. Bylo totiž prokázáno, že paratransverzální MRI zobrazení děložního čípku (kolmé na dlouhou osu cervixu) je senzitivnější, specifičtější a přesnější v hodnocení patologického stadia než klasické zobrazení [32], a proto byly také provedeny pokusy o začlenění konturace cílového objemu v paratransverzální rovině. Petric et al [33] ve své práci popisují snazší pochopení prostorových vztahů mezi aplikátory a patologickými a anatomickými strukturami. Dokumentují rovněž výbornou „interobserver“ shodu a snazší konturaci. Nicméně pouze malá část plánovacích systémů v současné době umožňuje konturaci a plánování v jiné než transverzální rovině, proto nelze zatím tento přístup pokládat za standardní.
Závěr
Naše první zkušenosti na skromném souboru pacientek potvrzují předpoklad, že 3D plánování brachyterapie neoperovaných nádorů děložního hrdla s pomocí fúze MRI a CT vyšetření přináší jednoznačně možnost dávkové eskalace na oblast tumoru a významným způsobem šetří okolní rizikové orgány. Ve svém důsledku pak vede tento způsob plánování k lepší lokoregionální kontrole onemocnění a k nižší postradiační morbiditě.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 4. 8. 2013
Přijato: 5. 9. 2013
MUDr. Radovan Vojtíšek
Onkologická a radioterapeutická klinika LF UK a FN Plzeň
alej Svobody 80
340 60 Plzeň
e-mail: vojtisekr@fnplzen.cz
Zdroje
1. Dušek L, Mužík J, Kubásek M et al (eds). Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005]. Dostupný z: http:/ / www.svod.cz. Verze 7.0 [2007].
2. Mouková L, Nenutil R, Fabián P et al. Prognostické faktory karcinomu děložního hrdla. Klin Onkol 2013; 26(2): 83 – 90.
3. Viswanathan AN, Thomadsen B, American Brachytherapy Society Cervical Cancer Recommendations Committee et al. American Brachytherapy Society consensus guidelines for locally advanced carcinoma of the cervix. Part I: general principles. Brachytherapy 2012; 11(1): 33 – 46. doi: 10.1016/ j.brachy.2011.07.003.
4. Green JA, Kirwan JM, Tierney JF et al. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta‑analysis. Lancet 2001; 358(9284): 781 – 786.
5. Shin KH, Kim TH, Cho JK et al. CT ‑ guided intracavitary radiotherapy for cervical cancer: Comparison of conventional point A plan with clinical target volume‑based three ‑ dimensional plan using dose‑volume parameters. Int J Radiat Oncol Biol Phys 2006; 64(1): 197 – 204.
6. ICRU. Dose and volume specification for reporting intracavitary therapy in gynaecology. ICRU report 38. Bethesda: International Commission on Units and Measurements: 1985.
7. Onal C, Arslan G, Topkan E et al. Comparison of conventional and CT‑based planning for intracavitary brachytherapy for cervical cancer: target volume coverage and organs at risk doses. J Exp Clin Cancer Res 2009; 28 : 95. doi: 10.1186/ 1756 – 9966 – 28 – 95.
8. Pötter R, Dimopoulos J, Bachtiary B et al. 3D conformal HDR ‑ brachy ‑ and external beam therapy plus simultaneous cisplatin for high‑risk cervical cancer: clinical experience with 3 year follow‑up. Radiother Oncol 2006; 79(1): 80 – 86.
9. Pötter R, Dimopoulos J, Georg P et al. Clinical impact of MRI assisted dose volume adaptation and dose escalation in brachytherapy of locally advanced cervix cancer. Radiother Oncol 2007; 83(2): 148 – 155.
10. Dimopoulos JC, Lang S, Kirisits C et al. Dose‑volume histogram parameters and local tumor control in magnetic resonance image ‑ guided cervical cancer brachytherapy. Int J Radiat Oncol Biol Phys 2009; 75(1): 56 – 63. doi: 10.1016/ j.ijrobp.2008.10.033.
11. ICRU Report 50. Prescribing, recording and reporting photon beam therapy. Bethesda: International Commission for Radiation Units and Measurements, 1993 : 71.
12. ICRU Report 62. Prescribing, recording and reporting photon beam therapy (Suppl to ICRU Report 50). Bethesda: International Commission for Radiation Units and Measurements, 1999 : 52.
13. Lim K, Small W Jr, Portelance L et al. Consensus guidelines for delineation of clinical target volume for intensity ‑ modulated pelvic radiotherapy for the definitive treatment of cervix cancer. Int J Radiat Oncol Biol Phys 2011; 79(2): 348 – 355. doi: 10.1016/ j.ijrobp.2009.10.075.
14. Haie ‑ Meder C, Pötter R, Van Limbergen E et al. Gynaecological (GYN) GEC ‑ ESTRO Working Group. Recommendations from Gynaecological (GYN) GEC ‑ ESTRO Working Group (I): concepts and terms in 3D image based 3D treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV. Radiother Oncol 2005; 74(3): 235 – 245.
15. Pötter R, Haie ‑ Meder C, Van Limbergen E et al. GEC ESTRO Working Group. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): concepts and terms in 3D image‑based treatment planning in cervix cancer brachytherapy ‑ 3D dose volume parameters and aspects of 3D image‑based anatomy, radiation physics, radiobiology. Radiother Oncol 2006; 78(1): 67 – 77.
16. Viswanathan AN, Beriwal S, De Los Santos JF et al. American Brachytherapy Society consensus guidelines for locally advanced carcinoma of the cervix. Part II: high‑dose‑rate brachytherapy. Brachytherapy 2012; 11(1): 47 – 52. doi: 10.1016/ j.brachy.2011.07.002.
17. Lang S, Kirisits C, Dimopoulos J et al. Treatment planning for MRI assisted brachytherapy of gynecologic malignancies based on total dose constraints. Int J Radiat Oncol Biol Phys 2007; 69(2): 619 – 627.
18. Hanlon AL, Schultheiss TE, Hunt MA et al. Chronic rectal bleeding after high‑dose conformal treatment of prostate cancer warrants modification of existing morbidity scales. Int J Radiat Oncol Biol Phys 1997; 38(1): 59 – 63.
19. Storey MR, Pollack A, Zagars G et al. Complications from radiotherapy dose escalation in prostate cancer: preliminary results of a randomized trial. Int J Radiat Oncol Biol Phys 2000; 48(3): 635 – 642.
20. Doležel M, Vaňásek J, Odrážka K et al. The progress in the treatment of cervical cancer ‑ 3D brachytherapy CT/ MR‑based planning. Ceska Gynekol 2008; 73(3): 144 – 149.
21. Wachter ‑ Gerstner N, Wachter S, Reinstadler E et al. The impact of sectional imaging on dose escalation in endocavitary HDR ‑ brachytherapy of cervical cancer: results of a prospective comparative trial. Radiother Oncol 2003; 68(1): 51 – 59.
22. Souhami L, Seymour R, Roman TN et al. Weekly cisplatin plus external beam radiotherapy and high dose rate brachytherapy in patients with locally advanced carcinoma of the cervix. Int J Radiat Oncol Biol Phys 1993; 27(4): 871 – 878.
23. Morris M, Eifel PJ, Lu J et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para‑aortic radiation for high‑risk cervical cancer. N Engl J Med 1999; 340(15): 1137 – 1143.
24. Pearcey R, Brundage M, Drouin P et al. Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol 2002; 20(4): 966 – 972.
25. Chen SW, Liang JA, Yang SN et al. The adverse effect of treatment prolongation in cervical cancer by high‑dose‑rate intracavitary brachytherapy. Radiother Oncol 2003; 67(1): 69 – 76.
26. Fyles A, Keane TJ, Barton M et al. The effect of treatment duration in the local control of cervix cancer. Radiother Oncol 1992; 25(4): 273 – 279.
27. Girinsky T, Rey A, Roche B et al. Overall treatment time in advanced cervical carcinomas: a critical parameter in treatment outcome. Int J Radiat Oncol Biol Phys 1993; 27(5): 1051 – 1056.
28. Perez CA, Grigsby PW, Castro‑Vita H et al. Carcinoma of the uterine cervix. I. Impact of prolongation of overall treatment time and timing of brachytherapy on outcome of radiation therapy. Int J Radiat Oncol Biol Phys 1995; 32(5): 1275 – 1288.
29. Kirisits C, Lang S, Dimopoulos J et al. The Vienna applicator for combined intracavitary and interstitial brachytherapy of cervical cancer: design, application, treatment planning, and dosimetric results. Int J Radiat Oncol Biol Phys 2006; 65(2): 624 – 630.
30. Popowski Y, Hiltbrand E, Joliat D et al. Open magnetic resonance imaging using titanium ‑ zirconium needles: improved accuracy for interstitial brachytherapy implants? Int J Radiat Oncol Biol Phys 2000; 47(3): 759 – 765.
31. Dimopoulos JC, Kirisits C, Petric P et al. The Vienna applicator for combined intracavitary and interstitial brachytherapy of cervical cancer: clinical feasibility and preliminary results. Int J Radiat Oncol Biol Phys 2006; 66(1): 83 – 90.
32. Shiraiwa M, Joja I, Asakawa T et al. Cervical carcinoma: efficacy of thin‑section oblique axial T2 – weighted images for evaluating parametrial invasion. Abdom Imaging 1999; 24(5): 514 – 519.
33. Petric P, Dimopoulos J, Kirisits C et al. Inter ‑ and intraobserver variation in HR ‑ CTV contouring: intercomparison of transverse and paratransverse image orientation in 3D ‑ MRI assisted cervix cancer brachytherapy. Radiother Oncol 2008; 89(2): 164 – 171.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Druhé nádory – příčiny, incidence a budoucnost
- Cytokinové profily mnohočetného myelomu a Waldenströmovy makroglobulinemie
- Lymfomy se dvěma zásahy – přehled literatury a kazuistika
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Na MRI založené 3D plánování brachyradioterapie karcinomů děložního hrdla – naše zkušenosti s použitím uterovaginálního aplikátoru Vienna Ring MR‑ CT
- Editorial
- Významná protinádorová účinnost imatinibu u c-kit negativního gastrointestinálního stromálního tumoru – kazuistika
- Gastrointestinální stromální nádor žaludku s diseminací do kostí – kazuistika a přehled literatury
- Předávání znalostí na letní škole Regionálního centra aplikované molekulární onkologie v roce 2013
- Erratum
- Biosimilars (ne)jen v onkologii – dnešní realita i budoucnost
- Zajímavé případy z nutriční péče v onkologii
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
-
Onkologie v obrazech
Umělecké projevy toxicity protinádorové léčby - V lednu letošního roku zemřel ve vysokém věku doc. MUDr. Václav Bek, DrSc.
- Recenze knihy „Principy systémové protinádorové léčby“
- Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
- Druhé nádory – příčiny, incidence a budoucnost
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



