-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lymfomy se dvěma zásahy – přehled literatury a kazuistika
Double‑hit Lymphomas – Review of the Literature and Case Report
B‑lymphocytes are cells of the immune system responsible for the antibody ‑ mediated immune response. As estimated, a human body can produce as much as 1011 specific antibodies. There are no specific genes coding for every individual antibody in the human genome. Discrepancy between the huge diversity of antibodies and limited coding capacity of the genome is solved by combination of unique arrangement of genetic information for immunoglobulin and unique genetic and somatic processes providing this wide spectrum of antibodies. On one side, these mechanisms represent a life protecting source of a wide spectrum of antibodies but at the same time, they can be life threatening by raising the risk of a serious tumor disease, the B ‑ cell lymphoma. Double‑hit lymphomas represent a specific group of B ‑ cell lymphomas often featuring concurrent rearrangements of BCL2 and MYC genes. Activation of the MYC oncogene, typical for Burkitt lymphoma (BL), causes strong stimulation of cell proliferation. High activity of BCL ‑ 2, typical for follicular lymphoma, induces resistance to apoptosis. Concurrent damage of regulation of apoptosis and proliferation is probably responsible for the typical clinical manifestation of double‑hit lymphomas – aggressive course, resistance to conventional chemotherapy, high-risk of early relapse, short overall survival, frequent extranodal and central nervous system involvement. Recently, these lymphomas have attracted a strong attention of researchers as they provide sharp insights into processes of lymphocytes maturing and lymphomas development and highlight the double‑edged nature of mechanisms allowing the antibody broad diversity.
Case report:
Fifty ‑ three‑year ‑ old man was diagnosed with B ‑ cell lymphoma unclassifiable with features intermediate between diffuse large B ‑ cell lymphoma (DLBCL) and BL, based on morphology and immunophenotype. Fluorescent in situ hybridization analysis revealed double‑hit lymphoma diagnosis as the tumor cells bear t(14;18) translocation concurrently with the MYC gene rearrangement. The patient died five months after diagnosis.Key words:
B‑lymphocytes – antibody formation – B ‑ cell lymphoma – double‑hit lymphoma
This study was supported by grant of Internal Grant Agency of the Czech ministry of Health No. NT/13519-4/2012.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
2. 8. 2013Accepted:
11. 9. 2013
Autoři: J. Šmardová 1; M. Moulis 1; K. Lišková 1; J. Koptíková 2; R. Hrabálková 1; J. Klusáková 3
Působiště autorů: Ústav patologie, LF MU a FN Brno 1; Institut biostatiky a analýz, LF MU, Brno 2; MDgK‑ plus spol. s r. o., Újezd u Brna 3
Vyšlo v časopise: Klin Onkol 2014; 27(1): 24-32
Kategorie: Přehled
Souhrn
B lymfocyty jsou buňky imunitního systému zodpovědné především za specifickou, protilátkami zprostředkovanou imunitní odpověď. Odhaduje se, že lidský organizmus disponuje 1011 protilátkami s různou specifitou. V genomu neexistují specifické geny pro jednotlivé protilátky. Rozpor mezi obrovskou diverzitou protilátek a omezenou kódující kapacitou genomu je vyřešen kombinací unikátního uspořádání genetické informace pro imunoglobuliny a unikátními genetickými a somatickými procesy, které vytvoření tak širokého spektra různých protilátek zajistí. Tyto mechanizmy na jedné straně představují život ochraňující zdroj širokého spektra protilátek, na straně druhé představují život ohrožující riziko v podobě možnosti vývoje závažného nádorového onemocnění, B lymfomu. Lymfomy se dvěma zásahy tvoří mezi B lymfomy specifickou skupinu onemocnění. Nejčastěji nesou aberaci genů BCL2 a MYC. Důsledkem aktivace MYC, typické pro Burkittův lymfom (BL), je výrazná stimulace buněčného cyklu. Vysoká aktivita BCL2, typická pro folikulární lymfomy, způsobuje rezistenci k apoptóze. Paralelní závažné poškození regulace proliferace a apoptózy je příčinou charakteristických klinických projevů lymfomů se dvěma zásahy – velké agresivity, rezistence ke standardní terapii, vysokého rizika brzkého relapsu, krátkého celkového přežití, častého postižení extranodálních míst a centrální nervové soustavy. Lymfomy se dvěma zásahy v posledních letech přitahují velkou pozornost odborníků, mimo jiné proto, že přinášejí vhledy do procesu zrání lymfocytů a vývoje lymfomů a výrazně poukazují na dvousečnost mechanizmů umožňujících diverzifikaci protilátek.
Případ:
U 53letého muže byl na základě morfologických a imunofenotypických znaků diagnostikován B buněčný lymfom neklasifikovatelný, s rysy mezi difuzním velkobuněčným lymfomem (diffuse large B ‑ cell lymphoma – DLBCL) a BL. Cytogenetická analýza prokázala, že se jedná o lymfom se dvěma zásahy nesoucí translokaci t(14;18) a přestavbu MYC. Pacient zemřel pět měsíců po stanovení diagnózy.Klíčová slova:
B lymfocyty – tvorba protilátek – B lymfomy – lymfomy se dvěma zásahyÚvod
B lymfocyty jsou buňky imunitního systému zodpovědné především za specifickou, protilátkami zprostředkovanou imunitní odpověď. Odhaduje se, že každý lidský organizmus disponuje asi 1011 protilátkami s různou specifitou [1]. To je tak velký počet, že je vyloučené, aby pro každou z nich v genomu existoval specifický gen. Rozpor mezi obrovskou diverzitou protilátek a omezenou kódující kapacitou genomu je vyřešen kombinací unikátního uspořádání genetické informace pro imunoglobuliny a unikátními genetickými a somatickými procesy, které vytvoření tak širokého spektra různých protilátek zajistí. V lidském genomu jsou tři geny pro imunoglobulinové řetězce. Gen IGH na chromozomu 14 (14q32) kóduje těžký řetězec μ, IGK na chromozomu 2 (2p12) lehký řetězec κ a IGL na chromozomu 22 (22q11) lehký řetězec λ. Jedním zdrojem diverzity protilátek je uspořádání genů do tzv. genových segmentů V, D a J a možnost jejich přeskupování a kombinování. Dalšími jsou pak úpravy vazebných míst pro antigen mechanizmem somatických hypermutací a izotypové přepnutí. Tyto unikátní mechanizmy na jedné straně představují život ochraňující a život umožňující zdroj širokého spektra protilátek, na straně druhé představují život ohrožující riziko v podobě možnosti vývoje závažného nádorového onemocnění, B lymfomu.
Lymfomy se dvěma zásahy (double‑hit lymphomas – DHL) jsou specifickým typem B lymfomů. Vyznačují se vysokou agresivitou a rezistencí ke standardní terapii a v posledních letech přitahují velkou pozornost odborníků. Jejich studium přináší hluboké vhledy do procesu vývoje zdravých B lymfocytů i vývoje lymfomů. Mimo jiné proto, že právě lymfomy se dvěma zásahy zřetelně poukazují na dvousečnost mechanizmů umožňujících diverzifikaci protilátek.
Vývoj B lymfocytů
Prekurzory B lymfocytů vznikají dělením pluripotentní hematopoietické kmenové buňky (hematopoietic stem cells – HSC) v kostní dřeni [2]. Vývoj B lymfocytů lze rozdělit na tři fáze (obr. 1). První se uskutečňuje bez přítomnosti antigenu, ke druhé je zapotřebí antigenní stimulace, třetí fází je terminální stadium diferenciace aktivovaného B lymfocytu. Jednotlivé fáze diferenciace B lymfocytů se odehrávají v odlišných tělních kompartmentech a lze je sledovat na základě morfologických změn a také na základě změn exprese specifických membránových markerů [1,3].
Obr. 1. Vývoj B lymfocytu. Prekurzorový B lymfoblast v kostní dřeni prodělává přeskupování genových segmentů genů pro imunoglobuliny. Postupně zraje nezávisle na přítomnosti antigenu až do stadia nezralého B lymfocytu, který začíná exprimovat již přeskupený B buněčný receptor (BcR). Zralé B lymfocyty migrují krví do sekundárních lymfatických orgánů. Naivní B buňky osidlují primární lymfatické folikly a po aktivaci antigenem vytvářejí germinální centra. V germinálním centru podléhají B buňky somatickým hypermutacím variabilních úseků imunoglobulinů a izotypovému přepnutí. Vývoj B lymfocytu končí přeměnou na plazmatické buňky produkující protilátky a klidové paměťové buňky. Převzato a upraveno dle [3,37]. ![Vývoj B lymfocytu.
Prekurzorový B lymfoblast v kostní dřeni prodělává přeskupování genových segmentů genů pro imunoglobuliny. Postupně zraje nezávisle na přítomnosti antigenu až do stadia nezralého B lymfocytu, který začíná exprimovat již přeskupený B buněčný receptor (BcR). Zralé B lymfocyty migrují krví do sekundárních lymfatických orgánů. Naivní B buňky osidlují primární lymfatické folikly a po aktivaci antigenem vytvářejí germinální centra. V germinálním centru podléhají B buňky somatickým hypermutacím variabilních úseků imunoglobulinů a izotypovému přepnutí. Vývoj B lymfocytu končí přeměnou na plazmatické buňky produkující protilátky a klidové paměťové buňky. Převzato a upraveno dle [3,37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/981282a376267567148897ab793927c2.jpg)
První fáze vyzrávání B lymfocytů – bez přítomnosti antigenu – probíhá v kostní dřeni. V této fázi dochází k přeskupování genových segmentů – rekombinaci V(D)J – nejdříve těžkých a pak lehkých řetězců, za účasti RAG1 a 2. Nezralé B lymfocyty tak exprimují na svém povrchu přeskupený B buněčný receptor (BcR), nejdříve typu IgM, později IgD. Prostřednictvím BcR B lymfocyty rozpoznávají antigenní podněty. Rozpustné formy BcR fungují jako protilátky nacházející se v tělních tekutinách. Po přeskupení genových segmentů je selekčními procesy testována autoimunita a schopnost přežít v periferních lymfatických tkáních. Buňky s nefunkčními či autoreaktivními receptory jsou eliminovány apoptózou. Buňky, které projdou selekcí, dozrávají v naivní B buňky.
Druhá fáze vývoje B lymfocytů začíná vyplavováním naivních B buněk do krve, odkud se dostávají do periferních lymfatických orgánů (sleziny, lymfatických uzlin, tonzily a dalších), kde osidlují primární lymfoidní folikly. Tam se prostřednictvím folikulárních dendritických buněk (follicular dendritic cell – FDC) setkávají s antigeny a jsou pomocnými T buňkami aktivovány. Po aktivaci B buňky intenzivně proliferují a tvoří germinální (zárodečná) centra (GC). Primární folikly se tak přeměňují na folikly sekundární. V germinálních centrech probíhají dva klíčové procesy – 1. Dochází zde procesem řízeným antigeny k somatickým hypermutacím (somatic hypermutation – SHM) ve variabilních oblastech imunoglobulinů (IgV). Hypermutace zvyšují afinitu imunoglobulinu k příslušnému aktivujícímu antigenu. 2. Druhým klíčovým procesem je izotypové přepnutí (class ‑ switch recombination – CSR) neboli změna třídy imunoglobulinů, které se z původních IgM a IgD mění na IgG, IgA nebo IgE. Izotypové přepnutí zajistí, že budou produkovány protilátky různých tříd. Oba procesy – SHM i CSR – jsou spjaty s aktivací indukovanou cytidin deaminázou (activation‑induced cytidine deaminase – AID).
Vývoj B lymfocytu končí třetí fází, přeměnou na plazmatickou buňku, která produkuje protilátky, a vznikem paměťové buňky. Plazmatické buňky jako nejvýše diferencované B lymfocyty se opět nacházejí především v kostní dřeni [1,3,4].
Úloha germinálního centra v diferenciaci B lymfocytu
Germinální centra jsou vytvářena proliferujícími B buňkami ve foliklech periferních lymfoidních tkání (obr. 2). Mají specifickou strukturu. Tzv. tmavá zóna GC je tvořena rychle se dělícími centroblasty, u kterých dochází k somatickým hypermutacím. Klidové B buňky jsou vytlačovány těmi vysoce proliferujícími na periferii foliklu, kde tvoří tzv. plášťovou zónu. Světlá zóna GC je tvořena nedělícími se centrocyty, u kterých probíhá izotypové přepnutí. Postupně vznikají paměťové a plazmatické buňky. Proces SHM je spojen s vytvářením dvouřetězcových zlomů DNA a vede k jednonukleotidovým záměnám nebo krátkým delecím a inzercím v IgV oblastech imunoglobulinů. Proces CSR probíhá mechanizmem rekombinace DNA a nehomologního spojování konců DNA. Jak SHM, tak CSR jsou absolutně závislé na IAD. IAD katalyzuje cílenou deaminaci zbytků deoxycytidinů a jejich konverzi na uracil. To vede ke změně páru C : G na pár U : G [5 – 8].
Obr. 2. Mikroprostředí germinálního centra. B buňky aktivované antigenem diferencují v centroblasty, které klonálně expandují v tmavé zóně germinálního centra. Během proliferace probíhá proces somatických hypermutací (SHM). Centroblasty diferencují v centrocyty a přesunují se do světlé zóny, kde za pomoci T buněk a folikulárních dendritických buněk (FDC) dochází k selekci na základě vazby k imunizujícímu antigenu. Centrocyty, které produkují nevyhovující protilátky, vstupují do apoptózy, ostatní centrocyty procházejí procesem izotypového přepnutí (CSR) a dále diferencují v plazmatické a paměťové buňky. Převzato a upraveno dle [4]. ![Mikroprostředí germinálního centra.
B buňky aktivované antigenem diferencují v centroblasty, které klonálně expandují v tmavé zóně germinálního centra. Během proliferace probíhá proces somatických hypermutací (SHM). Centroblasty diferencují v centrocyty a přesunují se do světlé zóny, kde za pomoci T buněk a folikulárních dendritických buněk (FDC) dochází k selekci na základě vazby k imunizujícímu antigenu. Centrocyty, které produkují nevyhovující protilátky, vstupují do apoptózy, ostatní centrocyty procházejí procesem izotypového přepnutí (CSR) a dále diferencují v plazmatické a paměťové buňky. Převzato a upraveno dle [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/14519f2567c8b06a1b02db57804d89eb.jpg)
Diferenciace antigenem aktivovaných B buněk v centroblasty je spojena s dramatickým zvýšením proliferace. Zároveň je ale u těchto buněk na rozdíl od jiných intenzivně proliferujících buněk výrazně snížena citlivost k poškození DNA, tak aby byly tolerovány procesy související s vyzráváním – SHM a CRS. Centroblasty mají aktivní telomerázu, aby během klonální expanze B buněk v GC nebyl vyčerpán jejich replikační potenciál. Na druhé straně jsou tyto buňky silně citlivé k indukci apoptózy, např. vůbec neexprimují antiapoptotické geny BCL2. Klíčovým regulátorem fenotypu centroblastů v GC je protein BCL6. Funguje jako transkripční represor, který prostřednictvím svých cílových genů (např. p53, PIAS2, ATM, BCL2, BLIMP1) zajišťuje snížení vnímavosti buněk k indukci apoptózy, zástavě buněčného cyklu a citlivosti k poškození DNA. BCL6 se také podílí na regulaci aktivace B buněk a jejich diferenciace v paměťové buňky. BCL6 je tak skutečně klíčovým a hlavním efektorem vývoje B buněk v GC [4].
Vznik lymfomů
Protiváhou prospěšné a nezastupitelné úlohy germinálních center ve vyzrávání a rozrůzňování B lymfocytů je jejich úloha, kterou sehrávají při vývoji většiny typů B lymfomů. Obecně lze říci, že mnohé lymfomy vznikají právě v GC, a to kvůli chybám, ke kterým dochází během procesů somatických hypermutací a izotypového přepnutí. Tyto procesy jsou fyziologicky cíleny na IgV oblasti imunoglobulinových řetězců, ale mohou způsobit hypermutace nebo translokace i některých jiných genů, např. BCL6, MYC, BCL2, CCND1, NF‑κ B a dalších, a stát se tak příčinou vývoje některých nehodgkinských lymfomů [5 – 8]. Většina těchto lymfomů skutečně vykazuje mutovaný IgV, což jasně ukazuje, že jsou odvozeny z buněk, které prošly nebo procházely GC. Výjimkou jsou např. translokace t(14;18), které vedou k fúzi genu BCL2 a regulační sekvence genu IGH, spojené s vývojem folikulárního lymfomu (FL), a translokace t(8;14) spojené s endemickým typem Burkittova lymfomu (BL), které jsou pravděpodobněji výsledkem aberací, ke kterým dochází během V(D)J rekombinace, a tedy v pre‑GC buňkách.
Aberantní SHM zasahující neimunoglobulinové geny (např. MYC, PIM1, BCL6, PAX5 a další) jsou spojeny především s DLBCL. Až 30 % případů DLBCL nese chromozomální translokaci genu BCL6 (3q27), a to buď s některým genem pro imunoglobulinový řetězec, nebo s neimunoglobulinovým genem. Také translokace t(14;18) způsobující aktivaci BCL2, typická pro FL, je u DLBCL častá, vyskytuje se až u 30 % případů. Chromozomální translokace způsobující fúzi genu MYC s některým z genů pro imunoglobulin (IGH, IGL, IGK) se vyskytují téměř u všech případů BL, ale také asi u 10 % případů DLBCL. Pro lymfom z buněk plášťové zóny (mantle cell lymphoma – MCL) jsou typické translokace t(11;14), které vedou k translokaci genu CCND1 s genem IGH. Tyto typické chromozomální přestavby a hypermutace jsou nejenom charakteristické pro určité typy lymfomů, ale považují se také za změny primární, iniciující vývoj nádoru [4,9].
Lymfomy se dvěma zásahy
DHL tvoří specifickou skupinu onemocnění s charakteristickým klinickým chováním. Typické DHL nesou aberaci genu BCL2 a MYC. Důsledkem aktivace MYC, typické pro Burkittův lymfom, je výrazná stimulace buněčného cyklu. Vysoká aktivita BCL2, typická pro folikulární lymfomy, vede k výrazné rezistenci k apoptóze. Paralelní závažné poškození těchto dvou klíčových buněčných procesů je pravděpodobně příčinou charakteristických klinických projevů těchto lymfomů. Jsou velmi agresivní, rezistentní ke standardní terapii, s vysokým rizikem brzkého relapsu. Medián přežití je odhadován mezi 4,5 a 18,5 měsíci, tedy výrazně kratší než např. u BL a IPI odpovídajícího DLBCL. Typické je časté postižení extranodálních míst a postižení centrální nervové soustavy [10 – 12].
Definice DHL
Termín „lymfomy se dvěma zásahy“ není zcela jednoznačný. Původně se používal pro označení B lymfomů, které nesou zároveň přestavbu genu MYC a genu BCL2. V současnosti se označení DHL používá obecněji i pro další agresivní B lymfomy, které nesou přestavbu genu MYC v kombinaci s další či dalšími přestavbami jiných genů typickými pro lymfomy. Jsou to např. lymfomy nesoucí vedle přestavby genu MYC aberaci BCL6, BCL3 nebo CCND1, lymfomy se třemi zásahy MYC/ BCL2/ BCL6 a další varianty [11 – 13]. Někdy se označení DHL užívá ještě obecněji pro všechny B lymfomy, které nesou násobné přestavby [11].
„Klasické“ DHL nesou aberace MYC a BCL2. Morfologicky tyto lymfomy nesou často znaky jak BL, tak DLBCL. Podle poslední WHO klasifikace z roku 2008 existuje kategorie B buněčný lymfom neklasifikovatelný s rysy mezi DLBCL a BL (BCLU: B ‑ cell lymphoma, unclassifiable with features intermediate between DLBCL and BL) [14]. Řada případů DHL spadá právě do této kategorie a podle některých studií představují vysoký podíl BCLU [13,15,16]. Některé případy DHL jsou diagnostikovány jako DLBCL, mezi kterými mohou představovat 5 – 12 % případů [11,17,18]. BCLU a DLBCL nejsou jediné dvě kategorie, ve kterých lze DHL nalézat. Obecněji platí, že hranice mezi jednotlivými typy lymfomů nejsou ostré a zcela jasně vymezitelné. Naopak existuje plynulé spektrum případů od jasně vymezených a jednoznačně klasifikovatelných po nejrůznější nezařaditelné, netypické lymfomy se znaky více kategorií. DHL se nejčastěji nalézají právě v té „šedé zóně“ netypických lymfomů, ale mohou se rekrutovat téměř ze všech skupin lymfomů (obr. 3) [13].
Obr. 3. Šedá zóna netypických, neklasifikovatelných lymfomů. Potenciální zdroje a vývoj neklasifikovatelných lymfomů a lymfomů se dvěma zásahy. Převzato a upraveno dle [13]. ![Šedá zóna netypických, neklasifikovatelných lymfomů. Potenciální zdroje a vývoj neklasifikovatelných lymfomů a lymfomů se dvěma zásahy. Převzato a upraveno dle [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/19de4522aa000b3d5cb2a89a232e23d2.jpg)
Zajímavou okolností DHL je typ přestavby, který postihuje gen MYC. U BL je převážná většina případů (80 – 90 %) přestavby MYC typu t(8;14), tedy fúzí genu MYC s genem IGH pro těžký imunoglobulin μ; jen zbylých 10 – 20 % případů připadá na t(2;8) a t(8;22), tedy přestavby MYC s geny IGL a IGK pro lehké imunoglobulinové řetězce λ a κ. Pro BL je navíc typický jednoduchý karyotyp jen s malým množstvím dalších cytogenetických aberací. U DHL je v translokaci s genem MYC mnohem vyšší zastoupení genů pro lehké imunoglobulinové řetězce a také neimunoglobulinových genů [10,16,19]. Podstatně nižší zastoupení IGH v translokaci s MYC u DHL ve srovnání s BL může souviset s tím, že přestavbě MYC obvykle předchází jiná přestavba, nejčastěji lokusu BCL2 v translokaci t(14;18), v důsledku které je jedna alela IGH již přestavěna – „spotřebována“. Proto se následné translokace s MYC účastní geny ostatních imunoglobulinů [10,15]. Přitom není vyloučeno, že typ partnera v translokaci MYC může mít vliv na klinické chování onemocnění [16,19,20].
„Klasická“ varianta DHL – současná aberace MYC a BCL2 – je nejčastější, představuje asi 2/ 3 všech případů DHL. Kombinace aberace MYC a BCL6 je výrazně vzácnější, je detekovaná asi v 1/ 10 případů. Až 2násobně častější jsou THL (triple hit lymphoma) s kombinací aberací MYC/ BCL2/ BCL6 [11,17]. Podle některých studií se zdá, že specifické kombinace aberantních genů jsou spojeny se specificky odlišnými fenotypy onemocnění. Tak např. studie 23 vzácnějších případů DHL, které nesou přestavbu genů MYC a BCL6, ukázala, že se jedná o typicky agresivní lymfomy, často s postižením extranodálních míst a často s GC fenotypem, ale oproti DHL s aberacemi MYC/ BCL2 jsou cytologicky méně komplexní a mohou mít odlišný imunofenotyp [21].
DHL typu MCL
Svébytnou skupinu DHL tvoří lymfomy zahrnující přestavbu CCND1. Představují asi 10 % všech případů DHL [11]. Translokace t(11;14), která vede k přemístění genu CCND1 pod regulační sekvence genu IGH pro těžký imunoglobulinový řetězec a způsobí vysokou expresi cyklinu D1, je typickým molekulárním znakem MCL. Existují vzácné případy, kdy je namísto cyklinu D1 zvýšena exprese cyklinu D2 nebo D3 [22], a také případy, kdy je sice zvýšena hladina cyklinu D1, ale v důsledku jiné aberace než translokace t(11;14) [23]. Vysoká exprese cyklinu D1 (případně D2, D3) je považována za změnu, která iniciuje vývoj MCL, ale není změnou pro vývoj MCL dostatečnou. Účast sekundárních aberací je nezbytná. Až 5 % všech případů MCL nese vedle přestavby CCND1 přestavbu MYC [11]. Nedávno byla publikována práce, která podrobně představila čtyři nové případy tohoto typu a shrnula data již dříve publikovaných 26 případů [24]. Podle této studie se vždy jednalo o pokročilé stadium (stage IV) onemocnění MCL, nejčastěji blastoidní nebo pleomorfní varianty. Pacienti, často navzdory agresivní terapii, zemřeli nejčastěji během prvních dvou let po stanovení diagnózy. Pokud šlo o typ aberace postihující gen MYC, méně častá byla amplifikace, častější (18/ 30) byly translokace. Z nich asi ve třetině případů byl gen MYC translokován s IGH, v další třetině s IGL nebo IGK a třetina případů nesla translokaci MYC s jiným než imunoglobulinovým genem [24]. Ačkoliv jsou DHL typu MCL samy o sobě poměrně vzácné, nejsou vyloučeny ani případy, které nesou kombinaci aberace MYC a vzácnějšího typu aberace „MCL typu“, jako je např. aberace t(11;22)(q13;q11.2) genu CCND1 s IGL [25]. Tato přestavba genu pro cyklin D1 byla již dříve popsaná u MCL, který nebyl DHL [23].
Podobně byl popsán případ DHL, který měl vedle „obvyklé“ translokace t(8;14) velice ojedinělou translokaci t(12;14)(q24;q32) zahrnující na chromozomu 12 pravděpodobně gen BCL7A [26]. Translokace zahrnující gen BCL7A byla již dříve zachycena v buněčné linii odvozené z BL [27]. Ačkoliv buněčná funkce proteinu BCL7A zůstává zatím neznámá, jeho spojení s vývojem lymfomů, především DLBCL, prokázáno bylo [28,29]. Navíc byl gen BCL7A detekován mezi geny, které patří k velice účinným substrátům aktivované cytidin deaminázy AID [30]. Na tomto příkladu je ovšem dobře patrná jistá bezbřehost současného používání označení lymfomů se dvěma zásahy. Bylo prokázáno, že genů, které se mohou stát cílem působení AID a zároveň mají onkogenní potenciál, jsou tucty (obr. 4) [6]. Otázkou pak je, které geny zasažené translokací, hypermutacemi a dalšími aberacemi – vedle t(8;14) či jiné aberace „obvyklé“ u lymfomů – naplňují ještě kritérium DHL.
Obr. 4. Chromozomální translokace vyskytující se u B lymfomů. Kruhový diagram znázorňuje lidský genom s vyznačenými geny, které se účastní chromozomálních přestaveb u malignit odvozených z B buněk. Oblouky uvnitř diagramu spojují partnerské geny, které se v přestavbách vyskytují. Barevně jsou zvýrazněny geny a přestavby zmíněné v textu. Převzato a upraveno dle [6]. ![Chromozomální translokace vyskytující se u B lymfomů. Kruhový diagram znázorňuje lidský genom s vyznačenými geny, které se účastní chromozomálních přestaveb u malignit odvozených z B buněk. Oblouky uvnitř diagramu spojují partnerské geny, které se v přestavbách vyskytují. Barevně jsou zvýrazněny geny a přestavby zmíněné v textu. Převzato a upraveno dle [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0c09c8e62753edad40999780c37b7916.jpg)
Dynamika vývoje DHL
Za přestavbu genu MYC je nejčastěji zodpovědná AID během zrání lymfocytů v GC, zatímco přestavba BCL2 a CCND1 je obvykle zprostředkovaná RAG1 a RAG2 během V(D)J rekombinace v prekurzorových buňkách. To znamená, že vznik translokace t(14;18) předchází přestavbě genu MYC. Někdy bývá tento fakt i klinicky manifestován v podobě časově odlišitelných fází onemocnění, kdy je původně diagnostikovaný indolentní lymfom, nejčastěji FL, transformován na BCLU či obecně DHL [16,19,31 – 33].
Většina DH lymfomů (asi 80 %) jsou de novo případy bez předchozí historie indolentního lymfomu. I v takovém případě ale může být časová souslednost vzniku cytogenetických aberací patrná. Tak tomu bylo např. u pacientky, které byl diagnostikován lymfom podobný BL v čelisti a rameni. V nádorových buňkách byla prokázána přítomnost translokace genu BCL2 – t(14;18) – a amplifikace genu MYC. U téže pacientky byla v době diagnózy detekována infiltrace kostní dřeně, periferní krve a cerebrospinální tekutiny nádorovými buňkami, které morfologicky odpovídaly FL a nesly translokaci t(14;18), zatímco amplifikace genu c ‑ MYC u nich nalezena nebyla [34]. Dynamika procesu vývoje DHL se může vzácně manifestovat také ve struktuře nádorové tkáně. Byl popsán DHL, v jehož tkáni se vyskytovala ohniska BL spojeného s translokací MYC na pozadí FL. Zatímco translokace t(14;18) byla přítomna ve všech oblastech nádorové tkáně, translokace genu MYC byla detekována pouze v ohniscích BL [33]. Podobně heterologní struktura nádorové tkáně byla popsána také u případu DHL typu MCL. Lymfatická uzlina, v níž byly zřetelné oblasti nádorové tkáně s obvyklým typem MCL, byla difuzně infiltrovaná tkání morfologicky a imunofenotypicky odpovídající BL včetně toho, že v těchto úsecích nádoru, na rozdíl od původní MCL tkáně, bylo možné metodou FISH detekovat přestavbu genu MYC. Translokace t(11;14) byla přítomna ve všech nádorových buňkách [35].
U DHL, které nesou aberace genu MYC spolu s aberacemi BCL6, BCL3 a dalších genů, je o dynamice jejich vývoje známo mnohem méně. O těchto genech se předpokládá, že jejich aberace jsou zprostředkovány stejným mechanizmem – aktivací indukovanou cytidin deaminázou – a tak je mnohem těžší předjímat, v jakém pořadí vznikají a jak se navzájem ovlivňují [11].
Kazuistika
U muže ve věku 53 let byla v srpnu 2012 na Chirurgickém oddělení Městské nemocnice v Hustopečích provedena probatorní biopsie infiltrátu mezenteria při explorativní laparotomii. Materiál byl s klinickou diagnózou Sarkoma radicis mesenterii inoper. generalisatum odeslán do Bioptické a cytologické laboratoře MDgK ‑ plus spol. s r. o. Újezd u Brna, kde byl stanoven předběžný závěr, že se jedná o lymfom. Materiál byl v září 2012 odeslán ke druhému čtení a další analýze do Ústavu patologie FN Brno‑Bohunice.
Nádor měl některé morfologické a imunofenotypické znaky jak Burkittova lymfomu, tak difuzního velkobuněčného B lymfomu. Byl tvořen mírně polymorfní populací středně velkých a velkých buněk převážně centroblastického vzhledu. Nádorové buňky byly mitoticky vysoce aktivní a vykazovaly extrémně vysokou proliferační aktivitu dle Ki67 (90 – 100 %). Navíc četné nádorové buňky procházely apoptózou. Úsekovitě byl naznačen obraz hvězdného nebe. Imunohistochemicky byla v nádorových buňkách prokázána difuzní silná pozitivita CD79a a také difuzní silná pozitivita BCL2 (obr. 5). Dále nádorové buňky exprimovaly CD10 při negativitě BCL6. Závěrečná diagnóza podle WHO klasifikace zněla – B buněčný lymfom neklasifikovatelný s rysy mezi DLBCL a BL, s tím, že je nutné zvážit možnost, zda se nejedná o lymfom se dvěma zásahy. Následovaly proto molekulárně biologické analýzy, jejichž cílem bylo vyšetřit aberace genů BCL2 a MYC.
Obr. 5. Nádorová tkáň prezentovaného případu vykazuje morfologické a imunofenotypické znaky jak Burkittova lymfomu, tak difúzního velkobuněčného B lymfomu. Je tvořena mírně polymorfní populací středně velkých a velkých buněk převážně centroblastického vzhledu, úsekovitě je naznačen obraz hvězdného nebe (A); nádorové buňky vykazují proliferační aktivitu 90–100 % dle Ki67 (B), difuzní silnou pozitivitu BCL-2 (C) a CD79a (D). 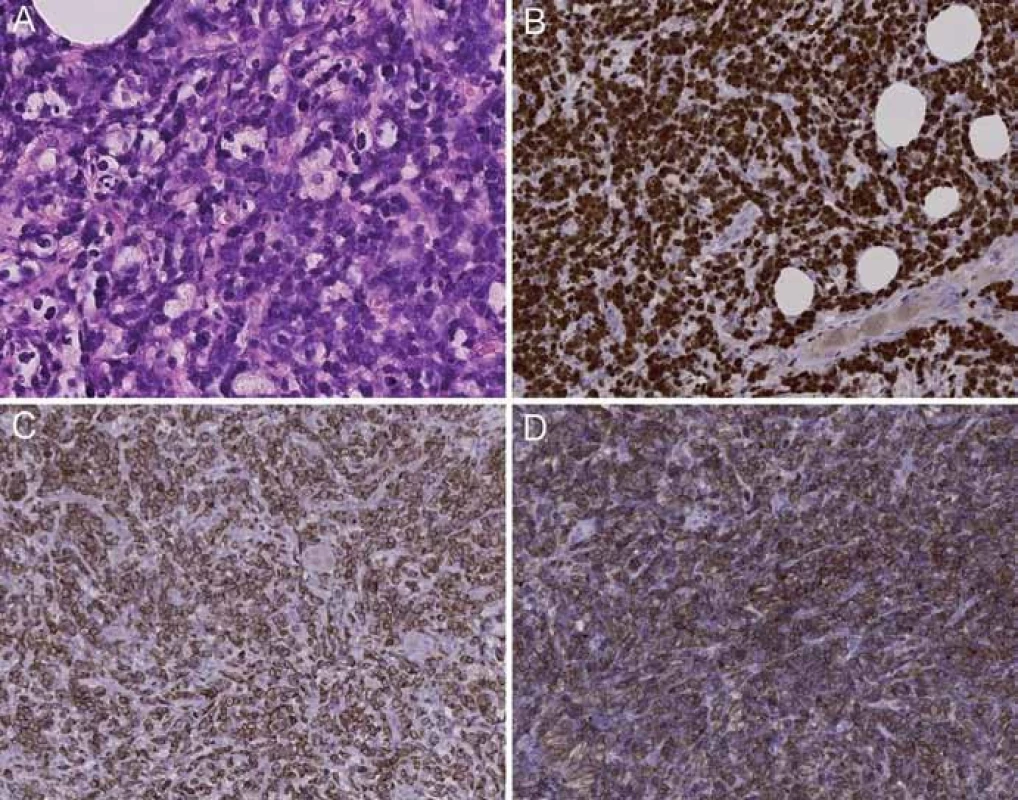
Byla provedena fluorescenční hybridizace in situ (FISH), detekující translokaci t(14;18) s využitím dvoubarevné fúzní sondy IgH/ BCL2 (Vysis – ABBOTT). Výsledek byl jednoznačně pozitivní, translokace byla detekována v 77 % vyšetřených buněčných jader (obr. 6). Dále byla provedena FISH využívající dvoubarevnou fúzní sondu IgH/ MYC (Vysis – ABBOTT) detekující translokaci t(8;14). Výsledek byl negativní, fúzní signál byl zaznamenán pouze u 1 % vyšetřených jader. Proto byla následně provedena další analýza, využívající zlomovou sondu (break ‑ apart rearrangement probe), která detekuje přestavbu genu MYC – lokusu 8q24, aniž by identifikovala partnerský gen, který se translokace účastní. Výsledek byl pozitivní, přestavbu obsahovalo 28 % jader (obr. 6). Výsledky analýz FISH jednoznačně potvrdily, že se jedná o lymfom se dvěma zásahy, který nese translokaci genu BCL2 i translokaci genu MYC.
Obr. 6. Fluorescenční hybridizace <em>in situ</em>. Translokace t(14;18) byla detekována využitím dvoubarevné fúzní sondy <em>IGH/BCL2</em> v 77 % vyšetřených buněčných jader (A); translokace t(8;14) byla pomocí fúzní sondy <em>IGH/MYC</em> nalezena jen u 1 % jader; přestavba genu <em>MYC</em> – lokusu 8q24 – byla detekována využitím zlomové sondy ve 28 % jader (C). 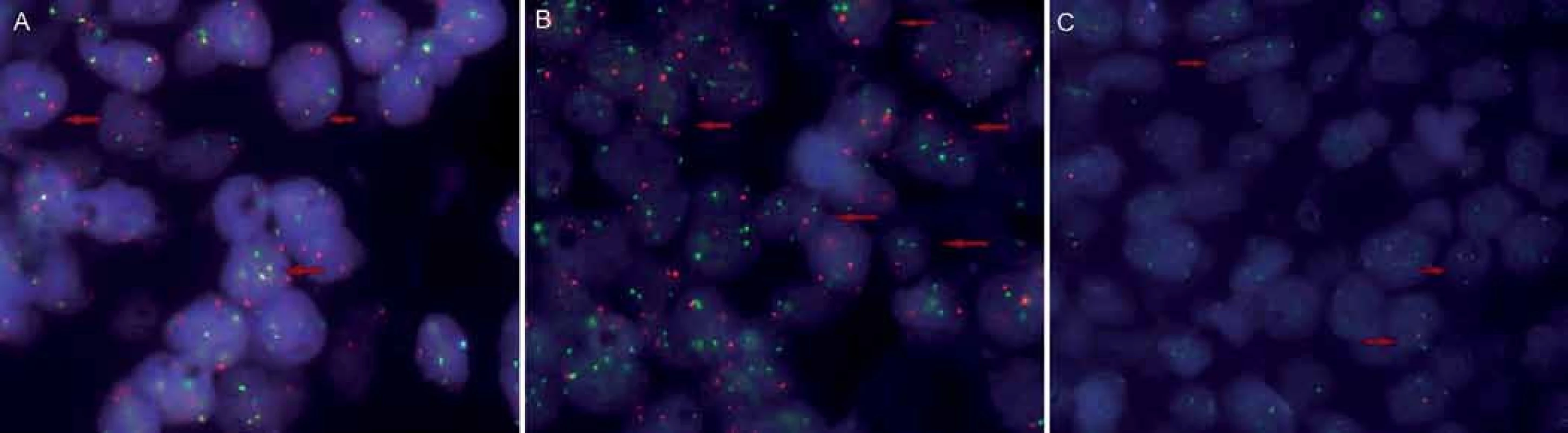
Průběh nemoci poukazoval na to, že lymfom je chemorezistentní. Navzdory intenzivní chemoterapii (R ‑ CODOX ‑ M) onemocnění progredovalo a pacient zemřel v lednu 2013.
Diskuze
Prezentovaný případ patří k nejtypičtější formě lymfomu se dvěma zásahy – nese translokaci genu BCL2 a genu MYC. Translokace BCL2 byla prokázána u 77 % nádorových buněk, zatímco translokace MYC se vyskytovala u výrazně nižšího podílu nádorových buněk – 28 %. Ačkoliv morfologicky či fenotypicky nádorová tkáň nejevila známky heterologní struktury, výsledky FISH naznačují možnost, že translokace BCL2 byla ve vývoji tohoto lymfomu změnou primární, po které následovala jako sekundární změna translokace genu MYC. Taková možnost je v naprostém souladu jak s literárními prameny, tak se současnou představou o vývoji DHL typu BCL2/ MYC [16,19,31 – 34]. Podobně je v souladu se současnými poznatky fakt, že gen MYC není translokován s lokusem genu IGH pro těžký imunoglobulin μ, ale buď s genem IGK pro lehký imunoglobulinový řetězec κ, IGL pro lehký imunoglobulinový řetězec λ nebo s neimunoglobulinovým genem [10,16,19]. Typické znaky DHL naplnil náš případ také svou morfologií a imunofenotypem, kdy měl znaky na rozhraní Burkittova lymfomu a difuzního velkobuněčného B lymfomu, a také průběhem onemocnění – chemorezistencí a krátkým celkovým přežitím.
Závěr
Pomocí metody FISH jsme jednoznačně potvrdili navrženou diagnózu – lymfom se dvěma zásahy – a prokázali souběžnou přestavbu antiapoptotického genu BCL2 a genu MYC, který kóduje induktor proliferace. Metoda FISH či jiná cytogenetická analýza je v diagnostice DHL naprosto nezastupitelná, bez těchto analýz nelze DHL jednoznačně diagnostikovat. Zdá se, že v současnosti představují DHL spíše podhodnocenou kategorii lymfomů, protože bez cílené detekce aberací klíčových genů, především MYC, BCL2, BCL6, BCL3 a CCND1, zůstávají DHL často nerozpoznány.
Přesná diagnóza DHL je důležitá. DHL jsou velmi agresivní lymfomy, rezistentní ke standardní terapii, s vysokým rizikem brzkého relapsu a krátkým celkovým přežitím, s častým postižením extranodálních míst a centrální nervové soustavy. Velkou výzvou v oblasti DHL zůstává nalezení účinné terapie [11,12,18,31,36].
Double‑Hit Lymphoma ≈ Double‑Edged Sword!
Unikátní mechanizmy somatických hypermutací a izotypového přepnutí imunoglobulinů během vyzrávání B lymfocytů představují na jedné straně život umožňující zdroj širokého spektra protilátek, na straně druhé život ohrožující riziko v podobě možnosti vývoje B lymfomů. B buňky platí vysokou cenu za to, že mohou využívat AID a tvořit dvouřetězcové zlomy – asi 95 % všech lidských lymfomů je odvozeno od B buněk. Výhody ale převažují. Efektivní ochrana proti patogenním infekcím je pro přežití druhu mnohem kritičtější než perfektní ochrana proti pomalé akumulaci genomové nestability, která u některých jedinců vede k vývoji nádoru [7].
Tato práce byla podpořena grantem IGA MZ ČR č. NT/13519-4/2012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 2. 8. 2013
Přijato: 11. 9. 2013
prof. RNDr. Jana Šmardová, CSc.
Ústav patologie
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: janasmarda@seznam.cz
Zdroje
1. Krejsek J, Kopecký O. B lymfocyty a protilátková imunita. In: Krejsek J, Kopecký O (eds). Klinická imunologie. 1. vyd. NUCLEUS HK 2004 : 241 – 270.
2. Nagasawa T. Microenvironmental niches in the bone marrow required for B ‑ cell development. Nat Rev Immunol 2006; 6(2): 107 – 116.
3. Jares P, Colomer D, Campo E. Genetic and moleular pathogenesis of mantle cell lymphoma: perspectives for new targeted therapeutics. Nat Rev Cancer 2007; 7(10): 750 – 762.
4. Klein U, Dalla ‑ Favera R. Germinal centres: role in B ‑ cell physiology and malignancy. Nat Rev Immunol 2008; 8(1): 22 – 33.
5. Di Noia JM, Neiberger MS. Molecular mechanisms of antibody somatic hypermutation. Annu Rev Biochem 2007; 76 : 1 – 22.
6. Robbiani DF, Nussenzweig MC. Chromosome translocation, B cell lymphoma, and activated‑induced cytidine deaminase. Annu Rev Pathol 2013; 8 : 79 – 103.
7. Wang JH. The role of activation‑induced deaminase in antibody diversification and genomic instability. Immunol Res 2013; 55(1 – 3): 287 – 297.
8. Keim C, Kazadi D, Rothschild G et al. Regulation of AID, the B ‑ cell genome mutator. Genes Dev 2013; 27(1): 1 – 17.
9. Vega F, Medeiros LJ. Chromosomal translocations involaved in non‑Hodgkin lymphomas. Arch Pathol Lab Med 2003; 127(9): 1148 – 1160.
10. Tomita N, Tokunaka M, Nakamura N et al. Clinicopathological features of lymphoma/ leukemia patients carrying both BCL2 and MYC translocations. Haematologica 2009; 94(7): 935 – 943.
11. Aukema SM, Siebert R, Schuuring E et al. Double‑hit B ‑ cell lymphomas. Blood 2011; 117(8): 2319 – 2331.
12. Lindsley RC, LaCasce AS. Biology of double‑hit B ‑ cell lymphomas. Curr Opin Hematol 2012; 19(4): 299 – 304.
13. Salaverria I, Siebert R. The gray zone between Burkitt’s lymphoma and diffuse large B ‑ cell lymphoma from genetics perspective. J Clin Oncol 2011; 29(14): 1835 – 1843.
14. Kluin P, Harris N, Stein H et al. B ‑ cell lymphoma, unclassifiable, with features intermediate between diffuse large B ‑ cell lymphoma and Burkitt’s lymphoma. In: Swerdlow SH, Campo E, Harris NL (eds). WHO, Classification of tumors of haematopoietic, lymphoid tissues. 4th ed. Lyon: IARC Press 2008 : 265 – 266.
15. Foot NJ, Dunn RG, Geoghegan H et al. Fluorescence in situ hybridisation analysis of formalin‑fixed paraffin‑embedded tissue sections in the diagnostic work ‑ up of non‑Burkitt high grade B ‑ cell non‑Hodgkin’s lymphoma: a single centre’s experience. J Clin Pathol 2011; 64(9): 802 – 808.
16. Pedersen MO, Gang AO, Poulsen TS et al. Double‑hit BCL2/ MYC translocations in a consecutive cohort of patients with large B ‑ cell lymphoma – a single centre’s experience. Eur J Haematol 2012; 89(1): 63 – 71.
17. Barrans S, Crouch S, Smith A et al. Rearrangement of MYC is associated with poor prognosis in patients with diffuse large B ‑ cell lymphoma treated in the era of rituximab. J Clin Oncol 2010; 28(20): 3360 – 3365.
18. Kobayashi T, Tsutsumi Y, Sakamoto N et al. Double‑hit Lymphomas constitute a highly a ggressive subgroup in diffuse large B ‑ cell lymphomas in the era of rituximab. Jpn J Clin Oncol 2012; 42(11): 1035 – 1042.
19. Johnson NA, Savage KJ, Ludkovski O et al. Lymphomas with concurrent BCL2 and MYC translocations: the critical factors associated with survival. Blood 2009; 114(11): 2273 – 2279.
20. Hummel M, Bentink S, Berger H et al. A biological definition of Burkitt’s lymphoma from transcriptional and genomic profiling. N Engl J Med 2006; 354(23): 2419 – 2430.
21. Pillai RK, Sathanoori M, Van Oss SB et al. Double‑hit B ‑ cell lymphomas with BCL6 and MYC translocations are aggressive, frequently extranodal lymphomas distinct from BCL2 double‑hit lymphomas. Am J Surg Pathol 2013; 37(3): 323 – 332.
22. Salaverria I, Royo C, Carvajal ‑ Cuenca A et al. CCND2 rearrangements are the most frequent genetic events in cyclin D1 – mantle cell lymphoma. Blood 2013; 121(8): 1394 – 1402.
23. Rocha CK, Praulich I, Gehrke I et al. A rare case of t(11;22) in a mantle cell lymphoma like B ‑ cell neoplasia resulting in a fusion of IGL and CCND1: case report. Mol Cytogenet 2011; 4(1): 8 – 12.
24. Setoodeh R, Schwartz S, Papenhausen P et al. Double‑hit mantle cell lymphoma with MYC gene rearrangement or amplification: a report of four cases and review of the literature. Int J Clin Exp Pathol 2013; 6(2): 155 – 167.
25. Delas A, Dobbelstein S, Brousset P et al. Unusual concomitant rearrangements of Cyclin D1 and MYC genes in blastoid variant of mantle cell lymphoma: Case report and review of literature. Pathol Res Pract 2013; 209(2): 115 – 119.
26. Yamazaki T, Ohno H. Double‑hit lymphoma with t(8;14)(q24;q32) and t(12;14)(q24;q32) chromosamal translocations. Intern Med 2011; 50(21): 2659 – 2662.
27. Nacheva E, Fischer P, Karpas A et al. Complex translocation t(8;12;14) in a cell line derived from a child with nonendemic Burkitt‑type acute lymphoblastic leukemia. Cancer Genet Cytogenet 1987; 28(1): 145 – 153.
28. Blenk S, Engelmann J, Weniger M et al. Germinal center B cell‑like (GCB) and activated B ‑ cell‑like (ABC) type of diffuse large B cell lymphoma (DLBCL): analysis of molecular predictors, signatures, cell cycle state and patient survival. Cancer Informatics 2007; 3 : 399 – 420.
29. Morton LM, Purdue MP, Zheng T et al. Risk of non‑Hodgkin lymphoma associated with germline variation in genes that regulate the cell cycle, apoptosis, and lymphocyte development. Cancer Epidemiol Biomarkers Prev 2009; 18(4): 1259 – 1270.
30. Kato L, Begum NA, Burroughs AM et al. Nonimmunoglobulin target loci of activation‑induced cytidine deaminase (AID) share unique features with immunoglobulin genes. Proc Natl Acad Sci USA 2012; 109(7): 2479 – 2484.
31. Parker SM, Olteanu H, VanTuinen P et al. Follicular lymphoma transformation to dual translocated Burkitt‑like lymphoma: improved disease control associated with radiation therapy. In J Haematol 2009; 90(5): 616 – 622.
32. Xu X, Zhang L, Wang Y et al. Double‑hit nd triple ‑ hit lymphomas arising from follicular lymphoma following acquisition of MYC: report of two cases and litarture review. Int J Clin Exp Pathol 2013; 6(4): 788 – 794.
33. Hwang YY, Loong F, Chung LP et al. Atypical burkitt’s lymphoma transforming from follicular lymphoma. Diagn Pathol 2011; 6 : 63 – 69.
34. Kobayashi H, Ichikawa M, Hangaiashi A et al. Concurrent development of the „Burkitt‑like“ lymphoma and BCL ‑ 2 - rearranged low ‑ grade B cell lymphoma sharing the same germinal center origin. Int J Hematol 2011; 93(1): 112 – 117.
35. Felten CL, Stephenson CF, Ortiz RO et al. Burkitt transformation of mantle cell lymphoma. Leuk Lymph 2004; 45(10): 2143 – 2147.
36. Friedberg JW. Double‑hit diffuse large B ‑ cell lymphoma. J Clin Oncol 2012; 30(28): 3439 – 3443.
37. LeBien TW, Tedder TF. B lymphocytes: how they develop and function. Blood 2008; 112(5): 1570 – 1580.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Druhé nádory – příčiny, incidence a budoucnost
- Cytokinové profily mnohočetného myelomu a Waldenströmovy makroglobulinemie
- Lymfomy se dvěma zásahy – přehled literatury a kazuistika
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Na MRI založené 3D plánování brachyradioterapie karcinomů děložního hrdla – naše zkušenosti s použitím uterovaginálního aplikátoru Vienna Ring MR‑ CT
- Editorial
- Významná protinádorová účinnost imatinibu u c-kit negativního gastrointestinálního stromálního tumoru – kazuistika
- Gastrointestinální stromální nádor žaludku s diseminací do kostí – kazuistika a přehled literatury
- Předávání znalostí na letní škole Regionálního centra aplikované molekulární onkologie v roce 2013
- Erratum
- Biosimilars (ne)jen v onkologii – dnešní realita i budoucnost
- Zajímavé případy z nutriční péče v onkologii
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
-
Onkologie v obrazech
Umělecké projevy toxicity protinádorové léčby - V lednu letošního roku zemřel ve vysokém věku doc. MUDr. Václav Bek, DrSc.
- Recenze knihy „Principy systémové protinádorové léčby“
- Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
- Druhé nádory – příčiny, incidence a budoucnost
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



