-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
High-dose Interferon Alpha in Treatment of Patients with Malignant Melanoma, Monitoring of Predictive and Prognostic Biomarkers
Backrounds:
The incidence of malignant melanoma is increasing by about 2–5% per year, exceeding an incidence of all other tumors. Adjuvant immunotherapy with high-dose interferon (HDI) as per the ECOG 1684 trial Kirkwood’s schema is still recommended as a standard. HDI should be started within 60 days after a surgical procedure. Meaningful adjuvant immunotherapy is based on radical surgical excision, an investigation of the sentinel node and regional lymph node dissection, if indicated. Current research aims to utilize routinely usable biomarkers in order to define patients who would explicitly profit from HDI.Design:
The authors present a review of HDI trials, focusing on the management of adverse effects of HDI and on biomarkers. This review also discusses the initial own experiences at the Oncology Centre in Hradec Králové.Conclusion:
Malignant melanoma is a very immunogenic tumour. Immunotherapy with HDI is considered to be the only therapeutic modality so far that has been proven to prolong relapse-free survival and overall survival (in short-time criterion) in adjuvant setting. However, the results of these trials are inconsistent and particular biomarkers of therapeutic response have not been defined yet.Key words:
malignant melanoma – immunotherapy – high-dose interferon – prognostic and predictive factors – serum VEGF
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: J. Vaňásková; J. Grim; J. Kopecký; E. Kubala; S. Filip
Působiště autorů: Klinika onkologie a radioterapie, LF UK a FN Hradec Králové
Vyšlo v časopise: Klin Onkol 2011; 24(3): 180-186
Kategorie: Přehledy
Souhrn
Východiska:
Incidence maligního melanomu stoupá o 2–5 % ročně, což přesahuje nárůst výskytu všech ostatních nádorů. Za doporučovaný standard adjuvantní léčby se stále považuje imunoterapie vysokodávkovaným interferonem (HDI) v klasickém Kirkwoodově schématu dle studie ECOG 1684. Základním předpokladem smysluplné adjuvantní imunoterapie je radikální chirurgické odstranění primárního nádoru, vyšetření sentinelové uzliny, event. exenterace spádových uzlin a zahájení HDI do 60 dnů od chirurgického výkonu. Předmětem současného výzkumu je definování populace pacientů, kteří by z HDI jednoznačně profitovali – na základě rutinně použitelných biomarkerů.Cíl:
V následujícím přehledovém článku autoři předkládají přehled jednotlivých studií s vysokodávkovaným interferonem. Dále je věnována pozornost managementu nežádoucích účinků a sledování biomarkerů na základě vlastních prvních zkušeností.Závěr:
Maligní melanom je velmi imunogenní nádor. Imunoterapie HDI je doposud jedinou terapeutickou modalitou pro adjuvantní léčbu, která prokázala prodloužení doby bez znovuobjevení se choroby (relaps-free survival, RFS) a krátkodobě i celkového přežití (overall survival, OS). Výsledky studií jsou přesto nekonzistentní, konkrétní biomarkery terapeutické odpovědi prozatím nebyly definovány.Klíčová slova:
maligní melanom – imunoterapie – high-dose interferon – prognostické a prediktivní faktory – sérový VEGFÚvod
Maligní melanom je onemocnění kůže vznikající maligní transformací kožních melanocytů. Jeho incidence stoupá o 2–5 % ročně, což přesahuje nárůst výskytu všech ostatních nádorů. Je geograficky odlišná, v České republice se pohybuje okolo 10/100 000 [1]. Klinicky a histologicky rozlišujeme několik typů maligního melanomu – povrchově se šířící, nodulární, lentigo maligna a akrolentiginózní formu. V nádorovém ložisku se často nachází mimo jiné denzní lymfocytární infiltrát.
Chirurgické odstranění primárního ložiska v časném stadiu má zásadní kurativní postavení. Prognosticky má význam zhodnocení vertikálního růstu dle Breslowa, určení ulcerace primárního nádoru a stagingové vyšetření sentinelové uzliny (SN), což prokázaly i velké multicentrické studie [2,3].
Jako rizikové definujeme melanomy s tloušťkou > 2 mm, úrovní invaze > III (invaze na rozhraní str. papilare a str. reticulare a hlouběji), s přítomností in-tranzitních metastáz (regionální metastázy v kůži lokalizované od 2 cm od primárního ložiska do první drénující uzliny) v čase diagnózy primárního ložiska, s klinicky zjevnými metastázami do uzlin, s rekurencí do uzlin nebo s postiženými uzlinami a neznámým primárním ložiskem. Dle AJCC tvoří cílovou skupinu adjuvantní terapie pacienti stadia IIb, IIc a III (tj. pT3 1,5–4 mmN0M0, pT4 více než 4 mm nebo satelitní metastázy do 2 cm od primárního ložiska, N0M0, event. N1-2, tj. regionální metastázy do 3 cm nebo větší než 3 cm, M0).
Imunoterapie v adjuvantní léčbě maligního melanomu
Maligní melanom je nejvíce imunogenním lidským nádorem. Pozorované spontánní regrese inspirovaly k imunoterapii.
V roce 1995 Food and Drug Administration Company (FDA) schválila interferon alfa2b jako první agens pro adjuvantní léčbu maligního melanomu. Jeho účinnost byla hodnocena mj. čtyřmi velkými multicentrickými randomizovanými European Cooperative Oncology Group (ECOG) a Intergroup studiemi (E1684, E1690, E1694, E2696) – viz tab. 1, kterých se od roku 1980 zúčastnilo více než 2 000 pacientů. Ve všech prokázal interferon alfa2b ve vysokodávkovaném podání snížení rizika rekurence tohoto onemocnění (z 38 % na 24 %), prodloužení RFS a ve dvou studiích bylo prokázáno prodloužení OS [4–6]. Přestože souhrnná analýza toto nepotvrdila, krátkodobé prodloužení OS – v horizontu dvou let – je pro pacienty s vysokým rizikem rekurence významné měřítko. Studie s HDI byly provedeny i pro paliativní a neoadjuvantní léčbu (tab. 2 a 3).
Tab. 1. Přehled studií zabývajících se HDI v adjuvantní léčbě. 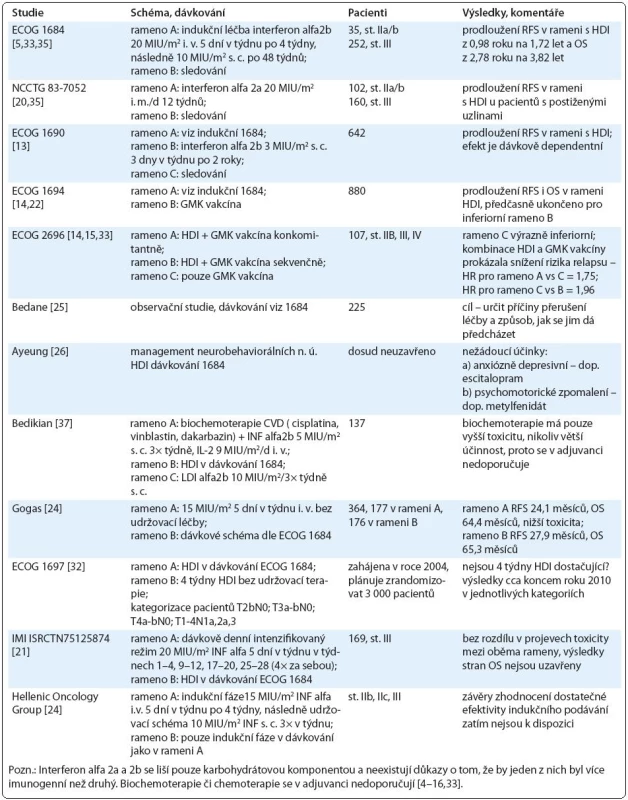
Tab. 2. Přehled studií zabývajících se HDI v paliativní léčbě. 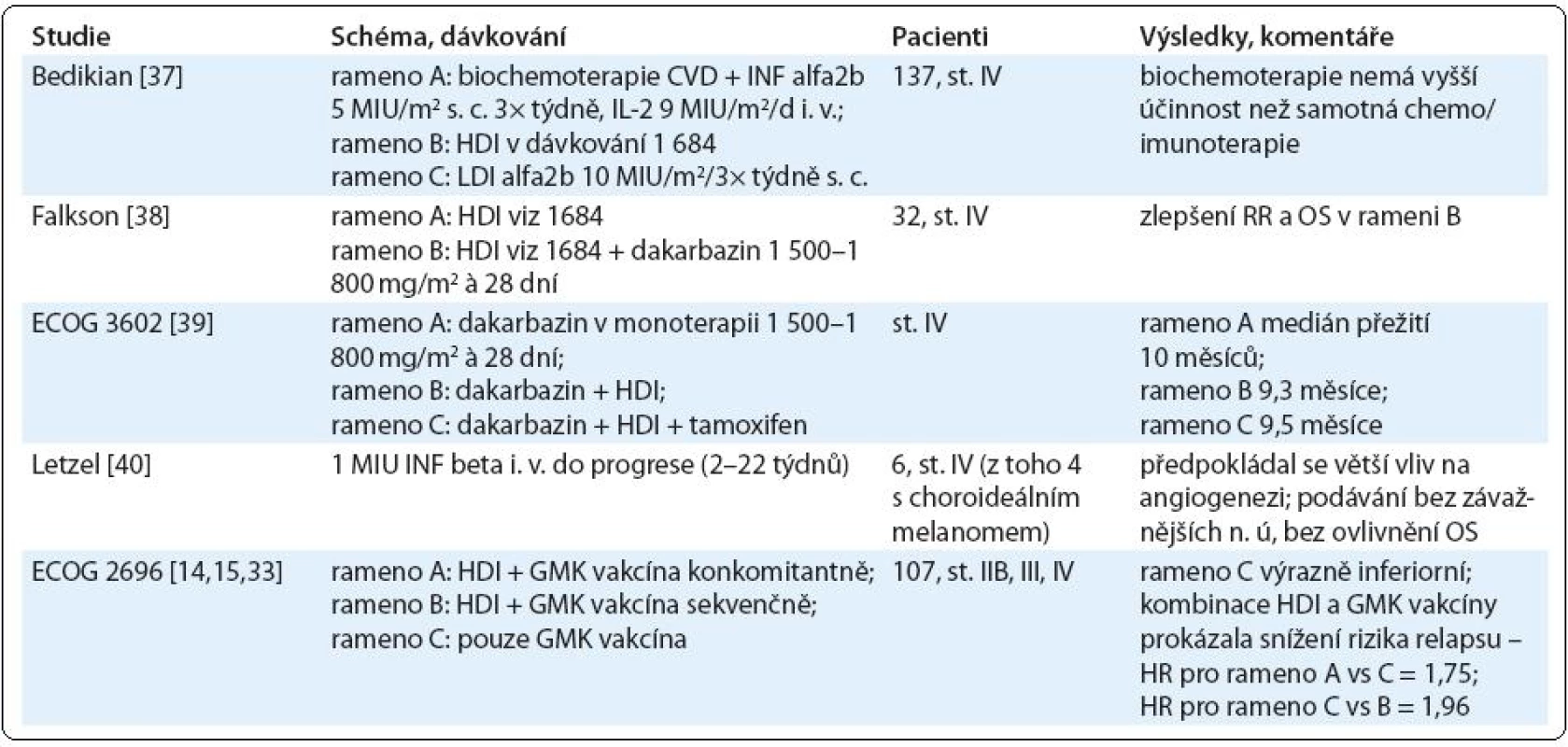
Tab. 3. Neoadjuvantní podávání HDI. 
Pacienti ve stadiu IIb–III mají 50–90% riziko relapsu onemocnění a riziko úmrtí do pěti let v souvislosti s maligním melanomem přesahuje 40 %, v závislosti na počtu postižených uzlin, na rozsahu jejich postižení a na ulceraci primárního ložiska. To je důvod, proč u těchto pacientů máme největší zájem o efektivní adjuvantní léčbu.
V USA je HDI široce užívaná léčebná modalita, Evropa je konzervativnější, větší studie provedla pouze Asociace dermato-onkologů v Německu, v Itálii Melanoma Intergroup a Hellenic Oncology Group v Řecku [7].
Charakteristika interferonu
Interferony jsou přirozeně se vyskytující cytokiny s antiproliferačním a protivirovým působením. Jsou to důležité regulátory imunitního systému. Jsou tvořeny nezralými dendritickými buňkami (rovněž přispívají k jejich vyzrávání), makrofágy, B-lymfocyty, hepatocyty a buňkami napadenými viry [8].
Nitrobuněčnou obranu a kontrolu zajišťuje interferonový systém zahrnující tři základní složky: interferon alfa, beta a gama. Interferony se vážou na buněčný receptor, který se skládá z několika podjednotek. Podjednotka uložená vně buněčné membrány zodpovídá za specifickou vazbu s cytokinem, podjednotky uložené v cytoplazmě pak za spojení s intracelulárními signalizačními molekulami (nekovalentní asociace s intracelulárními proteinkinázami nejčastěji JAK-STAT signální dráhy). Po oligomerizaci receptorových podjednotek dochází k iniciaci kaskády fosforylačních dějů, na jejímž konci je stimulace transkripce genů, a tudíž např. zablokování buněčného cyklu, indukce apoptózy, up-regulace exprese MHC (Major Histocompatibility Complex) molekul, tumor specifických antigenů, adhezních molekul, STAT (Signal Transducer and Activator of Transcription) nebo antiangiogenních působků [9]. Cytokinová síť je vzájemně zastupitelná a působí v kaskádě autokrinně, parakrinně i endokrinně [8].
Interferon alfa je kódován 14 geny na krátkém raménku 9. chromozomu. Jedná se o glykoprotein složený ze 189 aminokyselin. Potlačuje replikaci virů, působí antiproliferačně a pyrogenně. Má imunoregulační vlastnosti – zvyšuje tvorbu protilátek, aktivuje NK buňky [10], efektivně působí na dendritické buňky a upravuje defekty v signalizaci T buňkám. Stimuluje cytotoxické efektorové funkce krevních mononukleárů, zvyšuje expresi TAP (transport proteins associated with antigen processing) a aktivitu proteazomů [11]. V jejich přítomnosti dochází k up-regulaci zejména CD38 ovlivňující funkci dendritických buněk [12].
Studie s HDI (tab. 1–3)
ECOG E1684 byla první randomizovaná studie porovnávající HDI s pouhou observací. Probíhala v letech 1984–1990 a bylo do ní zařazeno 287 pacientů, kterým bylo podáváno 20 milionů mezinárodních jednotek (International Units – MIU) na m2/d i. v. 5 dní v týdnu po dobu 4 týdnů indukční fáze a následně 10 MIU/m2/d 3krát v týdnu po dobu 48–52 týdnů udržovací fáze. Pacienti v rameni s HDI měli signifikantně lepší RFS – 1,72 roku ve srovnání s observačním ramenem (0,92 roku). Medián OS byl 3,82 roku versus 2,78 roku [5].
Randomizovaná studie Intergroup 1690 porovnávala HDI, low dose interferon (LDI) a observaci. V letech 1991––1995 se jí zúčastnilo 642 pacientů a v roce 2000 byla zhodnocena s mediánem sledování 4,3 roku. Rameno s HDI prokázalo statisticky signifikantní benefit v RFS [hazard ratio (HR) = 1,28; p = 0,025]. Oproti tomu LDI neprokázalo benefit v RFS ve srovnání s observací. Stran OS neprokázalo v této studii ani HDI ani LDI prodloužení. Nicméně retrospektivní analýzy hovoří u výsledků o disproporci vzniklé přechodem nemocných z observačního ramene při rekurenci onemocnění do ramene s HDI [13].
Randomizovaná studie Intergroup 1694 porovnávala gangliosidovou (GMK) vakcínu a HDI. V letech 1996–1999 do ní bylo zařazeno 880 pacientů. Byla zhodnocena v roce 2000 a předčasně ukončena pro výrazně inferiorní výsledky v rameni s GMK vakcínou ve smyslu relapsu i mortality [14].
Randomizovaná studie fáze II ECOG 2696 porovnávala GMK vakcínu s konkomitantním nebo sekvenčním podáváním HDI s GMK vakcínou pro adjuvantní i paliativní léčbu. Zúčastnilo se jí 107 pacientů stadia IIb, III a IV. V rameni A byly podávány HDI a GMK vakcína konkomitantně, v rameni B sekvenčně a v rameni C pouze GMK vakcína. Kombinace GMK vakcíny a HDI prokázala snížení rizika relapsu v mediánu sledování 24 měsíců (HR = 1,75 pro rameno C versus A; HR = 1,96 pro rameno C versus B) [15].
Eggermont et al v metaanalýze publikované roku 2001 zpracovali data 6 000 pacientů a popisují prodloužení RFS napříč různým dávkováním interferonu alfa2b, bez signifikantního ovlivnění OS a nulový terapeutický efekt podávání vysokodávkovaného interferonu u melanomu stadia IV [16]. Další metaanalýza Eggermonta et al publikovaná v roce 2009 popisuje 7% benefit HDI na prodloužení DFS (disease free survival) a 3% na prodloužení OS, a to bez rozdílu, pokud jde o dávkové schéma či dobu trvání léčby [17]. Stejný kolektiv analyzoval i prognostické faktory v datech pacientů ze souboru studie EORTC 18 952 (125 pacientů) a Nordic IFN Trial (230 pacientů). Pozitivní prognostický význam autoprotilátek (měřené sérové koncentrace antikardiolipinových, antithyreoglobulinových a antinukleárních protilátek) se nepotvrdil [18], ačkoli jiné práce popisují zlepšení výsledků imunoterapie u pacientů vykazujících autoimunitní odpověď (vitiligo, autoprotilátky) (Gogas) [7,19,20].
Zajímavá studie IMI ISRCTN75125874 [21] zahájila zařazování pacientů v roce 2006. Je to randomizovaná studie s dávkově-denzním intenzifikovaným režimem: HDI v týdnech 1.–4., 9.–12., 17.–20. a 25.–28. v rameni A versus rameno B s dávkováním HDI dle studie E1684. Zúčastnilo se jí 169 pacientů stadia III. Při prvních projevech toxicity grade 3–4 snižovali dávku o 30 %, při druhém výskytu o 60 %. Při kompletní regeneraci dávku opět reeskalovali. V rameni A absolvovalo všechny cykly 62 % pacientů, zatímco pouze 40 % pacientů v rameni B dokončilo léčbu ve schématu indukční + udržovací. Dávkově-denzní intenzifikovaný režim trvající však celkově kratší dobu pacienti tolerovali lépe než režim s pouze čtyřtýdenním intravenózním podáváním, ale roční udržovací subkutánní léčbou. Vyvstává tedy otázka, zdali pro pacienty není tím hůře snášeným dlouhodobé low-dose podávání a zdali by stejný terapeutický efekt neměl pouze intravenózní režim či zda jeho zopakování v určitém intervalu by nepřineslo další prodloužení RFS a OS. Výsledky stran RFS a OS ještě nejsou uzavřeny.
Některé studie popisují prodloužení RFS při HDI zejména u pacientů s postiženými uzlinami (NCCTG 83-7052 ), jiné vyzdvihují antiangiogenní působení HDI u pacientů st. IIb (ECOG 1694). Antiangiogenní působení má dostatečný terapeutický efekt v případě minimální reziduální choroby [20,22].
V současné době probíhají s adjuvantním vysokodávkovaným podáváním interferonu studie ECOG 1697, Hellenic Oncology Group [23], Gogas [23,24] s režimem HDI pouze s indukční intravenózní fází a studie zabývající se podpůrnou léčbou a nežádoucími účinky HDI – Bedane [25], Ayeung [26].
Management nežádoucích účinků HDI
Mezi nežádoucí účinky HDI patří chronická únava, myalgie, nauzea, zvracení, myelosuprese, jaterní dysfunkce ve smyslu elevace jaterních testů, neurologické a depresivní poruchy. Vzácně jsou popisovány také nekrózy kůže v místě aplikace [27].
V jednoleté observační multicentrické studii se kanadský tým lékařů Bedane et al [25] zaměřil na nežádoucí účinky HDI v dávkování jako ve studii ECOG 1684. Zařazeno bylo 225 pacientů. 64 % pacientů byli muži, medián věku byl 51,7 roku. Adjuvantní imunoterapie byla zahájena u všech pacientů do 56 dnů od radikálního chirurgického výkonu. 33 % pacientů přerušilo léčbu v indukční fázi, 25,8 % ve fázi udržovací, což dohromady představuje téměř 60 %. Ve studii ECOG 1684 to bylo 50 % pacientů, kteří přerušili léčbu pro nežádoucí účinky [5].
Denní příjem více než 1,5 l tekutin a kvalitní ošetřovatelská péče zvyšují pravděpodobnost dokončení terapie. K prevenci flu-like syndromu se doporučuje 1 000 mg paracetamolu před podáním interferonu, dále dle potřeby (max. 3 000 mg/d) 8 mg ondansetronu nebo 3 mg granisetronu k prevenci nauzey a zvracení. U pacientů s nadprodukcí žaludečních šťáv nebo anamnézou žaludečních vředů je doporučováno 20–40 mg omeprazolu denně. Obecně je doporučován příjem vitaminů a fyzická aktivita, při poklesu hemoglobinu vyšetření vazebné kapacity železa a jeho substituce.
V roce 2009 se neurobehaviorálním nežádoucím účinkům HDI a jejich managementu věnovala Ayeungova studie [26]. Tyto nežádoucí účinky dělí na anxiózně-depresivní symptomatiku a únavový syndrom s psychomotorickým zpomalením. V prvním případě je terapeuticky podáván escitalopram a v druhém metylfenidát. Snahou je definovat nejlepší strategii k předcházení neurobehaviorálním nežádoucím účinkům HDI. Zkoumání doposud nebylo uzavřeno.
V našem centru jsme podali HDI prozatím 11 pacientům s věkovým průměrem 58,5 roku (47–67 let), muži : ženy 10 : 1, v sedmi případech s nodulárním melanomem, dvakrát s přítomností ulcerace a v jednom případě dokonce s amelanotickým nodulárním ulcerovaným melanomem. Všem byla vyšetřena SN, v polovině případů byla pozitivní. HDI zahájili v průměru do 50 dní.
V premedikaci podáváme zejména v prvním týdnu HDI paracetamol a setrony, eventuálně omeprazol. Snažíme se vyhnout podání kortikoidů, klademe důraz na parenterální hydrataci (2 000 ml/d) a ošetřovatelskou péči.
Až na jednoho nemocného všichni dokončili intravenózní podávání interferonu bez nutnosti redukce dávky. U zmiňovaného pacienta jsme byli nuceni intravenózní podávání předčasně ukončit pro rozvoj neurologické symptomatiky charakteru parkinsonizmu, kteréžto potíže však již dříve anamnesticky uváděl.
Z nežádoucích účinků se potýkáme s elevacemi jaterních enzymů, které prozatím nikdy nedosáhly pětinásobku, dále s mírnou neutropenií a chřipkovými příznaky zvládnutelnými běžnými antipyretiky. Dále nás zajímají dosahované plazmatické koncentrace interferonu a věnujeme se také ukazatelům angiogeneze jakožto možným prognostickým a prediktivním faktorům odpovědi na léčbu a jejího terapeutického benefitu. Výzkum není uzavřen.
Prognostické a prediktivní faktory
Melanom je velice zrádnou malignitou, v jakémkoli stadiu potenciálně letální. Má extrémně vysoký potenciál k tvorbě metastáz, a to i pozdních. Proto je pro nás důležité včas zachytit signál o rozběhnuvší se progresi a metastazování. Negativní prognostické faktory jsou vysoká hodnota dle Breslowa, přítomnost ulcerace primárního ložiska, rekurentní onemocnění v čase zahájení adjuvantní léčby [3,7].
Nádorová transformace a progrese má svůj genetický podklad (sekvenční inaktivace tumor-supresorových genů, nebo naopak aktivace proto-onkogenů), který provází i změna v produkci růstových faktorů a cytokinů. Ty modulují mikroprostředí a umožňují nádoru růst [28].
Jedním z hlavních regulátorů angiogeneze je vaskulární endotelový růstový faktor (VEGF). Zvýšená exprese VEGF působí na endotelie cév ve smyslu větší viability, mitogeneze, chemotaxe a permeability. Působí především prostřednictvím dvou tyrozinkinázových receptorů – VEGFR-1 (flt-1) a VEGFR-2 (flk-1/KDR) [29]. Změny v angiogenezi ve smyslu proangiogenního přepnutí a vývoje angiogenního fenotypu usnadňují progresi nádoru a tvorbu vzdálených metastáz, jelikož tumor je schopen se vyživit difúzí bez vlastní vaskulatury pouze do objemu 1–2 mm3.
Úroveň angiogeneze můžeme hodnotit měřením sérové koncentrace angiogenních proteinů nebo hodnocením denzity mikrovaskulatury a angiogenních receptorů v primárním ložisku či metastatických ložiscích. Několik studií prokázalo signifikantně zvýšené koncentrace VEGF, LDH (laktátdehydrogenáza), MMP (matrix metaloproteináza), některých interleukinů (IL-1, IL-6 a IL-8) [31] či zvýšenou expresi S100 proteinu u pacientů s maligním melanomem [14]. Zvýšené sérové koncentrace některých cytokinů, angiogenních a růstových faktorů by mohly sloužit jako efektivní biomarkery časné diagnostiky, prognózy, monitoringu průběhu onemocnění či odpovědi na léčbu (např. zvýšená koncentrace IL-6 je spojována se špatnou prognózou u pacientů s maligním melanomem st. IV a je definována jako negativní prediktivní faktor OS) [30–33].
Kirkwood et al v roce 2007 analyzovali 29 sérových cytokinů, chemokinů, angiogenních a růstových faktorů u 179 pacientů s maligním melanomem podstoupivších HDI a porovnával je s koncentracemi v séru 378 zdravých jedinců. Cílem bylo mj. definovat, zda podání HDI mění sérové koncentrace těchto cytokinů. Z jejich rozborů lze vyzdvihnout, že koncentrace IL-1 alfa i beta, IL-6, IL-8, IL-12 a IL-13, GCSF (granulocyte colony stimulating factor), interferon alfa, TNF (tumor necrosis factor), TNF receptoru II, EGF (epidermal growth factor) a VEGF byly u pacientů s maligním melanomem významně vyšší než u zdravých jedinců a po terapii interferonem alfa2b poklesly. Interferon alfa inhibuje tumorem indukovanou angiogenezi [33].
V další analýze se věnovali sérové koncentraci proteinu S100B u pacientů po resekci melanomu [14]. Chemoiluminiscenční metodou byla vyšetřena séra 670 pacientů ze studie ECOG 1694 skladovaná pro prospektivní práce. Z výsledků vyplynulo, že vyšší koncentrace sérového S100 proteinu je nezávislým negativním prognostickým faktorem, stejně jako zvýšená hladina LDH (AJCC 2002). Naopak výskyt autoimunitních protilátek (antithyreoglobulinové, antinukleární, antikardiolipinové) a vitiliga je spojován s lepší prognózou, ačkoli výsledky jejich vyšetřování ve studiích EORTC 18952 a Nordic IFN trial toto nepotvrdily [18].
Diskuze
Z hlediska terapeutického efektu HDI se jako podstatné jeví dosažení vysokých plazmatických koncentrací interferonu při intravenózním podávání, včasné zahájení imunoterapie a k ní podpůrná léčba. O délce, dávkování a důležitosti udržovací fáze se vedou polemiky. Zůstává otázkou, zdali by stejný efekt neměl i režim bez udržovací fáze nebo zda by zopakování intravenózního režimu v určitém intervalu nepřineslo další zlepšení RFS či celkového přežívání [21]. Je důležité charakterizovat populaci pacientů, která by z HDI jednoznačně profitovala (rozsah a podtyp onemocnění) a definovat prognostické a prediktivní faktory časné diagnostiky, monitoringu průběhu onemocnění, odpovědi na léčbu a rizika relapsu.
Eggermont přehodnotil staging SN a jako nejvhodnější k HDI definuje pacienty s centrálně postiženou SN, ale bez klinické lymfadenopatie (Melanoma Forum, Frankfurt, 2011).
Na základě provedených studií můžeme říci, že neexistuje jeden vhodný prognostický parametr, ale hledání biomarkerů půjde zřejmě cestou testování panelu několika cytokinů, angiogenních a růstových faktorů [11,18,30,33].
Otázka klinického přínosu a ekonomické efektivity této léčby byla zodpovězena na mezinárodním kongresu ASCO 2007, kde byl tento režim zhodnocen jako „cost effective“ pro pacienty stadia IIIb a IIIc mladší 52 let [6,34].
Tolik diskutovaná otázka nežádoucích účinků tohoto režimu se zdá být mírně přeceňována. Mohlo by to být dáno několika faktory. Jedním z nich je skutečnost, že se v metaanalýzách stále opakují výsledky starých studií, které neměly takové možnosti podpůrné terapie, jako máme dnes, a neprováděly dávkové redukce. Dalším faktorem je, že mnoho studií s HDI bylo prováděno na kožních klinikách, kde pacienti obvykle nepodstupují tak náročné léčebné režimy se závažnými nežádoucími účinky, jak je běžné u onkologických léčebných režimů, kde jsou výrazné nežádoucí účinky podávaných terapií každodenní záležitostí, někdy i bagatelizovanou.
Závěr
Vysokodávkovaný interferon jako jediné léčivo prokázal prodloužení DFS i OS oproti observaci [2,4,5], schopnost inhibovat tumorem indukovanou angiogenezi [20,22,30–33] a vyléčit minimální reziduální chorobu [32]. Závěry studií jsou přesto nekonzistentní, jelikož pokryly velmi heterogenní skupiny pacientů, používaly různá dávková schémata a byly předčasně finálně hodnoceny. Výsledky studií provedených před 15 lety nelze brát jako finální [36]. Je čas na nich stavět ve světle současných znalostí z nádorové imunologie, patofyziologie, molekulární biologie, proteomiky, genomiky; monitorovat sérové biomarkery (VEGF aj.), reakce specifických T-lymfocytů, dendritických buněk, protilátkovou odpověď [11] aj. Je třeba hledat nové možnosti využití synergního působení této nespecifické imunoterapie například ve vakcinačních schématech aktivní imunoterapie nebo jiných terapeutických kombinacích.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.MUDr. Jarmila Vaňásková
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: Jaja.vanaskova@seznam.cz
Zdroje
1. Dušek L, Mužík J, Gelnarová E. Incidence a mortalita nádorových onemocnění v České republice. Klin Onkol 2010; 23(5): 311–324.
2. Eggermont A, Garde C, Peris K et al. Diagnosis and treatment of melanoma: European consensus-based interdisciplinary guideline. Eur J Cancer 2010; 46(2): 270–283.
3. Krajsová I. Mapování a biopsie sentinelové uzliny. In: Krajsová I (ed). Melanom. Praha: Maxdorf 2006 : 155–170.
4. Verma S, Quirt I, McCready D et al. Systematic review of systemic adjuvant therapy for patients at high risk for recurrent melanoma. Cancer 2006; 106(7): 1431–1442.
5. Kirkwood JM, Strawderman MH, Ernstoff MS et al. Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 1996; 14(1): 7–17.
6. Crott R. Cost effectiveness and cost utility of adjuvant interferon alpha in cutaneous melanoma: a review. Pharmacoeconomics 2004; 22(9): 569–580.
7. Gogas H, Pectasides D, Kirkwood JM. et al. Prognostic significance of autoimmunity during treatment of melanoma with interferon. N Engl J Med 2006; 354(7): 709–718.
8. Hořejší V, Bartůňková J. Cytokiny. Základy imunologie. 4. vydání. Praha: Triton 2009 : 101–112.
9. Kirkwood JM, Wang W, Edington HD et al. Effects of high-dose IFNalpha2b on regional lymph node metastases of human melanoma: modulation of STAT5, FOXP3, and IL-17. Clin Cancer Res 2008; 14(24): 8314–8320.
10. KopeckýJ, Kopecký O. NK buňky, chemokiny a chemokinové receptory. Klin Onkol 2010; 23(1): 1–9.
11. Abuzahra F, Baron JM, Heise R et al. Adjuvant interferon alfa treatment in patients with malignant melanoma stimulates transporter proteins associated with antigen processing and proteasome activator 28. Lancet Oncol 2004; 5(4): 250.
12. Svane IM, Trepiakas R, Pedersen AE et al. Addition of interferon-alpha to a standard maturation cocktail induces CD38 up-regulation and increases dendritic cell function. Vaccine 2009; 27(16): 2213–2219.
13. Kirkwood JM, Ibrahim JG, Sondak VK et al. High - and low-dose interferon alfa2b in high risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 2000; 18(12): 2444–2458.
14. Kirkwood JM, Lee S, Tarhini AA et al. Prognostic significance of serum S100B protein in high-rish surgically resected melanoma patients participating in Intergroup trial ECOG 1694. J Clin Oncol 2009; 27(1): 38–44.
15. Kirkwood JM, Manola J, Ibrahim J et al. A pooled analysis of eastern cooperative oncology group and intergroup trials of adjuvant high-dose interferon for melanoma. Clin Cancer Res 2004; 10(1): 1670–1677.
16. Eggermont AM. The role interferon-alfa in malignant melanoma remains to be defined. Eur J Cancer 2001; 37(17): 2147–2153.
17. Eggermont AM, Gogas H, Testori A et al. Utility of systemic adjuvant therapy in melanoma. Ann Oncol 2009; 20 (Suppl 6): vi30–vi34.
18. Eggermont AM, Bouwhuis MG, Suciu S et al. Autoimmune antibodies in recurrence-free interval in melanoma patients treated with adjuvant interferon. J Natl Cancer Inst 2009; 101(12): 869–877.
19. Mohr P, Weichenthal M, Hauschild A. Adjuvant therapy in melanoma. Onkologie 2003; 26(3): 227–233.
20. Slaton JW, Perrotte P, Inoue K et al. Interferon-alfa-mediated down-regulation of angiogenesis-related genes and therapy of bladder cancer are dependent on optimization of biological dose and schedule. Clin Cancer Res 1999; 5(10): 2726–2734.
21. Chiaron-Sileni V, Del Bianco P, Romanini A et al. Tolerability of intensified interferon-alfa-2b versus the ECOG 1684 schedule as adjuvant therapy for stage III melanoma: a randomized phase III Melanoma Inter-group trial (IMI – Mel.A.) ISRCTN75125874. BMC Cancer 2006; 6 : 44.
22. Kirkwood JM. Studies of interferons in the therapy of melanoma. Semin Oncol 1991; 18(5 Suppl 7): 83–90.
23. Agarwala SS, Gray RJ, Wong MK. Duration of high-dose interferon alfa-2b for resected high-risk melanoma.J Clin Oncol 2009; 27(25): e82–e83.
24. Gogas H, Pectasides D, Dafni U et al. A randomized phase III trial of 1 month versus 1 year adjuvant high-dose interferon-alfa2b in patients with resected high risk melanoma. J Clin Oncol 2009; 27(6): 939–944.
25. Bédane C, Le Brun V, Boulinguez S et al. Tolerance and feasibility of adjuvant treatment of stage II malignant melanoma with high-dose interferon alpha. Ann Dermatol Venereol 1999; 126(2): 142–146.
26. Auyeung SF, Long Q, Royster EB et al. Sequential multiple-assignment randomized trial design of neurobehavioral treatment for patients with metastatic malignant melanoma undergoing high-dose interferon-alpha therapy. Clin Trials 2009; 6(5): 480–490.
27. Aquilar García G, Serrano Falcón C, Serrano Falcón Mdel M et al. Cutaneous necrosis due to interferon alpha in a patient with melanoma. Actas Dermosifiliogr 2006; 97(8): 539–542.
28. Filip S, Mokrý J, Petera J. Kmenové buňky, nádorové kmenové buňky a karcinogeneze. Klin Onkol 2006; 19(2): 149–152.
29. Larrivée B, Karsan A. Signalling pathways induced by vascular endothelial growth factor (review). Int J Mol Med 2000; 5(5): 447–456.
30. Ciotti P, Rainero ML, Nicolò G et al. Cytokine expression in human primary and metastatic melanoma cells: analysis in fresh bioptic specimens. Melanoma Res 1995; 5(1): 41–47.
31. Mouawad R, Rixe O, Meric JB et al. Serum interleukin-6 concentrations as predictive factor of time to progression in metastatic malignant melanoma patients treated by biochemotherapy: a retrospective study. Cytokines Cell Mol Ther 2002; 7(4): 151–156.
32. Kirkwood JM, Tarhini AA, Moschos SJ et al. Adjuvant therapy with high-dose interferon alfa-2b in patients with high-risk stage IIB/III melanoma. Nat Clin Pract Oncol 2008; 5(1): 2–3.
33. Kirkwood JM, Edington HD, Marrangoni AM et al. Multiplex analysis of serum cytokines in melanoma patients treated with interferon-alfa2b. Clin Cancer Res 2007; 13(8): 2422–2428.
34. Cormier NJ, Xing Y, Ding M et al. Cost effectiveness of adjuvant interferon in node-positive melanoma. J Clin Oncol 2007; 25(17): 2442–2448.
35. Kefford RF. Adjuvant therapy of cutaneous melanoma: the interferon debate. Ann Oncol 2003; 14(3): 358–365.
36. Moschos SJ, Kirkwood JM, Konstantinopoulos PA. Present status and future prospects for adjuvant therapy of melanoma: time to build upon the foundation of high-dose interferon alfa-2b. J Clin Oncol 2004; 22(1): 11–14.
37. Bedikian AY, Kim KB, Legha SS et al. A randomized phase III trial of biochemotherapy versus interferon-alpha-2b for adjuvant therapy in patients at high risk for melanoma recurrence. Melanoma Res 2009; 19(1): 42–49.
38. Falkson CI. Experience with interferon alpha 2b combined with dacarbazine in the treatment of metastatic malignant melanoma. Med Oncol 1995; 12(1): 35–40.
39. Falkson CI, Ibrahim J, Kirkwood JM et al. Phase III trial of dacarbazine versus dacarbazine with interferon alpha-2b versus dacarbazine with tamoxifen versus dacarbazine with interferon alpha-2b and tamoxifen in patients with metastatic malignant melanoma: an Eastern Cooperative Oncology Group study. J Clin Oncol 1998; 16(5):1743–1751.
40. Letzel S, Fierlbeck G, Voelter-Mahlknecht S et al. Phase 2 trial of the continuous IV administration of interferon-beta in patients with disseminated malignant melanoma. Skinmed 2006; 5(6): 271–276.
41. Kirkwood JM, Moschos SJ, Edington HD et al. Neoadjuvant treatment of regional stage IIIB melanoma with high-dose interferon alfa2b induces objective tumor regression in association with modulation of tumor infiltrating host cellular response. J Clin Oncol 2006; 24(19): 3164–3171.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Selén a rakovina: od prevencie k liečbe
- High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
- Gastrointestinální stromální tumory
- In vitro hodnocení prostupnosti cytotoxických léčiv přes rekonstruovanou lidskou epidermis a ústní epitel
- Dynamika vývoja psychosociálnej záťaže prežívajúcich pacientok s karcinómom prsníka: klinický úspech s psychosociálnymi dôsledkami
- Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
- Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
- Paliativní péče v České republice v roce 2011 – několik poznámek
- Avastin v léčbě karcinomu prsu
- Zápis ze schůze výboru České onkologické společnosti dne 5. 4. 2011 v Praze
- Zápis ze schůze výboru České onkologické společnosti dne 27. 5. 2011 v MOÚ v Brně
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gastrointestinální stromální tumory
- Selén a rakovina: od prevencie k liečbe
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



