-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kožní karcinom z Merkelových buněk
Merkel Cell Skin Carcinoma
Merkel cell carcinoma is a rare tumour of the skin. It affects predominantly elderly Caucasian males on sun ‑ exposed areas of the skin. Distinctively more frequent and at significantly lower age, its incidence is higher in immunocompromised patients. In these patients we often observe the highly aggressive course of Merkel cell carcinoma and a fatal outcome. The incidence of Merkel cell carcinoma has been rising in recent years and is more dramatic than the increased incidence of cutaneous melanoma. More than one ‑ third of Merkel cell carcinoma patients will die from this cancer, making it twice as lethal as melanoma. The malignant transformation of Merkel cells is currently thought to be related to an infection with Merkel cell polyomavirus. In the early stage the discreet clinical picture may be contrary to extensive microscopic invasion and this seemingly benign appearance can delay diagnosis or increase the risk of insufficient tumour excision. The diagnosis is definitely confirmed by histological evaluation and immunohistochemical tests. A typical feature is the tendency of Merkel cell carcinoma to frequent local recurrence and early metastasizing into regional lymph nodes with subsequent tumour generalization. The mainstay of therapy is radical excision of the tumour and adjuvant radiotherapy targeted at the site of primary incidence and local draining lymph nodes. The efficacy of different chemotherapy protocols in Merkel cell carcinoma is limited and the median survival rate is measured in months. In the future, prophylaxis with vaccination against Merkel cell polyomavirus will hopefully be possible in high‑risk patients, as well as therapeutic usage of antisense oligonucleotides or microRNAs, eventually complete Merkel cell carcinoma elimination by affecting the tumour suppressor gene Atonal homolog 1 expression. The staging of the tumour at time of diagnosis is the most important prognostic factor. In this respect, the importance of preventative skin inspection in high‑risk immunocompromised patients must be stressed and suitable therapy must be indicated in suspected lesions.
Key words:
Merkel cell carcinoma – diagnostic imaging – etiology – cancer staging – cell cycle – Merkel cell polyomavirus – therapy – prognosis
Autoři: K. Krejčí 1; J. Zadražil 1; T. Tichý 2; P. Horák 1; H. Ciferská 1; M. Hodulová 1; M. Zezulová 3; M. Zlevorová 3
Působiště autorů: III. interní nefrologická, revmatologická a endokrinologická klinika FN a LF UP, Olomouc 1; Ústav patologie FN a LF UP, Olomouc 2; Onkologická klinika FN a LF UP, Olomouc 3
Vyšlo v časopise: Klin Onkol 2010; 23(4): 210-217
Kategorie: Přehledy
Souhrn
Karcinom z Merkelových buněk je vzácné nádorové onemocnění kůže vyskytující se především na slunci exponovaných místech u starších mužů, bělochů. Výrazně častější a v signifikantně mladším věku je jeho záchyt u imunokompromitovaných jedinců. U těchto nemocných má nádor většinou vysoce agresivní průběh a často fatální výsledek. Výskyt karcinomu z Merkelových buněk má v posledních letech celosvětově vzrůstající tendenci. V porovnání s melanomem vykazuje strmější vzestup incidence a je spojen s dvojnásobnou letalitou. Více než třetina nemocných nádoru nebo s ním spojeným komplikacím podléhá. Maligní zvrat Merkelových buněk je v současné době dáván do souvislosti s infekcí vyvolanou nedávno objeveným Merkel cell polyomavirem. V některých případech může mít onemocnění v počáteční fázi poměrně nenápadný klinický obraz, což je v kontrastu s jeho rozsáhlou mikroskopickou propagací. Z tohoto důvodu se zvyšuje riziko pozdní diagnózy nebo nedostatečného primárního chirurgického ošetření. Diagnostickým standardem je histologické a především imunohistochemické vyšetření vzorku nádorové tkáně. Karcinom z Merkelových buněk má výraznou tendenci k lokální rekurenci a časnému rozvoji metastáz do regionálních uzlin s následnou generalizací. Základem léčby je radikální excize tumoru doplněná ve většině případů o adjuvantní radioterapii cílenou na místo primárního výskytu a na oblast regionálních drenážních uzlin. Účinnost rozdílných chemoterapeutických protokolů u karcinomu z Merkelových buněk je většinou malá a medián přežití je jen v řádu měsíců. Příslibem do budoucna se jeví možnost vakcinační profylaxe Merkel cell polyomavirové infekce u rizikových pacientů, terapeutické využití antisense oligonukleotidů nebo microRNAs, případně kompletní eliminace karcinomu z Merkelových buněk ovlivněním exprese tumor supresorového genu atonal homolog 1. Z prognostického hlediska hraje u karcinomu z Merkelových buněk nejvýznamnější roli staging tumoru v době záchytu. V této souvislosti je třeba zdůraznit význam pravidelné inspekce kůže u nejrizikovější skupiny imunokompromitovaných nemocných a u suspektních lézí indikovat adekvátní terapeutický přístup.
Klíčová slova:
Úvod
karcinom z Merkelových buněk – zobrazovací diagnostika – etiologie – staging tumoru – buněčný cyklus – Merkelův polyomavirus – terapie – prognózaKarcinom z Merkelových buněk (Merkel cell carcinoma – MCC) je vysoce agresivní neuroendokrinní kožní nádor, poprvé popsaný Tokerem [1] v roce 1972 jako trabecular cell carcinoma. Nádor primárně vychází z Merkelových buněk lokalizovaných v bazální vrstvě epidermis. Tyto buňky se vyvíjejí z epidermálních kmenových buněk a mají svůj původ v embryonální pokožce. U dospělých myší epidermální kmenové buňky postupně nahrazují odumírající populaci Merkelových buněk. K tomu, aby se z kmenových buněk staly Merkelovy buňky, je nezbytný transkripční faktor atonal homolog 1 (Atoh1) [2]. V současné době jsou zkoumány možnosti regulace tohoto faktoru ve vztahu k diferenciaci Merkelových buněk a rozvoji MCC.
Nádor se vyskytuje především na slunci exponovaných místech u starších mužů, bělochů. V signifikantně mladším věku je jeho záchyt vyšší u jedinců s imunitní dysfunkcí vzniklou nejčastěji na podkladě virové infekce, autoimunitního onemocnění nebo po orgánové transplantaci. Výjimečně byl popsán i v dětském věku [3,4]. Výskyt MCC má v posledních letech vzrůstající tendenci. Dle Surveillance Epidemiology and End Results (SEER) registru Spojených států amerických činila roční incidence 1,5 případu na jeden milion obyvatel v roce 1986 a 4,4 případu na milion obyvatel v roce 2001 [5]. V roce 2008 však jen pro USA predikovala American Cancer Society až 1 500 nových případů MCC [6], tedy téměř pět případů na milion obyvatel, a podobná data byla prezentována i pro evropskou a australskou populaci [7,8].
V porovnání s melanomem je MCC charakterizován dvojnásobnou letalitou a strměji narůstající incidencí [5]. Po chirurgickém odstranění má nádor tendenci k lokální rekurenci (27–60%), k časnému postižení regionálních uzlin (45–91%) a vzdáleným metastázám (18–52%) [9]. Maligní zvrat Merkelových buněk je podle současných poznatků ve většině případů MCC předcházen integrací DNA sekvencí nedávno objeveného Merkel cell polyomaviru (MCPyV) do buněčného genomu [10].
Klinická manifestace, diagnostika a staging
Nádor se nejčastěji vyskytuje na hlavěa krku (40–75%), naopak na trupu a v gluteální oblasti se vyvíjí jen 10–27%nádorů [11]. Klinicky se zpravidla jeví jako nebolestivý, solidní, polokulovitý, červený až lividně zbarvený vyklenující se tumor velikosti v rozmezí 0,3–15cm [12]. Makroskopicky se většinou zdá být dobře ohraničený a homogenní, což je v kontrastu s jeho rozsáhlou mikroskopickou propagací. Přirůstu na trupu a v gluteální oblasti můženádor imponovat jako hluboko v podkoží uložený uzel barvy kůže podobající se cystě [13] a tento zdánlivě benigní nález zvyšuje riziko pozdní diagnózy nebo nedostatečné primární excize tumoru.
Histologické charakteristiky MCC jsouzřetelné, ale nespecifické. Histologický typ tumoru má vztah k agresivitě onemocnění, kdy rozlišujeme trabekulární, intermediární a nejmalignější variantu z malých buněk. Smíšené a přechodné formy mezi těmito třemi typy jsou velmi časté. Mitotický index bývá velmi vysoký a je pozorováno mnoho atypických mitóz a často invaze do lymfatických cév (obr. 1). Příslušnost k neuroendokrinnímu systému dokladuje elektronmikroskopický obraz elektrodenzních neurosekrečních granul v buňkách tumoru [14] a v některých případech lze detekovat i přítomnost intranukleárních a cytoplazmatických inkluzí MCPyV.
Obr. 1. Kompaktní nádorové ložisko složené z malých bazofi lních buněk s vysokým mitotickým indexem (vlevo, světelná mikroskopie, HE, x 400) a invazí do lymfatických cév (vpravo, světelná mikroskopie, HE, x 200). 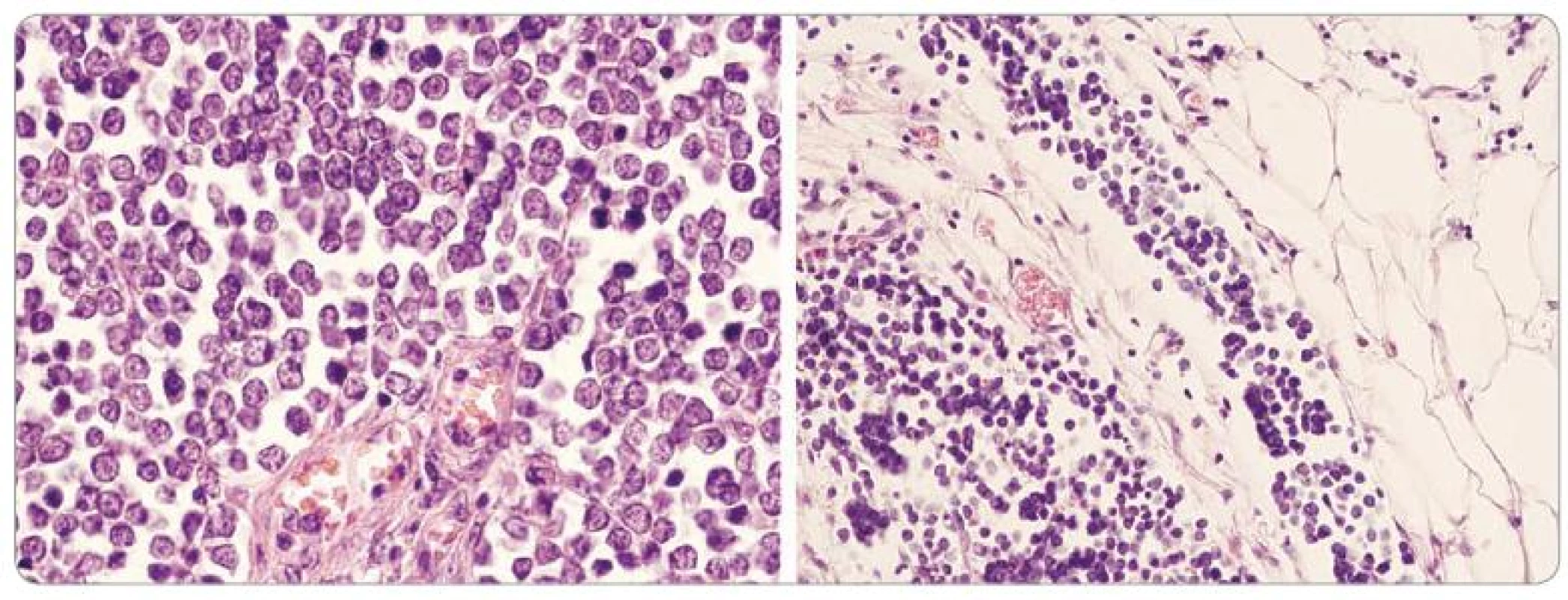
Diferenciálně diagnosticky je při základním histologickém vyšetření potřeba odlišit metastatický malobuněčný karcinom plic, neuroblastom, kožní lymfom, metastatický karcinoid, amelanotický melanom, karcinom potních žláz, histiocytózu z Langerhansových buněk a Ewingův sarkom [15]. Je tedy nutné provést pečlivé celkové klinické vyšetření a hlavně imunohistochemické vyšetření nádorové tkáně (tab. 1). MCC má charakteristicky paranukleární bodovou pozitivitu na cytokeratin 20 a rovněž pozitivní barvení na CD56, neuron specifickou enolázu, chromogranin a synaptofyzin (obr. 2). Může být slabě pozitivní na S100. Je třeba pamatovat i na možnost sdruženého výskytu s jinými nádory, například s karcinomem prsu nebo ovaria, leukemií, maligním lymfomem, anaplastickým meningeomem [16]. U 20–50% pacientů s MCC se v anamnéze vyskytuje další kožní neoplazie, zejména bazocelulární a dlaždicobuněčný karcinom [17].
Tab. 1. Imunohistochemické vyšetření v diferenciální diagnostice karcinomu z Merkelových buněk. 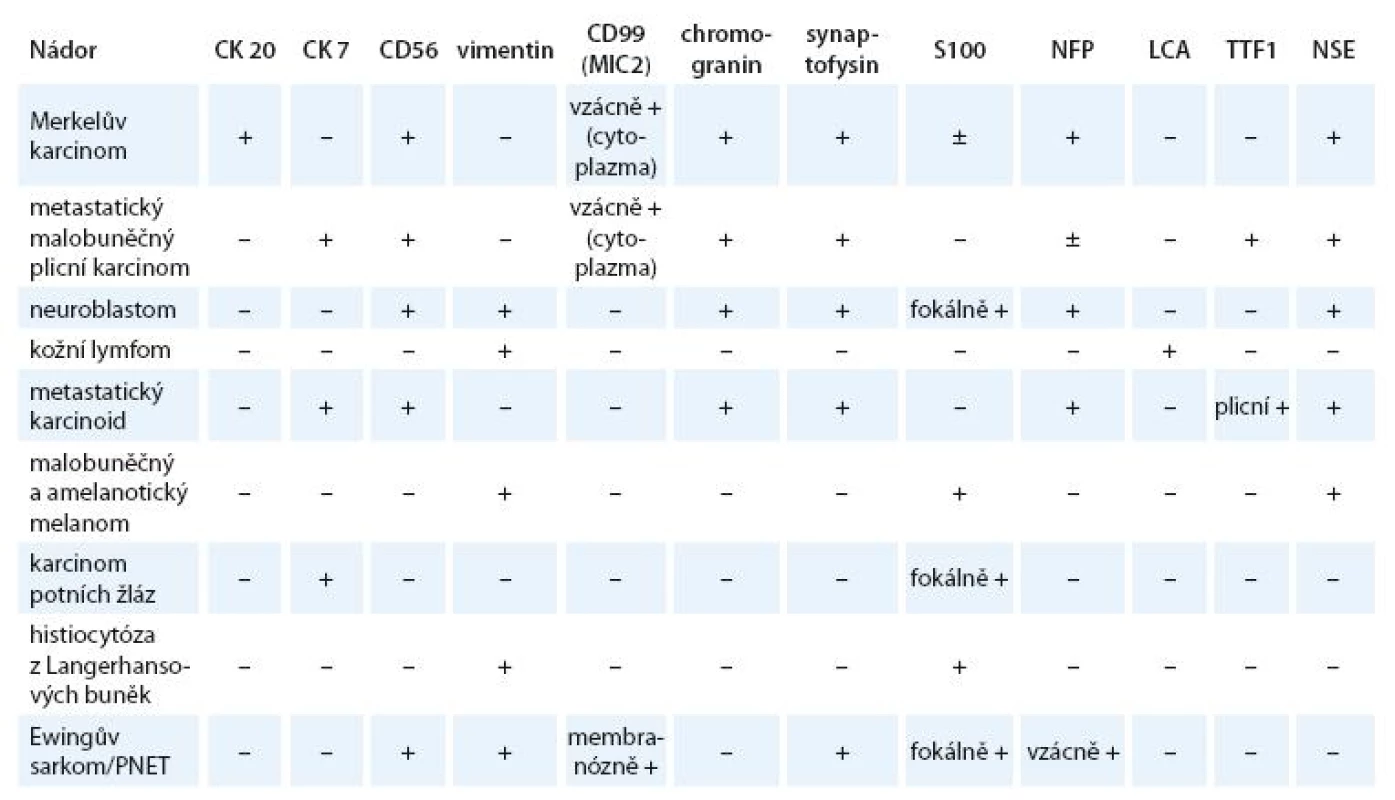
CK 20 – cytokeratin 20, CK 7 – cytokeratin 7, CD56 (NCAM) – adhezní protein nervových buněk, S100 – protein S100, NFP – neurofilamentový protein, LCA – společný leukocytární antigen, TTF1 – tyroidální transkripční faktor 1, NSE – neuron specifická enoláza, PNET – primitivní neuroektodermální tumor Obr. 2. Buňky tumoru s výraznou dot-like paranukleární pozitivitou cytokeratinu 20 (vlevo, x 200) a membránovou pozitivitou CD 56 (vpravo, x 200). 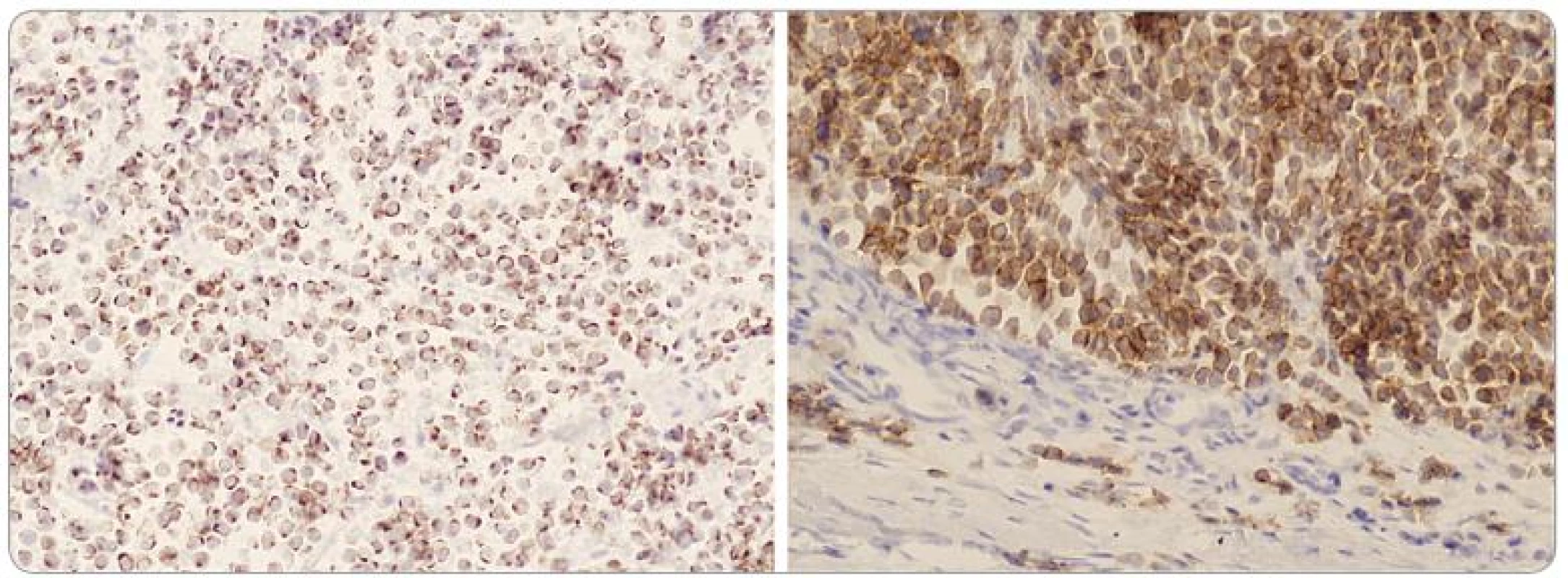
V určení stadia tumoru (tab. 2) hraje významnou roli PET/CT vyšetření. S vysokou citlivostí umožňuje odhalit jak postižení regionálních lymfatických uzlin, tak případnou rekurenci či přítomnost vzdálených metastáz (obr. 3,4). Je rovněž vhodné k plánování a hodnocení účinnosti cílené radioterapie a efektu aplikované chemoterapie [18,19].
Tab. 2. Stadia karcinomu z Merkelových buněk [73]. ![Stadia karcinomu z Merkelových buněk [73].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2c542e28c3085019e5d9a60ec8146d62.jpeg)
T – rozsah primárního nádoru, N – metastázy v regionálních mízních uzlinách, M – vzdálené metastázy Obr. 3. PET/ CT obraz rekurujícího ložiska karcinomu z Merkelových buněk v oblasti pravé hýždě u pacienta po kombinované transplantaci slinivky a ledviny. 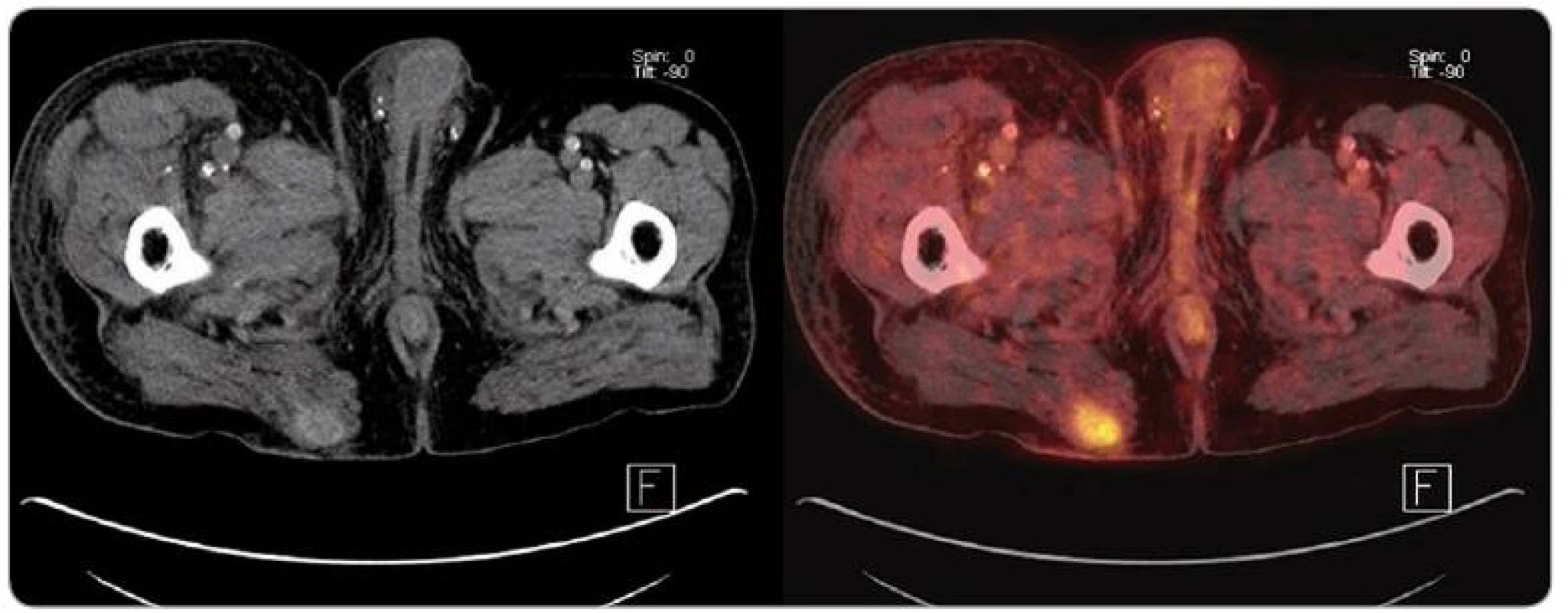
Obr. 4. PET/ CT obraz velké metastázy karcinomu z Merkelových buněk do transplantované slinivky (pravá jáma kyčelní) u pacienta po kombinované transplantaci slinivky a ledviny (levá jáma kyčelní). 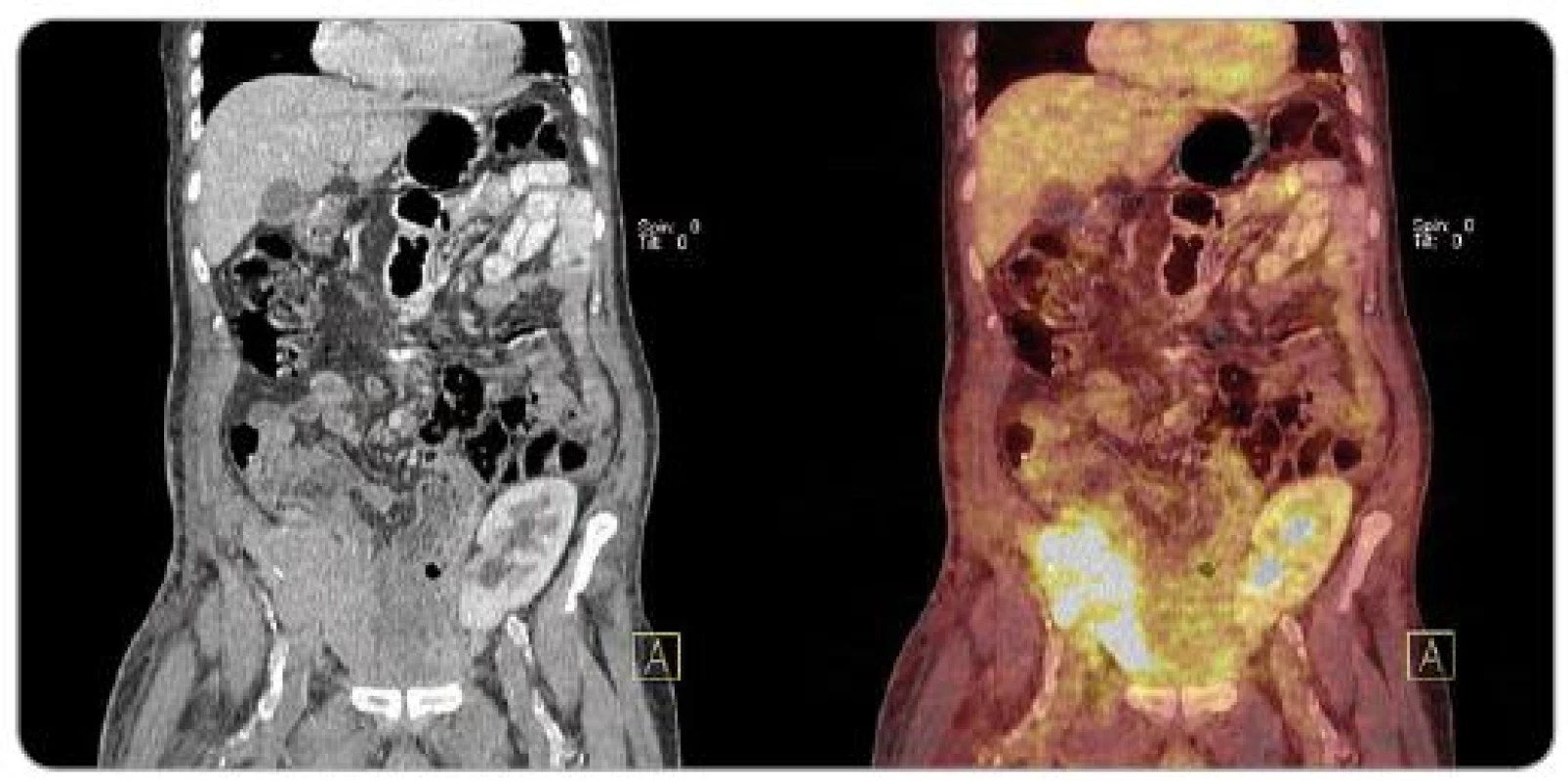
Etiopatogeneze MCC
Růstové charakteristiky, apoptóza a regulace buněčného cyklu
Pro MCC je typická tendence k časté lokální rekurenci a časnému rozvoji metastáz do regionálních uzlin s následnou generalizací onemocnění. Tento agresivní růstový potenciál, kdy tumor může bez terapie zdvojnásobit svůj rozměr během jednoho týdne [6], vedl ke studiu prorůstových charakteristik MCC buněk. První zmínka o genetické alteraci receptorů růstových faktorů u MCC přišla od Swicka et al [20]. Autoři u 3 z 9 (33%) MCC dokumentovali mutaci či jednonukleotidový polymorfizmus jedné heterozygotní báze na exonu 10 receptoru PDGF a (platelet derived growth factor a) vedoucí k náhradě aminokyseliny v kodonu 478. Všechny tři nádory rovněž exprimovaly PDGF a receptor při imunohistochemickém vyšetření. Podobně zkoumali i expresi c kit (CD117) receptoru pro SCF (stem cell factor), který je zapojen v kancerogenezi různých tumorů, s velmi variabilními nálezy. Pro c kit však nezjistili žádné aktivační mutace [21] a dle výsledků jiných studií jeho exprese ani nekoreluje s agresivitou onemocnění [22,23]. Expresi celé řady povrchových receptorů na MCC buňkách sledovali i Brunner et al především ve vztahu k možnému terapeutickému ovlivnění pomocí antisense oligonukleotidů a microRNA. V porovnání s nálezy Swicka et al [20] autoři zjistili vysokou expresi PDGF a u 23 z 29 (72%) pacientů s MCC současně s nízkou expresí PDGF b [24]. Vysoce exprimovány byly rovněž VEGF A (vascular endothelial growth factor A) (91%), VEGF C (75%) a VEGF R2 (88%) receptory a poprvé byla popsána vysoká exprese antiapoptotického proteinu Mcl 1 (88%) a transkripčního represoru Bmi 1 (78%). Až u třech čtvrtin MCC byla rovněž pozorována over exprese antiapoptotického Bcl 2 [25,26] a v souboru 19 pacientů s MCC byla ve všech případech zjištěna silná exprese antiapoptotického proteinu survivinu v jaderném nebo cytoplazmatickém kompartmentu [27]. Případy s pozitivitou nukleárního barvení vykazovaly agresivnější klinický průběh.
Porucha regulace buněčného cyklu se tak zdá být zásadní pro vznik tumoru. Důležitými represory buněčného cyklu, kteří zabraňují nekontrolované proliferaci, jsou retinoblastomový protein (RB) inhibující proliferační faktory a tumor supresorový protein p53, který jako transkripční faktor ovlivňuje expresi genů zavzatých do kontroly buněčného cyklu, indukce apoptózy nebo stárnutí a opravy DNA [28]. Obě RB a p53 cesty jsou považovány za základní tumor supresní mechanizmy, jejichž porucha je nezbytná pro rozvoj nádoru. U jiných tumorů je p53 asi v 50% postižen inaktivačními mutacemi. Nicméně u MCC byla mutace zjištěna jen u 3 z 15 tumorů a u 2 ze 6 buněčných linií [29,30]. Co se týče p63, jiného člena rodiny p53, jeho exprese v MCC buňkách výrazně koreluje s agresivitou onemocnění [31].
MCPyV a MCC
Výrazně častěji oproti běžné populaci se MCC vyskytuje u imunosuprimovaných transplantovaných a u pacientů s AIDS, podobně jako je tomu v případě výskytu Kaposiho sarkomu. Podobnost s tímto tumorem, v jehož etiopatogenezi se účastní herpes virus asociovaný s Kaposiho sarkomem, vedla k myšlence, že rovněž v pozadí MCC může být virová infekce. Feng et al aplikovali techniku DTS (digital transcriptome subctraction) k vyhledání virových sekvencí z MCC derivované DNA [10]. Jejich výzkum vedl k objevení genomu zahrnujícího 5 387 párů bází nového polyomaviru – MCPyV. Přítomnost MCPyV u MCC následně potvrdilo několik nezávislých skupin [32–34]. Frekvence virus pozitivních případů je obecně vysoká (v rozmezí 69–85%) s výjimkou australské populace, kde byla přítomnost viru identifikována jen u 24% MCC. V našem souboru 6 pacientů s MCC, identifikovaných v letech 2000–2009 z databáze bioptického archivu Ústavu patologie naší instituce, byla pomocí real time PCR verifikována přítomnost DNA MCPyV ve 100% tkáňových vzorků primárního nádoru. Pouze v jednom případě se jednalo o imunosuprimovaného pacienta po kombinované transplantaci ledviny a pankreatu [35].Rozvoji tumoru obvykle předchází integrace virové DNA do hostujícího genomu [36]. MCPyV následně exprimuje malý a velký T antigen, které jsou multifunkčními proteiny. Velký T antigen se váže na regulátor buněčného cyklu a tumor suprimující proteiny p53 a RB, a tím je inaktivuje. Následná virová stimulace buněčného cyklu je považována za hlavní hnací sílu v polyomaviry indukované onkogenezi [37,38]. Dalším studiem tohoto viru však bylo zjištěno, že jeho prevalence v běžné populaci je vysoká, neboť u 50–80% dospělých lze detekovat MCPyV specifickou protilátkovou odpověď [39,40]. Jde tedy o častou infekci, která jen velmi zřídka vede k rozvoji MCC. Z prognostického hlediska je význam přítomnosti MCPyV infekce u MCC nejasný a názory se různí. Dle Beckera [6] mají nádory, u kterých byla identifikována tkáňová přítomnost MCPyV, horší prognózu. Proti tomu stojí názor Sihta et al, že pacienti, jejichž MCC genom obsahuje virovou DNA, mají obvykle příznivější průběh choroby [41].
UV záření a imunosuprese
Mimo virovou etiologii se ovšem v patogenezi tumoru účastní i další faktory. Ke vzniku MCC může přispět ultrafialové záření (UV) a riziko vzrůstá se zvýšenou expozicí sluneční UV B složce [29,42]. Role UV záření je v tomto ohledu spíše imunosupresivní než mutagenní, kdy za rozhodující je považována indukce imunosupresivních cytokinů IL 10 a TNF a, izomerizace transurokanové kyseliny na cis urokanovou kyselinu a tvorba reaktivních kyslíkových radikálů [43,44]. Tento poznatek je ve shodě se zřejmou epidemiologickou vazbou mezi užíváním imunosupresivních léků a vznikem MCC [45]. Např. u pacientů po transplantaci ledviny je výskyt MCC až 15krát vyšší oproti běžné populaci. Ve finské studii čerpající data z National Renal Transplant Registry a Finnish Cancer Registry autoři zjistili mezi 4 200 pacienty po transplantaci ledviny tři případy s MCC [46]. Podobná pozorování častějšího výskytu MCC u imunokompromitovaných pacientů a v signifikantně mladším věku v porovnání s věkově srovnatelnými kontrolami učinili i další autoři [47–49]. U těchto pacientů má MCC rovněž dokumentovanou větší „disease specific“ mortalitu, a to až 56% [50]. Na druhou stranu byla publikována řada kazuistik o spontánní regresi MCC a tato byla pozorována i po restauraci imunitních funkcí po redukci imunosupresivní terapie. Např. Friendlander et al dokumentovali terminálně nemocného pacienta po transplantaci ledviny, u kterého došlo k přechodné regresi MCC po eliminaci cyklosporinu z imunosupresivního protokolu [51]. Kauzální role cyklosporinu v patogenezi kožních nádorů u pacientů po orgánové transplantaci je ovšem sporná [52] a riziko jejich vzniku souvisí spíše s celkovou úrovní imunosuprese než s jedním konkrétním imunosupresivem [53,54]. U našeho pacienta po kombinované transplantaci ledviny a pankreatu byla terapie od počátku založena na podávání takrolimu spolu s mykofenolát mofetilem a prednisonem. Přes konverzi na sirolimus a vysazení mykofenolátu krátce po stanovení diagnózy došlo po několika měsících ke generalizaci procesu [35]. Vznik MCC byl pozorován i u pacienta dlouhodobě užívajícího azathioprin [55] a ani v tomto případě konverze na sirolimus nezabránila generalizaci onemocnění. Tyto nálezy podporují myšlenku kauzální role celkové úrovně imunosuprese spíše než jednoho konkrétního imunosupresiva a rovněž naznačují nedostatečný efekt redukce imunosuprese a konverze na sirolimus při ovlivnění dalšího průběhu tohoto onemocnění.
Terapie
Excize tumoru a adjuvantní radioterapie
Po verifikaci MCC na podkladě biopsie nebo excize suspektního kožního ložiska by další terapie měla být vedena chirurgickým pracovištěm specializovaným na léčbu maligního melanomu. Jejím základem je radikální excize nebo v případě pozitivních resekčních hranic reexcize tumoru, vždy doplněná o biopsii sentinelové uzliny. V případě její pozitivity je indikována kompletní disekce regionálních lymfatických uzlin [56]. Na chirurgický výkon by měla navazovat adjuvantní radioterapie cílená na místo primárního výskytu a na oblast regionálních drenážních uzlin, a to v případě, byl li primární tumor větší než 2cm, při pozitivních resekčních hranicích nebo blízkosti tumoru k těmto hranicím a při angiolymfatické invazi [57]. Radioterapie je rovněž jednoznačně doporučena při pozitivní biopsii sentinelové uzliny nebo pokud nebyly uzliny histologicky vyšetřeny [56,58] a u imunokompromitovaných pacientů.
Chemoterapie
Neexistují randomizované studie hodnotící účinnost adjuvantní chemoterapie u pacientů s MCC. Rovněž o efektivitě rozdílných chemoterapeutických protokolů existuje jen málo dat a prezentované závěry jsou protichůdné [59,60]. Adjuvantní chemoterapie je indikována u rozsáhlého uzlinového postižení [61], při extranodální expanzi a při rekurenci po předchozí terapii. V těchto případech je vhodné ji doplnit o radioterapii [62,63]. Nejvíce zkušeností bylo získáno s protokoly užívanými v první linii léčby malobuněčného karcinomu plic, obsahujícími etoposid a karboplatinu [61,64]. Efekt této léčby je popisován v 60–75%, nicméně medián přežití je až na výjimky [65] obvykle jen v řádu měsíců [66].
Nové terapeutické možnosti
Úspěch terapie se tedy zdá být závislý na rozvoji nových terapeutických postupů. V této souvislosti byla zkoušena řada protilátek proti povrchovým receptorům patřícím do protein kinase signalling network, trastuzumab proti erbB 2 receptoru (Her 2/Neu onkogen) a cetuximab proti EGF (epidermal growth factor) receptoru. Tyto receptory ale nebývají u MCC exprimovány [67]. V případě exprese c kit (CD117), VEGF receptorů a PDGF receptorů se nabízí možnost ovlivnit nádorovou proliferaci aplikací sorafenidu nebo sunitinibu [24] a u nádorů exprimujících PDGF receptory i podáním imatinib mesylátu [20]. U MCC byla rovněž pozorována zvýšená exprese antiapoptotického proteinu Mcl 1, člena rodiny Bcl 2 proteinů, a Bmi 1, transkripčního represoru patřícího do rodiny polycomb group proteinů, ovlivňujícího regulaci buněčného cyklu, proliferaci a buněčnou sebeobnovu [24]. Inhibice těchto expresních genů zodpovědných za buněčnou proliferaci a apoptózu pomocí antisense oligonukleotidů nebo microRNAs by mohla být rovněž nadějnou cestou, jak ovlivnit nádorový růst [68]. K ozřejmění významu této protinádorové a antiangiogenní terapie u MCC však budou nutné další studie. K ověření zůstává i antitumorózní efekt IFN alfa, který in vitro redukoval proliferaci buněčných linií, DNA syntézu a indukoval apoptózu MCC buněk [69]. Stejně tak bude nutné ověřit další potenciální terapeutický přístup s objasněním role Atoh1 transkripčního faktoru v diferenciaci Merkelových buněk [2], zda Atoh1 funguje u Merkelových buněk jako tumor supresorový gen a také jaké jsou možnosti jeho regulace s využitím v protinádorové terapii [70].
Prevence
Základním preventivním opatřením zůstává pravidelná kontrola kůže u imunosuprimovaných pacientů spojená v případě suspektního nálezu u menších lézí s těsnou excizí, u větších s provedením prosté biopsie. Aplikace antivirotik u MCPyV pozitivních rizikových pacientů je limitována skutečností, že v té době je již u většiny pacientů přítomna protilátková odpověď, což nasvědčuje tomu, že aktivní infekce proběhla v předchorobí a neprobíhá aktivní replikace viru. V budoucnu tak snad bude možné alespoň využít profylaktickou vakcinaci proti MCPyV, a to u imunosuprimovaných pacientů, kteří se doposud s MCPyV infekcí nesetkali [71].
Prognóza
Z prognostického hlediska hraje u MCC nejvýznamnější roli staging tumoru v době záchytu onemocnění. Lokalizovaný tumor < 2cm bez uzlinových metastáz má dobrou prognózu. Nádory velikosti > 2cm jsou spojeny s vysokým rizikem generalizace [72]. Rovněž některé další faktory jsou diskutovány z hlediska jejich možného vlivu na prognózu pacientů. Léze lokalizované na hýždi a trupu jsou spojovány s vyšším výskytem nodálních metastáz oproti lézím lokalizovaným na hlavě a krku [73,74]. Někteří autoři však zpochybňují vliv primární lokalizace tumoru na celkové přežití pacientů [75]. Podobně byl zpochybněn i význam tumor pozitivní resekční hranice a blízkosti léze regionálním lymfatickým uzlinám v predikci vývoje nodálního postižení [74]. Přesto je doporučeno provádět širokou lokální excizi tumoru, neboť lokální rekurence je spojována s horší celkovou prognózou [73]. Za prognosticky negativní je rovněž považována zvýšená exprese inhibitoru apoptózy survivinu a p63 [27,31].
Závěr
Karcinom z Merkelových buněk je vzácnénádorové onemocnění kůže s výraznou tendencí k lokální rekurenci, postižení regionálních uzlin a vzdáleným metastázám. U imunokompromitovaných pacientů má většinou vysoce agresivní průběh a často fatální výsledek. To zdůrazňuje nutnost pravidelné preventivní inspekce kůže u těchto nemocných a u suspektních lézí indikovat adekvátní chirurgický přístup. V případě potvrzení MCC by návazná terapeutická opatření měla být komplexní a dostatečně intenzivní. Příslibem do budoucna se jeví možnost vakcinační profylaxe či terapie MCPyV infekce u imunokompromitovaných pacientů, terapeutické využití antisense oligonukleotidů nebo microRNAs, případně kompletní eliminace MCC ovlivněním exprese tumor supresorového genu Atoh1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Karel Krejčí, Ph.D.
III. interní nefrologická, revmatologická a endokrinologická klinika FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e mail: karel.krejci@fnol.cz
Zdroje
1. Toker C. Trabecular carcinoma of the skin. Arch Dermatol 1972; 105(1): 107 – 110.
2. Van Keymeulen A, Mascre G, Youseff KK et al. Epidermal progenitors give rise to Merkel cells during embryonic development and adult homeostasis. J Cell Biol 2009; 187(1): 91 – 100.
3. Mottl H, Abrahamová J. Nádor z Merkelových buněk u dvouleté dívky – kazuistika. Klin Onkol 1990; 3(1): 19 – 21.
4. Schmid C, Beham A, Feichtinger J et al. Recurrent and subsequently metastasizing Merkel cell carcinoma in a 7‑year ‑ old girl. Histopathology 1992; 20(5): 437 – 439.
5. Hodgson NC. Merkel cell carcinoma: changing incidence trends. J Surg Oncol 2005; 89(1): 1 – 4.
6. Becker JC, Schrama D, Houben R. Merkel cell carcinoma. Cell Mol Life Sci 2009; 66(1): 1 – 8.
7. Weller K, Vetter ‑ Kauzcok C, Kahler K et al. Guideline implementation in Merkel cell carcinoma: an example of a rare disease. Dtsch Arztebl 2006; 103(42): 2791 – 2796.
8. Girschik J, Fritschi L, Threlfall T et al. Deaths from non‑melanoma skin cancer in Western Australia. Cancer Causes Control 2008; 19(8): 879 – 885.
9. Pectasides D, Pectasides M, Economopoulos T. Merkel cell cancer of the skin. Ann Oncol 2006; 17(10): 1489 – 1495.
10. Feng H, Shuda M, Chang Y et al. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319(5866): 1096 – 1100.
11. Medina ‑ Franco H, Urist MM, Fiveash J et al. Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 2001; 8(3): 204–20 8.
12. Tai PT, Yu E, Tonita J et al. Merkel Cell Carcinoma of the Skin. J Cutan Med Surg 2000; 4(4): 186 – 196.
13. Helmbold P, Schröter S, Holzhausen HJ et al. Merkel cell carcinoma: a diagnostic and therapeutic challenge. Chirurg 2001; 72(4): 396 – 401.
14. Warner TF, Uno H, Hafez GR et al. Merkel cells and Merkel cell tumors. Ultrastructure, immunocytochemistry and review of the literature. Cancer 1983; 52(2): 238 – 245.
15. Smith DF, Messina JL, Perrott R et al. Clinical approach to neuroendocrine carcinoma of the skin (Merkel cell carcinoma). Cancer Control 2000; 7(1): 72 – 83.
16. Brenner B, Sulkes A, Rakowsky E et al. Second neoplasms in patients with Merkel cell carcinoma. Cancer 2001; 91(7): 1358 – 1362.
17. Boyle F, Pendlebury S, Bell D. Further insights into the natural history and management of primary cutaneous neuroendocrine (Merkel cell) carcinoma. Int J Radiat Oncol Biol Phys 1995; 31(2): 315 – 323.
18. Iagaru A, Quon A, McDougall IR et al. Merkel cell carcinoma: Is there a role for 2 - deoxy - 2 - [f - 18]fluoro‑D ‑ glucose‑positron emission tomography/ computed tomography? Mol Imaging Biol 2006; 8(4): 212 – 217.
19. Concannon R, Larcos GS, Genese M. The impact of 18F ‑ FDG PET ‑ CT scanning for staging and management of Merkel cell carcinoma: Results from Westmead Hospital, Sydney, Australia. J Am Acad Dermatol 2010; 62(1): 76 – 84.
20. Swick BL, Ravdel L, Fitzpatrick JE et al. Platelet ‑ derived growth factor receptor alpha mutational status and immunohistochemical expression in Merkel cell carcinoma: implications for treatment with imatinib mesylate. J Cutan Pathol 2008; 35(2): 197 – 202.
21. Swick BL, Ravdel L, Fitzpatrick JE et al. Merkel cell carcinoma: evaluation of KIT (CD117) expression and failure to demonstrate activating mutations in the C ‑ KIT proto ‑ oncogene – implications for treatment with imatinib mesylate. J Cutan Pathol 2007; 34(4): 324 – 329.
22. Feinmesser M, Halpern M, Kaganovsky E et al. c ‑ kit expression in primary and metastatic merkel cell carcinoma. Am J Dermatopathol 2004; 26(6): 458 – 462.
23. Strong S, Shalders K, Carr R et al. KIT receptor (CD117) expression in Merkel cell carcinoma. Br J Dermatol 2004; 150(2): 384 – 385.
24. Brunner M, Thurnher D, Pammer J et al. Expression of VEGF ‑ A/ C, VEGF ‑ R2, PDGF‑alpha/ beta, c ‑ kit, EGFR, Her ‑ 2/ Neu, Mcl ‑ 1 and Bmi ‑ 1 in Merkel cell carcinoma. Mod Pathol 2008; 21(7): 876 – 884.
25. Feinmesser M, Halpern M, Fenig E et al. Expression of the apoptosis‑related oncogenes bcl ‑ 2, bax, and p53 in Merkel cell carcinoma: Can they predict treatment response and clinical outcome? Hum Pathol 1999; 30(11): 1367 – 1372.
26. Kennedy MM, Blessing K, King G et al. Expression of bcl ‑ 2 and p53 in Merkel cell carcinoma. An immunohistochemical study. Am J Dermatopathol 1996; 18(3): 273 – 277.
27. Kim J, McNiff JM. Nuclear expression of survivin portends a poor prognosis in Merkel cell carcinoma. Mod Pathol 2008; 21(6): 764 – 769.
28. Horn HF, Vousden KH. Coping with stress: multiple ways to activate p53. Oncogene 2007; 26(9): 1306 – 1316.
29. Popp S, Waltering S, Herbst C et al. UV ‑ B‑type mutations and chromosomal imbalances indicate common pathways for the development of Merkel and skin squamous cell carcinomas. Int J Cancer 2002; 99(3): 352 – 360.
30. Van Gele M, Kaghad M, Leonard JH et al. Mutation analysis of P73 and TP53 in Merkel cell carcinoma. Br J Cancer 2000; 82(4): 823 – 826.
31. Asioli S, Righi A, Volante M et al. p63 expression as a new prognostic marker in Merkel cell carcinoma. Cancer 2007; 110(3): 640 – 647.
32. Becker JC, Houben R, Ugurel S et al. MC polyomavirus is frequently present in Merkel cell carcinoma of European patients. J Invest Dermatol 2009; 129(1): 248 – 250.
33. Garneski KM, Warcola AH, Feng Q et al. Merkel cell polyomavirus is more frequently present in North American than Australian Merkel cell carcinoma tumors. J Invest Dermatol 2009; 129(1): 246 – 248.
34. Kassem A, Schöpflin A, Diaz C et al. Frequent Detection of Merkel Cell Polyomavirus in Human Merkel Cell Carcinomas and Identification of a Unique Deletion in the VP1 Gene. Cancer Res 2008; 68(13): 5009 – 5013.
35. Krejčí K, Tichý T, Horák P et al. Merkel cell carcinoma of gluteal region with ipsilateral metastasis into the pancreatic graft in patient after combined kidney ‑ pancreas transplantation. Odesláno k publikaci do časopisu Onkologie.
36. zur Hausen H. Novel human polyomaviruses – re‑emergence of a well known virus family as possible human carcinogens. Int J Cancer 2008; 123(2): 247 – 250.
37. Moens U, Van Ghelue M, Johannessen M. Oncogenic potentials of the human polyomavirus regulatory proteins. Cell Mol Life Sci 2007; 64(13): 1656 – 1678.
38. Caracciolo V, Reiss K, Khalili K et al. Role of the interaction between large T antigen and Rb family members in the oncogenicity of JC virus. Oncogene 2006; 25(38): 5294 – 5301.
39. Kean JM, Rao S, Wang M et al. Seroepidemiology of human polyomaviruses. PLoS Pathos 2009; 5(3): Dostupné z: http:/ / www.plospathogens.org/ article/ info:doi%2F10.1371%2Fjournal.ppat.1000363.
40. Tolstov YL, Pastrana DV, Feng H et al. Human Merkel cell polyomavirus infection II. MCV is a common human infection that can be detected by conformational capsid epitope immunoassays. Int J Cancer 2009; 125(6): 1250 – 1256.
41. Sihto H, Kukko H, Koljonen V et al. Clinical Factors Associated With Merkel Cell Polyomavirus Infection in Merkel Cell Carcinoma. J Natl Cancer Inst 2009; 101(23): 938 – 945.
42. Lawenda BD, Thiringer JK, Foss RD et al. Merkel Cell Carcinoma Arising in the Head and Neck: Optimizing Therapy. Am J Clin Oncol 2001; 24(1): 35 – 42.
43. Ullrich SE. Mechanisms underlying UV‑induced immune suppression. Mutat Res 2005; 571(1 – 2): 185 – 205.
44. Ullrich SE. Sunlight and Skin Cancer: Lessons from the Immune Systém. Mol Carcinog 2007; 46(8): 629 – 633.
45. Buell JF, Trofe J, Hanaway MJ et al. Immunosuppression and Merkel cell cancer. Transplant Proc 2002; 34(5): 1780 – 1781.
46. Koljonen V, Kukko H, Tukiainen E et al. Incidence of Merkel cell carcinoma in renal transplant recipients. Nephrol Dial Transplant 2009; 24(10): 3231 – 3235.
47. Busse PM, Clark JR, Muse VV et al. Case records of the Massachusetts General Hospital. Case 19 – 2008. A 63‑year ‑ old HIV ‑ positive man with cutaneous Merkel ‑ cell carcinoma. N Engl J Med 2008; 358(25): 2717 – 2723.
48. Veness MJ, Harris D. Role of radiotherapy in the management of organ transplant recipients diagnosed with non‑melanoma skin cancers. Australas Radiol 2007; 51(1): 12 – 20.
49. Engels EA, Frisch M, Goedert JJ et al. Merkel cell carcinoma and HIV infection. Lancet 2002; 9305(359): 497 – 498.
50. Engels EA, Biggar RJ, Hall HI et al. Cancer risk in people infected with human immunodeficiency virus in the United States. Int J Cancer 2008; 123(1): 187 – 194.
51. Friedlaender MM, Rubinger D, Rosenbaum E et al. Temporary regression of Merkel cell carcinoma metastases after cessation of cyclosporine. Transplantation 2002; 73(11): 1849 – 1850.
52. Kessler M, Jay N, Molle R et al. Excess risk of cancer in renal transplant patients. Transpl Int 2006; 19(11): 908 – 914.
53. Fortina AB, Piaserico S, Caforio AL et al. Immunosuppressive level and other risk factors for basal cell carcinoma and squamous cell carcinoma in heart transplant recipients. Arch Dermatol 2004; 140(9): 1079 – 1085.
54. Moosa MR, Gralla J. Skin cancer in renal allograft recipients – experience in different ethnic groups residing in the same geographical region. Clin Transplant 2005; 19(6): 735 – 741.
55. Boratyńska M, Watorek E, Smolska D et al. Anticancer effect of sirolimus in renal allograft recipients with de novo malignancies. Transplant Proc 2007; 39(9): 2736 – 2739.
56. National Cancer Institute (NCI) guidelines for Merkel Cell Carcinoma treatment available online at http:/ / www.cancer.gov/ cancertopics/ pdq/ treatment/ merkelcell/ HealthProfessional/ page5 (Accessed May 15, 2010).
57. Goepfert H, Remmler D, Silva E et al. Merkel cell carcinoma (endocrine carcinoma of the skin) of the head and neck. Arch Otolaryngol 1984; 110(11): 707 – 712.
58. Veness MJ, Morgan GJ, Gebski V. Adjuvant locoregional radiotherapy as best practice in patients with Merkel cell carcinoma of the head and neck. Head Neck 2005; 27(3): 208 – 216.
59. Poulsen M, Rischin D, Walpole E et al. High‑risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/ etoposide and radiation: a Trans‑Tasman Radiation Oncology Group Study – TROG 96 : 07. J Clin Oncol 2003; 21(23): 4371 – 4376.
60. Poulsen MG, Rischin D, Porter I et al. Does chemotherapy improve survival in high‑risk stage I and II Merkel cell carcinoma of the skin? Int J Radiat Oncol Biol Phys 2006; 64(1): 114 – 119.
61. National Comprehensive Cancer Network (NCCN) guidelines for cancer treatment available online at http:/ / www.nccn.org/ professionals/ physician_gls/ f_guidelines.asp (Accessed August 2, 2009).
62. Eng TY, Naguib M, Fuller CD et al. Treatment of recurrent Merkel cell carcinoma: an analysis of 46 cases. Am J Clin Oncol 2004; 27(6): 576 – 583.
63. Poulsen M, Walpole E, Harvey J et al. Weekly Carboplatin Reduces Toxicity During Synchronous Chemoradiotherapy for Merkel Cell Carcinoma of Skin. Int J Radiat Oncol Biol Phys 2008; 72(4): 1070 – 1074.
64. Tai PT, Yu E, Winquist E et al. Chemotherapy in neuroendocrine/ Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 2000; 18(12): 2493 – 2499.
65. Rečková M, Lawrence HE. Nezvyčajný prípad dlhodobého prežívania pacientky s chemorefraktérnym Merkelovym karcinómom. Klin Onkol 2007; 20(5): 354 – 356.
66. Becker J, Mauch C, Kortmann RD et al. Short German guidelines: Merkel cell carcinoma. J Dtsch Dermatol Ges 2008; 6(Suppl 1): 15 – 16.
67. Maubec E, Duvillard P, Velasco V et al. Immunohistochemical analysis of EGFR and HER ‑ 2 in patients with metastatic squamous cell carcinoma of the skin. Anticancer Res 2005; 25(2B): 1205 – 1210.
68. Dean NM, Bennett CF. Antisense oligonucleotide‑based therapeutics for cancer. Oncogene 2003; 22(56): 9087 – 9096.
69. Krasagakis K, Krüger ‑ Krasagakis S, Tzanakakis GN et al. Interferon‑alpha inhibits proliferation and induces apoptosis of merkel cell carcinoma in vitro. Cancer Invest 2008; 26(6): 562 – 568.
70. Bossuyt W, Kazanjian A, De Geest N et al. Atonal homolog 1 is a tumor suppressor gene. PLoS Biol 2009; 7(2): Dostupné z: http:/ / www.plosbiology.org/ article/ info:doi/ 10.1371/ journal.pbio.1000039.
71. Pastrana DV, Tolstov YL, Becker JC et al. Quantitation of Human Seroresponsiveness to Merkel Cell Polyomavirus. PLoS Pathog 2009; 5(9): Dostupné z: http:/ / www.plospathogens.org/ article/ info:doi%2F10.1371%2Fjournal.ppat.1000578.
72. Allen PJ, Bowne WB, Jaques DP et al. Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 2005; 23(10): 2300 – 2309.
73. Shaw JH, Rumball E. Merkel cell tumour: clinical behaviour and treatment. Br J Surg 1991; 78(2): 138 – 142.
74. Yiengpruksawan A, Coit DG, Thaler HT et al. Merkel cell carcinoma. Prognosis and management. Arch Surg 1991; 126(12): 1514 – 1519.
75. Bielamowizc S, Smith D, Abemayor E. Merkel cell carcinoma: an aggressive skin neoplasm. Laryngoscope 1994; 104(5 Pt 1): 528 – 532.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- ABL1, SRC a další nereceptorové tyrozinkinázy jako nové cíle specifické protinádorové léčby
- Kožní karcinom z Merkelových buněk
- Molekulární prediktory u nádorů hlavy a krku
- Cílená léčba bronchioloalveolárního karcinomu inhibitory tyrozinkinázové aktivity EGFR: přehled literatury a kazuistika klinicky promptní a výrazné odpovědi na léčbu erlotinibem
- Malignity žlučových cest
- Bortezomib v léčbě mnohočetného myelomu u pacientů po alogenní transplantaci krvetvorných buněk
- Pozdní následky Wilmsova tumoru a jeho léčby u pacientů léčených v letech 1980– 2001 na jediném pracovišti
- Změny cílových objemů při použití magnetické rezonance pro plánování radioterapie lůžka prostaty – předběžné výsledky
- Diseminovaný karcinóm prsníka u 28- ročného muža
- Klinický registr NEXAVAR®
- Zápis z XVII. pracovního setkání Fóra onkologů a zástupců zdravotních pojišťoven Brno 21. 5. 2010
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kožní karcinom z Merkelových buněk
- Diseminovaný karcinóm prsníka u 28- ročného muža
- Malignity žlučových cest
- Cílená léčba bronchioloalveolárního karcinomu inhibitory tyrozinkinázové aktivity EGFR: přehled literatury a kazuistika klinicky promptní a výrazné odpovědi na léčbu erlotinibem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



