-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Distribuční šíře monocytů a její význam pro včasnou diagnostiku sepse
Monocyte distribution width and its application for early diagnosis of sepsis
Sepsis is the leading cause of death from infectious diseases. This is one of the most common causes of death. Time is a key factor in starting treatment early, and therefore recognizing patients with a high risk of development of sepsis who are not recognized as critical at the time of admission. In addition to the established biomarkers such as C-reactive protein or procalcitonin, new biomarkers are emerging that reflect their cell in the immune response. One of these biomarkers is Monocytic Distribution Width (MDW). Three subpopulations of monocytes and dendritic cells were characterized in peripheral blood. During sepsis, functional reprogramming occurs between monocytes and macrophages, which causes not only morphological changes but also changes in cell volume. These changes are reflected in the so-called monocytic distribution width, which can be a potential biomarker, or a complementary biomarker, for early diagnosis of sepsis at emergency departments. This is a parameter routinely determined with a differential leukocyte count. According to the recent literature, a suitable MDW cut-off value for sepsis is approximately 23.0 for samples with K3EDTA (respectively 20.5 for K2EDTA).
Keywords:
Monocytes – sepsis – monocytic distribution width
Autoři: P. Lehnert; M. Šrámková; R. Průša
Působiště autorů: Ústav lékařské chemie a klinické biochemie, 2. Lékařská fakulta Univerzity Karlovy a FN Motol, V Úvalu 84, Praha 5, 150 06
Vyšlo v časopise: Klin. Biochem. Metab., 30, 2022, No. 1, p. 5-11
Souhrn
Sepse je hlavní příčinou úmrtí na infekční choroby. Jedná se o jedno z nejčastějších příčin úmrtí. Je velmi důležité rozpoznání pacientů s vysokým rizikem rozvoje sepse, kteří nejsou v době příjmu ještě kriticky nemocní. Vedle klasických biomarkerů, jako jsou C-reaktivní protein nebo prokalcitonin, se hledají biomarkery nové. Jedním z nich je distribuční šíře monocytů (MDW). V periferní krvi byly charakterizovány tři subpopulace monocytů a dendritických buněk. Během sepse dochází k funkčnímu přeprogramování mezi monocyty a makrofágy, což vyvolává také morfologické změny včetně změny v objemu buněk. Tyto změny reflektuje tzv. distribuční šíře monocytů, která může být potenciální biomarker, případně doplňující biomarker, pro včasnou diagnostiku sepse na odděleních urgentního příjmu. Jedná se o parametr stanovovaný rutinně s diferenciálním rozpočtem leukocytů. Podle dostupné literatury je vhodným rozhodovacím limitem MDW pro sepsi přibližně hodnota 23,0 pro vzorky s K3EDTA (event. 20,5 pro K2EDTA).
Klíčová slova:
sepse – monocyty – distribuční šíře monocytů
Epidemiologie a definice sepse
Sepse je nově definována jako život ohrožující orgánová dysfunkce způsobená deregulovanou odpovědí hostitelského organismu na přítomnost infekce. Tato definice je též označována jako Sepsis-3 a byla publikována v roce 2016 časopisem Journal of American Medical Association především k odlišení nekomplikované infekce od sepse a s cílem poskytnout nástroj k včasné identifikaci pacientů s vysokým rizikem úmrtí [1].
Nová definice sepse vyžaduje kromě rozpoznání infekce i rozpoznání akutní orgánové dysfunkce. K tomuto účelu je určeno skóre Sequential Organ Failure Assessment (SOFA) [1]. Toto skóre hodnotí podle bodové stupnice respirační funkce, parametry koagulace, jaterní a renální funkce a stav vědomí. Skóre SOFA nicméně vyžaduje mnoho laboratorních testů (PaO2/FiO2, hypotenze/vazopresory, Glasgow Coma Scale, hladina bilirubinu, kreatininu, počet trombocytů), které nemusejí být vždy včas dostupné a jsou vhodné zejména do prostředí jednotek intenzivní péče. S cílem zjednodušit a zrychlit posouzení přítomnosti orgánové dysfunkce způsobené sepsí v přednemocniční péči, na urgentních příjmech a standardních odděleních doporučuje nová definice používat tzv. qSOFA (quickSOFA). Jedná se o tříbodový systém, kde každý bod reprezentuje odchylku v jednom vitálním parametru: nízký krevní tlak (systolický krevní tlak < 100 mmHg), tachypnoe (> 22 dechů za minutu), změna vědomí (Glasgow Coma Scale < 15). Přítomnost dvou nebo více bodů qSOFA u pacienta s infekcí znamená vysokou pravděpodobnost sepse a významně vyšší riziko nepříznivého průběhu akutního onemocnění a je indikací k aktivnímu pátrání po dalších projevech akutní orgánové dysfunkce [2].
U pacientů nad 65 let jsou infekční příčiny častějším důvodem k hospitalizaci než srdeční selhání a infarkt myokardu [3]. Sepse je hlavní příčinou úmrtí na infekční choroby. Data z roku 2015 ukazují, že sepse každoročně na světě postihne 30 milionů pacientů, z nichž 25-30 % zemře [4]. Náklady vynaložené na léčbu sepse dosahují 5,2 % celkových výdajů na zdravotnictví ve vyspělých zemích. Navíc po vyléčení se pacienti nejsou schopni vrátit do plnohodnotného života. Trpí dlouhodobými tělesnými, mentálními a kognitivními poruchami s významnými zdravotními, ekonomickými a sociálními důsledky a mají zvýšené riziko úmrtí ještě řadu let po epizodě sepse [2]. Včasná diagnóza sepse a především časné zahájení léčby má velký vliv na snížení vysoké úmrtnosti, nákladů na její léčbu, ale i na zlepšení dlouhodobé kvality života pacientů.
Biomarkery infekce v současné době
Na počátku sepse, tohoto těžkého stavu, je vždy určitý typ infekce. Stanovení diagnózy infekce a její léčba je tedy stěžejním a prvním krokem, jak předejít syndromu sepse. Rychlé, přesné a levné stanovení diagnózy infekce je i v současné době velká výzva. Používání standardních kultivačních technik pro izolaci a detekci patogenních organismů ze sterilního vzorku tělních tekutin stále považováno za „zlatý standard“ pro diagnostiku infekce a sepse. Rutinní kultivace krve však může trvat šest hodin až pět dní, přičemž k následné identifikaci (24 hodin) a testování (48 hodin) citlivosti na antibiotika je zapotřebí dalšího času [5]. Během posledního desetiletí bylo navrženo několik biomarkerů sepse. Mezi nimi např. procalcitonin (PCT) a C-reaktivní protein (CRP), které jsou tradičně indikovány při diagnostice a monitorování sepse [6]. Dále je významný interleukin-6 (IL-6), který se dostal opět do popředí zájmu především díky pandemii onemocnění covid-19. Studie se zabývají rolí v predikci závažnosti onemocnění, monitorování odpovědi na terapii a podobností s jinými chorobnými stavy spojenými s cytokinovou bouří [7-10]. Jedním z nejnovějších biomarkerů pro včasnou detekci sepse je presepsin. Studie ukazují, že presepsin může být platným a spolehlivým biomarkerem bakteriální sepse, zejména gramnegativních bakterií, a je také nástrojem při hodnocení účinnosti terapie. Rovněž se ukazuje, že presepsin má diagnostický a prognostický výkon v podstatě srovnatelný s procalcitoninem, i když ne všichni autoři se shodují na diagnostické přesnosti. Studie prováděné v pediatrickém prostředí ukázaly, že při diagnostice neonatální sepse může být presepsin účinnější než procalcitonin [11]. Biomarkery, jako procalcitonin, presepsin, interleukin-6, CRP, jsou významně ovlivněny pooperačním stresem u pacientů bez jakýchkoli infekčních komplikací. V důsledku infekce, autoimunitního stavu, monogenních poruch, ale také po léčbě některými typy imunoterapie může docházet k hypercytokinemii neboli cytokinové bouři [12]. Jedná se o fyziologickou reakci organismu na vnější agens např. virus, bakterie, ale i neinfekční podnět, jakým může být pankreatitida, roztroušená skleróza nebo reakce imunitního systému vůči hostitelskému štěpu, při které dochází k nadbytečné produkci prozánětlivých cytokinů jako např. interleukinu-1β, interleukinu-6 a tumor nekrotického faktoru alfa.
Vedle standardních biochemických biomarkerů se v posledních letech objevují studie, které se zaměřují na parametry krevního obrazu a diferenciálního rozpočtu leukocytů [13]. Jedná se o skóre Intensive Care Infection Score (ICIS), které se skládá z pěti parametrů derivovaných z krevního obrazu a diferenciálu leukocytů týkajících se vrozené imunitní odpovědi.
Role monocytů v progresi sepse
Monocyty jsou buňky vrozeného imunitního systému první linie obrany těla před infekcí. Mezi další buňky tohoto systému patří neutrofily, bazofily, eozinofily, žírné buňky a také určité typy lymfocytů, jako jsou yδ-T-buňky a přirozené zabíječské lymfocyty. Vrozená imunitní odpověď se vyvíjí během prvních hodin a dní poté, co proniknou patogeny do lidského těla. Myeloidní prekurzory v kostní dřeni se diferencují na promonocyty a poté na zralé monocyty, které vstupují do periferní krve. Tyto monocyty zůstávají v oběhu po dobu jednoho až tří dnů, poté migrují do tkání a orgánů, kde se mění v makrofágy a dendrické buňky. Morfologicky monocyty jsou velké buňky měřící v průměru 10 až 18 μm, se spletenými jádry a azurofilními granulemi v cytoplazmě [14].
Monocyty hrají multifunkční role v homeostáze, imunitní obraně a opravě tkání a bylo prokázáno, že exprimují extrémně rozmanitý transkriptom. Funkce těchto buněk je regulována řadou buněčných povrchových receptorů. V periferní krvi byly charakterizovany tři subpopulace monocytů a dendrických buněk.
Klasické monocyty, které představují 80–90 % monocytů v periferní krvi a jsou charakteristické velkým výskytem znaků CD14, ale nepřítomností znaků CD16 a značí se: (CD14++CD16-). CD14 je glykoprotein, vyskytující se na povrchu monocytů a makrofágů a je receptorem pro lipopolysacharidové (LPS) komplexy. Malý fragment vzniklý odštěpením od glykoproteinu CD14 označovaný jako sCD14-ST je známý jako presepsin. CD16 se nachází na povrchu nejen monocytů, ale i neutrofilů a makrofágů. CD16 byl identifikován jako Fc receptor FcγRIIIa (CD16a) a FcγRIIIb (CD16b) a patří do imunoglobulinové superrodiny (IgSF) zapojený do buněčné cytotoxicity závislé na protilátkách. Monocyty „intermediate“ jsou zastoupeny ve velmi malém počtu a jsou charakterizovány větším výskytem povrchových znaků CD16 (CD14++CD16+) a jejich počet roste při zánětech nebo cytokinové stimulaci. „Neklasické“ monocyty jsou charakterizovány úbytkem znaků CD14 a naopak vykazují vysoký výskyt znaků CD16 (CD14+CD16++) [15].
Změny funkčních vlastností souvisejících s monocyty byly pozorovány u časné sepse, kdy se v krvi zvýšila hladina tzv. „intermediate“ monocytů (CD14++CD16+) [16]. Během sepse dochází k funkčnímu přeprogramování mezi monocyty a makrofágy, což vyvolává změnu tvaru i objemu buněk [17]. Tyto změny reflektuje tzv. distribuční šíře monocytů, která může být potenciální biomarker pro včasnou diagnostiku sepse na urgentních odděleních [18] nebo na jednotkách intezivní péče [19].
Distribuční šíře monocytů a současný stav
Distribuční šíře monocytů (MDW) je parametr, který je vydáván hematologickým analyzátorem v rámci diferenciálního rozpočtu leukocytů. Parametr je určen dospělým pacientům, kteří jsou přijímáni na urgetních příjmech s podezřením na sepsi a je u nich objednána analýza krevního obrazu spolu s diferenciálním rozpočtem leukocytů. Analýza vzorku musí proběhnout do dvou hodin od odebrání vzorku žilní krve. Odběr krve může být buď do zkumavek s antikoagulantem K2EDTA nebo K3EDTA. Podle typu antikoagulantu se liší cut-off hodnoty, přičemž pro K2EDTA odpovídá hodnotě 20,0 a pro K3EDTA je hodnota 21,5 [20]. Pokud jsou výsledky analýzy vyšší než hodnoty cut-off pro jednotlivé antikoagulanty, hrozí riziko rozvoje sepse během 12 hodin od příjmu pacienta. Při interpretaci výsledků se musí vždy brát v úvahu celkový klinický obraz pacienta a výsledky dalších vyšetření. Naopak při hodnotách rovných nebo menších, než jsou stanovené cut-off hodnoty pro dané antikoagulanty, nelze jednoznačně vyloučit rozvoj sepse v dalších 12 hodinách a opět je potřeba postupovat dle správné klinické a laboratorní praxe.
Samotný parametr MDW se vypočítá jako standardní odchylka (SD) ze sady hodnot objemu monocytárních buněk. Populace monocytů je charakterizována pomocí objemu (V), vodivosti (C) a několika úhlů rozptylu světla (S). Měření objemu koreluje s velikostí buňky. Monocyty jsou poté identifikovány v dataplotu objemu (V) versus rotovaného rozptylu světla (Rotated Light Scatter (RLSn)). Parametr MDW je kontrolován dvěma typy kontrol. Kontrolují dva nové parametry (MDW a LDW-Lymphocytes Distribution Width) na třech hladinách a představují hodnoty disperze pro různé velikosti populací podskupin bílých krvinek. Parametr MDW poskytuje větší hodnotu rozptylu nad cut-off hodnotou, zatímco parametr LDW poskytuje menší disperzní hodnoty blízko nebo pod cut-off hodnotou. Druhou kontrolou je kontrola nastavení modulu, který měří objem (V), vodivosti (C) a úhly rozptylu světla (S) [20].
Diagnostický význam distribuční šíře monocytů
Výsledky několika multicentrických studií, které byly od roku 2017 provedeny a jsou shrnuty v Tabulce 1, jednoznačně ukázaly, že u pacientů s diagnózou sepse dle definice Sepsis-2 nebo Sepsis-3, jsou hodnoty distribuční šíře monocytů významně vyšší, než u pacientů bez sepse [19, 21-24, 29, 31]. Mnohé studie potvrdily, že cut-off hodnota pro skupinu pacientů se sepsí je přibližně pro odběrový materiál s K2EDTA ≥ 20,0 a pro K3EDTA ≥ 21,5. Drobné odchylky od těchto hodnot v jednotlivých studiích jsou ve většině případů způsobeny různě velkým souborem dat pacientů, případně i jejich zařazením do skupin dle různých definic sepse. Vyšší hodnoty MDW byly pozorovány u pacientů na jednotkách intenzivní péče, na rozdíl od pacientů, kteří prošli oddělením urgentního příjmu [19, 27]. Nevýhodou těchto studií je relativně malý soubor pacientů, ale zároveň ukazují zajímavý trend, kdy u pacientů, kteří přežili, byl medián počáteční hodnoty MDW 29,14 a v době ukončení pobytu na jednotce intenzivní péče byl medián hodnoty MDW 25,67. U pacientů, kteří nepřežili, naopak zůstaly mediány hodnot MDW stejné, tedy 29,19 respektive 29,13. [27] Nicméně jsou patrné rozdíly mezi jednotlivými studiemi. Crouser a kolektiv pracovali s cut-off hodnotou 20,5, při které byla senzitivita a specificita 74,0 %, respektive 72,0 % [24], zatímco Agnello a kolektiv reportovali senzitivitu a specificitu 92,0 %, respektive 92,9 %, ale při cut-off hodnotě 23,5 [24]. Jediná studie zabývající se problematikou referenčních mezí je od Agnello a kolektivu z roku 2020 [25]. Autoři pro stanovení referenčních mezí biomarkeru MDW využili 486 dospělých a zdravých dárců krve. Data ze studie zpracovali podle tří statistických modelů, kdy odchylky od jednotlivých modelů nebyly statisticky významné. Průnik všech tří modelů stanovil spodní a horní mez biomarkeru MDW 16,19 – 23,24. Vedle studií zabývajících se především stanovením cut-off hodnoty a diagnostickým významem samotného biomarkeru MDW, vznikly dvě studie, které sledují vedle distribuční šíře monocytů také další parametr z diferenciálního rozpočtu leukocytů, a to průměrný objem monocytů (MMV) [28, 32]. Parametr, který kombinuje jak MDW, tak průměrný objem monocytů (MMV), nazvali autoři jako index sepse (SI). Hlavním důvodem pro vznik tohoto parametru vedl autory fakt, že v předchozích publikacích při hodnotách MDW 23 – 26 docházelo k falešně pozitivním výsledkům a pacienti byli často zařazováni do jiných kategorií (SIRS, sepse, infekce). Autoři proto začali hledat vztah mezi distribuční šíří monocytů a průměrným objemem monocytů, kdy vzrůstající hodnoty MDW jsou spojeny s výskytem populace cirkulujících monocytů charakterizovaných jejich zvýšeným objemem. Při stratifikaci pacientů podle přítomnosti sepse (septický vs. neseptický), samotné parametry MDW a MMV identifikovaly dva klastry (septický vs. neseptický) s překrývající se oblastí. Zajímavým faktem je, že pokud je MDW vyneseno proti MMV pro všechna pozorování, oblast překryvu byla výrazně snížena. Vývojem polynomické funkce, která interpolovala všechny body shluku septických pacientů, kteří odpovídali daným kritériím: i) hodnota MDW ≥ 23; ii) nejnižší hodnota MDW se stejným MMV, se zvýšila specifita parametru MDW. Při aplikaci této polynomické funkce byla získána pro každou hodnotu MMV teoretická hodnota MDW (MDWth). Index sepse se vypočítá jako poměr MDW/MDWth a hodnota ≥ 1 byla určena jako cut-off k definování sepse. Analýza křivky ROC ukázala, že index sepse by mohl mít výjimečnou diagnostickou přesnost pro predikci sepse. Ačkoli plocha pod křivkou (AUC) indexu sepse nebyla významně odlišná od parametru MDW (0,964 respektive 0,966), specificita indexu sepse s cut-off ≥ 1 byla vyšší než samotného MDW (94,7 % respektive 90,6 %), bez snížení citlivosti (92,0 %). Index sepse byl validován a zaveden do rutinní praxe [32], nicméně autoři zdůrazňují, že index sepse není diagnostickým biomarkerem sepse, ale pouze identifikuje pacienty s vysokým rizikem jejího vzniku.
Tab. 1. Systematic review of recent publications on MDW 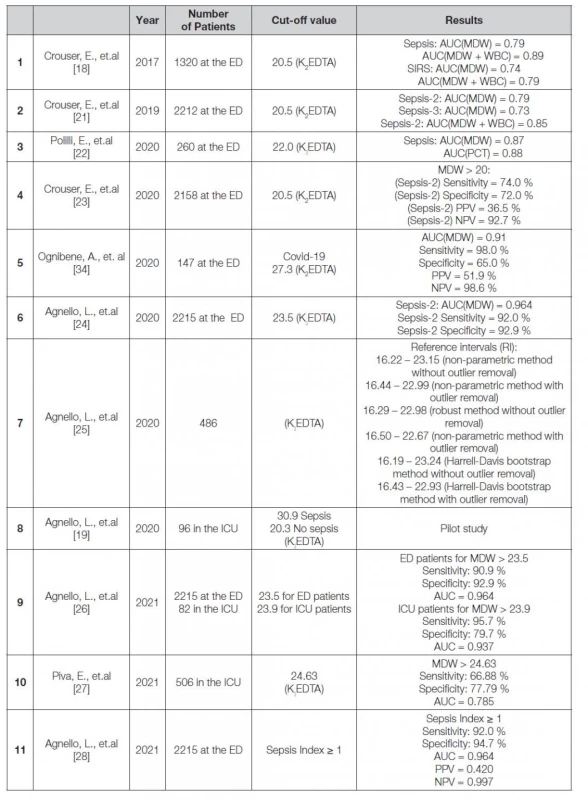

(ED = Emergency Department; ICU = Intensive Critical Care Unit; PPV = Positive Predictive Value; NPV = Negative Predictive Value) Kromě studie o indexu sepse byla publikována další studie, která se zaměřuje na diagnostiký význam biomarkeru MDW v kombinaci s dalšími parametry krevního obrazu, NLR (Neutrophil-to-Lymphocyte Ratio) a PLR (Platelet-to-Lymphocyte Ratio), kdy se jedná o poměr neutrofilů k lymfocytům a ve druhém případě o poměr krevních destiček k lymfocytům [33]. Zjištění této studie naznačila, že nové zánětlivé biomarkery, konkrétně MDW > 20, NLR > 9 a PLR > 210 ve spojení se skórovacími systémy jako jsou SOFA a qSOFA, mohou zvýšit diagnostickou přesnost pro časnou detekci sepse. Vedle těchto zjištění autoři vyvinuli jednoduchý pětibodový model, který zahrnuje skóre qSOFA > 1 spolu s MDW > 20, NLR > 9 a PLR > 210. Autoři na základě těchto získaných dat předpokládají, že tento model by mohl pomoci při stratifikaci pacientů, kteří potřebují včasné nasazení antibiotik, od těch, kteří je nepotřebují, přičemž vycházejí ze základní teze, kdy včasného použití antibiotik lze dosáhnout pouze prostřednictvím rychlé a správné diagnostiky sepse. Tento nový bodovací systém vyvinutý pro predikci sepse vykazoval plochu pod křivkou (AUC) 0,757, při použití skóre qSOFA > 1, NLR > 9 U, PLR > 210 a MDW > 20 U. Při hodnotě skóre dva tento nový bodovací systém vykazoval citlivost 77,7 % a specificitu 63,9 % pro včasnou diagnostiku sepse na odděleních urgentního příjmu.
Distribuční šíře monocytů ve srovnání s CRP a prokalcitoninem
Vedle studií, které se zabývají diagnostickým významem samotného biomarkeru MDW případně s dalšími parametry krevního obrazu, vznikly studie, které porovnávají tento biomarker se dvěma nejčastějšími, a to CRP a prokalcitoninem. Ve studii od Polilli a kolektiv se ukazuje, že při srovnání MDW s prokalcitoninem se plochy pod křivkou (AUC), pro MDW = 0,87 a pro PCT = 0,88 při hodnotách MDW = 22,0 a PCT = 1,0 ng/mL, téměř překrývaly, což naznačuje, že MDW může být skutečně hodnoceno pro predikci sepse v klinické praxi [22]. Autoři na závěr konstatují, že biomarker MDW byl přinejmenším vhodným ekvivalentem pro PCT pro predikci sepse u pacientů hospitalizovaných na infekčním oddělení, a to především z ekonomického pohledu, ale i co se týče dostupnosti a rychlosti stanovení. Navíc při hodnotách MDW < 20 byly vždy pozorovány negativní hemokultury. Senzitivita, specificita, pozitivní prediktivní hodnota a negativní prediktivní hodnota pro MDW > 22 byly 94,3 %, 69,7 %, 67,8 % a 94,7 %. Stejně tak byly stanoveny pro hodnoty PCT > 1 ng/mL v pořadí senzitivita, specificita, pozitivní prediktivní hodnota a negativní prediktivní hodnota, 82,7 %, 86,7 %, 85,1 % a 84,5 %.
V další studii byl diagnostický význam MDW porovnáván s CRP. V celé kohortě pacientů vykazoval CRP statisticky významnou korelaci s MDW (Spearman rho 0,513, p < 0,001). Při analýze křivky ROC pro predikci sepse byla AUC pro MDW (0,964; 95% CI 0,945 – 0,984) významně vyšší (DeLong, p = 0,014) než pro CRP (0,935; 95% CI 0,915–0,954) [24]. Závěrem autoři konstatují, že biomarker MDW je nezávislý prediktor sepse, což potvrdila univariační a vícerozměrná logistická regresní analýza. Zároveň MDW prokázal vynikající diagnostickou přesnost předpovědi sepse, vyšší než CRP, jak ukazuje analýza křivky ROC. Nejlepší cut-off hodnotu MDW pro detekci sepse byla 23,5. Na základě dat studie se podporuje používání biomarkeru MDW jako screeningového nástroje pro včasnou identifikaci pacientů s vysokým rizikem sepse na odděleních urgentního příjmu.
První studií, která hodnotila MDW jako biomarker sepse a porovnává jej jak s CRP, tak s prokalcitoninem, je od Woo a kolektivu z roku 2021 [29]. Diagnostický výkon všech biomarkerů byl testován pomocí AUC křivek ROC, senzitivity a specificity. Pacienti byli rozděleni do tří skupin podle definice Sepse-3: neinfekce, infekce a sepse. Biomarker MDW vykazoval nejvyšší hodnotu v skupině sepse (medián = 24,0). Hodnoty AUC pro MDW, CRP, PCT a bílých krvinek pro predikci sepse byly 0,71 (95% interval spolehlivosti [CI], 0,67–0,75), 0,75 (95% CI, 0,71–0,78), 0,76 (95% CI, 0,72–0,79 a 0,61 (95% CI, 0,57–0,65). S optimální mezní hodnotou kohorty byla citlivost 83,0 % pro MDW (cut-off, 19,8), 69,7 % pro CRP (cut-off, 4,0) a 76,6 % pro PCT (cut-off, 0,05 ng/mL). Kombinace skórovacího systému qSOFA s MDW zlepšila AUC (0,76; 95% CI, 0,72–0,80). Samotný skórovací systém qSOFA vykázal hodnotu AUC (0,67; 95% CI, 0,62–0,72).
Poslední dostupnou publikací, jejímž cílem bylo vyhodnotit a porovnat výkonnost MDW pro včasnou detekci sepse na oddělení urgentního příjmu s prokalcitoninem a CRP, je multicentrická studie od Hausfater a kolektiv z roku 2021 [31]. Pacienti byli hodnoceni podle kritérií Sepsis-2 a Sepsis-3. Diagnostický význam byl hodnocen dle AUC při 95% intervalu spolehlivosti. Pro diagnostiku dle Sepsis-2 byly hodnoty 0,81 (0,78–0,84) a 0,86 (0,84–0,88) pro MDW a MDW kombinované s leukocyty. Pro diagnostiku dle Sepsis-3 byla AUC pro MDW 0,82 (0,79–0,85). Kombinace AUC pro detekci sepse pomocí MDW s WBC byl podobný jako pro samotný CRP 0,85 (0,83-0,87) a překračoval AUC pro PCT 0,78 (0,75–0,81).
Závěr
Sepse je komplexní syndrom. V současné době neexistuje žádný dokonalý „zlatý standard“ pro diagnostiku sepse a stále existuje riziko nesprávné diagnózy. Včasná intervence např. nasazení vhodných antibiotik, může vést k lepším výsledkům při léčbě sepse, a proto jsou rychlé a snadno dostupné screeningové nástroje velmi přínosné. MDW jak samotná, tak v kombinaci s leukocyty, může být přínosem v rámci diferenciální diagnostiky sepse. Společně s dalšími klinickými kritérii jako SIRS nebo skórovací systém qSOFA může zlepšit přesnost včasné diagnostiky sepse zejména na odděleních urgentního příjmu. Jako u každého nového biomarkeru existují určitá omezení, a proto je potřeba k němu přistupovat s opatrností. Jedná se biomarker nespecifický, ale z dosud publikovaných dat je patrné, že u určitých skupin pacientů existuje vztah mezi hodnotou MDW a tíží stavu pacienta. Biomarker MDW vykazoval v několika studiích relativně vyšší citlivost, negativní prediktivní hodnotu a lepší diagnostický výkon než konvenční zánětlivé markery jako CRP a PCT. Jeho jednoznačnou výhodou je dostupnost, rychlost a cena vyšetření. Jedná se o parametr vydávaný běžně s diferenciálním rozpočtem leukocytů. U tak komplexního závažného stavu, jako je sepse, bude vždy existovat šedá zóna, kde nepomůže žádný biomarker, ale vždy úsudek zkušeného klinika. Medicína hledá biomarker, který umí rychle a spolehlivě odhalit infekci, případně rozlišit virovou a bakteriální infekci. V současné době existují data, která ukazují přínos MDW v této problematice.
Seznam zkratek
AUC area under the curve (plocha pod křivkou)
CRP C-reaktivní protein
IL-6 interleukin-6
MDW monocyte distribution width (distribuční šíře monocytů)
MMV mean monocyte volume (střední objem monocytů)
NLR poměr neutrofilů/lymfocytů
PCT prokalcitonin
PLR poměr trombocytů/lymfocytů
SI sepsis index
SIRS systemic inflammatory response syndrome (syndrom systémové zánětlivé reakce)
SOFA sequential organ failure assessment (hodnocení sekvenčního selhání orgánů)
qSOFA quick sequential organ failure assessment (rychlé sekvenční hodnocení orgánového selhání)
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 4. 1. 2022
Adresa pro korespondenci
Prof. MUDr. Richard Průša, CSc.
Ústav lékařské chemie a klinické biochemie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: richard.prusa@lfmotol.cuni.cz
Zdroje
1. Singer, M., Deutschman, C. S., Seymour, C. W., et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3), JAMA, 2016, 315, s. 801-810.
2. Matějovič, M. Sepse a její nová definice, Postgraduální nefrologie, 2017, 15(1), s. 4-8.
3. Goto, T., Yoshida, K., Tsugawa, Y., et al. Infection Disease-Related Emergency Department Visits of Elderly Adults in the United States, 2011-2012. J. Am. Geriatr. Soc., 2016, 64, s. 31-36.
4. Fleischmann, C., Scherag, A., Adhikari, N. K., Hartog, C. S., Tsaganos, T., Schlattmann, P., et al. International Forum of Acute Care Trialists Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations, Am. J Respir. Crit. Care Med., 2016, 193(3), s. 259-272.
5. Sinha, M., Jupe, J., Mack, H., Coleman, T. P., Lawrence, S. M., Fraley, S. I. Emerging Technologies for Molecular Diagnosis of Sepsis. Clin. Microbiol. Rev., 2018, 31(2), e00089-17.
6. Heper, Y., Akalin, E. H., Mistik, R., Akgöz, S., Töre, O., Göral, G., et al. Evaluation of serum C-reactive protein, procalcitonin, tumor necrosis factor alpha, and interleukin-10 levels as diagnostic and prognostic parameters in patients with community-acquired sepsis, severe sepsis, and septic shock. Eur. J Clin. Microbiol. Infect. Dis., 2006, 25(8), s. 481-491.
7. Ruan, Q., Yang, K., Wang, W., Jiang, L., Song, J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intens. Care Med., 2020, 46(5), s. 846–848.
8. Chen G, Wu, D., Guo, W., et al. Clinical and immunologic features in severe and moderate Coronavirus Disease 2019. J Clin. Invest., 2020, 130(5), s. 2620-2629.
9. Laguna-Goya, R., Utrero-Rico, A., Talayero, P., Lasa-Lazaro, M., Ramirez-Fernandez, A., Naranjo, L., et al. IL-6-based mortality risk model for hospitalized patients with COVID-19. J Allergy Clin. Immunol., 2020, 146(4), s. 799-807.
10. Copaescu, A., Smibert, O., Gibson, A., Phillips, E. J., Trubiano, J. A. The role of IL-6 and other mediators in the cytokine storm associated with SARS-CoV-2 infection. J Allergy Clin. Immunol., 2020, 146(3), s. 518 – 534.
11. Piccioni, A., Santoro, M. C., de Cunzo, T., et al. Presepsin as Early Marker of Sepsis in Emergency Department: A Narrative Review. Medicina (Kaunas), 2021, 57(8), s. 770-781.
12. Fajgenbaum, D. C., and June, C. H. Cytokine Storm. N Engl. J Med., 2020, 383(23), s. 2255-2273.
13. van der Geest, P. J., Mohseni, M., Linssen, J., Duran, S., de Jonge, R., Groeneveld, A. B. The intensive care infection score - a novel marker for the prediction of infection and its severity. Crit. Care, 2016, 20(1), s. 180-188.
14. Sukhacheva, E. The Role of Monocytes in the Progression of Sepsis. Clin. Lab., 2020 August. Dostupné z: https://clinlabint.com/the-role-of-monocytes-in-theprogression - of-sepsis/
15. Ziegler-Heitbrock, L., Ancuta, P., Crowe, S., Dalod, M., Grau, V., Hart, DN., et al. Nomenclature of monocytes and dendritic cells in blood. Blood, 2010, 116(16), e74-80.
16. Greco, M., Mazzei, A., Palumbo, C., Verri, T., Lobreglio, G. Flow Cytometric Analysis of Monocytes Polarization and Reprogramming From Inflammatory to Immunosuppressive Phase During Sepsis. EJIFCC, 2019, 30(4), s. 371-384.
17. Arenson, E. B. Jr., Epstein, M. B., Seeger, R. C. Volumetric and functional heterogeneity of human monocytes. J Clin. Invest., 1980, 65(3), s. 613-8.
18. Crouser, E. D., Parrillo, J. E., Seymour, C., Angus, D. C., Bicking, K., Tejidor, L., et al. Improved Early Detection of Sepsis in the ED With a Novel Monocyte Distribution Width Biomarker. Chest, 2017, 152(3), s. 518-526.
19. Agnello, L., Sasso, B. L., Giglio, R. V., Bivona, G., Gambino, C. M., Cortegiani, A., et al. Monocyte distribution width as a biomarker of sepsis in the intensive care unit: A pilot study. Ann. Clin. Biochem., 2021, 58(1), s. 70-73.
20. Beckman Coulter, Inc. Early Sepsis Indicator (ESId) Application Addendum, PN C21894AC, April 2020.
21. Crouser, E. D., Parrillo, J. E., Seymour, C. W., Angus, D. C., Bicking, K., Esguerra, V. G., et. al. Monocyte Distribution Width: A Novel Indicator of Sepsis-2 and Sepsis-3 in High-Risk Emergency Department Patients. Crit Care Med., 2019, 47(8), s. 1018-1025.
22. Polilli, E., Sozio, F., Frattari, A., Persichitti, L., Sensi, M., Posata, R., et.al. Comparison of Monocyte Distribution Width (MDW) and Procalcitonin for early recognition of sepsis. PLoS One, 2020, 15(1), s. 1-13.
23. Crouser, E. D., Parrillo, J. E., Martin, G. S., Huang, D. T., Hausfater, P., Grigorov, I., et. al. Monocyte distribution width enhances early sepsis detection in the emergency department beyond SIRS and qSOFA. J Intens. Care, 2020, 8, s. 33-43.
24. Agnello, L., Bivona, G., Vidali, M., Scazzone, C., Giglio, R. V., Iacolino, G., et. al. Monocyte distribution width (MDW) as a screening tool for sepsis in the Emergency Department. Clin. Chem. Lab. Med., 2020, 58(11), s. 1951-1957.
25. Agnello, L., Lo Sasso, B., Bivona, G., Gambino, C. M., Giglio, R. V., Iacolino, G., et. al. Reference interval of monocyte distribution width (MDW) in healthy blood donors. Clin. Chim. Acta, 2020, 510, s. 272-277.
26. Agnello, L., Lo Sasso, B., Vidali, M., Scazzone, C., Gambino, C. M., Giglio, R. V., et. al. Validation of monocyte distribution width decisional cut-off for sepsis detection in the acute setting. Int. J Lab. Hematol., 2021, 43(4), O183-O185.
27. Piva, E., Zuin, J., Pelloso, M., Tosato, F., Fogar, P., Plebani, M. Monocyte distribution width (MDW) parameter as a sepsis indicator in intensive care units. Clin. Chem. Lab. Med., 2021, 59(7), s. 1307-1314.
28. Agnello, L., Iacona, A., Lo Sasso, B., Scazzone, C., Pantuso, M., Giglio, R. V., et. al. A new tool for sepsis screening in the Emergency Department. Clin. Chem. Lab. Med., 2021, 59(9), s. 1600-1605.
29. Woo, A., Oh, D. K., Park, C. J., Hong, S. B. Monocyte distribution width compared with C-reactive protein and procalcitonin for early sepsis detection in the emergency department. PLoS One, 2021, 16(4), e0250101.
30. Riva, G., Castellano, S., Nasillo, V., Ottomano, A. M., Bergonzini, G., Paolini, A., et. al. Monocyte Distribution Width (MDW) as novel inflammatory marker with prognostic significance in COVID-19 patients. Sci Rep., 2021, 11(1), 12716-12725.
31. Hausfater, P., Robert Boter, N., Morales Indiano, C., Cancella de Abreu, M., Marin, A. M., Pernet, J., et. al. Monocyte distribution width (MDW) performance as an early sepsis indicator in the emergency department: comparison with CRP and procalcitonin in a multicenter international European prospective study. Crit. Care., 2021, 25(1), 227-239.
32. Agnello, L., Iacona, A., Maestri, S., Lo Sasso, B., Giglio, R. V., Mancuso, S., et. al. Independent Validation of Sepsis Index for Sepsis Screening in the Emergency Department. Diagnostics (Basel), 2021, 11(7), s. 1292-1299.
33. Hou, S. K., Lin, H. A., Chen, S. C., Lin, C. F., Lin, S. F. Monocyte Distribution Width, Neutrophil-to-Lymphocyte Ratio, and Platelet-to-Lymphocyte Ratio Improves Early Prediction for Sepsis at the Emergency. J Pers. Med., 2021, 11(8), s. 732-746.
34. Ognibene, A., Lorubbio, M., Magliocca, P., Tripodo, E., Vaggelli, G., Iannelli, G., et. al. Elevated monocyte distribution width in COVID-19 patients: The contribution of the novel sepsis indicator. Clin. Chim. Acta, 2020, 509, s. 22-24.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2022 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Biochemické analyty séra, COVID-19 a harmonizace
- Kvantitativní měření a neutralizační kapacita anti-SARS-CoV-2. Stav v srpnu 2021. Krátké sdělení.
- Doporučení České společnost klinické biochemie ČLS JEP o vnitřní kontrole kvality
- Doporučení České společnost klinické biochemie ČLS JEP Laboratorní aspekty stanovení kardiálních troponinů
- In memoriam Per Hyltoft Petersen
- Zelená éra a klinická laboratoř
- Distribuční šíře monocytů a její význam pro včasnou diagnostiku sepse
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Distribuční šíře monocytů a její význam pro včasnou diagnostiku sepse
- Doporučení České společnost klinické biochemie ČLS JEP o vnitřní kontrole kvality
- Biochemické analyty séra, COVID-19 a harmonizace
- Zelená éra a klinická laboratoř
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



