-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pracovní návrh doporučených postupů pro diagnostiku a léčbu kostních poruch při CKD MBD se specifickým zaměřením na nálezy nízkého obsahu kostního minerálu při vyšetření DXA
Background theses for the formulation of guidelines on diagnosis and therapy metabolic bone disease as a part of CKD-MBD, with specific focus on low mineral bone content in DXA examination
The paper brings the basal background for the interdisciplinary cooperation between clinical osteology and nephrology in the field of metabolic osteopathy in kidney patients. Traditionally, renal bone disease is presented as a result of missing excretory, as well as endocrine renal function. Its main cause is secondary hyperparathyroidism, resp. disordered function of parathyroid glands. The term CKD-MBD, promoted in 2006, take into account the association between bone disorder and its systemic consequences, namely cardiovascular. The indication for the DXA assessment in kidney patients is growing. Low bone mineral content, however, is not representative for the severity of hyperparathyreosis, but it brings important information about associated or even dominating osteoporosis. It has been proven that renal patients may suffer from any other metabolic disease, not being associated with renal function. Clinical osteology focused on metabolic bone diseases. The most common bone disease is osteoporosis. As stated above, this osteoporosis may be modifying or even dominating finding also in patients with chronic kidney disease and even renal failure. The associa-tion with growing age of dialysis patients, with more common hormonal and nutritional disorders, long-lasting vitamin D deficiency, but also with the increasing frequencies of corticosteroid treatments, can be associated with the low bone mineral content in these patients. Low bone mineral content in DXA assessment is diagnostics for osteoporosis. Therapy of osteoporosis in physiological renal function follows its rules. However, osteoporosis itself, i.e. low bone mineral density, we found also in patients with chronic kidney disease and even in patients with kidney failure. In these patients, there is no necessary the link to traditional causes of renal osteodystrophy. Therapy of renal bone disease associated with functional derangement of parathyroid glands in kidney patients is well known. The same is true for the diagnosis and treatment of osteoporosis in basic population. However, practical recommendations for the treatment osteoporotic component, resp. renal osteopathy with low bone mineral content, are still lacking. The aim of this paper is to formulate the background for the wide discussion of experts. This should lead to formulation of concrete and practical recommendations for the treatment of osteoporosis (defined as osteopathy with DXA proven low bone mineral density) in patients with chronic renal disease as well as renal failure.
Keywords:
osteoporosis – bisphosphonates – dialysis – antiosteoresorptive therapy – chronic renal disease (CKD) – denosumab – densitometry (DXA) – low bone mineral content – renal osteodystrophy – secondary hyperparathyroidism
Autoři: V. Palička 1; S. Dusilová Sulková 2,3; doc. MUDr. Ludmila Brunerová, Ph.D. 4
Působiště autorů: Osteocentrum, Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové 1; Hemodialyzační středisko FN Hradec Králové 2; Katedra interních oborů LF UK, Hradec Králové 3; II. interní klinika FNKV a 3. LF UK, Praha 4
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 2, p. 64-72
Souhrn
Článek formuluje základní teze mezioborové spolupráce klinické osteologie a nefrologie v oblasti metabolické osteopatie u nefrologických nemocných. Kostní nemoc při onemocnění a selhání ledvin je tradičně chápána jako důsledek chybějící vylučovací a endokrinní renální funkce (tzv. renální osteopatie). Její hlavní příčinou je sekundární hyperparatyreóza, resp. porucha funkce příštítných tělísek. Pojem CKD-MBD (chronic kidney disease – mineral and bone disorder), zavedený v roce 2006, zohledňuje souvislost mezi kostním postižením a jeho systémovými důsledky, zejména kardiovaskulárními. Denzitometrické vyšetření (DXA) se u nefrologických pacientů využívá až v poslední době. Nález nízkého obsahu minerálů v kosti sice není informativní pro tíži hyperparatyreózy, avšak vypovídá o přidružené, či dokonce dominující osteoporóze. Pacienti s onemocněním či selháním ledvin totiž mohou mít jakoukoliv jinou metabolickou osteopatii, která nesouvisí s funkcí ledvin. Klinická osteologie se zabývá metabolickými onemocněními skeletu. Nejčastější metabolickou osteopatií je osteoporóza. Jak výše uvedeno, právě osteoporóza může být modifikujícím, či dokonce převažujícím nálezem i u pa-cientů s onemocněním a selháním ledvin. Tato skutečnost souvisí s vyšším věkem, častějšími hormonálními a nutričními poruchami, dlouhodobým deficitem vitaminu D, ale také s častější předcházející léčbou kortikoidy apod. Nálezy nízkého obsahu minerálů v kosti při vyšetření DXA jsou pro osteoporózu obecně diagnostické. Léčba osteoporózy při normální funkci ledvin má stanovena svá pravidla. Osteoporózu, resp. nízkou kostní denzitu nacházíme však i u osob s onemocněním, a dokonce i se selháním ledvin, aniž by nutně byla spojena s tradičními příčinami renální osteopatie. Léčba renální kostní nemoci asociované s poruchou funkce příštítných tělísek u nefrologických pacientů je poměrně dobře definována; stejně tak i postupy pro diagnostiku a léčbu osteoporózy v běžné populaci. Léčebná pravidla pro osteoporotickou komponentu, resp. pro renální osteopatii s nízkým obsahem kostního minerálu při nemocech a selhání ledvin dosud chybí. Cílem článku je vytvořit vstupní podklad pro širší odbornou diskusi, která povede k formulaci konkrétních a praktických doporučení pro léčbu osteoporózy (definované jako osteopatie s nízkou kostní denzitou při DXA vyšetření) u nemocí a selhání ledvin.
Klíčová slova:
antiosteoresorpční léčba – bisfosfonáty – chronické onemocnění ledvin – denosumab – denzitometrie (DXA) – dialýza – nízký obsah kostního minerálu – osteoporóza – renální osteopatie – sekundární hyperparatyreóza
Úvod
Klinická osteologie se zabývá zejména diagnostikou a léčbou metabolických onemocnění skeletu (osteoporóza, osteomalacie a další). Naproti tomu komplexní porucha kostního metabolismu při onemocnění a selhání ledvin spadá do péče nefrologa o jeho nemocné. Její hlavní komponentou jsou důsledky sekundární hyperparatyreózy [1].
Do nedávné doby byla metabolická osteopatie při nemocech ledvin vnímána pouze jako tzv. renální osteopatie, spadající podle definice z roku 2006 pod tzv. CKD-MBD (chronic kidney disease – mineral and bone disorder/minerálová a kostní nemoc při chronickém onemocnění ledvin), a chápána jako přímý a výlučný důsledek onemocnění ledvin [2,3]. První zmínky o možné „osteoporóze“ ve smyslu nízké kostní denzity jsou však v nefrologické literatuře zaznamenány již před 15 lety [4].
Postupně se ukazuje, a dnes o tom není pochyb, že do výsledného klinického i laboratorního obrazu kostní nemoci asociované s onemocněním ledvin se promítá nejen „tradiční“ renální osteopatie (spojená především se sekundární hyperparatyreózou – SHPT), ale i další patogenetické faktory (věk, hormonální vlivy, statut vitaminu D, kortikoterapie, nutriční stav apod.). Jde o stejné či obdobné faktory, které se uplatňují v patogenezi metabolických osteopatií v běžné populaci [5–8].
Důležitým momentem pro toto širší pojetí je vývoj demografických charakteristik pacientů léčených v dialyzačním programu. Jejich věk se zvyšuje, prodlužuje se délka léčby dialýzou, avšak i délka predialyzačního sledování; jsou dialyzováni pacienti s řadou předchozích onemocnění, tj. například i ti, kteří jsou dlouhodobě léčeni kortikoidy. Se stoupajícím věkem jsou spojeny i involuční hormonální změny. Dialyzovaní pacienti jsou často hůře pohybliví, resp. jejich způsob života je méně fyzicky aktivní. Demografická data dialyzovaných a transplantovaných pacientů v ČR lze nalézt na webových stránkách České nefrologické společnosti (www.nefrol.cz); dobře přehledná jsou data z USA (www.usrds.org).
Pro diagnózu a diferenciální diagnostiku „klasických“ metabolických osteopatií je vyšetření kostní denzity (DXA) nezastupitelné. Nejčastější metabolická osteopatie – osteoporóza je přímo definována nízkou kostní denzitou. Vyšetření DXA je zde diagnostické (i když nemusí přímo odlišit např. osteomalacii od osteoporózy) [5]. Naproti tomu denzitometrické nálezy u pacientů s CKD/ESRD (end-stage renal disease) jsou velmi heterogenní, od velkého snížení denzity kostního minerálu až po jeho zcela normální hodnoty. Proto se až donedávna denzitometrické vyšetření považovalo u CKD/ESRD pacientů za nepřínosné. Neumožňovalo totiž rozlišit, o který z jednotlivých „subtypů“ renální kostní nemoci se jedná [9].
V současné době se tento přístup opouští, a to právě proto, že obraz renální osteopatie může být komplikován i jinou osteopatií. Ta sice může mít jen modifikující vliv, avšak může být i zcela dominantní. Denzitometrická vyšetření jsou u nefrologických pacientů indikována stále častěji, zejména při kostních symptomech a komplikacích (včetně fraktur) a doporučuje ho i recentní KDIGO text (s poznámkou, že indikace má být v situacích, pokud nález může vést ke změně léčby) [10].
Interpretaci DXA vyšetření provádí klinický osteolog. Zhodnocení, zda a jak je zastoupena případná jiná osteopatie než „renální“, je někdy obtížné. Diagnostický a terapeutický přístup k pacientům s onemocněním ledvin a současně s osteoporózou diagnostikovanou DXA vyšetřením není dosud jednoznačný. Je však jisté, že jde o společné téma osteologů i nefrologů [5,8,10].
Cílem textu, který se opírá o přednášku se stejným názvem, přednesenou na Osteologickém kongresu v Brně (2019), ale také o publikaci autorek Brunové a Štěpánkové v Postgraduální nefrologii [5] a o článek autorů Brunerová, Palička a Dusilová Sulková v zahraničním časopise [8], je načrtnout výchozí návrh pro formulaci společných doporučených postupů. Text je v této podobě jen vstupní, informativní, a je určen hlavně k širší diskusi („call for action“).
Vyšetření kostní denzitometrie u pacientů s CKD a ESRD
Pro diagnostiku a léčbu komplexu poruchy metabolismu kalcia, vápníku a také vitaminu D (včetně SHPT) označovaného jako CKD-MBD byly nefrologickými autoritami (nadnárodní iniciativa KDIGO) opakovaně formulována doporučení („guidelines“) [9,10]. Ještě v KDIGO doporučení z roku 2009 nebylo DXA-vyšetření zařazeno mezi doporučené vyšetřovací postupy, dokonce nebylo ani zvažováno jako vhodné. Důvodem byl v té době chybějící doklad o vztahu mezi denzitou kosti a SHPT a zejména chybějící doklad o predikci kostních fraktur při CKD ve vztahu k denzitometrickým nálezům.
I nadále platí, že denzitometrie neukáže přesnou formu kostního postižení v rámci renální osteopatie v užším slova smyslu. Platí však, že denzitometrie může i u selhání ledvin být prospěšná pro predikci kostních fraktur. Zejména však platí, že nízký obsah minerálu v kosti ukazuje možnost i jiné, s onemocněním ledvin nesouvisející metabolické osteopatie [10]. A právě tato situace je hlavním předmětem našeho textu.
V literatuře je někdy uváděn nový termín – osteoporóza asociovaná s onemocněním ledvin (kidney-induced osteoporosis) [6]. V názvu však není rozlišeno, zda je nízká kostní denzita přímo spojena s onemocněním ledvin, či zda jde o kombinaci s jinými faktory indukujícími osteoporózu. Tabulka 1 uvádí přehledně indikace DXA vyšetření u nefrologických pacientů.
Tab. 1. Vyšetření DXA v nefrologii 
Pozn.: U nefrologických nemocných, včetně dialyzovaných i transplantovaných, je vhodné věnovat zvýšenou pozornost hodnotám kostní denzity i v oblasti distálního předloktí Vstupní návrh pro formulaci textu společného doporučení obou odborností pro léčbu postižení kostní tkáně při CKD-MBD
Denzitometrické vyšetření u dispenzarizovaných pacientů s CKD i u dialyzovaných (a též i transplantovaných) pacientů indikuje většinou nefrolog. Osteo-log zodpovídá za interpretaci výsledku, rozpoznání „osteoporotické“ komponenty a za návrh a realizaci její léčby (volba přípravku a návrh dávkovacího schématu). Navrhovanou léčbu však má zhodnotit i nefrolog, a to zejména z hlediska bezpečnosti [5]. O pacienta pak pečují společně; nefrolog se významně podílí na monitorování zejména bezpečnosti (mimo jiné i proto, že nefrologická dispenzarizace má kontroly častěji); výsledné zhodnocení účinku je předmětem vyšetření klinickým osteologem.
Vlastní text návrhu doporučení je členěn podle funkčního stadia onemocnění ledvin (CKD1–5). Základní teze pro spolupráci dvou odborností a základní body pro terapeutickou rozvahu u nefrologických pacientů s nízkou kostní denzitou v DXA vyšetření jsou uvedeny v Tabulce 2 a Tabulce 3.
Tab. 2. Základní body pro diagnostiku a léčbu osteopatie spojené s nízkou kostní denzitou u nefrologických pacientů (léčba koordinovaná, nasazena a monitorována ve spolupráci nefrologa a osteologa) 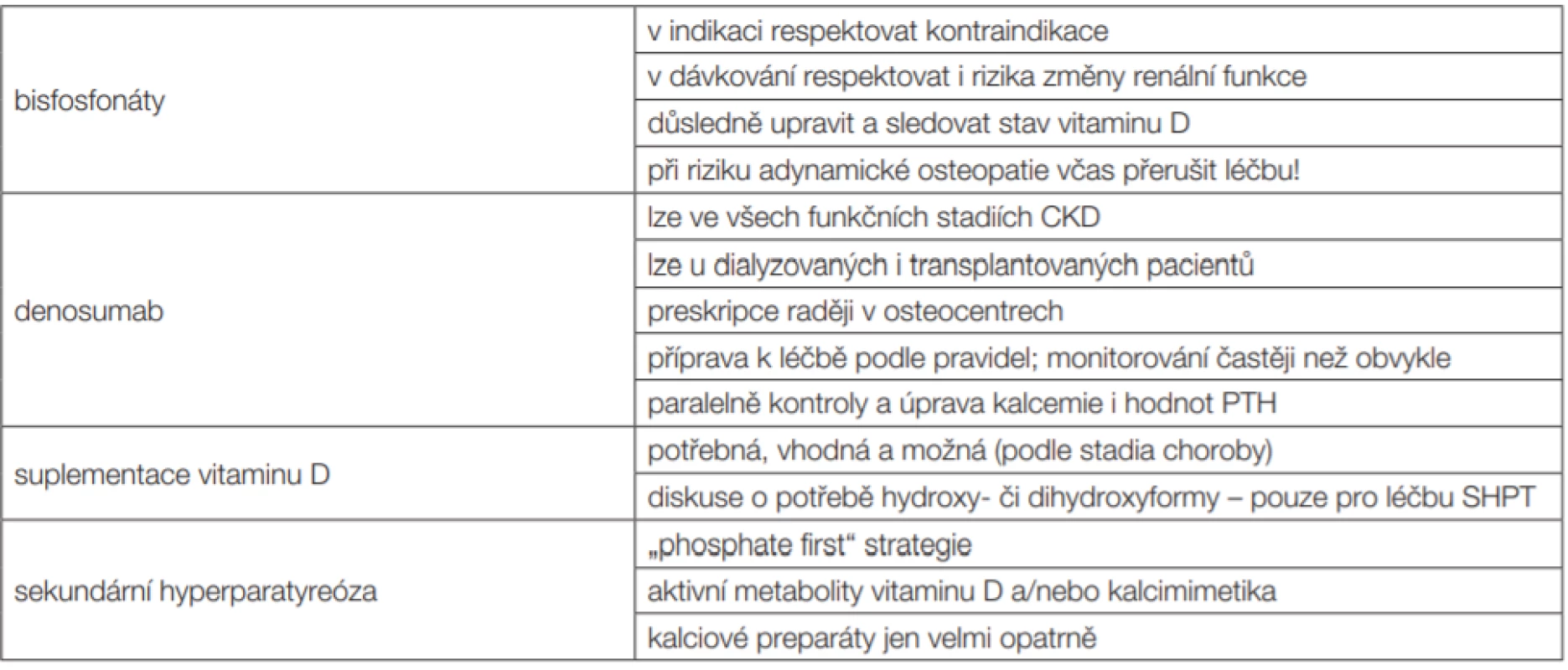
Tab. 3. Spolupráce klinického osteologa a nefrologa při léčbě metabolické osteopatie u pacientů s nízkou kostní denzitou při DXA vyšetření 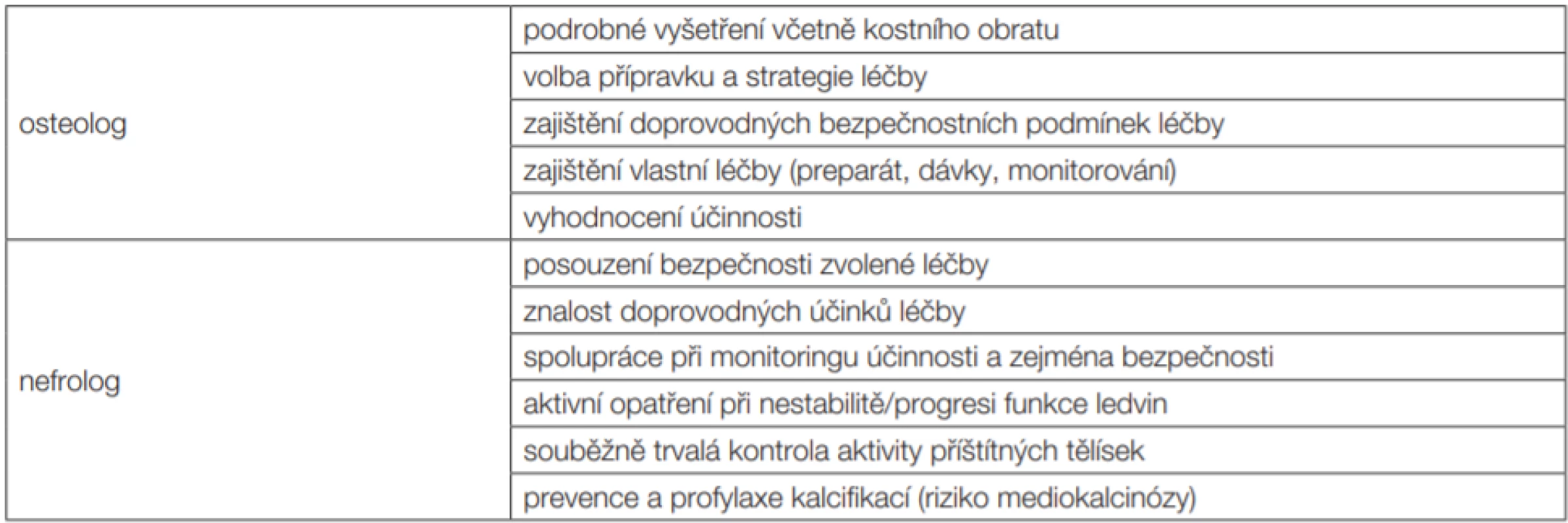
CKD stadium 1 a metabolické osteopatie
Domníváme se, ve shodě s literaturou, že diagnostický i terapeutický postup má být zcela stejný jako u běžné populace (do které tito pacienti patří, neboť sice mají onemocnění ledvin, avšak nemají poruchu funkce ledvin). Sledujícím a ošetřujícím lékařem z hlediska osteopatie je klinický osteolog. K úvaze je, zda již v této situaci doporučit vyšetření k vyloučení (primární) hyperparatyreózy (PHPT) a rovněž stanovení stavu zásob vitaminu D v organizmu. Vlastní postup, resp. volba vyšetřovacích postupů a volba léčby, je však plně v gesci osteologů a je v jejich kompetenci si stanovit pravidla.
CKD stadium 2–3a a metabolické osteopatie
V optimálním případě je tento pacient již dispenzarizován v nefrologické ambulanci. Je stanovena a pokud možno i léčena primární renální diagnóza. Jsou současně sledovány nejen funkce ledvin a jejich vývoj v čase (s důrazem na zpomalení progrese), ale i možné sekundární komplikace snížené funkce ledvin. V indikovaných případech (hyperkalcemie apod) je cíleně vyšetřen status příštítných tělísek ve smyslu nejen detekce SHPT, ale i pro odlišení sekundární (SHPT) od primární (PHPT) hyperparatyreózy.
Rozvaha ohledně metabolické osteopatie (asociované/neasociované s CKD) zahrnuje: (i) již zmíněné vyloučení hyperparatyreózy, resp. odlišení primární od sekundární, (ii) rozpoznání a včasná korekce deficitu vitaminu D (v té době je ještě předpokládána funkční renální produkce kalcitriolu), (iii) klinická rozvaha – jsou/nejsou přítomny známky onemocnění kostního metabolismu, resp. jsou/nejsou přítomny klinické projevy? (iv) klinická rozvaha ohledně indikace DXA vyšetření, resp. konzultace osteologa.
Ke klinickému osteologovi přicházejí tito pacienti buď na doporučení nefrologa, nebo kteréhokoliv specialisty včetně praktického lékaře, pokud nastala klinická indikace. Nejčastějším důvodem je proběhlá fraktura.
Pokud DXA u pacienta s onemocněním ledvin ve funkčním stadiu CKD2–3a ukáže abnormální výsledek, především nízký obsah minerálu v kosti, zařazuje klinický osteolog pacienta do své péče a případně i své dispenzarizace. Ta pak probíhá paralelně s dispenzarizací nefrologickou.
V gesci klinického osteologa je podrobné osteologické odborné vyšetření. Stejně tak je v gesci klinického osteologa volba konkrétního preparátu i dávky a zajištění a vedení (antiosteoresorpční) léčby. Nefrolog se vyjadřuje k bezpečnosti léčby, tj. nejen ke zvolenému léku, ale i k dávkovacímu schématu a doplňujícím postupům (mj. suplementace vápníku, dietní doporučení atd).
Vzájemná spolupráce obou odborností je velmi potřebná, ať již při volbě léčebné strategie (viz výše), hodnocení její účinnosti a také při monitoringu bezpečnosti léčby.
Příkladem je včasné snížení dávek či přerušení léčby bisfosfonáty v návaznosti na akcentaci renální dysfunkce. Těsnou spolupráci vyžaduje každá nestabilita funkce ledvin a progresivní zhoršování funkce ledvin. Vzhledem k trvalé potřebě kontroly SHPT je třeba znát vzájemné interakce mezi aktivitou příštítných tělísek a osteoresorpčními léky (typicky zvyšuje aktivitu příštítných tělísek denosumab, situace je však řešitelná) [11].
Kromě sérových koncentrací Ca, P, aktivity ALP a jejího kostního izoenzymu a hladin 25D je potřeba sledovat i kalciurii a také fosfaturii, optimálně vyjádřenou jako frakční exkrece (fyziologická hodnota do 20). Tyto kontroly lze převést na nefrologickou ambulanci. Jak již uvedeno, kontroly jsou v tomto případě obvykle častější než v ambulanci klinického osteologa.
Naproti tomu (laboratorní) monitorování kostního obratu (úrovně novotvorby i osteoresorpce) je vhodné provádět v osteocentru. Monitorování léčby je tedy povinností nejen osteologa, ale i nefrologa. Doplňujeme, že homeostáza vápníku i fosforu je při CKD i ESRD narušena a ve své podstatě křehká, vápník i fosfor se snadno deponují do cévní stěny (mediokalcinóza, v extrémních případech i kalcifylaxe). Při interpretaci kalciurie je třeba vzít v úvahu i vlastní snížení glomerulární filtrace. Pro posuzování fosfaturie je velmi cenná tzv. frakční exkrece. Každé její zvýšení je suspektní z hyperparatyreózy.
Prevenci vzniku a progrese mediokalcinózy je potřeba věnovat samostatnou pozornost (v gesci nefrologa).
CKD3b-5(nonD) a nízká kostní denzita
Jde o pacienty s již významným poklesem vylučovací funkce ledvin (< 0,75 ml/s), a proto s již iniciálními či v čase pokročilými sekundárními komplikacemi, které CKD doprovázejí. Základní přístup k metabolickému onemocnění skeletu, včetně rozdělení povinností, resp. kompetencí mezi klinickým osteologem a nefrologem, zůstává shodný.
Pacient je do osteocentra odeslán obvykle nefrologem. Osteolog pak podle výsledku vyšetření případně zařadí pacienta do dispenzarizace v osteocentru. Ale ani pacienti s pokročilým onemocněním ledvin nemusí být podchyceni v nefrologické ambulanci, resp. i tyto pacienty může k osteologovi poslat kterýkoliv lékař-specialista (včetně praktického lékaře). Pokud však je funkce ledvin snížená, je důležité odeslat pacienta k nefrologovi (tj. i směr cesty „z osteologie na nefrologii“).
Rozhodovat o potřebě osteologického vyšetření a léčby mohou určité laboratorní a zejména klinické nálezy (včetně fraktur). Rozvaha o indikaci k vyšetření klinickým osteologem má být běžnou součástí komplexní péče o tyto pacienty.
V gesci nefrologa vždy zůstává prevence a léčba SHPT a status PTH musí být při pokročilých stadiích CKD definován vždy. Rovněž je povinností nefrologa definovat status vitaminu D a kvalifikovaně ho upravit. K širší diskusi obou specializací jsou způsoby provedení a vlastně i cílové hodnoty.
Již v těchto stadiích CKD jsou u řady pacientů (nikoliv u všech) detekovány cévní kalcifikace. Těmto pacientům není vhodné paušálně podávat kalcium v perorální suplementační léčbě a je třeba na ně nahlížet jako na osoby s vysokým kardiovaskulárním rizikem [10]. Zásadní je redukce přívodu fosforu do organizmu; vysloveně nevhodné jsou potraviny s obsahem konzervantů (tzv. éčka) [12].
Případná osteoresorpční léčba je v těchto případech, stejně jako v kterémkoliv stadiu CKD, v gesci klinického osteologa, monitorování účinnosti a bezpečnosti probíhá analogicky, tj. ve spolupráci obou specializací jako u stadia CKD2–3a, kontroly jsou však častější.
Obě odbornosti (nefrolog i klinický osteolog) dbají i na non-farmalologické důležité postupy k ochraně a udržení aktivního životního stylu [8]. Mléčné výrobky jsou však kontroverzní, resp. v pokročilých stadiích CKD, a zejména u dialyzovaných jsou nevhodné [12]. Mimořádně důležitá je aktivní podpora v prevenci pádů.
Denosumab nemá žádné přímé kontraindikace při selhání ledvin a nemění se ani dávkovací schéma [13]. Příbalový leták (SPC) upozorňuje na vyšší riziko hypokalcemie při CKD 4–5 (včetně CKD5d). Riziko hypokalcemie a následně i hyperparatyreózy se zvyšuje paralelně s progresí CKD. Známé pravidlo, že pro léčbu denosumabem je důležitá předchozí úprava zásob vitaminu D v organismu, je zde mimořádně důležité [11]. Vitamin D a případně i kalcium se během léčby podle potřeby samozřejmě průběžně doplňují.
Bisfosfonáty jsou v léčbě pacientů s glomerulární filtrací < 30–35 ml/min (0,5 ml/s) považovány za kontraindikované [13]. Vylučují se ledvinami a s progresí CKD se jejich koncentrace v krvi významně zvyšují.
Příbalové informace (SPC) konkrétních přípravků překvapivě neuvádějí přímou toxicitu, ale své „nedoporučení“, resp. „warning“ opírají o chybění dat, která by doložila bezpečnost při nízké funkci ledvin. Bisfosfonáty tedy pro pacienty s CKD4–5, včetně 5d, nejsou doporučovány. Jsou-li přesto indikovány, je to vždy s velkou opatrností. O indikaci rozhoduje osteolog; nefrolog se k bezpečnosti léčby vyjadřuje vždy – často s návrhem nižší frekvence dávkování (mj. i riziko adynamické osteopatie). Zejména vzhledem k aspektům bezpečnosti se domníváme, že tato skupina pacientů má být sledována a léčena výhradně na odborných pracovištích se zkušenostmi.
Pacienti se selháním ledvin (ESRD, dialyzovaní pacienti)
Tito pacienti zcela jistě mají metabolickou osteopatii. Může být otázkou, zda jde pouze o „čistě renální“ patogenezi, či zda (a nakolik) se podílejí i jiné faktory, typické pro běžnou populaci daného věku a pohlaví.
Podle současných poznatků i na podkladě vlastních zkušeností je stanovení kostní minerální denzity žádoucí. Nízká hodnota BMD je poměrně častá. Vyšetření kostní denzitometrie by mělo zahrnout mimo standardně sledované oblasti i oblast distálního předloktí. Akcentovaný pokles kostní denzity v oblasti předloktí v porovnání s nálezy v obvyklých vyšetřovaných lokalizacích je pro hyperparatyreózu příznačný. Výpověď DXA-nálezu zvýší i stanovení TBS (trabecular bone score) [15, 16].
Při nízké kostní denzitě je i zde role klinického osteologa nezastupitelná. Základní postup je analogický jako při méně významném snížení funkce ledvin. Patologicky vysoký kostní obrat (s vyloučením hyperparatyreózy jako jediné či dominující příčiny) spojený s nízkou kostní denzitou spadá do gesce klinického osteologa, který zvažuje a indikuje léčbu antiosteoresorpčními přípravky.
Ze současných možností se nabízí denosumab, neboť jeho farmakokinetika není ovlivněna renální funkcí [11]. Podkožní aplikace má stejná pravidla jako u běžné populace, včetně dávky a dávkovacího intervalu šest měsíců. Shodná jsou i vstupní vyšetření, resp. potřebná vyšetření před vlastní aplikací (včetně vyšetření stomatologického – cave! při selhání ledvin jsou velmi časté patologické zubní nálezy!). Předpokladem úspěchu je zde podrobná teoretická znalost fungování přípravku, včetně regulačních a dalších souvislostí, stejně tak jako potřeba vlastní praktické zkušenosti.
Nefrologie v současné době nesplňuje podmínky pro preskripci dle odborností. I proto by denosumab při selhání ledvin by měl být v gesci klinického osteologa, který při léčbě postupuje ve spolupráci s nefrologem. Navíc, klinický osteolog má nepochybně více zkušeností s touto léčbou než nefrolog (snad kromě expertních pracovišť). I zde je třeba pečlivě kontrolovat a upravit hladinu vitaminu D v organizmu (resp. hladinu 25D v krvi).
Pro bisfosfonáty stále platí kontraindikace, resp. výše uvedené zásadní omezení při velmi nízké funkci ledvin. Avšak, trochu paradoxně, u dialyzovaných pacientů je přístup volnější. Samotná nefrotoxicita již není dominantním problémem, neboť funkce ledvin je vyhaslá. Pro úpravu nízké kostní denzity spojené s vysokým kostním obratem (který není podmíněn pouze s hyperparatyreózou) lze u dialyzovaných pacientů bisfosfonáty použít. Rizikem je však přesmyk léčby až do tzv. adynamické kostní nemoci, s utlumeným až zastaveným kostním obratem. Změna však může být pro délku léčby. I zde je třeba mít stále na mysli, že navázání bisfosfonátů na povrch kostních trámců je velice pevné a dlouhodobé.
Roli bisfosfonátů při funkčním stadiu CKD4 i CKD5 (včetně dialyzovaných pacientů) lze v současné době shrnout takto [13,14]: Všechny bisfosfonáty jsou podle SPC (Summary of Product Characteristics) kontraindikovány (resp. nedoporučeny) ve stadiích CKD4–5d. Přesto jsou s jejich podáváním u těchto pacientů určité zkušenosti. Podávání bylo vždy velmi opatrné, s velmi pečlivým monitorováním účinku i rizik, a dávky byly obvykle nižší, než by byly aplikovány při vyšší funkci ledvin, vlastní délka léčby (doba podávání) může být kratší. Jde o dávkování „off-label“ a je potřeba o to vyšší opatrnosti. Podle literatury [14] je pravděpodobně nejméně rizikový přípravek ibandronát – je dialyzovatelný a má nejvíce dat. Rutinně však v současné době bisfosfonáty nelze při nízké renální funkci (stadium CKD4–5) doporučit.
Rozpoznání, prevence a léčba SHPT je u všech nefrologických pacientů v gesci nefrologa. Kromě známých (a zde jen okrajově zmíněných) farmakologických postupů (viz níže) a případné indikace k paratyreoidektomii je velmi důležitá volba dialyzačního předpisu. Dialýza má odstranit co nejvíce katabolitů, včetně fosforu. Dialýza však má optimálně korigovat minerálovou i acidobazickou rovnováhu. Dialyzační roztoky jsou již výhradně bikarbonátové a koncentrace difuzibilního kalcia v nich je 1,25 či 1,50 či 1,75 mmol/l. Obsah kalcia v roztoku má pochopitelně vliv nejen na sérovou koncentraci kalcia, ale i na aktuální změnu koncentrace PTH, neboť i nepatrný pokles koncentrace ionizovaného kalcia v krvi (o 1–2 procenta) okamžitě stimuluje sekreci PTH, a naopak – i nepatrné zvýšení Ca2+ v krvi sekreci PTH utlumí.
Stabilizaci volných iontů v bikarbonátových roztocích zajišťuje malé množství kyselé komponenty. Tzv. BIK roztok obsahuje malou příměs kyseliny octové (acetát); v roztoku označovaném jako BIC je kyselina octová nahrazena kyselinou citronovou (citrát). BIC roztok snižuje ionizovanou frakci kalcia v krvi (byť jen nepatrně a přechodně), tím spouští okamžitou sekreci PTH z buněk příštítných tělísek (a při dlouhodobém opakování i proliferační aktivitu příštítných tělísek).
Správně nastavená a monitorovaná léčba sekundární hyperparatyreózy je samozřejmá a nezbytná. Sem spadá korekce hyperfosfatemie, úprava případného deficitu vitaminu D, supresivní léčba hyperparatyreózy (selektivními) aktivátory receptoru pro vitamin D, vše samozřejmě s monitorováním účinnosti a bezpečnosti (mj. pokud možno i ochranou cév před rozvojem a progresí mediokalcinózy). Základní terapeutické postupy při léčbě hyperparatyreózy jsou podrobně popsány v literatuře a nejsou předmětem tohoto textu (text je primárně zaměřen na problematiku „osteoporózy“ při selhání ledvin, nikoliv na CKD-MBD) [1,12].
Pacienti po úspěšné transplantaci ledvin (CKD-T)
Funkce štěpu (tj. transplantované ledviny) je po úspěšné transplantaci (TxL) upravena ve všech svých komponentách (vylučovací, endokrinní, metabolická i regulační). Stupeň této úpravy je však různý a v čase se mění. Při průřezových studiích větších kohort je většina pacientů dlouhodobě ve stadiu CKD-T3a-b. Život s transplantovanou ledvinou je vždy spojen s úbytkem kostního minerálu. K důležitým příčinám patří především dlouhodobá léčba kortikoidy [17].
Samotná SHPT se po úspěšné TxL může upravit (přibližně třetina až polovina pacientů), nebo přetrvává (opět přibližně třetina až polovina), případně u některých pacientů progreduje. Výjimečně je progrese rychlá a symptomatická, s těžkou hyperkalcémií a s nutností neodkladné chirurgické paratyreoidektomie (PTX). Příčinou této vzácné situace je již autonomní povaha hyperparatyreózy při příchodu k transplantaci (tzv. terciární hyperparatyreóza). Po úspěšné TxL bychom čekali, že se sekundární hyperparatyreóza upraví, neboť základní patogenetické mechanismy (chybějící aktivita renální 1-alfa-hydroxylázy je obnovena a také fosfát je funkčním štěpem již dobře vylučován). Pokud tomu tak není, je potřeba počítat s tím, že v pozadí zůstává již morfologická změna příštítných tělísek – jejich hyperplazie [1,17,18].
Hyperparatyreóza po transplantaci ledvin se v mnoha aspektech blíží hyperparatyreóze primární. Je provázena hyperkalcémií, hypofosfatémií a také výraznějšími kostními problémy, než vídáme při stejných koncentracích PTH u hyperparartyreózy sekundární. Platí vždy, že negativní vliv PTH na kostní metabolismus a kostní tkáň je po TxL mnohem výraznější než u dialyzovaných pa-cientů. Posouzení a řešení hyperparatyreózy po transplantaci ledviny je v gesci transplantačních nefrologů.
Vyšetření kostní minerální hustoty je u transplantovaných pacientů velmi důležité, a to i opakovaně, pro sledování dynamiky změn v čase. Podle tíže symptomů a podle závažnosti denzitometrických nálezů je indikována antiosteoresorpční léčba [18,19]. Indikace této léčby je v gesci klinického osteologa, stejně jako volba přípravku a nastavení monitorování nežádoucích účinků, resp. zajištění jejich prevence; nefrolog se vyjadřuje k bezpečnosti navrhovaného léčebného schématu. V gesci klinického osteologa je i rozhodnutí, zda zvolit bisfosfonát či jinou možnost (denosumab). S oběma možnostmi jsou již dostatečné zkušenosti, včetně zkušeností našich pracovišť [18,19]. Opět, u bisfosfonátů je nezbytné zvažovat jejich nefrotoxicitu, resp. funkční stadium CKD!
I zde je vhodná a žádoucí spolupráce obou odborností, zejména s ohledem na bezpečnost léčby. Frekvence návštěv pacienta v transplantační poradně je častější, monitoring léčby je tím usnadněn. Nefrolog souběžně kontroluje hladiny vitaminu D a samozřejmě hladiny PTH. Sleduje funkci štěpu, která po transplantaci může i v krátkém čase významně kolísat.
Obě základní komponenty kostního postižení transplantovaných pacientů, tj. hyperparatyreóza i osteoporóza spojená s glukokortikoidy (GIOP – glucocorticoid induced osteoporosis) i s jinými vlivy (hormonální poruchy, apod) se mohou prolínat, ale mohou a mají být léčeny souběžně. Samotná hyperparatyreóza, je-li dobře podchycena, není příčinou odkládání léčby bisfosfonátů ani denosumabu. Obě odbornosti musí být podrobně o léčebné strategii informovány. Změna dávkování kortikoidů může být iniciována oběma specializacemi, avšak konkrétní úprava je v gesci nefrologa (minimalizace rejekce štěpu).
U pacientů po úspěšné transplantaci je poměrně častá hyperkalcemie, která může být i dlouhodobá, nevidíme ji však časně po TxL, ale až přibližně od 3. měsíce po transplantaci. Za příčinu se obvykle považuje perzistující hyperparatyreóza. Příčinou hyperkalcémie však může být i nadprodukce kalcitriolu v transplantované ledvině. Případná indikace kalcimimetika v terapii SHPT po úspěšné transplantaci ledviny musí být skutečně velmi opatrná. Nejde jen o indikaci „off-label“, ale také o to, že hyperkalcémie u transplantovaných pacientů sama o sobě ještě není průkazem skutečné hyperparatyreózy.
Pro charakteristiku i tíži kostních metabolických změn po TxL je vždy důležitá i funkce štěpu. Pacienti se selhávající/selhanou funkcí štěpu mají ty nejtěžší metabolické abnormality asociované s renální dysfunkcí, plus akumulované důsledky předchozí dlouhodobé terapie (nejen) kortikoidy. Spolupráce nefrologa a osteologa je v těchto situacích nejen indikovaná, ale nutná. Měření BMD je vhodné nejen pro posouzení aktuálního stavu, ale i pro predikci budoucího rizika progrese kostního postižení. Primární nefrologické terapeutické opatření je cílené na korekci, resp. prevenci hyperfosfatémie [12].
Poznámky k laboratorním metodám
Základní laboratorní vyšetření zahrnuje (mimo jiné) sérové koncentrace kalcia (Ca), fosforu (P), parathormonu (PTH) a aktivity alkalické fosfatázy (ALP), resp. jejího kostního izoenzymu (b-ALP). Do budoucna se jeví jako potřebné i stanovení plazmatických hodnot FGF23, zejména u pacientů časně po transplantaci, ale i v jiných situacích. Vyšetření metabolitů vitaminu D má zahrnovat nejen sérovou koncentraci 25D, ale u vybraných situací (transplantovaní?) i koncentraci 1,25D.
Je známo, že výsledky jednotlivých laboratoří se mohou lišit podle použité analytické metody. Při analýzách existují značné metodické rozdíly. Nezbytné je především konzultovat s klinickým biochemikem metodu stanovení PTH.
U pacientů s pokročilým onemocněním ledvin a zejména u dialyzovaných pacientů není samotná koncentrace kalcia v séru odrazem skutečné kalciové homeostázy. Pro aktuální situaci je vhodnější stanovit ionizované kalcium v séru. Při současné hypoproteinémii, resp. hypalbuminémii je důležité pracovat s tzv. korigovanou koncentrací kalcia. Avšak žádná z těchto modifikací nevypovídá, zda je při hypokalcemii skutečně indikována kalciová suplementace! Naopak, ta může být i při hypokalcemii riziková (ukládání kalcia mimo kost, zejména při současném zánětu).
Je vhodné připomenout, že hladiny kostních markerů v krvi jsou ovlivněny dialyzační procedurou, jejím typem a použitou membránou a samozřejmě i případnou renální eliminací (Tabulka 4). Pro interpretaci jsou nutné detailní znalosti i zkušenosti. V principu však s těmito hodnotami lze pracovat; přitom platí, že fyzio-logické „spřažení“ mezi aktivitou osteoblastů i osteoklastů je při selhání ledvin zachováno (byť na kvantitativně jiné úrovni). Případná zřetelná dysbalance mezi ukazateli osteoresorpce oproti ukazatelům novotvorby může poukázat na jinou než „čistě renální“ metabolickou osteopatii. Koncentrace PTH v krvi se akutně a výrazně mění v závislosti na koncentraci kalcia v dialyzačním roztoku a dynamika hodnot se též liší mezi tzv. BIK a BIC roztoky. BIC roztoky a roztoky s nízkým obsahem kalcia (1,25 mmol/l difusibilního kalcia, resp. méně) indukují nejen akutní sekreci PTH, ale v dlouhodobém působení i proliferaci buněk příštítných tělísek a přispívají tak k jejich hyperplazii.
Tab. 4. Laboratorní ukazatele kostního obratu 
Pro léčbu osteopatie s nízkou kostní minerální denzitou při CKD a ESRD (tzv. osteoporóza asociovaná s onemocněním ledvin) je extrémně důležité stanovit kostní obrat. Bohužel, dostupná laboratorní vyšetření nemají pro CKD ani pro selhání ledvin žádnou „cut-off“ hranici, která by rozlišila mezi nízkým a vysokým obratem ve vztahu k typu osteopatie.
Hlavními opěrnými body jsou koncentrace PTH a kostního izoenzymu ALP, ale i zde zůstává velká míra nejistoty. I proto je důležitá vzájemná spolupráce mezi klinickým osteologem, který se dobře orientuje nejen v denzitometrickém nálezu, ale také v laboratorních ukazatelích kostního obratu (za podmínek normální funkce ledvin), a zkušeným klinickým biochemikem a nefrologem, který spíše zná problematiku odchylek laboratorních dat při selhání ledvin ve vztahu k hodnotám u běžné populace [8].
Návrh dalšího postupu pro formulaci textu doporučení
Cílem, ke kterému je daný text praktickým úvodem a podkladem nyní pro diskusi, je vytvoření vlastního textu „doporučení“. Nyní považujeme za potřebné vytvoření společné expertní pracovní skupiny obou odborností pro dopracování zde předloženého dokumentu. Jde nejen o konkrétní dopracování dané předlohy, ale i o její podrobnější (a co nejpřesnější) konkretizaci a další doplnění, včetně podrobnějšího zaměření na prevenci fraktur na jedné straně a minimalizaci kardiovaskulárního a dalšího rizika asociovaného s CKD-MBD pro CKD/ESRD pacienty na straně druhé [5,8,10,20,21].
Konkrétní „doporučení“ by mělo být opřeno o aktuální konkrétní data a informace, teoretické znalosti, ale zejména aplikované klinické znalosti a zkušenosti. Text by měl poskytovat co nejvíce praktický návod cílený na přímé využití v každodenní praxi.
Finální verze může být sestavena až po „veřejné diskusi“ obou odborných společností. Všechny podněty jsou vítány! Následně je ke zvážení i vytvoření „center expertizy“ pro konzultace a řešení netypických a velmi komplikovaných situací v praxi.
V neposlední řadě je zde ještě další aspekt. Text je zaměřen na definovanou oblast – metabolické osteo-patie při selhání ledvin, resp. ta jejich komponenta, která není přímo asociovaná s poruchou či chyběním vylučovací a endokrinní funkce ledvin a je charakterizována nízkou kostní denzitou. Tuto oblast řeší již nejen nefrolog, ale je v gesci osteologa, resp. ve vzájemné spolupráci obou odborností. Problematika však přesto může mít přesah i do dalších lékařských specializací – klinická biochemie, revmatologie, endokrinologie, a další (ortopedie, rehabilitační lékařství, jiné?). Pro finální text doporučení, který se bude formovat v čase a bude mu předcházet diskuse, uvítáme odezvu právě i od dalších odborností.
Tento článek byl poprvé uveřejněn v časopise Clinical Osteo-logy 2020; 24(4) na ss. 169-177 a je přetištěn s laskavým svolením autorů, redakční rady a vydavatele časopisu Clin Osteol.
Podpořeno MZ ČR – RVO (FNHK, 00179906) a programem PROGRES Q40/11.
Adresa pro korespondenci
Prof. MUDr. Vladimír Palička, CSc, dr.h.c.
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: Palicka@lfhk.cuni.cz
Zdroje
1. Cunningham, J., Locatelli, F., Rodriquez, M. Secon-dary hyperparathyoidism: pathogenesis, disease progression and therapeutic options. Clin. J Am. Soc. Nephrol., 2011, 6(4): p. 913–921. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.06040710>.
2. Hruska, K. A., Teitelbaum, S. L. Renal Osteodystrophy. N Engl. J Med., 1995, 333(3): p. 166–174. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199507203330307>.
3. Moe, S. M., Drueke, T. B. et al. Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2006, 69(11): p. 1945–1953. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.ki.5000414>.
4. Cunningham, J., Sprague, S. M., Cannata-Andia, J. et al. [Osteoporosis Work Group]. Osteoporosis in chronic kidney disease. Am J Kidney Dis. 2004, 43(3): p. 556–571. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2003.12.004>. Komentář in: Dusilová-Sulková, S. Osteoporóza a selhání ledvin. Postgrad. Nefrol., 2004, 2(4): p. 50–51.
5. Štěpánková, J., Brunová, J. Léčba osteoporózy u dia-lyzovaných pacientů. Postgrad. Nefrol., 2019, 17(4): p. 7–9.
6. Moe, S. M. Renal Osteodystrophy or Kidney-Induced Osteoporosis? Curr Osteoporos. Rep., 2017, 15(3): p. 194–197. Dostupné z DOI: <http://dx.doi.org/10.1007/s11914–017–0364–1>.
7. Miller, P. D. Bone disease in CKD: a focus on osteoporosis diagnosis and management. Am J Kidney Dis., 2014, 64(2): p. 290–304. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2013.12.018>.
8. Brunerová, L., Palička, V., Dusilova-Sulkova, S. Commentary on management of osteoporosis in advanced CKD: common view of a nephrologist and bone specialist. Endocrine Practice, 2019, 25 (2): p. 193–196. Dostupné z DOI: <https://doi.org/10.4158/EP-2018–0311>.
9. Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group]. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int. Suppl. 2009, (113): S1-S130. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2009.188>.
10. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease–Mineral and Bone Disorder (CKD-MBD). Kidney Int., 2017, 7(1): p. 1–59. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kisu.2017.04.001>. Erratum in Erratum: Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int. Suppl., 2017, 7: p. 1–59. Dostupné z WWW: <http://www.kisupplements.org>.
11. Festuccia, F., Jafari, M. T., Moioli, A. et al. Safety and efficacy of denosumab in osteoporotic hemodialysed patients. J Nephrol., 2017, 30(2): p. 271–279. Dostupné z DOI: <http://dx.doi.org/10.1007/s40620–016–0334–1>.
12. Ritter, C. S., Slatopolsky, E. Phosphate toxicity in CKD: the killer among us. Clin. J Am. Soc. Nephrol., 2016, 11(6): p. 1088–1100. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.11901115>.
13. Nitta, K., Yajima, A., Tsuchiya, K. Management of Osteoporosis in Chronic Kidney Disease. Intern. Med., 2017, 56(24): p. 3271–3276. Dostupné z DOI: <http://dx.doi.org/10.2169/internalmedicine.8618–16>.
14. Bergner, R. Bisphosphonate therapy in renal osteodystrophy – a review. J Nephrol. 2013, 26(3): p. 450–455. Dostupné z DOI: <http://dx.doi.org/10.5301/jn.5000188>.
15. Brunerová, L., Ronová, P., Verešová, J. et al. Osteoporosis and Impaired Trabecular Bone Score in Hemodialysis Patients. Kidney Blood Press Res., 2016, 41(3): p. 345–354. Dostupné z DOI: <http://dx.doi.org/10.1159/000443439>.
16. Aleksova, J., Kurniawan, S., Elder, G. J. The trabecular bone score is associated with bone mineral density, markers of bone turnover and prevalent fracture in patients with end stage kidney disease. Osteoporos. Int. 2018, 29(6): p. 1447–1455. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4468-y>.
17. Bouquegneau, A., Salam, S., Delanaye, P. et al. Bone disease after kidney transplantation. Clin. J Am. Soc. Nephrol., 2016, 11(7): p. 1282–1296. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.11371015>.
18. Nakai, K., Fujii, H., Ishimura, T. et al. Incidence and Risk Factors of Persistent Hyperparathyroidism After Kidney Transplantation. Transplant. Proc., 2017, 49(1): p. 53–56. Dostupné z DOI: <http://dx.doi.org/10.1016/j.transproceed.2016.10.011>.
19. Brunova, J., Kratochvilova, S., Stepankova, J. Osteoporosis Therapy with Denosumab in Organ Transplant Recipients. Front Endocrinol. (Lausanne) 2018, 9 : 162. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2018.00162>.
20. Kan, S. L., Ning, G. Z., Chen, L. X. et al. Efficacy and Safety of Bisphosphonates for Low Bone Mineral Density After Kidney Transplantation: A Meta-Analysis. Medicine (Baltimore) 2016; 95(5): e2679. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000002679>.
21. Pimentel, A., Ureña-Torres, P., Zillikens, M. C. et al. Fractures in patients with CKD-diagnosis, treatment, and prevention: a review by members of the European Calcified Tissue Society and the European Renal Association of Nephrology Dialysis and Transplantation. Kidney Int., 2017, 92(6): p. 1343–1355. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2017.07.021>.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 2- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Editorial
- Detekce opiátů v moči po jednorázovém požití máku setého v kuchyňské úpravě
- Jak se mění výsledky biochemických, hematologických, koagulačních a zánětlivých markerů u COVID-19?
- Markery kostního obratu u osteoporózy - společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu (SMOS) ČLS JEP a České společnosti klinické biochemie (ČSKB) ČLS JEP
- Pracovní návrh doporučených postupů pro diagnostiku a léčbu kostních poruch při CKD MBD se specifickým zaměřením na nálezy nízkého obsahu kostního minerálu při vyšetření DXA
- Sborník 50. celostátního sjezdu biochemických laborantů České společnosti klinické biochemie ČLS JEP
- Abstrakta přednášek
- Abstrakta posterů
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Markery kostního obratu u osteoporózy - společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu (SMOS) ČLS JEP a České společnosti klinické biochemie (ČSKB) ČLS JEP
- Jak se mění výsledky biochemických, hematologických, koagulačních a zánětlivých markerů u COVID-19?
- Detekce opiátů v moči po jednorázovém požití máku setého v kuchyňské úpravě
- Pracovní návrh doporučených postupů pro diagnostiku a léčbu kostních poruch při CKD MBD se specifickým zaměřením na nálezy nízkého obsahu kostního minerálu při vyšetření DXA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



