-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role epikardiálního tuku v patofyziologii srdečních onemocnění
Role of epicardial tissue in pathophysiology of cardiovascular diseases
Obesity is a significant risk factor for the development of cardiovascular diseases. Adipose tissue is currently considered to be a metabolically active organ. Rather than subcutaneous adipose tissue, visceral adipose tissue has importance in the pathophysiology of cardiovascular diseases. Due to its proximity to the heart, epicardial adipose tissue (EAT), which has the same embryonic origin as visceral adipose tissue, is currently widely studied for its possible involvement in the pathophysiology of cardiovascular diseases. EAT produces a number of biologically active substances which can affect the adjacent myocardium by paracrine or vasocrine signalling. The most robust evidence is available of the role of EAT in the pathophysiology of atherosclerosis and coronary artery disease. However, the position of EAT in pathophysiology of atrial fibrillation and heart failure is also evident. This review article provides information on current knowledge about the role of EAT in the pathophysiology of cardiovascular diseases and potential therapeutic implications.
Key words:
obesity – cardiovascular risk – epicardial adipose tissue
Autoři: F. Souček 1; J. Novák 2
Působiště autorů: I. interní kardioangiologická klinika FN u sv. Anny v Brně 1; II. interní klinika FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2018, 20(3): 212-217
Souhrn
Obezita je považována za významný rizikový faktor rozvoje kardiovaskulárních onemocnění (KVO). Změnil se pohled na tukovou tkáň, která je v současnosti vnímána jako metabolicky aktivní orgán. Větší význam v patofyziologii KVO se dává tukové tkáni viscerální. Epikardiální tuková tkáň (epicardial adipose tissue – EAT), která s viscerální tukovou tkání sdílí stejný embryonální původ, je kvůli své blízkosti k srdci v současnosti široce studována pro její možné zapojení v patofyziologii KVO. EAT produkuje řadu biologicky aktivních látek, které mohou ovlivňovat přilehlý myokard parakrinní či vazokrinní cestou. Nejvíce důkazů je k dispozici o vlivu EAT v patofyziologii aterosklerózy a ischemické choroby srdeční, nicméně existuje řada důkazu o jeho vlivu i v patofyziologii fibrilace síní a srdečního selhání. Tento přehledový článek podává informaci o aktuální úrovni poznatků o roli EAT v patofyziologii KVO a jeho možném terapeutickém ovlivnění.
Klíčová slova:
obezita – kardiovaskulární riziko – epikardiální tuková tkáň
Úvod
Epikardiální tuková tkáň (epicardial adipose tissue – EAT) představuje specifický podtyp tukové tkáně lokalizovaný mezi myokardem a viscerální vrstvou perikardu. V posledních letech se výrazně změnil pohled na tukovou tkáň obecně, která je nyní vnímána spíše jako metabolicky aktivní orgán s řadou endokrinních a parakrinních funkcí než jen jako „zásobárna energie“. Zejména viscerální tuková tkáň je považována za významný marker kardiovaskulárního (KV) rizika. Vzhledem ke stejnému původu EAT s viscerální abdominální tukovou tkání a jeho anatomické blízkosti k srdci a velkým cévám je v poslední době EAT studován jako možný činitel v patofyziologii srdečních onemocnění.
Anatomické souvislosti
Tuková tkáň obklopující srdce se rozděluje na dva různé typy, které, ačkoli jsou si anatomicky velmi blízké, se liší v několika důležitých aspektech, a to embryonálním původem, cévním zásobením a metabolickým efektem na myokard (tab. 1).
Tab. 1. Tuková tkáň obklopující srdce se rozděluje na dva různé typy, které se liší embryonálním původem, cévním zásobením a metabolickým efektem na myokard. 
Tab. 2. Tuková tkáň obklopující srdce se rozděluje na dva různé typy, které se liší embryonálním původem, cévním zásobením a metabolickým efektem na myokard. 
EAT se nachází mezi myokardem a viscerální vrstvou perikardu a vzhledem k absenci anatomické bariéry přímo naléhá na přilehlý myokard a probíhající koronární cévy (obr. 1) [1]. Tuková tkáň tak přímo přechází do přilehlého myokardu. Ostrůvky tukové tkáně se častěji vyskytují v myokardu pravé komory a mohou sloužit jako přímý zdroj volných mastných kyselin (VMK) pro myokard. EAT pokrývá 80 % povrchu srdce a tvoří 20 % jeho hmotnosti [1]. Rozložení EAT je značně variabilní s maximem výskytu v atrioventrikulární a interventrikulární rýze, podél velkých cév a na volné stěny pravé komory [2].
Obr. 1. Anatomické souvislosti. Schéma zobrazuje řez srdeční komorou od myokardu (nejvíce vlevo) po parakardiální tukovou tkáň (nejvíce vpravo). Obrázek byl vytvořen s využitím Servier Medical Art. 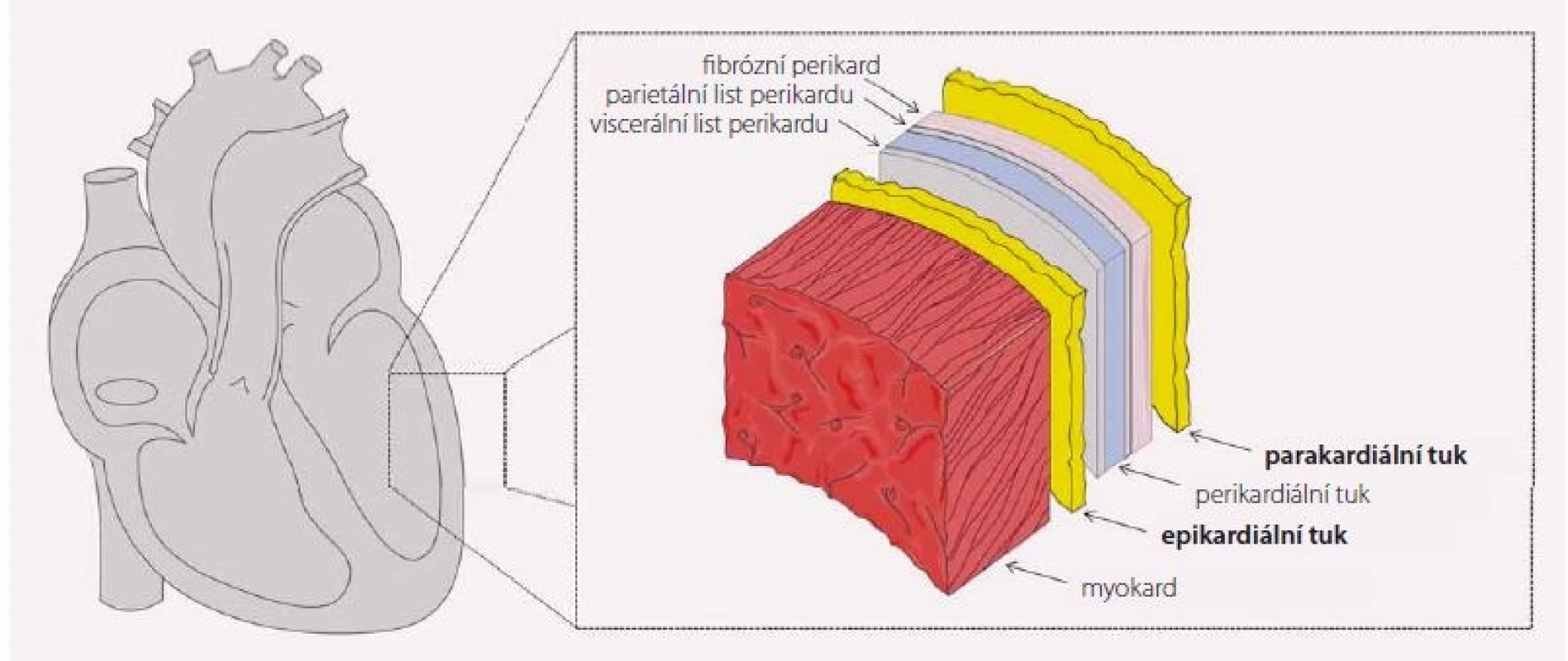
Naproti tomu parakardiální tuk (paricardial adipose tissue – PAT) je lokalizován až za fibrózní vrstvou perikardu a od vlastní svaloviny srdeční jej oddělují oba listy perikardu, vč. jeho fibrózní vrstvy [3]. V některých publikacích se pak setkáme s použitím pojmu perikardiální tuk, který slouží jako souhrnný název pro EAT i PAT dohromady.
Cévní zásobení obou tukových vrstev je odlišné. Zatímco PAT je zásoben z arteria thoracica interna, která je větví arteria subclavia, EAT je vyživován přímo z koronárních arterií [4]. Dále se obě vrstvy liší embryonálním původem, kdy EAT má stejný původ s mezenteriálním a omentálním tukem, a to ze splanchnopleurického mezodermu, zatímco PAT pochází z hrudního mezenchymu [5].
Fyziologické funkce epikardiální tukové tkáně
Endokrinní funkce
EAT je metabolicky aktivní orgán a je známo, že produkuje celou řadu bioaktivních cytokinů, které jsou zavzaty do regulace endoteliální funkce a ovlivňují také koagulaci či zánětlivou odpověď. Produkované cytokiny hrají roli jak ve fyziologii myokardu, tak v patofyziologii různých srdečních onemocnění. Pozitivní vlastnosti mají především adrenomodulin a adiponectin.
Adiponectin je produkovaný převážně buňkami tukové tkáně, byla ovšem zjištěna jeho sekrece buňkami příčně pruhované svaloviny, kardiomyocyty, epiteliálními buňkami slinných žláz a buňkami kostní dřeně. O adiponectinu je známo, že zvyšuje inzulinovou senzitivitu a oxidaci mastných kyselin, a tím snižuje obsah tukových dep v myokardu. Mezi další pozitivní vlastnosti patří jeho účinky protizánětlivé, antioxidační, antiapoptotické a účinky antiatherogenní. Hladina adiponectinu je nižší u obézních pacientů, u pacientů s onemocněním koronárních tepen nebo u pacientů s metabolickým syndromem a negativně koreluje s množstvím epikardiálního, perikardiálního a břišního viscerálního tuku, a dále s inzulinovou rezistencí, diabetes mellitus 2. typu, hyperlipidemií, hypertenzí a hypertrofií levé komory [6– 9].
Imunitní funkce
EAT slouží jako imunitní bariéra chránící koronární arterie a myokard před zánětlivými a infekčními působky [10].
Mechanická funkce
Vzhledem k tomu, že se EAT nachází podél epikardiálních častí koronárních cév a disponuje značnou elasticitou, působí jako mechanická ochrana proti nadměrnému zkroucení koronárních arterií při průchodu pulzové vlny a srdečních kontrakcích [11]. Díky svým vlastnostem umožňuje i expanzi arteriální stěny v časných fázích aterosklerózy [12].
Metabolické funkce
Energetický metabolizmus srdce je závislý na oxidaci VMK. Bylo prokázáno, že EAT obsahuje velké množství VMK a také jejich příjem a výdej je v porovnání s abdominálním viscerálním a podkožním tukem výrazně vyšší [13].
Tato vlastnost pomáhá k ochraně myokardu před vysokou koncentrací VMK v období nadměrného energetického příjmu a naopak slouží jako rychlý zdroj energie v období zvýšené potřeby [12]. VMK difundují z epikardiálního tuku do myokardu buď přímo přes intersticiální tekutinu, nebo cestou koronárních arterií.
Termogenní efekt
Podobně jako u hnědé tukové tkáně obsahuje EAT oproti ostatním depům tukové tkáně mitochondrie, které zvýšeně exprimují tzv. uncoupling protein-1 (UCP1) [14]. Tento protein je v hnědé tukové tkáni zodpovědný za produkci tepla při vystavení organizmu chladovým podmínkám – „rozpojuje“ dýchací řetězec a nastřádaná energie není převáděna do podoby adenozintrifosfátu (ATP), nýbrž je rovnou (přes tento protein) využita k tvorbě tepla. Proto se předpokládá, že EAT může působit jako ochrana myokardu a koronárních cév před hypotermickým poškozením [15].
Zobrazení epikardiální tukové tkáně
Dosud neexistuje shoda ohledně horní hranice normality pro množství srdečního tuku, ať již se jedná o EAT nebo PAT. Podle pitevních nálezů je množství srdeční tukové tkáně velmi variabilní mezi různými populacemi pohybující se v rozmezí 4– 52 % celkové hmotnosti srdce [2]. Pro klinickou praxi je však důležité, že EAT může být vizualizován a jeho množství kvantifikováno pomocí neinvazivních metod, a to pomocí echokardiografie, magnetické rezonance (MR) či počítačové tomografie (CT). V současné době neexistuje konsenzus o metodě volby pro in vivo kvantifikaci srdečního tuku, neboť každá z metod má své výhody i nevýhody.
Echokardiografie umožnuje jednoduchý, rychlý a levný způsob měření vrstvy EAT. Nevýhodou však je nízká reprodukovatelnost odvíjející se od zkušenosti vyšetřujícího lékaře a dále pouze dvourozměrné zobrazení vyšetřované tkáně s nemožností získání objemových dat. Navíc je v některých případech obtížné rozlišit mezi EAT a PAT, a ve skutečnosti má proto ultrazvuk tendenci nadhodnocovat množství EAT na úkor PAT ve srovnávání s MR [16]. Iacobellis a Willens [3] navrhli standardizovanou metodu měření EAT, která se provádí v parasternální dlouhé ose, v endsystole na úrovni volné stěny pravé komory. Výsledná hodnota je průměr z dat získaných ze tří srdečních cyklů [3].
CT vyšetření oproti echokardiografii poskytuje možnost trojrozměrného zobrazení EAT s možností kalkulace objemových dat. CT poskytuje ve srovnání s ostatními zobrazovacími metodami možnost přesnějšího hodnocení EAT, a to díky vyššímu prostorovému rozlišení dané metody. K zobrazení tukové tkáně není třeba použití kontrastní látky, je však oproti echokardiografii zatíženo rentgenovým zářením. Dle protokolu navrženého Foxem et al [17] je srdce snímáno za použití prospektivního EKG-triggeringu po 2,5 mm silných řezech. Kvantifikace celkového objemu EAT probíhá offline. Je nutné manuálně označit perikard v jednotlivých řezech v rozmezí od pravé horní plicní žíly po bránici. Objem uvnitř perikardu je pak vypočten automaticky. Finální kvantifikace EAT je provedena na základě nastavení rozmezí – 195 až – 45 HU, která odpovídá tukové tkáni.
MR srdce je prováděno pomocí standardizovaného protokolu za pomoci EKG-triggeringu. Scanování EAT se provádí pomocí T1 vážených sekvencí v levé šikmé projekci v srdeční diastole [16]. EAT je pro potřeby MR definován jako tuková tkáň uvnitř perikardiálního vaku. Analýza objemu tukové tkáně se provádí podobně jako u CT manuálně. Pro každý řez se určí plocha EAT a objem se získá vynásobením síly jednotlivých řezů. Oproti CT vyšetření pomocí MR pacienta nezatěžuje rentgenovým zářením, je však dražší a časově náročnější.
Vztah epikardiální tukové tkáně k srdečním onemocněním
Kvůli absenci anatomické překážky mezi EAT, myokardem a koronárními cévami je pravděpodobné, že EAT hraje důležitou roli v patofyziologii KV onemocnění (KVO).
Bylo prokázáno, že množství EAT, nezávisle na body mass indexu (BMI), koreluje s přítomností metabolického syndromu, obezity, inzulinové rezistence, dyslipidemie a s kouřením, tedy se všemi tradičními rizikovými faktory KVO [18,19]. Zvláště silná evidence poukazuje na vztah mezi EAT a ischemickou chorobou srdeční (ICHS). Méně dat je dostupných o roli EAT v patofyziologii fibrilace síní (FS) a ostatních KVO.
Ischemická choroba srdeční
Obezita jako taková je významným rizikovým faktorem ICHS. Ukazuje se, že spíše než celkové množství tuku hraje roli jeho lokální distribuce. Role abdominální viscerální obezity v rozvoji aterosklerózy je jasně prokázána, zatímco vztah mezi podkožní tukovou tkání a aterosklerózou již tak těsný není.
EAT je vzhledem ke svému stejnému původu s viscerální tukovou tkání a jeho anatomické blízkosti ke koronárním arteriím přisuzována možná role v patofyziologii ICHS. V popředí jsou dva možné mechanizmy. V prvé řadě, EAT je součástí viscerální adipozity a metabolického syndromu jako rizikového faktoru v rozvoji KVO. Za druhé je to metabolická aktivita EAT a jeho parakrinní a endokrinní vlastnosti. EAT lokálně produkuje celou řadu pro - i protizánětlivých cytokininů, které hrají roli v rozvoji aterosklerózy. Mezi hlavní patří TNF-α, interleukin-6, plasminogen activator inhibitor-1 a adiponectin. Zánětlivé působky uvolněné z EAT ovlivňují stěnu koronárních tepen zejména parakrinně, tedy přímou difuzí přes stěnu tepny. Alternativě pak i cestou vazokrinní, tedy sekrecí působku do vasa vasorum arteriální stěny.
Zajímavou práci publikovali Mazurek et al [20], kde porovnávali lokální koncentraci prozánětlivých působků v EAT a podkožním tuku u pacientů podstupujících operaci koronárních bypassů. Ve své práci prokázali signifikantně vyšší koncentrace mRNA pro interleukin-1, interleukin-6 a TNF-α v EAT oproti podkožní tukové tkáni – toto zjištění poukazuje na možný vliv EAT v rozvoji ICHS nezávisle na celkové obezitě. Všechny tři uvedené cytokiny, zejména pak interleukin-6, působí významně prozánětlivě (narušují smáčivost endotelu, způsobují vystavení prozánětlivých receptorů na endotelových buňkách a obecně jsou považovány za jedny z hlavních mediátorů zánětu urychlujících proces aterosklerózy – EAT produkcí těchto cytokinů tedy může přispívat k rozvoji ICHS lokálním prozánětlivým působením) [21].
Na druhé straně byla prokázána v EAT i exprese adiponectinu, který je považován za protizánětlivý působek. K jeho expresi dochází pouze ve zralých adipocytech a jeho snížená koncentrace je spojována s rozvojem aterosklerózy. Hladina adiponectinu negativně koreluje s množstvím viscerální tukové tkáně a slouží jako ukazatel KV rizika. Iwayama et al [22] prokázali, že hladina adiponectinu obsažená v EAT a secernovaná do perikardiální tekutiny u neobézních pacientů s ICHS negativně koreluje s objemem EAT. Produkce výše uvedených cytokinů v EAT podporuje hypotézu přímé role EAT v regulaci lokální zánětlivé reakce v rozvoji koronární aterosklerózy nezávisle na celkové obezitě.
Vztah mezi tloušťkou EAT a metabolickým syndromem byl opakovaně dokumentován, jak ukazuje metaanalýza publikovaná Pierdomenicem et al [23]. Několik klinických studií zkoumalo vztah mezi EAT a ICHS [24,25]. Framinghamská studie a studie MESA (Multiethnic Study of Atherosclerosis) ukázaly na tradičních rizikových faktorech nezávislý vztah mezi množstvím kalcia obsaženým ve stěně cév a EAT, podporující teorii lokálního efektu EAT na cévní stěnu [26,27]. Další studie ukazují vztah mezi zvýšeným množstvím EAT a přítomností vulnerabilních aterosklerotických plátů, kdy objem EAT byl téměř dvojnásobný u pacientů s vulnerabilními pláty ve srovnání s pacienty bez prokázané ICHS [28]. V dalších studiích byl prokázán vztah mezi množstvím EAT s TIMI (Thrombolysis in Myocardial Infarction) risk score u pacientů s infarktem myokardu bez ST elevací a nestabilní anginou pectoris [29]. V populaci žen s bolestmi na hrudi bez angiografického nálezu na koronárních tepnách bylo zvýšené množství EAT spojeno se sníženou koronární rezervou.
Hajsadeghi et al [30] ukázali, že přidání informace o množství epikardiálního tuku k závažnosti ICHS určené pomocí CT koronarografie významně zlepšuje predikci hlavních srdečních příhod (Major Adverse Cardial Events – MACE) u pacientů s podezřením na ICHS. Všechny tyto studie tak ukazují, že stanovení množství EAT by mohlo v budoucnu sloužit jako jeden z nových snadno dostupných biomarkerů k lepší stratifikaci rizika u pacientů trpících ICHS.
Fibrilace síní
FS je nečastěji se vyskytující arytmie. Patofyziologie FS není dosud i přes značný pokrok v poznání plně objasněna. Při vzniku a udržení FS hraje roli řada rizikových faktorů – mezi základní rizikové faktory přitom jako i u jiných KV nemocí patří obezita. Populační studie ukázaly, že BMI jako marker obezity je silným prediktorem FS a každý nárůst BMI o 5 kg/ m2 zvyšuje riziko vzniku FS o 10– 30 % [31].
U obézních pacientů se hlavní příspěvek do patofyziologie FS přiznává viscerální tukové tkáni, která může hrát centrální roli ve vývoji KVO, spíše než podkožnímu tuku, jehož význam se dle aktuálně dostupných dat jeví výrazně menší [32].
Epikardiální tuk je kvůli absenci anatomické bariéry mezi EAT a myokardem považován za významný rizikový faktor pro vznik a udržení FS. Již v 60. a 70. letech se předpokládalo, že množství tuku obklopujícího srdce může souviset s výskytem síňových arytmií. Teprve nedávno se teorie o roli EAT v patofyziologii arytmií dostala do popředí zájmu, a to zejména s rozvojem neinvazivních zobrazovacích metod. Wong et al [33] provedli metaanalýzu 63 studií zahrnující celkem 352 275 pacientů studující vztah mezi FS a EAT. Dle výsledků této metaanalýzy je množství EAT spojeno s vyšším výskytem FS. Z výsledků navíc vyplývá, že množství EAT pozitivně koreluje s progresí FS z formy paroxysmální do formy perzistující. Podobně pozitivní vztah má množství EAT i k riziku rekurence FS po radiofrekvenční ablaci či elektrické kardioverzi – pacienti s větším množstvím EAT z výše uvedených výkonů spíše tedy nebudou profitovat než jedinci s nižším množstvím EAT. Dále z výsledku této velké metaanalýzy vyplývá, že asociace mezi EAT a FS je statisticky významnější než vztah mezi FS a celkovou či abdominální obezitou [33], což ještě více poukazuje na možné lokální působení EAT než na celkový vliv obezity jako takové na rozvoj a udržení FS.
EAT se může na progresi FS podílet několika způsoby. Jednak masa tuku naléhající na myokard muže vést ke zhoršení diastolické funkce srdeční, a tím k progresi dilatace levé síně, která je nezávislým faktorem vzniku a udržení FS [34]. Také přibývá důkazů, že lokální i systémová zánětlivá reakce hraje roli v patofyziologii FS a podobně jako u ICHS (viz výše) bylo prokázáno, že markéry zánětu jako C-reaktivní protein, interleukin-6, interleukin-8, interleukin-1 beta a TNF-α hrají roli při vzniku a rekurenci FS [35– 37]. Výsledky biopsií ze síní ukazují zvýšenou přítomnost zánětlivých infiltrátů, myokardiální nekrózy a fibrózy u pacientů s tzv. lone FS oproti pacientům s Wolff-Parkinson-White syndromem [35]. Pro - a protizánětlivé cytokininy secernované EAT mohou ovlivňovat přilehlý myokard jednak lokálně a jednak přes vasa vasorum, a tím přispívat k vzniku a udržení FS.
Sekrece adipokininů v rámci perikardiálního prostoru a jejich parakrinní působení může vést i k progresi fibrózy myokardu. Ve prospěch této teorie hovoří fakt, že látky secernované z EAT vedly při pokusech na krysím modelu k progresi fibrózy síní, zatímco látky secernované z podkožní tukové tkáně nikoli [38]. Mezi látky, u kterých byl prokázán přímý vztah k progresi fibrózy, patří zejména adiponectin, aktivin-A a dále matrixové metalloproteinázy 2 a 7 [39,40].
Dalším potenciálním mechanizmem je přímá infiltrace adipocytu do přilehlého myokardu síní. Přítomnost adipocytů vede ke zpomalení vedení vzruchu a vzniku heterogenity vzniku a šíření akčního potenciálu podobnému jako u fibrózní přestavby myokardu [41]. Přitom bylo prokázáno, že infiltrace myokardu adipocyty je úměrná množství EAT [42]. Zajímavé také je, že akumulace EAT korelují s místy frakcionovaných potenciálů v levé síni a plicních žil, čímž EAT může ovlivňovat spouštěče FS [43].
V neposlední řadě je dalším diskutovaným mechanizmem také autonomní dysfunkce vedoucí k vyvolání a udržení FS [44]. Ganglia autonomního nervového systému se nacházejí přímo v EAT a jejich aktivace může vést jak k sympatické, tak parasympatické odpovědi, což ve svém důsledku vede ke změně délky trvání akčního potenciálu myokardu síní. To, zda a jakým způsobem EAT ovlivňuje ganglia autonomního systému, není zatím zcela jasné, avšak tuto hypotézu podporuje fakt, že injekce botulotoxinu do perikardiálního vaku vedla k poklesu aktivity autonomního nervstva a výskytu FS [45].
Srdeční selhání
Bylo publikováno několik studií poukazujících na redukci EAT u pacientů se systolickým srdečním selháním (SS) oproti zdravým pacientům, a to nezávisle na etiologii SS [46,47]. Z výsledků subanalýzy jedné ze studií vyplývá, že pacienti s těžkou systolickou dysfunkcí (EF LK < 35 %) měli méně EAT než pacient s depresí funkce středního a lehkého stupně, a to nezávisle na BMI [46]. V další studii byla prokázána negativní korelace mezi množstvím EAT a hladinou BNP jako tradičního markeru SS [48]. Naproti tomu Mookadam et al [49] publikovali studii, kde ukázali větší množství EAT u pacientů s mírnou formou SS (EF LK 45– 55 %) v porovnání se zdravými pacienty. Ve studii publikované Karayannisem et al [50] nebyl rozdíl mezi množství EAT u pacientů s ischemickou kardiomyopatií a kontrolní skupinou.
Z výše uvedených velmi heterogenních výsledků vyplývá, že vztah mezi množstvím EAT a SS je stále nejasný. EAT slouží jako zdroj VMK pro pracující myokard. Jednou z teorií je vyšší energetický nárok selhávajícího myokardu, jehož potřeby jsou pokrývány právě z EAT, čímž dochází k jeho redukci. Recentní studie také ukázaly, že jak natriuretický peptid A, tak Bpravděpodobně aktivují lipolýzu v tukové tkání, tedy zvýšené hodnoty u pacientů se SS se mohou podílet na redukci EAT [8,51,52]. V neposlední řadě se redukce EAT přičítá celkové kachektizaci u pacientů se SS. Než tedy bude možné zcela objasnit význam EAT v patofyziologii SS, je nutné provést větší a komplexnější studie, které budou zahrnovat pacienty s různou tíží i etiologií SS.
Terapeutické ovlivnění množství epikardiální tukové tkáně
S ohledem na výše popsané zapojení EAT do patofyziologie KVO (zejména možný negativní podíl zvýšeného množství EAT) jsou zkoumány i možnosti jejího možného terapeutického ovlivnění. Mezi primární možnosti ovlivnění EAT patří zejména změna životního stylu. Redukce hmotnosti snížením kalorického příjmu nebo navýšení energetického výdeje cvičením je spojeno s redukcí objemu EAT u obézních pacientů [53]. Stejný efekt byl popsán u pacientů podstupujících bariatrickou operaci žaludku [54].
Efekt medikamentózního působení na snížení množství EAT zůstává kontroverzní. Existují dvě práce popisující efekt terapie statiny na množství epikardiálního tuku [55,56] a výstupem těchto prací je i myšlenka, že redukce EAT je jedním z možných dalších pleotropních účinků statinové terapie.
Další možnosti medikamentózního ovlivnění množství EAT přinášejí práce s antidiabetiky. Užívání pioglitazonu vedlo ve srovnání s metforminem k nárůstu objemu EAT [57]. Naopak Lima-Martínez et al [58] publikovali studii ukazující signifikantní redukci EAT u diabetiků 2. typu, kteří užívali sitagliptin přidaný k monoterapii metforminem po dobu 24 měsíců. Podobný účinek byl nedávno popsán i u liraglutidu, a to nezávisle na změně tělesné hmotnosti [59].
Závěr
Dle současných poznatků hraje EAT významnou roli v patofyziologii srdečních onemocnění a kvůli svým vlastnostem endokrinním a parakrinním ovlivňuje přilehlý myokard. Přes četný výzkum zůstává řada mechanizmů ovlivnění myokardu nejasná. Zatím nejvíce důkazů existuje o vlivu EAT na rozvoj aterosklerózy a ICHS, u ostatních KVO jako FS a SS je evidence zatím slabší.
Díky jeho snadné kvantifikaci pomocí neinvazivních zobrazovacích metod je na EAT pohlíženo jako na možný marker, který bude možno v budoucnosti použít k přesnější stratifikaci KV rizika.
Vzhledem k jeho vlastnostem a potenciálnímu riziku by mělo být na EAT pohlíženo jako na nový terapeutický cíl, kdy kromě nefarmakologických intervencí se v současné době jako nejslibnější lékovou skupinou zdají být statiny a léky ovlivňující inkretinový systém.
Doručeno do redakce: 14. 5. 2018
Přijato po recenzi: 23. 5. 2018
MU Dr. Filip Souček
Zdroje
1. Iacobellis G, Corradi D, Sharma AM. Epicardial adipose tissue: anatomic, biomolecular and clinical relationships with the heart. Nat Clin Pract Cardiovasc Med 2005; 2(10): 536– 543. doi: 10.1038/ ncpcardio0319.
2. Rosito GA, Massaro JM, Hoffmann U et al. Pericardial fat, visceral abdominal fat, cardiovascular disease risk factors, and vascular calcification in a community-based sample. Circulation 2008; 117(5): 605– 613. doi: 10.1161/ CIRCULATIONAHA.107.743062.
3. Iacobellis G, Willens HJ. Echocardiographic epicardial fat: a review of research and clinical applications: inflammatory mechanisms and persistence of atrial fibrillation. J Am Soc Echocardiogr 2009; 22(12): 1311– 1319. doi: 10.1016/ j.echo.2009.10.013.
4. Sacks HS, Fain JN. Human epicardial adipose tissue: A review. Am Heart J 2007; 153(6): 907– 917. doi: 10.1016/ j.ahj.2007.03.019.
5. Chung MK, Martin DO, Sprecher D et al. C-reactive protein elevation in patients with atrial arrhythmias. Circulation 2001; 104(24): 2886– 2891.
6. Duncan BB, Schmidt MI, Pankow JS et al. Adiponectin and the development of type 2 diabetes. Diabetes 2004; 53(9): 2473– 2478.
7. Baker AR, da Silva NF, Quinn DW et al. Human epicardial adipose tissue expresses a pathogenic profile of adipocytokines in patients with cardiovascular disease. Cardiovasc Diabetol 2006; 5 : 1– 1. doi: 10.1186/ 1475-2840-5-1.
8. Iacobellis G, Pistilli D, Gucciardo M et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease. Cytokine 2005; 29(6): 251– 255. doi: 10.1016/ j.cyto.2004.11.002.
9. Jain SH, Massaro JM, Hoffmann U et al. Cross-sectional associations bet ween abdominal and thoracic adipose tissue compartments and adiponectin and resistin in the framingham heart study. Diabetes Care 2009; 32(5): 903– 908. doi: 10.2337/ dc08-1733.
10. Schäffler A, Schölmerich J. Innate immunity and adipose tissue biology. Trends Immunol 2010; 31(6): 228– 235. doi: 10.1016/ j.it.2010.03.001.
11. Prati F, Arbustini E, Labellarte A et al. Eccentric atherosclerotic plaques with positive remodelling have a pericardial distribution: a permissive role of epicardial fat? A three-dimensional intravascular ultrasound study of left anterior descending artery lesions. Eur Heart J 2003; 24(4): 329– 336.
12. Sacks HS, Fain JN, Cheema P et al. Inflammatory genes in epicardial fat contiguous with coronary atherosclerosis in the metabolic syndrome and type 2 diabetes: changes associated with pioglitazone. Diabetes Care 2011; 34(3): 730– 733. doi: 10.2337/ dc10-2083.
13. Pezeshkian M, Noori M, Najjarpour-Jabbari H et al. Fatty acid composition of epicardial and subcutaneous human adipose tissue. Metab Syndr Relat Disord 2009; 7(2): 125– 131.
14. Yao X, Shan S, Zhang Y et al. Recent progress in the study of brown adipose tissue. Cell Biosci 2011; 1 : 35. doi: 10.1186/ 2045-3701-1-35.
15. Sacks HS, Fain JN, Holman B et al. Uncoupling protein-1 and related messenger ribonucleic acids in human epicardial and other adipose tissues: epicardial fat functioning as brown fat. J Clin Endocrinol Metab 2009; 94(9): 3611– 3615. doi: 10.1210/ jc.2009-0571.
16. Sicari R, Sironi AM, Petz R et al. Pericardial rather than epicardial fat is a cardiometabolic risk marker: an MRI vs echo study. J Am Soc Echocardiogr 2011; 24(10): 1156– 1162. doi: 10.1016/ j.echo.2011.06.013.
17. Fox CS, Gona P, Hoffmann U et al. Pericardial fat, intrathoracic fat, and measures of left ventricular structure and function: the Framingham Heart Study. Circulation 2009; 119(12): 1586– 1591. doi: 10.1161/ CIRCULATIONAHA.108.828970.
18. Djaberi R, Schuijf JD, van Werkhoven JM et al. Relation of Epicardial Adipose Tissue to Coronary Atherosclerosis. Am J Cardiol 2008; 102(12): 1602– 1607. doi: 10.1016/ j.amjcard.2008.08.010.
19. Wang TD, Lee WJ, Shih FY et al. Relations of epicardial adipose tissue measured by multidetector computed tomography to components of the metabolic syndrome are region-specific and independent of anthropometric indexes and intraabdominal visceral fat. J Clin Endocrinol Metab 2009; 94(2): 662– 669. doi: 10.1210/ jc.2008-0834.
20. Mazurek T, Zhang L, Zalewski A et al. Human epicardial adipose tissue is a source of inflammatory mediators. Circulation 2003; 108(20): 2460– 2466. doi: 10.1161/ 01.CIR.0000099542.57313.C5.
21. Hartman J, Frishman WH. Inflammation and atherosclerosis: a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy. Cardiol Rev 2014; 22(3): 147– 151. doi: 10.1097/ CRD.0000000000000021.
22. Iwayama T, Nitobe J, Watanabe T et al. The role of epicardial adipose tissue in coronary artery disease in non-obese patients. J Cardiol 2014; 63(5): 344– 349. doi: 10.1016/ j.jjcc.2013.10.002.
23. Pierdomenico SD, Pierdomenico AM, Cuccurullo F et al. Meta-analysis of the relation of echocardiographic epicardial adipose tissue thickness and the metabolic syndrome. Am J Cardiol 2013; 111(1): 73– 78. doi: 10.1016/ j.amjcard.2012.08.044.
24. Yerramasu A, Dey D, Venuraju S et al. Increased volume of epicardial fat is an independent risk factor for accelerated progression of sub-clinical coronary atherosclerosis. Atherosclerosis 2012; 220(1): 223– 230. doi: 10.1016/ j.atherosclerosis.2011.09.041.
25. Wang TD, Lee WJ, Shih FY et al. Association of epicardial adipose tissue with coronary atherosclerosis is region-specific and independent of conventional risk factors and intra-abdominal adiposity. Atherosclerosis 2010; 213(1): 279– 287. doi: 10.1016/ j.atherosclerosis.2010.07.055.
26. Ding J, Hsu FC, Harris TB et al. The association of pericardial fat with incident coronary heart disease: the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Clin Nutr 2009; 90(3): 499– 504. doi: 10.3945/ ajcn.2008.27358.
27. Ito T, Nasu K, Terashima M et al. The impact of epicardial fat volume on coronary plaque vulnerability: insight from optical coherence tomography analysis. Eur Heart J Cardiovasc Imaging 2012; 13(5): 408– 415. doi: 10.1093/ ehjci/ jes022.
28. Schlett CL, Ferencik M, Kriegel MF et al. Association of pericardial fat and coronary high-risk lesions as determined by cardiac CT. Atherosclerosis 2012; 222(1): 129– 134. doi: 10.1016/ j.atherosclerosis.2012.02.029.
29. Sade LE, Eroglu S, Bozbaş H et al. Relation between epicardial fat thickness and coronary flow reserve in women with chest pain and angiographically normal coronary arteries. Atherosclerosis 2009; 204(2): 580– 505. doi: 10.1016/ j.atherosclerosis.2008.09.038.
30. Hajsadeghi F, Nabavi V, Bhandari A et al. Increased epicardial adipose tissue is associated with coronary artery disease and major adverse cardiovascular events. Atherosclerosis 2014; 237(2): 486– 489. doi: 10.1016/ j.atherosclerosis.2014.09.037.
31. Wang TJ, Parise H, Levy D et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004; 292(20): 2471– 2477. doi: 10.1001/ jama.292.20.2471.
32. Fox CS, Massaro JM, Hoffmann U et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study. Circulation 2007; 116(1): 39– 48. doi: 10.1161/ CIRCULATIONAHA.106.675355.
33. Wong CX, Sun MT, Odutayo A et al. Associations of epicardial, abdominal, and overall adiposity with atrial fibrillation. Circ Arrhythm Electrophysiol 2016; 9(12): pii: e004378. doi: 10.1161/ CIRCEP.116.004378.
34. Chen PS, Chen LS, Fishbein MC et al. Role of the autonomic nervous system in atrial fibrillation: pathophysiology and therapy. Circ Res 2014; 114(9): 1500– 1515. doi: 10.1161/ CIRCRESAHA.114.303772.
35. Frustaci A, Chimenti C, Bellocci F et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation 1997; 96(4): 1180– 1184.
36. Aviles RJ, Martin DO, Apperson-Hansen C et al. Inflammation as a risk factor for atrial fibrillation. Circulation 2003; 108(24): 3006– 3010. doi: 10.1161/ 01.CIR.0000103131.70301.4F.
37. Malouf JF, Kanagala R, Al Atawi FO et al. High sensitivity c-reactive protein: a novel predictor for recurrence of atrial fibrillation after successful cardioversion. J Am Coll Cardiol 2005; 46(7): 1284– 1287. doi: 10.1016/ j.jacc.2005.06.053.
38. Venteclef N, Guglielmi V, Balse E et al. Human epicardial adipose tissue induces fibrosis of the atrial myocardium through the secretion of adipo-fibrokines. Eur Heart J 2015; 36(13): 795– 805. doi: 10.1093/ eurheartj/ eht099.
39. Boixel C, Fontaine V, Rücker-Martin C et al. Fibrosis of the left atria during progression of heart failure is associated with increased matrix metalloproteinases in the rat. J Am Coll Cardiol 2003; 42(2): 336– 344. doi: 10.1016/ S0735-1097(03)00578-3.
40. Iacobellis G, Leonetti F, Singh N et al. Relationship of epicardial adipose tissue with atrial dimensions and diastolic function in morbidly obese subjects. Int J Cardiol 2007; 115(2): 272– 273. doi: 10.1016/ j.ijcard.2006.04.016.
41. Wong CX, Stiles MK, John B et al. Direction-dependent conduction in lone atrial fibrillation. Heart Rhythm 2010; 7(9): 1192– 1199. doi: 10.1093/ europace/ eur42842.
42. Mahajan R, Lau DH, Brooks AG et al. Electrophysiological, electroanatomical, and structural remodeling of the atria as consequences of sustained obesity. J Am Coll Cardiol 2015; 66(1): 1– 11. doi: 10.1016/ j.jacc.2015.04.058.
43. Nakahara S, Toratani N, Nakamura H et al. Spatial relationship between high-dominant-frequency sites and the linear ablation line in persistent atrial fibrillation: its impact on complex fractionated electrograms. Europace 2013; 15(2): 189– 197. doi: 10.1093/ europace/ eus290.
44. Nakagawa H, Scherlag BJ, Patterson E et al. Pathophysiologic basis of autonomic ganglionated plexus ablation in patients with atrial fibrillation. Hear Rythm 2009; 6 (12 Suppl): S26– S34. doi: 10.1016/ j.hrthm.2009.07.029.
45. Pokushalov E, Kozlov B, Romanov A et al. Long-term suppression of atrial fibrillation by botulinum toxin injection into epicardial fat pads in patients undergoing cardiac surgery. Circ Arrhythm Electrophysiol 2015; 8(6): 1334– 1341. doi: 10.1161/ CIRCEP.115.003199.
46. Khawaja T, Greer C, Chokshi A et al. Epicardial fat volume in patients with left ventricular systolic dysfunction. Am J Cardiol 2011; 108(3): 397– 401. doi: 10.1016/ j.amjcard.2011.03.058.
47. Doesch C, Haghi D, Flüchter S et al. Epicardial adipose tissue in patients with heart failure. J Cardiovasc Magn Reson 2010; 12 : 40. doi: 10.1186/ 1532-429X-12-40.
48. Tabakci MM, Durmuş Hİ, Avci A et al. Relation of epicardial fat thickness to the severity of heart failure in patients with nonischemic dilated cardiomyopathy. Echocardiography 2015; 32(5): 740– 748. doi: 10.1111/ echo.12796.
49. Mookadam F, Goel R, Alharthi MS et al. Epicardial fat and its association with cardiovascular risk: a cross-sectional observational study. Heart Views 2010; 11(3): 103– 108. doi: 10.4103/ 1995-705X.76801.
50. Karayannis G, Giamouzis G, Tziolas N et al. Association between epicardial fat thickness and weight homeostasis hormones in patients with noncachectic heart failure. Angiology 2013; 64(3): 173– 180. doi: 10.1177/ 0003319712447978.
51. Nagaya N, Moriya J, Yasumura Y et al. Effects of ghrelin administration on left ventricular function, exercise capacity, and muscle wasting in patients with chronic heart failure. Circulation 2004; 110(24): 3674– 3679. doi: 10.1161/ 01.CIR.0000149746.62908.BB.
52. Papotti M, Ghè C, Cassoni P et al. Growth hormone secretagogue binding sites in peripheral human tissues. J Clin Endocrinol Metab 2000; 85(10): 3803– 3807. doi: 10.1210/ jcem.85.10.6846.
53. Iacobellis G, Singh N, Wharton S et al. Substantial changes in epicardial fat thickness after weight loss in severely obese subjects. Obesity (Silver Spring) 2008; 16(7): 1693– 1697. doi: 10.1038/ oby.2008.251.
54. Gaborit B, Jacquier A, Kober F et al. Effects of bariatric surgery on cardiac ectopic fat: lesser decrease in epicardial fat compared to visceral fat loss and no change in myocardial triglyceride content. J Am Coll Cardiol 2012; 60(15): 1381– 1389. doi: 10.1016/ j.jacc.2012.06.016.
55. Park JH, Park YS, Kim YJ et al. Effects of statins on the epicardial fat thickness in patients with coronary artery stenosis underwent percutaneous coronary intervention: comparison of atorvastatin with simvastatin/ ezetimibe. J Cardiovasc Ultrasound 2010; 18(4): 121– 126. doi: 10.4250/ jcu.2010.18.4.121.
56. Soucek F, Covassin N, Singh P et al. Effects of atorvastatin (80 mg) therapy on quantity of epicardial adipose tissue in patients undergoing pulmonary vein isolation for atrial fibrillation. Am J Cardiol 2015; 116(9): 1443– 1446. doi: 10.1016/ j.amjcard.2015.07.067.
57. Jonker JT, Lamb HJ, van der Meer RW et al. Pioglitazone compared with metformin increases pericardial fat volume in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2010; 95(1): 456– 460. doi: 10.1210/ jc.2009-1441.
58. Lima-Martínez MM, Paoli M, Rodney M et al. Effect of sitagliptin on epicardial fat thickness in subjects with type 2 diabetes and obesity: a pilot study. Endocrine 216; 51(3): 448– 455. doi: 10.1007/ s12020-015-0710-y.
59. Morano S, Romagnoli E, Filardi T et al. Short-term effects of glucagon-like peptide 1 (GLP-1) receptor agonists on fat distribution in patients with type 2 diabetes mellitus: an ultrasonography study. Acta Diabetol 2015; 52(4): 727– 732. doi: 10.1007/ s00592-014-0710-z.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2018 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hypertyreóza a srdce
- Hypotyreóza a srdce
- Primární hyperaldosteronizmus a hypertenze
- Feochromocytom a srdce
- Kardiovaskulární riziko u pacientů s Cushingovým syndromem
- Dyslipidemie u vybraných endokrinopatií
- Evropská doporučení pro diagnostiku a management synkop z roku 2018 – komentovaná zkrácená verze
- Gestační diabetes a možnosti jeho léčby
- Role epikardiálního tuku v patofyziologii srdečních onemocnění
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav
- Evropský kardiologický kongres 2018
- Co také zaznělo na Kongresu o srdečním selhání 2018 ve Vídni
- ESC 2018 Řešení při vysokém KV riziku? Správná kombinace!
- ESC 2018 „Diamantová cesta“ – moderní přístup v léčbě anginy pectoris
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hypertyreóza a srdce
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav
- Hypotyreóza a srdce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



