-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHypotyreóza a srdce
Hypothyroidism and the heart
Hypothyroidism is often found in patients with cardiovascular disease; it is a risk factor for atherosclerosis and ischaemic heart disease and has a negative impact on left and right ventricle function (hypothyroid cardiomyopathy). Overt hypothyroidism is always treated with levothyroxine replacement. In patients with coincident cardiovascular disease, the treatment starts with a low dose of levothyroxine, which is increased gradually. In subclinically hypothyroid patients with cardiovascular disease, the levothyroxine replacement remains controversial and its benefits probably depend on the patient’s age. As the risk/benefit ratio often increases in the elderly, we are usually satisfied with target TSH in the upper part of the reference range or slightly above. With some simplification we can say that the best risk/benefit ratio of levothyroxine replacement in subclinical hypothyroidism is in cardiovascular patients aged 45–65.
Key words:
hypothyroidism – subclinical hypothyroidism – cardiovascular risk – ischaemic heart disease – left ventricle failure – right ventricle failure
Autoři: J. Jiskra
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Kardiol Rev Int Med 2018, 20(3): 173-177
Souhrn
Hypotyreóza je u pacientů se srdečním onemocněním častým nálezem. Je rizikovým faktorem aterosklerózy a ischemické choroby srdeční a má přímý negativní vliv na funkci levé i pravé srdeční komory (hypotyreózní kardiomyopatie). Manifestní hypotyreóza je vždy důvodem k substituční léčbě levotyroxinem. U pacientů se srdečním onemocněním vždy začínáme léčbu malou dávkou a zvyšujeme postupně. Léčba subklinické hypotyreózy zůstává u pacientů se srdečním onemocněním kontroverzní a její benefity pravděpodobně závisí na věku. Ve vyšším věku často rizika léčby převáží, a proto se raději spokojíme s cílovými hodnotami tyreoidálního stimulačního hormonu v horním pásmu referenčního rozmezí nebo i lehce nad ni, než abychom pacienta předávkovali. Velmi zjednodušeně lze říci, že z léčby subklinické hypotyreózy pravděpodobně nejvíce profitují pacienti se srdečním onemocněním ve věku 45– 65 let.
Klíčová slova:
hypotyreóza – subklinická hypotyreóza – kardiovaskulární riziko – ischemická choroba srdeční – dysfunkce levé komory srdeční – dysfunkce pravé komory srdeční
Patofyziologie
Existují dva hlavní mechanizmy negativního vlivu hypotyreózy na srdce:
- přímý negativní vliv hypotyreózy na srdeční funkci (hypotyreózní kardiomyopatie),
- hypotyreóza jako potenciální rizikový faktor aterosklerózy, ischemické choroby srdeční (ICHS) a dalších kardiovaskulárních chorob.
Hypotyreózní kardiomyopatie
Změny srdce u manifestní hypotyreózy jsou dobře známé. Patří sem perikardiální výpotek a porucha relaxace a kontraktility srdečního svalu s diastolickou a systolickou dysfunkcí. Průvodním jevem jsou nespecifické změny na EKG (negativní T a snížená voltáž v hrudních svodech) a elevace kreatinkinázy v séru. Ty jsou nejednou mylně interpretovány jako ischemické změny (obr. 1). Perikardiální výpotek je způsoben sníženou glomerulární filtrací a sníženou schopností ledvin vylučovat vodu. Při tom dochází k hromadění tekutiny v třetích prostorech a k hyponatremii. To je pro hypotyreózu typický jev. Porucha srdečního svalu se nejprve projeví poruchou relaxace (diastolická dysfunkce). Příčinou je zřejmě změna složení proteoglykanů mezibuněčného prostoru myokardu a vazba vody na ně – podobně jako při postižení kůže. Postupně dochází i k poruše bílkovin myokardu a k poklesu kontraktility (stejný mechanizmus vede v příčně pruhovaných svalech k hypotyreózní myopatii). Tyto změny jsou reverzibilní a funkce srdečních komor se po substituční léčbě levotyroxinem normalizuje, i když to může trvat řadu měsíců.
Obr. 1. EKG u hypotyreózy – a) negativní T u neléčené hypotyreózy, b) normalizace po léčbě levotyroxinem. 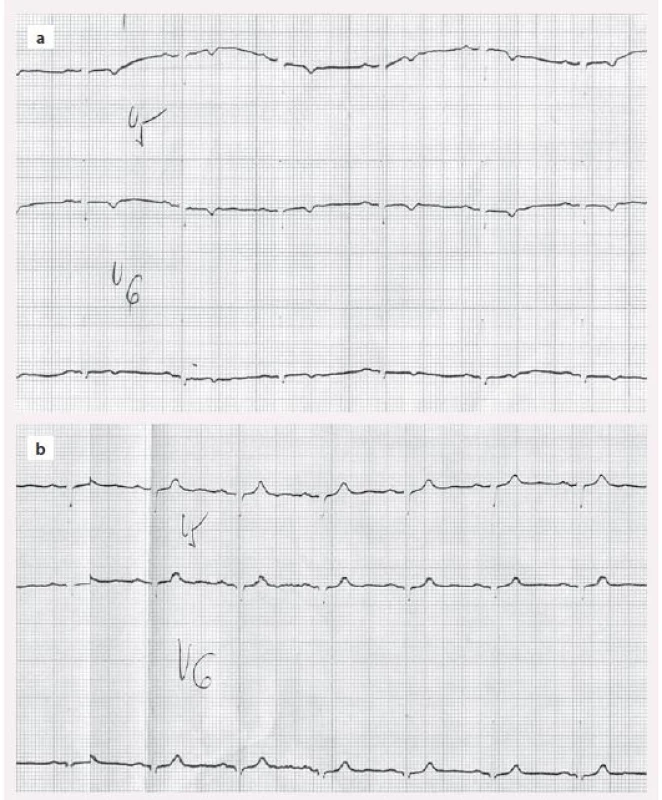
Hypotyreóza jako rizikový faktor aterosklerózy, ICHS a dalších kardiovaskulárních chorob
Mechanizmy, kterými může hypotyreóza přispívat k ateroskleróze, jsou v tab. 1. V posledních 30 letech byla realizována řada studií a metaanalýz, ve kterých byla manifestní hypotyreóza významným rizikovým faktorem kardiovaskulární (KV) morbidity a mortality. Naopak subklinická hypotyreóza byla signifikantním rizikovým faktorem jen v některých z nich a některé práce naopak ukázaly, že vyšší tyreoidální stimulační hormon (TSH) je spojen s nižší KV mortalitou [1]. Je zřejmé, že KV riziko je u subklinické hypotyreózy závislé na věku (obr. 2) [2] a nejvíce jsou ohroženy osoby ve věku 45– 65 let (zejména postmenopauzální ženy), kdy je obecně KV riziko vysoké [3]. Intervence v podobě substituční léčby levotyroxinem v tomto období má také nejvyšší potenciál toto riziko snížit, i když žádné randomizované studie to nepotvrdily. Naopak ve vyšším věku (> 85 let) je subklinická hypotyreóza spíše protektivním faktorem KV chorob. Příkladem je 2× nižší mortalita u osob nad 85 let s mírně vyšším TSH (> 4,8 IU/ l) [4]. Nedávno publikovaná studie TRUST (Thyroid Hormone Replacement for Subclinical Hypo-Thyroidism Trial) ukázala, že léčba subklinické hypotyreózy u osob vyššího věku nevedla ani ke zlepšení klinických příznaků (únavy a dalších možných symptomů hypotyreózy) ve srovnání s kontrolní skupinou [5].
Tab. 1. Kardiovaskulární a metabolické důsledky hypotyreózy. 
LDL – lipoprotein s nízkou hustotou, HDL – lipoprotein s vysokou hustotou Obr. 2. Závislost kardiovaskulárního rizika subklinické hypotyreózy na věku. Převzato a upraveno dle [2]. ![Závislost kardiovaskulárního rizika subklinické hypotyreózy na věku.
Převzato a upraveno dle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9a0fb9093b0d804d4f93b889c0ed1d65.jpeg)
Nemáme dosud žádné důkazy, že má léčba levotyroxinem u subklinické hypotyreózy pozitivní vliv na KV morbiditu a mortalitu. K dispozici jsou pouze intervenční, většinou nerandomizované studie, které ukázaly, že léčba příznivě ovlivňuje rizikové faktory aterosklerózy [6,7], klesala rychlost pulzové vlny jako nezávislého prediktoru koronární aterosklerózy [8], zlepšila se průtokem zprostředkovaná vazodilatace [9], došlo k poklesu systolického i diastolického krevního tlaku, zlepšila se glomerulární filtrace, snížila se intimomediální tloušťka, zvětšil se průměr a. carotis a byl pozorován vzestup endoteliálních progenitorových buněk jako nepřímá známka zlepšení endoteliální dysfunkce [10]. Terapie levotyroxinem u subklinické hypotyreózy také vedla ke zlepšení funkční tělesné zdatnosti (měřené 6minutovým „walk“ testem na běhátku) [11] a ke zlepšení dysfunkce levé [12] i pravé [13] srdeční komory. Na druhou stranu KV morbidita byla zvýšená i u pacientů, kteří měli subklinickou hypotyreózu léčenou levotyroxinem [14]. Řada prací také ukázala, že zejména u starších osob je relativní KV riziko subklinické hypertyreózy (a tedy i riziko plynoucí z předávkování levotyroxinem!) vyšší než riziko subklinické hypotyreózy (obr. 3) [3]. Nedávné retrospektivní kohortové studie neprokázaly žádný vliv léčby levotyroxinem u pacientů se subklinickou hypotyreózou na riziko infarktu myokardu a celkovou mortalitu (n = 12 212) [15] ani na další KV příhody či frekvenci hospitalizací (n = 1 192) [16]. Rovněž zcela recentní dvojitě slepá randomizovaná studie neprokázala pokles intimomediální tloušťky karotid ani jiný příznivý vliv na aterosklerózu karotid při léčbě levotyroxinem u subklinické hypotyreózy u osob > 65 let [17].
Obr. 3. Relativní riziko kardiovaskulární morbidity u subklinické hypo- a hypertyreózy u osob starších 80 let. Převzato a upraveno dle [3]. ![Relativní riziko kardiovaskulární morbidity u subklinické hypo- a hypertyreózy
u osob starších 80 let. Převzato a upraveno dle [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/dc99dbfee82f9ffe2c80bcb27e8d0921.jpeg)
Diagnostika hypotyreózy
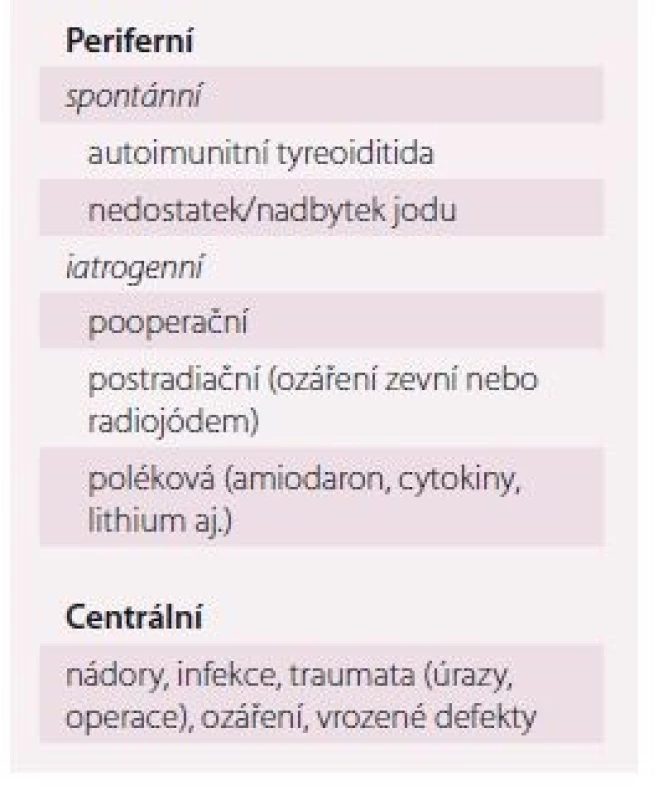
Základem diagnostiky periferní hypotyreózy je vyšetření TSH v séru. Pokud je normální, lze periferní tyreoidální dysfunkci vyloučit. Pokud je TSH zvýšený, doplníme volný tyroxin (FT4) a protilátky proti tyreoidální peroxidáze (TPOAb) v séru, event. zopakujeme TSH. Bude-li FT4 snížený, jde o manifestní hypotyreózu, bude-li normální, jde o subklinickou hypotyreózu. Pozitivní TPOAb svědčí pro nejčastější příčinu hypotyreózy – autoimunitní tyreoiditidu. Ostatní příčiny jsou relativně vzácné (tab. 2). Je-li podezření na centrální hypotyreózu (operace nebo onemocnění hypofýzy v anamnéze, úraz hlavy, ozáření centrálního nervového systému (CNS), krvácení do CNS apod.), je diagnóza naopak založena na vyšetření FT4.
Důležité je, že ne každá elevace TSH automaticky znamená hypotyreózu. Většina velkých observačních studií ukázala, že TSH v krvi fyziologicky stoupá s věkem pravděpodobně z důvodu přirozených tyreoidálních změn v rámci „stárnutí orgánu“ a změny úrovně hypofyzární zpětné vazby [18,19]. Ve studii NHANES u pacientů nad 30– 39 let stoupal 97,5 percentil normy pro TSH každých 10 let o 0,3 IU/ l, což nebylo ovlivněno hmotností, tyreoidálními protilátkami, ani jodurií [20]. Kromě toho existují i „netyreoidální“ příčiny mírné elevace TSH (tab. 3), kdy jsou negativní protilátky a normální ultrazvuk. Tyto stavy nevyžadují léčbu levotyroxinem.
Tab. 3. Příčiny netyreoidální elevace TSH v séru. 
Proto by diagnóza subklinické hypotyreózy měla být potvrzena nejméně dvěma patologickými výsledky TSH v odstupu 3– 6 měsíců a měly by se doplnit TPOAb v séru nebo ultrazvuk štítné žlázy, aby byla dokumentována příčina. Normalizace TSH je totiž častá, zejména ve vyšším věku. Podle studie Somwaru et al došlo u osob ve věku > 65 let po 2 letech ke spontánní normalizaci TSH u 46 % osob se vstupním TSH 4,5– 6,9 IU/ l a u 10 % osob se vstupním TSH 7– 9,9 IU/ l a u 48 % osob se vstupně negativními TPOAb a 15 % osob se vstupně pozitivními TPOAb [21]. Obecně platí, že diagnostika hypo - i hypertyreózy je spolehlivější v ambulantním režimu. Důvodem je to, že TSH je velmi citlivý parametr, který je ovlivněn řadou přidružených akutních i chronických chorob. Pokud je však důvodné klinické podezření na tyreoidální dysfunkci, provádíme laboratorní testy samozřejmě i za hospitalizace.
Terapie hypotyreózy u pacienta se srdečním onemocněním
Podstatou léčby hypotyreózy je hormonální substituce levotyroxinem (LT4). Orientační denní dávka je 1,5 µg LT4 na 1 kg tělesné hmotnosti, závisí však na řadě faktorů. U mladých a jinak zdravých jedinců můžeme ihned podat téměř plnou dávku. U pacientů s ICHS, srdečním selháním či jinak KV rizikových se doporučuje začít léčbu malou dávkou (12,5– 25 µg denně), která se zvyšuje postupně (o 50– 100 % po 4– 6 týdnech). Podobně postupujeme i u starších, jinak zdravých osob, i když důkazy pro tento postup chybějí a jsou práce, které ukázaly, že i ve vyšším věku je zahájení substituce plnou dávkou bezpečné [22]. Dávka LT4 se upravuje podle hodnoty TSH v séru – cílové hodnoty jsou rovny referenčnímu pásmu příslušné laboratorní metody (obvykle od 0,4– 0,5 IU/ l do 4,0– 5,0 IU/ l). Při léčbě pacienta se srdečním onemocněním se často raději spokojíme s hodnotami TSH v horní polovině referenčního rozmezí (2– 4 IU/ l) nebo i lehce nad ni, než abychom pacienta předávkovali. Subklinická hypertyreóza vzniklá předávkováním má totiž prokazatelně větší zdravotní rizika než neléčená subklinická hypotyreóza [1,3]. U pacientů se srdečním onemocněním vedou neodůvodněně vysoké dávky LT4 spojené s poklesem TSH pod dolní mez referenčního rozmezí (0,4–0,5 IU/ l) prokazatelně ke komplikacím (fibrilace síní, tachykardie, manifestace anginy pectoris, manifestace srdečního selhání, osteoporóza, depresivní syndrom) a jsou spojeny se zvýšenou morbiditou a mortalitou (obr. 3). Výjimkou je tzv. supresní léčba po odstranění štítné žlázy pro diferencovaný karcinom štítné žlázy (differentiated thyroid gland carcinoma – DTC). Jejím cílem je zabránit potlačením produkce TSH růstu případné zbytkové tyreoidální tkáně nebo metastáz. I ta však musí být u pacientů se srdečním onemocněním indikována s rozvahou a s přihlédnutím k poměru riziko/ benefit. U pacientů s DTC s nízkým rizikem se dnes supresní léčba nedoporučuje a spokojíme se s poklesem TSH do dolního pásma referenčních hodnot (0,5– 2,0 IU/ l). Pouze u pacientů s karcinomem štítné žlázy s vysokým rizikem je suprese agresivnější s cílovým TSH pod dolní hranici referenčních hodnot, vždy však v závislosti na toleranci pacienta. Po 5 letech se v závislosti na aktuální restratifikaci rizika suprese uvolňuje a přechází se na substituční dávku.
Manifestní hypotyreóza (elevace TSH, pokles FT4, příznaky hypotyreózy) by měla být léčena vždy a o příznivém efektu léčby nemůže být pochyb. O léčbě subklinické hypotyreózy u pacientů se srdečním onemocněním by mělo být rozhodnuto individuálně po posouzení všech benefitů a rizik (tab. 4). Jak bylo výše uvedeno, léčba sice redukovala některé rizikové faktory aterosklerózy, zlepšovala srdeční funkci a možná zlepšovala tělesnou zdatnost nemocných, studie však většinou nebyly randomizované, ani placebem kontrolované. Příznivý vliv léčby subklinické hypotyreózy na mortalitu ani morbiditu nemocných nebyl prokázán a v recentní randomizované studii u osob > 65 let léčba nevedla ani ke zlepšení symptomů. Naopak při předávkování levotyroxinem může být pacient léčbou i poškozen.
Tab. 4. Rámcová doporučení k léčbě hypotyreózy levotyroxinem u pacienta s onemocněním srdce. 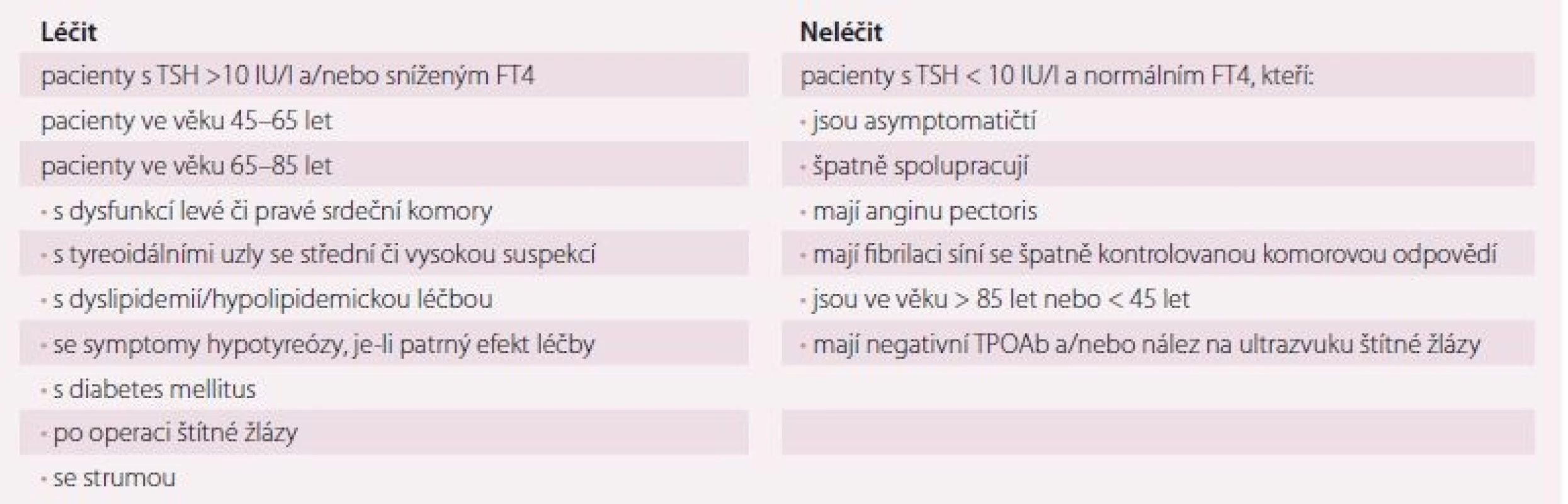
TSH – tyreoidální stimulační hormon, FT4 – volný tyroxin, TPOAb – protilátky proti tyreoidální peroxidáze LT4 by se měl užívat nalačno alespoň 30 min před požitím potravy a jiných léků, jinak se snižuje resorpce. Tu snižují nejvíce preparáty železa, léky snižující žaludeční aciditu (omeprazol, antacida) a iontoměniče (pryskyřice při hypolipidemické léčbě). Resorpce se také snižuje u pacientů s chronickým městnavým srdečním selháním. K monitoraci léčby periferní hypotyreózy LT4 s používá výhradně TSH. Vyšetřování FT4 nebo dokonce TPOAb za tímto účelem je zbytečné a imunoanalytické vyšetření FT4 je navíc u polymorbidních pacientů užívajících řadu léků značně nespolehlivé. Než dojde ke stabilizaci stavu a optimalizaci dávky, kontroluje se TSH po 4– 6 týdnech od poslední úpravy. Častější kontroly nemají velký význam, změna dávky se v hodnotě sérového TSH dříve neprojeví. U stabilizovaného pacienta stačí kontroly TSH a klinického stavu 1× ročně.
Amiodaronem indukovaná hypotyreóza
V jodsuficientních oblastech se udává prevalence manifestní amiodaronem indukované hypotyreózy (AIH) kolem 5 %, subklinické až 25 %. Příčinou je inhibice syntézy tyreoidálních hormonů nadbytkem jodu (Wolff-Chaikoffův efekt), často u pacientů s preexistující autoimunitní tyreoiditidou, kteří byli dosud eutyroidní. Terapeuticky se doporučuje podávat substituční léčbu levotyroxinem, jehož dávka může být vyšší než obvykle [23], a amiodaron nepřerušovat. Výjimkou je situace, kdy amiodaron není efektivní v léčbě arytmie a kdy jeho další podávání není odůvodněné. U amiodaronem indukované tyreotoxikózy častěji léčíme i subklinickou hypotyreózu, protože řada pacientů splňuje rámcová indikační kritéria (tab. 4). Dávky levotyroxinu se řídí podle hodnot TSH. Protože většina pacientů má rizikovou kardiologickou anamnézu a jsou často vyššího věku, jsou cílové hodnoty TSH vyšší než v běžné populaci a TSH může být i mírně zvýšený.
Závěr
Hypotyreóza je u pacientů se srdečním onemocněním častým nálezem. Potvrzená manifestní hypotyreóza je vždy důvodem k substituční léčbě levotyroxinem, u pacientů se srdečním onemocněním vždy začínáme léčbu malou dávkou a zvyšujeme postupně. Často se raději spokojíme s cílovými hodnotami TSH v horním pásmu referenčního rozmezí nebo i lehce nad něj, než abychom pacienta předávkovali. Benefit z léčby subklinické hypotyreózy by měl být u pacientů se srdečním onemocněním zvážen vždy individuálně v závislosti na věku, komorbiditách a dalších faktorech.
Zdroje
1. Franklyn JA. The thyroid-too much and too little across the ages. The consequences of subclinical thyroid dysfunction. Clin Endocrinol (Oxf) 2013; 78(1): 1– 8. doi: 10.1111/ cen.12011.
2. Mariotti S. Mild hypothyroidism and ischemic heart disease: Is age the answer? J Clin Endocrinol Metab 2008; 93(8): 2969– 2971. doi: 10.1210/ jc.2008-1237.
3. Ochs N, Auer R, Bauer DC et al. Meta-analysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med 2008; 148(11): 832– 845.
4. Singer RB. Mortality in a complete 4year follow up of 85yearold residents of leiden, classified by serum level of thyrotropin and thyroxine. J Insur Med 2006; 38(1): 14– 19.
5. Stott DJ, Rodondi N, Kearney PM et al. TRUST Study Group. Thyroid hormone therapy for older adults with subclinical hypothyroidism. N Engl J Med 2017; 376(26): 2534– 2544. doi: 10.1056/ NEJMoa1603825.
6. Iqbal A, Jorde R, Figenschau Y. Serum lipid levels in relation to serum thyroidstimulating hormone and the effect of thyroxine treatment on serum lipid levels in subjects with subclinical hypothyroidism: the tromso Study. J Intern Med 2006; 260(1): 53– 61. doi: 10.1111/ j.1365-2796.2006.01652.x.
7. Abreu IM, Lau E, de Sousa Pinto B et al. Subclinical hypothyroidism: to treat or not to treat, that is the question! A systematic review with meta-analysis on lipid profile. Endocr Connect 2017; 6(3): 188– 199. doi: 10.1530/ EC-17-0028.
8. Biondi B, Galderisi M, Pagano L et al. Endothelial-mediated coronary flow reserve in patients with mild thyroid hormone deficiency. Eur J Endocrinol 2009; 161(2): 323– 329. doi: 10.1530/ EJE-09-0196.
9. Razvi S, Ingoe L, Keeka G et al. The beneficial effect of lthyroxine on cardiovascular risk factors, endothelial function and quality of life in subclinical hypothyroidism: randomised, crossover trial. J Clin Endocrinol Metab 2007; 92(5): 1715– 1723. doi: 10.1210/ jc.2006-1869.
10. Shakoor SK, Aldibbiat A, Ingoe LE et al. Endothelial progenitor cells in subclinical hypothyroidism: the effect of thyroid hormone replacement therapy. J Clin Endocrinol Metab 2010; 95(1): 319– 322. doi: 10.1210/ jc.2009-1421.
11. Curotto Grasiosi J, Peressotti B, Machado RA et al. Improvement in functional capacity after levothyroxine treatment in patients with chronic heart failure and subclinical hypothyroidism. Endocrinol Nutr 2013; 60(8): 427– 432. doi: 10.1016/ j.endonu.2013.01.013.
12. Monzani F, Di Bello V, Caraccio N et al. Effect of levothyroxine on cardiac function and structure in subclinical hypothyroidism: a double blind, placebo-controlled study. J Clin Endocrinol Metab 2001; 86(3): 1110– 1115. doi: 10.1210/ jcem.86.3.7291.
13. Turhan S, Tulunay C, Ozduman Cin M et al. Effects of thyroxine therapy on right ventricular systolic and diastolic function in patients with subclinical hypothyroidism: a study by pulsed wave tissue Doppler imaging. J Clin Endocrinol Metab 2006; 91(9): 3490– 3493. doi: 10.1210/ jc.2006-0810.
14. Nyirenda MJ, Clark DN, Finlayson AR et al. Thyroid disease and increased cardiovascular risk. Thyroid 2005; 15(7): 718– 724. doi: 10.1089/ thy.2005.15.718.
15. Andersen MN, Olsen AM, Madsen JC et al. Levothyroxine substitution in patients with subclinical hypothyroidism and the risk of myocardial infarction and mortality. PLoS One 2015; 10(6):e0129793. doi: 10.1371/ journal.pone.0129793.
16. Andersen MN, Olsen AS, Madsen JC et al. Long-term outcome in levothyroxine treated patients with subclinical hypothyroidism and concomitant heart disease. J Clin Endocrinol Metab 2016; 101(11): 4170– 4177. doi: 10.1210/ jc.2016-2226.
17. Blum MR, Gencer B, Adam L et al. Impact of thyroid hormone therapy on atherosclerosis in the elderly with subclinical hypothyroidism: a randomized trial. J Clin Endocrinol Metab 2018. doi: 10.1210/ jc.2018-00279.
18. Hollowell JG, Staehling NW, Flanders WD et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002; 87(2): 489– 499. doi: 10.1210/ jcem.87.2.8182.
19. Garber JR, Cobin RH, Gharib H et al. American Association Of Clinical Endocrinologists and American Thyroid Association Taskforce On Hypothyroidism In Adults. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Thyroid 2012; 22(12): 1200– 1235. doi: 10.1089/ thy.2012.0205.
20. Boucai L, Hollowell JG, Surks MI. An approach for development of age-, gender-, and ethnicity-specific thyrotropin reference limits. Thyroid 2011; 21(1): 5– 11. doi: 10.1089/ thy.2010.0092.
21. Somwaru LL, Rariy CM, Arnold AM et al. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012; 97(6): 1962– 1969. doi: 10.1210/ jc.2011-3047.
22. Roos A, Linn-Rasker SP, van Domburg R et al. The starting dose of levothyroxine in primary hypothyroidism treatment: a prospective, randomized, bouble-blind trial. Arch Intern Med 2005; 165(15): 1714– 1720. doi: 10.1001/ archinte.165.15.1714.
23. Harjai KJ, Licata AA. Effects of amiodarone on thyroid function. Ann Intern Med 1997; 126(1): 63– 73.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2018 Číslo 3- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hypertyreóza a srdce
- Hypotyreóza a srdce
- Primární hyperaldosteronizmus a hypertenze
- Feochromocytom a srdce
- Kardiovaskulární riziko u pacientů s Cushingovým syndromem
- Dyslipidemie u vybraných endokrinopatií
- Evropská doporučení pro diagnostiku a management synkop z roku 2018 – komentovaná zkrácená verze
- Gestační diabetes a možnosti jeho léčby
- Role epikardiálního tuku v patofyziologii srdečních onemocnění
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav
- Evropský kardiologický kongres 2018
- Co také zaznělo na Kongresu o srdečním selhání 2018 ve Vídni
- ESC 2018 Řešení při vysokém KV riziku? Správná kombinace!
- ESC 2018 „Diamantová cesta“ – moderní přístup v léčbě anginy pectoris
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hypertyreóza a srdce
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav
- Hypotyreóza a srdce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání