-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Upstream terapie u fibrilace síní, co nového?
Upstream therapy, what's new?
Atrial fibrillation (AF) is the most common arrhythmia and is associated with high morbidity and mortality and poor quality of life. Remodelling of the atrial substrate begins long before the first episode of AF and continues to progress. AF can maintain and further deepen most of the mechanisms of remodelling and hypercoagulability, which makes it progressive in itself. Upstream therapy reduces the progression of remodelling or induces positive remodelling of the atrium, thus preventing AF or improving sinus rhythm maintenance. In patients without history of AF who have heart failure with reduced left ventricular function and/or have hypertension or possibly left ventricular hypertrophy are indicated for the primary prevention of AF by the use of renin-angiotensin-aldosterone system blockers (ACE-I or sartans). Treatment with RAAS antagonists is indicated for these diagnoses as well as for secondary prevention. Patients with recurrent AF in antiarrhythmic therapy undergoing electrical cardioversion may be pre-treated with ACE-I or sartans. In patients without structural heart disease, this ACE-I or sartan treatment is not indicated in primary or secondary prevention. Based on the results of the RACE 3 study, upstream therapy in secondary prevention in patients undergoing cardioversion, maximum tolerated doses of RAAS blockers, statins, weight reduction diet, rehabilitation and psychological education for patient collaboration are recommended. Accentuated upstream therapy leads to a sustained sinus rhythm after 1 year of follow-up in 75% of patients as compared to 63% achieved with conventional therapy.
Key words:
atrial remodelling – atrial fibrillation – rhythm control – upstream therapy – renin-angiotensin-aldosterone system blockers – angiotension-converting enzyme inhibitors – angiotensin receptor blockers – primary and secondary prevention
Autoři: R. Lábrová
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno
Vyšlo v časopise: Kardiol Rev Int Med 2017, 19(4): 231-236
Souhrn
Fibrilace síní (FS) je nejčastější arytmií a má horší morbiditu, mortalitu i kvalitu života. Remodelace síňového substrátu začíná již dlouho před první epizodou FS a stále progreduje. FS může většinu mechanizmů remodelace i hyperkoagulačního stavu udržovat a dále ještě prohlubovat, takže sama o sobě má progresivní charakter. Upstream terapie redukuje progresi remodelace nebo navodí pozitivní remodelaci síně, a tím může zabránit vzniku FS nebo zlepšit udržení sinusového rytmu. U pacientů bez dokumentované FS, kteří mají přítomné srdeční selhání a dysfunkci levé komory a/nebo mají hypertenzi, event. s přítomností hypertrofie levé komory, je indikováno v rámci primární prevence vzniku FS podávání blokátorů renin-angiotensin-aldosteronového systému (RAAS) – inhibitorů angiotenzin konvertujícího enzymu (ACEI) nebo sartanů. Léčba blokátory RAAS je indikována u těchto diagnóz i v rámci sekundární prevence. U pacientů s rekurentní FS na antiarytmické terapii podstupujících elektrickou kardioverzi lze zvážit předléčbu ACEI nebo sartany. U pacientů bez strukturálního onemocnění srdce není tato léčba ACEI ani sartany indikována v primární ani v sekundární prevenci. Dle výsledků studie RACE 3 se u pacientů podstupujících elektrickou kardioverzi doporučuje v rámci upstream terapie v sekundární prevenci maximálně tolerované dávky blokátorů RAAS, statinů, dietní opatření s redukcí hmotnosti, rehabilitace, psychologická edukace ke spolupráci pacienta. U této akcentované upstream terapie ve srovnání s konvenční terapií udrželo sinusový rytmus po 1 roce sledování 75 vs. 63 % pacientů.
Klíčová slova:
síňová remodelace – fibrilace síní – kontrola rytmu – upstream terapie – blokátory renin-angiotenzin-aldosteronového systému – inhibitory angitoenzin konvertujícího enzymu – blokátory receptoru 1 pro angiotenzin II – primární a sekundární prevenceÚvod
Fibrilace síní (FS) je nejčastější setrvalou srdeční arytmií a postihuje více než 6 milionů lidí v Evropě. Její incidence a prevalence stále narůstá. Prevalence se odhaduje na 3 % u osob nad 20 let. U osob starších 70 let je prevalence FS kolem 10 – 15 % [1]. U většiny starších pacientů je FS částečně způsobena komorbiditami, jako je hypertenze, srdeční selhání (SS), ischemická choroba srdeční (ICHS), diabetes mellitus (DM), obezita, metabolický syndrom, zánět či obstrukční spánková apnoe. Nárůst prevalence FS se nedá vysvětlit pouze stárnutím populace, ale i lepší detekcí asymptomatické FS a dalšími stavy a onemocněními, které ke vzniku FS predisponují. Až 70 % paroxysmů FS může být u jednotlivce asymptomatických.
Pacienti s FS mají různou symptomatologii, trpí palpitacemi, dušností, únavou, nevýkonností a zhoršenou tolerancí zátěže. Mají horší kvalitu života a zvyšuje se i morbidita a mortalita [2,3]. U žen s FS je 2násobné riziko celkové mortality a u mužů 1,5násobné ve srovnání s populací se sinusovým rytmem [4]. Nejčastější příčinou úmrtí jsou cévní mozkové příhody (CMP), SS a náhlé úmrtí. V důsledku FS vzniká 20 – 30 % CMP [5]. U pacientů s FS je častější kognitivní postižení a vaskulární demence, a to i u pacientů antikoagulovaných. U 20–30 % pacientů s FS je přítomna dysfunkce levé komory (LK). FS zhoršuje SS u již přítomného organického postižení srdce, u pacientů s funkční skupinou NYHA IV dosahuje FS prevalence až 50 %. U mnoha pacientů sama FS může být příčinou dysfunkce LK a SS z důvodu elektrické, strukturální a následně mechanické remodelace myokardu [6]. Úspěšná léčba FS a obnovení sinusového rytmu může vést ke zlepšení nebo až normalizaci funkce LK. Léčba FS je farmakologická a v indikovaných případech kauzální nefarmakologická invazivní terapie – katetrizační ablace, resp. chirurgická ablace. Farmakologická terapie zahrnuje antiarytmickou terapii ke kontrole rytmu nebo frekvence, u rizikových pacientů zavedení antikoagulační terapie a dále zavedení tzv. upstream léčby.
Patofyziologie vzniku FS
- Genetická predispozice se projeví především u pacientů mladší věkové skupiny, u které nejsou přítomné kardiovaskulární (KV) choroby. Až u třetiny pacientů s FS jsou vykazovány běžné genetické varianty, které predisponují ke vzniku FS [7,8].
- Mechanizmy vedoucí ke vzniku FS:
- remodelace struktury síňového myokardu a funkce iontových kanálů,
- elektrofyziologické mechanizmy FS,
- hyperkoagulační stav.
Remodelace struktury síňového myokardu a funkce iontových kanálů
Různé etiologické faktory, nejčastěji hypertenze, SS, DM, obezita, ICHS, stárnutí, včetně genetické predispozice, ale i FS samotná, vyvolávají celý komplex patofyziologických změn v síních, které dávají vznik postupné progresi strukturální remodelace síní. Podkladem těchto změn je především aktivace fibroblastů, zmnožení pojivové tkáně a napětím indukovaná fibróza, kdy největším aktivátorem fibrózy je angiotenzin II. Dále vzniká tuková infiltrace, leukocytární infiltrace, apoptóza, zánět, cévní remodelace a ischemie, což způsobuje mechanickou remodelaci – sníženou kontraktilitu síní [9 – 11].
Elektrofyziologické mechanizmy FS
Různorodost akčních potenciálů souvisí převážně s vápníkovými a draslíkovými iontovými kanály [12,13]. Dochází k nestabilitě transportu Ca2+, a tím vzniku ektopií, fokusů, převážně v síňovém myokardu v ústí plicních žil, což vede ke vzniku FS. Během FS se redukují L typy kalciových proudů. Dále vzniká dysfunkce a remodelace iontových kanálů s nerovnoměrným převodem vzruchu mezi svalovými snopci a s přítomnou lokální heterogenitou vedení, což je podkladem reentry mechanizmu, který slouží k udržení FS. Strukturální remodelace a elektrická disociace vytváří podmínky nejen pro vznik, ale i udržení FS [14].
Sympatikus – adrenergní stimulace zvyšuje vstup kalcia do buněk, tím zvyšuje kontraktilitu a potencuje ektopickou aktivitu. Parasympatikus aktivuje draslíkové kanály, které jsou napojené na muskarinové receptory aktivující reentry okruhy. Také angiotenzin II nepřímo ovlivňuje iontové kanály. Stimulace AT1 receptorů aktivuje fosfolipázu C, která vede k inozitol trifosfátem indukovanému uvolnění vápníku ze sarkoplazmatického retikula. Zvýšená hladina vápníku a redukce draslíku potom ovlivňují změnu síňové refrakterity [15].
Hyperkoagulační stav
Některé změny během remodelace síňového myokardu navozují u pacientů s FS hyperkoagulační stav. Snížená kontraktilita síňového myokardu navodí pokles napětí v endotelu, což způsobí nárůst exprese inhibitoru aktivátoru plasminogenu 1. Ischemií navozený zánět způsobuje uvolnění endoteliálních adhezních molekul cévních buněk nebo uvolňování endoteliálních buněk, čímž dochází k působení tkáňového faktoru v krevním řečišti. Snižuje se fibrinolýza, aktivují se trombocyty, narůstá faktor IIa. To vše u FS navodí v síních trombogenní prostředí.
FS může většinu mechanizmů remodelace i hyperkoagulačního stavu udržovat a dále ještě prohlubovat, takže sama o sobě má progresivní charakter [16,17].
Začátek a průběh remodelace síňového substrátu začíná dlouho před první epizodou FS (obr. 1).
Obr. 1. Časový průběh remodelace síňového substrátu, který začíná dlouho před první epizodou fibrilace síní. Upraveno dle [31]. Hypotetické znázornění vlivu základního onemocnění, jako je hypertenze nebo srdeční selhání, na indukci remodelace síní ještě dlouho před nástupem FS a jak postupně progreduje remodelace síní ve vztahu ke klinické FS. Světlá šedá šipka označuje časné podání upstream terapie, která redukuje progresi remodelace nebo navodí pozitivní remodelaci síně (tečkovaná čára), a tím může zlepšit udržení sinusového rytmu. ACEI – inhibitory angiotenzin konvertujícího enzymu, ARB – sartany, blokátory receptorů 1 angiotenzinu II, MRA – antagonisté receptoru mineralokortikoidů, ECV – elektrická kardioverze, AF – fibrilace síní, SR – sinusový rytmus ![Časový průběh remodelace síňového substrátu, který začíná dlouho před první epizodou fibrilace síní. Upraveno dle [31].
Hypotetické znázornění vlivu základního onemocnění, jako je hypertenze nebo srdeční selhání, na indukci remodelace síní ještě dlouho před nástupem FS a jak postupně progreduje remodelace síní ve vztahu ke klinické FS. Světlá šedá šipka označuje časné podání upstream terapie, která redukuje progresi remodelace nebo navodí pozitivní remodelaci síně (tečkovaná čára), a tím může zlepšit udržení sinusového rytmu.
ACEI – inhibitory angiotenzin konvertujícího enzymu, ARB – sartany, blokátory receptorů 1 angiotenzinu II, MRA – antagonisté receptoru mineralokortikoidů, ECV – elektrická kardioverze, AF – fibrilace síní, SR – sinusový rytmus](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/aa6442dab1442083454ba7771184f2a3.png)
Upstream terapie FS
Upstream terapie (léčba „proti proudu“) se podle nových doporučení z roku 2016 nazývá také neantiarytmická terapie FS a vede k prevenci a také k léčbě remodelace síní, která vede ke vzniku a udržení FS. Upstream terapie časně zasahuje do patogeneze FS, protože ovlivňuje mechanizmy remodelace síňového myokardu. Pokud FS přetrvává, tak se remodelační proces udržuje a ještě prohlubuje. Paroxys-mální forma FS se mění v chroničtější formu, v perzistentní či permanentní FS. Pokud dojde k nastolení sinusového rytmu, navodí se pozitivní reverzní remodelační proces [18].
U pacientů s přítomnou hypertenzí, po IM se SS, kde je velké riziko vzniku FS, by se měla zahájit preventivní opatření velmi časně (primární prevence), abychom zabránili vzniku remodelace myokardu, a tím vzniku nové FS. Pokud byla u těchto rizikových skupin FS již přítomna, tak je snaha zabránit rekurenci či progresi FS do chroničtější formy. Stupeň remodelace síňového myokardu je potom důležitý pro udržení sinusového rytmu a účinnosti léčby FS, a to antiarytmické, katetrové ablace i udržení sinusového rytmu po elektrické kardioverzi. Čím je více vyjádřena remodelace síní, tím je nižší pravděpodobnost obnovení a udržení sinusového rytmu, vznikají častější a delší ataky FS. Upstream terapie má zabránit nejen progresi strukturální remodelace, ale má navodit pozitivní reverzní remodelaci. Reverzibilní změny však nemusí být úplné.
Studie se síňovými defibrilátory, které se nakonec v klinické praxi v léčbě FS neuplatnily pro nepříjemné a bolestivé vnímání výboje, ukázaly, že časná léčba FS výbojem ze síňového defibrilátoru vedla ke snížené četnosti atak FS.
Statiny, kortikoidy, rybí olej, omega-3 vícenenasycené mastné kyseliny
V menších studiích byly v rámci upstream terapie FS zkoušeny statiny, dále byly podávány kortikoidy, rybí olej, omega-3 vícenenasycené mastné kyseliny (PUFA), ale jejich efekt nebyl na větším počtu pacientů prokázán, proto nejsou ani v nových doporučeních pro léčbu FS z roku 2016 v upstream terapii doporučeny k zavedení do klinické praxe.
Blokátory renin-angiotenzin-aldosteronového systému
V upstream terapii FS se nejvíc uplatňuje podání blokátorů renin-angiotenzin-aldosteronového systému (RAAS), především inhibitorů angiotenzin konvertujícího enzymu (ACEI) a blokátorů angiotenzinových receptorů 1 pro angiotenzin II (ARB).
U pacientů s KV onemocněním, a zvláště pokud je přítomna dysfunkce LK, se aktivuje RAAS, který reguluje rovnováhu vodního prostředí, minerálů a ovlivňuje cévní reakci na poškození a zánět. V řadě mezinárodních multicentrických studiích u pacientů se SS, s dysfunkcí LK, po srdečním infarktu, po CMP a s přítomnou arteriální hypertenzí ACEI a sartany snižují KV morbiditu, mortalitu a brání vzniku nové FS [19].
Mechanizmus, kterým blokáda RAAS zabrání FS, zahrnuje snížení síňového napětí, snížení end-diastolického tlaku LK a následně tlaku levé síně (LS), a tím předchází vzniku síňové fibrotizace. Na antiarytmických účincích se podílí modifikace sympatického tonu, ovlivnění iontových kanálů a proudů a změna refrakterity síní. Inhibitory ACE snižují periferní cévní rezistenci, mají mírný venodilatační účinek a způsobují pokles tlaku, ale nezvyšují baroreceptory zprostředkované zrychlení tepové frekvence.
Obě lékové skupiny ovlivňují negativní působení angiotenzinu II, který je největším stimulátorem fibrózy myokardu. Fibrotizace je nevýznamnějším rizikovým faktorem strukturální remodelace, která se podílí na vzniku a udržování FS. Angiotenzin II dále způsobuje hypertrofii myokardu, poruchu mezibuněčného spojení a ovlivňuje funkci iontových kanálů. Angiotenzin II aktivuje různé zánětlivé mediátory, např. C reaktivní protein, tumor nekrosis faktor alfa, interleukin 6, nukleární faktor kappa B, nukleární faktor alfa, a tím dochází k progresi zánětlivých změn a také se stimuluje infiltrace neutrofily [20].
Retrospektivně byla zpracována data multicentrických randomizovaných studií, kdy se podávaly blokátory RAAS z důvodu jiných KV onemocnění a sledoval se jejich vliv na prevenci nově vzniklé FS či rekurenci FS. V roce 2005 byla publikována data metaanalýzy 11 randomizovaných klinických studií s 56 308 pacienty, kde se sledoval účinek blokády RAAS na FS. Čtyři studie byly u pacientů s přítomným SS, 3 u hypertoniků, 2 u pacientů po elektrické kardioverzi a 2 u pacientů po prodělaném infarktu myokardu (IM) [21]. ACEI a ARB redukovaly celkové relativní riziko vzniku FS o 28 %. Nebyl zjištěn statisticky významný rozdíl v účinku obou skupin, inhibitorů ACEI (28 %) a ARB (29 %).
V roce 2008 Jibrini et al provedli metaanalýzu 11 randomizovaných klinických studií hodnotících účinek ACEI nebo ARB na vývoj FS. Zjistili, že pacienti s hypertenzí měli prospěch z léčby ACEI nebo ARB, došlo ke snížení relativního rizika (RR) vzniku FS o 23 %, u pacientů po IM o 11 %. Největší snížení RR vzniku FS bylo u pacientů po elektrické kardioverzi o 51 % a u pacientů se SS o 32 %. Celkově snížila inhibice RAAS RR vzniku FS o 19 % [22].
Tab. 1. Upstream léčba v primární prevenci FS. Upraveno dle [10]. ![Upstream léčba v primární prevenci FS. Upraveno dle [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d054b8e865149e84509e89051c0f35b2.png)
ACEI – inhibitory angiotenzin-konvertujícího enzymu, ARB – blokátory receptorů 1 pro angiotenzin II, FS – fibrilace síní, LK – levá komora Tab. 2. Upstream léčba v sekundární prevenci FS. Upraveno dle [10]. ![Upstream léčba v sekundární prevenci FS. Upraveno dle [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/aaa3a64b7550514b7e9db73a8a6f1d13.png)
ACEI – inhibitory angiotenzin-konvertujícího enzymu, ARB – blokátory receptorů 1 pro angiotenzin II, FS – fibrilace síní V roce 2011 byla publikována metaanalýza klinických studiích, které probíhaly od roku 1950 do května 2009, čerpáno bylo z databáze Medline, Embase a Cochrane Library. Byly zahrnuty randomizované, kontrolované klinické studie s podáváním ACEI nebo ARB ve vztahu k hlášení FS. Bylo zjištěno 21 studií zahrnujících 91 381 pacientů a 5 730 případů FS. Celkově ACEI nebo ARB snížily RR vzniku FS o 25 %. U primární a sekundární prevence snížily ACEI nebo ARB RR výskytu FS o 24, resp. 27 %. U pacientů s hypertenzí se snížilo RR vzniku FS o 29 %, u pacientů s chronickým SS o 42 %. Výsledky metaanalýzy ukazují, že ACEI nebo ARB jsou účinné pro primární prevenci a sekundární prevenci vzniku FS. Snižují výskyt FS zejména u pacientů s hypertenzí a u pacientů s chronickým SS [23].
Další metaanalýza publikovaná v roce 2013 měla zhodnotit, zda podání ACEI nebo ARB může zabránit recidivám FS. Bylo zjištěno 21 randomizovaných kontrolovaných studií zahrnujících 13 184 pacientů s FS. Celkově byl výskyt FS výrazně snížen u pacientů užívajících ACEI nebo ARB (poměr pravděpodobnosti OR 0,43; 95% CI 0,32–0,56; p < 0,001), a to jak u irbesartanové podskupiny (OR 0,38, 95% CI 0,21–0,68, p = 0,001), tak u pacientů užívajících antiarytmickou terapii (OR 0,37, 95% CI 0,29 – 0,48; < 0,001) a neexistoval významný rozdíl mezi ACEI a ARB. Metaanalýza ukázala, že podání ACEI nebo ARB je účinné při sekundární prevenci FS, zejména u pacientů, kteří mají arteriální hypertenzi a užívají antiarytmickou terapii [24].
V roce 2012 italští autoři publikovali výsledky srovnání efektu podání ARB (telmisartanu) vs. blokátor kalciového kanálu (amlodipinu) na rekurenci paroxysmální FS u hypertoniků s normální nebo zvětšenou velikostí LS (příčný rozměr LS – LAX).
Autoři zařadili 378 ambulantních pacientů s mírnou hypertenzí se sinusový rytmem, ale s ≥ 2 epizodami FS v předchozích 6 měsících. Byli rozdělení do dvou skupin. Skupina 1 zahrnovala ženy s LS (LS LAX) < 40 mm a muže s LS < 45 mm. Skupina 2 zahrnovala ženy s LS > 40 mm a < 45 mm, muže s LS > 45 mm a < 50 mm. V obou skupinách byli pacienti náhodně léčeni telmisartanem nebo amlodipinem po dobu 1 roku.
Výsledky: Systolický a diastolický krevní tlak byl podobně snížen telmisartanem a amlodipinem v obou skupinách. Míra recidivy FS byla významně nižší u pacientů léčených telmisartanem než u pacientů léčených amlodipinem, a to ve skupině 1 (12 vs. 39; p < 0,01) a ve skupině 2 (40 vs. 59; p < 0,05). U telmisartanu byla míra recidivy FS významně nižší ve skupině 1 než ve skupině 2 (12,9 vs. 42,1 %; p < 0,05). Doba do prvního relapsu FS byla signifikantně delší u telmisartanu než u amlodipinu v obou skupinách (u skupiny 1 (176 ± 94 dní vs. 74 ± 61 dní; p < 0,05) a skupiny 2 (119 ± 65 dní vs. 38 ± 35 dní; p < 0,05)).
Závěr: U pacientů s atriální hypertenzí byl telmisartan účinnější než amlodipin v prevenci recidiv paroxysmální FS [25].
Italští autoři prezentovali v roce 2012 výsledky malé multicentrické randomizované studie, ve které se u pacientů s hypertenzí podával telmisartan vs. karvedilol v rámci prevence recidivy FS. Byli zařazeni ambulantní pacienti s mírnou hypertenzí (systolický/ diastolický krevní tlak 140–159/90–99 mm Hg) se sinusovým rytmem, kteří zaznamenali na elektrokardiogramu v předchozích 6 měsících ≥ 1 epizodu FS. Dostávali náhodně telmisartan 80 mg/ den nebo karvedilol 25 mg/den. Krevní tlak a 24hodinové EKG byly sledovány měsíčně po dobu 1 roku; pacienti byli požádáni, aby hlásili symptomatické epizody FS a podstoupili EKG co nejdříve.
Výsledky: Studii dokončilo celkem 132 pacientů (telmisartan n = 70; karvedilol n = 62). U telmisartanu ve srovnání s karvedilolem bylo zaznamenáno signifikantně méně epizod FS (14,3 vs. 37,1 %; p < 0,003). Průměr LS hodnocený echokardiografií byl podobný s telmisartanem a karvedilolem (3,4 ± 2,3 cm vs. 3,6 ± 2,4 cm). Na konci studie oba režimy výrazně snížily průměrný hmotnostní index LK, ale snížení dosažené s telmisartanem bylo významně vyšší než u karvedilolu (117,8 ± 10,7 vs. 124,7 ± 14,5; p < 0,0001). Průměrné hodnoty krevního tlaku nebyly mezi skupinami významně odlišné (telmisartan 154/ 97–123/75 mm Hg; p < 0,001; karvedilol 153/94–125/78 mm Hg; p < 0,001).
Závěr: Telmisartan byl významně účinnější než karvedilol při prevenci recidivujících epizod FS u pacientů s hypertenzí i přes podobné snížení krevního tlaku [26].
V roce 2015 byla publikována meteanalýza randomizovaných studií, jejímž cílem bylo zkoumat účinnost a bezpečnost ACEI nebo ARB na prevenci FS u pacientů s hypertenzí. Do metaanalýzy bylo zahrnuto 10 vysoce kvalitních studií ukončených před prosincem 2013, s celkem 42 892 pacienty (20 491 pacientů ve skupině s ACEI/ARB a 22 401 pacientů ve skupině s betablokátory nebo s blokátory kalciového kanálu).
Výsledky ukázaly, že ACEI/ARB snížily výskyt recidivy FS v porovnání s blokátory kalciového kanálu (RR 0,48, 95% CI 0,40–0,58; p < 0,00001) nebo betablokátory (RR 0,39; 0,20 – 0,74; p = 0,005) v dlouhodobém sledování. ACEI/ARB dále snížily výskyt kongestivního SS (RR 0,86; 95% CI 0,77–0,96; p = 0,007). Nebyly pozorovány žádné významné účinky na výskyt nové FS, srdeční úmrtí, IM a mrtvice. Výsledky naznačují, že ACEI/ARB mohou snížit výskyt recidivy FS a městnavého SS s méně závažnými nežádoucími účinky [27].
V roce 2008 byla publikována studie VALUE. Němečtí autoři uvádí, že FS je nejčastější arytmie a zvyšuje KV riziko u pacientů s hypertenzí. Proto autoři hodnotili dlouhodobé užívání antihypertenziv, kdy srovnávali účinek valsartanu a amlodipinu na nový vznik FS. Do studie bylo zařazeno celkem 15 245 pacientů s arteriální hypertenzí a s přítomným vysokým KV rizikem. Pacienti dostali valsartan v dávce 80 – 160 mg/den nebo amlodipin 5 – 10 mg/ den v kombinaci s dalšími antihypertenzivy. Elektrokardiogramy byly získány každý rok a analyzovány centrálně pro důkazy hypertrofie LK a pro záznam nového nástupu FS.
Výsledky: Na počátku léčby byla diagnostikována FS u 2,6 % z 7 649 pacientů užívajících valsartan a 2,6 % z 7 596 medikujících amlodipin. Během antihypertenzní léčby byla incidence nejméně jednoho potvrzeného nového výskytu FS u 3,67 % ve skupině valsartanu a 4,34 % u amlodipinu (neupravený poměr rizika 0,843; 95% CI 0,713–0,997; p = 0,0455). Výskyt perzistující FS byl 1,35 % u valsartanu a 1,97 % u amlodipinu (neupravený poměr rizika 0,683; 95% CI 0,525 – 0,889; p = 0,0046).
Závěr: Léčba valsartanem snížila nový záchyt FS, zejména perzistentní formy FS ve srovnání s léčbou amlodipinem. Tato zjištění naznačují, že sartany mohou lépe zabránit nově diagnostikované FS než blokátory kalciového kanálu u pacientů s hypertenzí [28].
V roce 2015 byl publikován protokol k nové multicentrické randomizované open-label studii VF-HT-AF (Upstream therapeutic strategies of valsartan and fluvastatin on hypertensive patients with non-permanent atrial fibrillation). Studie se zabývá podáním valsartanu a fluvastatinu v rámci upstream terapeutické strategie u pacientů s hypertenzí a nepermanentní FS. Upstream terapie se jeví jako potenciální strategie v prevenci a léčbě FS. Bylo navrženo užívání blokátorů receptorů angiotenzinu II a statinů, které snižují nově vzniklé ataky FS. Tato studie byla navržena tak, aby zkoumala, zda valsartan nebo fluvastatin mohou snížit riziko nepermanentní FS u pacientů s hypertenzí. Studie VF-HT-AF je multicentrická, randomizovaná, otevřená, se čtyřmi paralelními skupinami a analýzou podání valsartanu a fluvastatinu jako upstream terapie pacientů s hypertenzí a přítomnou nepermanentní FS. Primárním výsledkem je změna ve vývoji paroxysmální FS na perzistentní nebo permanentní FS, vývoj perzistentní FS v permanentní FS, což bude hodnoceno 7denním ambulantním EKG Holterovým monitorováním a kontrolou deníků pacientů během 2letého sledování. K sekundárním cílům patří výskyt fatálního nebo nefatálního IM, SS, kardiogenní šok, závažné krvácení vyžadující hospitalizaci, maligní ventrikulární arytmie, revaskularizační terapie, radiofrekvenční ablace FS, změny rozměru LS měřené echokardiografií, KV úmrtnost a celková úmrtnost. Celkem bude zařazeno 1 879 pacientů v 15 lékařských centrech v celé Číně, aby se získaly příslušné informace [29].
Na posledním evropském kardiologickém kongresu v Barceloně v srpnu 2017 byly prezentovány výsledky nizozemské studie RACE 3 (Rutinní vs. agresivní upstream terapie ke kontrole rytmu a prevenci časné FS u pacientů se SS). Výsledky zatím nebyly publikovány. Studie RACE 3 vychází z hypotézy, že u pacientů s časným vznikem FS a přítomným mírně až středně zvýšeným systolickým nebo diastolickým SS, kteří podstupují elektrickou kardioverzi, zvyšuje agresivní kontrola rytmu v rámci upstream terapie možnost udržení sinusového rytmu ve srovnání s konvenční léčbou.
RACE 3 je prospektivní, randomizovaná, otevřená, mezinárodní multicentrická studie. Byli zařazeni stabilní pacienti s časnou symptomatickou perzistující FS a mírným až středně závažným SS, kteří mají podstoupit elektrickou kardioverzi. Celkem bylo zařazeno 119 pacientů do upstream terapie a 126 do konvenční terapie. Časná symptomatická perzistující FS je definována jako celková anamnéza FS < 5 let před randomizací a celková doba trvání FS > 7 dní, ale < 6 měsíců (je povolena více než jedna epizoda), přičemž je nejvýše jedna předchozí elektrická kardioverze během posledních 2 let; není povolena ani elektrická ani farmakologická kardioverze ≥ 2 roky. Méně až středně závažné SS je definováno jako výskyt SS < 1 rok, a to diastolického SS ejekční frakce (EF) LK ≥ 45 %, funkční třída II–III New York heart association (NYHA) a další kritéria zahrnující echo parametry a/nebo zvýšený natriuretický peptid (NTproBNP) nebo systolické SS s EF LK 25 – 45 % a NYHA I – III. K nejdůležitějším vylučovacím kritériím patří závažné SS, tj. NYHA IV nebo EF LK < 25 %, velikost LS v příčném rozměru > 50 mm, závažné onemocnění chlopní a současné užívání antagonistů mineralokortikoidních receptorů (MRA).
Upstream terapie se skládá z podání inhibitorů angiotenzin konvertujícího enzymu a/ nebo blokátorů receptorů angiotenzinu, antagonistů receptorů mineralokortikoidů, statinů, rehabilitačního programu, intenzivního poradenství v oblasti dietních omezení, udržování adherence ke cvičení, dietním a režimovým opatřením a pravidelnému užívání léků. Konvenční terapie se skládá z rutinní terapie ke kontrole rytmu, bez rehabilitační terapie a intenzivního poradenství. V obou skupinách bylo vynaloženo veškeré úsilí na udržení pacientů ve strategii kontroly rytmu. Léčba byla zahájena nejméně 3 týdny před elektrickou kardioverzí a pokračovala po dobu 12 měsíců. Byla snaha o optimální titraci všech léků. Pokud se objevily relapsy FS, mohla být znovu provedena elektrická kardioverze, zavedena antiarytmická terapie nebo ablace plicních žil. Primárním cílem byla přítomnost sinusového rytmu po jednom roce sledování, ten byl hodnocen sedmidenním EKG Holterovým monitorováním v posledním týdnu studie.
Studie RACE 3 ukazuje, že intenzivní upstream terapie zaměřená na snížení rizikových faktorů, včetně léčby KV onemocnění a změny životního stylu, příznivě působí na remodelaci síní. U této akcentované upstream terapie ve srovnání s konvenční terapií udrželo sinusový rytmus po 1 roce sledování 89 ze 119 (75 %) pacientů vs. 79 ze 126 (63 %) pacientů (p = 0,021) (obr. 2). Tato intenzivní upstream terapie je účinná a zlepšuje udržení sinusového rytmu u pacientů s časným záchytem FS a SS.
Obr. 2. Studie RACE 3, primární endpoint po 1 roce sledování. Zdroj: ESC 2017, Barcelona. Intenzivní upstream terapie vs. rutinní léčba ke kontrole rytmu u pacientů se srdečním selháním a přítomnou časnou fibrilací síní, podstupujících elektrickou kardioverzi. Při akcentované upstream terapii ve srovnání s konvenční terapií udrželo sinusový rytmus po 1 roce sledování 89 ze 119 (75 %) pacientů vs. 79 ze 126 (63 %) pacientů (p = 0,021). Hypotéza pro superioritu byla prokázána. 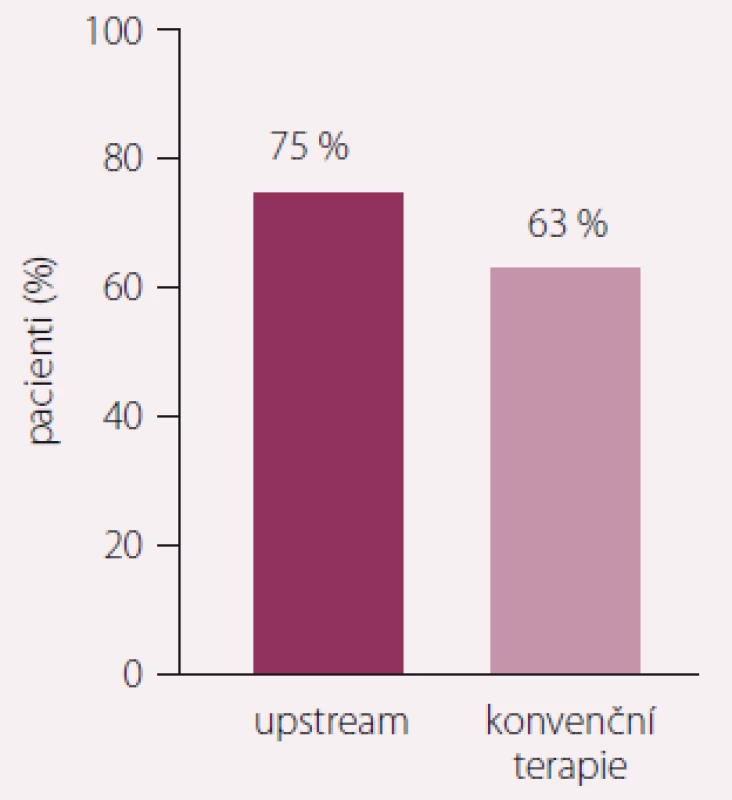
OR 1,765 95% CI – dolní hranice 1,115 Závěr
Zvyšující se znalosti o složitých strukturálních remodelačních procesech, které vznikají ještě před vznikem FS a následně progredují již během přítomné FS, alespoň částečně objasňují selhání současných terapeutických strategií při kontrole rytmu u pacientů s FS. Upstream terapie, která zabraňuje nebo zeslabuje proces remodelace myokardu nebo navozuje pozitivní remodelaci myokardu, může být účinná nebo přinejmenším může podporovat konvenční terapii kontroly rytmu, zvláště u pacientů, u nichž je strukturální remodelace méně pokročilá.
U pacientů bez dokumentované FS, kteří mají přítomné SS a dysfunkci LK a/nebo mají hypertenzi, event. s přítomností hypertrofie LK, je indikováno v rámci primární prevence vzniku FS podávání blokátorů RAAS – ACEI nebo sartanů. Léčba blokátory RAAS je indikována u těchto diagnóz i v rámci sekundární prevence. U pacientů s rekurentní FS na antiarytmické terapii podstupujících elektrickou kardioverzi lze zvážit předléčbu ACEI nebo sartany.
U pacientů bez strukturálního onemocnění srdce není tato léčba ACEI ani sartany indikována v primární ani v sekundární prevenci.
Studie RACE 3 ukazuje, že intenzivní upstream terapie, zaměřená na rizikové faktory, včetně změny životního stylu, je účinná v udržení sinusového rytmu u pacientů s časnou perzistentní FS a SS. Intenzivní upstream terapie ke kontrole rytmu zahrnovala podání maximálně tolerovaných dávek ACEI a/ nebo ARB, MRA, statinů, KV rehabilitaci, poradenství a dietní omezení. Studie se prováděla u pacientů s časnou perzistentní FS, u nichž se očekává, že strukturální remodelace je méně významná, a proto může být prospěšná upstream terapie ke kontrole rytmu.
Účinek intenzivní upstream terapie ve srovnání s konvenční terapií FS na snížení rizikových faktorů a KV onemocnění, vzhledem k pozitivnímu působení na remodelaci síní, byl příznivý. Studie RACE 3 ukázala, že intenzivní upstream terapie ke kontrole rytmu zvyšuje perzistenci sinusového rytmu ve srovnání s konvenční terapií. Výsledky studie RACE 3 mohou přispět k většímu zaměření na úpravu rizikových faktorů, a tak zlepšit výsledky terapie FS podporující farmakologickou a nefarmakologickou terapii.
Intenzivní upstream terapie u časné perzistentní FS se SS je účinnější než konvenční terapie ke kontrole rytmu a mohla by se stát novým terapeutickým přístupem k léčbě FS.
Doručeno do redakce: 27. 11. 2017
Přijato po recenzi: 5. 12. 2017
doc. MUDr. Růžena Lábrová, Ph.D.
www.fnbrno.cz
labrova@seznam.cz
Zdroje
1. Benjamin EJ, Levy D. Independent risk factors for atrial fibrillation in a population-based kohort. The Framingham Heart Study. JAMA 1994; 27(11): 840 – 844.
2. Lábrová R. Epidemilogie fibrilace síní. Kardiofórum 2007; 5(1): 6 – 10.
3. McGovern PG, Jacobs DR Jr, Shahar E et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota Heart Survey. Circulation 2001; 104(1): 19 – 24.
4. Andersson T, Magnuson A, Bryngelsson IL et al. All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term case-control study. Eur Heart J 2013; 34(14): 1061 – 1067. doi: 10.1093/ eurheartj/ ehs469.
5. Bonita R, Solomon N, Broad JB. Prevalence of stroke and stroke-relevant disability. Stroke 1997; 28(10): 1898 – 1902.
6. Lábrová R, Špinar J. Srdeční selhání a fibrilace síní. Cor Vasa 2008; 50(10): 358 – 392.
7. Olesen MS, Nielsen MW, Haunso S et al. Atrial fibrillation: the role ofcommon and rare genetic variants. Eur J Hum Genet 2014; 22(3): 297 – 306. doi: 10.1038/ ejhg.2013.139.
8. Tada H, Shiffman D, Smith JG et al. Twelve-single nucleotide polymorphism genetic risk score identifies individuals at increased riskfor future atrial fibrillation and stroke. Stroke 2014; 45(10): 2856 – 2862.
9. Savelieva I, Camm AJ. Is there any hope for angiotensin-converting enzyme inhibitors in atrial fibrillation? Am Heart J 2007; 154(3): 403 – 406. doi: 10.1016/ j.ahj.2007.05.008.
10. Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS, The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC), Developed with the special contribution of the European Heart, Rhythm Association (EHRA) of the ESC, Endorsed by the European Stroke Organisation (ESO). Eur Heart J 2016; 37(38): 2893 – 2962. doi: 10.1093/ eurheartj/ ehw210.
11. Čihák R, Haman L, Táborský M. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Summary of the document prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58: e636 – e683. Dostupné na: http:/ / www.sciencedirect.com/ science/ article/ pii/ S0010865016301047.
12. Dobrev D, Friedrich A, Voigt N et al. The G protein-gated potassium current I (K,ACh) is constitutively active in patients with chronic atrial fibrillation. Circulation 2005; 112(24): 3697 – 3706. doi: 10.1161/ CIRCULATIONAHA.105.575332.
13. Van Wagoner DR, Pond AL, Lamorgese M et al. Atrial L-type Ca2+ currents and human atrial fibrillation. Circ Res 1999; 85(5): 428 – 436.
14. Bosch RF, Scherer CR, Rub NL et al. Molecular mechanisms of early electrical remodeling: transcriptional downregulation of ion channel subunits deduces I (Ca,L) an I(to) in rapid atrial pacing in rabbits. J Am Coll Cardiol 2003; 41(5): 858 – 869.
15. Madrid AH, Escobar C, Rebollo JM et al. Angiotensin receptor blocker as adjunctive therapy for rhythm control in atrial fibrillation: results of the irbesartan-amiodarone trial. Card Electrophysiol Rev 2003; 7(3): 243 – 246.
16. Lim HS, Willoughby SR, Schultz C et al. Effect of atrial fibrillation on atrial thrombogenesis in humans: impact of rate and rhythm. J Am Coll Cardiol 2013; 61(8): 852 – 860. doi: 10.1016/ j.jacc.2012.11.046.
17. Hijazi Z, Oldgren J, Siegbahn A et al. Biomarkers in atrial fibrillation: a clinical review. Eur Heart J 2013; 34(20): 1475 – 1480. doi: 10.1093/ eurheartj/ eht024.
18. Lábrová R. Fibrilace síni v době katetrové ablace. Vnitr Lek 2010; 56(8): 871 – 879.
19. Freestone B, Beevers DG, Lip GY. The renin-angiotensin-aldosterone system in atrial fibrillation: a netherapeutic target? J Hum Hypertens 2004; 18(7): 461 – 465. doi: 10.1038/ sj.jhh.1001694.
20. Das UN. Is angiotensin-II an endogenous proinflammatory molecule? Med Sci Monit 2005; 11(5): 155 – 162.
21. Healey JS, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45 : 1832 – 1839.
22. Jibrini MB, Molnar J, Arora RR. Prevention of atrial fibrillation by way of abrogation of the renin-angiotensin system: a systematic review and meta-analysis. Am J Therb 2008; 15(1): 36 – 43. doi: 10.1097/ MJT.0b013e31804beb59.
23. Huang G, Xu JB, Liu JX et al. Angiotensin-converting enzyme inhibitors and angiotensin receptor blockers decrease the incidence of atrial fibrillation: a meta-analysis. Eur J Clin Invest. 2011; 41(7): 719 – 733. doi: 10.1111/ j.1365-2362.2010.02460.x.
24. Han M, Zhang Y, Sun S et al. Renin-angiotensin system inhibitors prevent the recurrence of atrial fibrillation: a meta-analysis of randomized controlled trials. J Cardiovasc Pharmacol 2013; 62(4): 405 – 415. doi: 10.1097/ FJC.0b013e3182a094a1.
25. Fogari R, Zoppi A, Maffioli P et al. Effect of telmisartan on paroxysmal atrial fibrillation recurrence in hypertensive patients with normal or increased left atrial size. Clin Cardiol 2012; 35(6): 359 – 364. doi: 10.1002/ clc.21994.
26. Galzerano D, Di Michele S, Paolisso G et al. A multicentre, randomized study of telmisartan versus carvedilol for prevention of atrial fibrillation recurrence in hypertensive patiens. J Renin Angiotensin Aldosterone Syst 2012; 13(4): 496 – 503. doi: 10.1177/ 1470320312443909.
27. Zhao D, Wang ZM, Wang LS. Prevention of atrial fibrillation with renin-angiotensin system inhibitors on essential hypertensive patients: a meta-analysis of randomized controlled trials. J Biomed Res 2015; 29(6): 475 – 485. doi: 10.7555/ JBR.29.20140149.
28. Schmieder RE, Kjeldsen SE, Julius S et al. Reduced incidence of new-onset atrial fibrillation with angiotensin II receptor blockade: the VALUE trial. J Hypertens 2008; 26(3): 403 – 411. doi: 10.1097/ HJH.0b013e3282f35c67.
29. Qi WW, Liu T, Xu G et al. Upstream therapeutic strategies of Valsartan and Fluvastatin on Hypertensive patients with non-permanent Atrial Fibrillation (VF-HT-AF): study protocol for a randomized controlled trial. Trials 2015; 16 : 336. doi: 10.1186/ s13063-015-0836-5.
30. Alings M, Smit MD, Moes ML et al. Routine versus aggressive upstream rhythm control for prevention of early atrial fibrillation in heart failure: background, aims and design of the RACE 3 study. Neth Heart J 2013; 21(7 – 8): 354 – 363. doi: 10.1007/ s12471-013-0428-5.
31. Cosio FG, Aliot E, Botto GL et al. Delayed rhythm control of atrial fibrillation may be a cause of failure to prevent recurrences: reasons for change to active antiarrhythmic treatment at the time of the first detected episode. Europace 2008; 10(1): 21 – 27. doi: 10.1093/ europace/ eum276.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Akutní selhání ledvin
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2017 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Antiarytmická léčba u fibrilace síní
- Upstream terapie u fibrilace síní, co nového?
- Úloha intrakardiální echokardiografie při katetrizační ablaci poruch srdečního rytmu
- Moderní pohled na elektrickou kardioverzi fibrilace síní
- Náhlá srdeční smrt a její diagnostika
- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Význam nových parametrů kontraktility a tepové práce pro hodnocení srdeční funkce a prognózy
- Kvalita života pacientů s dlouhodobou mechanickou srdeční podporou
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Revmatoidní artritida pro kardiologa
- Akutní selhání ledvin
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- MUDr. Pavel Jerie se dožívá 90 let
- Srdíčkáři na Pálavě aneb V. setkání osob žijících s transplantovaným srdcem
- První Kurz srdečního selhání v Brně
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Akutní selhání ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



