-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
Modern antithrombotic treatment after ACS – do we use it adequately?
Ticagrelor is an adenosine derivate and it is an oral, reversible, direct inhibitor of adenosine diphosphate (ADP) receptor type P2Y12 with a rapid effect and higher anti-aggregation activity than clopidogrel. Ticagrelor (180mg loading dose, 90mg twice daily long term) was tested against clopidogrel (300–600mg loading dose, 75mg long term) in the PLATO study in 18,624 patients after acute coronary syndrome with or without ST elevation. The combined endpoint defined as death, myocardial infarction or stroke was observed in 9.8% of subjects in the Ticagrelor group and in 11.7% in the clopidogrel group after 12 months (p < 0.001). There was no difference in bleeding (11.6 vs. 11.2%, p = 0.43). Ticagrelor decreased significantly the primary endpoint from 22.0 to 17.3% in patients with chronic kidney disease (creatinine clearance less than 60 ml/min, n = 3.237) with more significant decrease of the absolute risk when compared to the whole population (7.9 vs. 8.9%). The PEGASUS-TIMI 54 tested the long-term effect of Ticagrelor after myocardial infarction and showed a decrease of the risk of death after myocardial infarction and stroke with a small increase in bleeding.
Keywords:
ticagrelor – myocardial infarction – anti-aggregation – renal functions
Autoři: J. Špinar 1; J. Vítovec 2
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno, Brno 1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2017, 19(1): 56-60
Souhrn
Tikagrelor je derivát adenozinu a je orální, reverzibilní, přímý inhibitor receptoru pro adenozindifosfát (ADP) typu P2Y12, má rychlejší nástup účinku a více vyjádřenou antiagregační aktivitu než klopidogrel. Ve velké multicentrické studii PLATO (180 mg úvodní dávka, 90 mg 2× denně udržovací dávka) byl zkoušen proti klopidogrelu (300 – 600 mg úvodní dávka, 75 mg udržovací dávka) u 18 624 nemocných s akutním koronárním syndromem s ST elevací i bez ST elevace. Po 12 měsících se kombinovaný cíl úmrtí z kardiovaskulárních příčin (infarkt myokardu či cévní mozková příhoda) vyskytl u 9,8 % nemocných léčených tikagrelorem vs 11,7 % u nemocných léčených klopidogrelem (p < 0,001). Nebyl pozorován rozdíl ve výskytu velkých krvácení (11,6 vs. 11,2 %; p = 0,43). U pacientů s chronickým onemocněním ledvin (clearance kreatininu < 60 ml/ min; n = 3 237) snížil tikagrelor v porovnání s klopidogrelem významně výskyt primárního sledovaného parametru na 17,3 z 22,0 % s větším snížením absolutního rizika než u pacientů s normálními renálními funkcemi (n = 11 965): 7,9 vs. 8,9 %. U pacientů s AKS a renální insuficiencí je tikagrelor nyní plně hrazen. Jeho efekt v delším časovém období zkoumala studie PEGASUS-TIMI 54, která prokázala, že léčba tikagrelorem více než 1 rok po infarktu myokardu snižuje riziko úmrtí na infarkt myokardu a cévní mozkové příhody s mírným zvýšením velkých krvácení.
Klíčová slova:
tikagrelor – infarkt myokardu – antiagregace – renální funkce
Zatímco stávající protidestičkové léky, jako je acetylsalicylová kyselina (ASA), tiklopidin či klopidogrel nebo inhibitory receptoru IIb/ IIIa, přicházely s mnohaletými pauzami, v posledních letech jsme svědky nástupu celé řady nových protidestičkových léků. Důvodů je mnoho. Prvním je jistě vysoký výskyt aterotrombotických komplikací, jehož ovlivnění je velkou příležitostí pro farmaceutické firmy. Za druhé je to skutečnost, že vlastní aktivace trombocytu je pod kontrolou řady receptorů, z nichž dosud umíme ovlivnit jen některé. Vývoj nových inhibitorů by mohl potencovat protidestičkový účinek, a zlepšit tak prognózu nemocných. Posledním důležitým faktorem je, že stávající protidestičkové léky mají významné omezení – část populace je k jejich působení zcela či částečně rezistentní. Nové léky tak mají šanci dosavadní léky buď nahradit, či v kombinaci s nimi zvýšit protidestičkový účinek [1].
Tikagrelor – základní charakteristika
Tikagrelor je perorálně účinné protidestičkové léčivo; chemickou strukturou patří mezi cyklopentyl-triazolo-pyrimidiny (CPTP) (není tedy thienopyridin!) (obr. 1).
Obr. 1. Inhibitory receptoru P2Y<sub>12</sub> pro ADP. 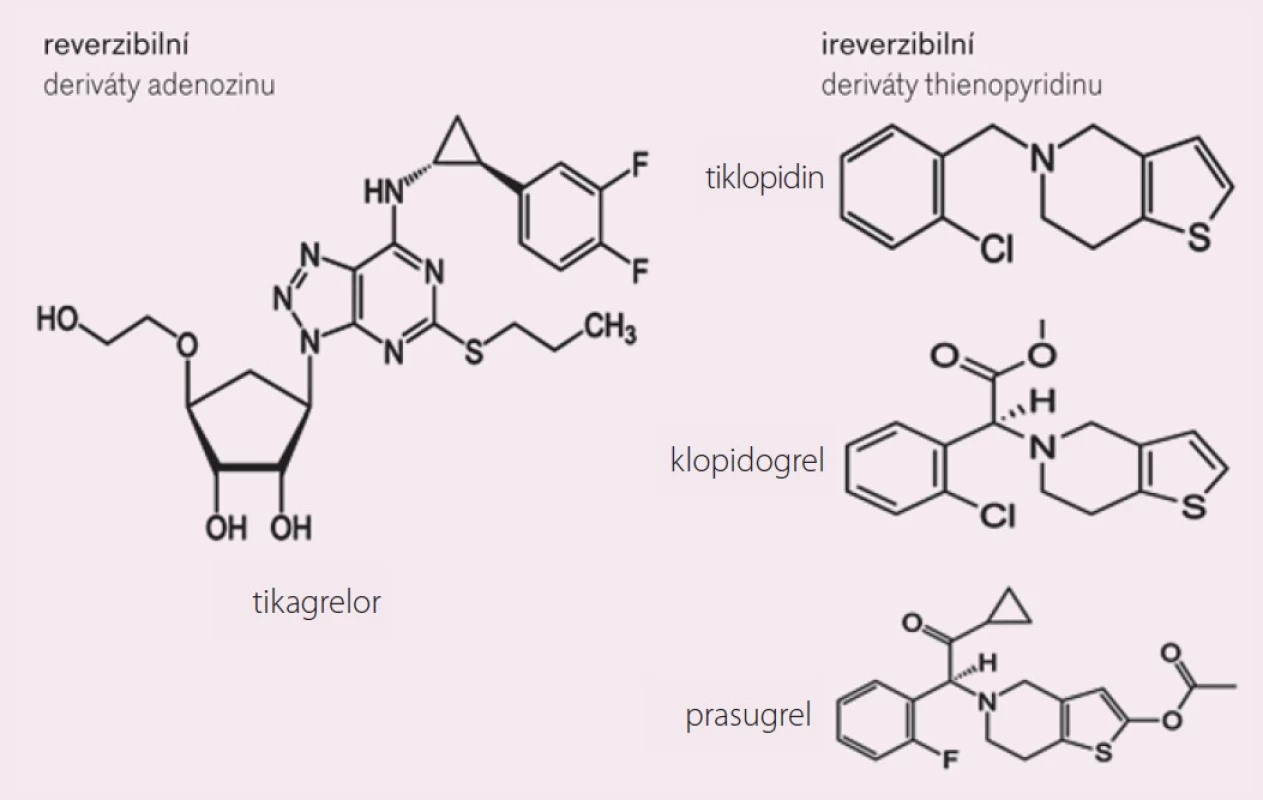
Mechanizmus jeho antiagregačního účinku spočívá stejně jako u thienopyridinů (klopidogrel, prasugrel) ve vazbě na destičkový receptor P2Y12 pro ADP s následnou blokádou aktivace trombocytů zprostředkované ADP.
Na rozdíl od thienopyridinů působí tikagrelor přímo, bez nutnosti konverze na aktivní metabolit, a blokáda aktivace destiček vyvolaná tikagrelorem je reverzibilní [1–3]. Tikagrelor má rychlý nástup účinku, po perorálním podání iniciální dávky 180 mg pacientům se stabilizovanou ischemickou chorobou srdeční (ICHS) léčenou ASA dochází po 30 min k průměrné inhibici agregace krevních destiček v rozsahu přibližně 41 %, maxima (asi 89 %) je dosaženo za 2–4 hod, účinek přetrvává 2–8 hod [4,5].
Tikagrelor se po perorálním podání rychle absorbuje. Příjem stravy významně neovlivňuje Cmax ani AUC tikagreloru ani aktivního metabolitu. Obě látky se silně vážou na plazmatické proteiny (> 99,7 %). Po podání radioaktivního tikagreloru se větší část aktivity z organizmu vylučuje stolicí, menší část močí. Průměrný eliminační poločas je asi 7 hod pro tikagrelor a 8,5 hod pro aktivní metabolit.
Vedlejší účinky
Vedlejší účinky nejsou časté a mohou zahrnovat kromě zvýšeného rizika krvácení i pocit dušnosti. Po zahájení léčby se v prvním týdnu mohou ojediněle vyskytnout bradyarytmie (pauzy do 3 s). U menšího procenta osob se může vyskytnout i kožní vyrážka a svědění.
Indikace
Tikagrelor je indikován v kombinaci s ASA k prevenci aterotrombotických příhod u dospělých pacientů s akutním koronárním syndromem (AKS) (nestabilní angina pectoris, infarkt myokardu (IM) bez elevace segmentu ST nebo IM s elevací segmentu ST), vč. pacientů léčených konzervativně a pacientů, kteří byli ošetřeni perkutánní koronární intervencí (PCI) nebo jsou po koronárním arteriálním bypassu (CABG).
Kontraindikace
Mezi kontraindikace podání tikagreloru patří přecitlivělost na složky přípravku, aktivní patologické krvácení, anamnéza nitrolebního krvácení, střední až závažné poškození jater, souběžné podávání se silnými inhibitory CYP3A4 (např. s ketokonazolem, klarithromycinem, nefazodonem, ritonavirem a atazanavirem).
Pokud má pacient podstoupit plánovanou operaci a antiagregační účinek není žádoucí, je vhodné tikagrelor vysadit 7 dní před výkonem.
Dávkování
Počáteční dávka jsou 2 tablety ve stejnou dobu (nárazová dávka 180 mg). Po této počáteční dávce je obvyklá dávka 1 tableta 90 mg 2× denně.
Tikagrelol ve velkých klinických studiích
IM je stále jedna z velmi závažných diagnóz. Stále více lidí s IM však přežívá díky systému primární péče a jsou ve významném ohrožení recidivy. Proto je na tyto nemocné cíleně zaměřena intenzivní sekundární prevence. Jedním ze základních mechanizmů další ischemické příhody je aktivace destiček – tvorba trombu. ASA má prokázanou účinnost na snížení trombotických příhod, proto je doporučována po IM do dlouhodobé léčby. Přidání tikagreloru – inhibitoru P2Y12 receptoru k ASA za účelem snížení trombotických příhod do 1 roku po akutním IM (AIM) bylo sledováno ve studii PLATO [2,6,7].
Do studie PLATO bylo zařazeno 18 624 nemocných po AIM, kteří byli randomizováni na klopidogrel (300 – 600 mg úvodní dávka, 75 mg udržovací dávka) a tikagrelor (180 mg úvodní dávka, 90 mg 2× denně udržovací dávka). Pacientům bylo doporučeno, aby současně užívali ASA. Studie probíhala v 862 centrech ve 43 zemích a nábor byl zahájen v říjnu 2006 a ukončen v červnu 2008. Sledování nemocných probíhalo do února 2009.
Ovlivnění primárního cíle ve studii PLATO – kardiovaskulární (KV) úmrtí, IM a cévní mozkovou příhodu (CMP) ukazuje graf 1.
Graf 1. Studie PLATO – ovlivnění primárního cíle – úmrtí, infarktu myokardu a cévní mozkové příhody – čas do první příhody. 
Ovlivnění primárního bezpečnostního cíle (výskyt krvácení v obou skupinách) je sumarizováno v grafu 2. Jak je patrné, mezi klopidogrelovou a tikagrelovou větví nebyly pozorovány významné rozdíly ve výskytu krvácení. Hlavní výsledky studie PLATO uvádí tab. 1.
Graf 2. Výskyt krvácení ve studii PLATO. 
Tab. 1. Hlavní výsledky studie PLATO. 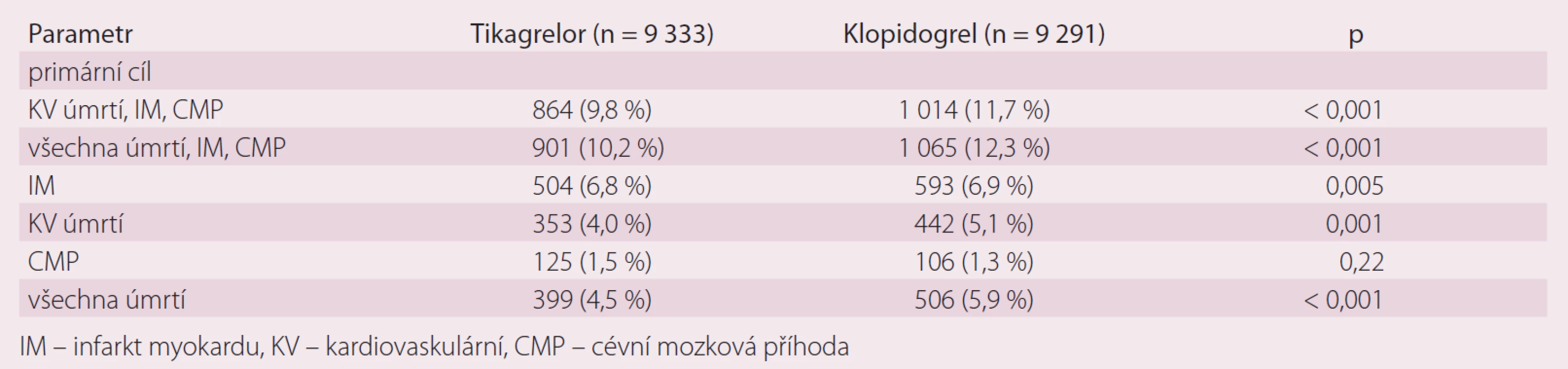
Výsledky můžeme shrnout do následujících bodů:
- Při léčbě 1 000 nemocných s AIM tikagrelor oproti klopidogrelu zabrání:
- 14 úmrtím,
- 11 IM,
- 7 trombózám ve stentu.
- Na základě těchto výsledků jsou inhibitory P2Y12receptoru doporučovány po dobu 12 měsíců jak v amerických, tak v evropských doporučeních [8 – 12].
U pacientů s AKS je snížení renálních funkcí spojeno nejen s horší prognózou, ale i se zvýšeným rizikem krvácení, což může pozměnit poměr rizik a přínosu antiagregační léčby. I mírná a středně těžká dysfunkce ledvin zvyšuje riziko IM a úmrtí u všech forem AKS. I když nejsou mechanizmy vyššího výskytu plně objasněny, jako možné faktory byly popsány akcerelace aterosklerózy, oxidační stres, zánět a zvýšená agregace destiček, stejně jako nedostatečné využívání doporučených léků, např. antitrombotik, i invazivních výkonů. Porucha vylučování řady farmak ledvinami navíc zvyšuje riziko předávkování pacientů se sníženými renálními funkcemi, což dále zvyšuje riziko krvácení. Proto i ve studii PLATO byla zvýšená pozornost věnována nemocným se sníženými renálními funkcemi.
Hodnoty sérového kreatininu stanovované v centrální laboratoři byly při vstupu do studie k dispozici u 15 202 (81,9 %) pacientů s AKS; pomocí rovnice podle Cockcrofta a Gaulta byla vypočtena clearance kreatininu. U pacientů s chronickým onemocněním ledvin (clearance kreatininu < 60 ml/ min; n = 3 237) snížil tikagrelor v porovnáni s klopidogrelem významně výskyt primárního sledovaného parametru na 17,3 z 22,0 % (CI 0,65 – 0,90) s větším snížením absolutního rizika než u pacientů s normálními renálními funkcemi (n = 11 965): 7,9 vs. 8,9 % (CI 0,79 – 1,02). U pacientů s chronickým onemocněním ledvin snížil tikagrelor celkovou mortalitu o 10,0 vs 14,0 %(CI 0,58 – 0,89). Incidence závažného krváceni, fatálního krvácení a závažného krvácení bez souvislosti s koronárním bypassem se mezi dvěma randomizovanými skupinami statisticky významně nelišila. Interakce mezi clearance kreatininu a randomizovanou léčbou u všech proměnných jako sledovaných parametrů nebyly statisticky významné. U pacientů s chronickým onemocněním ledvin, kteří prodělali AKS, tikagrelor v porovnaní s klopidogrelem významně snižuje sledované parametry ischemických příhod a mortality bez statisticky významného zvýšení incidence závažného krvácení, avšak při zvýšeném počtu případů krvácení bez souvislosti s provedeným výkonem [13]. Vzhledem k významnému benefitu pacientů s AKS a renální insuficiencí je tikagrelor nyní nově plně hrazen u této skupiny pacientů.
Studie PEGASUS-TIMI 54 byla dvojitě slepá, randomizovaná mezinárodní studie prováděná ve 1 161 centru v 31 zemích, vč. ČR. Zařazeni mohli být nemocní 1 – 3 roky po IM s dalším vysokým rizikem. Doprovodnou mediací byla ASA v dávce 75 – 150 mg [14 – 17].
Primární cíl byla kombinace KV úmrtí, IM a CMP. Sekundárním cílem byla celková mortalita. Primární bezpečnostní cíl bylo krvácení hodnocené TIMI klasifikací jako velké [14,15,18,19].
Randomizováno bylo 21 162 nemocných, průměrného věku 65,4 let, kdy počet žen byl ve všech skupinách kolem 24 %. ASA užívalo více než 99 % nemocných, betablokátory více než 82 % a blokádu RAAS 80 % nemocných. Průměrná doba od posledního infarktu byla 1,7 let. Během studie ukončilo léčbu 32,0 % na 2 × 90 mg, 28,7 % na 2 × 60 mg a 21,4 % na placebu (p < 0,001 pro obě dávky vs placebo). Medián sledování byl 33 měsíců.
Obě dávky tikagreloru statisticky významně snížily primární cíl – KV, IM a ischemická mozková příhoda (graf 3). Účinek tikagreloru byl konzistentní na každý z primárních podcílů, kdy na obou dávkách byl výskyt primárního cíle 7,81 %, výskyt KV úmrtí 2,90 vs. 3,39 % na placebu (p = 0,57), IM 4,47 vs. 5,25 % (p = 0,0055) a výskyt CMP 1,54 vs. 1,94 % (p = 0,034) (graf 4).
Graf 3. Primármí cíl ve studii PEGASUS-TIMI 54. 
Graf 4. Primární a sekundární cíle ve studii PEGASUS-TIMI 54. 
Nebyl pozorován žádný rozdíl podle věku, pohlaví, typu IM či dávky ASA.
Primární bezpečnostní cíl – TIMI velké krvácení – byl vyšší na obou dávkách tikagreloru s výskytem po 3 letech: 2,60 % na 2 × 90 mg, 2,30 % na 2 × 60 mg a 1,06 % na placebu (p < 0,001 pro obě dávky vs placebo). TIMI malé krvácení bylo podobné na obou dávkách i na placebu. Výskyt smrtelného krvácení byl pod 1 % a nelišil se mezi skupinami. Předčasné ukončení pro krvácení bylo častější na aktivní léčbě 7,8 % pro 2 × 90 mg, 6,2 % pro 2 × 60 mg a 1,5 % pro placebo.
Dušnost byla častější na obou dávkách a pro dušnost byla léčba významně častěji ukončena na obou dávkách 6,5 vs. 4,5 vs. 0,8 % (p < 0,001 pro obě dávky). Nebyly pozorovány žádné nežádoucí účinky hepatotoxické, nefrotoxické ani bradyarytmické.
Výsledky studie PEGASUS-TIMI 54 nyní přinášejí jasný průkaz prospěchu z dlouhodobého podávání tikagreloru u pacientů s předchozím AKS, a to na KV mortalitu.
Obě dávky tikagreloru (2 × 60 mg i 2 × 90 mg) byly stejně účinné na primární účinnostní cíl, avšak menší počet ukončení a lepší tolerance byla pozorována po nižší dávce. Obě dávky byly testovány přidáním k malé dávce ASA, což je plně v souladu s doporučeními pro stabilní ICHS [8,11,20,21].
Sahlen et al provedli ve Švédsku v letech 2010 – 2013 registr na 45 073 nemocných po AKS léčených tikagrelorem (n = 11 954) nebo klopidogrelem (n = 33 119) známý jako SWEDEHEART. Primárním cílem byl výskyt úmrtí, hospitalizace pro IM nebo CMP a sekundární cíle byly jednotlivé položky a navíc krvácení. Riziko primárního cíle dosahovalo po 24 měsících na tikagreloru vs. klopidogrel 11,7 vs. 22,3 %, riziko IM 6,1 vs. 10,8 %. Riziko krvácení bylo naopak po tikagreloru lehce vyšší, ne však krvácení závažné. Kumulativní krvácení vyžadující hospitalizaci bylo stejné, asi 5,5 % [22].
Závěr
Tikagrelor je účinný orální, reverzibilní, přímý inhibitor receptoru pro ADP typu P2Y12 s rychlým nástupem účinku a výraznou antiagregační aktivitou. Klinické studie s tikagrelorem prokázaly jeho účinky na snížení ischemických příhod v sekundární prevenci u osob po IM. Poslední data ukazují na jeho bezpečnost a účinnost i u nemocných se sníženými renálními funkcemi a na jeho bezpečnost v dlouhodobém podávání.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Doručeno do redakce: 10. 3. 2017
Přijato po recenzi: 17. 3. 2017
prof. MU Dr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
spinar.jindrich@fnbrno.cz
Zdroje
1. Bultas J. Ticagrelor. Remedia 2011; 21(2): 116 – 125.
2. Špinar J, Vítovec J. Ticagrelor a studie PLATO. Kardiol Rev 2012; 13(4): 254 – 257.
3. Špinar J. Význam studie Pegasus a nová indikace ticagreloru. Farmakoterapie 2016; 4 : 10 – 13.
4. Penka M. Máme dnes lepší antitrombotika? Kardiol Rev 2012; 14(2): 62.
5. Penka M. Antikoagulační a antiagregační léčba – základní principy. Kardiol Rev 2012; 14(2): 63 – 67.
6. Scirica BM, Cannon CP, Emanuelsson H et al. The incidence of bradyarrhythmias and clinical bradyarrhythmic events in patients with acute coronary syndromes treated with ticagrelor or clopidogrel in the PLATO (Platelet Inhibition and Patient Outcomes) trial: results of the continuous electrocardiographic assessment substudy. J Am Coll Cardiol 2011; 57(19): 1908 – 1916. doi: 10.1016/ j.jacc.2010.11.056.
7. Wallentin L, Becker RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361(11): 1045 – 1057. doi: 10.1056/ NEJMoa0904327.
8. Amsterdam EA, Wenger NK, Brindis RG et al. 2014 AHA/ ACC guideline for the management of patients with non-st-elevation acute coronary syndromes: executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130(25): 2354 – 2394. doi: 10.1161/ CIR.0000000000000133.
9. Hamm CW, Bassand JP, Agewall S et al. ESC Guide-lines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011; 32(23): 2999 – 3054. doi: 10.1093/ eurheartj/ ehr236.
10. O'Gara PT, Kushner FG, Ascheim DD et al. 2013 ACCF/ AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guide-lines. Circulation 2013; 127(4): e362 – e425. doi: 10.1161/ CIR.0b013e3182742cf6.
11. Montalescot G, Sechtem U, Achenbach S et al. Task Force Members. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34(38): 2949 – 3003. doi: 10.1093/ eurheartj/ eht296.
12. Steg PG, James SK, Atar D et al. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20): 2569 – 2619. doi: 10.1093/ eurheartj/ ehs215.
13. James S, Budaj A, Aylward P et al. Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function. results from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation 2010; 122(11): 1056 – 1067. doi: 10.1161/ CIRCULATIONAHA.109.933796.
14. Bonaca MP, Bhatt DL, Cohen M et al. The PEGASUS-TIMI 54 Steering Committee and Investigators. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372(19): 1791 – 1800. doi: 10.1056/ NEJMoa1500857.
15. Bonaca MP, Bhatt DL, Oude Ophuis T et al. Long-term tolerability of ticagrelor for secondary prevention of major adverse cardiovascular events: a secondary analysis of the PEGASUS-TIMI 54 trial. JAMA Cardiol 2016; 1(4): 425 – 432. doi: 10.1001/ jamacardio.2016.1017.
16. Špinar J, Špinarová L, Vítovec J. Studie PEGASUS – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu. Kardiol Rev Int Med 2015; 17(1): 41 – 45.
17. Špinar J, Špinarová L, Vítovec J. Ticagrelor a duální antiagregace po infarktu myokardu – studie PEGASUS. Farmakoterapie 2015; 1 : 74 – 80.
18. Bonaca MP, Bhatt DL, Braunwald E et al. Design and rationale for the prevention of cardiovascular events in patients with prior heart attack using ticagrelor compared to placebo on a background of aspirin-thrombolysis in myocardial infarction 54 (PEGASUS-TIMI 54) trial. Am Heart J 2014; 167(4): 437 – 444.e5. doi: 10.1016/ j.ahj.2013.12.020.
19. Mehran R, Rao SV, Bhatt DL et al. Standardized bleeding definitions for cardiovascular clinical trial. a consensus report from the bleeding academic research consortium. Circulation 2011; 123(23): 2736 – 2747. doi: 10.1161/ CIRCULATIONAHA.110.009449.
20. Fihn SD, Gardin JM, Abrams J et al. 2012 ACCF/ AHA/ ACP/ AATS/ PCNA/ SCAI/ STS guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology Foundation/ American Heart Association task force on practice guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation 2012; 126(25): e354 – e471. doi: 10.1161/ CIR.0b013e318277d6a0.
21. Lábrová R. Edoxaban – farmakologický profil. Kardiol Rev Int Med 2017; 19(1): 45–50.
22. Sahlen A, Verenhorst C, Lagerqvist B et al. Outcomes in patients treated with ticagrelor or clopidogrel after acute myocardial infarction: experiences from SWEDEHEART registry. Eur Heart J2016; 37(44): 3335 – 3342. doi: 10.1093/ eurheartj/ ehw284.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2017 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Manuál ambulantního specialisty-kardiologa
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



