-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunosupresivní léčba po transplantaci srdce
Immunosuppression treatment following heart transplantation
In recent years, heart transplantation is the treatment of choice in patients with severe heart failure. Immunosuppressants form the basis of pharmacotherapy in these patients. The traditional immunosuppressants are cyclosporin, azathioprine and glucocorticoids. Newer treatment schedules include cyclosporin, mycophenolate mofetil and glucocorticoids or tacrolimus, mycophenolate mofetil and glucocorticoids. Recently, combinations without nephrotoxic calcineurin inhibitors (cyclosporin or tacrolimus) are preferred in post‑orthotopic heart transplantation (OHT) patients with renal function impairment. Sirolimus or everolimus are used instead in combination with mycophenolate. We aim to cease glucocorticoids in all treatment regimens after the first year of treatment with the resulting two‑drug combination being life-long. Drug interactions are the most frequently linked to cyclosporin. The drugs that increase cyclosporin levels include amiodarone, cimetidine, steroids, diltiazem, erythromycin nicardipine, oral contraception, ranitidine and verapamil. The increased cyclosporin levels might lead to nephrotoxicity. On the other hand, the drugs that decrease cyclosporin levels might cause rejection (e. g. carbamazepine, antituberculotics, cholestyramine, phenobarbital). Concomitant administration of azathioprine and allopurinol might cause bone marrow suppression. Steroids enhance the effect of cyclosporin, their combination with diuretics leads to potassium depletion and ulcerogenic effect is potentiated when combined with anti‑inflammatory agents. It is well known that both cyclosporin and tacrolimus are metabolised via the CYP 450 3A4 as are atorvastatin, lovastatin, simvastatin or the newer rosuvastatin. Consequently, an interaction between these drugs may lead to increased plasmatic concentrations of the statins and increased risk of myopathies. On the other hand, since pravastatin is not metabolised via the CYP 450 system and fluvastatin metabolises via the CYP 2C9, these agents appear to be suitable pharmacological options in the post‑OHT patients as the risk of drug interactions at the CYP 450 3A4 is minimal. In the post‑OHT patients, treatment with a low dose of any statin (atorvastatin 10 mg, lovastatin 20 mg, simvastatin 10 mg, rosuvastatin 10 mg, pravastatin 20–40 mg or fluvastatin 40 mg) should be started as soon as possible following OHT. If increased cholesterol needs further control, hydrophilic fluvastatin in retarded formulation or, alternatively, pravastatin 80 mg should be selected as they are, due to their pharmacological profile, less likely to cause myopathies. In conclusion, it is imperative that cardiologists regularly monitor their patients and consult transplantation centres if in any doubt.
Keywords:
transplantation – immunosuppression – interaction
Autoři: L. Špinarová; J. Vítovec
Působiště autorů: I. interní kardioangiologická klinika, LF MU Brno
Vyšlo v časopise: Kardiol Rev Int Med 2009, 11(2): 63-65
Souhrn
Srdeční transplantace je v posledních letech metodou volby léčby pacientů s těžkým srdečním selháním. Imunosupresiva tvoří základ farmakoterapie těchto pacientů. Klasickou imunosupresi tvoří cyklosporin, azathioprin a kortikoidy. Novější léčebná schémata obsahují cyklosporin, mykofenolát mofetil a kortikoidy či tacrolimus, mykofenolát mofetil a kortikoidy. V posledních letech se u pacientů po ortotopické transplantaci srdce (OTS) s poruchou renálních funkcí uplatňuje kombinace bez kalcineurinových inhibitorů (cyklosporinu či tacrolimu), které jsou nefrotoxické. Místo nich se užívá do kombinace s mykofenolátem sirolimus či everolimus. Po prvním roce se snažíme ve všech režimech vysadit kortikoidy a výsledná doživotní léčba je dvojkombinace. Lékové interakce jsou nejčastější s cyklosporinem. Léky zvyšující hladinu cyklosporinu jsou amiodaron, cimetidin, steroidy, diltiazem, erytromycin nicardipin, orální kontraceptiva, ranitidin, verapamil. Při zvýšení hladiny cyklosporinu může dojít k nefrotoxicitě. Naopak léky snižující hladinu cyklosporinu mohou vyvolat rejekci (např. karbamazepin, antituberkulotika, cholestyramin, fenobarbital). Při současném podání azathioprinu a alopurinolu se může vyvolat dřeňový útlum. Steroidy zvyšují účinek cyklosporinu, s diuretiky vedou k depleci draslíku, s protizánětlivými léky potencují ulcerogenní efekt. Je známo, že cyklosporin i tacrolimus se metabolizují cestou CYP 450 3A4 stejně jako atorvastatin, lovastatin, simvastatin či nový rosuvastastin a na základě lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s následným nebezpečím myopatií. Naproti tomu pravastatin, který se přes systém CYP 450 nemetabolizuje, a fluvastatin, jenž se metabolizuje cestou CYP 2C9, se jeví farmakologicky vhodný u nemocných po OTS, protože nebezpečí lékových interakcí na CYP 450 3A4 je minimální. U nemocných po OTS je možno začít co nejdříve po OTS s nízkými dávkami jakéhokoliv statinu (atorvastatin 10 mg, lovastatin 20 mg, simvastatin 10 mg, rosuvastatin 10 mg, pravastatin 20–40 mg a fluvastatin 40 mg). Je‑li přesto nutné kontrolovat zvýšený cholesterol, zvolíme hydrofilní fluvastatin v retardované formě, event. pravastatin v dávce 80 mg, které mají farmakologické předpoklady mít nižší výskyt myopatií. Velmi důležité je proto pravidelné sledování pacientů kardiologem a v případě jakýchkoliv nejasností konzultace transplantačního centra.
Klíčová slova:
transplantace – imunosuprese – interakceÚvod
Ortotopická transplantace srdce (OTS) je v posledních letech metodou volby léčby pacientů s těžkým srdečním selháním. Z praktického hlediska je v potransplantačním období důležitá znalost možných komplikací, lékových interakcí imunosupresiv a jejich nežádoucích účinků. Při podávání všech imunosupresiv je zvýšená náchylnost k infekcím jakékoliv etiologie. Imunosupresiva podáváme v dvojkombinaci, první rok ještě i s přidáním Prednisonu. Užívané kombinace imunosupresiv ukazuje tab. 1.
Cyklosporin
Cyklosporin je cyklický oligopeptid izolovaný z Tolypocladium inflatum nebo Tolypocladium terricola, v buňkách se váže na cyklofiliny, s nimiž tvoří komplex, který zasahuje do procesu intracelulárních signálních cest. Jeho konečným efektem je inhibice transkripčních faktorů nutných k aktivaci některých cytokinových genů, zejména genu pro IL 2, IL 3, IL 4 a interferon, čímž dochází k inhibici časné fáze aktivace T lymfocytů, potlačení sekrece IL 2 zamezuje aktivaci dalších lymfocytů [1].
Nežádoucí účinky jsou: hyperplazie dásní (je obvykle reverzibilní během šesti měsíců po ukončení terapie), hirsutizmus, hypertenze, nefrotoxicita (projevující se jako intersticiální fibróza s tubulární atrofií), třes (jeho výskyt je závislý na dávce), hyperkalemie, hypomagnezemie, hyperurikemie, hyperlipidemie [2–4].
Lékové interakce: Cyklosporin je lipofilní, je metabolizován v játrech přes systém CYP 450, izoenzym 3A4 a jeho plazmatická koncentrace může být ovlivněna řadou léků, které se rovněž metabolizují přes tento systém [5]. Prodlužuje biologický poločas digoxinu; zvyšuje riziko vzniku myopatie až rhabdomyolýzy při terapii statiny (především lovastatinu, simvastatinu a atorvastatinu) (tab. 2). Je známo, že cyklosporin i tacrolimus se metabolizují cestou CYP 450 3A4 stejně jako atorvastatin, lovastatin, simvastatin či nový rosuvastastin a na základě lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s následným nebezpečím myopatií [6]. Naproti tomu pravastatin, který se přes systém CYP 450 nemetabolizuje, a fluvastatin, který se metabolizuje cestou CYP 2C9, se jeví farmakologicky vhodnější u nemocných po OTS, protože nebezpečí lékových interakcí na CYP 450 3A4 je minimální [7].
Tab. 2. Léky, které moho u ovlivnit plazmatické koncentrace statinů. 
U nemocných po OTS je možno začít s nízkými dávkami jakéhokoliv statinu (atorvastatin 10mg, lovastatin 20mg, simvastatin 10mg, rosuvastatin 10mg, pravastatin 20–40mg a fluvastatin 40mg).
Je li přesto nutné kontrolovat zvýšený cholesterol, zvolíme hydrofilní fluvastatin v retardované formě, event. pravastatin v dávce 80mg, které mají farmakologické předpoklady mít nižší výskyt myopatií [8]. Ve fázi zkoušení je podávání ezetimibu.
Další léky, které zvyšují plazmatické hladiny cyklosporinu, jsou cimetidin, omeprazol, metoclopramid, cisaprid, diltiazem, verapamil, amiodaron, nefazodon, erythromycin, clarithromycin, norfloxacin, ciprofloxacin, ketoconazol, itraconazol, fluconazol, inhibitory retrovirových proteáz, bromocriptin, danazol, estrogeny, progestiny, flavonoidy (naringin) obsažené v grapefruitové šťávě, perorální kontraceptiva, vysoké dávky methylprednisolonu, perorální antidiabetika ze skupiny derivátů sulfonylurey, NSAID (s výjimkou koxibů), chlorochin, colchicin, allopurinol, acetazolamid. Plazmatické hladiny naopak snižují: ticlopidin, barbituráty, carbamazepin, phenytoin, extrakt z třezalky tečkované, orlistat, rifampicin, rifabutin, isoniazid, pyrazinamid, terbinafin, octreotid. Současné podávání inhibitorů ACE nebo kalium šetřících diuretik vede ke zvýšení rizika hyperkalemie [9].
Azathioprin
Je derivátem cytostaticky účinného mercaptopurinu s vysokou účinností na potlačení imunity zprostředkované především lymfocyty T.
Jeho nežádoucí účinky jsou: nechutenství, nauzea, zvracení, megaloblastická anémie, leukopenie, trombocytopenie, alergické kožní reakce [10].
Lékové interakce: snižuje účinek perorálních antikoagulancií, jeho biotransformaci inhibuje současné podávání allopurinolu, které vyžaduje snížení dávek azathioprinu až na jednu čtvrtinu, jeho myelotoxicitu zvyšují ostatní myelotoxická léčiva.
Prednison
Prednison je nehalogenovaný kortikosteroid s vystupňovanou glukokortikoidní účinností a nízkým mineralokortikoidním působením. Dávka 5mg odpovídá cca 20mg hydrocortisonu. Má nespecifické protizánětlivé účinky. Blokuje produkci cytokinů T lymfocyty a makrofágy, inhibuje tvorbu prostaglandinů a leukotrienů (inhibicí fosfolipázy A2), tlumí tvorbu interleukinů a zasahuje do celulární imunitní odpovědi [11]. Nežádoucí účinky jsou uvedeny v tab. 3.
Tab. 3. Nežádoucí účinky kortikoidů. 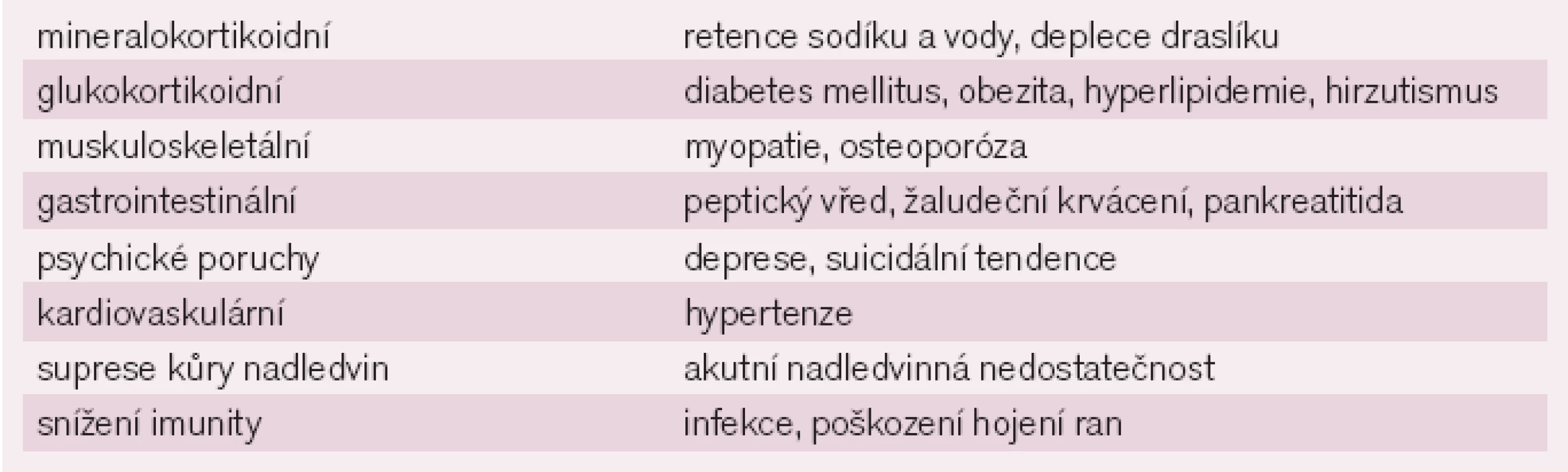
Lékové interakce: kortikoidy zvyšují hladiny cyklosporinu, s diuretiky zhoršují depleci draslíku, zvyšují toxicitu digoxinu, nesteroidních antiflogistik včetně ASA. Snižují účinek perorálních antidiabetik, inzulinu či antikoagulancií.
Tacrolimus (FK 506)
Jde o makrolidové antibiotikum produkované Streptomyces tsukubaensis s výrazným imunosupresivním účinkem. Inhibicí kalcineurinu se váže na cytoplazmatický receptor FK binding protein (FKBP-12). Je značně podobný mechanizmu účinku cyklosporinu: brání aktivaci lymfocytů T vyvolané mitogenní a antigenní stimulací (in vitro) přibližně 100krát účinněji než cyklosporin. Je velmi účinný zejména u chronických kortikorezistentních rejekcí [12].
Nežádoucí účinky jsou: nauzea, zvracení, bolesti břicha, průjem, nechutenství, neurotoxicita (úzkost, zmatenost, deprese, závratě, halucinace, poruchy spánku, epileptické paroxyzmy, parestezie), periferní otoky, nefrotoxicita, anémie, hyperglykemie, hyperkalemie, hypomagnezemie, svědění, alergické kožní reakce; méně často hypertenze, neuropatie, tinnitus, poruchy vidění, osteoporóza, hyperlipidemie, vzácně lymfoproliferativní onemocnění [13].
Lékové interakce: jeho plazmatické hladiny ovlivňují stejné léky jako v případě cyklosporinu.
Mykofenolát mofetil
Je to účinné imunosupresivum ze skupiny antiproliferativních látek. Vlastní účinnou látkou je kyselina mykofenolová, která vzniká biotransformací proléčiva mycophenolat mofetilu. Inhibuje syntézu guanozinových nukleotidů inhibicí inosinmonofosfátdehydrogenázy. Má výraznější efekt na lymfoidní buňky než na myeloidní, způsobený odlišnou závislostí těchto dvou buněčných linií na syntéze nukleotidů de novo. Nemá vliv na časné fáze aktivace lymfocytů (neinhibuje syntézu interleukinu 2), ale zřejmě zasahuje až do pozdějších proliferativních a diferenciačních pochodů. Dochází k potlačení produkce protilátek i ke snížení buněčné imunitní reakce [14].
Nežádoucí účinky jsou: zažívací potíže, dyspnoe, periferní otoky, hematurie, poruchy krevního obrazu, méně často poruchy srdečního rytmu, závratě, nespavost, bolest svalů, kostí a kloubů, třes, krvácení do trávicího ústrojí, hyperplazie dásní, gingivitida, stomatitida, pankreatitida, alergické kožní reakce; vzácněji vznik lymfoproliferativního onemocnění.
Lékové interakce: jeho plazmatické hladiny snižují adsorpční antacida a colestyramin.
Sirolimus (rapamycin) a everolimus
Sirolimus je makrolidové antibiotikum produkované Streptomyces hydroscopicus s výrazným imunosupresivním účinkem, jehož podrobný mechanizmus není zcela znám. Je však do značné míry odlišný od cyklosporinu nebo tacrolimu. Brání aktivaci lymfocytů T vyvolané mitogenní a antigenní stimulací (in vitro), přitom blokuje na vápníku závislé i nezávislé intracelulární signální transdukce. Derivátem sirolimu je RAD (everolimus). Sirolimus a everolimus inhibují progresi T lymfocytů do S-fáze buněčného cyklu. Experimentální data ukazují, že by sirolimus mohl zabraňovat chronické rejekci a tím i vývoji vaskulopatie štěpu.
Nežádoucí účinky sirolimu jsou zažívací potíže, hypertenze, poruchy srdečního rytmu, dyspnoe, bolesti kostí a kloubů, periferní otoky, poruchy krevního obrazu, hypercholesterolemie, hyperlipidemie, hyperkalemie nebo naopak hypokalemie, akneiformní erupce, alergické kožní reakce; epistaxe, otoky obličeje, hemolyticko uremický syndrom, vzácněji lymfoproliferativní onemocnění.
Důvody převodu na sirolimus u pacientů po srdeční transplantaci jsou chronická cyklosporinová nefrotoxicita [15,16], refrakterní rejekce [17], vaskulopatie štěpu [18], myopatie či cyklosporinová neurotoxicita.
Lékové interakce: jsou podobné jako u cyklosporinu či tacrolimu.
Na základě vlastních zkušeností z průběhu 15 let, od roku 1993 do roku 2008, můžeme pozorovat významné změny v imunosupresivní terapii u pacientů po OTS. Dochází k poklesu užívání cyklosporinu a azathioprinu, na rozdíl od vzestupu používání mykofenolátu a tacrolimu. V kombinační léčbě je na ústupu kombinace cyklosporin a azathioprin, naopak vzrůstá počet pacientů s kombinací mykofenolát + cyklosporin nebo mykofenolát + tacrolimus [19].
Indukční terapie
Zahrnuje krátký interval prvních sedmi dnů od transplantace, dokud nejsou dosaženy terapeutické hladiny kalcineurinových inhibitorů. Existují různé protokoly využívající buď monoklonální, nebo polyklonální protilátky.
Polyklonální protilátky (ATG antithymocytární nebo ALG antilymfocytární globulin) suprimují jak T, tak B lymfocyty, a tím mohou vést ke zvýšenému výskytu zejména oportunních infekcí. Muromonab (OKT3) je monoklonální protilátka namířená speciálně proti T lymfocytům, a tak šetří ostatní části imunitního systému příjemce. Jako nadějné se jeví protilátky přímo proti receptoru interleukinu 2: basiliximab (Simulect) nebo daclizumab (Zenapax).
Tyto léky se podávají jako čtvrté do základní trojkombinace imunosupresiv [20].
Závěr
Problematika kombinační terapie po srdeční transplantaci zahrnuje velmi široké spektrum preparátů, které pacienti užívají. Dlouhodobý úspěch této léčby pro pacienty závisí nejenom na práci transplantačních center a klinických pracovišť, ale také na dobré spolupráci s terénními kardiology, kteří se s těmito pacienty dnes již běžně setkávají.
Podpořeno záměrem MSM 0021622402
Doručeno do redakce 17. 3. 2009
Přijato po recenzi 24. 4. 2009
prof. MUDr. Lenka Špinarová, Ph.D., FESC
prof. MUDr. Jiří Vítovec, CSc., FESC
I. interní kardioangiologická klinika, LF MU Brno
lenka.spinarova@fnusa.cz
Zdroje
1. Martínek V, Matoušovic K, Špatenka J. Objev a užití cyklosporinu v klinické praxi. Prakt Lék 2002; 82 : 14–20.
2. Špinarová L. Transplantace srdce z pohledu kardiologa. Kardiologická revue 1999; 2 : 101–105.
3. Málek I. Transplantace srdce. Postgraduální medicína 1999; 1 : 95–100.
4. Krejčí J, Hude P, Špinarová L et al. Transplantace srdce – indikace, komplikace, terapie – naše zkušenosti ze sledování 100 pacientů po srdeční transplantaci. Vnitřní lék 2000; 46 : 750–755.
5. Kousalová L, Baranová J, Anzenbacher P. Lékové interakce na úrovni cytochromů P450 – část 1. CYP 3A4. Klin Farmakol Farm 2003; 17 : 151–157.
6. Widimský J. Poškození svalů při léčbě inhibitory HMG CoA reduktázy-statiny. Cor Vasa 2003; 45 : 376–386.
7. Špinarová L, Toman J. Fluvastatin u pacientů po transplantaci srdce.Vnitř lék 1998; 44 : 13–16.
8. Ballantyne CM. Statins after Cardiac Transplatation: Which Statin, What Dose, and How Low Should We Go? J Heart Lung Transplant 2000; 19 : 515–517.
9. Hošková L, Málek I, Šedivý J et al. Lékové interakce cyklosporinu A. Cor Vasa 2002; 44 : 481–488.
10. Lácha J. Úskalí imunosupresivní léčby. Vnitřní Lék 2003; 49 : 430–433.
11. Gebauerová M, Jandová R, Málek I et al. Obraz nemocného po srdeční transplantaci. Cor Vasa 1994; 35 : 258–262.
12. Rinaldi M, Pellegrini C, Martinelli L et al. FK506 effectiveness in reducing acute rejection after heart transplantation: a prospective randomised study. J Heart Lung Transplant 1997; 16 : 1001–1010.
13. Špinarová L, Toman J, Hude P et al. Dlouhodobé metabolické účinky tacrolimu a cyklosporinu po transplantaci srdce. Sborník abstrakt V. konference transplantace orgánů a tkání, Brno 2002.
14. Špinarová L, Toman J. Pharmacotherapy after heart transplantation. Cor Vasa 2000; 42 : 335–340.
15. Snell GI, Levvey BJ, Chin W et al. Sirolimus allows renal recovery in lung and heart transplant recipients with chronic renal impairment. J Heart Lung Transplant 2002; 21 : 540–546.
16. Hunt J, Lerman M, Dewey T et al. Conversion to sirolimus lessens renal dysfunction in heart transplant patients. J Heart Lung Transplant 2004; 23 : 113.
17. Viklický O, Matl I. Rapamycin: nové imunosupresivum schopné potlačit chronickou rejekci? Čas Lék Čes 2001; 140 : 22–25.
18. Mancini D, Pinney S, Burkhoff D et al. Use of rapamycin slows progression of cardiac transplantation vasculopathy. Circ 2003; 108 : 48–53.
19. Špinarová L, Hude P, Krejčí J et al. Vývoj imunosupresivních režimů v průběhu 10 let u pacientů po transplantaci srdce. Sborník abstrakt 6. kongresu České transplantační společnosti. Praha 14.–16. 10. 2004 : 15.
20. Vítovec J, Špinar J et al. Farmakoterapie kardiovaskulárních onemocnění. 2. vyd. Praha: Grada 2004.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2009 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- prof. MUDr. Miloš Štejfa, DrSc., FESC (*28. 5. 1929)
- Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční
- REGISTR BRNO – změnila se farmakoterapie po infarktu myokardu v posledních letech?
- Rehabilitace nemocných s ischemickou chorobou srdeční
- Imunosupresivní léčba po transplantaci srdce
- Omyly a chyby v rozpoznání a léčbě chlopenních srdečních vad
- Co nového v hypertenzi?
- Cardiometabolic risk is a threat for the 21st century cardiology
- Dosahování cílových hodnot LDL-cholesterolu v klinické praxi. Poznatky ze studie IN-CROSS
- Ve dvou se to lépe táhne
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční
- Imunosupresivní léčba po transplantaci srdce
- Cardiometabolic risk is a threat for the 21st century cardiology
- Rehabilitace nemocných s ischemickou chorobou srdeční
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




