-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční
Diagnosis and treatment mistakes in acute forms of ischaemic heart disease
Not only cardiologists but also other specialists are faced with diagnoses and differential diagnoses of acute coronary syndrome. The paper provides an overview, in chronological order, of some difficulties and mistakes in history taking, clinical examinations and the conduct of standard investigations as part of the diagnostic process. Furthermore, the paper outlines possible treatment shortfalls and errors. Rapid diagnosis and correct treatment are the main prerequisites for preventing serious complications or even death in acute coronary syndrome.
Keywords:
akutní koronární syndrom – STEMI – non-STEMI – diagnostika – léčba
Autoři: M. Gřiva 1; R. Náplava 1; O. Hlinomaz 2
Působiště autorů: Interní klinika IPVZ, Krajská nemocnice T. Bati a. s., Zlín 1; I. interní kardioangiologická klinika FN u sv. Anny, Brno 2
Vyšlo v časopise: Kardiol Rev Int Med 2009, 11(2): 48-53
Souhrn
S diagnostikou a diferenciální diagnostikou akutního koronárního syndromu je konfrontován nejen kardiolog, ale i lékaři jiných odborností. Článek chronologicky přináší shrnutí některých chyb a úskalí při odebírání anamnézy, klinickém vyšetření a provádění standardních vyšetření v rámci diagnostického postupu. Zároveň nastiňuje možné nedostatky a chyby v léčbě. Rychlá diagnostika a správná léčba je u akutních koronárních syndromů základním předpokladem prevence závažných komplikací, event. úmrtí pacienta.
Klíčová slova:
akutní koronární syndrom – STEMI – non‑STEMI – diagnostika – léčbaÚvod
S akutním koronárním syndromem a jeho diferenciální diagnostikou je často konfrontován nejen kardiolog, ale i internista, praktický lékař a lékař záchranné služby. Je zřejmé, že chyby v diagnostice mohou vést k neadekvátní či pozdní léčbě a v konečném důsledku k významnému poškození pacienta s trvalou invalidizací či dokonce k jeho úmrtí.
Článek shrnuje nejčastější chyby v jednotlivých etapách kontaktu s pacientem – od anamnézy a objektivního vyšetření přes některé vyšetřovací modality až po léčbu.
Anamnéza
Základem kontaktu lékaře s pacientem je odebírání anamnézy. Chyby na této úrovni mohou vést ke špatnému plánování dalších diagnostických kroků s následkem pozdního zahájení příslušné léčby, v horším případě k tomu, že vlastní příčina potíží pacienta není léčena vůbec.
Klíčovým úkolem je rozlišit bolesti, které pacient lokalizuje do oblasti hrudníku, a odhadnout jejich příčinu. Pokud má bolest všechny atributy tzv. „stenokardií“, tedy jde o typickou bolest vznikající při ischemii myokardu, většinou nečiní diagnostické potíže. Do složité situace se můžeme dostat, když součástí výpovědi pacienta jsou i příznaky působící zcela atypicky. Někdy vede k chybné interpretaci potíží méně typická lokalizace či charakter bolestí. Není výjimkou, že je pacient s nauseou, zvracením a bolestí v epigastriu hospitalizován na chirurgii pro podezření na cholecystitidu a teprve internista v rámci předoperačního vyšetření nachází na elektrokardiogramu (EKG) vývojové známky infarktu myokardu spodní stěny.
Přítomnost arthropatie ramenního kloubu, refluxní choroby jícnu či jeho spazmů, vertebrogenních potíží nebo panické ataky můžou být taktéž důvodem chybně stanovené pracovní diagnózy. Zvlášť komplikované bývají situace, kdy pacienti s výše uvedenými komorbiditami mají zároveň různě pokročilé onemocnění koronárních tepen.
Odlišení stenokardií od bolestí perikardiálního původu i přes důkladně odebranou anamnézu nemusí být vždy jednoduché, zvláště v přítomnosti elevací ST segmentů na EKG.
S další nástrahou jsme konfrontováni při recidivě bolestí na hrudníku s časovým odstupem po úspěšné léčbě rozsáhlého infarktu myokardu s elevacemi ST segmentů (ST Elevation Myocardial Infarction – STEMI) přímou angioplastikou. Rozlišení mezi subakutní trombózou ve stentu a pericarditis epistenocardiaca může někdy být na základě anamnézy prakticky nemožné.
Bolest při aortální disekci má většinou jiný charakter než typické stenokardie. Nicméně v medicíně nic neplatí stoprocentně a výjimky potvrzují pravidlo. Nemyslet na tuto závažnou diagnózu má pro pacienta v krátkém čase tragické následky.
Podobnou symptomatologii jako akutní koronární syndrom (AKS) může mít i plicní embolie, zvláště nejsou li bolesti na hrudníku zcela typické a pacient si navíc stěžuje na dušnost.
Ne vždy se akutní formy ischemické choroby srdeční projevují bolestí. Prvním projevem AKS může být dušnost, velká slabost, nausea, synkopa, srdeční arytmie, srdeční selhání až kardiogenní šok či náhlá srdeční smrt. Každý pacient, který tvrdí, že mu je nebo bylo velmi špatně, vyžaduje intenzivní lékařskou pozornost.
Typickou skupinou pacientů s odlišnou prezentací AKS jsou pacienti s diabetes mellitus (přítomnost autonomní neuropatie). Není zde výjimkou zcela asymptomatický průběh nebo průběh bez typických bolestí, kdy prvním příznakem může být až dušnost v rámci akutního srdečního selhání. Atypická symptomatologie však nepostihuje výhradně jen diabetiky.
Důležité:
- Anamnéza je základem diagnostiky akutních koronárních syndromů.
- Při každé bolesti na hrudi, zad, krku, dolní čelisti a břicha musíme pomýšlet na AKS.
- Prvním projevem AKS může být dušnost, velká slabost, nausea, synkopa, srdeční arytmie, srdeční selhání až kardiogenní šok.
Objektivní vyšetření
Základní chybou na úrovni objektivního vyšetření je nedokonale vyšetřený či dokonce nevyšetřený pacient. Přestože akutní formy ischemické choroby srdeční (ICHS) nejsou spojeny s některou specifickou změnou v objektivním nálezu, zanedbání důkladného vyšetření může vést k přehlédnutí typických komplikací AKS a k nemožnosti stratifikovat riziko a prognózu pacienta. Objektivní vyšetření je také základním pilířem diferenciální diagnostiky.
Poslechový nález na plicích, přítomnost srdečního cvalu či zvýšená náplň krčních žil jsou prvními ukazateli akutního srdečního selhání.
Při zanedbání hodnocení poslechového nálezu na srdci může uniknout přítomnost významné chlopenní vady, arytmie či mechanické komplikace infarktu myokardu. Extrémním příkladem by mohlo být řešení hraniční stenózy koronární tepny provedením koronární angioplastiky u pacienta s nediagnostikovanou významnou aortální stenózou či rekanalizace infarktové tepny u nemocného s život ohrožující mechanickou komplikací infarktu myokardu místo toho, aby byl nemocný okamžitě odeslán na kardiochirurgii.
S ohledem na diferenciální diagnostiku a stratifikaci rizika by bylo chybou opomenutí měření krevního tlaku. Hypertenzní krize může být příčinou akutního srdečního selhání s mírnou pozitivitou troponinu i bez nálezu významných stenóz na koronárních tepnách. Nekorigovaná hypertenze nutí pomýšlet na možnost aortální disekce. Hypotenze je alarmujícím nálezem, ať už souvisí s kardiogenním šokem či infarktem pravé komory. V době intervenčního řešení většiny AKS je nutno též při zjištění jinak nevysvětlené hypotenze zvažovat raritní komplikaci katetrizace – krvácení do retroperitonea s rozvojem hypovolemického šoku.
Přehlédnutí asymetrického otoku jedné z dolních končetin může vést ke zbytečné koronární angiografii pacienta s hlubokou flebotrombózou komplikovanou plicní embolií.
Anemický kolorit kůže a bledé spojivky upozorňují všímavého lékaře na možnost anémie, která může klinicky demaskovat do té doby asymptomatickou mnohdy hraniční stenózu koronární tepny. Často za příčinou anémie stojí dlouhodobé ztráty krve trávicím traktem při peptickém vředu nebo tumoru lokalizovaném v gastrointestinálním traktu (GIT). Důsledkem opomenutí přítomnosti anémie a pátrání po její příčině může být progrese krvácení do GIT (hematemeza, meléna) potencovaná použitím inhibitorů glykoproteinových receptorů IIb/IIIa či duální antiagregační léčbou v souvislosti s perkutánní koronární intervencí.
Důležité:
- Vždy důkladně poslechneme srdce a plíce, všimneme si náplně krčních žil a otoků dolních končetin.
- Popíšeme barvu kůže a prokrvení spojivek. Myslíme na možnou anémii při krvácení.
- Vyšetřujeme pulzace na horních i dolních končetinách a na obou karotidách.
Elektrokardiografie
EKG je u pacienta s protrahovanou bolestí na hrudníku klíčovým vyšetřením rozhodujícím o způsobu a načasování léčby, event. o dalších vyšetřeních. Nález Pardeeho vln ve svodech odpovídajících povodí některé koronární tepny je indikací k provedení urgentní koronarografie bez ohledu na denní dobu. Rozhodování při jasném EKG nálezu většinou nečiní potíže. První nástrahou, která v tomto ohledu může číhat na méně zkušeného lékaře, je absence denivelace ST segmentů časně po vzniku potíží pacienta. V některých případech může docházet k vývoji typických elevací ST segmentů se zpožděním. Neprovedení kontrolního EKG záznamu s časovým odstupem zhruba 30–60 min (event. neprovedení dalších opakovaných záznamů) povede k nerozpoznání probíhajícího STEMI se všemi důsledky pro pacienta. Sledování dynamiky změn EKG křivky je enormně důležité u všech AKS. Jsou li stenokardie intermitentní, mohou být intermitentně vyjádřeny i ischemické změny na EKG. Proto je nutno posuzovat EKG záznam pořízený v období symptomů a srovnávat ho se záznamem, kdy byl nemocný bez potíží.
Z pohledu hodnocení EKG je mnohdy problematická diagnostika ischemie boční stěny. Při akutním uzávěru ramus circumflexus nebo některé z jeho větví nemusí vždy dojít k rozvoji elevací ST segmentů ve svodech z levého prekordia či ve svodech I a aVL. Vhodným příkladem je tzv. pravý zadní infarkt myokardu („inferobazální“ dle Univerzální definice infarktu myokardu) [1], kdy dochází k vývoji hlubokých depresí ST segmentů ve svodech V1–4 (obr. 1). Nesprávná interpretace tohoto EKG nálezu odepírá pacientovi s akutní okluzí koronární tepny možnost okamžité reperfuzní léčby. Při nejistotě je rozhodující nález elevací ST segmentů ve svodech V7–9 a echokardiografické vyšetření.
Obr. 1. Pravý zadní (true-posterior, inferobazální) infarkt myokardu při kritické stenóze ramus circumfl exus. 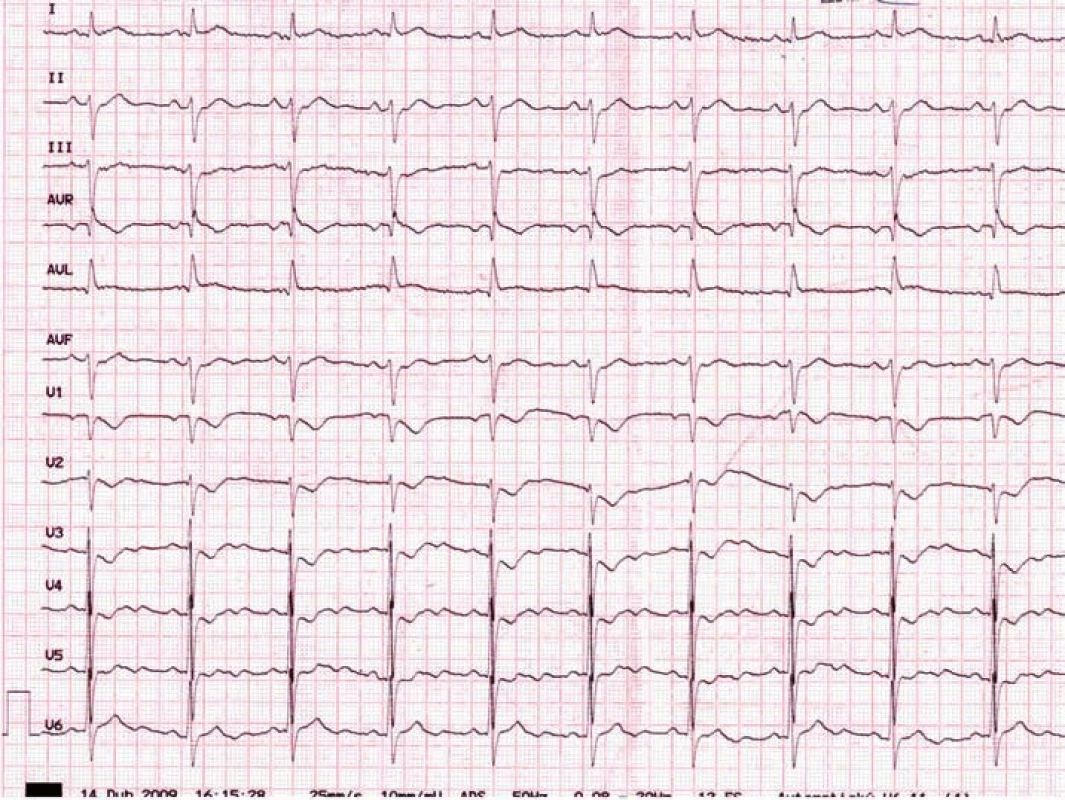
Rozsáhlý akutní STEMI spodní stěny je nezřídka spojen s hypotenzí. Jiný terapeutický postup bude následovat, jde li o hypotenzi související s kardiogenním šokem, zcela jinak musíme léčit pacienta s hypotenzí při infarktu pravé komory srdeční. Pro diagnózu infarktu myokardu (IM) pravé komory je typický nález elevací ST segmentů ve svodu V4R (obr. 2). Záznam EKG ze svodů z pravého prekordia je tedy nutný minimálně u pacientů se STEMI spodní stěny a hypotenzí, optimálně u všech pacientů se STEMI spodní stěny [2].
Obr. 2. Infarkt pravé komory srdeční při uzávěru proximálního úseku pravé věnčité tepny. 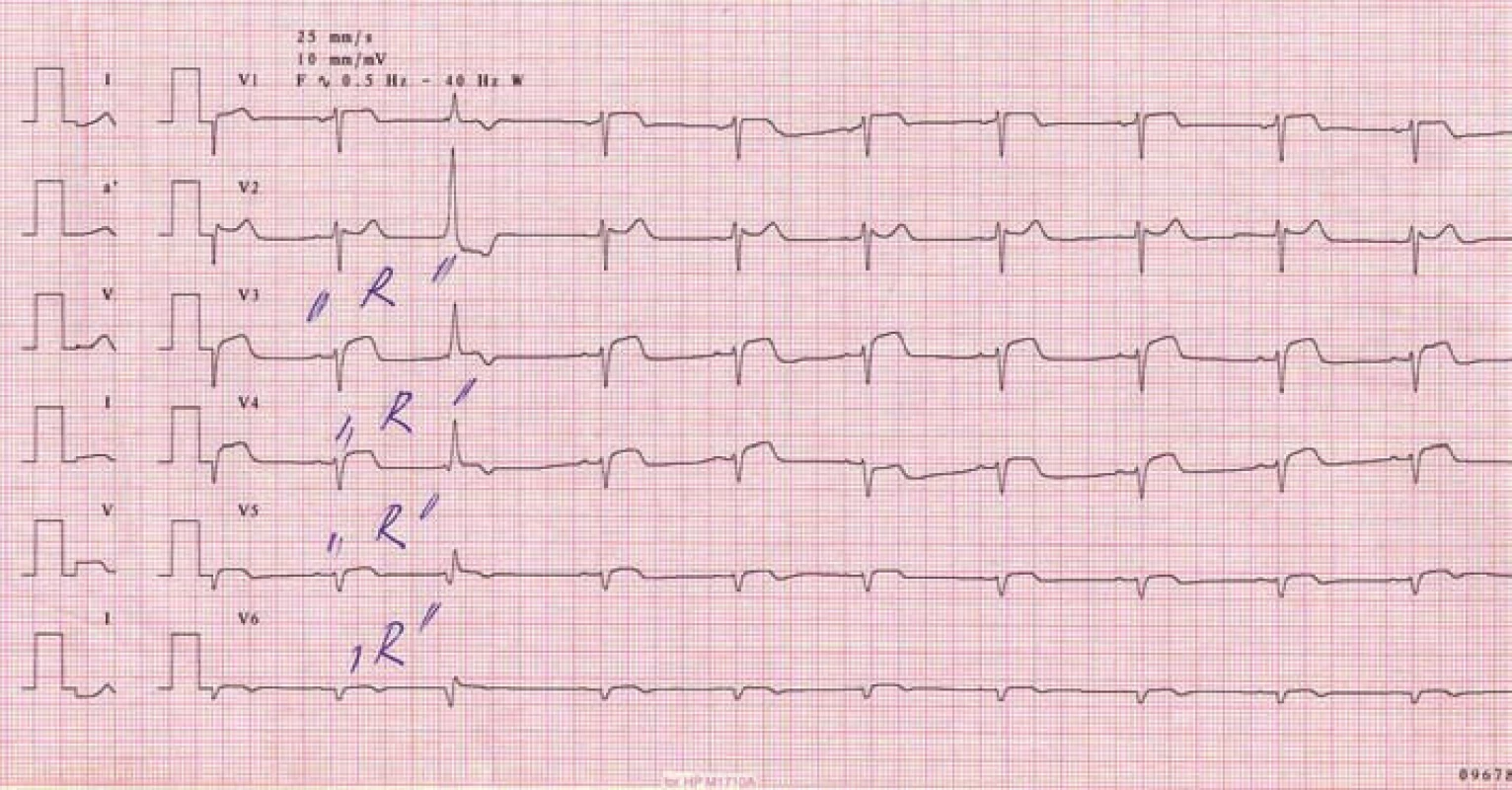
Data ze čtyř velkých randomizovaných studií dokládají, že atrioventrikulární blokáda (AVB) se objevuje téměř u 7% STEMI [3]. Dojde li ke vzniku AVB III. stupně s náhradním rytmem se širokými QRS komplexy, diagnostika přítomnosti a lokalizace infarktu myokardu se komplikuje.
Prakticky nemožná je také EKG diagnostika STEMI u pacientů se stimulací komor při plné dependenci na kardiostimulátoru.
Součástí definice STEMI je nově vzniklý (nebo pravděpodobně nově vzniklý) blok levého raménka Tawarova (Left Bundle Branch Block – LBBB). V souvislosti s tím bychom chtěli podtrhnout význam pečlivých popisů EKG a jejich archivace v dokumentaci pacienta. Znalost EKG nálezu v předchorobí může v konkrétním případě pomoci posoudit indikaci provedení koronární angiografie v urgentním režimu.
V rámci diferenciální diagnostiky nálezu elevací ST segmentů na EKG u pacienta s bolestí na hrudníku je nutný komplexní přístup zahrnující důkladnou anamnézu, posouzení objektivního nálezu, event. další doplňková vyšetření. Jen tak může být odlišen STEMI, perikarditida, příp. syndrom časné repolarizace. Mnohdy přinese definitivní odpověď až koronarografie.
Důležité:
- Normální EKG nevylučuje AKS. Platí to především tehdy, jestliže v okamžiku EKG záznamu již nemocný nemá stenokardie.
- Deprese ST úseků ve svodech V1–4, R větší než S ve svodu V1 a přetrvávající stenokardie jsou indikací k urgentní koronarografii.
- Je li EKG normální a trvají li stenokardie, natočíme i EKG ve svodech V7–9.
- Při infarktu myokardu s elevacemi ST úseků nad dolní stěnou natočíme i EKG ve svodech z pravého prekordia.
Laboratorní diagnostika
Podle „Univerzální definice infarktu myokardu“ vydané Evropskou kardiologickou společností v roce 2007 by měl být pojem infarktu myokardu vyhrazen pro stav s prokázanou myokardiální nekrózou související s klinickým průběhem odpovídajícím ischemii myokardu [1]. Jedním z kritérií, které vyhovuje uvedené definici, je detekce vzestupu a/nebo poklesu biomarkerů myokardiální nekrózy (upřednostňován je srdeční troponin) s alespoň jednou hodnotou nad 99. percentil horního limitu normy společně s průkazem ischemie myokardu minimálně jedním z dalších způsobů.
V případě STEMI by samozřejmě jakékoliv zdržení čekáním na výsledek troponinu bylo chybou způsobující odklad reperfuzní léčby. Odběry jsou v těchto případech prováděny rutinně a výsledek je získán dodatečně.
Zcela jiná situace je u AKS bez elevací ST segmentů. Pozitivita biomarkerů srdeční nekrózy potvrzuje diagnózu akutního infarktu myokardu bez elevací ST segmentů (non ST Segment Myocardial Infarction – non STEMI), při jejich negativitě se pacienti řadí do podskupiny s nestabilní anginou pectoris, nebo se o AKS nejedná. Rozhodně by však bylo chybou na základě negativní hodnoty troponinu v prvních hodinách po vzniku potíží soudit, že se o non STEMI nejedná. Po vzniku ischemie se koncentrace troponinu T zvyšuje za 3–4 hod, troponinu I za 6 hod. Proto je v prvních 6–12 hod nutné opakované stanovení troponinů. Kontrolní druhý odběr troponinu nemusíme provádět tehdy, jestliže mezi posledními stenokardiemi a prvním odběrem uplynulo více než 12 hod. Jakákoliv jiná než nulová hodnota srdečního troponinu vyžaduje vždy velkou pozornost. Srdeční troponin se do krve může dostat pouze z nekrotických nebo významně poškozených buněk myokardu. Na druhé straně je nutno mít na paměti, že kombinace bolestí na hrudníku a pozitivity troponinu nemusí vždy znamenat diagnózu infarktu myokardu. Existuje řada dalších kardiálních i nekardiálních onemocnění, při kterých dochází ke zvýšení troponinů (tab. 1, 2) [4,5].
Tab. 1. Další kardiální onemocnění s možným zvýšením troponinů [4]. ![Další kardiální onemocnění s možným zvýšením troponinů [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/76b67d2bd234e1a45539705c20691d76.png)
Tab. 2. Nekardiální onemocnění s možným zvýšením troponinů [4]. ![Nekardiální onemocnění s možným zvýšením troponinů [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3bc423bc442448de41055d9174a25949.png)
Důležité:
- Při podezření na AKS vždy odebereme srdeční troponin, kreatinin, glykemii, ionty, lipidy, hsCRP, hemoglobin a trombocyty.
- Negativní troponin v prvních odběrech nevylučuje akutní infarkt myokardu ani akutní koronární syndrom.
- Stanovení D dimerů nám může vyloučit plicní embolii.
- Určení NT-proBNP nebo BNP nám pomůže objasnit příčinu dušnosti.
Echokardiografie
Echokardiografické vyšetření účinně pomáhá vyhnout se některým výše uvedeným chybám v diferenciální diagnostice akutních koronárních syndromů. V případě bolestí na hrudníku s nespecifickým EKG nálezem pomůže rozlišit akutní koronární syndrom, perikarditidu, plicní embolii, aortální disekci, hypertrofickou kardiomyopatii či jinou příčinu potíží [6]. Vždy je nutno mít na paměti, že stejně jako změny na EKG, i porucha kinetiky levé komory srdeční může mít intermitentní charakter s progresí v období symptomů.
U pacientů s EKG obrazem STEMI a ne zcela typickými klinickými příznaky nebo při nálezu elevací ST segmentů nesplňujících diagnostická kritéria STEMI může být průkaz segmentární poruchy kinetiky levé komory srdeční zásadním nálezem určujícím další postup.
Echokardiografie je základní metodou hodnotící funkci levé komory srdeční a event. přítomnost komplikací infarktu myokardu. Tím je nenahraditelná pro odhad prognózy pacienta a rozhodnutí o způsobu léčby.
Na méně zkušeného echokardiografistu mohou při hodnocení nálezu čekat některé nástrahy. Potíže může někdy činit např. odlišení segmentární poruchy kinetiky typické pro ischemii v povodí některé koronární tepny, poruchy kinetiky při myokarditidě či asynchronní kontrakce levé komory při blokádě Tawarova raménka. V rukou zkušeného echokardiografisty je však metoda nenahraditelnou pomůckou na cestě ke správné léčbě pacienta.
Ostatní základní zobrazovací metodiky mají význam zvláště v diferenciální diagnostice, stratifikaci rizika a detekci komplikací akutních forem ICHS [7].
Důležité:
- Při bolestech na hrudi a negativním nebo nejednoznačném EKG je okamžité ECHO vyšetření metodou volby.
- Při bolestech na hrudi a nálezu tekutiny v perikardu vždy myslíme na možnost disekce aorty nebo ruptury srdeční stěny.
- Drobnou rupturu srdeční stěny nebo septa lze při rychlém orientačním ECHO vyšetření přehlédnout.
Chyby a nástrahy v léčbě
Akutní infarkt myokardu s elevacemi ST segmentů (STEMI)
Díky rozložení sítě katetrizačních laboratoří je v našich podmínkách prakticky jediná správná možnost léčby akutního STEMI urgentní revaskularizace s využitím přímé perkutánní koronární intervence (direct Percutaneous Coronary Intervention – dPCI), zcela výjimečně urgentní kardiochirurgická revaskularizace (indikační kritéria urgentní kardiochirurgické revaskularizace myokardu přesahují rámec našeho sdělení).
Vzhledem ke známé progresi ischemických změn v čase směřujících k ireverzibilnímu poškození myokardu je největší chybou jakékoliv zdržení a odklad revaskularizace. Stále znovu jsme konfrontováni s pacienty čekajícími hodiny na ústup bolestí doma, s případy, kdy pacient s bolestí na hrudníku nejdříve čeká v plné čekárně svého ošetřujícího lékaře, načež je odeslán do ambulance odborného internisty či kardiologa k natočení a popisu EKG. Bohužel nejsou výjimkou ani případy, kdy u pacienta ošetřeného záchrannou službou v domácích podmínkách není pořízen EKG záznam a pacient je primárně transportován do spádové nemocnice nevybavené katetrizační laboratoří, odkud je pak s další prodlevou organizován sekundární transport. Dle doporučení ESC [2] by měl být čas od prvního medicínského kontaktu s pacientem do první dilatace kratší než 90 min.
Reperfuzní terapie je jednoznačně indikována u pacientů s klinickou symptomatologií STEMI a odpovídajícím EKG nálezem v prvních 12 hod od vzniku potíží. Není li poskytnuta léčba během tohoto intervalu, obvykle dochází k ústupu symptomů v souvislosti s dokončeným ireverzibilním poškozením myokardu. Přetrvávají li klinické či EKG známky pokračující ischemie i po uplynutí 12 hod od vzniku potíží, bylo by chybou reperfuzní léčbu pacientovi odepřít. Na druhé straně nejsou důkazy o profitu reperfuzní léčby u pacientů po uplynutí 12 hod od vzniku symptomů s jejich odezněním [8–10].
Součástí prvního kontaktu s pacientem se STEMI je léčba bolesti. Pacientům v této indikaci nikdy nepodáváme nesteroidní antiflogistika pro jejich možný protrombogenní efekt.
Clopidogrel by měl být podán co nejdříve po stanovení diagnózy STEMI v dávce minimálně 300mg či lépe v dávce 600mg pro rychlejší a účinnější inhibici agregace destiček.
Facilitovaná PCI je definována jako farmakologická reperfuzní léčba následovaná perkutánní koronární intervencí. Na základě provedených studií není žádný důkaz klinické prospěšnosti některého z testovaných algoritmů facilitované PCI, tedy podání plné dávky trombolytika či podání redukované dávky trombolytika a GP IIb/IIIa následované provedením PCI [11–14].
Fondaparinux (selektivní inhibitor faktoru Xa) by neměl být použit u pacientů podstupujících primární PCI pro prokázaný trend k vyšší 30denní mortalitě a výskytu rekurentního infarktu ve srovnání s nefrakcionovaným heparinem [15].
Na tomto místě bychom ještě rádi připomněli nutnost důsledné kompenzace diabetes mellitus a řádně vedenou rehabilitaci jako nezbytnou součást správné péče o pacienty se STEMI.
Důležité:
- Čas je myokard.
- Trvají li stenokardie nebo elevace ST úseků i po 12 hod od vzniku potíží, je dPCI metodou volby.
- PCI uzavřené infarktové tepny u pacientů bez pokračující ischemie za více než 24 hod není indikována.
- Při dPCI provádíme s výjimkou kardiogenního šoku pouze PCI infarktové tepny.
Akutní koronární syndrom bez elevací ST segmentů
Po uložení pacienta s AKS bez elevací ST segmentů na monitorované lůžko se snažíme o jeho farmakologickou stabilizaci – o ovlivnění ischemie a aktivity destiček. Je třeba, aby farmakoterapie byla zahájena co nejdříve. Iniciálně podáváme analgetika, nitráty, kyselinu acetylsalicylovou (ASA), antikoagulancia (fondaparinux, nízkomolekulární heparin nebo nefrakcionovaný heparin), clopidogrel, event. betablokátor.
Při alergii na ASA podáváme thienopyridiny, přednostně clopidogrel v sytící dávce minimálně 300mg, častěji 600mg p.o.
U pacientů s AKS je optimálním řešením duální antiagregační léčba ASA + clopidogrel po dobu až jednoho roku (studie CURE [16]). V České republice je hrazen v indikaci AKS po dobu šesti měsíců, v dalším období nezbývá jiná možnost než plná úhrada pacientem.
Při podávání nízkomolekulárních heparinů (Low Molecular Weight Heparins – LMWH) je třeba vyvarovat se předávkování u pacientů s chronickou renální insuficiencí. Je li glomerulární filtrace 30–60ml/min, je vhodné kontrolovat účinnost LMWH pomocí stanovení hodnoty anti Xa, u pacientů s glomerulární filtrací pod 30ml/min je prakticky vždy nutná redukce dávky LMWH (titrace pomocí anti Xa). Obecně je doporučeno monitorování anti Xa u pacientů s vysokým rizikem krvácení nebo vysokým rizikem trombotických komplikací. Plná antikoagulační léčba má být obvykle ukončena do 24 hod po provedení revaskularizace, při neúspěšné revaskularizaci či indikaci konzervativního postupu je s antikoagulační léčbou pokračováno do propuštění pacienta. Na tomto místě je ještě vhodné poznamenat, že subkutánní aplikace jakýchkoli léků (což se týká často LMWH) je nevhodná u hemodynamicky nestabilních pacientů.
Fondaparinux je u AKS bez elevací ST segmentů vhodná a bezpečnější alternativa dosud používaných antikoagulačních léků [17]. Chybou by však bylo jeho podání při těžké renální insuficienci. Dále není doporučeno podávání samotného fondaparinuxu během perkutánní koronární intervence (PCI) pro dokumentovaný vyšší výskyt trombů v katétrech. Proto je během PCI využívána kombinace s nefrakcionovaným heparinem. Vhodná je také kombinace s inhibitory GP IIb/IIIa.
Porovnáme li četnost podání inhibitorů GP IIb/IIIa v České republice a na jiných evropských pracovištích, zjistíme více než pětinásobný rozdíl v neprospěch ČR [18]. Vhodná, ale málo využívaná strategie je podání eptifibatidu či tirofibanu společně s 600mg clopidogrelu u rizikových pacientů před jejich odesláním k invazivnímu vyšetření (tzv. „na cestu“). Další možnost je podání abciximabu či eptifibatidu až v katetrizační laboratoři během invazivního vyšetření. V našich podmínkách je nejčastější tzv. „bail-out“ podání (nouzové) přímo na katetrizačním sále při komplikovaném výkonu spojeném s intrakoronární trombózou, no-reflow fenoménem apod. Chybou je naopak rutinní podání inhibitorů receptorů IIb/IIIa pacientům s nízkým rizikem či pacientům, u kterých je nadále postupováno konzervativně.
Každý pacient s AKS bez elevací ST segmentů je ohrožen rozvojem STEMI, maligními arytmiemi či náhlou srdeční smrtí. Snad největší chybou v péči o tuto skupinu pacientů by byla protrahovaná hospitalizace na pracovišti bez katetrizační laboratoře s odkladem koronární angiografie. Ke stratifikaci rizika pacientů s AKS bez elevací ST segmentů je využíváno několik klasifikačních systémů, např. klasifikace TIMI (tab. 3) [19] či GRACE. Obecně platí, že nejvíce rizikovou skupinou jsou pacienti s přetrvávající anginou pectoris doprovázenou dynamickými změnami ST segmentů, pacienti s hemodynamickou nestabilitou, srdečním selháním či maligními arytmiemi. Tato skupina je jednoznačně indikována k okamžité revaskularizační léčbě podobně jako u STEMI. Nemocní se středním rizikem dle klasifikačních schémat, které se daří stabilizovat farmakoterapií, by měli být revaskularizováni do 72 hod! Pobyt na spádovém interním oddělení pět až sedm dní s následným odesláním do kardiocentra neúměrně zvyšuje riziko komplikací AKS. Čistě konzervativní postup u non STEMI je indikován pouze u malé skupiny pacientů se známým neřešitelným nálezem na věnčitých tepnách a u pacientů biologicky velmi starých s četnými komorbiditami. Další skupinou, kde postupujeme konzervativně, jsou pacienti s původní pracovní diagnózou AKS, kteří mají opakovaně negativní EKG i biomarkery myokardiální nekrózy, s negativním výsledkem neinvazivního zátěžového vyšetření.
Tab. 3. TIMI risk score (Thrombolysis in Myocardial Infarction Score) – Stanovení jednoletého kombinovaného rizika úmrtí/infarkt myokardu/nutnost urgentní revaskularizace. 
Důležité:
- Pozor na sekundární příčiny AKS bez elevací ST úseků.
- Deprese ST úseků jsou významným ukazatelem špatné prognózy nemocného a vyžadují brzké koronarografické vyšetření.
- Inhibitory IIb/IIIa destičkových receptorů jsou indikovány u nemocných s non STEMI, depresemi ST úseků a u diabetiků s AKS před koronarografií.
- Fondaparinux je indikován u všech nemocných s AKS bez elevací ST úseků, kde neplánujeme okamžitou koronarografii.
Závěr
Rychlá diagnostika a správná léčba je u akutních koronárních syndromů základním předpokladem prevence závažných komplikací, event. úmrtí pacienta. Jen dobrá znalost příznaků, možných vyšetřovacích a léčebných postupů a také neustálá ostražitost nám umožní vyhnout se velkému množství různých omylů a chyb, kterých se můžeme dopustit při péči o tyto pacienty. Na druhé straně můžeme být opakovaně konfrontováni se situacemi, kdy je těžké posoudit, co je vlastně „správně“ – výskyt akutních koronárních syndromů u nemocných s různě pokročilým maligním onemocněním, u velmi starých polymorbidních pacientů apod. Ne na všechny otázky najdeme odpověď v Doporučených postupech. Ale jistě by bylo neodpustitelné chybovat jen proto, že Doporučené postupy vlastně neznáme.
Doručeno do redakce 21. 4. 2009
Přijato po recenzi 24. 4. 2009
MUDr. Martin Gřiva1
MUDr. Robert Náplava1
MUDr. Ota Hlinomaz, CSc.2
1 Interní klinika IPVZ,
Krajská nemocnice T. Bati a. s., Zlín
2 I. interní kardioangiologická klinika
FN u sv. Anny, Brno
m.griva@seznam.cz
Zdroje
1. Thygesen K, Alpert JS, White HD. Universal definition of myocardial infarction. Eur Heart J 2007; 28 : 2525–2538.
2. Werf FV, Bax J, Betriu A et al. The Task Force on the management of ST‑segment elevation acute myocardial infarction of the European Society of Cardiology: Management of acute myocardial infarction in patients presenting with persistent ST‑segment elevation. Eur Heart J 2008; 29 : 2909–2945.
3. Meine TJ, Al-Khatib SM, Alexander JH et al. Incidence, predictors, and outcomes of high‑degree atrioventricular block complicating acute myocardial infarction treated with thrombolytic therapy. Am Heart J 2005; 149 : 670–674.
4. Bělohlávek J, Aschermann M. Doporučený postup pro diagnostiku a léčbu akutních koronárních syndromů bez elevací ST úseků na EKG. Cor Vasa 2008; 50 : 1S7–1S23.
5. Bassand JP, Hamm CV, Ardissino D et al. Guidelines for the diagnosis and treatment of non‑ST‑segment elevation acute coronary syndromes. Eur Heart J 2007; 28 : 1598–1660.
6. Cheitlin MD, Armstrong WF, Aurigemma GP et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force of Practise Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003; 108 : 1146–1162.
7. Veselka J. Hledá se kardiolog. Zn.: Znalost CT a MR srdce nutná! Cor Vasa 2007; 49 : 346–347.
8. Schomig A, Mehilli J, Antoniucci D et al. Betone 12 h Reperfusion AlternatiVe Evaluation (BRAVE-2) Trial Investigators. Mechanical reperfusion in patients with acute myocardial infarction presenting more than 12 hours from symptom onset: a randomized controlled trial. JAMA 2005; 293 : 2865–2872.
9. Hochman JS, Lamas GA, Bulle CE et al. Coronary intervention for persistent occlusion after myocardial infarction. N Engl J Med 2006; 355 : 2395–2407.
10. Menon V, Pearte CA, Buller CE et al. Lack of benefit from percutaneous intervention of persistently occluded infarct arteries after the acute phase of myocardial infarction is time independent: insights from Occluded Artery Trial. Eur Heart J 2009; 30 : 183–191.
11. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST‑segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet 2006; 367 : 569–578.
12. Keeley EC, Boura JA, Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST‑elevation myocardial infarction: quantitative review of randomised trials. Lancet 2006; 367 : 579–588.
13. Ellis SG, Tendera M, de Belder MA et al. FINESSE Investigators. Facilitated PCI in patients with ST‑elevation myocardial infarction. N Engl J Med 2008; 358 : 2205–2217.
14. Van’t Hof AW, Ten Berg J, Heestermans T et al. Ongoing Tirofiban In Myocardial infarction Evaluation (On-TIME) 2 study group. Prehospital initiation of tirofiban in patients with ST‑elevation myocardial infarction undergoing primary angioplasty (On-TIME 2): a multicentre, double-blind, randomised controlled trial. Lancet 2008; 372 : 537–546.
15. Yusuf S, Mehta SR, Chrolavicius S et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST‑segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA 2006; 295 : 1519–1530.
16. Yusuf S, Zhao F, Mehta SR et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST‑segment elevation. N Engl J Med 2001; 345 : 494–502.
17. Yusuf S, Mehta SR, Chrolavicius S et al. Efficacy and safety of fondaparinux compared to enoxaparin in 20,078 patients with acute coronary syndromes without ST segment elevation. The OASIS (Organization to Assess Strategie in Acute Ischemic Syndromes)-5 Investigators. N Engl J Med 2006; 354 : 1464–1476.
18. Kala P, Poloczek M. Patofyziologie akutního infarktu myokardu bez elevací úseku ST a specifika léčby v České republice. Cor Vasa 2008; 50 : 413–417.
19. Antman EM, Cohen M, Bernink PJ et al. The TIMI risk score for unstable angina/non‑ST elevation MI: A method for prognostication and therapeutic decision making. JAMA 2000; 284 : 835–842.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2009 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- prof. MUDr. Miloš Štejfa, DrSc., FESC (*28. 5. 1929)
- Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční
- REGISTR BRNO – změnila se farmakoterapie po infarktu myokardu v posledních letech?
- Rehabilitace nemocných s ischemickou chorobou srdeční
- Imunosupresivní léčba po transplantaci srdce
- Omyly a chyby v rozpoznání a léčbě chlopenních srdečních vad
- Co nového v hypertenzi?
- Cardiometabolic risk is a threat for the 21st century cardiology
- Dosahování cílových hodnot LDL-cholesterolu v klinické praxi. Poznatky ze studie IN-CROSS
- Ve dvou se to lépe táhne
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční
- Imunosupresivní léčba po transplantaci srdce
- Cardiometabolic risk is a threat for the 21st century cardiology
- Rehabilitace nemocných s ischemickou chorobou srdeční
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



