-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nutriční podpora u nemocných s demencí
Nutritional support in dementia patiens
The article deals with the frequently discussed issue of indicating invasive realimentation in patients dementia, especially in terminal stages of severe dementia, where nothing but natural alimentation is recommended. The conclusion lists the ways of ensuring proper and safe food intake in severe stages of dementia.
Keywords:
dementia – nutrition – PEG – malnutrition – palliative care
Autoři: R. Petrová
Vyšlo v časopise: Geriatrie a Gerontologie 2015, 4, č. 2: 87-91
Kategorie: Přehledové články
Souhrn
Článek se věnuje často diskutované problematice indikace invazivních metod realimentace (PEG) u pacientů s demencí, a to především v terminálních fázích těžké demence, kdy není doporučován jiný způsob alimentace než přirozenou cestou. V závěru jsou uvedeny způsoby podpory správného a bezpečného přijímání stravy v těžkých stadiích demence.
Klíčová slova:
demence – výživa – PEG – malnutrice – paliativní péčeÚvod
Demence se ve většině případů pojí s poruchami výživy, vedoucími k proteinoenergetické malnutrici. Ta zhoršuje kvalitu života a zvyšuje riziko dalších komplikací, především infekčních. Pacienti jsou pak indikováni k podpoře výživy, jejíž formu a metodu určuje ošetřující lékař.
Podpora výživy cestou PEG (perkutánní endoskopické gastrostomie) je jednou z invazivních metod realimentace. Vzhledem k možným komplikacím při zavádění sondové soupravy PEG je nutné dodržovat indikační a kontraindikační kritéria. Podle guidelines ESPEN (Evropské společnosti pro klinickou výživu a metabolismus) by mělo být velmi zřídka indikováno zavádění PEG pacientům s krátkou perspektivou přežití či pokročilou demencí. Dále se zde uvádí, že by PEG neměl být cestou usnadnění péče nebo náhradou dobré ošetřovatelské péče.
V systému současné „vítězné“ technicky vyspělé a dostupné medicíny je však ošetřující lékař pacienta s demencí a poruchami výživy ve smyslu dysfagie mnohdy ovlivněn nemalým tlakem ze strany ošetřujícího personálu a rodinných příslušníků. V důsledku toho je pro něj jednodušší zavést pacientovi PEG než rozhodnout o zahájení paliativní péče a o zajišťování příjmu potravy jinými možnými způsoby bez použití invazivních metod realimentace.
Demence
Demence je progresivní a velkou měrou ireverzibilní klinický syndrom, způsobený nejčastěji neurodegenerativním poškozením mozku. Je charakterizována multifokálním nebo globálním poškozením vyšších kortikálních funkcí, zahrnujících paměť, myšlení, orientaci, chápání, počítání, exekutivní funkce, schopnost učení, jazyk a úsudek(2). Druhotně dochází také k postižení nekognitivních funkcí – zejména k poruchám chování, ztrátě soběstačnosti, poruchám příjmu potravy a v konečném důsledku ke smrti.
Demence lze zhruba dělit do dvou skupin:
- atroficko-degenerativního původu (primární)
- symptomatické (sekundární), kde se etiologicky uplatňují systémové choroby, vaskulární postižení, infekce, intoxikace, úrazy a další léze postihující mozek.
Nejčastější příčinou je Alzheimerova nemoc (50–65 %), druhou nejčastější degenerativní demencí je demence s Lewyho tělísky (10–15 %), vzácnější je skupina frontotemporální demence (5 %). Vaskulární demence ve své čisté formě tvoří 10–15 % všech demencí. Řada pacientů s degenerativními demencemi má současně přítomnou i vaskulární složku, hovoříme pak o demencích smíšených. Zbývajících 10 % tvoří ostatní příčiny demencí.
Obecné příznaky demencí zahrnují 3 základní okruhy postižení:
- Oblast kognitivních (poznávacích) funkcí: poruchy paměti, pozornosti, motivace, vnímání, intelektu, exekutivních funkcí aj.
- Behaviorální a psychologické symptomy demence (BPSD): poruchy chování, nálady, emotivity, spánku apod. Vyskytují se u 70–90 % pacientů s demencí.
- Oblast aktivit denního života: jsou porušeny nejprve složité profesní aktivity, později s progresí demence dochází k postižení i bazálních aktivit, jako je péče o sebe sama, osobní hygiena, oblékání, výživa apod.
K orientačnímu posouzení tíže postižení demencí slouží test tzv. MMSE (Mini-Mental State Examination) s maximem 30 bodů.
Demence a výživa
Se stoupajícím věkem dochází v organismu k fyziologickým změnám, které ovlivňují metabolické procesy ve stáří. Zvyšuje se podíl tukové tkáně, zatímco dochází k poklesu svalové hmoty. Rovněž klesá energetická potřeba, snižuje se pocit hladu a žízně. Tyto fyziologické procesy samy o sobě mohou při nedodržování zásad správné výživy (např. z ekonomických důvodů) vést až k malnutrici. Ve stáří se však přidružují další faktory, které zvyšují riziko vzniku poruch výživy až u 65 % seniorů žijících ve vlastním prostředí a až u 90 % seniorů hospitalizovaných či institucionalizovaných. Tabulka 1 uvádí nejčastější příčiny malnutrice ve stáří(3).
Tab. 1. Příčiny malnutrice ve stáří 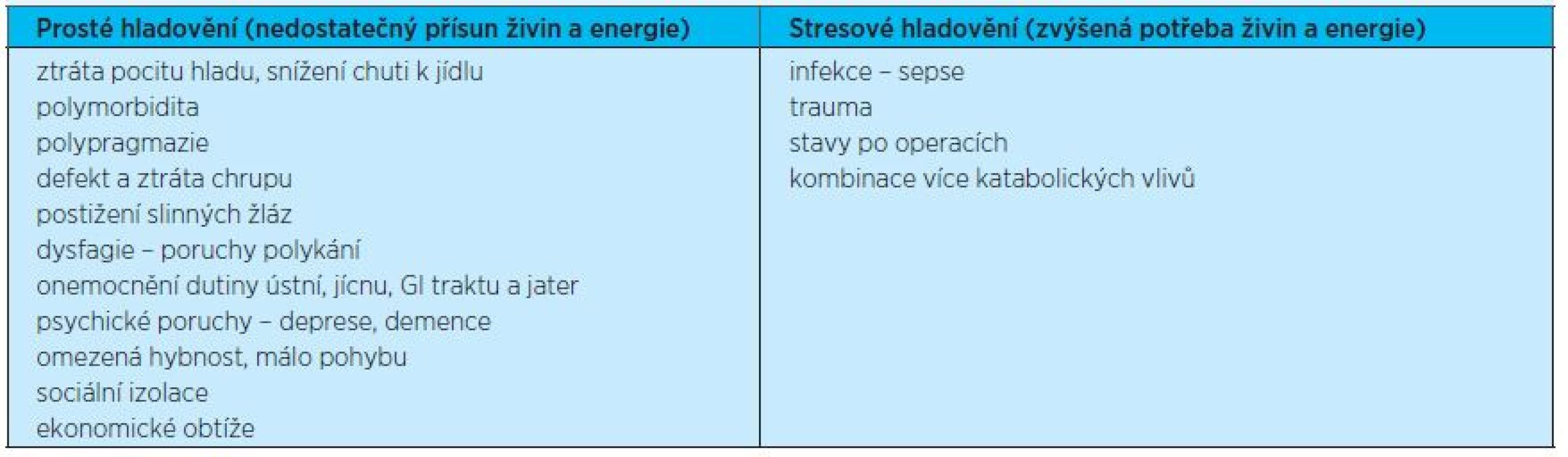
Tab. 2. Indikace zavedení PEG<sup>(4, 9)</sup> 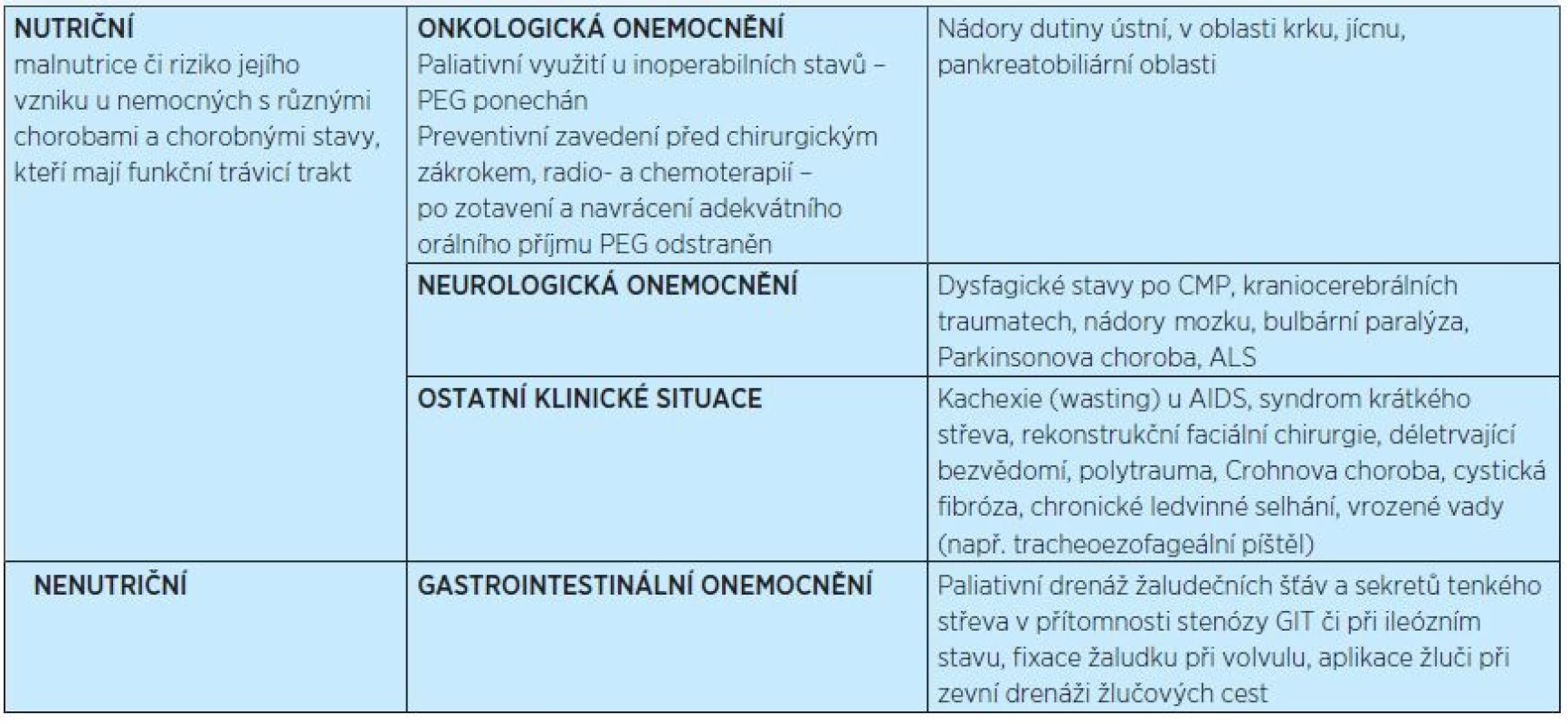
Tab. 3. Kontraindikace zavedení PEG<sup>(4)</sup> 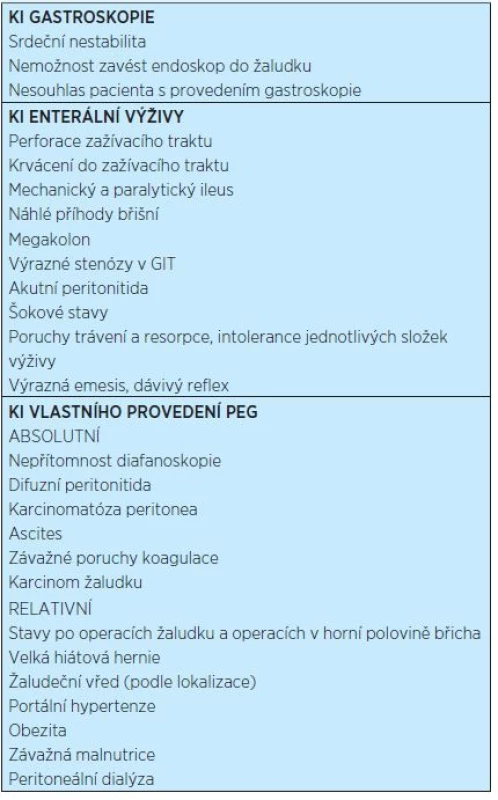
Malnutrice vede u seniora k řadě komplikací (snížená svalová síla, poruchy imunity, snížení mobility, otoky, zhoršené hojení ran, snížená střevní motilita, anemie…), které mohou vzájemně utvořit tzv. circulus vitiosus (bludný, začarovaný kruh) a tím negativně ovlivnit stav a prognózu pacienta.
Téměř u všech pacientů s demencí se v jejím průběhu vyvinou poruchy výživy způsobené především poruchou dostatečného příjmu potravy, kdy v těžkých stadiích onemocnění dominují především poruchy polykání (dysfagie). Polykání je mechanismus, který posouvá potravu z úst do jícnu a žaludku. Jedná se o reflexní děj (polykací reflex) skládající se ze 3 částí (orální, faryngeální, ezofageální). Tento děj je pouze v první fázi částečně ovládán vůlí, ostatní fáze jsou řízeny podkorovými centry CNS a vyžadují přesnou koordinaci práce svalových skupin. Dysfagie u demencí mohou být způsobeny poruchou synchronizace v kterékoli volní či nevolní fázi a často se kombinují. Při dysfagii se zvyšuje riziko aspirace a tím vznik dalších komplikací (chemická pneumonitida, aspirační pneumonie, mechanická obstrukce dýchacích cest)(5).
U Alzheimerovy choroby se uplatňují navíc specifické metabolické změny, jejichž patofyziologické mechanismy nejsou zcela jasné a jež mohou mít souvislost s ovlivněním regulace výdeje energie na centrální úrovni. Sledováním energetické bilance pacientů s tímto onemocněním se prokázal vyšší klidový energetický výdej. K udržení aktivní tělesné hmoty v pokročilých stadiích choroby je tedy u nemocných s Alzheimerovou demencí nutný vyšší energetický příjem(7).
Perkutánní endoskopická gastrostomie
Perkutánní endoskopická gastrostomie (dále jen PEG) je jedním z aplikačních systémů podávání enterální výživy. Moderní sondové soupravy pro PEG jsou vyrobeny z dobře tolerovaného materiálu (polyuretan nebo silikonová guma) a jsou zaváděny v průběhu gastroskopického vyšetření břišní stěnou do žaludku.
Výživa cestou PEG je zvažována v případech, kdy nutriční příjem pacienta je kvalitativně či kvantitativně nedostatečný po dobu delší než 2–3 týdny. Před zavedením PEG by měly být zcela individuálně zváženy přínosy každého případu. V této souvislosti by mělo být zohledněno následující: klinická situace, diagnóza, prognóza, etické otázky, očekávaný vliv na kvalitu života a vlastní přání pacienta(4).
Hlavní otázka, která musí být před zavedením PEG zodpovězena, zní: Je pravděpodobné, že výživa cestou PEG dokáže udržet či zlepšit kvalitu života pacienta? „Zavedení PEG by nemělo být terminálním, či dokonce symbolickým opatřením u pacientů s nepříznivou prognózou nebo neléčitelnou nemocí a je – podle současných poznatků a chápání – velmi zřídka indikováno u pacientů s krátkou perspektivou přežití či pokročilou demencí.“ Toto doporučení je uvedeno v guidelines ESPEN. Dále se zde uvádí: „Zavedení PEG by mělo mít vždy medicínské důvody a naopak nemělo by být nástrojem usnadnění péče – úsporou času, peněz či pracovních sil – stejně jako by neměl být PEG náhradou dobré ošetřovatelské péče.“(6)
Za kontraindikaci PEG se nepovažují:
- věk nemocného
- ventrikuloperitoneální shunt
- Crohnova choroba
- popáleniny
- vřed antra žaludku či duodena
- těhotenství.
Demence a PEG
Poruchy výživy u pacientů s demencí jsou nejvýznamnější v těžkých a terminálních stadiích choroby. K příčinám „prostého hladovění“ přistupuje s progresí choroby ztráta schopnosti od „managementu stravování“ (výběr, nákup, příprava stravy) u lehčích stadií až po neschopnost vlastního samostatného příjmu potravy (používání příborů) s nutností krmení u těžkých demencí. V terminálních stadiích se objevují poruchy polykání a s tím zvýšené riziko komplikací (aspirace, dehydratace, prohloubení podvýživy)(5).
V těchto případech se z hlediska podpory výživy nabízí zahájení realimentace invazivní cestou (nazogastrální sonda, PEG, parenterální výživa…). Je však stále předmětem diskuse, kdy je třeba od tohoto způsobu výživy ustoupit(8). V guidelines ESPEN je jasně vyjádřeno doporučení, že v terminálních stadiích onemocnění, jako je demence, není výživa cestou PEG (natož pak parenterální cestou) indikována(6). Pro ošetřujícího lékaře je však především při objevení se dysfagie a jejích komplikací velmi těžké nepodlehnout nátlaku pečující rodiny nebo ošetřovatelského personálu a neindikovat zavedení soupravy PEG.
Na druhé straně jsou případy, kdy je zahájení realimentace cestou PEG u dementního pacienta správně indikováno, neboť řeší reverzibilní nebo částečně reverzibilní situaci, a ve svém důsledku mnohdy zlepšuje kvalitu dalšího pacientova života. Jedná se o stavy, kdy malnutrice, poruchy příjmu potravy a polykání nejsou ještě způsobeny progresí demence (tzn. demence není v terminální fázi), ale způsobují je jiné, další nebo nově vzniklé komorbidity. Jedná se především o stavy, které vedou ke „stresovému hladovění“ – infekce, sepse, trauma, operace či stavy po cévních mozkových příhodách, které jsou často provázeny reverzibilními poruchami polykání (dysfagiemi). Je na ošetřujícím lékaři, aby posoudil reverzibilitu těchto stavů, a dále zda nově vzniklá situace „neposunula“ fázi demence do těžkého, terminálního stadia. Někdy je to velmi složité, většinou chybí informace o stavu výživy v předchorobí, často se setkáváme s nevzdělaností lékařů a ošetřujícího personálu v oblasti výživy a metabolické péče. Indikují se složité a drahé léčebné postupy (ATB, operace, přípravky na hojení ran atd.), které ve finále nemají žádaný efekt. Přitom by stačilo, zjednodušeně řečeno, dát pacientovi najíst. Je však důležité určit správné složení, množství a formu stravy.
Pokud ošetřující lékař indikuje PEG jako první volbu realimentace, je tento postup chybný. Vždy volíme nejdříve podporu výživy nesondovou cestou – formou sippingu, úpravou stravy, vhodnými potravinovými doplňky atd. V případě, že pacient normální cestou nepřijímá dostatečný objem stravy a energie, není-li v terminální fázi demence či nemáme-li jistotu, že se jedná o ireverzibilní stav, zavádíme nazogastrickou sondu, do které podáváme přesně definované množství sondové stravy. Po týdnu hodnotíme stav a efekt, zároveň se pokoušíme podávat stravu ústy a podporujeme návrat polykacího reflexu. Tento proces opakujeme 2–3 týdny. V případě, že se stav pacienta zlepší (hodnotíme především subjektivní vnímání pacienta, svalovou sílu, mobilitu, zlepšení hojení chronických ran apod., nikoli pouze laboratorní výsledky!), podávání enterální výživy sondou je efektivní, ale polykací akt nefunguje, indikujeme zavedení sondy PEG k dlouhodobé výživě sondovou stravou.
Výživa u těžké a terminální demence
Správná a dostatečná výživa je jedním z velmi důležitých zdravotních aspektů ve zvládání progresivní choroby demence. V průběhu demence nastávají specifické poruchy příjmu potravy závislé na tíži poruchy kognitivních funkcí a postižení CNS. Tabulka 4 přehledně ukazuje poruchy příjmu potravy z hlediska stadií demence.
Tab. 4. Poruchy příjmu potravy z hlediska stadií demence 
V těžkých a terminálních fázích demence se setkáváme s těmito konkrétními problémy a potížemi při stravování(1):
- Pacient necítí stravu, kterou má v ústech, nebo se chová, jako by o ní nevěděl.
- Pokud má stravu v ústech, nic s ní nedělá, jen ji v ústech drží.
- Špatně stravu kouše a neposunuje ji v soustech dozadu směrem k hltanu.
- Vyplivuje nebo vystrkuje kousky stravy z úst.
- Jí velmi rychle a dává si do úst příliš velká sousta.
- Jí nedostatečně, odmítá potravu, brzy s jídlem přestává, nechce dále jíst či pít.
- Povídá s plnou pusou, zapomíná polykat, kašle.
- Kašle, fouká do jídla nebo do pití.
- I po spolknutí sousta či doušku má vlhký „kloktavý“ hlas.
- Má potíže s polykáním tablet.
- „Kloktá“ tekutiny, místo, aby je polykal.
V těžkých a terminálních fázích demence, kdy není indikován jiný způsob alimentace než přirozenou cestou, je nezbytné podporovat správné a bezpečné přijímání stravy.
Platí tyto obecné zásady(1):
- Pacient má při jídle pokud možno sedět, bradu má držet co nejníže (při záklonu se otevírá epiglottis – snáze hrozí vdechnutí). V případě ležícího pacienta je nutné při jídle zvednout podhlavní část lůžka tak, aby hlava byla alespoň o 10–20 cm výše než žaludek. V této poloze je třeba pacienta ponechat nejméně 30 minut po jídle.
- Sousta mají být malá.
- Střídat jídlo s pitím (snazší vyprázdnění dutiny ústní).
- Podněcovat pacienta, aby správně a důkladně polykal, i několikrát za sebou jedno sousto.
- Jestliže po polknutí zůstává stále jídlo v ústech, podat prázdnou lžičku, tak se snáze vyprovokuje další polknutí.
- Po skončení jídla zkontrolovat dutinu ústní, neponechávat zbytky jídla a tekutin v DÚ – hrozí aspirace!
Dále platí zásada přizpůsobení formy jídla potížím pacienta s dysfagií(1):
- Jídlo musí pacientovi chutnat – zjistit, co dříve rád jedl, které druhy preferoval a které méně, v těžkých stadiích demence je v zájmu pacienta dostatečný příjem živin a energie oproti dodržování zásad zdravé výživy (není třeba důsledně dodržovat diabetickou dietu, nízkocholesterolovou dietu atd.).
- Nejsnáze se polyká kašovitá, vazká strava.
- Nejhůře se polyká následující strava:tekutiny s kousky masa, zeleniny (polévky), vločky v mléce atd. potraviny houževnaté konzistence – zelí, slanina, tuhé maso s dlouhými vlákny atd. jemné lístky – salát drobné a tuhé kousky – oříšky, kukuřice, hrášek, čočka, rýže.
- Tablety je třeba drtit nebo dávat přednost tekuté formě (kapky, sirupy).
- Tekutiny lze změnit na konzistenci jogurtu či kaše díky různým přípravkům, které dodávají potravinářské i farmaceutické firmy (např. Nutilis firmy Nutricia).
Závěr
Pacienti s demencí mohou trpět poruchami výživy ve všech stadiích onemocnění, zvláště pak v těžké a terminální fázi, kdy často přistupují i poruchy polykání (dysfagie). Je nezbytně nutné poruchám výživy předcházet, eventuálně včas diagnostikovat a léčit. Léčba spočívá v neinvazivních metodách realimentace. Pokud jsou poruchy výživy a polykání způsobeny progresí demence (těžká stadia), není indikována alimentace cestou zavedení sondové soupravy PEG, neboť progrese choroby se nezastaví a nezlepší se kvalita života pacienta. Na druhou stranu u pacientů v lehčích stadiích demence mohou nastat reverzibilní poruchy výživy při komorbiditách způsobujících „stresové hladovění“ (infekce, trauma, operace atd.) nebo při vzniku poruch polykání po CMP. Zde je na zvážení ošetřujícího lékaře při splnění indikačních a kontraindikačních kritérií, zda nechá zavést sondovou soupravu PEG. V případě nejistoty je vhodné provést „zkoušku“ přechodně zavedenou sondou nazogastrickou.
V každém případě je nezbytné, aby při rozhodování o způsobu výživy u dementních pacientů byly známy tyto skutečnosti:
- typ a stadium demence
- příčina poruch příjmu stravy, event. malnutrice a délka trvání.
Nelze jednoznačně říci, že u dementních pacientů není alimentace cestou PEG nikdy indikována. Je třeba zvažovat každý případ individuálně a na mysli mít především pacientovu osobu, kvalitu jeho dalšího života a právo na důstojné umírání.
Autorka prohlašuje, že v souvislosti s publikací článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny farmaceutickou firmou.
MUDr. Renáta Petrová
1Léčebna dlouhodobě nemocných Městská nemocnice Hořice
2Geriatrická ambulance, Medicentrum Praha
MUDr. Renáta Petrová
e-mail: geriatrie@ordinace-petrova.cz
Atestovala v oboru vnitřní lékařství, v roce 2002 v oboru geriatrie. V roce 2005 získala funkční licenci, v roce 2012 zvláštní odbornou způsobilost v oborech Klinická výživa a metabolická péče a Paliativní medicína. V současnosti vede Geriatrickou ambulanci v Medicentru Praha a je primářkou LDN v Městské nemocnici Hořice.
Zdroje
1. Holmerová I, Jarolímová E, Suchá J, a kol: Péče o pacienty s kognitivní poruchou. Česká alzheimerovská společnost a Gerontologické centrum, 2009.
2. Jirák R, Laňková J: Demence. Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře, 2007.
3. Jurášková B, Hrnčiariková D, Holmerová I, Kalvach Z: Poruchy výživy ve stáří. Medicína pro praxi 2007; 4(11): 443–446.
4. Kohout P, Kotrlíková E: Základy klinické výživy, sv. I. Forsapi: Praha 2009.
5. Kubešová H, Weber P: Poruchy příjmu potravy ve stáří. Interní medicína pro praxi 2008. 10(2): 64–68.
6. Löser, et al.: Doporučení ESPEN k umělé enterální výživě – Perkutánní endoskopické gastrostomii (PEG). Clinical Nutrition 2005.
7. Těšínský P: Poruchy výživy u Alzheimerovy demence a možnosti jejich ovlivnění. Psychiatrie pro praxi 2003; 6 : 248–253.
8. Volicer L: Paliativní přístupy k pacientům s demencí. Česká geriatrická revue 2003; 2 : 16–19.
9. Wilhelm Z, a kol.: Výživa v onkologii. NCO NZO: Brno 2004.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Editorial
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2015 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Atypický průběh disekce hrudní aorty u 80leté ženy
- Geriatrie 2015 v Evropě a u nás
-
Recenze knihy:
Ošetřovatelství v geriatrii – hodnoticí nástroje - Editorial
- Jsou senioři s duševní poruchou více nemocní a medicínsky náročnější?
- Vnímání psychické dimenze kvality života seniory s chronickou nenádorovou bolestí
- Chronické srdeční selhání – specifika léčby seniorů
- Chronická pankreatitida ve stáří
- Nutriční podpora u nemocných s demencí
- Recenze anglické směrnice o omezovacích prostředcích
- Využití podtlakové terapie v lokální terapii chronických a obtížně hojitelných ran
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronická pankreatitida ve stáří
- Nutriční podpora u nemocných s demencí
- Chronické srdeční selhání – specifika léčby seniorů
- Atypický průběh disekce hrudní aorty u 80leté ženy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




