-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sledování rezistence chřipkových virů na oseltamivir – naše dosavadní zkušenosti
Monitoring influenza virus oseltamivir resistance – our experience to date
Objective: The monitoring of influenza virus resistance is a routine part of influenza virus surveillance conducted by the National Reference Laboratory for Influenza and Non-Influenza Respiratory Viral Diseases (NRL/INI) at the National Institute of Public Health (NIPH). The aim is to detect neuraminidase inhibitor (oseltamivir) resistance in patients diagnosed with influenza.
Material and methods: A total of 326 influenza virus isolates from tissue culture were included in the study. They were obtained from inpatient and outpatient nasopharyngeal swabs which were referred to the NRL/INI during the seasons 2013/2014 to 2019/2020 and turned out to be RTPCR (reverse transcription polymerase chain reaction) positive for RNA (ribonucleic acid) of influenza virus A or B. The MDCK (Madin-Darby canine kidney) tissue culture cells were used for virus isolation from nasopharyngeal swabs. Oseltamivir resistance was tested using the NA-Star Influenza Neuraminidase Inhibitor Resistance Detection Kit (Applied Biosystems, Foster City, CA).
Results: Nine of 326 positive specimens were oseltamivir resistant. Resistant strains showed IC50 values 100 times as high on average as those in oseltamivir sensitive strains.
Conclusions: Monitoring influenza virus resistance is helpful in controlling reasonable prescription of antivirals and thus becomes an integral part of influenza virus surveillance. Antiviral resistance monitoring is necessary not only in hospitalized patients on antivirals but also in symptomatically treated outpatients as the detection of antiviral drug resistant strains in the latter group can suggest the emergence and/or spread of antiviral drug resistance in the population.
Keywords:
surveillance – Mutation – resistance – influenza A and B – oseltamivir
Autoři: Lucie Nováková; M. Havlíčková
Působiště autorů: Státní zdravotní ústav, Centrum epidemiologie a mikrobiologie, Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 4, s. 241-246
Kategorie: Původní práce
Souhrn
Cíl práce: Sledování rezistence chřipkových virů patří k rutinní součásti surveillance viru chřipky v Národní referenční laboratoři pro chřipku a nechřipková respirační virová onemocnění (NRL/CHNCH) ve Státním zdravotním ústavu Praha (SZÚ). Cílem práce je prokázání rezistence k inhibitoru neuraminidázy (oseltamiviru) u pacientů s diagnostikovaným onemocněním chřipkou.
Materiál a metodika: Vyšetřovaný soubor tvořilo 326 virů chřipky izolovaných na tkáňové kultuře. Zdrojem izolátů byly nazofaryngeální stěry hospitalizovaných i ambulantních pacientů, které byly doručeny do NRL/CHNCH v průběhu sezon 2013/2014 až 2019/2020 a u nichž byla polymerázovou řetězovou reakcí s reverzní transkripcí (RTPCR) prokázána přítomnost ribonukleové kyseliny (RNA) virů chřipky A a B. Pro izolaci virů z nazofaryngeálních stěrů byla použita tkáňová kultura MDCK (Madin-Darby canine kidney). Rezistence na oseltamivir byla vyšetřována pomocí kitu NA-Star Influenza Neuraminidase Inhibitor Resistance Detection Kit (Applied Biosystems, Foster City, CA).
Výsledky: U devíti z 326 vyšetřených pozitivních materiálů byla prokázána rezistence na oseltamivir. Hodnoty inhibiční koncentrace (IC50) u rezistentních kmenů byly v průměru 100krát vyšší než u kmenů citlivých na oseltamivir.
Závěry: Sledování rezistentních chřipkových kmenů pomáhá kontrolovat účelnou indikaci antivirotik, a proto se v současnosti stává neoddělitelnou součástí virologické surveillance chřipkového viru. Sledování rezistence na antivirotika je nezbytné nejen u hospitalizovaných pacientů s antivirotickou léčbou, ale i u symptomaticky léčených ambulantních pacientů, neboť průkaz kmenů rezistentních na antivirotika v této skupině může signalizovat šíření rezistentního chřipkového kmene v populaci.
Klíčová slova:
mutace – surveillance – rezistence – chřipka A a B – oseltamivir
ÚVOD
Hemaglutinin (HA) a neuraminidáza (NA) jsou základní membránové glykoproteiny chřipkového viru. HA zprostředkovává vstup viru do hostitelské buňky prostřednictvím vazby virové partikule na glykoproteiny obsahující kyselinu sialovou. Kromě toho je HA hlavním antigenem, proti němuž jsou tvořeny obranné virus neutralizační protilátky, které brání nákaze antigenně shodným virem. Jeho název vyplývá ze schopnosti aglutinovat červené krvinky in vitro. NA (sialidáza) má enzymatickou aktivitu. Štěpí glykosidickou vazbu kyseliny sialové, čímž umožní virionům proniknout k buňkám. Kromě toho se NA uplatňuje na konci replikačního cyklu, kdy enzymaticky zajišťuje uvolňování virionů z buňky, a podporuje tak jejich další šíření [1, 2, 3, 4]. Oba glykoproteiny jsou velmi proměnlivé a podmiňují rozlišování antigenních subtypů a variant chřipkového viru. Do dnešní doby bylo identifikováno 18 různých typů HA (H1 až H18) a 11 různých typů NA (N1 až N11) [5, 6].
Při léčbě chřipkového onemocnění se využívají antivirové preparáty, které můžeme na základě jejich mechanismu účinku rozdělit do několika skupin:
1. generace: inhibitory M2 proteinu: adamantany (amantadin a rimantadin)
2. generace: inhibitory neuraminidázy (oseltamivir, zanamivir, peramivir, laninamivir)
3. generace: inhibitory RNA-dependentní RNA polymerázy (favipiravir)
4. generace: inhibitory cap-dependentní endonukleázy (baloxavir)
Adamantany fungují jako inhibitory proteinového kanálu M2 chřipky typu A, a způsobují tak zastavení replikace viru. V praxi však představoval problémem snadný vznik rezistence na adamantany a navíc tyto preparáty nefungovaly na léčbu viru chřipky typu B. Ten má sice BM2 protein podobný M2 proteinu, ale není citlivý na M2 inhibitory [7]. Adamantany proto byly postupně zcela nahrazeny inhibitory neuraminidázy.
Inhibitory neuraminidázy odštěpují v místě sialové vazby cukernou skupinu z glykokonjugátu na povrchu viru, a dochází tak k přerušení replikace viru. Dále znemožňují výstup virů z infikované buňky a rozptýlení infikovaných částic na další buňky. Jsou účinné jak proti viru chřipky A, tak i viru chřipky typu B a jsou velmi dobře tolerovány. Mohou být využity i pro profylaktické podání osobám, které se setkaly s chřipkovým onemocněním [8]. Řadí se sem oseltamivir, zanamivir, peramivir a laninamivir [9, 10]. V České republice (ČR) je registrován oseltamivir, zanamivir a peramivir, ale aktuálně jsou k dispozici pouze první dva přípravky [11]. Oseltamivir (komerční název např. Tamiflu, Segosana, Ebilfumin) má perorální užití a je schválen pro všechny věkové skupiny. Zanamivir (komerční název např. Relenza, Dectova) se aplikuje inhalačně a je pouze pro osoby starší 5 let. Pro oba přípravky platí nutnost podání první dávky do 48 hodin od prvních příznaků [10]. Peramivir (komerční název např. Alpivab, Rapivab; intravenózní použití) se využívá pouze pro léčbu a ne k profylaxi a v současné době je k dispozici v Anglii, USA, Japonsku, Jižní Koreji a Číně [10, 12]. Laninamivir (komerční název např. Inavir; inhalační aplikace) není v ČR registrován, využívá se zatím pouze v Japonsku. Kromě léčby je schválen i pro profylaxi a působí i na kmeny, které jsou rezistentní na oseltamivir [13, 14].
Dalším léčivem, které je nově schváleno v ČR, je baloxavir (komerční název Xofluza) [11]. Baloxavir inhibuje cap-dependentní endonukleázu, enzym nezbytný pro transkripci a replikaci chřipkového viru [15]. Je schválen k léčbě nekomplikované chřipky u pacientů nad 12 let. Podává se perorálně, a to nejpozději, jako u jiných antivirových preparátů, do 48 hodin od prvních příznaků. Kromě kurativy je schválený i pro profylaxi [16].
Slibným antivirovým preparátem další generace schváleným v Japonsku, který působí nejen na viry chřipky A, B a C, ale i na mnohé další RNA viry (Noroviry, Paramyxoviry, Flaviviry, virus Eboly atd.), je favipiravir – orální pyrazinecarboxamid, jehož antivirový efekt je založen na inhibici RNA-dependentní RNA polymerázy. Velkou výhodou tohoto preparátu, stejně jako u baloxaviru, je možnost jeho použití i tam, kde inhibitory neuraminidázy selhávají. Bylo popsáno i jeho synergické působení v kombinaci s oseltamivirem [17, 18, 19]. Účinky tohoto preparátu se zkoušely i na SARSCoV2 [20]. Negativum favipiraviru je, že preparát je teratogenní a může působit toxicky na embryo [21].
Kromě těchto popsaných 4 skupin inhibitorů se stále vyvíjejí a testují další skupiny antivirotik např. DAS181, arbidol (hojně používaný v Rusku a Číně, ale bez prokázaného účinku), nitazoxanid nebo pimodivir [22, 23, 24, 25].
Masivnější používání inhibitorů neuraminidázy s sebou přineslo nutnost průběžného sledování případné rezistence na antivirotika stejně jako u antibiotik. K dispozici jsou dva testovací přístupy: sekvenace neuraminidázových a hemaglutinačních genů (genotypové testování) a dále testy založené na měření enzymatické aktivity neuraminidázy (fenotypové testování). Jednodušší a zatím v praxi používanější metodou měření citlivosti virů chřipky vůči inhibitorům neuraminidázy jsou enzymatické fenotypové testy.
První fenotypový test (MUNANA) využívá jako fluorescenční substrát, kyselinu 20(4-methylumbelliferyl)-a-D-N-acetylneuraminidázovou. Druhý možný fenotypový přístup (NA-Star) pracuje s chemiluminiscenčním substrátem, kyselinou 20(4NA-Star)-a-D-N-acetylneuraminidázovou [26]. Oba testy kalkulují tzv. hodnoty inhibiční koncentrace (IC50), tj. koncentrace inhibitoru, při které za daných podmínek dochází k 50% poklesu aktivity sledovaného enzymu [27]. Výhodné je zvolit oba přístupy zároveň. Hlavním důvodem jsou neznámé mutace vedoucí k antivirové rezistenci. Fenotypové testy nám mohou ukázat nové změny v genomu a rovněž poukázat i na částečně rezistentní vzorky, které na základě doposud známých sekvenačních změn vedoucích k rezistenci na jednotlivá antivirotika, nemusí být rozpoznány.
MATERIÁL A METODY
Vyšetřovaný soubor tvořilo 326 virů chřipky izolovaných na tkáňové kultuře. Zdrojem izolátů byly nazofaryngeální stěry hospitalizovaných i ambulantních pacientů, které byly doručeny do NRL/CHNCH v průběhu sezon 2013/2014 až 2019/2020, a u nichž byla RTPCR prokázána přítomnost RNA virů chřipky A a B. Pro účely stanovení rezistence na oseltamivir byly vhodné izoláty virů chřipky s hemaglutinačním titrem minimálně 1 : 16. Rezistence byla vyšetřena pomocí kitu NA-STAR a výsledky zpracovány softwarem MyAssays Analysis Software Solutions [28].
Kultivace viru chřipky na tkáňové kultuře MDCK
Účelem metody kultivace viru chřipky na tkáňových kulturách je pomnožení viru z klinického materiálu na vnímavých buňkách. Přítomnost viru v buněčné kultuře je prokázána pomocí hemadsorpčního testu, pro určení množství viru v izolátu slouží metoda titrace hemaglutininu. Oba testy se provádějí s 0,5% roztokem morčecích erytrocytů [29]. Pro kultivaci virů chřipky se používá kontinuální linie MDCK buněk připravená Laboratoří pro tkáňové kultury SZÚ (LTK), tkáňové kultivační médium UltraMDCK™ Serum-free Medium (LONZA), TPCK-trypsin a L-Glutamin 200 mM. První den pokusu se buněčná suspenze o hustotě 350 000 buněk/1 ml nasadila do 96 jamkových mikrotitračních destiček v objemu 0,1 ml/ jamku. Destička se umístila do inkubátoru (37 °C, 5 % CO2). Druhý den se po mikroskopické kontrole konfluentního monolayeru (souvislá jednoduchá vrstva na povrchu kultivační destičky) a odsátí média z jamky inokuloval vyšetřovaný materiál v objemu 0,05 ml na jamku. Po centrifugaci destičky (3 500 otáček/minutu, 15 minut) se k inokulu doplnilo 0,15 ml média pro tkáňové kultury s přidaným trypsinem a destičky se umístily zpět do inkubátoru na 5–6 dní.
NA-STAR
Rezistence na oseltamivir byla vyšetřována kitem NA-Star Influenza Neuraminidase Inhibitor Resistance Detection Kit (Applied Biosystems, Foster City, CA), který doporučuje Světová zdravotnická organizace. Skládá se z NA-Star Substrate (10 mM koncentrace), NA-Star Assay Buffer (26 mM Morpholinoethanesulfonic acid, 4 mM CaCL2), NA-Star Accelerator a 96 jamkových destiček. Dodržoval se postup podle protokolu, který je součástí kitu.
K provedení testu bylo nutné nejprve naředit jednotlivé chřipkové kmeny v poměru 1 : 5 pufrem NA-Star Assay Buffer a připravit 10 roztoků inhibitoru neuraminidázy (koncentrace: 2000; 633; 200; 63,4; 20; 6,3; 2; 0,64; 0,20; 0,06 nM) podle návodu výrobce. K 25 μl naředěného kmene se napipetovalo 25 μl příslušného roztoku inhibitoru neuraminidázy, následovala inkubace 10–20 minut při teplotě 37 °C. Potom bylo přidáno 10 μl NASTAR Substrate a opět proběhla inkubace (10–30 minut při pokojové teplotě). Po jejím skončení se destička umístila do luminometru INFINITE 200 PRO (TECAN), ovládaného prostřednictvím počítače a softwaru iControl. V dalším kroku injektor vstříknul do každé jamky 60 μl NASTAR Accelerator, v důsledku čehož došlo k uvolnění světelného signálu, který byl následně změřen. Naměřená data byla exportována do MS Excel. Pro výpočet IC50 byl použit software MyAssays Analysis Software Solutions [28].
VÝSLEDKY
Během sezon 2013/2014 až 2019/2020 bylo vyšetřeno na rezistenci celkem 326 (130x H1N1, 146x H3N2 a 50x B) pozitivních materiálů od ambulantních i hospitalizovaných pacientů. Zároveň s těmito materiály byly vyšetřeny referenční kmeny získané z WHO. Jednalo se o kmeny A/Texas/23/2012 (H1N1), A/Texas/12/2007 (H3N2), B/Rochester/02/2001 a B/Memphis/20/1996. Jednotlivé vzorky byly vždy testovány duplicitně a následně vyhodnoceny softwarem MyAssays Analysis Software Solutions.
Od roku 2013, kdy se začala rezistence na oseltamivir v NRL/CHNCH vyšetřovat, bylo zachyceno celkem devět rezistentních kmenů a čtyři kmeny (1x H1N1, 1x H3N2 a 2x B), u kterých byla pozorována redukovaná inhibice (obr. 1 a 2). U rezistentních kmenů na oseltamivir se v pěti případech jednalo o pacienty, u kterých bylo prokázáno onemocnění chřipkou typu A/H1N1, v jednom případě byla rezistence detekována u viru chřipky typu A/H3N2 a ve třech případech u viru chřipky typu B. Tyto rezistentní kmeny byly izolovány od hospitalizovaných pacientů se závažným průběhem chřipky a během léčby užívali lék Tamiflu. Naměřené hodnoty IC50 rezistentních kmenů byly v průměru 100krát vyšší než u vzorků citlivých na oseltamivir a rovněž výsledné křivky rezistentních kmenů se lišily od těch citlivých kmenů. Rezistentní kmeny viru chřipky typu A/H1N1 byly následně sekvenovány. Sekvenace prokázala přítomnost mutace H275Y, která je typická pro subtyp H1N1 a je zodpovědná za rezistenci na oseltamivir.
Obr. 1. Graf rezistence na oseltamivir: rezistentní kmeny viru chřipky A/H1N1
Figure 1. Graph of oseltamivir resistance: resistant strains of influenza A/H1N1 virus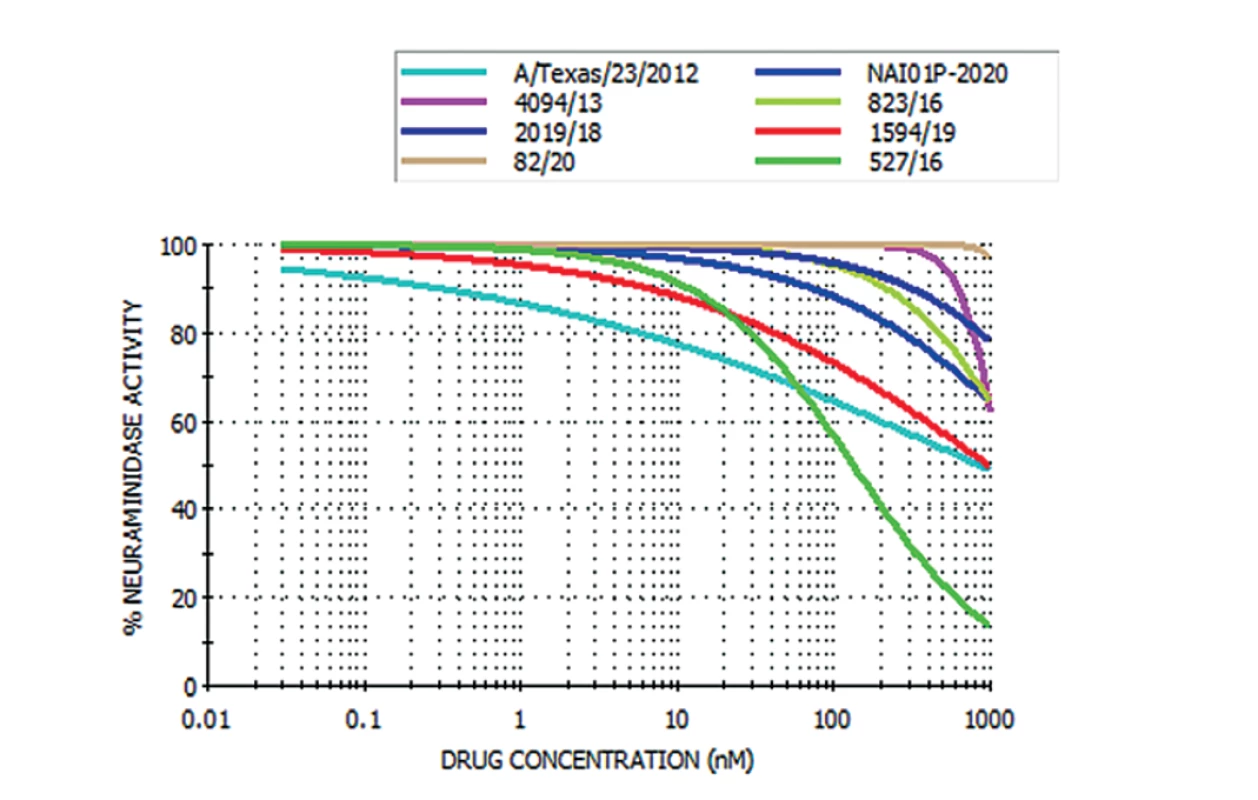
Obr. 2. Graf rezistence na oseltamivir: rezistentní kmeny viru chřipky A/H3N2 a B
Figure 2. Graph of oseltamivir resistance: resistant strains of influenza A/H3N2 virus and B strains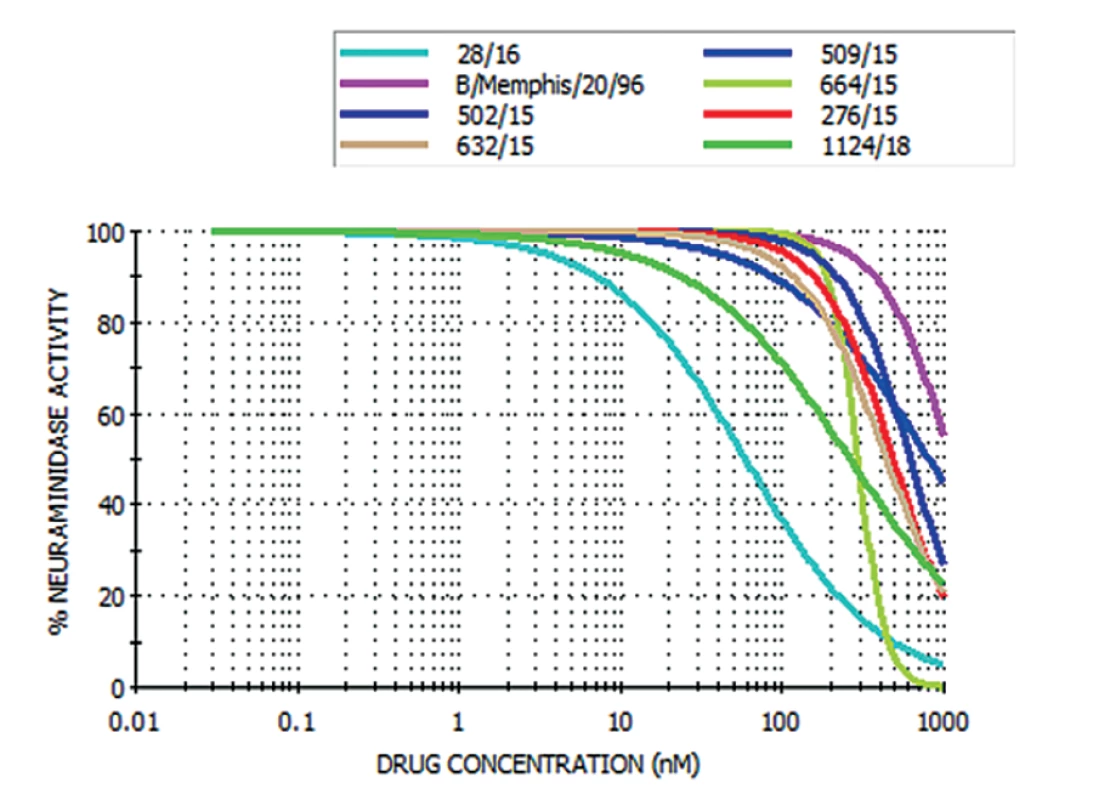
DISKUSE A ZÁVĚR
Antivirová terapie chřipkového onemocnění s sebou přinesla i možnost rozvoje rezistence na antivirotika. Adamantany jsou v současné době zcela překonané, recentně cirkulující viry chřipky jsou ve více než v 90 % nositeli mutace S31N, a tedy jsou vůči nim zcela rezistentní [30, 31].
V posledních letech se začínají objevovat i kmeny rezistentní na oseltamivir nebo zanamivir. Na počátku roku 2008 se norské úřady poprvé zmínily o vysoké míře odolnosti viru na oseltamivir. Během roku 2007 bylo v Norsku testováno 37 izolátů viru chřipky A (H1N1) a 26 (70 %) z nich bylo rezistentních na oseltamivir. Během sezony 2007/2008 byly tyto rezistence zjištěny i v dalších evropských zemích, a to s různou prevalencí (0–70 %). Nejvíce rezistentních kmenů na oseltamivir bylo zachyceno ve Francii, Norsku, Portugalsku a Finsku [32]. Tato epizoda byla časově omezená a její příčiny nebylo možné blíže specifikovat. Aktuální data týkající se zejména rezistence na inhibitory neuraminidázy jsou pravidelně zveřejňována na stránkách Evropského střediska pro prevenci a kontrolu nemocí (ECDC) i Světové zdravotnické organizace (WHO). Zatím se nejedná zdaleka o takové množství rezistentních inhibitorů neuraminidázy jako u skupiny adamantanů. Během jednotlivých sezon byl prokázán minimální počet případů [12, 33, 34]. Počet rezistentních chřipkových kmenů se pohybuje v intervalu od 1 % do 3 %. Rezistence na oseltamivir a zanamivir je způsobená mutacemi neuraminidázy, které se u jednotlivých (sub)typů viru chřipky liší. Například u subtypu A/H1N1 je nejznámější mutace H275Y, pro subtyp A/H3N2 je typická mutace E119V a u viru chřipky typu B se jedná o mutaci R371K [33]. Avšak ne všechny mutace jsou známé a z tohoto důvodu je nezbytné provádět oba typy testů – fylogenetický screening a sekvenaci tam, kde se screeningový výsledek vymyká předpokládaným hodnotám.
V Japonsku proběhla studie, ve které byla porovnávána jednotlivá antivirotika (oseltamivir, zanamivir, laninamivir a peramivir) při léčbě různých subtypů chřipky. U lidí, kteří onemocněli virem chřipky subtypu A/H3N2, z daných preparátů nejrychleji zabíral peramivir. Průměrná doba, za kterou teplota klesla pod 37,5 °C, byla 17 hodin. Naopak u pacientů, u kterých byl prokázán subtyp A/H1N1, nejlépe účinkovaly oseltamivir a zanamivir [13]. V další srovnávací studii zkoumali rozdíl mezi baloxavirem, oseltamivirem a placebo efektem. U skupiny lidí, kteří byli léčeni baloxavirem, bylo prokázáno významné zkrácení doby do zmírnění příznaků oproti placebu. Srovnání skupiny s baloxavirem a skupiny s oseltamivirem neprokázalo žádný statisticky významný rozdíl [16].
V NRL/CHNCH bylo za sedm vyšetřovaných sezon zachyceno devět kmenů virů chřipky zcela rezistentních na oseltamivir. Tyto izoláty byly získány od pacientů, kteří byli hospitalizováni s těžším průběhem chřipky. U dvou pacientů s hematoonkologickou diagnózou, kteří onemocněli chřipkovým onemocněním, měla nemoc fatální průběh. Právě „rizikové“ skupiny lidí (např. malé děti do 5 let, hematoonkologičtí a imunokompromitovaní pacienti a lidé po transplantaci) často onemocní kmenem chřipky, který nese zmutovaný gen H275Y a je zodpovědný za to, že je oseltamivir bez účinku [35, 36].
Indikace oseltamiviru je v ČR velmi střídmá a je téměř výlučně vázána na případy hospitalizovaných pacientů s těžším průběhem infekce. Tento postup lze vnímat jako správný, má však svá úskalí. Největší problém v těchto situacích je skutečnost, že antivirová léčba je nasazována relativně pozdě – často za více než 48 hodin od prvních příznaků. Rovněž nutnost perorálního podání preparátu je nevýhodou, neboť u mnohých pacientů je složitě proveditelné. Je proto důležité, aby byla v ČR dostupná i intravenózně aplikovatelná forma, která by terapeutické možnosti nepochybně zlepšila.
Sledování kmenů virů chřipky rezistentních na antivirotika pomáhá kontrolovat účelnou indikaci preparátu a v současné době se stává neoddělitelnou součástí virologické surveillance chřipkového viru. Je nutné kontrolovat potenciálně imunosuprimované pacienty na rezistenci na antivirotika. Při hospitalizaci a antivirové léčbě se tato antivirová rezistence objevuje častěji než u jedinců, u nichž infekce probíhá pod obvyklým klinickým obrazem a kteří jsou léčeni ambulantně. Pro získání komplexního přehledu o cirkulaci rezistentních kmenů v populaci je důležité sledování ambulantních pacientů. Záchyt rezistentních chřipkových kmenů právě u těchto pacientů, kteří nejsou léčeni antivirotiky, může signalizovat šíření rezistentního kmene v populaci. V případě záchytu více jak 5 % rezistentních chřipkových kmenů u ambulantních pacientů, musí NRL/ CHNCH informovat WHO a ECDC.
Věnování
Ráda bych tento článek věnovala mé školitelce, učitelce a kolegyni MUDr. Martině Havlíčkové, CSc., která mě od mého nástupu do Národní referenční laboratoře pro chřipku a nechřipková respirační onemocnění zasvěcovala do problematiky rezistencí na antivirotika, vedla mě a dávala mi užitečné rady. Tento článek jsme psaly dohromady, ale okolnosti nepřály tomu, abychom ho i společně dokončily.
MUDr. Martina Havlíčková, CSc., se celý svůj profesní život věnovala problematice respiračních virů. Po absolvování studia medicíny na Univerzitě Karlově v roce 1986 nastoupila do Státního zdravotního ústavu. V letech 1997–2013 vedla Národní chřipkové centrum, od roku 2013 byla vedoucí Národní referenční laboratoře pro chřipku a nechřipková respirační onemocnění a v letech 2012–2019 vedoucí Oddělení respiračních, střevních a exantematických virových nákaz Státního zdravotního ústavu. Dále byla členkou výboru Společnosti pro epidemiologii a mikrobiologii České lékařské společnosti J. E. Purkyně a opakovaně zastupovala Českou republiku na mezivládních jednáních na WHO v Ženevě a v ECDC ve Stockholmu. Bylo mi ctí s ní pracovat.
Do redakce došlo dne 4. 8. 2021.
Adresa pro korespondenci:
Mgr. Ludmila Nováková
SZÚ Praha Šrobárova 48/49
100 00 Praha 10
e-mail: ludmila.novakova@szu.cz
Zdroje
1. Webster RG, Bean WJ, Gorman OT, et al. Evolution and ecology of influenza A viruses. Microbiological Reviews, 1992;56 : 152–179.
2. Gubareva LV, Kaiser L, Hayden FG. Influenza virus neuraminidase inhibitors. The Lancet, 2000;355 : 827–835.
3. Lamb RA, Krug RM. Orthomyxoviridae: The viruses and their replication. In: Knipe, DM, Howley PM, Griffin DE., Eds., Fields Virology, Lippincott Williams & Wilkins, 2001, 4th edition, pp. 1487–1531.
4. McKimm-Breschkin JL. Influenza neuraminidase inhibitors: antiviral action and mechanisms of resistance. Influenza and Other Respiratory Viruses, 2012;7(1):25–36.
5. Li Q, Sun X, Li Z, et al. Structural and functional characterization of neuraminidase-like molecule N10 derived from bat influenza A virus. Proceedings of the National Academy of Sciences of the United States of America, 2012;109(46):18897–18902.
6. Wu Y, Wu Y, Tefsen B, et al. Bat-derived influenza-like viruses H17N10 and H18N11. Trends in Microbiology, 2014;22(4):183 – 191.
7. Rosenberg MR, Casarotto MG. Coexistence of two adamantane binding sites in the influenza A M2 ion channel. PNAS, 2010;107(31):13866–13871.
8. Adabala PJ, LeGresley EB, Bance N, et al. Exploitation of the catalytic site and 150 cavity for design of influenza A neuraminidase inhibitors. The Journal of Organic Chemistry, 2013; 78(21):10867 – 10877.
9. Singh A, Soliman ME. Understanding the cross-resistance of oseltamivir to H1N1 and H5N1 influenza A neuraminidase mutations using multidimensional computational analyse. Drug Design, Development and Therapy, 2015;9 : 4137–4154.
10. Lampejo T. Influenza and antiviral resistence: an overview. European Journal of Clinical Microbiology & Infectious Diseases, 2020;39 : 1201–1208.
11. Státní ústav pro kontrolu léčiv [online]. Dostupné zwww: https://www.sukl.cz/.
12. Takashita E, Ejima M, Itoh R, et al. A community cluster of influenza A (H1N1)pdm09 virus exhibiting cross-resistance to oseltamivir and peramivir in Japan, November to December 2013. Eurosurveillance, 2014;19(1):pii=20666. Dostupné na www: http://www.eurosurveillance. org/ViewArticle.aspx?ArticleId= 20666.
13. Shobugawa Y, Saito R, Sato I, et al. Clinical effectiveness of neuraminidase inhibitors-oseltamivir, zanamivir, laninamivir and peramivir-for treatment of influenza A(H3N2) and A(H1N1) pdm09 infection: an observational study in the 2010-2011 influenza season in Japan. Journal of Infection and Chemotherapy, 2012;18(6):858–864.
14. Chong Y, Matsumoto S, Kang D, et al. Consecutive influenza surveillance of neuraminidase mutations and neuraminidase inhibitor resistence in Japan. Influenza and Other Respiratory Viruses, 2019;13 : 115–122.
15. Yang T. Baloxavir marboxil: The first cap – dependent endonuclease inhibitor for the treatment of influenza. Annals of Pharmacotherapy, 2019;53(7):754–759.
16. Hayden FG, Sugaya N, Hirotsu N, et al. Baloxavir marboxil for uncomplicated influenza in adults and adolescents. The New England Journal of Medicine, 2018;379(10):913–923.
17. Li TCM, Chan MCW, Lee N. Clinical implication of antiviral resistence in influenza. Viruses, 2015;7(9):4929–4944.
18. Furuta Y, Gowen BB, Takahashi K, et al. Favipiravir (T705), a novel viral RNA polymerase inhibitor. Antiviral Research, 2013;100 : 446–454.
19. Furuta Y, Komeno T, Nakamura T. Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proceedings of the Japan Academy Series, 2017;93(7):449–463.
20. Joshi S, Parkar J, Ansari A, et al. Role of favipiravir in the treatment of COVID19. International Journal of Infectious Diseases, 2021;102 : 501–508.
21. Nagata T, Lefor AK, Hasegawa M, et al. Favipiravir: a new medication for the Ebola virus disease pandemic. Disaster Medicine and Public Health Preparedness, 2015;9 : 79–81.
22. Belardo G, Cenciarelli O, La Frazia S, et al. Synergistic effect of nitazoxanide with neuraminidase inhibitors against influenza A viruses in vitro. Antimicrobial Agents and Chemotherapy, 2015;59 : 1061–1069.
23. Huang L, Zhang L, Liu Y, et al. Arbidol for preventing and treating influenza in adults and children. Cochrane Database of Systematic Reviews, 2015;1 : 1–9.
24. Koszalka P, Tilmanis D, Hurt AC. Influenza antivirals currently in late – phase clinical trial. Influenza and Other Respiratory Viruses, 2017;11 : 240–246.
25. Hayden FG, Shindo N. Influenza virus polymerase inhibitors in clinical development. Current Opinion in Infectious Diseases, 2019;32(2):176–186.
26. Neuraminidase inhibition assay (IC50). In International society for influenza and other respiratory virus diseases [online]. Dostupné na www: http://www.isirv.org/site/index.php/methodology/ nai-assay-ic50.
27. WHO. Meetings of the WHO working group on surveillance of influenza antiviral susceptibility-Geneva, November 2011 and 2012. Weekly epidemiological record, 2012;87 : 369–373.
28. MyAssays Analysis Software Solutions. In MyAssays. Analysis, solved [online]. Dostupné na www: http://www.myassays.com. aspx.
29. WHO. Manual for the laboratory diagnosis and virological surveillance of influenza [online]. 2011. ISBN 978 92 4 154809 0. Dostupné na www: http://apps.who.int/iris/bitstre am/10665/44518/1/9789241548090_eng.pdf.
30. Dong G, Peng C, Luo J, et al. Adamantane – resistant influenza A viruses in the world (1902–2013): frequency and distribution of M2 gene mutations. PLoS ONE, 2015;10(3):e0119115.
31. Moasser E, Moasser A, Zaraket H. Incidence of antiviral drug resistence markers among human influenza A viruses in the Eastern mediterranean region, 2005 – 2016. Infection, Genetics and Evolution, 2018;67 : 60–66.
32. Lackenby A, Hungnes O, Dudman SG, et al. Emergence of resistance to oseltamivir among influenza A(H1N1) viruses in Europe. Euro Surveillance, 2008;13(5):pii=8026. Dostupné na www: https://doi.org/10.2807/ese.13.05.08026-en.
33. Sheu TG, Deyde VM, Okomo-Adhiambo M, et al. Surveillance for neuraminidase inhibitor resistance among human influenza A and B viruses circulating worldwide from 2004 to 2008. Antimicrobial Agents and Chemotherapy, 2008;52(9):3284–3292.
34. Murtaugh W, Mahaman L, Healey B, et al. Evaluation of three influenza neuraminidase inhibition assays for use in a public health laboratory setting during the 2011–2012 influenza season. Public Health Reports, 2013;128 : 75–87.
35. Calatayud L, Lackenby A, Reynolds A, et al. Oseltamivir-resistant pandemic (H1N1) 2009 virus infection in England and Scotland, 2009–2010. Emerging Infectious Diseases, 2011;17 : 1807–1815.
36. Hurt AC, Chotpitayasunondh T, Cox NJ, et al. Antiviral resistence dutiny the 2009 influenza A H1N1 pandemic: Public health, laboratory, and clinical perspectives. The Lancet Infectious Diseases, 2012;12 : 240–248.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2021 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Studie rodinných clusterů s výskytem covid-19 v Ústeckém kraji se zaměřením na děti – klinický obraz, sekundární přenos, protilátková odpověď
- Genotypy norovirů u pacientů Fakultní nemocnice v Plzni, Česká republika, 2017–2020
- Sledování rezistence chřipkových virů na oseltamivir – naše dosavadní zkušenosti
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
- Příušnice a jejich výskyt v České republice a na Slovensku
- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- Covid-19 u dětí spojený s dětským zánětlivým multisystémovým syndromem (PIMS)
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- K osmdesátinám profesora Jiřího Městeckého
- Udělení Řádu T. G. Masaryka I. třídy in memoriam prof. MUDr. Karel Raška, DrSc. (17. 11. 1909–21. 11. 1987)
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- Příušnice a jejich výskyt v České republice a na Slovensku
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



