-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
Possibilities for the analysis of peripheral blood B cell subpopulations in a routine immunological laboratory
B cells play a vital role in the defence of the body against infectious agents. Apart from their ability to present antigen to T cells, B cells are mainly producers of antibodies. These play a crucial role in the effective elimination of infection and are also involved in the regulation of the immune response. The analysis of peripheral blood B cell subpopulations that makes it possible to monitor the development of B cells to the stage of antibody producing plasmablasts provides a valuable laboratory parameter which is important for both the study of the pathogenesis and diagnosis of some diseases. Laboratory analysis of B cell subpopulations is now a routinely available laboratory option thanks to the development of multicolour flow cytometry. This article summarizes the core knowledge which is currently applied to the analysis of B cell subpopulations in immunological laboratories.
Keywords:
B cell– flow cytometry – marginal zone of the spleen – germinal centre
Autoři: J. Štíchová 1; J. Nechvátalová 1,2; J. Litzman 1,2; M. Vlková 1,2
Působiště autorů: Ústav klinické imunologie a alergologie, LF MU v Brně 1; Ústav klinické imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 4, s. 264-280
Kategorie: Souhrnné sdělení
Souhrn
Při obraně organismu vůči infekčním agens hrají B lymfocyty zcela nezastupitelnou úlohu. Kromě schopnosti prezentovat antigen T lymfocytům jsou především producenty protilátek. Ty jsou nezbytné pro efektivní eliminaci infekce a podílejí se též na regulaci imunitní odpovědi. Stanovení B-lymfocytárních subpopulací v periferní krvi, pomocí kterého můžeme sledovat část vývoje B lymfocytů až do stadia plasmablastů produkujících protilátky, je proto cenným laboratorním parametrem, který má význam ve studiu patogeneze některých onemocnění, stejně jako napomáhá správnému stanovení diagnózy některých onemocnění. Laboratorní stanovení B lymfocytárních subpopulací je v současné době rutinním laboratorním vyšetřením zejména díky rozvoji mnohobarevné průtokové cytometrie. Tento článek shrnuje základní poznatky, které jsou v současné době při rutinním vyšetření B lymfocytárních subpopulací v imunologické laboratoři uplatňovány.
Klíčová slova:
průtoková cytometrie – B lymfocyt – marginální zóna sleziny – germinální centrum
ÚVOD
K obraně organismu proti mikroorganismům musí buňky imunitního systému cizí mikroby rozpoznat a reagovat na ně. Buňky imunitního systému se ale také musí vyvarovat útoku na tělu vlastní antigeny zdravých tkání, což by mohlo vést k autoimunitnímu onemocnění. B lymfocyty, kromě své funkce prezentace antigenů, produkují na konci svého vývoje ve stadiu plasmablastů protilátky (glykoproteiny), které dokážou bránit organismus proti široké škále antigenů včetně choroboplodných mikroorganismů. Kromě toho mohou některé protilátky také rozpoznávat vlastní struktury buněk těla. Před konečným stadiem plasmablastů procházejí B lymfocyty několika vývojovými stadii, která jsou definována nejen imunofenotypicky, ale jsou takéznáma jejich procentuální a absolutní zastoupení v periferní krvi.
Rozvoj imunologických metod, zejména pak možností mnohobarevné průtokové cytometrie, umožnil v posledním desetiletí podrobnou analýzu diferenciačních stadií T a B lymfocytů jak během jejich vývoje v primárních lymfatických orgánech (kostní dřen, thymus), tak zejména v periferních oblastech imunitního systému (lymfatické uzliny, slezina, slizniční imunitní systém). Ačkoliv vývoj T a B lymfocytů probíhá ve výše zmíněných kompartmentech imunitního systému, je krev nejdostupnějším laboratorním materiálem, kde lze periferní diferenciační stadia T a B lymfocytů sledovat. Tento přehledný článek se zaměřuje na základní informace o vývoji B lymfocytů v periferii imunitního systému a na možnosti vyšetření B-lymfocytárních vývojových stadií v krvi. Stanovení těchto subpopulací se v současné době stalo základním vyšetřením pro diagnostiku primárních imunodeficiencí a slouží také k monitorování aktivity autoimunitních chorob (tab. 1 a 2).
Tab. 1. Zastoupení B lymfocytárních subpopulací v periferní krvi u vybraných imunodeficitů
Table 1. Distribution of peripheral blood B cell subpopulations in selected immunodeficiencies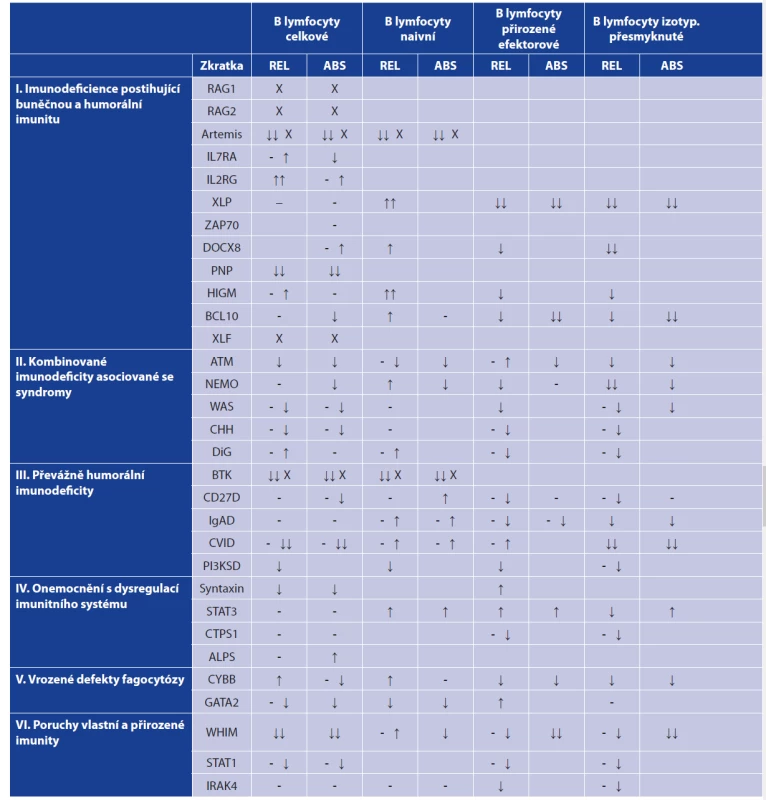
Tabulka uvádí změny v zastoupení celkových B lymfocytů a jednotlivých subpopulací v periferní krvi pacientů s vybranými imunodeficiencemi. Uvedené změny je nutno považovat pouze za orientační, protože zastoupení B lymfocytárních subpopulací může být ovlivněno např. léčbou nebo dalšími komorbiditami. Prázdná místa v tabulce jsou přítomna tam, kde se nepodařilo informace o dané B lymfocytární subpopulaci v odborné literatuře dohledat. Uvedené imunodeficity byly zařazeny do skupin na základě aktualizované verze IUIS fenotypické klasifikace vrozených vad imunitního systému [1].
Vysvětlivky: (REL) relativní zastoupení (%), (ABS) absolutní počet, (-) norma, (↓) snížení, (- ↓) v normě nebo snížení, (↓↓) výrazné snížení, (- ↑) v normě nebo zvýšení, (↑) zvýšení, (↑↑) výrazné zvýšení, (X) populace obvykle chybí.
(podle [2, 3])
The table shows changes in the distribution of the total B cells and different B cell subpopulations in the peripheral blood of patients with selected immunodeficiencies. The changes presented should only be considered as indicative as the distribution of different B cell subpopulations may vary with the treatment or comorbidities. Blank spaces in the table mean that the data on the given B cell subpopulation could not be found in the literature. The immunodeficiencies presented were classified into groups based on the updated version of the IUIS phenotypic classification of inborn errors of immunity [1].
Note: (REL) relative distribution (%), (ABS) absolute number, (-) norm, (↓) decrease, (- ↓) norm or decrease, (- ↑) norm or increase, (↓↓) significant decrease, (↑) increase, (↑↑) significant increase, (X) population usually absent.
(according to [2, 3])Tab. 2. Zastoupení B lymfocytárních subpopulací u nejčastěji se vyskytujících autoimunitních onemocnění
Table 2. Distribution of B cell subpopulations in the most common autoimmune diseases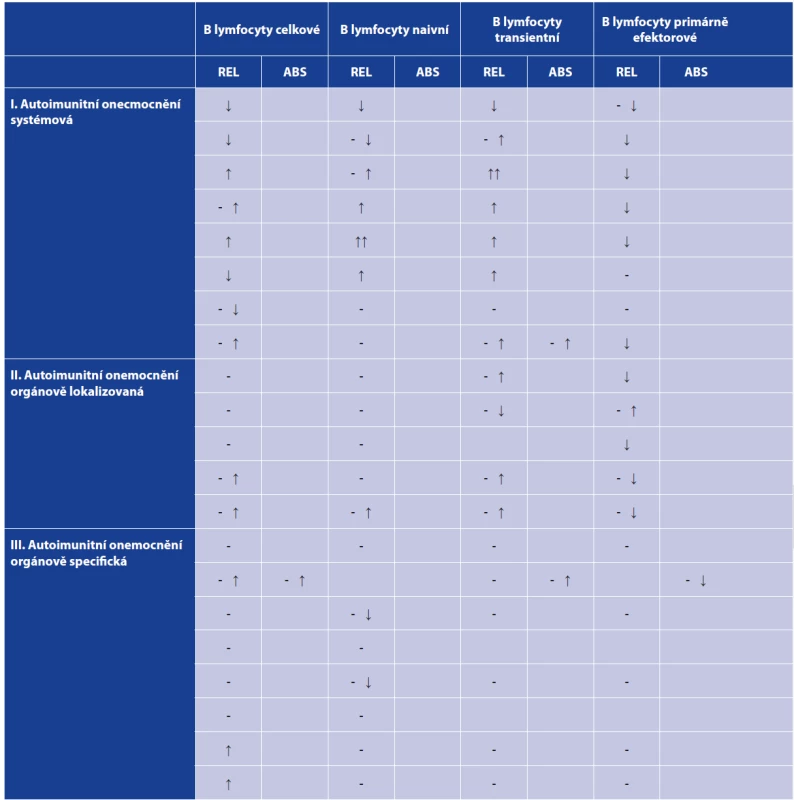
Tabulka zahrnuje zejména změny v relativním zastoupení B lymfocytárních subpopulací v periferní krvi z důvodu neúplných informací o absolutních počtech B lymfocytů u většiny uvedených onemocnění v odborné literatuře. Uvedené změny v B lymfocytárních subpopulacích jsou pouze orientační a zahrnují pouze pacienty s aktivní, klinicky manifestní formou daného onemocnění před zahájením léčby. Prázdná místa v tabulce jsou přítomna tam, kde se nepodařilo informace o dané B lymfocytární subpopulaci v odborné literatuře dohledat.
*Pouze u Grawesovy-Basedowovy choroby byly v odborné literatuře nalezeny informace o absolutních změnách B lymfocytárních subpopulací, nikoli o relativním zastoupení.
Vysvětlivky: (REL) relativní zastoupení (%), (ABS) absolutní počet, (-) norma, (↓) snížení, (- ↓) v normě nebo snížení, (- ↑) v normě nebo zvýšení, (↑) zvýšení, (↑↑) výrazné zvýšení.
(podle [2, 3])
The table shows mainly changes in the relative distribution of peripheral blood B cell subpopulations due to incomplete literature data on the absolute numbers of B cells for most diseases listed. The changes in B cell subpopulations presented are only indicative and relating only to patients with active, clinically manifest disease before the start of the treatment. Blank spaces in the table mean that the data on the given B cell subpopulation could not be found in the literature.
*For Graves’ disease only, literature data were found on absolute changes in B cell subpopulations but not on their relative distribution.
Note: (REL) relative distribution (%), (ABS) absolute number, (-) norm, (↓) decrease, (- ↓) norm or decrease, (- ↑) norm or increase, (↑) increase, (↑↑) significant increase.
(according to [2, 3])Vyšetření B-lymfocytárních subpopulací nalézá význam u všech hlavních skupin poruch funkce imunitního systému [1]. Některé stavy imunitní nedostatečnosti jsou provázeny změnami v celkovém zastoupení B lymfocytů, úplné chybění B lymfocytů lze nalézt například u pacientů s X-vázanou agamaglobulinemií. Výrazné snížení počtu B lymfocytů je ale přítomno i u některých pacientů s běžnou variabilní imunodeficiencí (CVID). Tito pacienti mívají také výrazně snížené zastoupení paměťových B lymfocytů. I u mnoha dalších imunodeficitních chorob můžeme pozorovat změny v zastoupení jednotlivých B-lymfocytárních subpopulací. Například snížený počet izotypově přesmyknutých paměťových B lymfocytů můžeme pozorovat u pacientů s hyper-IgM syndromem a také v menší míře u pacientů s IgA deficitem [2, 3]. Snížené zastoupení celkových B lymfocytů spolu se zvýšeným zastoupením plasmablastů bylo popsáno u GATA-2 deficience [4]. Více informací o změnách B-lymfocytárních subpopulací u vybraných imunodeficitů přináší tabulka 1. Změny v B-lymfocytárních subpopulacích lze také pozorovat u některých virových onemocnění a po očkování, kdy stoupá zejména počet plasmablastů [5]. V rámci autoimunitních onemocnění (viz tab. 2) lze jako vybrané příklady jmenovat systémový lupus erythematodes (SLE), kde u pacientů dochází k poklesu počtu transientních, naivních B lymfocytů a přirozených efektorových B lymfocytů a na druhé straně stoupá počet IgM only (IgM+IgD-CD27+) B lymfocytů, dále pak plasmablastů a plasmatických buněk [6]. Zvýšený počet plasmablastů a plasmatických buněk můžeme také nalézt u pacientů s revmatoidní artritidou (RA) [7]. U pacientů se Sjögrenovým syndromem byl zjištěn pokles počtu primárně efektorových B lymfocytů [8, 9].
Rutinně používané povrchové znaky při imunofenotypizaci B lymfocytů
CD45 představuje transmembránovou protein tyrosin fosfatázu (PTP), která se nachází na povrchu všech jaderných hematopoetických buněk včetně lymfocytů. PTP představuje esenciální regulátor transdukce signálů v hematopoetických buňkách a zodpovídá za jejich správný vývoj. V průtokové cytometrii se CD45 používá jako tzv. pan-leukocytární znak umožňující odlišení leukocytů od ostatních částic přítomných v měřeném vzorku [10].
Znaky CD19 a CD20 jsou obecně známy jako specifické B-lymfocytární markery, které jsou v laboratořích hojně využívány pro identifikaci B lymfocytů. Znak CD19 spolu s komplementovým receptorem 2 (CR2, CD21) a CD81 tvoří na povrchu B lymfocytů signalizační komplex, který se podílí na amplifikaci signálu přijatého skrze B-cell receptor (BCR) a molekulu CD21. Znak CD19 je exprimován na všech vývojových stadiích B lymfocytů s výjimkou plasmatických buněk [11]. CD20 představuje transmembránový glykoprotein, který se podílí na B-lymfocytární aktivaci, proliferaci a přenosu Ca2+ iontů. Na periferních B lymfocytech je exprimován od stadia tzv. transientních B lymfocytů až do izotypově přesmyknutých paměťových B lymfocytů, ale podobně jako u znaku CD19 má nízkou expresi na plasmablastech. Nicméně při správném gatování lze plasmablasty pomocí znaků CD19 a CD20 v periferní krvi rovněž zachytit [12, 13].
CD5 náleží do rodiny scavengerových receptorů a na povrchu B lymfocytů sehrává roli negativního regulátoru BCR signalizace. Tento znak je nejvíce exprimován na transientních B lymfocytech a ve velmi nízké míře se nachází takřka na všech B-lymfocytárních subsetech. Zvýšená exprese CD5 byla nalezena i na maligně transformovaných B lymfocytech (např. u chronické lymfatické leukemie, CLL) [14]. Exprese znaku CD5 je na lidských B buňkách heterogenní. Tento znak je exprimován transientními, naivními a v menší míře i paměťovými B lymfocyty. Expresi CD5 lze vyvolat stimulací, přičemž nejúčinnějším signálem pro up-regulaci CD5 je současná stimulace BCR i CD40 [15]. U myší je znak CD5 charakteristickým pro B1 lymfocyty. Z tohoto důvodu existuje tendence označovat i lidské CD5+ B lymfocyty také jako B1 lymfocyty. Toto označení ale není správné, neboť, jak už bylo výše popsáno, CD5 se u lidí vyskytuje také na různých vývojových formách B lymfocytů, navíc je jeho exprese indukovatelná, a tedy znak CD5 může být exprimován na B2 lymfocytech [15]. V roce 2016 bylo u myší zjištěno, že specifickým znakem pro B1 lymfocyty je regulátor aktivity SRC kináz, který nese označení CD148, a má unikátní úlohu při aktivaci BCR receptoru u B1 buněk, kdežto u B2 buněk tuto roli postrádá [16]. U lidí se na potvrzení jednoznačného markeru pro B1 lymfocyty stále čeká.
CD21 představuje komplementový receptor 2 (CR2). Váže antigenní částice s navázanými štěpy komplementu C3dg a po přemostění antigenní částice s BCR receptorem zesiluje jeho signalizaci. Výsledkem je silnější aktivace B lymfocytů a podpora diferenciace do plasmatických buněk. CD21 se nachází na maturovaných B lymfocytech (naivní, primárně efektorové) [17].
CD24 je jedním z nejčasnějších povrchových glykoproteinů exprimovaných na povrchu nezralých B lymfocytů podílejících se na vývoji a selekci B lymfocytů v kostní dřeni. V periferní krvi tento znak nesou transientní B lymfocyty a izotypově přesmyknuté paměťové B lymfocyty [18].
CD27 náleží do TNF-receptorové rodiny povrchových molekul leukocytů. Vazbou ligandu CD70 (CD27L) se podílí na buněčné signalizaci a je považován za typický znak paměťových forem B lymfocytů [19].
CD38 představuje transmembránový enzym s mnohočetnými funkcemi, který syntetizuje a hydrolyzuje cyklický adenosin 5‘-difosfát-ribózu, což je druhý posel pro mobilizaci intracelulárního Ca2+. Tímto způsobem se významně podílí na přežívání a aktivaci buněk. Znak CD38 je exprimován na vývojových stadiích B lymfocytů v kostní dřeni, dále na transientních B lymfocytech, plasmablastech a plasmatických buňkách [20].
IgM na povrchu B lymfocytů tvoří součást komplexu BCR receptoru, která váže antigen. Povrchové IgM se v rámci vývoje B lymfocytů tvoří jako první a jeho vystavením na buněčném povrchu vzniká nezralý B lymfocyt, který následně opouští kostní dřeň. Vysokou expresí IgM se vyznačují B lymfocyty transientní, primárně efektorové B lymfocyty, IgM plasmablasty, střední expresí pak B lymfocyty naivní. Povrchový IgM ztrácejí izotypově přesmyknuté paměťové B lymfocyty a plasmatické buňky [21].
IgD tvoří rovněž součást komplexu BCR receptoru, která váže antigen. IgD se však na povrchu B lymfocytů objevuje později ve srovnání s IgM, a to v průběhu jejich vývoje v sekundárních lymfatických orgánech, konkrétně ve stadiu T2 B lymfocytu (obr. 1). IgD exprimují B lymfocyty naivní, IgM paměťové a minoritní populace IgD+ plasmablastů. Tento znak naopak ztrácejí izotypově přesmyknuté B lymfocyty a plasmatické buňky [17, 21].
Obr. 1. Vývoj B lymfocytů
Figure 1. Development of B cells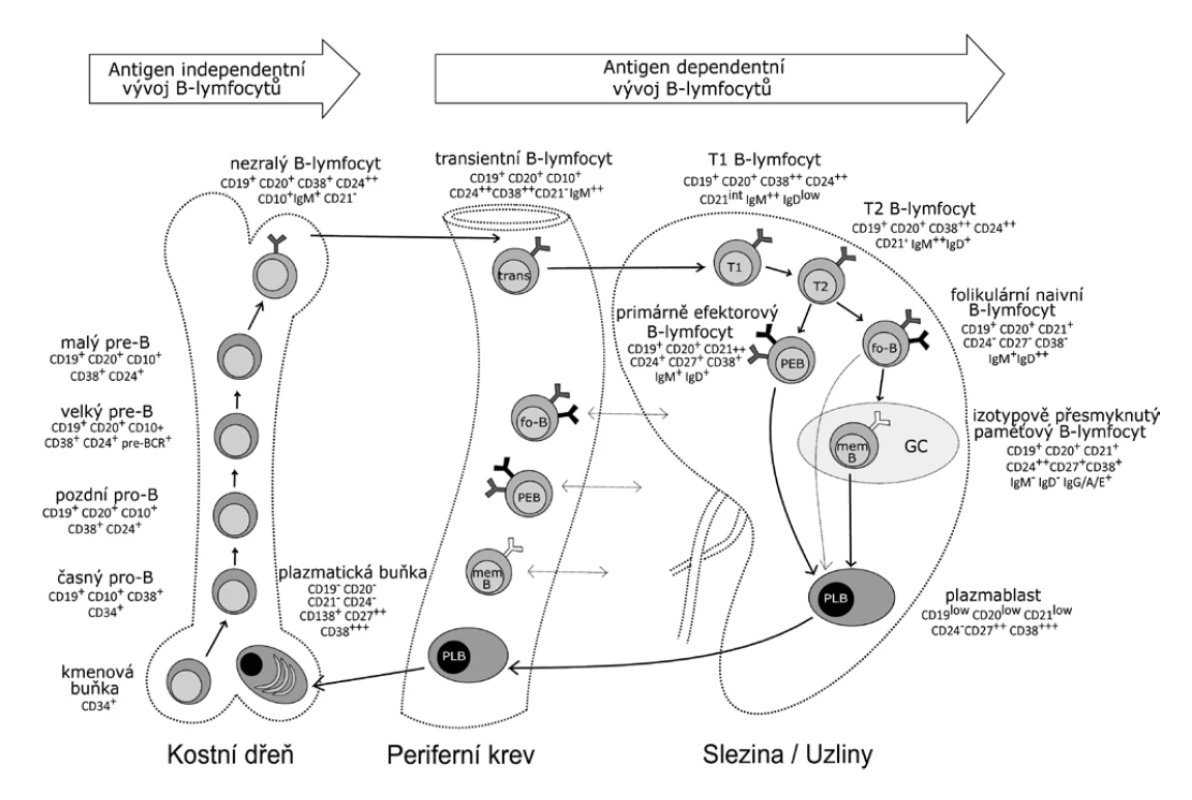
B lymfocyty se vyvíjejí v kostní dřeni z hematopoetické kmenové buňky přes stadia časného a pozdního pro-B lymfocytu, velkého a malého pre-B lymfocytu až k nezralým B lymfocytům. Každé z těchto vývojových stadií lze identifikovat na základě odlišné exprese vybraných povrchových markerů. Nezralé B lymfocyty nesou na svém povrchu kompletní BCR (B-cell receptor) třídy IgM a z kostní dřeně jsou uvolňovány do periferní krve, kde se označují jako transientní B lymfocyty. K dokončení svého vývoje se přesouvají do sekundárních lymfatických orgánů, především do sleziny. Zde transientní B lymfocyty přicházejí do kontaktu s folikulárními dendritickými buňkami, které jim poskytují signály k přežití a diferenciaci. Ta pokračuje přes stadium T1 a T2 B lymfocytů (zvýšení exprese CD21). Následným zvýšením exprese IgD se stávají plně vyzrálými B lymfocyty. Většinu z těchto zralých B lymfocytů představují naivní folikulární B lymfocyty, které odpovídají na T-dependentní antigeny (většinou proteiny). Druhou, méně početnou populaci představují primárně efektorové B lymfocyty (PEB), které odpovídají na T-independentní antigeny (typicky polysacharidové antigeny). Po styku zralých B lymfocytů s cílovým antigenem diferencují do krátce žijících plasmablastů a paměťových B lymfocytů. Část plasmablastů produkuje IgM v primárních folikulech sekundárních lymfatických orgánů a po krátké době umírá, další část se přesouvá do kostní dřeně, kde diferencuje v terminální vývojové stadium B lymfocytů – dlouze žijící plasmatické buňky (PLB).
(podle [17, 21])
B cells develop in the bone marrow from hematopoietic stem cells through the early and late pro-B-cell stages, large and small pre-B cells to immature B cells. Each of these developmental stages can be identified based on different expression of selected surface markers. Immature B cells carry a complete surface IgM B cell receptor (BCR) and are released from the bone marrow to the peripheral blood where they are referred to as transitional B cells. To complete their development, they move to the secondary lymphoid organs, especially to the spleen. There transitional B cells come into contact with follicular dendritic cells that deliver signals to them for survival and differentiation. The differentiation continues through T1 and T2 B cell stages (increase in CD21 expression). Subsequent increase in IgD expression results in fully mature B cells. Most of these mature B cells are naïve follicular B cells that respond to T-dependent antigens (mostly proteins). Another, less numerous population are primary effector B cells (PEB) that respond to T-independent antigens (typically polysaccharide antigens). After contact with the target antigen, mature B cells differentiate into short-lived plasmablasts and memory B cells. Some of the plasmablasts produce IgM in the primary follicles of the secondary lymphoid organs and die after a short time while others move to the bone marrow where they differentiate into the terminal developmental stage – long-lived plasma B cells (PLB).
(according to [17, 21])Instrumentace a zpracování vzorku pro imunofenotypizaci B lymfocytů
K vyšetření B-lymfocytárních subpopulací je nezbytný průtokový cytometr, který umožňuje měření nejméně osmi různých znaků, tj. osmibarevný. V současné době se tyto přístroje rutinně používají a mnoho pracovišť má takovéto přístrojové vybavení k dispozici.
Pro kvalitní interpretaci naměřených výsledků je třeba také zajistit správné zpracování vzorku. Základní krok spočívá v odstranění plazmy, a to centrifugací vyšetřované nesrážlivé plné krve s následným odsátím plazmy, která je po centrifugaci přítomna nad buněčnou peletou. Odstranění plazmy se provádí z důvodu přítomnosti sérových imunoglobulinů, které by se v plné krvi mohly vázat na přidané monoklonální protilátky namířené proti imunoglobulinům IgM nebo IgD používaných při fenotypizaci, protože tyto imunoglobuliny jsou rovněž přítomny na povrchu B lymfocytů jako BCR. Vazbou přidaných monoklonálních protilátek na sérové imunoglobuliny by došlo ke znemožnění označení povrchového BCR. Dále je nutné správné zagatování B lymfocytů (obr. 2) [22].
Při analýze B lymfocytů obvykle začínáme gatovaním lymfocytů. Pro tento účel je využívána protilátka anti-CD45, která v kombinaci s parametrem Side Scatter (SS) umožňuje identifikaci základních leukocytárních populací – granulocytů, monocytů a lymfocytů (viz obr. 2 C).
Populaci B lymfocytů lze odlišit od ostatních lymfocytů pomocí protilátek anti-CD19 nebo anti-CD20. V následujících krocích již pracujeme pouze s populací B lymfocytů – vynesením základních B-lymfocytárních markerů (IgM, IgD, CD5, CD21, CD27, CD24 a CD38), na dot plotech lze poté stanovit procento jednotlivých B-lymfocytárních subpopulací. Rozlišujeme B lymfocyty naivní, které na svém povrchu exprimují IgM a IgD, ale nikoli CD27 (fenotyp CD27-IgM+IgD+), dále následuje populace označovaná jako primárně efektorové B lymfocyty či IgM paměťové B lymfocyty (CD27+IgM+ IgD+) a izotypově přesmyknuté paměťové B lymfocyty (CD27+IgM-IgD-) – viz obrázek 2 G, plasmablasty, plasmatické buňky (CD27++CD38+++) – viz obrázek 2 F a transientní buňky (CD27-CD5+CD24++CD38++) – viz obrázek 2 H) [23, 24, 25].
Obr. 2. Základní gatovací strategie B lymfocytárních subpopulací
Figure 2. Basic gating strategy for B cell populations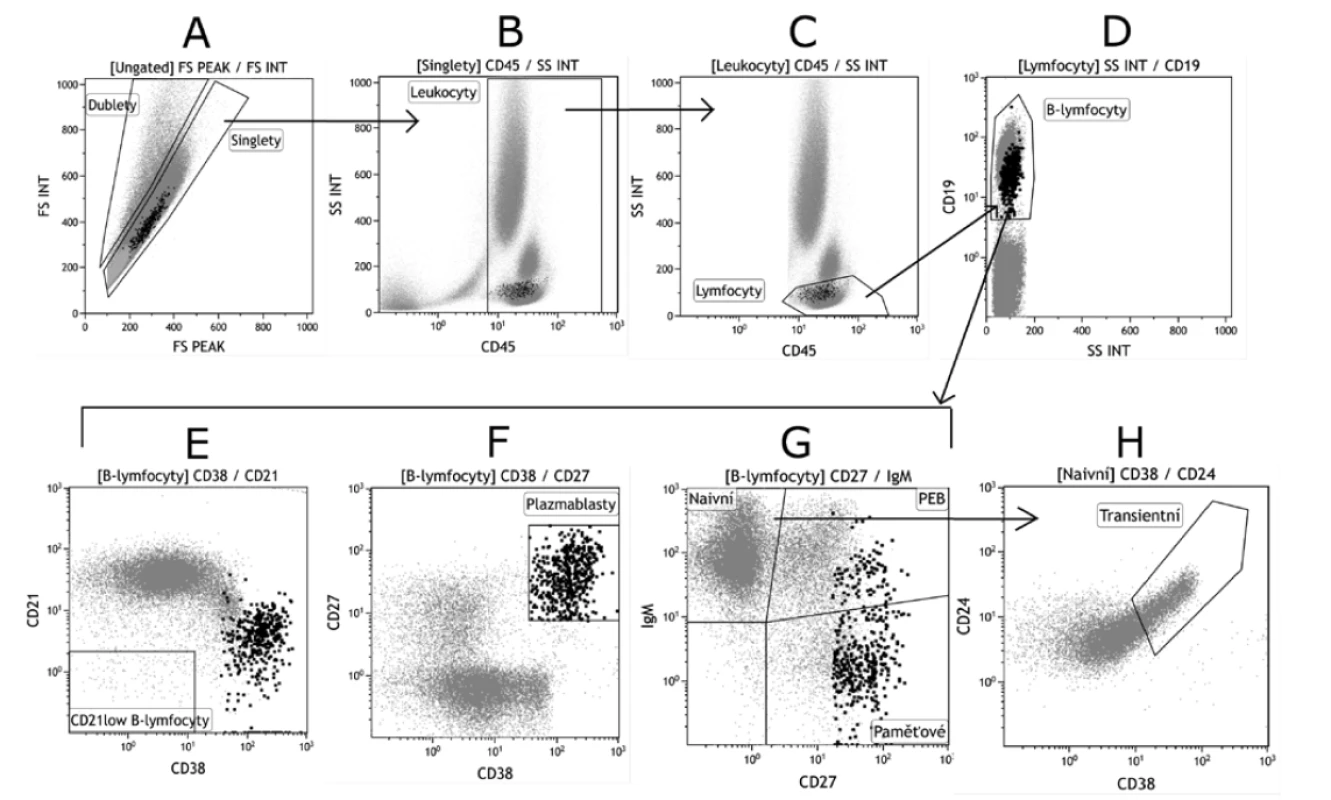
A. Analýza B lymfocytárních subpopulací na průtokovém cytometru vždy začíná odstraněním dubletů – tedy buněk, které laserovým paprskem přístroje prošly jako clustery 2 a více buněk a nikoli jako jednotlivé buňky (singlety).
B. Analýza dále vychází pouze ze singletů. Kombinace pan-leukocytárního znaku CD45 vůči Side Scatteru (SSC) dovoluje oddělení leukocytů od ostatních částic v suspenzi (erytrocyty, prachové částice, debris).
C. Ve třetím kroku jsou z CD45 pozitivních leukocytů gatovány pouze lymfocyty – buňky s nejmenší velikostí, kterou udává SS.
D. B lymfocyty jsou ze všech lymfocytů odděleny na základě pozitivity pro znak CD19 nebo CD20. V dalších krocích analýzy pracujeme pouze s populací CD19+ (popř. CD20+) B lymfocytů.
E. CD21low B lymfocyty jsou typické negativitou pro znaky CD21 i CD38.
F. Terminální vývojová stadia B lymfocytů – plasmablasty a plasmatické buňky se vyznačují vysokou expresí CD27 a CD38, exprese CD19 je snížená. Kombinace těchto znaků ale neumožní jejich odlišení.
G. Kombinací znaků IgM a CD27 lze rozlišit B lymfocyty naivní (IgM+CD27-), PEB (IgM+CD27+) a izotypově přesmyknuté paměťové (IgM-CD27+).
H. Transientní B lymfocyty jsou gatovány z naivních B lymfocytů a vyznačují se vysokou expresí CD24 a CD38.
A. Flow cytometry analysis of B cell subpopulations always starts with removal of doublets, that is, cells that passed through the interrogation point as two or more cell clusters and not as single cells (singlets).
B. The analysis further focuses on singlets alone. The combination of the pan-leukocyte marker CD45 vs. Side Scatter (SSC) allows the separation of white blood cells from other particles in the suspension (red blood cells, particulate matter, debris).
C. In step 3, from CD45 positive white blood cells, only B cells as the smallest size cells discriminated by SS, are gated.
D. B cells are separated from all other lymphocytes based on the CD19 or CD20 marker positivity. In the following steps, only CD19+ (or possibly CD20+) B-cell populations are the subject of analysis.
E. CD21low B cells are typically CD21 and CD38 negative.
F. Terminal developmental stages of B cells – plasmablasts and plasma cells – are characterized by high expression of CD27 and CD38 and decrease in CD19 expression. However, the combination of these markers does not allow discrimination of these cells.
G. The combination of the IgM and CD27 markers allows discrimination between naive B cells (IgM+CD27-), PEB (IgM+CD27+), and isotype-switched memory cells (IgM-CD27+).
H. Transitional B cells are gated from naive B cells and are characterized by high expression of CD24 and CD38.Vývoj B lymfocytů v periferii
B lymfocyty se vyvíjejí v kostní dřeni z pluripotentní kmenové buňky a za působení cytokinů a dalších podpůrných buněk pokračuje jejich vývoj od syntézy pre-BCR receptoru až do konečné exprese BCR na povrchu buňky. BCR je tvořen membránově vázaným imunoglobulinem IgM a řetězci Ig-α a Ig-β. Kostní dřeň opouštějí tyto buňky jako nezralé B lymfocyty, tzv. transientní B lymfocyty, které dále směřují do sleziny, případně dalších lymfatických sekundárních orgánů. Zde pokračují ve vyzrávání, a to buď do stadia naivních folikulárních B lymfocytů, nebo do primárně efektorových B lymfocytů (obr. 2) [26].
Fenotyp folikulárních B lymfocytů se liší podle toho, zda se setkaly či nesetkaly s antigenem (Ag). B lymfocyty po reakci s Ag na svém povrchu exprimují znak CD27 a jsou nazývány paměťovými B lymfocyty, zatímco naivními jsou nazývány ty B lymfocyty, které nebyly svému antigenu doposud exponovány a jsou CD27 negativní [27].
Transientní B lymfocyty
Transientní B lymfocyty se vyznačují vysokou expresí znaků CD5, CD24, CD38, IgM a procházejí několika fázemi vývoje [23, 25]. V první fázi, při opuštění kostní dřeně, jsou nazývány transientními B lymfocyty typu I (T1), přičemž kromě výše uvedených znaků mají nízkou expresi znaků IgD, CD21 a CD27. Ve slezině, případně dalších sekundárních lymfatických orgánech, dochází k jejich vyzrávání do transientních B lymfocytů typu 2 (T2), které již exprimují IgD i CD21. Poté, co dozrají do stadia naivních B lymfocytů (CD27-IgM+IgD+) nebo B lymfocytů marginální zóny, snižují svou expresi CD24 a CD38 [28, 29].
Transientní B lymfocyty dosahují nejvyššího zastoupení v pupečníkové krvi a u novorozenců (obr. 3). Poté jejich počet s věkem a postupným vyzráváním imunitního systému klesá a přibývá zralých naivních B lymfocytů. S vyzráváním imunitního systému koreluje rostoucí hladina IgG v séru a klesající počet transientních buněk. U dětí do 5 let jsou relativní počty B lymfocytů vyšší v porovnání s dospělými. Tyto děti mají také vyšší počet CD5+CD10+CD19+ B lymfocytů, což je dáno tím, že znak CD10 je rovněž exprimován na transientních B lymfocytech [30]. Vysoké hodnoty transientních B lymfocytů nacházíme také u pacientů po transplantaci kostní dřeně při obnovení vlastní krvetvorby včetně B lymfocytů [31].
Obr. 3. Vývoj zastoupení transientních B lymfocytů v periferní krvi v závislosti na věku
Figure 3. Distribution of transitional B cells in the peripheral blood by age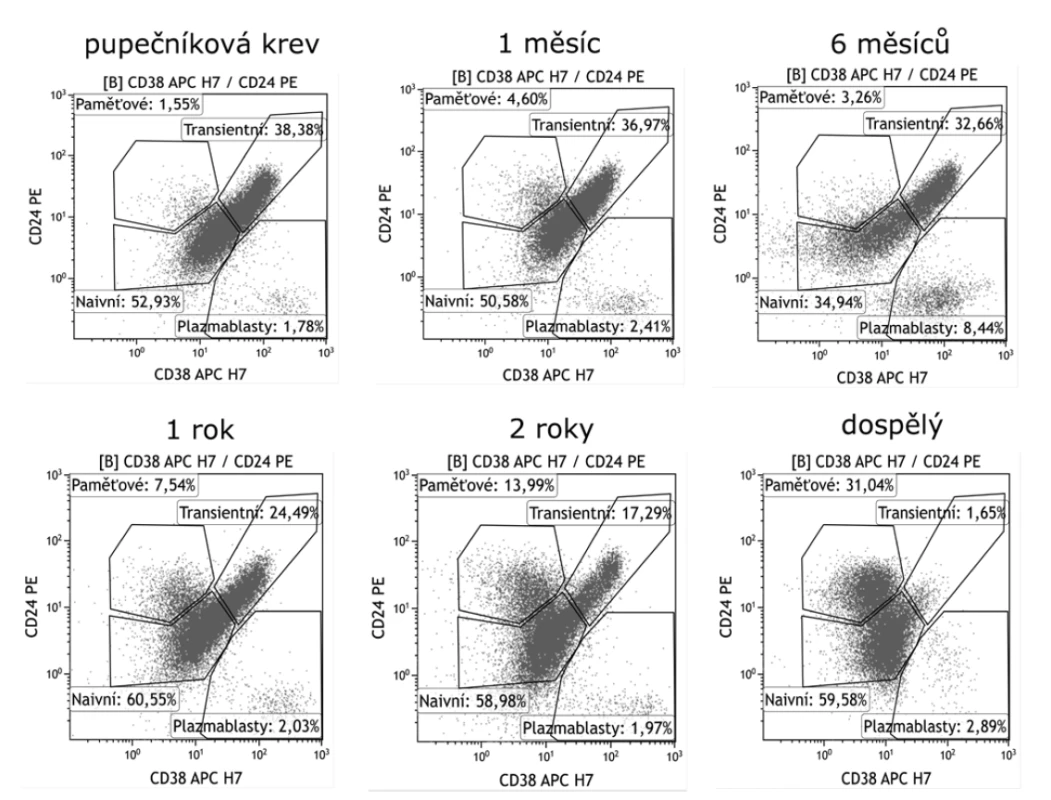
Transientní B lymfocyty dosahují nejvyššího zastoupení v pupečníkové krvi a u novorozenců. S věkem jejich počet postupně klesá a nejnižšího zastoupení dosahuje u dospělých.
Transitional B cells are most abundant in umbilical cord blood and in newborns. Their number gradually decreases and is the lowest in adults.Naivní B lymfocyty
Zralé naivní B lymfocyty (CD27-IgM+IgD+) tvoří největší část B-lymfocytárních subpopulací v dětském věku, kdy do jednoho roku věku dítěte dosahuje zpravidla více než 90 %, poté se jejich zastoupení s věkem postupně snižuje. Ovšem i u zdravého dospělého člověka představují zralé naivní B lymfocyty většinovou populaci ze všech B lymfocytů [32]. Zralé naivní B lymfocyty exprimují BCR typu IgM i IgD, mají střední expresi znaku CD21, CD24 a CD38 a jsou CD10 negativní. Zvýšené procento naivních B lymfocytů se nachází u pacientů s běžnou variabilní imunodeficiencí (CVID) a X-vázaným hyper-IgM syndromem, fyziologicky pak u malých dětí [23, 24].
Naivní B lymfocyty cirkulují v krvi mezi sekundárními lymfatickými orgány, dokud v nich nepotkají svůj antigen (Ag). Po reakci s Ag se nejprve diferencují na krátce žijící IgM plasmablasty a IgM paměťové B lymfocyty (IgM+IgD+CD27+), které mohou dále pokračovat ve vývoji až do izotypově přesmyknutých paměťových B lymfocytů (IgM-IgD-CD27+) nebo do stadia plasmablastů a plasmatických buněk produkujících izotypově přesmyknuté imunoglobuliny [33].
Primárně efektorové B lymfocyty (PEB)
Do populace primárně efektorových B lymfocytů (PEB) náleží ty B lymfocyty, které jsou IgM, IgD a CD27 pozitivní. Někdy jsou také nazývány B lymfocyty marginální zóny (MZB, IgM+IgD+CD27+) nebo IgM paměťové B lymfocyty. PEB vznikají po setkání folikulárních naivních B lymfocytů s Ag, B lymfocyty marginální zóny se pravděpodobně vyvíjejí přímo z T2 lymfocytů ve slezině a reagují především s T-independentními Ag. Tyto dvě populace nelze v periferní krvi pomocí znaků IgM, IgD, CD21, CD24 a CD27 navzájem odlišit. PEB mají BCR, který na rozdíl od folikulárních B lymfocytů po styku s T-independentním antigenem většinou neprochází procesem somatické hypermutace ani afinitní maturace, proto tyto buňky ve stadiu plasmablastů produkují především IgM [17, 34]. PEB se mohou vyvinout i v nepřítomnosti sleziny, ale splenektomie u starších jedinců dramaticky snižuje jejich počet v krvi [35]. Schopnost odpovídat na T-independentní antigeny se objevuje až od druhého roku věku, kdy dochází k plnému vyzrání marginální zóny sleziny. U dětí mladších dvou let bylo zjištěno, že PEB, které se nacházejí v periferní krvi a ve slezině, nevykazují žádné známky aktivace a expanze, navzdory mnoha antigenním podnětům z probíhajících infekcí, které se v tomto věku vyskytují. Tato skutečnost v dětství ukazuje, že rovněž PEB nejsou schopny dostatečné odpovědi na infekce probíhající v tomto věku [36].
PEB se vyznačují zvýšenou expresí IgM, CD21, CD24 a střední expresí IgD, dále pak nižší expresí znaku CD38. Zpravidla jsou gatovány pomocí IgD nebo IgM a znaku CD27, kdy je identifikujeme jako buňky CD19+(CD20+) IgD+CD27+ nebo IgM+CD27+. Jedná se o nejreaktivnější B lymfocyty, které při in vitro stimulacích nejrychleji a nejsnadněji reagují a jsou schopny například dozrát v plasmablasty, nebo produkovat cytokiny [37].
Normální hodnoty procentuálního zastoupení populace IgM+IgD+CD27+ v periferní krvi se opět liší v závislosti na věku vyšetřované osoby. U dětí do dvou let dosahují hodnoty okolo 6 % z celkového počtu B lymfocytů [32]. Po dozrání sleziny se jejich hodnoty ustalují mezi 13–20 %. Zvýšené procento těchto buněk můžeme nalézt u pacientů s X-vázaným hyper-IgM syndromem [38] a u některých pacientů s CVID. U pacientů po splenektomii dochází k výraznému poklesu počtu těchto buněk [39]. U asplenických pacientů jsou však IgM+IgD+CD27+ B lymfocyty přítomny [40].
V praxi se k rozlišení PEB od ostatních populací nejčastěji používají znaky IgD a CD27, protože pomocí exprese IgM, na rozdíl od IgD, lze někdy obtížně rozlišit subpopulace izotypově přesmyknutých paměťových B lymfocytů a PEB. Při tomto způsobu gatování může docházet k chybám, a to u pacientů, kteří tvoří IgD-IgM+CD27+ B lymfocyty (obr. 4 A). Při použití IgD pak tato populace spadá do izotypově přesmyknutých paměťových B lymfocytů (obr. 4 B). Jedná se zejména o pacienty s autoimunitním onemocněním jako revmatoidní artritida, SLE apod. Z tohoto důvodu je dobré k takto definovaným populacím při odečítaní na průtokovém cytometru využít dot plotu, kde jsou proti sobě vyneseny exprese IgM a IgD (obr. 4 C). Zvýšené procento IgM+IgD- B lymfocytů poukáže na výskyt IgM+IgD-CD27+, a tím také na možnou chybu. Zda jsou IgM+IgD- autoreaktivními B lymfocyty zatím nebylo zcela objasněno.
Obr. 4. Gatování PEB pomocí kombinace znaků IgM, IgD a CD27
Figure 4. Gating of PEB using the combination of the IgM, IgD, and CD27 markers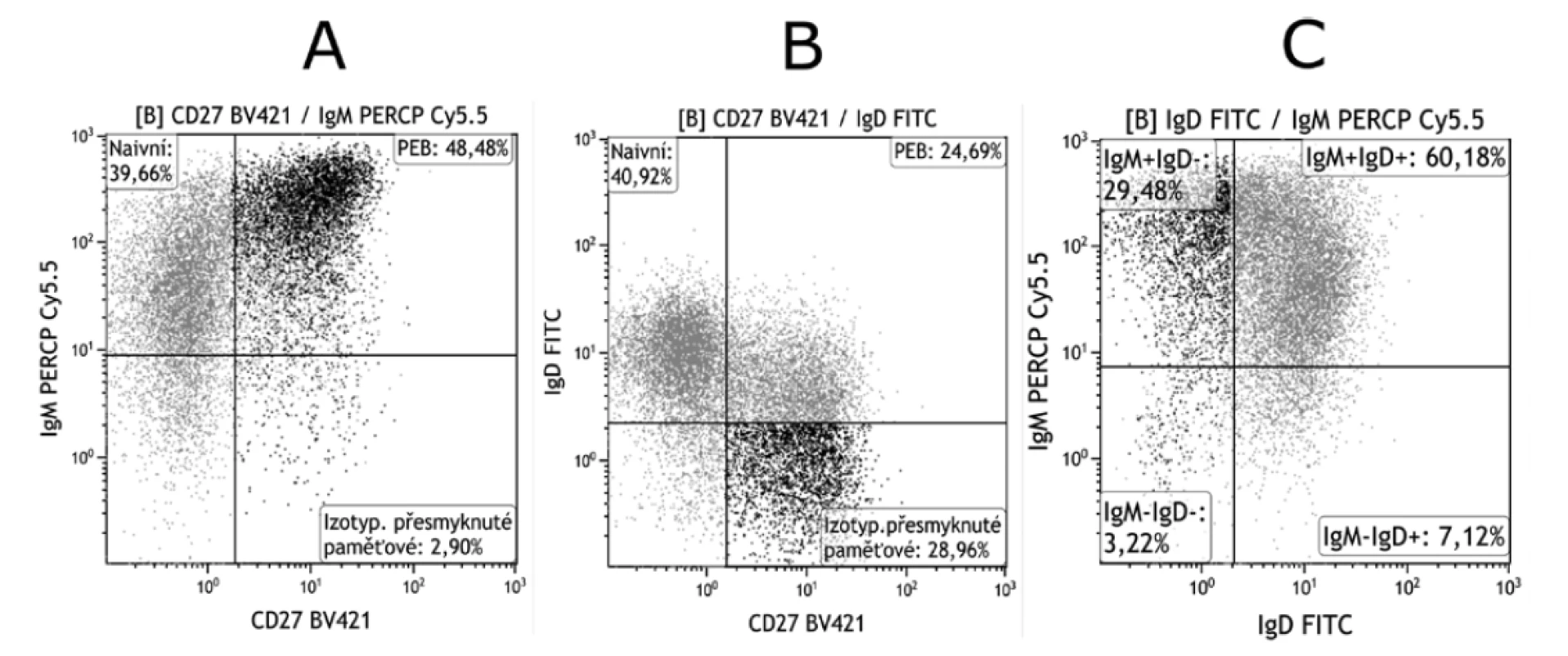
A. Při použití kombinace znaků IgM a CD27 lze někdy obtížně rozlišit subpopulace izotypově přesmyknutých paměťových B lymfocytů a PEB. U některých pacientů se totiž mohou tvořit IgD-IgM+CD27+ B lymfocyty.
B. Při použití IgD v kombinaci s CD27 IgD-IgM+CD27+ B lymfocyty spadají do izotypově přesmyknutých paměťových B lymfocytů a získané výsledky proto nejsou správné.
C. Při odečítaní je proto vhodné využít i dot plotu, kde jsou proti sobě vyneseny exprese IgM a IgD. Zvýšené procento IgM+IgDB lymfocytů poukáže na výskyt IgM+IgD-CD27+ B lymfocytů a tím také na možnou chybu.
A. Using the combination of the IgM and CD27 markers, it may be difficult to differentiate between the subpopulations of isotype- -switched B cells and PEB. In some patients, IgD-IgM+CD27+ B cells can form.
B. When IgD is used in combination with CD27, IgD-IgM+CD27+ B cells fall into isotype-switched memory B cells and, therefore, the results obtained are not correct.
C. When taking readings, it is also helpful to use a dot plot where IgM expression is plotted against IgD expression. A higher percentage of IgM+IgD- B cells points to the presence of IgM+IgD-CD27+ B cells and thus to a possible error.V nedávno publikované studii se ukázalo, že myši s CD27+ pozitivními B lymfocyty s vysokou expresí IgM a nízkou nebo chybějící expresí IgD mají autoimunitní charakter [41]. Tyto B lymfocyty jsou vysoce reaktivní s endogenními Ag a přeměňují se v krátce žijící plasmablasty produkující IgM v primárních folikulech, které ale dále nepřechází do germinálních center. Dokonce se může jednat také o izotypově přesmyknuté buňky, což však pouze z cytometrického měření nelze určit. Pro potlačení autoimunitní reakce může autoreaktivní B lymfocyt zcela zásadně snížit expresi IgM a zvýšit expresi IgD, a tím změnit svou autoreaktivitu. Z tohoto B lymfocytu pak vzniká anergická buňka [41, 42] nebo buňka s omezenou reaktivitou, která má po stimulaci sklony vstupovat do reakce germinálního centra, projít procesem somatické hypermutace, při kterém se může zbavit své autoreaktivity a vytvářet dlouze žijící izotypově přesmyknuté paměťové B lymfocyty.
Izotypově přesmyknuté paměťové B lymfocyty
Izotypově přesmyknuté paměťové B lymfocyty bývají gatovány jako IgM-IgD-CD27+ buňky. Jedná se o dlouhodobě žijící B lymfocyty, které mohou putovat krví a poté se usazují v sekundárních lymfatických orgánech a v kostní dřeni. Jejich přítomnost v rozmezích normálních hodnot spolu s normálními hodnotami hladin imunoglobulinů v séru ukazuje na schopnost organismu vytvářet paměťové buňky, tj. je dokumentována nejen diferenciační schopnost B lymfocytů, ale také správná funkce pomocných folikulárních T lymfocytů. Izotypově přesmyknuté paměťové B lymfocyty mají střední expresi CD21, vysokou až střední expresi CD24 a spíše nižší expresi CD38. Bývají zpravidla CD5 negativní a při použití monoklonálních protilátek proti IgG, IgA nebo IgE můžeme monitorovat počet konkrétních tříd izotypově přesmyknutých paměťových B lymfocytů. V současné době jsou již k dispozici kvalitní protilátky pro průtokovou cytometrii, což umožňuje i sledování podtříd IgG a IgA u paměťových buněk, např. u imunodeficitů nebo při infekcích.
Sledování izotypově přesmyknutých paměťových buněk jednotlivých podtříd imunoglobulinů lze s úspěchem využít při vyšetření pacientů s CVID, selektivním deficitem IgA nebo selektivním deficitem některých z podtříd IgG. Rovněž je lze sledovat při odpovědi na očkování, kdy u pacientů s postižením specifické protilátkové odpovědi (např. CVID), nenacházíme sedmý den po očkování vzestup počtu paměťových buněk, který bývá přítomen u zdravých lidí [5]. Snížený počet izotypově přesmyknutých paměťových buněk ukazuje na sníženou schopnost diferenciace B lymfocytů, a to buď v důsledku dalších poruch vývoje B lymfocytů (např. u pacientů s hyper-IgM syndromem) [5, 43] nebo postižení T buněčné řady (např. u pacientů s Di-Georgovým syndromem) [44, 45].
Zvýšený výskyt izotypově přesmyknutých paměťových B lymfocytů nalézáme po očkování a je také popisován u některých autoimunitních onemocnění. Při rozvoji SLE a RA můžeme sledovat změny v počtech izotypově přesmyknutých paměťových buněk, kdy dochází ke zvýšené tvorbě těchto buněk a mohou také korelovat s aktivitou daného onemocnění [6, 45].
U infekcí se při protilátkové odpovědi na rozpustné proteinové antigeny a membránové proteiny primárně indukují IgG1 protilátky, tedy i IgG1 plasmablasty, a jsou doprovázeny nižšími hladinami ostatních IgG podtříd. Virové infekce obecně vedou k produkci protilátek podtříd IgG1 a IgG3 a na druhé straně je protilátková odpověď na bakteriální kapsulární polysacharidové antigeny téměř omezena pouze na IgG2 [46]. Protilátky podtřídy IgG4 se často vytváří po opakované nebo dlouhodobé expozici antigenu v neinfekčním prostředí [47].
Normální počty izotypově přesmyknutých paměťových B lymfocytů jsou závislé na věku vyšetřované osoby. U kojenců se jejich hodnoty pohybují okolo 1 %, u dětí do dvou let pak okolo 3 %. S rostoucím věkem procento izotypově přesmyknutých paměťových B lymfocytů narůstá a v dospělosti dosahuje hodnot okolo 10 % a více [32].
Plasmablasty a plasmatické buňky
Využití znaků CD19, CD27 a CD38 umožňuje v periferní krvi sledování pozdních stadií vývoje B lymfocytů – plasmablastů. Plasmablasty se podobně jako buňky transientní vyznačují vysokou expresí znaku CD38 (viz obr. 1 H), která je ještě vyšší než u transientních buněk a nízkou expresí znaku CD21. Na rozdíl od transientních buněk mají plasmablasty také vysokou expresi znaku CD27 a nízkou expresi znaku CD24. Plasmablasty mohou být IgM pozitivní, nebo mohou být izotypově přesmyknuté a exprimovat IgG, IgA či IgE. Relativně malé procento (1–3 % ze všech plasmablastů) tvoří IgD+ plasmablasty. Obecně plasmablasty exprimují na svém povrchu nižší množství povrchových imunoglobulinů a ve stadiu plasmatických buněk ztrácejí povrchové Ig úplně. Plasmatické buňky se vyznačují ztrátou exprese CD19, jsou CD138+. Plasmablasty bývají často zahrnovány do gatů IgM+CD27+ a IgM-CD27+. Je pro ně rovněž typická nízká exprese CD19, proto je pro jejich monitorování nutné zahrnout i buňky s nízkou expresí tohoto znaku. Pro plasmablasty je také typické, že mají větší velikost než běžné B a T lymfocyty, tudíž i větší Forward Scatter (FCS).
Produkce IgG a plasmablastů je nejnižší v období 6 až 15 měsíců věku dítěte a vyznačuje se rovněž nízkými hladinami IgG v séru. V této době dítě ještě není schopno samo tvořit dostatečné množství těchto protilátek a zároveň dochází k poklesu transplacentárně přenesených IgG protilátek od matky [48]. U těchto dětí mohou být zaznamenány vyšší počty plasmablastů ve srovnání s referenčními daty, a to v případě nedávno proběhlého infekčního onemocnění nebo po očkování, kdy se počet plasmablastů v krvi zvyšuje. Plasmablasty naopak chybí u pacientů s CVID a u pacientů se selektivním IgA deficitem (IgAD) je snížen počet IgA+ plasmablastů, což může v důsledku vést k poklesu celkového počtu plasmablastů [43]. Jak již bylo výše popsáno, pro definici paměťových populací B lymfocytů se užívá znak CD27. Studie Grimsholm et al. [49] ukázala, že intenzita exprese tohoto znaku stoupá u paměťových buněk a plasmablastů spolu s věkem pacienta. Starší pacienti proto mohou mít poměrně vyšší expresi znaku CD27 v porovnání s dětskými pacienty.
CD21low B lymfocyty
Populace B lymfocytů neexprimující obvyklé diferenciační markery (IgM-IgD-CD27-CD21-CD38-) nebývá u zdravých lidí příliš početná. Je tvořena krátkodobě žijícími paměťovými B lymfocyty, které vyzrály zpravidla mimo germinální centrum. Poměrně dlouhou dobu nebyla jasná funkce této populace. V poslední době se z četných na sobě nezávislých studií ukazuje, že by se mohlo jednat o B lymfocyty reagující na virové infekce či chronickou stimulaci. Tato unikátní subpopulace B lymfocytů, která byla označena různými názvy, včetně dvojitě negativních B lymfocytů, CD21low B lymfocytů, atypických paměťových B lymfocytů, tkáňových paměťových B lymfocytů nebo B lymfocytů spojených s věkem (ABC), CD11c+ B lymfocytů, či T-bet+ B lymfocytů. Při podrobném zkoumání však bylo zjištěno, že jsou si tyto buňky fenotypicky i funkčně podobné. Zvýšení populace CD21low B lymfocytů bylo popsáno při akutních infekcích (chřipka, malárie, HCV), chronických infekcích (HIV, tuberkulóza) nebo chronickém zánětu přítomném u autoimunitních chorob (SLE, RA, Sjögrenův syndrom), ale i u imunodeficientních pacientů (CVID, IgAD). Jedná se o populace netypických paměťových B lymfocytů, které vznikají vazbou nukleových kyselin mikroorganismů nebo apoptotických zbytků na Pattern Recognition Receptory (PRR) pro nukleové kyseliny za přítomnosti Th1 cytokinů, přičemž se v této fázi vývoje indukuje exprese transkripčního faktoru T-bet [50]. Další vývoj těchto B lymfocytů probíhá v germinálních centrech, ale za určitých okolností se také mohou vyvíjet extrafolikulárně. Přítomnost transkripčního faktoru T-bet v těchto B lymfocytech ovlivňuje izotypový přesmyk u nově vznikajících imunoglobulinů z těchto buněk, a to u myší do izotypu IgG2 a u lidí do izotypů IgG1 a IgG3. Takto vzniklé paměťové B lymfocyty jsou dlouhodobě žijící, mají schopnost sebeobnovy a mohou být progenitory plasmatických buněk, nebo se při opětovném napadení diferencují na jiné efektorové B lymfocyty. Díky těmto vlastnostem mohou hrát klíčovou úlohu v ochraně proti intracelulárním patogenům [3, 45, 46].
ZÁVĚR
B lymfocyty prochází během svého vývoje mnoha diferenciačními stadii. Abnormální vývoj B lymfocytů může vést k autoimunitním onemocněním nebo imunodeficitním stavům. Změny v B lymfocytárních subpopulacích můžeme nalézt i u pacientů s přítomným onkologickým onemocněním vycházejícím z B lymfocytů nebo jejich prekurzorů, avšak jejich podrobnější analýza spadá do odbornosti hematologické laboratoře. Pro stanovení B-lymfocytárních subpopulací v periferní krvi se rutinně používá kombinace monoklonálních protilátek proti znakům CD45, CD5, CD19, CD20, CD21, CD24, CD27, CD38, IgM a IgD. Tyto znaky dovolují rozlišení B lymfocytů transientních, naivních, PEB, izotypově přesmyknutých paměťových, plasmablastů a CD21low B lymfocytů. Rutinní zpracování periferní krve toto stanovení vyžaduje nejen správné zpracování vzorku, ale také nákladné laboratorní vybavení (průtokový cytometr, monoklonální protilátky) a proškolený personál pro správné zhodnocení dat v průtokovém cytometru. Ke správné interpretaci výsledků by mohly napomoci přiložené tabulky onemocnění, u nichž dochází ke změnám zastoupení B-lymfocytárních subpopulací. I když se v případě tabulky 1 většinou jedná o vzácně se vyskytující imunodeficitní onemocnění, může nalezený posun v B-lymfocytárních subpopulacích vést k rychlejšímu nalezení diagnózy. Z tohoto důvodu je stanovení B-lymfocytárních subpopulací rutinním vyšetřením při podezření na některý z níže uvedených imunodeficitů [1, 43, 51, 52]. U autoimunitních chorob (tab. 2) lze tímto způsobem sledovat u jednotlivých pacientů ataky a remise daného onemocnění.
Získané výsledky B-lymfocytárních subpopulací musí být vždy hodnoceny v kontextu s věkem pacienta, jeho aktuálními klinickými obtížemi a případnou medikací. Jedině tak mohou tyto výsledky napomoci ke správné diagnostice onemocnění.
Do redakce došlo dne 1. 2. 2021.
Adresa pro korespondenci:
Mgr. Julie Štíchová
Mendlovo nám. 12
603 00 Brno-střed-Staré Brno
e-mail: julie.stichova@fnusa.cz
Zdroje
1. Bousfiha A, Jeddane L, Picard C, et al. Human Inborn Errors of Immunity: 2019 Update of the IUIS Phenotypical Classification. J Clin Immunol, 2020;40(1):66–81.
2. Agematsu K, Futatani T, Hokibara S, et al. Absence of Memory B Cells in Patients with Common Variable Immunodeficiency. Clin Immunol, 2002;103(1):34–42.
3. Nechvatalova J, Pikulova Z, Stikarovska D, et al. B-lymphocyte Subpopulations in Patients with Selective IgA Deficiency. J Clin Immunol, 2012;32(3):441–448.
4. Novakova M, Zaliova M, Sukova M, et al. Loss of B cells and their precursors is the most constant feature of GATA-2 deficiency in childhood myelodysplastic syndrome. Haematologica, 2016;101(6):707–716.
5. Chovancova Z, Vlkova M, Litzman J, et al. Antibody forming cells and plasmablasts in peripheral blood in CVID patients after vaccination. Vaccine, 2011;29(24):4142–4150.
6. Wardowska A, Komorniczak M, Skoniecka A, et al. 2020. Alterations in peripheral blood B cells in systemic lupus erythematosus patients with renal insufficiency. Int Immunopharmacol, 2020;83 : 106451.
7. Bugatti S, Vitolo B, Caporali R, et al. B Cells in Rheumatoid Arthritis: From Pathogenic Players to Disease Biomarkers. Biomed Res Int, 2014;2014.
8. Hansen A, Daridon C, Dörner T. What do we know about memory B cells in primary Sjögren’s syndrome? Autoimmun Rev, 2010;9(9):600–603.
9. Wei Ch, Jenks S, Sanz I. Polychromatic flow cytometry in evaluating rheumatic disease patients. Arthritis Res Ther, 2015;17(1):46.
10. Hermiston ML, Xu Z, Weiss A. CD45: a critical regulator of signaling thresholds in immune cells. Annu Rev Immunol, 2003;21 : 107 – 137.
11. Depoil D, Fleire S, Treanor BL, et al. CD19 is essential for B cell activation by promoting B cell receptor–antigen microcluster formation in response to membrane-bound ligand. Nat Immunol, 2008;9(1):63–72.
12. Quách TD, Rodríguez-Zhurbenko N, Hopkins TJ, et al. Distinctions among Circulating Antibody-Secreting Cell Populations, Including B-1 Cells, in Human Adult Peripheral Blood. J Immunol, 2016;196(3):1060–1069.
13. Walshe CA, Beers SA, French RR, et al. Induction of Cytosolic Calcium Flux by CD20 Is Dependent upon B Cell Antigen Receptor Signaling. J Biol Chem, 2008;283(25):16971–16984.
14. Burgueño-Bucio E, Mier-Aguilar AC, Soldevila G. The multiple faces of CD5. J Leukoc Biol, 2019;105(5):891–904.
15. Prieto JMB, Felippe JMB. Development, phenotype, and function of non-conventional B cells. Comp Immunol Microbiol Infect Dis, 2017;54 : 38–44.
16. Skrzypczynska KM, Zhu WJ, Weiss A. Positive Regulation of Lyn Kinase by CD148 Is Required for B Cell Receptor Signaling in B1 but Not B2 B Cells. Immunity, 2016;45(6):1232–1244.
17. Murphy K, Weaver C. Janeway’s immunobiology. New York and London: Garland Science; 2017.
18. Mensah FFK, Armstrong ChW, Reddy V, et al. CD24 Expression and B Cell Maturation Shows a Novel Link With Energy Metabolism: Potential Implications for Patients With Myalgic Encephalomyelitis/ Chronic Fatigue Syndrome. Front Immunol, 2018;9 : 2421.
19. Agematsu K, Hokibara S, Nagumo H, et al. CD27: a memory B-cell marker. Immunol Today, 2000;21(5):204–206.
20. Zhao, YJ, Lam CMCH, Lee HCH. The Membrane-Bound Enzyme CD38 Exists in Two Opposing Orientations. Sci Signa, 2012;5(241):ra67.
21. Loder BF, Bettina B, Ray JR, et al. B Cell Development in the Spleen Takes Place in Discrete Steps and Is Determined by the Quality of B Cell Receptor–Derived Signals. J Exp Med, 1999 : 190(1):75–90.
22. Kalina T, Flores-Montero J, Van Der Velden VHJ, et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia, 2012;26(9):1986 – 2010.
23. Wehr C, Kivioja T, Schmitt Ch, et al. The EUROclass trial: defining subgroups in common variable immunodeficiency. Blood, 2008; 111(1):77–85.
24. Buffa S, Pellicanò M, Bulati M, et al. A novel B cell population revealed by a CD38/CD24 gating strategy: CD38−CD24 − B cells in centenarian offspring and elderly people. Age, 2013;35(5):2009 – 2024.
25. Palanichamy A, Barnard J, Zheng B, et al. Novel Human Transitional B Cell Populations Revealed by B Cell Depletion Therapy. J Immunol, 2009 : 182(10):5982–5993.
26. Schroeder HW, Radbruch A, Berek C. 7 - B-Cell Development and Differentiation. In: Clinical Immunology (Fifth Edition) London: Elsevier; 2019. s. 107–118.
27. Klein U, Rajewsky K, Küppers R. Human Immunoglobulin (Ig) M+IgD+ Peripheral Blood B Cells Expressing the CD27 Cell Surface Antigen Carry Somatically Mutated Variable Region Genes: CD27 as a General Marker for Somatically Mutated (Memory) B Cells. J Ex Med, 1998;188(9):1679–1689.
28. Carsetti R, Köhler G, Lamers MC. Transitional B cells are the target of negative selection in the B cell compartment. J Exp Med, 1995;181(6):2129–2140.
29. Allman DM, Ferguson SE, Cancro MP. Peripheral B cell maturation. I. Immature peripheral B cells in adults are heat-stable antigenhi and exhibit unique signaling characteristics. J Immunol, 1992;149(8):2533–2540.
30. Garcia‐Prat M, Álvarez‐Sierra D, Aguiló‐Cucurull A, et al. Extended immunophenotyping reference values in a healthy pediatric population. Cytometry B Clin Cytom, 2019;96(3):223–233.
31. Marie-Cardine A, Divay F, Dutot I, et al. Transitional B cells in humans: Characterization and insight from B lymphocyte reconstitution after hematopoietic stem cell transplantation. Clin Immunol, 2008;127(1):14–25.
32. Piątosa B, Wolska‐Kuśnierz B, Pac M, et al. B cell subsets in healthy children: Reference values for evaluation of B cell maturation process in peripheral blood. Cytometry B Clin Cytom, 2010;78B(6):372–381.
33. Tangye SG, Liu YJ, Aversa G, et al. 1998. Identification of Functional Human Splenic Memory B Cells by Expression of CD148 and CD27. J Ex Med, 1998;188(9):1691–1703.
34. Weller S, Braun MC, Tan BK, et al. Human blood IgM “memory” B cells are circulating splenic marginal zone B cells harboring a prediversified immunoglobulin repertoire. Blood, 2004;104(12):3647–3654.
35. Kruetzmann S, Rosado MM, Weber H, et al. Human Immunoglobulin M Memory B Cells Controlling Streptococcus pneumoniae Infections Are Generated in the Spleen. J Ex Med, 2003;197(7):939–945.
36. Weller S, Mamani-Matsuda M, Picard C, et al. Somatic diversification in the absence of antigen-driven responses is the hallmark of the IgM+IgD+CD27+ B cell repertoire in infants. J Ex Med, 2008;205(6):1331–1342.
37. Ticha O, Moos L, Wajant H, et al. 2018. Expression of Tumor Necrosis Factor Receptor 2 Characterizes TLR9-Driven Formation of Interleukin-10-Producing B Cells. Front Immunol, 2018;8 : 1951.
38. Weller S, Faili A, Garcia C, et al. CD40-CD40L independent Ig gene hypermutation suggests a second B cell diversification pathway in humans. Proc Natl Acad Sci USA, 2001; 98(3):1166 – 1170.
39. Martinez-Gamboa L, Mei H, Loddenkemper CH, et al. Role of the spleen in peripheral memory B-cell homeostasis in patients with autoimmune thrombocytopenia purpura. Clin Immunol, 2009;130(2):199–212.
40. Scheeren FA, Nagasawa M, Weijer K, et al. T cell–independent development and induction of somatic hypermutation in human IgM+IgD+CD27+ B cells. J Ex Med, 2008;205(9):2033–2042.
41. Noviski M, Zikherman J. Control of autoreactive B cells by IgM and IgD B cell receptors: maintaining a fine balance. Curr Opin Immunol, 2018;55 : 67–74.
42. Sabouri Z, Perotti S, Spierings E, et al. IgD attenuates the IgM-induced anergy response in transitional and mature B cells. Nat Commun, 2016;7(1):13381.
43. Blanco E, Pérez-Andrés M, Arriba-Méndez S, et al. Defects in memory B-cell and plasma cell subsets expressing different immunoglobulin-subclasses in patients with CVID and immunoglobulin subclass deficiencies. J Allergy Clin Immunol, 2019;144(3):809–824.
44. Finocchi A, Di Cesare S, Romiti ML, et al. Humoral immune responses and CD27+ B cells in children with DiGeorge syndrome (22q11.2 deletion syndrome). Pediatr Allergy Immunol, 2006;17(5):382–388.
45. Klocperk A, Parackova Z, Bloomfield M, et al. Follicular Helper T Cells in DiGeorge Syndrome. Front Immunol, 2018;9 : 1730.
46. Palm Ak E, Henry C. Remembrance of Things Past: Long-Term B Cell Memory After Infection and Vaccination. Front Immunol, 2019;10 : 1787.
47. Vidarsson G, Dekkers G, Trispens T. IgG Subclasses and Allotypes: From Structure to Effector Functions. Front Immunol, 2014;5 : 520.
48. Lebon A, Verkaik NJ, Labout JAM, et al. Natural Antibodies against Several Pneumococcal Virulence Proteins in Children during the Pre-Pneumococcal-Vaccine Era: the Generation R Study. Infect Immun, 2011;79(4):1680–1687.
49. Grimsholm O, Piano Mortari E, Davydov AN, et al. The Interplay between CD27dull and CD27bright B Cells Ensures the Flexibility, Stability, and Resilience of Human B Cell Memory. Cell Rep, 2020;30(9):2963–2977.
50. Knox JJ, Myles A, Cancro MP. T-bet+ memory B cells: Generation, function, and fate. Immunol Rev, 2019;288(1):149–160.
51. Van Dongen JJM, Van Der Burg M, Kalina T, et al. EuroFlow-Based Flowcytometric Diagnostic Screening and Classification of Primary Immunodeficiencies of the Lymphoid System. Front Immunol, 2019;10 : 1271.
52. Van Der Burg M, Kalina T, Perez-Andres M. The EuroFlow PID Orientation Tube for Flow Cytometric Diagnostic Screening of Primary Immunodeficiencies of the Lymphoid System. Front Immunol, 2019;10 : 246.
53. Delmonte O, Schuetz C, Notarangelo L. RAG Deficiency: Two Genes, Many Diseases. J Clin Immunol, 2018;38(6):646–655.
54. Siala N, Azzabi O, Kebaier H, et al. Omenn syndrome: two case reports. Acta Dermatovenerol Croat, 2013;21(4):259 – 262.
55. Puel A, Leonard JW. Mutations in the gene for the IL-7 receptor result in T–B+NK+ severe combined immunodeficiency disease. Curr Opin Immunol, 2000;12(4):468–473.
56. Ege M, Ma Y, Manfras B, et al. Omenn syndrome due to ARTEMIS mutations. Blood, 2005; 105(11):4179–4186.
57. Giliani S, Mori L, Basile G, et al. Interleukin-7 receptor α (IL-7Rα) deficiency: cellular and molecular bases. Analysis of clinical, immunological, and molecular features in 16 novel patients. Immunol Rev, 2005;203(1):110–126.
58. Rossberg S, Schwarz K, Meisel C, et al. Delayed Onset of (Severe) Combined Immunodeficiency (S)CID (T-B+NK+): Complete IL-7 Receptor Deficiency in a 22 Months Old Girl. Klin Padiatr, 2009;221(6):339–343.
59. Lim CHK, Abolhassani H, Appelberg KS, et al. IL2RG hypomorphic mutation: identification of a novel pathogenic mutation in exon 8 and a review of the literature. Allergy Asthma Clin Immunol, 2019;15(2).
60. Ma C, Pittaluga S, Avery TD, et al. Selective generation of functional somatically mutated IgM+CD27+, but not Ig isotype - switched, memory B cells in X-linked lymphoproliferative disease. J Clinl Invest, 2006;116(2):322–333.
61. Ma C, Hare JN, Nichols KE, et al. Impaired humoral immunity in X-linked lymphoproliferative disease is associated with defective IL-10 production by CD4+ T cells. J Clin Invest, 2005;115(4):1049–1059.
62. Cuss AK, Avery DT, Cannons LJ, et al. Expansion of Functionally Immature Transitional B Cells Is Associated with Human-Immunodeficient States Characterized by Impaired Humoral Immunity. J Immunol, 2006;176(3):1506–1516.
63. Menard L, Cantaert T, Chamberlain N, et al. Signaling lymphocytic activation molecule (SLAM)/SLAM-associated protein pathway regulates human B-cell tolerance. J Allergy Clin Immunol, 2014;133(4):1149–1161.
64. Sharifinejad N, Jamee M, Zaki-Dizaji M, et al. Clinical, Immunological, and Genetic Features in 49 Patients With ZAP-70 Deficiency: A Systematic Review. Front Immunol, 2020;11 : 831.
65. Engelhardt KR, Gertz EM, Keles S, et al. The extended clinical phenotype of 64 patients with dedicator of cytokinesis 8 deficiency. J Allergy Clin Immunol, 2015;136(2):402–412.
66. Somech R, Lev A, Grisaru-Soen G, et al. Purine nucleoside phosphorylase deficiency presenting as severe combined immune deficiency. Immunol Res, 2013;56(1):150–154.
67. Agematsu K, Nagumo H, Shinozaki K, et al. Absence of IgD - -CD27(+) memory B cell population in X-linked hyper-IgM syndrome. J Clin Invest, 1998;102(4):853–860.
68. Tsai H, Yu HH, Chien YH, et al. X-linked hyper-IgM syndrome with CD40LG mutation: Two case reports and literature review in Taiwanese patients. J Microbiol Immunol, 2015;48(1):113 – 118.
69. Ameratunga R, Woon ST, Koopmans W, et al. Cellular and Molecular Characterisation of the Hyper Immunoglobulin M Syndrome Associated with Congenital Rubella Infection. J Clin Immunol, 2008;29(1):99–106.
70. Torres JM, Martinez-Barricarte R, García-Gómez S, et al. Inherited BCL10 deficiency impairs hematopoietic and nonhematopoietic immunity. J Clin Invest, 2014;124(12):5239–5248.
71. Çipe FE, Aydogmus C, Babayigit Hocaoglu A, et al. Cernunnos/ XLF Deficiency: A Syndromic Primary Immunodeficiency. Case Rep Pediatr, 2014;2014 : 614238.
72. Sharifinejad N, Jamee M, Zaki-Dizaji M, et al. Cernunnos deficiency: a case report. J Investig Allergol Clin Immunol, 2011;21(4):313–316.
73. Staples ER, McDermott EM, Reiman A, et al. Immunodeficiency in ataxia telangiectasia is correlated strongly with the presence of two null mutations in the ataxia telangiectasia mutated gene. Clin Exp Immunol, 2008;153(2):214–220.
74. Stefano AD, Boldt A, Schmiedel L, et al. Flow cytometry as an important tool in the diagnosis of immunodeficiencies demonstrated in a patient with ataxia-telangiectasia. Lab Medizin, 2016;40(4):255–261.
75. Pereira CTM, Bichuetti-Silva DC, Da Mota NVF, et al. B-cell subsets imbalance and reduced expression of CD40 in ataxia-telangiectasia patients. Allergol Immunopathol, 2018;46(5):438–446.
76. Heller S, Kölsch U, Magg T, et al. T Cell Impairment Is Predictive for a Severe Clinical Course in NEMO Deficiency. J Clin Immunol, 2020;40(3):421–434.
77. Chandrakasan S, Marsh AR, Uzel G, et al. Outcome of patients with NEMO deficiency following allogeneic hematopoietic cell transplant. J Allergy Clin Immunol, 2017;139(3):1040–1043.
78. Park JY, Shcherbina A, Rosen FS, et al. Phenotypic perturbation of B cells in the Wiskott–Aldrich syndrome. Clin Exp Immunol, 2005;139(2):297–305.
79. Simon KL, Anderson SM, Garabedian KE, et al. Molecular and phenotypic abnormalities of B lymphocytes in patients with Wiskott - Aldrich syndrome. J Allergy Clin Immunol, 2014;133(3):896 – 899.
80. Castiello MC, Bosticardo M, Pala F, et al. Wiskott–Aldrich Syndrome protein deficiency perturbs the homeostasis of B-cell compartment in humans. J Autoimmun, 2014;50 : 42–50.
81. McCann LJ, McPartland J, Barge D, et al. Phenotypic Variations of Cartilage Hair Hypoplasia: Granulomatous Skin Inflammation and Severe T Cell Immunodeficiency as Initial Clinical Presentation in Otherwise Well Child with Short Stature. J Clin Immunol, 2014;34(1):42–48.
82. Kostjukovits S, Klemetti P, Valta H, et al. Analysis of clinical and immunologic phenotype in a large cohort of children and adults with cartilage-hair hypoplasia. J Allergy Clin Immunol, 2017;140(2):612–614.
83. Sullivan KE, McDonald-McGinn D, Driscoll AD, et al. Longitudinal Analysis of Lymphocyte Function and Numbers in the First Year of Life in Chromosome 22q11.2 Deletion Syndrome (DiGeorge Syndrome/Velocardiofacial Syndrome). Clin Diagn Lab Immunol, 1999;6(6):906–911.
84. Giardino G, Radwan N, Koletsi P, et al. Clinical and immunological features in a cohort of patients with partial DiGeorge syndrome followed at a single center. Blood, 2019;133(24):2586–2596.
85. Sigmon JR, Kasasbeh E, Krishnaswamy G. X-linked agammaglobulinemia diagnosed late in life: case report and review of the literature. Clin Mol Allergy, 2008;6(1):5.
86. Alkhairy OK, Perez-Becker R, Driessen JG, et al. Novel mutations in TNFRSF7/CD27: Clinical, immunologic, and genetic characterization of human CD27 deficiency. J Allergy Clin Immunol, 2015;136(3):703–712.
87. Van Montfrans JM, Hoepelman IMA, Otto S, et al. CD27 deficiency is associated with combined immunodeficiency and persistent symptomatic EBV viremia. J Allergy Clin Immunol, 2012;129(3):787–793.
88. Celiksoy MH, Yildiran A. A comparison of B cell subsets in primary immune deficiencies that progress with antibody deficiency and age-matched healthy children. Allergol Immunopathol, 2016;44(4):331–340.
89. Singh A, Joshi V, Jindal KA, et al. An updated review on activated PI3 kinase delta syndrome (APDS). Genes Dis, 2020;7(1):67–74.
90. Thouenon R, Moreno-Corona N, Poggi L, et al. Activated PI3Kinase Delta Syndrome – A Multifaceted Disease. Front Pediatr, 2021;9 : 652405.
91. Shim J, Park S, Chandrakasan S. Early B Cell Development Is Impaired in Patients with Active Hemophagocytic Lymphohistiocytosis. Blood, 2017;130(1):1006.
92. Speckmann C, Enders A, Woellner C, et al. Reduced memory B cells in patients with hyper IgE syndrome. Clin Immunol, 2008;129(3):448–454.
93. Een W, Krätz EC, McKenzie IC, et al. Impaired memory B-cell development and antibody maturation with a skewing toward IgE in patients with STAT3 hyper-IgE syndrome. Allergy, 2019;74(12):2394–2405.
94. Martin E, Minet N, Boschatca, et al. Impaired lymphocyte function and differentiation in CTPS1-deficient patients result from a hypomorphic homozygous mutation. JCI Insight, 2020;5(5):e133880.
95. Bleesing JJH, Brown RM, Straus, ES, et al. Immunophenotypic profiles in families with autoimmune lymphoproliferative syndrome. Blood, 2001;98(8):2466–2473.
96. Bleesing JJ, Souto-Carneiro MM, Savage JW, et al. Patients with Chronic Granulomatous Disease Have a Reduced Peripheral Blood Memory B Cell Compartment. J Immunol, 2006;176(11):7096–7103.
97. Moir S, De Ravin SS, Santich HB, et al. Humans with chronic granulomatous disease maintain humoral immunologic memory despite low frequencies of circulating memory B cells. Blood, 2012;120(24):4850–4858.
98. Novakova M, Janda A, Wlodarski WM, et al. Defect in B Cell Production Driven By GATA2 Mutation Results in Their Absolute Reduction and Mature Phenotype in Pediatric Patients. Blood, 2014;124(21):2746.
99. McGuire PJ, Cunningham-Rundles CH, Ochs H, et al. Oligoclonality, impaired class switch and B-cell memory responses in WHIM syndrome. Clin Immunol, 2010;135(3):412–421.
100. Kawai T, Malech LH. WHIM Syndrome: Congenital Immune Deficiency Disease. Curr opin hematol, 2009;16(1):20–26.
101. Gulino AV, Moratto D, Sozzani S, et al. Altered leukocyte response to CXCL12 in patients with warts hypogammaglobulinemia, infections, myelokathexis (WHIM) syndrome. Blood, 2004;104(2):444–452.
102. Romberg N, Morbach H, Lawrence GM, et al. Gain-of-function STAT1 mutations are associated with PD-L1 overexpression and a defect in B-cell survival. J Allergy Clin Immunol, 2013;131(6):1691–1693.
103. Nemoto K, Kawanami T, Hoshina T, et al. Impaired B-Cell Differentiation in a Patient With STAT1 Gain-of-Function Mutation. Front Immunol, 2020;11 : 557521.
104. Zhang W, Chen X, Gao G, et al. Clinical Relevance of Gain - and Loss-of-Function Germline Mutations in STAT1: A Systematic Review. Front Immunol, 2021;12 : 654406.
105. Weller S, Bonnet M, Delagreverie H, et al. IgM+IgD+CD27+ B cells are markedly reduced in IRAK-4–, MyD88-, and TIRAP - but not UNC-93B–deficient patients. Blood, 2012;120(25):4992–5001.
106. Nishimura S, Kobayashi Y, Ohnishi H, et al. IRAK4 Deficiency Presenting with Anti-NMDAR Encephalitis and HHV6 Reactivation. J Clin Immunol, 2021;41(1):125–135.
107. Gobin K, Hintermeyer M, Boisson B, et al. IRAK4 Deficiency in a Patient with Recurrent Pneumococcal Infections: Case Report and Review of the Literature. Front Pediatr, 2017;5 : 83.
108. Moura RA, Weinmann P, Pereira AP, et al. Alterations on peripheral blood B-cell subpopulations in very early arthritis patients. Rheumatology, 2010;49(6):1082–1092.
109. Wang Y, Lloyd AK, Melas I, et al. Rheumatoid arthritis patients display B-cell dysregulation already in the naïve repertoire consistent with defects in B-cell tolerance. Sci Rep, 2019;9(1):19995.
110. Fedele AL, Tolusso B, Gremese E, et al. Memory B cell subsets and plasmablasts are lower in early than in long-standing Rheumatoid Arthritis. BMC Immunol, 2014;15 : 28.
111. DÖRNER T, JACOBI MA, LEE J et al. Abnormalities of B cell subsets in patients with systemic lupus erythematosus. J Immunol Methods, 2011;363(2):187–197.
112. Henning S, Lambers MW, Doornbos-Van Der Meer B, et al. Proportions of B-cell subsets are altered in incomplete systemic lupus erythematosus and correlate with interferon score and IgG levels. Rheumatology, 2020;59(9):2616–2624.
113. Jin W, Luo Z, Yang H. Peripheral B Cell Subsets in Autoimmune Diseases: Clinical Implications and Effects of B Cell-Targeted Therapies. J Immunol Res, 2020;2020:e9518137.
114. Piper CHJM, Wilkinson GLM, Deakin TC, et al. CD19+CD24hiCD38hi B Cells Are Expanded in Juvenile Dermatomyositis and Exhibit a Pro-Inflammatory Phenotype After Activation Through Toll-Like Receptor 7 and Interferon-α. Front Immunol, 2018;9 : 1372.
115. Young-Glazer J, Cisneros A, Wilfong ME, et al. Jo-1 autoantigen - specific B cells are skewed towards distinct functional B cell subsets in anti-synthetase syndrome patients. Arthritis Res Ther, 2021;23 : 33.
116. Ibrahem HM. B-cell dysregulation in primary Sjögren’s syndrome: A review. Jpn Dent Sci Rev, 2019;55(1):139–144.
117. Le Pottier L, Devauchelle V, Pers JO, et al. The mosaic of B-cell subsets (with special emphasis on primary Sjögren’s syndrome). Autoimmun Rev, 2007;6(3):149–154.
118. Nocturne G, Mariette X. B cells in the pathogenesis of primary Sjögren syndrome. Nat Rev Rheumatol, 2018;14(3):133–145.
119. Kraaij MD, Van Laar JM. The role of B cells in systemic sclerosis. Biol: Targets Ther, 2008;2(3):389–395.
120. Soto L, Ferrier A, Aravena AO, et al. Systemic sclerosis patients present alterations in the expression of molecules involved in B cell regulation. Front Immunol, 2015;6 : 496.
121. Hajas A, Barath S, Szodoray P, et al. Derailed B cell homeostasis in patients with mixed connective tissue disease. Hum Immunol, 2013;74(7):833–841.
122. Alvarez-Rodriguez L, Riancho-Zarrabeitia L, Calvo-Alén J, et al. Peripheral B-Cell Subset Distribution in Primary Antiphospholipid Syndrome. Int J Mol Sci, 2018;19(2):589.
123. Reincke ME, Payne JK, Harder I, et al. The Antigen Presenting Potential of CD21low B Cells. Front Immunol, 2020;11 : 535784.
124. Hisada RYO, Kato M, Sugawara ERI, et al. Circulating plasmablasts contribute to antiphospholipid antibody production, associated with type I interferon upregulation. J Thromb Haemost, 2019;17(7):1134–1143.
125. Kamphuis LS, Van Zelm CM, Lam HK, et al. Perigranuloma Localization and Abnormal Maturation of B Cells: emerging key players in sarcoidosis? Am J Respir Crit Care Med, 2013;187(4):406 – 416.
126. Saussine A, Tazi A, Feuillet S, et al. Active Chronic Sarcoidosis is Characterized by Increased Transitional Blood B Cells, Increased IL-10-Producing Regulatory B Cells and High BAFF Levels. PLoS One, 2012;7(8):e43588.
127. Timmermans WMC, Laar AMJ, Houwen BT, et al. B-Cell Dysregulation in Crohn’s Disease Is Partially Restored with Infliximab Therapy. PLoS One, 2016;11(7):e0160103.
128. Pararasa CH, Zhang N, Tull JT, et al. Reduced CD27−IgD − B Cells in Blood and Raised CD27−IgD − B Cells in Gut-Associated Lymphoid Tissue in Inflammatory Bowel Disease. Front Immunol, 2019;10 : 361.
129. Rabe H, Malmquist M, Barkman C, et al. Distinct patterns of naive, activated and memory T and B cells in blood of patients with ulcerative colitis or Crohn’s disease. Clin Exp Immunol, 2019;197(1):111–129.
130. Hosomi S, Oshitani N, Kamata N, et al. Increased numbers of immature plasma cells in peripheral blood specifically overexpress chemokine receptor CXCR3 and CXCR4 in patients with ulcerative colitis. Clin Exp Immunol, 2011;63(2):215–224.
131. Bures J. Memory B lymphocytes in peripheral blood in coeliac disease: a pilot study. Gastroenterol Hepatol, 2019;73(4):296 – 302.
132. Renand A, Habes S, Mosnier JF, et al. Immune Alterations in Patients With Type 1 Autoimmune Hepatitis Persist Upon Standard Immunosuppressive Treatment. Hepatol Commun, 2018;2(8):972–985.
133. Ma L, Qin J, Ji H, et al. Tfh and plasma cells are correlated with hypergammaglobulinaemia in patients with autoimmune hepatitis. Liver Int, 2014;34(3):405–415.
134. Li Y, Wang W, Tang L, et al. Chemokine (C-X-C motif ) ligand 13 promotes intrahepatic chemokine (C-X-C motif ) receptor 5+ lymphocyte homing and aberrant B-cell immune responses in primary biliary cirrhosis. Hepatology, 2015;61(6):1998 – 2007.
135. Zhang J, Zhang W, Leung SCP, et al. Ongoing activation of autoantigen - specific B cells in primary biliary cirrhosis. Hepatology, 2014;60(5):1708–1716.
136. Liu Y, Gong Y, Qu CH, et al. CD32b expression is down-regulated on double-negative memory B cells in patients with Hashimoto’s thyroiditis. Mol Cell Endocrinol, 2017;440 : 1–7.
137. Yu S, Qi Y, Wang H, et al. Dysfunction of CD24+CD38+ B cells in patients with Hashimoto’s thyroiditis is associated with a lack of interleukin 10. Int J Biochem Cell Biol, 2017;90 : 114–120.
138. Ruschil CH, Gabernet G, Lepennetier G, et al. Specific Induction of Double Negative B Cells During Protective and Pathogenic Immune Responses. Front Immunol, 2020;11 : 606338.
139. Van Der Weerd K, Van Hagen MP, Schrijver B, et al. The peripheral blood compartment in patients with Graves’ disease: activated T lymphocytes and increased transitional and pre-naive mature B lymphocytes. Clin Exp Immunol, 2013;174(2):256–264.
140. Mori H, Amino N, Iwatani Y, et al. Increase of peripheral B lymphocytes in Graves’ disease. Clin Exp Immunol, 1980;42(1):33–40.
141. Deng CH, Xiang Y, Tan T, et al. Altered Peripheral B-Lymphocyte Subsets in Type 1 Diabetes and Latent Autoimmune Diabetes in Adults. Diabetes Care, 2016;39(3):434–440.
142. Hanley P, Sutter AJ, Goodman GN, et al. Circulating B cells in type 1 diabetics exhibit fewer maturation-associated phenotypes. Clin Immunol, 2017;183 : 336–343.
143. Roberto P, Lobreglio G, Rosatelli CM, et al. Immunophenotypic Characterisation of Peripheral Blood Lymphocytes in Autoimmune Polyglandular Syndrome Type 1: Clinical Study and Review of the Literature. J Pediatr Endocrinol Metab, 2005;18(2):155–164.
144. Wolff ASB, Oftedal VEB, Kisand K, et al. Flow Cytometry Study of Blood Cell Subtypes Reflects Autoimmune and Inflammatory Processes in Autoimmune Polyendocrine Syndrome Type I. Scand J Immunol, 2010;71(6):459–467.
145. Kohler S, Keil POT, Swierzy M, et al. Disturbed B cell subpopulations and increased plasma cells in myasthenia gravis patients. J Neuroimmunol, 2013;264(1):114–119.
146. Hu Y, Wang J, Rao J, et al. Comparison of peripheral blood B cell subset ratios and B cell-related cytokine levels between ocular and generalized myasthenia gravis. Int Immunopharmacol, 2020;80 : 106130.
147. Kubota A, Izaki S, Fukaura H, et al. Circulating memory B cells are reduced in patients with late-onset myasthenia gravis. Clin Exp Neuroimmunol, 2015;6(3):322–329
148. Golinski ML, Demeules M, Derambure C, et al. CD11c+ B Cells Are Mainly Memory Cells, Precursors of Antibody Secreting Cells in Healthy Donors. Front Immunol, 2020;11 : 32.
149. Mouquet H, Musette P, Gougeon LM, et al. B-Cell Depletion Immunotherapy in Pemphigus: Effects on Cellular and Humoral Immune Responses. J Investe Dermatol, 2008;128(12):2859 – 2869.
150. Lu J, Ding Y, Yi X, et al. CD19+ B cell subsets in the peripheral blood and skin lesions of psoriasis patients and their correlations with disease severity. Braz J Med Biol Res, 2016;49(9):e5374.
151. Czarnowicki T, Gonzalez J, Bonifacio MK, et al. Diverse activation and differentiation of multiple B-cell subsets in patients with atopic dermatitis but not in patients with psoriasis. J Allergy Clin Immunol, 2016;137(1):118–129.
152. Habib J, Deng J, Lava N, et al. Blood B Cell and Regulatory Subset Content in Multiple Sclerosis Patients. J mult Scler, 2015;2(2):1000139.
153. Yilmaz V, Tura AD, Ulusoy C, et al. Flow cytometry analysis of peripheral blood B cell distribution of patients with multiple sclerosis. Turk J Neurol, 2017;23 : 219–224.
154. Claes N, Fraussen J, Vanheusden M, et al. Age-Associated B Cells with Proinflammatory Characteristics Are Expanded in a Proportion of Multiple Sclerosis Patients. J Immunol, 2016;197(12):4576–4583.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2021 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Studie rodinných clusterů s výskytem covid-19 v Ústeckém kraji se zaměřením na děti – klinický obraz, sekundární přenos, protilátková odpověď
- Genotypy norovirů u pacientů Fakultní nemocnice v Plzni, Česká republika, 2017–2020
- Sledování rezistence chřipkových virů na oseltamivir – naše dosavadní zkušenosti
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
- Příušnice a jejich výskyt v České republice a na Slovensku
- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- Covid-19 u dětí spojený s dětským zánětlivým multisystémovým syndromem (PIMS)
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- K osmdesátinám profesora Jiřího Městeckého
- Udělení Řádu T. G. Masaryka I. třídy in memoriam prof. MUDr. Karel Raška, DrSc. (17. 11. 1909–21. 11. 1987)
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti sledování subpopulací B lymfocytů v periferní krvi v rutinní imunologické laboratoři
- Příušnice a jejich výskyt v České republice a na Slovensku
- Corynebacterium sp. izolovaný z hemokultury bakteriemického pacienta. Potvrdí se předpoklady o novém korynebakteriu?
- Prevalence a kontrola arteriální hypertenze v populaci 25–64 let v České republice s ohledem na pacienty s diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



