-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Q horúčka a jej prevencia
Q fever and prevention
Coxiella burnetii is an intracellular, Gram-negative bacterium and the etiological agent of Q fever, a worldwide zoonotic disease with a considerable economic impact in the livestock industry. Domesticated ruminants like cattle, sheep, and goats are the main reservoirs of Q fever in men. Humans usually acquire the disease by inhaling contaminated aerosol produced by infected livestock. Acute infection is typically asymptomatic or manifests as a febrile flu-like illness or pneumonia. In 1–5% of primary infections, chronic Q fever may develop, which can be life-threatening and often presents as endocarditis.
Q fever outbreaks usually occur from occupational exposure involving shepherds, veterinarians, animal handlers, abattoir or dairy workers, and laboratory personnel working with C. burnetii. Thus, prevention and control efforts should be primarily directed toward these groups and the surrounding environment. The most effective way of prophylaxis is vaccination. Although clinical data are lacking, vaccination should also be considered for persons who are at higher risk for development of chronic Q fever, including those with cardiac valve defects, vascular aneurysms, and immunocompromised patients. Therefore, development of an effective and harmless vaccine is a subject of constant interest of researchers for decades. This review summarizes the progress toward Q fever vaccine development.
Keywords:
Coxiella burnetii – Q-fever – vaccine
Autoři: L. Škultéty
Působiště autorů: Mikrobiologický ústav AV ČR, v. v. i., Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 2, s. 87-94
Kategorie: Souhrnná sdělení
Souhrn
Coxiella burnetii je intracelulárna gramnegatívna baktéria a etiologický pôvodca Q horúčky, celosvetovo rozšírenej zoonózy, ktorá má značný ekonomický dopad na chov hospodárskych zvierat. Hlavnými rezervoármi Q horúčky sú domestikované prežúvavce, ako je hovädzí dobytok, ovce a kozy. Ľudia sa obvykle infikujú inhaláciou kontaminovaného aerosólu produkovaného nakazenými zvieratami. Akútna infekcia je u ľudí často asymptomatická, alebo sa prejavuje ako horúčkovité ochorenie podobné chrípke, často s nálezom atypickej pneumónie. U 1–5 % primárnych infekcií sa môže rozvinúť chronická forma, ktorá je často život ohrozujúca a prejavuje sa väčšinou ako endokarditída.
Ohniská Q-horúčky zvyčajne vypuknú z infekcie ľudí s rizikovým povolaním, akými sú pastieri, chovatelia zvierat, veterinári, pracovníci na bitúnkoch (jatkách), či mliekárniach, alebo výskumníci pracujúci s pôvodcom nákazy. Diagnostika a prevencia by sa teda mala primárne zamerať na tieto skupiny obyvateľstva a okolité životné prostredie. Najúčinnejším spôsobom prevencie je očkovanie. Aj keď klinické údaje nie sú dostatočné, očkovanie by sa malo zvážiť aj u osôb, ktoré sú vystavené vyššiemu riziku chronickej Q horúčky, a to najmä u imunokompromitovaných pacientov a osôb s poruchami srdcových chlopní, arteriálnymi aneuryzmami, či s vaskulárnym štepom. Vývoj účinnej a bezpečnej očkovacej látky voči Q horúčke je preto predmetom trvalého záujmu vedcov už celé desaťročia. Táto prehľadná práca sumarizuje pokrok vo vývoji týchto prípravkov.
Klíčová slova:
Coxiella burnetii – Q-horúčka – vakcína
ÚVOD
Q horúčka je horúčkovité ochorenie ľudí, ktoré bolo prvýkrát zdokumentované Eduardom Derrickom v roku 1935 u pracovníkov bitúnku v Brisbane (Queensland, Austrália) [1–3]. Nešpecifické príznaky tejto infekcie, vrátane intenzívnej bolesti hlavy a nevoľnosti naznačovali, že by mohlo ísť o brušný týfus, paratýfus alebo leptospirózu. Laboratórne testy však tento predpoklad nepotvrdili, a preto bolo toto ochorenie označené ako horúčka neznámeho pôvodu – Q horúčka (Q – z angličtiny Query – neznámy). Ďalšie štúdie však odhalili morfologickú podobnosť s rickettsiami, čoho výsledkom bolo počiatočné zatriedenie do rodu Rickettsia [3]. Avšak na základe sekvenčnej analýzy 16S rRNA bola táto baktéria fylogeneticky preklasifikovaná z radu Rickettsiales do Legionellales a najbližšími príbuznými sa stali rody Legionella a Francisella [4].
COXIELLA BURNETII
Pôvodcom Q horúčky je gramnegatívny kokobacil patriaci do čeľade Coxiellaceae [5, 6]. Typické pre tento rod je intracelulárny životný štýl v bunkách bezstavovcov, či stavovcov. C. burnetii prechádza vývojovým cyklom s dvoma morfologicky odlišnými formami. Malý bunkový variant (SCV – z ang. Small cell variant) je extracelulárna forma, ktorá je metabolicky neaktívna, ale vysoko odolná voči stresovým faktorom v životnom prostredí. Naproti tomu veľký bunkový variant (LCV – z ang. Large cell variant) je metabolicky a propagačne aktívny. Vyvíja sa vo vnútri monocytov alebo makrofágov po infikovaní buniek hostiteľa. Zdá sa, že spúšťačom tejto diferenciácie je nízke pH vo vnútri parazitofórnej vakuoly [7, 8].
V laboratórnych podmienkach baktéria podlieha aj antigénnej fázovej variácii [9]. C. burnetii izolovaná z prírodných zdrojov je plne virulentná a exprimuje na svojom povrchu molekuly typické pre antigénny variant I, medzi ktorými sú najvýznamnejšie lipopolysacharidy (LPS) s O-špecifickým postranným reťazcom obsahujúce 2 unikátne cukorné jednotky, virenózu a dihydrohydroxystreptózu [10]. K fázovému posunu dochádza po sérii pasáží in vitro v embryonálnych slepačích vajíčkach, tkanivových kultúrach, alebo najrýchlejšie v axenickom médiu. Výsledkom sú bunky fázy II so skráteným LPS, ktorý síce obsahuje lipid A a niekoľko rovnakých cukorných jednotiek v jadrovej oblasti ako fáza I, ale chýba mu O-polysacharid [11]. Táto antigénna forma má zníženú virulenciu a u imunokompetentných zvierat, či ľudí nespôsobuje ochorenie. Jav premenlivosti fáz má obrovský význam aj z hľadiska diagnostiky. Počas akútnej infekcie sa totiž najskôr objavujú protilátky proti fáze II a až neskôr protilátky proti antigénom fázy I. Pre chronickú infekciu sú preto typické dlhodobo zvýšené hladiny protilátok fázy I [12].
C. burnetii však nie je len pôvodcom ochorenia, ale javí sa aj ako účinný imunopotentátor. U zvierat, ktorým boli podané inaktivované bunky vo fáze I, sa pozorovalo významné zvýšenie rezistencie voči nádorom, vírusom, baktériám, alebo prvokom, a to prostredníctvom špecifickej, či nešpecifickej imunity [13–15]. Môžu za to pravdepodobne antigény, ktoré u hostiteľov výrazne zvyšujú tvorbu interferónu-γ (IFN-γ) a faktora nádorovej nekrózy-α (TNF-α) [16, 17]. Práve tieto molekuly sa následne podieľajú na inhibícii infekcie, a to stimuláciou baktericídnych systémov makrofágov a cytotoxických NK buniek [18]. Zistilo sa, že C. burnetii zvyšuje tvorbu cytokínov, ako sú GM-CSF a IL-1, ktoré stimulujú dendritické bunky. Môže tiež zvýšiť hladiny lymfokínov, či expresiu lymfocytárneho antigénu Ia MHC triedy II, čo vedie k zosilneniu antigén-špecifických humorálnych a bunkových imunitných reakcií u hostiteľov [17].
ŠÍRENIE BAKTERIE
Q horúčka je zoonóza s celosvetovou distribúciou [19, 20]. Domestikované kopytníky, vrátane hovädzieho dobytka, oviec a kôz sa považujú za primárne rezervoáre tejto nákazy u ľudí. Pôvodcu infekcie môže ale prenášať aj široká škála iných živočíchov, ako sú voľne žijúce (cicavce, plazy, ryby a vtáky) alebo domáce zvieratá (mačky a psy). Najmä mačky sa považujú za hlavný rezervoár C. burnetii v mestských aglomeráciách a za potenciálny zdroj ohnísk [21]. Kliešte a iné článkonožce sa na prenose podieľajú len čiastočne [22]. Zvyčajne infikujú voľne žijúce zvieratá a len zriedka človeka.
U zvierat je infekcia často asymptomatická, ale za určitých okolností sa prejavuje nízkou produkciou mlieka, neplodnosťou, endometritídou, placentitídou, potratom, či pôrodom mŕtvych alebo slabých mláďat [3, 19]. Mimoriadne infekčné sú najmä gravidné zvieratá v čase pôrodu. Coxiella má totiž silný tropizmus ku samičiemu reprodukčnému systému [23, 24], a preto sa v maternici, placente, či plodovej vode nachádza obrovské množstvo patogénu. Počas pôrodu, či potratu sa bakteriálne bunky z infikovaných tkanív uvoľňujú a prostredníctvom malých kvapiek aerosólu sa šíria vzduchom a kontaminujú prostredie. Inhalácia takéhoto aerosólu je primárnym zdrojom infekcie človeka. Keďže ľudia sú vysoko vnímaví, infekciu môže vyvolať čo i len pár buniek [25]. Mikroorganizmus sa u nakazených zvierat vylučuje aj do mlieka, moču a výkalov [26, 27], a preto sa nákaza môže preniesť aj pri pasení, či konzumácii produktov pôrodu. Medzi iné spôsoby prenosu patrí požitie nepasterizovaného mlieka, či mliečnych výrobkov. K prenosu z človeka na človeka dochádza len zriedkavo, ak vôbec. Je ale potrebné spomenúť, že C. burnetii môže vyvolať ochorenie aj bez priameho kontaktu s infikovanými zvieratami. Je totiž vysoko odolná voči rôznym environmentálnym podmienkam, dokáže prežiť vo vonkajšom prostredí bez hostiteľa aj niekoľko mesiacov, či rokov a po vetre sa šíri na značnú vzdialenosť (2–3 km alebo viac).
RIZIKOVÉ POVOLANIA
Keďže Q horúčka patrí medzi zoonózy, šíri sa najmä v poľnohospodárskych oblastiach. Preto predovšetkým infikuje [28, 29]:
- farmárov, pastierov, či chovateľov hospodárskych zvierat, ktorí pracujú s nakazenými zvieratami, či kontaminovaným materiálom (podstielka, výkaly alebo pôda kontaminovaná hnojom);
- chovateľov domácich zvierat, či ošetrovateľov exotických zvierat v zoologických záhradách;
- veterinárov (najmä počas pôrodu, či chirurgických výkonov);
- pracovníkov, či návštevníkov obchodov so zvieratami či aukcií zvierat;
- poľovníkov, či lovcov zveri;
- vodičov vozidiel prevážajúcich zvieratá;
- pracovníkov na bitúnkoch, v baliarni mäsa alebo v kafilérii;
- spracovateľov kožušín, či vlny;
- pracovníkov manipulujúcich s kontaminovaným pracovným odevom.
Nemožno ale zabúdať ani na výskumníkov pracujúcich s C. burnetii, ako ani na zdravotnícky personál, ktorý je v kontakte s krvou, spútom alebo tkanivom infikovaných pacientov (za bežných okolností zdravotnícky personál nie je ohrozený).
SYMPTÓMY Q HORÚČKY
Inkubačná doba závisí od veľkosti infekčnej dávky a obvykle trvá 2–3 týždne. Klinické príznaky sa však objavia len u polovici infikovaných. Akútna infekcia nastupuje náhle a prejavuje sa najmä vysokou horúčkou, zimnicou, potením, slabosťou, silnými bolesti hlavy, bolesťami svalov, zmätenosťou, bolesťami hrdla, bolesťou na hrudníku, neproduktívnym kašľom, nevoľnosťou, zvracaním, alebo hnačkou, či bolesťami brucha. Horúčka zvyčajne pretrváva 1–2 týždne a je často sprevádzaná výraznou stratou hmotnosti. U 30–50 % pacientov so symptomatickou infekciou sa vyvinie pneumónia. Väčšina pacientov má tiež abnormálne výsledky biochemických testov funkcie pečene. Prejaviť sa ale môže aj ako granulomatózna hepatitída, myokarditída alebo porucha centrálneho nervového systému [30–31]. V priebehu niekoľkých mesiacov sa väčšina pacientov plne zotaví, a to často aj bez akejkoľvek liečby. Výnimočne pretrváva v podobe tzv. syndrómu chronickej únavy, ktorý je charakterizovaný neustálou alebo opakujúcou sa únavou, nočným potením, silnými bolesťami hlavy, fotofóbiou, bolesťami svalov a kĺbov, či zmenami nálady, alebo problémami so spánkom [32]. Len približne 1–2 % pacientov s akútnou Q horúčkou podľahne tomuto ochoreniu [33]. Rizikovým je najmä pre tehotné ženy, keďže môže viesť k predčasnému pôrodu alebo potratu, narodeniu mŕtveho plodu, alebo dieťaťa s nízkou pôrodnou hmotnosťou.
U 1–5 % pacientov, ktorí prekonali primárnu akútnu Q horúčku, sa však môže vyvinúť o veľa nebezpečnejšia chronická infekcia [34]. Tá zväčša pretrváva dlhšie ako 6 mesiacov. Ohrození sú najmä ľudia s poruchami srdcových chlopní, vaskulárnymi aneuryzmami alebo chorobou štepu. Rizikovým faktorom je tiež tehotenstvo a imunosupresívna liečba. Najčastejšie sa toto ochorenie prejavuje endokarditídou, ktorá je pri zanedbanej liečbe často fatálna [33]. Preto pacienti trpiaci na tieto ochorenia by mali byť dôsledne diagnostikovaní, a v prípade potreby liečení antibiotikami (najmenej 18 mesiacov). Medzi ďalšie prejavy chronickej Q horúčky patria hepatitída, vaskulitída, osteomylitída alebo zápaly reprodukčných orgánov.
BIOLOGICKÁ ZBRAŇ
Q horúčka predstavuje mimoriadne bezpečnostné riziko aj pre armádu, a to najmä v regiónoch s vysokým výskytom. Najvyššie prevalencie Q horúčky boli hlásené z Blízkeho východu. Napríklad nedávny skríning v Iráne naznačil vysokú mieru séropozitivity u oviec (23,7 %) [35]. Tá veľmi dobre korelovala s výsledkami analýz u ľudí, ktorí boli v styku so zvieratami, kde séropozitivita dosiahla hodnotu 27,8 % [36]. Zvýšené hladiny protilátok boli potvrdené aj v skupine amerických vojakov, ktorí boli nasadení v Iraku [37]. Rozsiahla štúdia na 909 vojakoch, ktorí boli prijatí do nemocníc s horúčkou a inými nešpecifickými príznakmi, taktiež potvrdila vysokú séropozitivitu na Q horúčku u 88 z nich [38]. Práca z roku 2005 [39] popisujúca vznik ohniska nákazy v skupine 38 vojakov amerických námorných síl, dokonca potvrdila aj vysokú infektivitu patogénu, ktorá viedla k rozvoju infekcie u 22 z nich. Podobné zistenia uviedli aj spojenecké armády pôsobiace v oblasti. Napríklad v britských jednotkách sa z 26 prípadov horúčky neznámeho pôvodu potvrdila Q horúčka až v 6 prípadoch [40].
Skutočnou obavou je však použitie C. burnetii ako biologickej zbrane [41–43]. Táto baktéria totiž dokáže účinne oslabiť, prípadne znefunkčniť ľudský potenciál, pričom je pre človeka vysoko infekčná, je ľahko šíriteľná vzdušnou cestou a dobre odoláva environmentálnym vplyvom. Práve tieto vlastnosti viedli k jej testovaniu v útočných programoch (pred prijatím Dohovoru o biologických zbraniach) [41, 42]. Napríklad Spojené štáty americké zaradili testovanie C. burnetii do operácie Biely plášť (Whitecoat), v ktorej boli dobrovoľníci úmyselne vystavení tomuto patogénu a následne dôsledne monitorovaní na príznaky ochorenia a okamžite liečení oxytetracyklínom [1, 44]. Testovaný bol aj účinok bakteriálneho aerosólu vypusteného z výšky cca. 900 metrov [45]. Všetci exponovaní dobrovoľníci boli následne liečení antibiotikami a sledovaní na vývoj chronickej infekcie. Podobné výskumy samozrejme prebiehali aj v bývalom Sovietskom zväze [46]. Práve obava zo zneužitia C. burnetii, či ohrozenia verejného zdravia, vzbudili záujem o prevenciu, vrátane vakcinačných programov.
OPATRENIA V RÁMCI PREVENCIE A OCHRANY ZDRAVIA ĽUDÍ A ZVIERAT
Q horúčka patrí k najdrahším a najzávažnejším infekčným ochoreniam [47]. Vedie k významným ekonomickým stratám, a to nielen v dôsledku dlhodobej pracovnej neschopnosti a liečby infikovaných pracovníkov, ale aj zníženej produkcie mlieka, či nerealizovaného reprodukčného potenciálu hospodárskych zvierat následkom potratov, či mŕtvo narodených mláďat. Najúčinnejším preventívnym opatrením by bola preto eradikácia C. burnetii z hospodárskych zvierat. Také programy však v súčasnosti neexistujú. Bezpečnosť a ochranu zdravia obyvateľstva je preto nutné zamerať na dôslednú diagnostiku a prevenciu, a to najmä u rizikových skupín [48]. Pracovníci, ktorí prichádzajú do styku so zvieratami, živočíšnymi výrobkami a živočíšnym odpadom, by mali byť dôsledne informovaní o tejto chorobe, jej príznakoch a povahe rizika. Chované zvieratá by mali byť rutinne testované a sekundárne produkty pôrodu efektívne likvidované. S cieľom znížiť riziko vzniku ohnísk nákazy u ľudí, by chovné zariadenia nemali byť umiestnené v blízkosti husto obývaných oblastí a vyprodukované mlieko by malo byť vždy pasterizované. Odporúča sa tiež, aby zamestnanci takýchto zariadení boli pravidelne testovaní a v prípade potreby, bola zahájená účinná liečba [28, 49].
Riziko infekcie sa dá znížiť aj:
- zavedením bezpečnostných opatrení na ochranu osôb,
- zvýšením hygieny na pracovisku a
- očkovaním pracovníkov.
Prvoradé sú opatrenia na ochranu osôb, ktoré by mali znížiť riziko infekcie a zabrániť jej šíreniu na pracoviskách. V prípade prepuknutia infekcie by všetci pracovníci mali byť dôsledne vyškolení v dezinfekčných a sterilizačných postupoch. Mali by si často umývať a dezinfikovať ruky. Na pracovisku by nemali jesť, piť, fajčiť a ani si obhrýzať nechty. Mali by neustále nosiť ochranné pomôcky (pracovný odev, obuv a jednorazové rukavice), vrátane vhodných masiek, či respirátorov, ktoré zabránia vdýchnutiu aerosólu. Kontaminovaný odev by sa mal pred praním dezinfikovať v autokláve, alebo aspoň prať v horúcej vode. V žiadnom prípade by sa nemal nosiť do obydlí alebo verejných priestorov.
Pracoviská musia mať preto vypracovaný a implementovaný hygienický plán pre rutinnú dezinfekciu alebo sterilizáciu povrchov a osobnú hygienu. Musia výrazne obmedziť vstup do priestorov so zvýšeným rizikom Q horúčky (ustajnenie potenciálne infikovaných zvierat alebo zvierat v karanténe, či v infekčných zverincoch a laboratóriách). Všetky povrchy v týchto priestoroch, vrátane podláh a stien, ktoré by mohli byť kontaminované tekutinami alebo exkrementami infikovaných zvierat, sa musia pravidelne dezinfikovať vhodnými postupmi. Pôrody by sa mali uskutočniť v samostatných, ľahko dezinfikovateľných miestnostiach a všetky zvyšky bezpečne likvidovať. Infekčný odpad by sa najskôr mal vložiť do nádob odolných voči prepichnutiu a úniku, zreteľne označiť a sterilizovať pred finálnou likvidáciou v spaľovniach biologického odpadu. Podobne by sa mali likvidovať aj uhynuté zvieratá. Exkrementy zvierat by sa mali najskôr kompostovať, a až následne rozprestierať na pôdu, a aj to len za vhodných poveternostných podmienok, aby sa predišlo šíreniu prostredníctvom aerosolu.
Očkovanie exponovanej populácie by bolo ale najúčinnejším opatrením voči šíreniu Q horúčky medzi obyvateľstvom [50]. Aj keď klinické údaje sú nedostatočné, očkovanie by sa malo zvážiť aj u osôb s vyšším rizikom rozvoja chronickej formy ochorenia, teda najmä u imunokompromitovaných pacientov a osôb s poruchami srdcových chlopní, arteriálnymi aneuryzmami, či s vaskulárnym štepom [510]. V súčasnosti však vo svete existuje len jediná komerčne dostupná vakcína voči Q horúčke pre očkovanie ľudí. Ide o vysokopurifikovanú a formalínom inaktivovanú korpuskulárnu vakcínu Q-VAX® pripravenú v Commonwealth Serum Laboratories (Sequirus Australia) z buniek C. burnetii kmeňa Henzerling vo fáze I [52], ktorá je od roku 1989 licencovaná v Austrálii [47]. Keďže táto vakcína preukázala vysokú účinnosť voči akútnej forme infekcie [53–55], ktorá pretrváva minimálne po dobu piatich rokov [56], Austrália v roku 2002 zahájila národný vakcinačný program pre ohrozené skupiny obyvateľstva. Tým sa v krajine výrazne obmedzilo šírenie Q horúčky, čo sa prejavilo znížením počtu hlásených prípadov o viac ako 50 % [57].
Vývoj účinnej vakcíny voči Q horúčke je ale samozrejme predmetom neustáleho záujmu vedcov už niekoľko desaťročí [58, 59]. Jedna z prvých vakcín bola vyvinutá len pár rokov po rozpoznaní baktérie C. burnetii. Išlo taktiež o formalínom usmrtené korpuskuly C. burnetii kmeňov Henzerling a Dyer, ktoré boli purifikované éterovou extrakciou [60]. Podobne bola pripravená aj korpuskulárna vakcína z kmeňa Nine Mile [61], ktorá je od roku 2011 licencovaná v Európe pre očkovanie hospodárskych zvierat pod názvom Coxevac [62]. Uskutočnili sa tiež pokusy s prípravkami, ktoré boli inaktivované gama žiarením [63]. Keďže sa počas výskumu zistilo, že protektívny účinok pasážovaním slabne, bunky fázy I boli označené ako antigénne kompletné, a tak vhodnejšie na prípravu vakcín [64, 65]. To však viedlo aj k zvýšenému výskytu miestnych, či systémových reakcií u vakcinovaných osôb [66, 67], medzi ktoré patrí erytém alebo bolestivosť v mieste podania injekcie, bolesti hlavy a príznaky podobné chrípke, ako horúčka, zimnica, či potenie [43]. Tie sa vyskytli najmä u senzibilizovaných osôb, ktoré už prišli do styku s pôvodcom nákazy. Z vakcinácie ich preto bolo potrebné vylúčiť. Na tento účel sa vypracoval kožný test [68] a len napríklad v nedávnej rozsiahlej štúdii v Holandsku, bolo týmto testom a sérologickým vyšetrením vylúčených z očkovania až 22 % osôb [69]. Hoci sa podarilo čiastočne eliminovať nežiadúce reakcie dokonalejšou purifikáciou [70] a korpuskulárne vakcíny jasne preukázali vysokú imunogénnosť a schopnosť indukovať bunkovú a humorálnu imunitu na zvieratách, či ľudských dobrovoľníkoch [64], neboli odporučené na očkovanie širokej populácie obyvateľstva. Preto sa aj Q-VAX® môže doviesť do krajín EÚ len so súhlasom regionálnych autorít, a to zväčša iba za mimoriadnych okolností, ako sú epidémie veľkých rozmerov (tab. 1).
Tab. 1. Kľúčové očkovacie prípravky voči Q horúčke
Table 1. Key vaccines against Q fever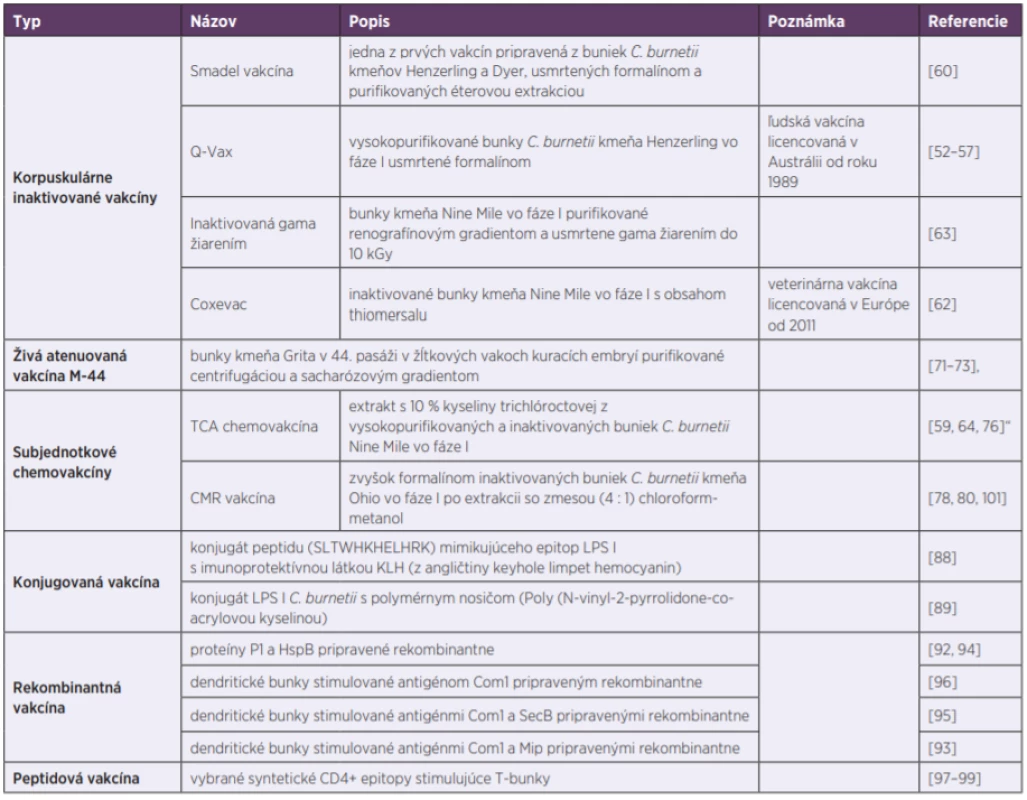
S cieľom obísť reaktogénnosť usmrtených buniek, pracovníci Gamalejovho epidemiologického ústavu v Moskve (Rusko) ešte v šesťdesiatych rokoch minulého storočia vyvinuli živú atenuovanú očkovaciu látku proti Q horúčke [71, 72]. Podarilo sa im získať kmeň Grita, ktorý v 44. pasáži v žĺtkových vakoch kuracích embryí výrazne znížil svoju virulenciu. Vakcína označená M-44 bola následne testovaná na stovkách dobrovoľníkov [3, 72, 73], u ktorých stimulovala imunitnú odpoveď [41]. Hoci táto vakcína bola v Rusku rozsiahlo využívaná, vo svete nenašla širšie uplatnenie [20, 43]. Zistilo sa totiž, že atenuované kmene použité na prípravu živých vakcín stratili niektoré atribúty virulencie, spojené s antigénnosťou a protektívnym účinkom. Navyše, niektoré štúdie poukázali na dlhodobú perzistenciu infekcie u pokusných zvierat, v ktorých vakcína spôsobovala drobné lézie v orgánoch, ako sú srdce, pečeň a slezina, alebo myokarditídu, či hepatitídu [74]. Práve tento fakt vyvolal obavu zo zvýšeného rizika vzniku endokarditídy, a to najmä u ľudí s reumaticky poškodenými srdcovými chlopňami, čo spochybnilo bezpečnosť vakcíny.
Základným krokom k zvýšeniu bezpečnosti vakcín bolo preto rozpoznanie protektívnych antigénov, a to extrakciou imunogénnych komponentov [75]. S týmto cieľom bol slovenským tímom z Virologického ústavu SAV v Bratislave pripravený solubilný antigén [61]. Pomocou kyseliny trichlóroctovej (10%) sa získal komplex obsahujúci proteíny a LPS [76]. Hoci táto acelulárna subjednotková chemovakcína stále obsahovala malé množstvo endotoxínu, stala sa oproti korpuskulárnym vakcínam lepšou voľbou, a preto sa pristúpilo k testovaniu jej reaktogénnosti a imunogénnosti na dobrovoľníkov v dlhodobých terénnych skúškach [59, 64, 76]. Očkovaní boli najmä laboratórní pracovníci, farmári, veterinárni lekári, ale aj vojaci nasadení v endemických regiónoch. U všetkých očkovaných sa zaznamenala signifikantná protilátková odpoveď, ktorá pretrvávala roky, a to za minimálnych vedľajších účinkoch [64, 76]. Aby sa odhalili účinné zložky, bola táto vakcína lepšie popísaná proteomickými metódami [77].
Ďalšia subjednotková vakcína bola pripravená v Rocky Mountain laboratóriách (Montana, Colorado, USA) v spolupráci s Medicínskym vedeckým inštitútom pre infekčné ochorenia armády Spojených štátov amerických. Išlo o zvyšok formalínom inaktivovaných buniek C. burnetii kmeňa Ohio vo fáze I, z ktorých prostredníctvom extrakcie so zmesou (4 : 1) chloroform-metanol bol odstránený „endotoxín“ [78, 79]. Táto vakcína úspešne prešla klinickými skúškami fázy I, v ktorých preukázala, že je bezpečná a účinná [80, 81]. Problém nastal iba v tom, že primárna dávka väčšinou nevyvolala tvorbu špecifických protilátok, ale až podporná, takže použitie tejto vakcíny vyžadovalo ďalšie náklady na preočkovanie. Hoci boli prezentované len minimálne nežiadúce účinky, isté pochybnosti o bezpečnosti vakcíny vyvolal aj fakt, že jedinci s pozitívnymi testami na C. burnetii, boli zo štúdie predom vylúčení [81, 82].
PROGRES VO VÝVOJI VAKCÍN NOVEJ GENERÁCIE
Hoci vyššie uvedené vakcíny priniesli veľa nádeje a jasne preukázali svoju účinnosť voči akútnej forme ochorenia, ich aplikácia vyžadovala predošlý skríning pomocou kožného testu alebo sérodiagnostiky. To ale z hľadiska rýchleho nasadenia v endemických oblastiach u profesionálov verejného zdravotníctva alebo armády znamenalo veľký problém. Preto stále pretrváva potreba vývoja „čistej“ vakcíny, ktorá by poskytla nielen vysokú a dlhodobú ochranu voči Q horúčke, ale aj bez akýchkoľvek vedľajších účinkov, či potreby ďalších podporných očkovaní. Tento cieľ však nie je ľahké dosiahnuť. Závisí najmä od toho, do akej miery sa podarí vybrať „správne“ a „dobre“ antigény. „Správne“ antigény reprezentujú faktory, ktoré sa zúčastňujú na vývoji ochorenia. Tie totiž indikujú tvorbu príslušných protilátok alebo bunkovú imunitnú odpoveď. Požiadavka „dobrého“ antigénu má na zreteli rýchly a výrazný protektívny účinok, a to bez ohľadu na to, či je jeho povaha je látková (humorálna) alebo bunková [83]. Hoci niektoré štúdie naznačili, že protilátky a B bunková odpoveď hostiteľa bude mať významnú úlohu v boji voči Q horúčke [84], dnes je už zjavné, že samotné nestačia a pri eliminácii baktérie je kľúčová imunita sprostredkovaná T bunkami [18, 85, 86].
Po dôslednej analýze Q-Vax bolo naznačené, že jednou z hlavných zložiek vakcíny novej generácie je vysoko imunogénny LPS fázy I a jeho komponenty [52], u ktorého bola preukázaná jasná spojitosť s imunitou voči Q horúčke [65, 86]. Tieto molekuly totiž dokážu aktivovať nielen B bunky, ale aj stimulovať makrofágy a T-bunky [87], z ktorých práve CD4+ a CD8+ majú kľúčovú úlohu pri eliminácii baktérie [85]. Následne Karahan v spolupráci s Virologickým ústavom SAV v Bratislave pripravil vakcínu novej generácie [88], ktorá bola založená na konjugáte LPS I C. burnetii s polymérnym nosičom (Poly - -N-vinyl-2-pyrrolidone-co-acrylová kyselina). Hoci tento komplex bol schopný poskytnúť významnú ochranu proti infekcii, získanie dostatočného množstva čistého LPS I výrazne obmedzuje využitie tohto typu vakcín v širokom meradle. Prostredníctvom kombinatoriálnej knižnice pre fágový displej bol preto odhalený a syntetizovaný peptid napodobňujúci protektívny epitop na LPS I C.burnetii [89]. Tento peptid (SLTWHKHELHRK) bol následne konjugovaný s imunoprotektívnou látkou KLH (z angličtiny keyhole limpet hemocyanin) a testovaný na myšiach BALB/c. Hoci vytvorený konjugát bol schopný vyvolať tvorbu protilátok a inhibovať infekciu, jeho ochranná funkcia bola výrazne nižšia ako u korpuskulárnej vakcíny [89].
Ďalšou významnou zložkou vakcín novej generácie by mohli byť proteíny interagujúce s monocytmi a makrofágami, ktoré stimulujú imunitný systém a zvyšujú produkciu interferónu-γ a iných cytokínov, ktoré obmedzujú intracelulárny rast baktérie [52, 64]. Medzi ne bezpochyby patria niektoré immunogénne [64, 90], či imunodominantné proteíny [91]. Z nich je potrebné spomenúť aspoň 29 kDa porín P1, Com1, SecB, HspB a Mip, ktoré boli pripravené aj rekombinantne [92–94]. Následne bolo preukázané, že imunita získaná po expozícii s proteínom P1 [80] alebo v zmesi s HspB [94], výrazne zvýšila klírens C. burnetii zo slezín infikovaných myší. Podobne aj pasívny prenos dendritických buniek z kostnej drene, ktoré boli stimulované antigénmi Com1, Mip a SecB, vyvolal čiastočnú ochranu [95, 96]. Zistilo sa, že takto aktivované bunky boli schopné polarizovať imunitný systém, a to predominantne smerom k tvorbe Th1 a Tc1 buniek [93]. Keďže práve T bunková odpoveď je pri eliminácii baktérie kľúčová, výskum pokračoval aj v smere hľadania CD4+ epitopov stimulujúcich T-bunky [97, 98]. Práve tento prístup sa zdá byť z pohľadu vývoja bezpečnej vakcíny najperspektívnejší, keďže úplne vylučuje prítomnosť akýchkoľvek intaktných LPS-proteínových komplexov v očkovacej látke, ktoré by mohli prispieť k nežiadúcim účinkom. Zároveň takáto vakcína minimalizuje aj krížovú reaktivitu v dôsledku vylúčenia homológnych epitopov [99].
ZÁVER
Vzhľadom na relatívny nedostatok informácií o CD4+ epitopoch, či proteínových antigénoch C. burnetii, ktoré by mohli predstavovať protektívne molekuly vhodné na formuláciu vakcíny novej generácie, je potrebné pokračovať v nastolenom výskume. Pomôcť môžu najmä proteínové mikročipy, ktoré sú ideálne na skríning imunitnej odpovede pacientov s Q horúčkou [100]. Klinické imunologické štúdie môžu taktiež identifikovať imunogénne antigény, ktoré prispievajú k ochrannej imunitnej odpovedi alebo naopak k reaktogénosti vakcíny u exponovanej populácie. Po identifikácii „správnych“ a „dobrých“ antigénov, ktoré indikujú tvorbu protilátok alebo bunkovú imunitnú odpoveď, bude tiež nutné vyvinúť zvierací model schopný zhodnotiť pravdepodobnosť vyvolania nežiadúcich reakcií u človeka s predošlou expozíciou s C. burnetii. Len tak bude možné pripraviť vakcínu voči Q horúčke, ktorá bude vyhovovať potrebám širokej populácie obyvateľstva.
Poďakovanie
Ministerstvo kultury, školství a tělovýchovy České republiky (LO1509).
Adresa pro korespondenci:
Ing. Ľudovít Škultéty, DrSc.
Mikrobiologický ústav AV ČR v.v.i.
Vídeňská 1083
142 20 Praha 4
e-mail: ludovit.skultety@biomed.cas.cz
Zdroje
1. Benenson AS, Tigertt WD. Studies on Q fever in man. Trans Assoc Am Physicians, 1956;69 : 98-104.
2. Fiset P, Woodward TE. Q Fever. In: Evans AS, Feldman HA. Bacterial Infections of Humans. Boston, MA: Springer US; 1982. s. 435-448.
3. Marrie TJ. Q fever - a review. Can Vet J, 1990;31(8):555-563.
4. Hornstra HM, Priestley RA, Georgia SM, et al. Rapid typing of Coxiella burnetii. PLoS One, 2011;6(11):e26201.
5. Massung RF, Dasch GA, Eremeeva ME. Rickettsia and Coxiella. In: Budowle B, Schutzer SE, Breeze RG, et al. Microbial Forensics, 2nd edition. Cambridge, MA: Academic Press US; 2011. s. 277-295.
6. Gürtler L, Bauerfeind U, Blümel J, et al. Coxiella burnetii - Pathogenic Agent of Q (Query) Fever. Transfus Med Hemotherapy, 2014;41(1):60-72.
7. Howe D, Mallavia LP. Coxiella burnetii exhibits morphological change and delays phagolysosomal fusion after internalization by J774A.1 cells. Infect Immun, 2000;68(7):3815-3821.
8. Minnick MF, Raghavan R. Developmental biology of Coxiella burnetii. In: Toman R, Heinzen R, Samuel J, et al. Coxiella burnetii: Recent advances and new perspectives in research of the Q Fever bacterium: Advances in experimental medicine and biology (vol 984). Dordrecht: Springer; 2012. s. 231-248.
9. Hotta A, Kawamura M, To H, et al. Phase variation analysis of Coxiella burnetii during serial passage in cell culture by use of monoclonal antibodies. Infect Immun, 2002;70(8):4747-4749.
10. Toman R, Skultety L, Ftacek P, et al. NMR study of virenose and dihydrohydroxystreptose isolated from Coxiella burnetii phase I lipopolysaccharide. Carbohydr Res, 1998;306(1-2):291-296.
11. Ftácek P, Skultéty L, Toman R, et al. Phase variation of Coxiella burnetii strain Priscilla: Influence of this phenomenon on biochemical features of its lipopolysaccharide. J Endotoxin Res, 2000;6(5):369-376.
12. Slabá K, Škultéty L, Toman R, Slaba K, Skultety L, Toman R. Efficiency of various serological techniques for diagnosing Coxiella burnetii infection. Acta Virol, 2005;49(2):123-127.
13. Clark IA. Resistance to Babesia spp. and plasmodium sp. in mice pretreated with an extract of Coxiella burnetii. Infect Immun, 1979;24(2):319-325.
14. Kelly MT, Granger DL, Ribi E, Milner KC, Strain SM, Stoenner HG. Tumor regression with Q fever rickettsiae and a mycobacterial glycolipid. Cancer Immunol Immunother, 1976;1(3):187-191.
15. Rolph MS, Mahalingam S, Cowden WB. Nonspecific antiviral immunity by formalin-fixed Coxiella burnetii is enhanced in the absence of nitric oxide. Virology, 2004;326(1):1-5.
16. Waag DM, Kende M, Damrow TA, Wood OL, Williams JC. Injection of inactivated phase I Coxiella burnetii increases non-specific resistance to infection and stimulates lymphokine production in mice. Ann N Y Acad Sci, 1990;590(1):203-214.
17. Zvilich M, Williams JC, Waag D, et al. Characterization of the non-specific humoral and cellular antiviral immunity stimulated by the chloroform-methanol residue (CMR) fraction of Coxiella burnetii. Antiviral Res, 1995;27(4):389-404.
18. Koster FT, Williams JC, Goodwin JS. Cellular immunity in Q fever: modulation of responsiveness by a suppressor T cell-monocyte circuit. J Immunol, 1985;135(2):1067-1072.
19. Parker NR, Barralet JH, Bell AM. Seminar Q fever. Lancet, 2006;367(9511):679-688.
20. Arricau-Bouvery N, Rodolakis A. Is Q Fever an emerging or re-emerging zoonosis? Vet Res, 2005;36(3):327-349.
21. Shapiro AJ, Bosward KL, Heller J, Norris JM. Seroprevalence of Coxiella burnetii in domesticated and feral cats in eastern Australia. Vet Microbiol, 2015;177(1-2):154-161.
22. Špitalská E, Sparagano O, Stanko M, et al. Diversity of Coxiella-like and Francisella-like endosymbionts, and Rickettsia spp., Coxiella burnetii as pathogens in the tick populations of Slovakia, Central Europe. Ticks Tick Borne Dis, 2018;9(5):1207-1211.
23. Van den Brom R, van Engelen E, Roest HIJ, et al. Coxiella burnetii infections in sheep or goats: an opinionated review. Vet Microbiol, 2015;181(1-2):119-129.
24. Roest HIJ, Bossers A, van Zijderveld FG, et al. Clinical microbiology of Coxiella burnetii and relevant aspects for the diagnosis and control of the zoonotic disease Q fever. Vet Q, 2013;33(3):148-160.
25. Honarmand H. Q fever: An old but still a poorly understood disease. Interdiscip Perspect Infect Dis, 2012;2012:Article ID 131932.
26. Gyuranecz M, Sulyok KM, Balla E, et al. Q fever epidemic in Hungary, April to July 2013. Eurosurveillance, 2014;19(30):9-13.
27. Rodolakis A, Berri M, He C, et al. Comparison of Coxiella burnetii shedding in milk of dairy bovine, caprine, and ovine herds. J Dairy Sci, 2007;90(12):5352-5360.
28. Anderson A, Bijlmer H, Fournier PE, et al. Diagnosis and management of Q fever - United States, 2013: Recommendations from CDC and the Q fever working group. MMWR Recomm Reports, 2013;62 : 1-23.
29. Raoult D, Marrie TJ, Mege JL. Natural history and pathophysiology of Q fever. Lancet Infect Dis, 2005;5(4):219-226.
30. Cutler SJ, Bouzid M, Cutler RR. Q fever. J Infect. 2007;54(4):313-318.
31. Bielawska-Drozd A, Cieslik P, Mirski T, et al. Q fever - selected issues. Ann Agric Environ Med, 2013;20(2):222-232.
32. Morroy G, Keijmel SP, Delsing CE, et al. Fatigue following acute Q-fever: A systematic literature review. PLoS One, 2016;11(5):e0155884.
33. Melenotte C, Protopopescu C, Million M, et al. Clinical features and complications of Coxiella burnetii infections from the french national reference center for Q Fever. JAMA Netw open, 2018;1(4):e181580.
34. Brouqui P. Chronic Q fever. Arch Intern Med, 1993;153(5):642-648.
35. Esmaeili S, Mostafavi E, Shahdordizadeh M, Mahmoudi H. A seroepidemiological survey of Q fever among sheep in Mazandaran province, northern Iran. Ann Agric Environ Med, 2013;20(4):708-710.
36. Esmaeili S, Pourhossein B, Gouya MM, Amiri FB, Mostafavi E. Seroepidemiological survey of Q fever and brucellosis in Kurdistan province, western Iran. Vector Borne Zoonotic Dis, 2014;14(1):41-45.
37. Royal J, Riddle MS, Mohareb E, et al. Seroepidemiologic survey for Coxiella burnetii among US military personnel deployed to southwest and central asia in 2005. Am J Trop Med Hyg, 2013;89(5):991-995.
38. Anderson AD, Baker TR, Littrell AC, et al. Seroepidemiologic survey for Coxiella burnetii among hospitalized US troops deployed to Iraq. Zoonoses Public Health, 2011;58(4):276-283.
39. Faix DJ, Harrison DJ, Riddle MS, et al. Outbreak of Q fever among US military in western Iraq, June–July 2005. Clin Infect Dis, 2008;46(7):e65–e68.
40. Bailey MS, Trinick TR, Dunbar JA, et al. Undifferentiated febrile illnesses amongst british troops in Helmand, Afghanistan. J R Army Med Corps, 2011;157(2):150-155.
41. Madariaga MG, Rezai K, Trenholme GM, et al. Q fever: a biological weapon in your backyard. Lancet Infect Dis, 2003;3(11):709-721.
42. Martin J, Christopher G, Eitzen E. History of biological weapons: from poisoned darts to intentional epidemics. In: Dembek ZF. Textbooks of military medicine. Medical aspects of biological warfare, Washington, DC: Borden Institute; 2007. s. 1-20.
43. Oyston PCF, Davies C. Q fever: the neglected biothreat agent. J Med Microbiol, 2011;60(1):9-21.
44. Pittman PR, Norris SL, Coonan KM, et al. An assessment of health status among medical research volunteers who served in the project whitecoat program at Fort Detrick, Maryland. Mil Med, 2005;170(3):183-187.
45. Bellamy RJ. Bioterrorism. QJM, 2001;94(4):227-234.
46. Shoham D, Wolfson Z. The Russian biological weapons program: Vanished or disappeared? Crit Rev Microbiol, 2004;30(4):241-261.
47. Garner MG, Longbottom HM, Cannon RM, et al. A review of Q fever in Australia 1991-1994. Aust N Z J Public Health, 1997;21(7):722-730.
48. Fournier PE, Marrie TJ, Raoult D. Diagnosis of Q fever. J Clin Microbiol, 1998;36(7):1823-1834.
49. Plummer PJ, McClure JT, Menzies P, et al. Management of Coxiella burnetii infection in livestock populations and the associated zoonotic risk: A consensus statement. J Vet Intern Med, 2018;32(5):1481-1494.
50. Porter SR, Czaplicki G, Mainil J, et al. Q Fever: Current state of knowledge and perspectives of research of a neglected zoonosis. Int J Microbiol, 2011;2011 : 1-22.
51. Forland F, Jansen A, de Carvalho Gomes H, et al. Risk assessment on Q fever. Stockholm; European Centre for Disease Prevention and Control; 2010.
52. Marmion B. Q fever: the long journey to control by vaccination. Med J Aust, 2007;186(4):164-166.
53. Gefenaite G, Munster JM, van Houdt R, et al. Effectiveness of the Q fever vaccine: A meta-analysis. Vaccine, 2011;29(3):395-398.
54. Sellens E, Norris JM, Dhand NK, et al. Q Fever Knowledge, Attitudes and vaccination status of Australia’s veterinary workforce in 2014. PLoS One, 2016;11(1):e0146819.
55. Sellens E, Norris JM, Dhand NK, et al. Willingness of veterinarians in Australia to recommend Q fever vaccination in veterinary personnel: Implications for workplace health and safety compliance. PLoS One, 2018;13(6):e0198421.
56. Kersh GJ, Fitzpatrick KA, Self JS, et al. Long-term immune responses to Coxiella burnetii after vaccination. Clin Vaccine Immunol, 2013;20(2):129-133.
57. Gidding HF, Wallace C, Lawrence GL, et al. Australia’s national Q fever vaccination program. Vaccine, 2009;27(14):2037-2041.
58. Ruiz S, Wolfe DN. Vaccination against Q fever for biodefense and public health indications. Front Microbiol, 2014;5:Article 726.
59. Kazár J, Řeháček J. Q fever vaccines: Present status and application in man. Zentralblatt für Bakteriol Mikrobiol und Hyg Ser A Med Microbiol Infect Dis Virol Parasitol, 1987;267(1):74-78.
60. Smadel JE, Snyder MJ, Robbins FC. Vaccination against Q fever. Am J Epidemiol, 1948;47(1):71-81.
61. Brezina R. Antigény a imunita pri Q horúčke. Bratislava: VEDA; 1977.
62. Schulze LSC, Borchardt S, Ouellet V, et al. Effect of a phase I Coxiella burnetii inactivated vaccine on body temperature and milk yield in dairy cows. J Dairy Sci, 2016;99(1):541-550.
63. Scott GH, McCaul TF, Williams JC. Inactivation of Coxiella burnetii by gamma irradiation. J Gen Microbiol, 1989;135(12):3263-3270.
64. Hendrix LR, Chen C. Antigenic analysis for vaccines and diagnostics. In: Toman R, Heinzen R, Samuel J, et al. Coxiella burnetii: Recent advances and new perspectives in research of the Q Fever bacterium: Advances in experimental medicine and biology (vol 984). Dordrecht: Springer; 2012. s. 299-328.
65. Zhang G, Zhang Y, Samuel JE. Components of protective immunity. Adv Exp Med Biol, 2012;984 : 91-104.
66. Stoker MG. Latent infections with viruses and rickettsiae. Br Med J, 1957;1 : 963–968.
67. Trubiano JA, Holmes NE, Williams DS, et al. Coxiella burnetii endocarditis after Q fever vaccination. J Med Microbiol, 2012;61 : 1775-1779.
68. Lackman DB, Bell EJ, Bell JF, et al. Intradermal sensitivity testing in man with a purified vaccine for Q fever. Am J Public Health, 1962;52(1):87-93.
69. Isken LD, Kraaij-Dirkzwager M, Vermeer-de Bondt PE, et al. Implementation of a Q fever vaccination program for high-risk patients in the Netherlands. Vaccine, 2013;31(23):2617-2622.
70. Waag DM. Coxiella burnetii: Host and bacterial responses to infection. Vaccine, 2007;25(42):7288-7295.
71. Genig VA. A live vaccine 1-M-44 against Q-fever for oral use. J Hyg Epidemiol Microbiol Immunol, 1968;12(3):265-273.
72. Zdrodovskij PF, Genig VA. The problem of a live vaccine against Q fever (Article in Russian). Vopr Virusol, 1962;7 : 355-359.
73. Robinson DM, Hasty SE. Production of a potent vaccine from the attenuated M-44 strain of Coxiella burneti. Appl Microbiol, 1974;27(4):777-783.
74. Freylikhman O, Tokarevich N, Suvorov A, et al. Coxiella burnetii persistence in three generations of mice after application of live attenuated human M-44 vaccine against Q fever. Ann N Y Acad Sci. 2003;990(1):496–499.
75. Anacker RL, Lackman DB, Pickens EG, et al. Antigenic and skin-reactive properties of fractions of Coxiella burnetii. J Immunol, 1962;89(1):145-153.
76. Kazár J, Brezina R, Palanová A, et al. Immunogenicity and reactogenicity of a Q fever chemovaccine in persons professionally exposed to Q fever in Czechoslovakia. Bull World Health Organ, 1982;60(3):389-394.
77. Flores-Ramírez G, Kmeťová M, Danchenko M, et al. Protein composition of the phase I Coxiella burnetii soluble antigen prepared by extraction with trichloroacetic acid. Acta Virol, 2017;61 : 361-368.
78. Williams JC, Cantrell JL. Biological and immunological properties of Coxiella burnetii vaccines in C57BL/10ScN endotoxin-nonresponder mice. Infect Immun, 1982;35(3):1091-1102.
79. Williams JC, Damrow TA, Waag DM, et al. Characterization of a phase I Coxiella burnetii chloroform-methanol residue vaccine that induces active immunity against Q fever in C57BL/10 ScN mice. Infect Immun, 1986;51(3):851-858.
80. Williams JC, Peacok MG, Waag DM, et al. Vaccines against coxiellosis and Q fever development of a chloroform:methanol residue subunit of phase I Coxiella burnetii for the immunization of animals. Ann N Y Acad Sci, 1992;653 : 88-111.
81. Waag DM, England MJ, Bolt CR, et al. Low-dose priming before vaccination with the phase I chloroform-methanol residue vaccine against Q fever enhances humoral and cellular immune responses to Coxiella burnetii. Clin Vaccine Immunol, 2008;15(10):1505-1512.
82. Waag DM, England MJ, Tammariello RF, et al. Comparative efficacy and immunogenicity of Q fever chloroform:methanol residue (CMR) and phase I cellular (Q-Vax) vaccines in cynomolgus monkeys challenged by aerosol. Vaccine, 2002;20(19-20):2623-2634.
83. Smith H. The search for protective antigens. Br Med Bull, 1969;25(2):126-130.
84. Humphres RC, Hinrichs DJ. Role of antibody in Coxiella burnetii infection. Infect Immun, 1981;31(2):641-645.
85. Read AJ, Erickson S, Harmsen AG. Role of CD4+ and CD8+ T cells in clearance of primary pulmonary infection with Coxiella burnetii. Infect Immun, 2010;78(7):3019-3026.
86. Zhang G, Russell-Lodrigue KE, Andoh M, et al. Mechanisms of vaccine-induced protective immunity against Coxiella burnetii infection in BALB/c mice. J Immunol, 2007;179(12):8372-8380.
87. Tough DF, Sun S, Sprent J. T-cell stimulation in vivo by lipopolysaccharide (LPS). J Exp Med, 1997;185(12):2089-2094.
88. Karahan M, Arayıcı PP, Mustafaeva ZA, et al. Development of new age vaccine models against Q fever. In: Book of abstracts from the 6th. EuCheMS Chemistry Congress. Seville, Spain. 2016. Dostupný na: doi:10.13140/RG.2.2.34469.50401.
89. Peng Y, Zhang Y, Mitchell WJ, et al. Development of a lipopolysaccharide-targeted peptide mimic vaccine against Q fever. J Immunol, 2012;189(10):4909-4920.
90. Flores-Ramírez G, Danchenko M, Quevedo-Díaz M, et al. Reliable tool for detection of novel Coxiella burnetii antigens, using immobilized human polyclonal antibodies. J Chromatogr B Analyt Technol Biomed Life Sci, 2017;1047 : 84-91.
91. Gerlach C, Škultéty L, Henning K, et al. Coxiella burnetii immunogenic proteins as a basis for new Q fever diagnostic and vaccine development. Acta Virol, 2017;61(3):377-390.
92. Varghees S, Kiss K, Frans G, et al. Cloning and porin activity of the major outer membrane protein P1 from Coxiella burnetii. Infect Immun, 2002;70(12):6741-6750.
93. Xiong X, Meng Y, Wang X, et al. Mice immunized with bone marrow-derived dendritic cells stimulated with recombinant Coxiella burnetii Com1 and Mip demonstrate enhanced bacterial clearance in association with a Th1 immune response. Vaccine, 2012;30(48):6809-6815.
94. Li Q, Niu D, Wen B, et al. Protective immunity against Q fever induced with a recombinant P1 antigen fused with HspB of Coxiella burnetii. Ann N Y Acad Sci, 2005;1063(1):130-142.
95. Wei Y, Wang X, Xiong X, Wen B. Coxiella burnetii antigen-stimulated dendritic cells mediated protection against Coxiella burnetii in BALB/c mice. J Infect Dis, 2011;203(2):283-291.
96. Wang Y, Xiong X, Wu D, et al. Efficient activation of T cells by human monocyte-derived dendritic cells (HMDCs) pulsed with Coxiella burnetii outer membrane protein Com1 but not by HspB-pulsed HMDCs. BMC Immunol, 2011;12:Article number 52.
97. Chen C, Dow C, Wang P, et al. Identification of CD4+ T cell epitopes in C. burnetii antigens targeted by antibody responses. PLoS One, 2011;6(3):e17712.
98. Scholzen A, Richard G, Moise L, et al. Promiscuous Coxiella burnetii CD4 epitope clusters associated with human recall responses are candidates for a novel T-cell targeted multi-epitope Q fever vaccine. Front Immunol, 2019;10 : 207.
99. Reeves PM, Paul SR, Sluder AE, et al. Q-vaxcelerate: A distributed development approach for a new Coxiella burnetii vaccine. Hum Vaccin Immunother, 2017;13(12):2977-2981.
100. Vigil A, Chen C, Jain A, et al. Profiling the humoral immune response of acute and chronic Q fever by protein microarray. Mol Cell Proteomics, 2011;10(10):M110.006304.
101. Gong W, Wang P, Xiong X, et al. Chloroform-methanol residue of Coxiella burnetii markedly potentiated the specific immunoprotection elicited by a recombinant protein fragment rOmpB-4 derived from outer membrane protein B of Rickettsia rickettsii in C3H/HeN mice. PLoS One, 2015;10(4):e0124664.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2020 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Smuteční oznámení: zemřel profesor MUDr. Miroslav Votava, CSc.
- Blahopřání RNDr. Marii Brůčkové, CSc.
- Nitrobřišní kandidóza na chirurgické jednotce intenzivní péče – epidemiologické rysy a trendy
- Význam exprese proteinu p16 u dlaždicobuněčných karcinomů dutiny ústní
- Bariéry léčby infekčních a dalších somatických onemocnění u uživatelů drog
- Vzácná invazivní fungální infekce Mucor circinelloides a Fusarium u imunokompetentního pacienta po devastačním poranění dolní končetiny s rekonstrukcí volným lalokem m. latissimus dorsi
- Q horúčka a jej prevencia
- Novorozenecká pneumonie způsobená Trichomonas vaginalis
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam exprese proteinu p16 u dlaždicobuněčných karcinomů dutiny ústní
- Q horúčka a jej prevencia
- Novorozenecká pneumonie způsobená Trichomonas vaginalis
- Vzácná invazivní fungální infekce Mucor circinelloides a Fusarium u imunokompetentního pacienta po devastačním poranění dolní končetiny s rekonstrukcí volným lalokem m. latissimus dorsi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



