-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam exprese proteinu p16 u dlaždicobuněčných karcinomů dutiny ústní
The significance of p16 protein expression in oral squamous cell carcinoma
Introduction: Human papillomavirus (HPV) infection plays an important role in the etiopathogenesis of oropharyngeal squamous cell carcinomas. HPV detection in these tumours is a positive prognostic marker. The p16 protein expression, which is detected immunohistochemically, is an indirect marker of active HPV infection. Unlike in oropharyngeal carcinoma, in oral carcinoma, the prognostic significance of HPV/p16 positivity is unclear. Some studies even show a worse prognosis in patients with HPV/p16 positive oral carcinoma. The aim of our study is to consider the significance of p16 protein expression in relation to clinicopathological parameters and prognosis in patients with oral squamous cell carcinomas.
Methods: One hundred and twenty patients treated surgically for oral carcinoma were enrolled in the study. The most common anatomical sites of oral carcinoma were the tongue body (54; 45% of cases) and floor of mouth (35; 29.2% of cases). All tumours were analysed immunohistochemically for p16 protein expression. The results were correlated with the clinicopathological parameters and analysed statistically.
Results: Ten patients (8.3%) tested positive for p16 expression. In the study cohort, p16 expression was identified as the most significant factor with a negative effect on survival (p=0.019). Based on the Cox proportional hazard model, the p16-positive patients had four times worse survival than the p16-negative ones. Other factors with a statistically significant effect on survival were T status, N status, and recurrence.
Conclusion: The significance of p16 expression differs between oral and oropharyngeal carcinomas. The p16 positivity seems to be a negative prognostic factor in oral carcinomas. Nevertheless, the significance of HPV presence in tumours outside the oropharyngeal area remains unclear.
Keywords:
Prognosis – p16 expression – oral carcinoma
Autoři: S. Maléřová 1; D. Kalfeřt 1; M. Grega 2; R. Tachezy 3
; J. Klozar 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku, 2. lékařská fakulta, Univerzita Karlova v Praze, Fakultní nemocnice v Motole, Praha 1; Ústav patologie a molekulární medicíny 2. lékařská fakulta, Univerzita Karlova v Praze, Fakultní nemocnice v Motole, Praha 2; Katedra genetiky a mikrobiologie, Přírodovědecká fakulta Univerzity Karlovy, BIOCEV, Praha 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 2, s. 64-72
Kategorie: Původní práce
Souhrn
Úvod: Infekce lidským papilomavirem (HPV) hraje důležitou roli v etiopatogenezi dlaždicobuněčných karcinomů orofaryngu. Průkaz HPV infekce u těchto nádorů je pozitivní prognostický marker. Exprese proteinu p16 je nepřímý marker aktivní HPV infekce, který je vyšetřován imunohistochemicky. Prognostický význam HPV/p16 pozitivity u karcinomů dutiny ústní, na rozdíl od karcinomů orofaryngu, není jasný. Některé studie prokazují dokonce horší prognózu pacientů s HPV/p16 pozitivním karcinomem dutiny ústní. Cílem naší studie je posouzení významu exprese p16 ve vztahu ke klinicko-patologickým parametrům a prognóze u pacientů s dlaždicobuněčnými karcinomy dutiny ústní.
Metodika: Do retrospektivní studie bylo zařazeno 120 pacientů chirurgicky léčených pro karcinom dutiny ústní. Nejčastějšími anatomickými lokalizacemi karcinomů dutiny ústní bylo tělo jazyka (54; 45 % případů) a spodina dutiny ústní (35; 29,2 % případů). U všech nádorů byla imunohistochemicky stanovena exprese proteinu p16. Výsledky byly korelovány s klinickopatologickými ukazateli a statisticky zhodnoceny.
Výsledky: Pozitivita exprese p16 byla prokázána u 10 (8,3 %) pacientů. V souboru byla exprese p16 prokázána jako nejvýznamnější faktor negativně ovlivňující přežití pacientů (p = 0,019). Přežití p16 pozitivních bylo podle Coxova modelu proporcionálních rizik 4krát horší v porovnání s p16 negativními pacienty. Dalšími faktory statisticky významně ovlivňující přežití byly: T status, N status a údaj o recidivě.
Závěr: Exprese p16 má u karcinomů dutiny ústní bezesporu jiný význam než u nádorů orofaryngu. Zdá se, že p16 pozitivita je negativním prognostickým faktorem, nicméně význam přítomnosti HPV u nádorů mimo orofaryngeální lokalizaci zůstává nejasný.
Klíčová slova:
p16 exprese – karcinom dutiny ústní – prognóza
ÚVOD
Dlaždicobuněčný karcinom dutiny ústní je jedním z nejčastějších malignit horního aerodigestivního traktu. Postihuje 2–4krát častěji muže než ženy. I přes progresivně se vyvíjející nové možnosti onkologické léčby se pětileté přežití pacientů pohybuje, v závislosti na stadiu onemocnění, mezi 40–50 %. Hlavním rizikovým faktorem je kouření, zejména v kombinaci s konzumací alkoholu [3]. Dalším rizikovým faktorem pro vznik dlaždicobuněčných karcinomů hlavy a krku, zejména v oblasti orofaryngu, je infekce lidským papilomavirem (HPV). Nejčastějšími typy zde nacházenými jsou vysokorizikové typy HPV 16 a HPV 18.
U dlaždicobuněčných karcinomů orofaryngu představuje HPV pozitivita významný prognostický faktor, který již byl implementován do aktuálního vydání TNM klasifikace (klasifikace zhoubných novotvarů, 8. vydaní) [15]. Prognostická role HPV pozitivity u dlaždicobuněčných karcinomů v ostatních lokalitách hlavy a krku zůstává nejasná. V patogenezi dlaždicobuněčných karcinomů hlavy a krku hraje významnou roli imunitní systém a nádorové mikroprostředí [19].
HPV infekci je možno prokazovat různými laboratorními metodami. Nejčastější metoda pro detekci HPV infekce u nádorů orofaryngu, která se využívá v běžné klinické praxi, je imunohistochemická detekce exprese proteinu p16INK4a (p16) [10]. Jedním z hlavních způsobů zásahu viru do metabolismu buňky je zablokování funkce retinoblastomového proteinu (pRb) virovým onkoproteinem E7. Následnou negativní zpětnou vazbou dochází ke zvýšené expresi proteinu p16. Exprese p16 se proto považuje za nepřímý marker HPV-indukovaných dlaždicobuněčných karcinomů hlavy a krku. Pro detekci HPV-asociovaného orofaryngeálního karcinomu má vysokou citlivost 88 % a o něco nižší specificitu (76–80 %). Jde o nejjednodušší a nejlevnější diagnostiku HPV pozitivity u orofaryngeální lokalizace, a proto byla také použita v nejnovější TNM klasifikaci (TNM-8), kde kategorie T a N p16 pozitivních pacientů s orofaryngeálním karcinomem jsou při stejném rozsahu onemocnění nižší než u p16 negativních tumorů. [15, 20].
Další možností je detekce HPV DNA pomocí polymerázové řetězové reakce (PCR). Následně je pro určení genotypu možné doplnit vyšetření typizací pomocí reverzní hybridizace nebo sekvenace. Detekce HPV DNA není však průkazem aktivní virové infekce, a proto je pro přesné určení etiologie HPV DNA diagnostika kombinována s diagnostikou exprese p16 proteinu [23]. K dalším možnostem HPV diagnostiky patří fluorescenční in situ hybridizace (FISH) a in situ hybridizace na sklíčkách (ISH). K rutinnímu vyšetření klinických vzorků se pro pracnost, nízkou citlivost a problémy s interpretací tyto metody pro průkaz HPV infekce nepoužívají.
Zlatým standardem je průkaz transkripce virových onkoproteinů pomocí detekce E6/E7 mRNA. Tato metoda detekuje transkripčně aktivní HPV infekci. Hlavní limitací této metody je fragmentace RNA, ke které dochází často u fixovaných tkání zalitých v parafínu. Právě tyto materiály jsou v případě nádorů hlavy a krku nejčastěji využívané pro rutinní diagnostické účely.
U neorofaryngeálních karcinomů hlavy a krku se podle některých studií jeví diagnostický význam zvýšené exprese p16 jako markeru HPV infekce jako nejasný, podobně nejasná je i role HPV infekce v jejich etiologii [11, 16].
Prevalence p16 exprese v karcinomech dutiny ústní se v publikovaných studiích liší, v Evropě se pohybuje v rozmezí 7–15,4 % [1, 5, 7, 8, 22]. Podle recentní přehledové publikace se orální prevalence HPV DNA u zdravé evropské populace pohybuje v rozmezí 1,2–11,6 %, z toho vysoce rizikové typy HPV (HR HPV) jsou nalézány u 2,2–7,2 % jedinců [26].
Výsledky studií zaměřených na posouzení vlivu p16/HPV DNA pozitivity na přežití pacientů po léčbě karcinomu dutiny ústní jsou rovněž velmi rozdílné.
SOUBOR A METODIKA
Charakteristika souboru
Do retrospektivní studie bylo zařazeno 120 pacientů, primárně chirurgicky léčených na Klinice ORL a chirurgie hlavy a krku 1. LF UK a FN v Motole pro dlaždicobuněčný karcinom dutiny ústní (tělo jazyka, spodina dutiny ústní, sliznice dutiny ústní, retromolární oblast a dáseň) v období 2002–2017.
Soubor zahrnuje dvě skupiny pacientů. Skupina 1 (N = 31) je skupina pacientů operovaných v období 2002–2012, jejichž data a vzorky biologického materiálu byly prospektivně odebírány v rámci předchozích projektů naší skupiny [12, 23]. V tomto souboru byla již provedena imunohistochemická detekce p16 a detekce HPV DNA. Skupina 2 (N = 89) je skupina pacientů operovaných v období 2013–2017, u kterých je k dispozici pouze výsledek imunohistochemického p16 vyšetření. Obě skupiny byly podobné, co se týče základních klinicko-patologických parametrů (věk, pohlaví, kuřáctví, anatomická lokalizace, T a N status).
Muži tvořili 77,5 % a ženy 22,5 %, věkové rozmezí zkoumaného souboru pacientů bylo 32–87 let s průměrným věkem 59,2 roku (medián 60 let).
V souboru bylo 56,8 % pacientů aktivními kuřáky cigaret, 22,5 % bývalými kuřáky a 20,7 % nekuřáky. Od 7,5 % pacientů nebyl údaj o kouření k dispozici. Alkohol pravidelně konzumovalo 37,0 % pacientů, 63,0 % pacientů alkohol nepilo vůbec nebo jen příležitostně. Od 7,5 % pacientů se informaci nepodařilo zpětně dohledat.
Soubor zahrnoval 47,2 % tumorů těla jazyka (C02), 32,0 % tumorů spodiny dutiny ústní (C04), 14,4 % tumorů lokalizovaných v jiných částech dutiny ústní (C06) a 6,4 % tumorů v retromolární oblasti (C062) nebo na dásni (C03).
Co do rozsahu onemocnění, převažovali pacienti s nádory pT1 (42,5 %) a pT2 (43,3 %). Postižení uzlin nádorem (pN+) bylo prokázáno u 47,5 % pacientů.
Adjuvantní radioterapie proběhla u 67,5 % pacientů v souboru. Z této skupiny 21,8 % pacientů podstoupilo konkomitantní chemoradioterapii.
Perineurální šíření nádoru bylo potvrzeno u 40,5 % pacientů. Hodnocení extrakapsulární šíření (anglicky zkratka ENE – extranodální extenze), bylo k dispozici u 85/120 pacientů (70,5 %) a pozitivně popsáno u 24,7 %. U zbývajících pacientů, operovaných před rokem 2013, nebylo možné data dohledat.
V průběhu sledování byla recidiva diagnostikována u 30 % pacientů a nádorová duplicita u 8,3 % pacientů.
Všechny klinicko-patologické parametry jsou shrnuty v tabulce 1.
Tab. 1. Klinicko-patologické parametry
Table 1. Clinicopathological parameters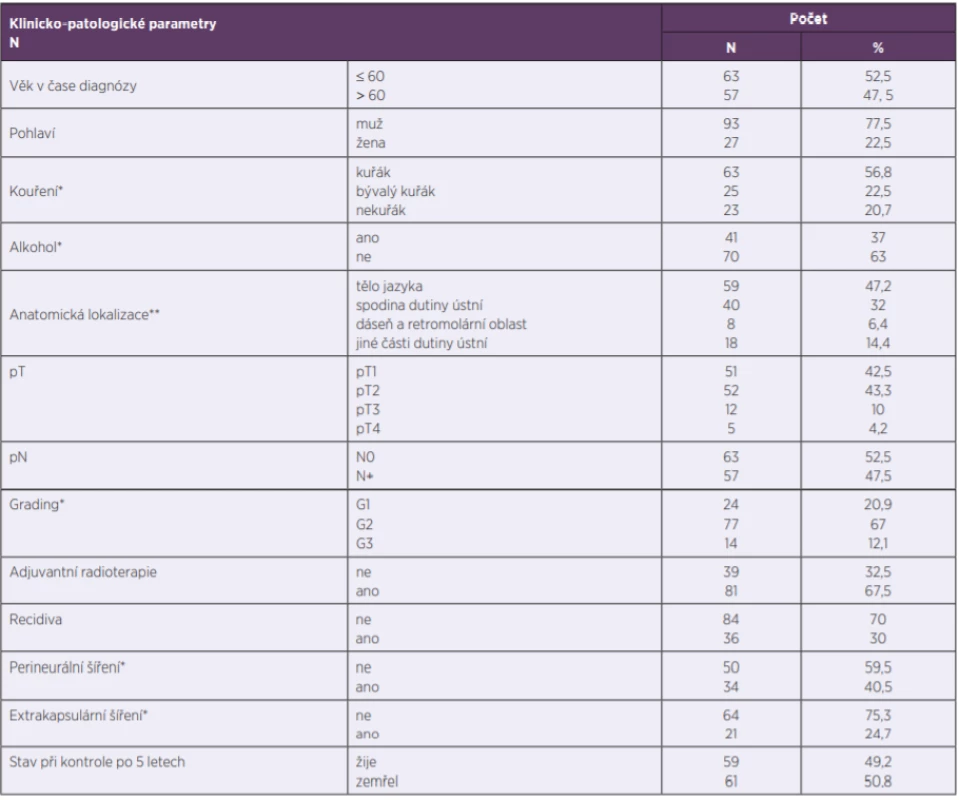
*některá data se retrospektivně nepodařilo dohledat
**některé primární nádory měly více anatomických lokalizací
*some data could not be traced back retrospectively
**some primary tumours appeared at multiple anatomical sitesp16 detekce
Exprese p16 byla stanovena imunohistochemicky v nádorové tkáni pomocí protilátky p16INK4a (Purified Mouse) Anti-Human p16, Clone G175-405, BD, v ředění 1 : 100 (Pharmingen, San Diego, CA, USA). Jako pozitivní kontrola byly použité dysplastické cervikální epitelové buňky. Vyhodnocení je semikvantitativní, na základě podílu obarvených buněk (v procentech) a intenzity zbarvení (dělení od jednoho + až po tři +++). Dále se hodnotí lokalizace exprese (cytoplazmatická, jaderná) a intenzita zbarvení. Jako pozitivní jsou hodnoceny nádory, které vykazují střední a vyšší intenzitu barvení (2+, 3+) a jadernou i cytoplazmatickou pozitivitu, a to minimálně v 70 % nádorových buněk.
Exprese v nižším procentu nádorových buněk, nižší intenzita exprese případně pouze cytoplazmatická pozitivita s jadernou negativitou se podle doporučení College of American Pathologists (CAP) hodnotí jako negativní [14].
HPV DNA detekce a genotypizace
Orální exfoliované buňky byly získány z orálního výplachu prováděného po dobu 30–60 sekund s 10 ml fosfátového pufru (PBS), (pH 7,4; AccuGENE, Cambrex Bio Science, Verviers, Belgie). DNA pro detekci HPV byla extrahována pomocí Puregene Core Kit B (Gentra Qiagen, Hilden, Německo) podle protokolu výrobce a rozpuštěna v 10 mM Tris-Cl, pH 8,0 na konečnou koncentraci 50 ng/μl. HPV DNA detekce a genotypizace byly prováděny pomocí PCR za použití širokospektrálních GP5 + a GP6 + (BSGP5 +/6 + bio) primerů, specifických pro gen L1, a metodou reverzní hybridizace (RLB), pomocí které lze identifikovat 37 různých typů HPV v jediném testu [27].
Statistická analýza
Ke statistickému zpracování výsledků byl použit statistický program IBM SSPS verze 22.0. Pro popis souboru byly zvoleny metody deskriptivní statistiky, Fisherův přesný test a Pearsonův chí-kvadrát test. K hodnocení 5letého přežití od ukončení léčby bez známek nádoru (DFS) a celkového přežití (OS) byla použita Kaplanova-Meierova metoda a ve vztahu k různým faktorům Log rank test (Mantel-Coxova metoda). Pro hodnocení statistické významnosti byla zvolena hodnota p ≤ 0,05. Metodou Coxova modelu proporcionálních rizik byly v zařazených proměnných spočítané signifikance, hazard ratio HR (změna rizika exitu při jednotkové změně nezávislé proměnné) a 95% intervaly spolehlivosti HR.
VÝSLEDKY
Prevalence p16 pozitivity v celém souboru byla 8,3 % (10/120) pacientů. V první podskupině byla exprese p16 zjištěna v 16,1 %, v druhé podskupině v 5,6 %. HPV DNA byla detekována u 9,7 % pacientů (3/31), HPV16 (N = 1) a HPV18 (N = 2). Dva pacienti byli pozitivní na HPV DNA i expresi p16, 2 pacienti byli pozitivní pouze na p16, ale přítomnost HPV DNA se nepotvrdila. Jeden pacient byl HPV18 pozitivní, ale exprese p16 u něho nebyla prokázána.
Exprese p16 – vztah demografických a klinicko-patologických parametrů
V souboru p16 pozitivních pacientů byli všichni (10/10) mužského pohlaví, v souboru p16 negativních taky převažovalo mužské pohlaví (75,5 %; 83/110) bez statisticky signifikantního rozdílu (p = 0,114).
Průměrný věk v souboru p16 pozitivních byl 57,2 roku, průměrný věk v souboru p16 negativních byl 59,4 roku. Pacientů ve věku 60 let a méně bylo v souboru p16 pozitivních 70,0 % (7/10), v souboru p16 negativních 50,9 % (56/110), (p = 0,329).
V naší studii nebyl zjištěn vztah mezi kuřáctvím a zvýšenou expresí p16 (p = 0,623).
V souboru p16 pozitivních bylo nejvíce pacientů s tumorem v oblasti spodiny dutiny ústní (40,0 %; 4/10 pacientů), v souboru p16 negativních byla polovina pacientů s nádory v oblasti těla jazyka (50,9 %; 56/110 pacientů). Výsledky analýzy vztahu exprese p16 a anatomické lokalizace nebyly statisticky signifikantní (p = 0,578).
Nebyl prokázán statisticky významný vztah exprese p16 k velikosti nádoru (pT) a k rozsahu uzlinového postižení (pN) – p = 0,900, respektive p = 1,000.
Perineurální šíření bylo přítomné u všech 4 vyšetřených pacientů s p16 pozitivitou a u 37,5 % (30/81) vyšetřených v souboru p16 negativních (p = 0,024). Extrakapsulární šíření bylo potvrzeno u 50,0 % (2/4) p16 pozitivních a 23,5 % (19/81) p16 negativních (p = 0,254).
Pacienti s expresí p16 neměli častěji recidivu onemocnění (p = 0,721).
Celkové 5leté přežití (OS) bylo ve skupině p16 negativních delší než u p16 pozitivních pacientů (p = 0,019). Nebyl nalezen statisticky významný rozdíl v nádorově specifickém přežití (DSS) (p = 0,952) u pacientů s HPV pozitivními ve srovnání s HPV negativními tumory.
Všechny klinicko-patologické parametry a jejich vztah k expresi p16 jsou shrnuty v tabulkách 1 a 2.
Tab. 2. Vztah klinicko-patologických parametrů a exprese p16
Table 2. Correlation between clinicopathological parameters and p16 expression
*některá data se retrospektivně nepodařilo dohledat
**některé primární nádory měly více anatomických lokalizací
***u analýzy byl použit Pearsonův test
*some data could not be traced back retrospectively
**some primary tumours appeared at multiple anatomical sites
***The Pearson test was used in the analysisFaktory ovlivňující 5leté přežití
Pětileté přežití od ukončení léčby v analýze podle Kaplana-Meiera bylo 49,2 % (59/120), z toho u mužů 44,0 % (41/93) a u žen 66,7 % (18/27). Pohlaví neovlivňovalo 5leté přežití pacientů (p = 0,05).
Věk při diagnóze neovlivňoval 5leté přežití pacientů (p = 0,771). Ani v Coxově modelu proporcionálních rizik věk neměl vliv na riziko úmrtí (p = 0,902; HR = 0,965; 95 % CI 0,545 – 1,708). Kouření neovlivňovalo 5leté přežití pacientů (p = 0,586). Ani v Coxově modelu proporcionálních rizik nemělo vliv na riziko úmrtí (p = 0,295; HR = 1,476; 95 % CI 0,715–3,58).
Anatomická lokalizace neovlivňovala 5leté přežití (p = 0,349). Pět let přežívalo 45,8 % (27/59) pacientů s karcinomem těla jazyka, 60,0 % (24/40) pacientů s karcinomem dutiny ústní, 22,2 % (2/9) pacientů s karcinomem dásně nebo retromolární oblasti a 44,4 % (8/18) pacientů s karcinomem jiné části dutiny ústní.
Klasifikace pT ovlivňovala 5leté přežití (p = 0,016). Pět let přežívalo 62,7 % (32/51) pacientů s pT1, 44,2 % (23/52) pacientů s pT2, 33,3 % (4/12) u pacientů s pT3 a 0,0 % (0/4) u pacientů s pT4.
Pět let od ukončení léčby přežívalo 60,3 % (38/63) pacientů bez postižení uzlin a 36,8 % (21/57) pacientů s postižením uzlin (p = 0,011). N status, jako faktor v Coxově modelu proporcionálních rizik, ovlivňoval riziko úmrtí (p = 0,007; HR = 2,159;95 % CI 1,236–3,772).
Recidiva statisticky signifikantně ovlivnila 5leté přežití (p = 0,001). V Coxově modelu proporcionálních rizik, recidiva onemocnění významně ovlivnila riziko úmrtí (p = 0,007; HR=2,263; 95 % CI 1,248–4,106).
Všechny klinicko-patologické parametry a jejich vztah k přežití jsou shrnuty v tabulce 3.
Tab. 3. Vztah klinicko-patologických parametrů a 5letého přežití (OS)
Table 3. Correlation between clinicopathological parameters and 5-year overall survival (OS)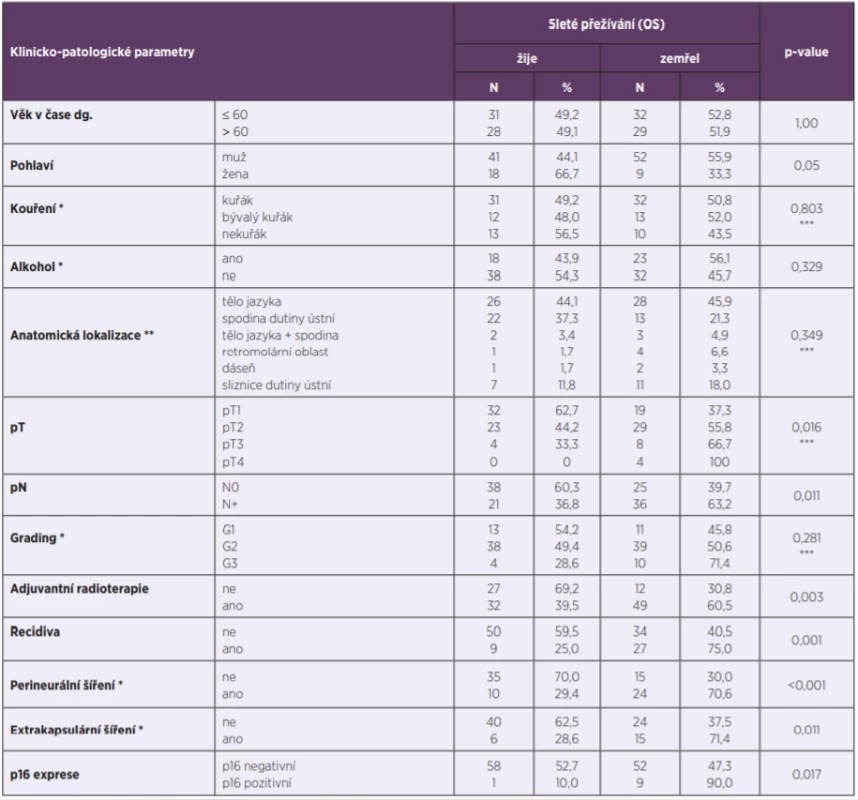
OS – celkové přežití
*některá data se retrospektivně nepodařilo dohledat
**některé primární nádory měly více anatomických lokalizací
***u analýzy byl použit Pearsonův test
OS – overall survival
*some data could not be traced back retrospectively
**some primary tumours appeared at multiple anatomical sites
***The Pearson test was used in the analysisJako statisticky významné faktory negativně ovlivňující 5leté přežití byly identifikované: pozitivní exprese p16 (obr. 1), vyšší status N (obr. 2), vyšší status T (obr. 3) a recidiva onemocnění (obr. 4). Faktory kouření (obr.5) a věk (obr. 6) statisticky signifikantně neovlivnily 5leté přežití.
Obr. 1. Vztah 5letého celkového přežití (Kaplan-Meier) a exprese p16
Figure 1. Correlation between 5-year overall survival (Kaplan-Meier estimate) and p16 expression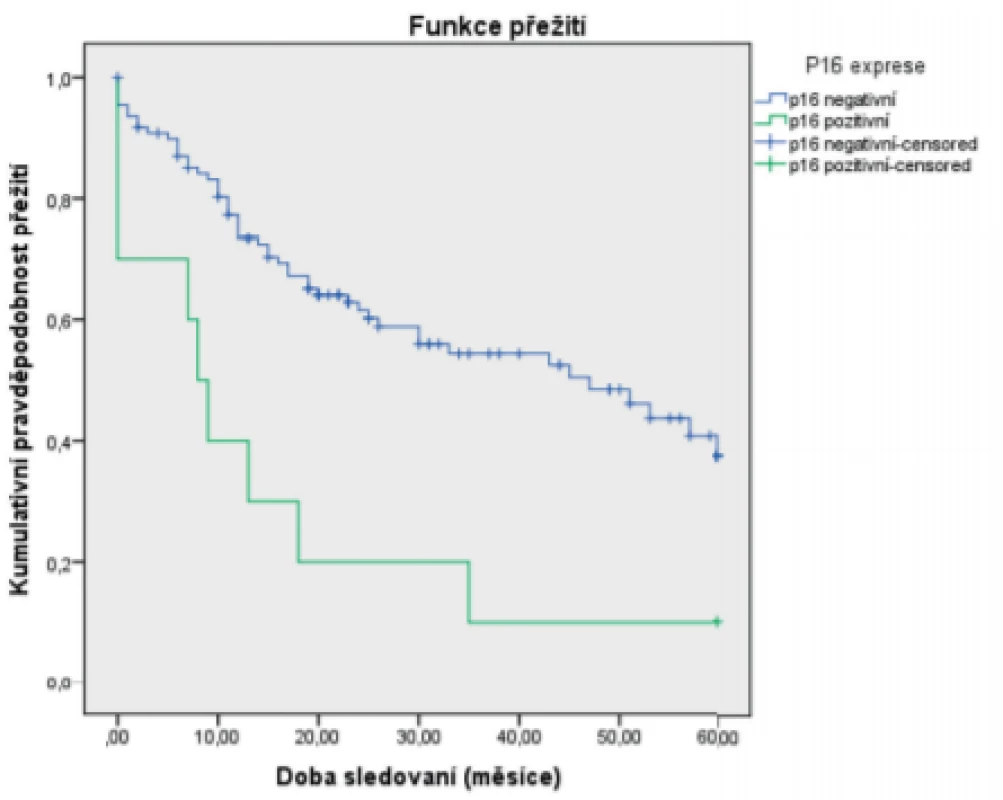
Obr. 2. Vztah 5letého celkového přežití (Kaplan-Meier) a pN statusu
Figure 2. Correlation between 5-year overall survival (Kaplan-Meier estimate) and pN status
Obr. 3. Vztah 5letého celkového přežití (Kaplan-Meier) a pT statusu
Figure 3. Correlation between 5-year overall survival (Kaplan-Meier estimate) and pT status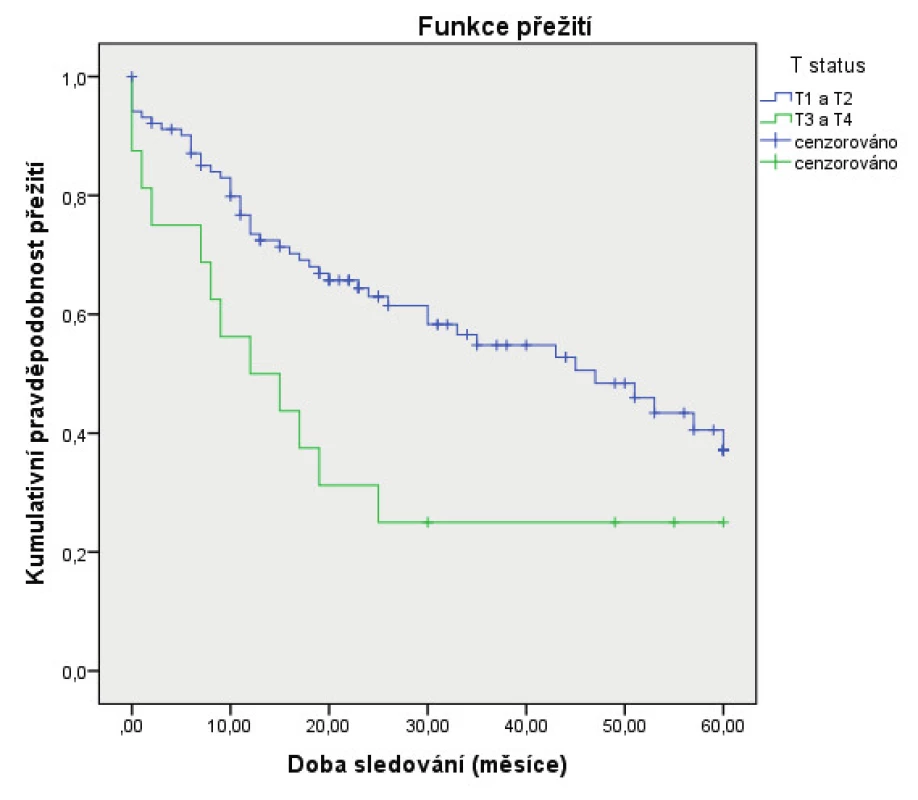
Obr. 4. Vztah 5letého celkového přežití (Kaplan-Meier) a recidivy základního onemocnění
Figure 4. Correlation between 5-year overall survival (Kaplan-Meier estimate) and recurrencies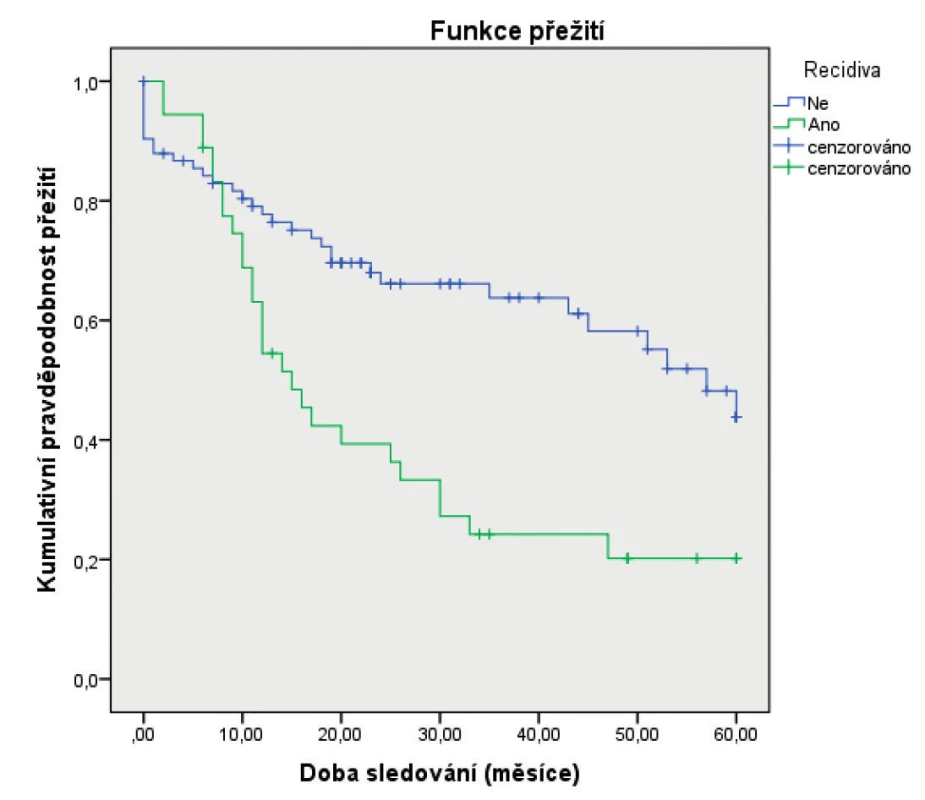
Obr. 5. Vztah 5letého celkového přežití (Kaplan-Meier) a kouření
Figure 5. Correlation between 5-year overall survival (Kaplan-Meier estimate) and smoking status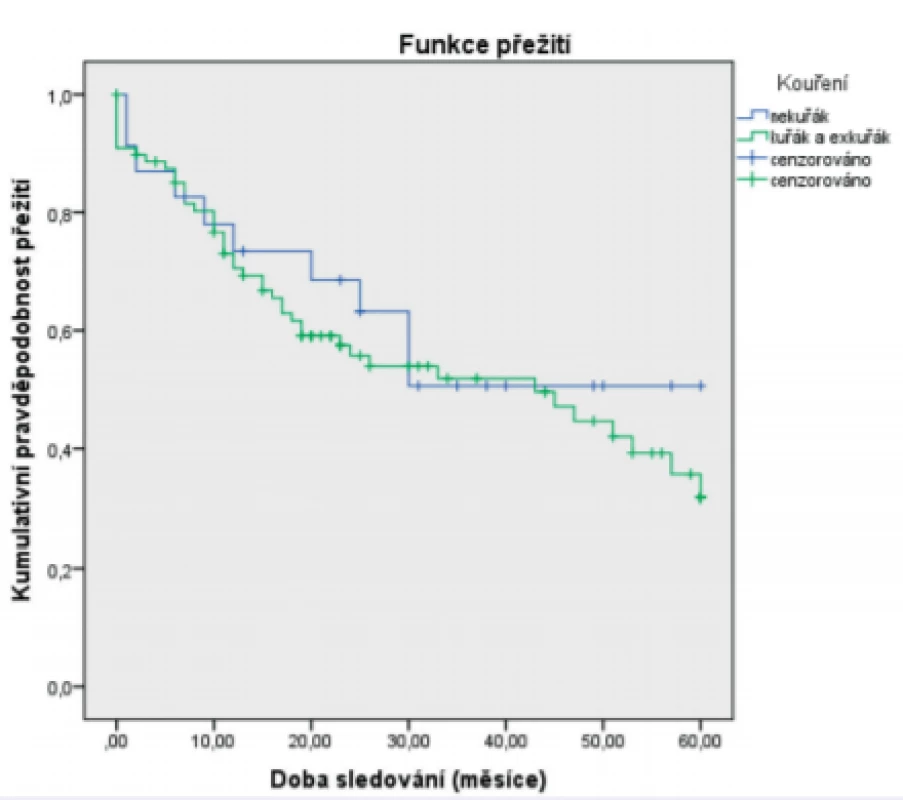
Obr. 6. Vztah 5letého celkového přežití (Kaplan-Meier) a věku
Figure 6. Correlation between 5-year overall survival (Kaplan-Meier estimate) and age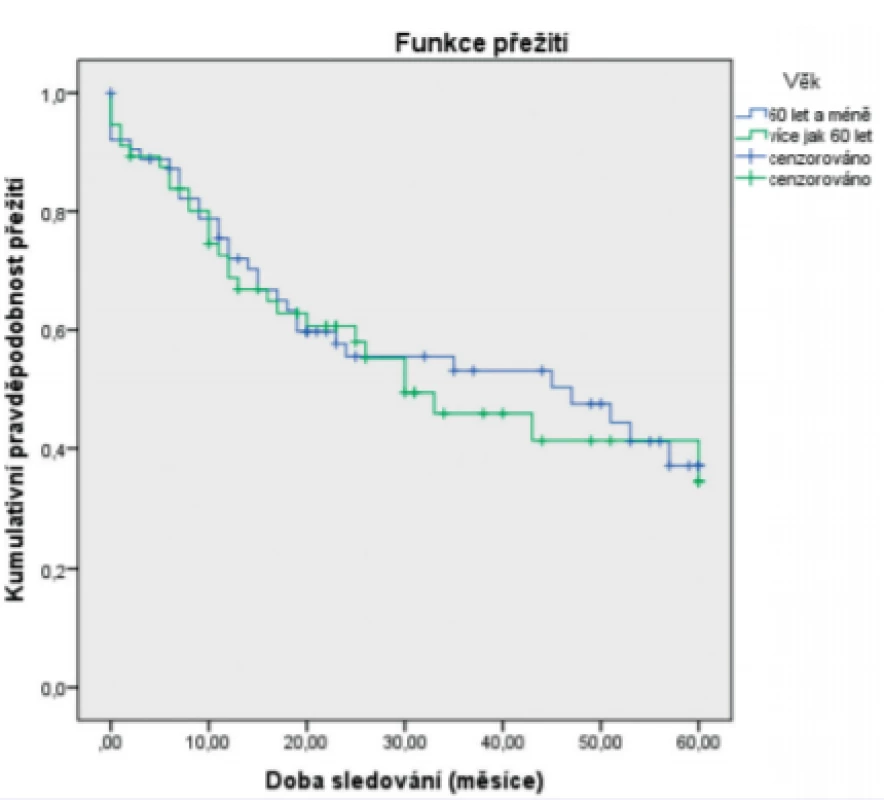
Pomocí Coxova modelu proporcionálních rizik byly faktory p16 pozitivita, recidiva a postižení krčních uzlin nádorem (pN+) zhodnoceny jako faktory zhoršující 5leté přežití (tab. 4).
Tab. 4. Coxův model proporcionálních rizik
Table 4. The Cox proportional hazard model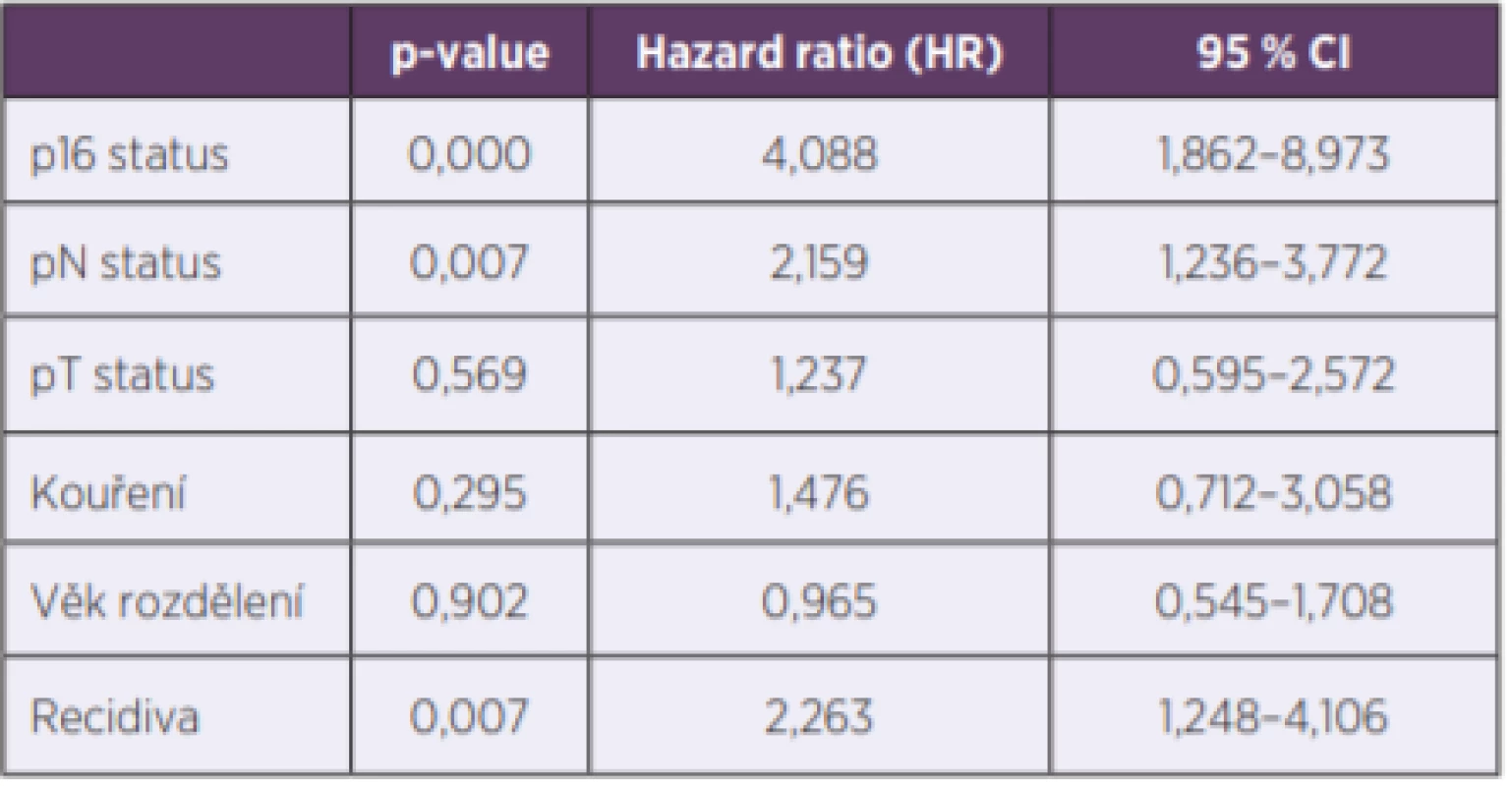
DISKUSE
Ve studii jsme hodnotili závislost p16 pozitivity nádorů dutiny ústní na demografických a klinických parametrech a zkoumali její vliv na přežití. Jak již bylo uvedeno v našich předchozích studiích a také z literatury vyplývá, že konkordance mezi HPV DNA pozitivitou a p16 pozitivitou je u orofaryngeálních dlaždicobuněčných karcinomů vysoká (93 %) [23]. Otázkou je, zda je tomu tak podobně i u neorofaryngeálních dlaždicobuněčných karcinomů hlavy a krku. Některé literární údaje uvádějí, že konkordance je výrazně nižší [9, 18]. Smysl by v tomto případě mělo doplnění HPV DNA detekce. Tato diagnostika je v klinické praxi hůře dostupná. V omezené míře jsme mohli konkordanci p16 a HPV pozitivity posoudit v první skupině našich pacientů. HPV pozitivita, vyjádřená dvojí pozitivitou na HPV DNA a expresi p16, v ní byla potvrzena u 2 pacientů, 2 pacienti byli pozitivní pouze na p16, ale přítomnost HPV DNA se u nich nepotvrdila. U jednoho pacienta byla přítomna HPV DNA (typ 18), ale exprese p16 byla negativní. Na rozdíl od orofaryngeálních karcinomů se ani v našem malém podsouboru pacientů nejeví p16 pozitivita jako spolehlivý marker HPV etiologie nádorů dutiny ústní.
Ve zkoumaném souboru byla prevalence p16 pozitivity 8,3 %, což je v souladu s recentními evropskými studiemi z Německa a Španělska, kde zjistili 7 % a 11 % p16 pozitivních pacientů s karcinomem dutiny ústní [8, 22].
Korelace mezi expresí p16 a prognózou, která je klinicky využívaná u orofaryngeálního karcinomu, je kontroverzním tématem i u nádorů mimo oblast hlavy a krku. Existuje široké spektrum nádorů se zvýšenou expresí p16, u kterých není HPV kauzálním agens. U těchto nádorů může být zvýšená p16 exprese způsobena například genovou mutací v tomto genu či v genech, které jeho expresi regulují. Pro některé nádory (karcinom plic, kolorektální karcinom, melanom) je ztráta exprese p16 spojená s horší prognózou [28], taky další studie potvrzují, že zvýšená exprese p16 byla u neuroblastomu a u karcinomů prostaty asociována se zhoršeným přežitím [21].
Jednoznačně pozitivní vliv p16 exprese na pětileté přežití, celkové přežití a snížení míry recidiv bylo prokázáno zatím pouze u orofaryngeálních karcinomů [12, 23].
Studie, které zkoumaly vztah mezi p16/HPV DNA pozitivitou a vlivem na přežití pacientů po léčbě karcinomu dutiny ústní mají rozdílné závěry. Některé jsou v souladu s výsledky naší studie a udávají horší prognózu u p16/HPV DNA pozitivních pacientů [6, 13, 24]. Jiné studie naopak udávají p16/HPV DNA pozitivitu jako faktor lepší prognózy u pacientů s karcinomem dutiny ústní [9, 17, 25]. Jako vysvětlení nabízejí, že nadměrná exprese p16 vede ke snížení invazivity nádoru redukcí matricových metaloproteináz (MMP-1 a MMP-9). Tyto enzymy jsou spojeny s vyšší invazivitou a rizikem metastazování [10].
V těchto studiích měli pacienti s p16/HPV DNA pozitivitou třikrát větší riziko vzdálených metastáz a 2–3krát vyšší pravděpodobnost úmrtí, ve srovnání s pacienty p16/HPV DNA negativními tumory. Příčiny však nejsou známé. Někteří autoři zdůrazňují, že p16 exprese nemusí být známkou HPV infekce u karcinomů dutiny ústní a jde tedy o samostatný prognostický marker.
Recentně publikovaná česká studie na souboru 78 pacientů s orálním karcinomem neprokázala statisticky signifikantní rozdíly v 3letém přežití mezi pacienty s p16 pozitivními tumory ve srovnání s pacienty s p16 negativními tumory. V článku však chybí jasné rozdělení pacientů podle anatomické lokalizace tumoru a zdá se, že v souboru jsou zahrnuti i pacienti s tumory kořene jazyka [2].
Závěry dosud publikovaných studií se značně liší. Z dosavadních výsledků vyplývá, že prevalence HPV DNA v tumorech dutiny ústní je výrazně nižší než u nádorů orofaryngu a zdá se, že neexistuje korelace mezi přítomností HPV a expresí p16 v těchto nádorech. Otázka HPV etiologie u nádorů dutiny ústní tedy není zatím objasněna. Exprese p16 se, na základě našich i publikovaných dat, zdá býti spíše negativním prognostickým faktorem. Z dalších faktorů negativně ovlivňujících prognózu byly v naší studii identifikované rekurence onemocnění a pozitivita uzlin. Podobné výsledky popisovala recentní přehledová studie, kde se výsledky zahrnutých studií mezi sebou lišily, pokud jde o pT status a rekurenci onemocnění. Pozitivita regionálních lymfatických uzlin měla negativní dopad na celkové a nádorově specifické přežití [4].
ZÁVĚRY
Prevalence p16 pozitivity u karcinomů dutiny ústní v naší studii byla 8,3 %. Multivariantní analýzou se nám ze zkoumaných klinicko-patologických parametrů (věk, kouření, T a N status, recidiva a p16 exprese) potvrdily jako statisticky významné prognostické faktory: N status, recidiva a p16 exprese. Nejvýznamnějším negativním prognostickým faktorem byla p16 pozitivita, která zhoršovala riziko přežití 4krát. Vzhledem k malé prevalenci p16 pozitivity v našem souboru však nelze tento závěr přeceňovat. Přes limitovaný počet subjektů v našem souboru lze uzavřít, že marker p16, který je nepřímým znakem HPV infekce a významným prognostickým markerem u nádorů orofaryngu, nemusí být vhodným pro použití u nádorů hlavy a krku jiné anatomické lokalizace.
Poděkování
Publikace je podpořena z programového projektu Ministerstva zdravotnictví ČR s registračním číslem 17-28055A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 27. 8. 2019.
Adresa pro korespondenci:
MUDr. Simona Maléřová
Klinika ORL a chirurgie hlavy a krku 1. LF UK a FN v Motole
V Úvalu 84/1
150 06 Praha 5-Motol
e-mail: simona.malerova7@gmail.com
Zdroje
1. Abrahao R, Anantharaman D, Gaborieau V, et al. The influence of smoking, age and stage at diagnosis on the survival after larynx, hypopharynx and oral cavity cancers in Europe: The ARCAGE study. Int J Cancer, 2018;143(1):32–44.
2. Blahak J, Zelinka J, Gumulec J, et al. HPV, protein p16 and squamous cell carcinoma of the oral cavity. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2019. [Ahead of Print].
3. Blot WJ, McLaughlin JK, Winn DM, et al. Smoking and drinking in relation to oral and pharyngeal cancer. Cancer Res, 1988;48(11):3282–3287.
4. De Morais EF, Mafra RP, Gonzaga AKG, et al. Prognostic factors of oral squamous cell carcinoma in young patients: A systematic review. J Oral Maxillofac Surg, 2017;75(7):1555–1566.
5. Dediol E, Sabol I, Virag M, et al. HPV prevalence and p16INKa overexpression in non-smoking non-drinking oral cavity cancer patients. Oral Dis, 2016;22(6):517–522.
6. Duray A, Descamps G, Decaestecker C, et al. Human papillomavirus DNA strongly correlates with a poorer prognosis in oral cavity carcinoma. Laryngoscope, 2012;122(7):1558–1565.
7. Gotz C, Drecoll E, Straub M, et al. Impact of HPV infection on oral squamous cell carcinoma. Oncotarget, 2016;7(47):76704–76712.
8. Grobe A, Hanken H, Kluwe L, et al. Immunohistochemical analysis of p16 expression, HPV infection and its prognostic utility in oral squamous cell carcinoma. J Oral Pathol Med, 2013;42(9):676–681.
9. Hoffmann M, Tribius S, Quabius ES, et al. HPV DNA, E6*I-mRNA expression and p16INK4A immunohistochemistry in head and neck cancer – how valid is p16INK4A as surrogate marker? Cancer Lett, 2012;323(1):88–96.
10. Kalfert D, Ludvikova M, Topolcan O, et al. Analysis of preoperative serum levels of MMP1, -2, and -9 in patients with site-specific head and neck squamous cell cancer. Anticancer Res, 2014;34(12):7431–7441.
11. Klozar J. Clinical relevance of human papillomavirus outside of oropharynx. Curr Opin Otolaryngol Head Neck Surg, 2019;27(2):80–84.
12. Koslabova E, Hamsikova E, Salakova M, et al. Markers of HPV infection and survival in patients with head and neck tumors. Int J Cancer, 2013;133(8):1832–1839.
13. Lee LA, Huang CG, Tsao KC, et al. Human Papillomavirus Infections are Common and Predict Mortality in a Retrospective Cohort Study of Taiwanese Patients With Oral Cavity Cancer. Medicine (Baltimore), 2015;94(47):e2069.
14. Lewis JS Jr, Beadle B, Bishop JA, et al. Human Papillomavirus Testing in Head and Neck Carcinomas: Guideline From the College of American Pathologists. Arch Pathol Lab Med., 2018;142(5):559–597.
15. Lydiatt WM, Patel SG, O‘Sullivan B, et al. Head and Neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual. CA Cancer J Clin, 2017;67(2):122–137.
16. Meshman J, Wang PC, Chin R, et al. Prognostic significance of p16 in squamous cell carcinoma of the larynx and hypopharynx. Am J Otolaryngol, 2017;38(1):31–37.
17. Minami K, Kogashiwa Y, Ebihara Y, et al. Human papillomavirus and p16 protein expression as prognostic biomarkers in mobile tongue cancer. Acta Otolaryngol, 2017;137(10):1121–1126.
18. Nemes JA, Deli L, Nemes Z, et al. Expression of p16(INK4A), p53, and Rb proteins are independent from the presence of human papillomavirus genes in oral squamous cell carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006;102(3):344–352.
19. Novák Š, Bandurová V, Mifková A, et al. Nádorové mikroprostredi. Otorinolaryng a Foniat., 2019;68(1):41–51.
20. O‘Sullivan B, Huang SH, Su J, et al. Development and valida-tion of a staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal cancer Network for Staging (ICON-S): a multicentre cohort study. Lancet Oncol, 2016;17(4):440–451.
21. Omura-Minamisawa M, Diccianni MB, Chang RC, et al. p16/p14(ARF) cell cycle regulatory pathways in primary neuroblastoma: p16 expres-sion is associated with advanced stage disease. Clin Cancer Res, 2001;7(11):3481–3490.
22. Rodriguez-Santamarta T, Rodrigo JP, Garcia-Pedrero JM, et al. Prevalence of human papillomavirus in oral squamous cell carcinomas in northern Spain. Eur Arch Otorhinolaryngol, 2016;273(12):4549–4559.
23. Rotnaglova E, Tachezy R, Salakova M, et al. HPV involvement in tonsillar cancer: prognostic significance and clinically relevant markers. Int J Cancer, 2011;129(1):101–110.
24. Saghravanian N, Zamanzadeh M, Meshkat Z, et al. Evaluation of the Prevalence Rate and the Prognostic Effect of Human Papilloma Virus Infection in a Group of Patients With Oral Cavity Squamous Cell Carcinoma. Iran J Cancer Prev, 2016;9(3):e3998.
25. Satgunaseelan L, Virk SA, Lum T, et al. p16 expression independent of human papillomavirus is associated with lower stage and longer disease-free survival in oral cavity squamous cell carcinoma. Pathology, 2016;48(5):441–448.
26. Simonidesova S, Hamsikova E, Klozar J, et al. Výskyt orální HPV infekce u zdravé populace – systematický přehled se zaměřením na evropskou populaci. Epidemiol. Mikrobiol. Imunol, 2018;67(4):175–183.
27. Tachezy R, Smahelova J, Kaspirkova J, et al. Human papillomavirus type-specific prevalence in the cervical cancer screening population of Czech women. PLoS One, 2013;8:e79156.
28. Yanagawa N, Tamura G, Oizumi H, et al. Frequent epigenetic silencing of the p16 gene in non-small cell lung cancers of tobacco smokers. Jpn J Cancer Res, 2002;93(10):1107–1113.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2020 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Smuteční oznámení: zemřel profesor MUDr. Miroslav Votava, CSc.
- Blahopřání RNDr. Marii Brůčkové, CSc.
- Nitrobřišní kandidóza na chirurgické jednotce intenzivní péče – epidemiologické rysy a trendy
- Význam exprese proteinu p16 u dlaždicobuněčných karcinomů dutiny ústní
- Bariéry léčby infekčních a dalších somatických onemocnění u uživatelů drog
- Vzácná invazivní fungální infekce Mucor circinelloides a Fusarium u imunokompetentního pacienta po devastačním poranění dolní končetiny s rekonstrukcí volným lalokem m. latissimus dorsi
- Q horúčka a jej prevencia
- Novorozenecká pneumonie způsobená Trichomonas vaginalis
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam exprese proteinu p16 u dlaždicobuněčných karcinomů dutiny ústní
- Q horúčka a jej prevencia
- Novorozenecká pneumonie způsobená Trichomonas vaginalis
- Vzácná invazivní fungální infekce Mucor circinelloides a Fusarium u imunokompetentního pacienta po devastačním poranění dolní končetiny s rekonstrukcí volným lalokem m. latissimus dorsi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



