-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Histopatológia a etiopatogenéza chronickej apikálnej parodontitídy – periapikálnych granulómov
Histopathology and Etiopathogenesis of Chronic Apical Periodontitis – Periapical Granuloma
Periapical lesions are among the most frequently diagnosed apical odontogenic pathologies in human teeth. The condition is generally described as apical periodontitis. Apical periodontitis is a sequel to endodontic infection and manifests itself as the host defense response to microbial challenge emanating from the root canal system to the periapical tissue. It is viewed as a dynamic encounter between microbial factors and host defenses at the interface between infected radicular pulp and periodontal ligament that results in local inflammation, resorption of hard tissues, destruction of other periapical tissues, and eventual formation of various histopathological categories of apical periodontitis, commonly referred to as periapical lesions. There are also factors located within the inflamed periapical tissue that can interfere with post-treatment healing of the lesion. The purpose of this article is to provide a comprehensive overview of the etiopathogenesis of apical periodontitis and causes of failed endodontic treatment. This study presents a histopathological analysis through optical microscopy of periapical lesions, commonly referred to as solid dental or periapical granuloma.
Keywords:
apical periodontitis – periapical lesions – periapical granuloma – etiopathogenesis of periapical granuloma – histopathology of periapical granuloma.
Autoři: J. Kováč; D. Kováč
Působiště autorů: Klinika stomatológie a maxilofaciálnej chirurgie LFUK a OÚSA Bratislava
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 60, 2011, č. 2, s. 77-86
Souhrn
Medzi najčastejšie diagnostikované odontogénne patologické stavy u ľudí patria periapikálne lézie, vo všeobecnosti označované ako apikálna parodontitída. Apikálna parodontitída vzniká ako dôsledok endodontickej infekcie a prejavuje sa ako obranná reakcia hostiteľa na mikroorganizmy prenikajúce zo systému koreňového kanálika zuba do oblasti apikálneho parodontu. Predstavuje dynamickú rovnováhu medzi exogénnymi dráždivými agensami, zvyčajne mikroorganizmami koreňového kanálika, a ich produktmi a obrannými mechanizmami hosťujúceho organizmu na rozhraní infikovanej zubnej dreni a periodontálneho ligamenta. Apikálna parodontitída má za následok miestny zápal, resorpciu tvrdých zubných tkanív, deštrukciu ďalších periapikálnych tkanív a možný vznik rôznych histopatologických foriem, zvyčajne označovaných ako periapikálne lézie. Vo vnútri periapikálneho tkaniva postihnutého zápalom sa môžu vyskytovať tiež faktory, ktoré môžu prekážať pri liečení lézie po uskutočnenej terapii. Cieľom tohto článku je poskytnúť všeobecný prehľad o etiopatogenéze apikálnej parodontitídy a príčinách neúspechu endodontickej terapie. Štúdia prezentuje histopatologickú analýzu, uskutočnenú optickým mikroskopom, periapikálnych lézií, zvyčajne označovaných ako solídny zubný alebo periapikálny granulóm.
Kľúčové slová:
apikálna parodontitída – periapikálne lézie – periapikálny granulóm – etiopatogenéza periapikálneho granulómu – histopatológia periapikálneho granulómu.Úvod
Apikálna parodontitída je vo svojej podstate ochorenie vyvolané infekciou systému koreňového kanálika zuba. Z toho logicky vyplýva, že liečba tohto ochorenia je založená na odstránení alebo výraznej redukcii počtu choroboplodných zárodkov z kanálového systému zuba a zabránení ďalšej pulpo-kanálovej infekcii koreňovou výplňou. Ak je ošetrenie koreňového kanálika realizované správne, zvyčajne nasleduje liečenie periapikálnej lézie spojené s kostnou regeneráciou. Táto regenerácia kosti je charakterizovaná postupnou redukciou rádiolucencie na opakovane zhotovených kontrolných röntgenových snímkach. Pre viaceré dôvody však nenastáva pri všetkých zuboch so zaplneným kanálovým systémom úplné vyliečenie, resp. zmenšenie apikálnej rádiolucencie [25]. V určitých prípadoch apikálna parodontitída po liečbe stále pretrváva, čo je stav zvyčajne označovaný ako neúspech endodontickej terapie. Vo všeobecnosti je potvrdené, že táto tzv. postterapeutická chronická apikálna parodontitída nastáva vtedy, ak endodontická terapia nedostatočne eliminovala infekciu [29].
Etiológia apikálnej parodontitídy
Etiologické momenty vyvolávajúce zápaly apikálneho parodontu sú podobné ako pri pulpe. Epidemiologické štúdie poukazujú na zvýšenú prevalenciu apikálnej parodontitídy v súvislosti so stúpajúcim vekom. Pulpitída a akútna apikálna parodontitída predstavujú najčastejší dôvod, pre ktorý pacient vyhľadáva akútne ošetrenie [2]. V praxi je možné sa najčastejšie stretnúť s apikálnou parodontitídou infekčnej etiológie, pri ktorej je zdrojom masívne infikovaná gangrenózna zubná dreň v koreňovom kanáliku [3, 23]. Bakteriálna infekcia nekrotických tkanív pulpy a systému koreňového kanálika postupuje rýchlo a postihuje tkanivá apikálneho parodontu. Existuje vzťah medzi infikovanou pulpou a vývojom infekcie v uvedenej oblasti [31]. Bakteriálna flóra je zmiešaná, prevažne obsahuje streptokoky, ďalej enterokoky, laktobacily, kandidy, neisserie, ako aj anaéroby (fusobaktérie, bakteroidy). Pri infekcii spočiatku v koreňovom kanáliku prevládajú aeróbne a fakultatívne anaeróbne baktérie [44]. Lokálny úbytok kyslíka následne podporuje rast obligátne anaeróbnych baktérií. Infikovanie dentínovej steny koreňového kanálika spôsobuje jej zmäknutie a demineralizáciu, čo spôsobuje stav označovaný ako infikovaný koreňový kanálik [8, 42].
Produkty metabolizmu mikroorganizmov a ich toxíny vyvolávajú zápalový proces v parodonte, najčastejšie v periapikálnej oblasti, ale môže byť lokalizovaný i v mieste laterálnych ramifikácií či subpulpálneho (Jesenského) kanálika. Forma zápalu môže byť primárne akútna alebo primárne chronická, prípadne chronická s akútnou exacerbáciou [34].
Výsledky rozsiahlych klinických štúdií poukazujú na skutočnosť, že kvalitná endodontická terapia má pri apikálnej parodontitíde za následok kompletnú, alebo významnú regresiu patologického procesu, pozorovateľnú na RTG snímke v 85–90 % prípadov. Pretrvávajúce nežiadúce príznaky súvisia najčastejšie s nevhodnou dezinfekciou, alebo neúplným uzáverom systému koreňového kanálika a s patogénnou úlohou zmiešanej mikrobiálnej flóry [1, 33].
Dôležitou príčinou apikálnej parodontitídy môže byť tiež akútna alebo chronická trauma. V tomto prípade okrem traumatizácie periodontálnych väzov nastáva aj poškodenie cievneho zásobenia pulpy. Pri akútnej traume môže byť toto poškodenie nezvratné, spojené so vznikom nekrózy, ktorá môže byť hematogénnou cestou infikovaná na gangrénu s následnými zápalmi apikálneho parodontu. Chronická traumatizácia, často iatrogénnej povahy, vedie skôr ku chronickému zápalu pulpy a priľahlej oblasti apikálneho parodontu. Akútna trauma, taktiež iatrogénna, môže vzniknúť pri chybnom mechanickom opracovaní koreňového kanálika koreňovými nástrojmi s neurčenou pracovnou dĺžkou. Veľmi často zároveň dochádza ku kontaminácii apikálnej oblasti mikrobiálnou flórou [9].
Problémy, väčšinou technického charakteru, ktoré spôsobujú vznik chronickej apikálnej parodontitídy po endodontickej liečbe zahŕňajú [26]:
- a) nedostatočnú aseptickú kontrolu;
- b) nevyhovujúci tvar prístupovej kavity;
- c) neošetrené koreňové kanáliky, ktoré ušli našej pozornosti;
- d) nedostatočné prístrojové vybavenie;
- e) nedostatočné odstránenie vrstvičky drviva z povrchu koreňových kanálikov;
- f) netesné dočasné alebo trvalé výplne.
Napriek dodržaniu najvyšších štandardov a najprísnejších postupov, apikálna parodontitída môže stále pretrvávať ako asymptomatická rádiolucencia, a to pre zložitosť koreňového systému, ktorý je tvorený hlavným a viacerými akcesórnymi (prídavnými) kanálikmi, ich apikálnymi ramifikáciami (rozvetveniami) a anastomózami (spojkami), ktoré nemôžu byť opracované, zbavené nečistôt, liečené a zaplnené existujúcimi nástrojmi, materiálmi a technikami. Ďalej existujú extraradikulárne etiologické faktory, nachádzajúce sa v okolí koreňových kanálikov, vo vnútri zapáleného periapikálneho tkaniva, ktoré môžu po terapii narušiť liečenie apikálnej parodontitídy. Skoršie výskumy periapikálnych biopsií, obmedzené odberom nevhodných vzoriek, použitím nehodiacich sa metód a kritérií, neboli prínosom pri zisťovaní etiológie uvedenej postterapeutickej chronickej apikálnej parodontitídy [28].
Príklady procedurálnych obmedzení zahŕňajú [26]:
- a) svetelnú mikroskopiu bez porovnania s elektrónovým mikroskopom;
- b) hodnotenie náhodných a nie sériových rezov;
- c) zalievanie vzoriek do parafínu namiesto do živice;
- d) stanovenie zložitých kritérií, ako sú napr. baktérie a/alebo vrstvička drviva, ktoré môžu predstavovať veľa potenciálnych etiologických faktorov.
V priebehu 90. rokov minulého storočia série starostlivo vykonaných vyšetrení, ktoré zohľadnili vhodnú selekciu prípadov a adekvátne metódy, preukázali, že existujú 4 biologické faktory, spôsobujúce postterapeutickú chronickú apikálnu parodontitídu [27].
Sú to tieto faktory 27:
- intraradikulárna infekcia pretrvávajúca v apikálnom systéme koreňa;
- extraradikulárna infekcia, zväčša vo forme periapikálnej aktinomykózy;
- reakcia organizmu na cudzorodú pretlačenú koreňovú výplň, iné cudzorodé látky, alebo endogénny cholesterol vyskytujúci sa vo forme kryštálov;
- cystické lézie.
Je treba zdôrazniť, že zo všetkých uvedených faktorov je práve pretrvávajúca infekcia v komplexnom koreňovom systéme hlavnou príčinou postterapeutickej chronickej apikálnej parodontitídy pri správne ošetrených zuboch [31]. Nedávny výskum 22 klinicky asymptomatických zubov, s prítomnými nevysvetliteľnými postterapeutickými chronickými apikálnymi rádiolucenciami, potvrdil toto konštatovanie [38].
Patogenéza chronickej apikálnej parodontitídy
Ak prítomnosť vyvolávajúcej príčiny pretrváva dlhšiu dobu, lézia môže prejsť bez zjavných klinických príznakov do chronického štádia. Chronická apikálna parodontitída predstavuje dynamickú rovnováhu medzi exogénnymi dráždivými agensami, zvyčajne mikroorganizmami koreňového kanálika a ich produktmi, a obrannými mechanizmami hosťujúceho organizmu. Obranné mechanizmy organizmu nie sú síce schopné úplne zničiť a odstrániť patogénne faktory, ale vytvorením ohraničenej bariéry efektívne predchádzajú ich ďalšej invázii [42, 47, 50].
Často sa stretávame s primárne chronickou apikálnou parodontitídou – parodontitis apicalis chronica, ktorá je charakteristická tvorbou granulačného tkaniva – periapikálny granulóm (obr. 1). Fibroblasty v granulačnom tkanive sa metamorfujú na osteoklasty resorbujúce kosť a ložisko sa zväčšuje. Zápalová resorpcia môže smerovať i na povrch apikálnej časti koreňa, kde cementoklasty resorbujú cement (vonkajšia zápalová resorpcia). Prevaha väzivového tkaniva v granulóme vytvára ohraničený útvar, ktorý pri extrakcii zuba často uľpieva na jeho koreni. Röntgenologicky sa takýto proces zobrazuje ako dobre ohraničené prejasnenie vychádzajúce z periodontálnej štrbiny a popisujeme ho ako parodontitis apicalis chronica circumscripta. Ak má prejasnenie väčší rozsah, môže byť označované aj ako ostitis chronica circumscripta. Riedke, silno krvácajúce granulačné tkanivo, charakteristické novotvorenými kapilárami a mikroabscesmi, býva príčinou skôr neohraničeného, difúzneho röntgenologického apikálneho prejasnenia. Takýto stav potom popisujeme ako parodontitis apicalis chronica diffusa, eventuálne ostitis diffusa. V prípade, že sa v mieste tvorby granulačného tkaniva nachádzajú pozostatky epitelu pochádzajúceho z embryonálnej Hertwigovej pošvy (Malassezove epiteliálne ostrovčeky), môže zápalový proces vyvolať ich proliferáciu. Vznikajú dutinky vystlané proliferujúcim epitelom a vytvára sa základ pre cystogranulóm. Cystický epitel potom secernuje číru cystickú tekutinu obsahujúcu lesklé cholesterolové kryštáliky. Útvar tak rastie a vzniká radikulárna cysta. Všetky chronické ochorenia apikálneho parodontu môžu akútne exacerbovať, buď pri oslabení imunity jedinca, alebo pri zvýšení virulencie prítomných mikroorganizmov. V typickom granulačnom tkanive sa následne objaví masívna leukocytárna infiltrácia a vznikajúci hnisavý exsudát sa šíri rovnakým spôsobom, ako je spomenuté pri primárne akútnom zápale. Takýto stav označujeme ako parodontitis apicalis chronica acutae exacerbans. U jedincov s vyššou obranyschopnosťou a menej virulentným infekčným agens (napr. pri zuboch neúspešne endodonticky ošetrených) sa vyskytuje chronická forma apikálnej parodontitídy typická naopak osteosklerózou kosti, t.j. hypermineralizáciou a kondenzáciou kostnej štruktúry. Takýto nález sa označuje ako kondenzujúca ostitis. Niekedy býva sprevádzaná i výskytom hypercementózy apexu vytvorenej nárastom sekundárneho cementu [9].
Obr. 1. Chronická apikálna parodontitída – periapikálny granulóm (zub 24) – autor Ján Kováč Fig. 1. Chronic apical periodontitis – periapical granuloma (tooth 24) – Author Ján Kováč 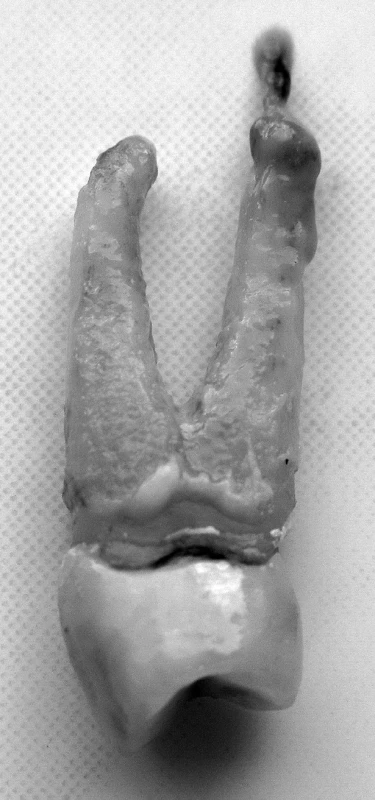
Vplyv imunitného systému na vývoj a pretrvávanie zápalového procesu pri chronickej apikálnej parodontitíde – periapikálnych granulómoch
Apikálna parodontitída predstavuje jedno z prvých ochorení ústnej dutiny, pri ktorej sa dokázal vplyv imunitného systému na vývoj a pretrvávanie zápalového procesu. Patogénny proces sa môže pritom iniciovať každým poškodením, ktoré vyvoláva akútnu imunitnú zápalovú odpoveď organizmu v periapikálnej oblasti. Povaha pôvodcov pritom predstavuje široké biologické spektrum [49].
Pri granulóme ide v podstate o obrannú reakciu organizmu na prenikajúcu infekciu z periodoncia. Ako chronický zápal sa klinicky neprejavuje a býva skôr náhodným nálezom na RTG snímke. Akútne vzplanutie pri granulómoch nastáva pri pretlačení infekcie (infikovaného dentínu s mikroorganizmami) koreňovými nástrojmi do granulačného tkaniva, ktoré je pri granulómoch sterilné. Akútna exacerbácia vzniká rýchlo (v priebehu 24 hodín) a náhla tvorba subperiostálneho abscesu môže nepríjemne zaskočiť pacienta i lekára. Preto je táto afekcia pomenovaná ako Fénix absces podľa bájneho vtáka, ktorý omladený vzlieta raz za sto rokov zo svojho popola. Tejto nežiadúcej príhode možno predísť zhotovením kontrolnej meracej snímky, prípadne používaním apexlokátora a striktným dodržiavaním pracovnej dĺžky nástroja. Pri rozsiahlejších periapikálnych granulómoch dochádza často i k resorpcii koreňa, a preto nie je možné spoliehať sa na taktilné nasondovanie apikálnej konstrikcie. Granulóm nie je možné na RTG snímke odlíšiť od cysty. Ostré ohraničenie afekcie môže na RTG snímke znamenať len väčšiu denzitu kostného tkaniva, ktorá je daná remineralizačným procesom v okolí granulačného tkaniva. Cystu môžeme diagnostikovať len histologicky, preto sa vždy dáva prednosť endodontickej terapii. Len v prípade neúspechu, ak nedôjde ku zmenšeniu až úplnej osifikácii ložiska, pristupuje sa ku chirurgickej liečbe, a to resekcii koreňového hrotu alebo exstirpácii cysty 9.
Približne 50 % chronických lézií je epitelizovaných 30. Pri periapikálnych cystách pochádza vrstevnatý dlaždicovitý epitel zo spiacich pozostatkov epiteliálnych Malassezových buniek a vytvára nepretržité lemovanie úplne uzatvárajúce patologickú dutinu. Pravé cysty majú lúmen obklopený vláknitým spojivovým tkanivom obsahujúcim chronický zápalový bunkový infiltrát [24].
Pri chronickej parodontitíde pozostáva zápalový bunkový infiltrát prakticky zo všetkých súčastí špecifickej i nešpecifickej zložky imunitného systému – B a T lymfocytov, plazmatických buniek a profesionálnych fagocytov: makrofágov a PMNL. Akumulácia buniek zápalovej reakcie predstavuje na jednej strane obrannú reakciu hostiteľského organizmu zameranú na eradikáciu prítomných mikroorganizmov a predchádza bakteriálnej invázii do kosti v oblasti apikálneho parodontu [16]. Na druhej strane však mechanizmus antiinfekčného účinku nie je obmedzený len na ničenie pôvodcov ochorenia, ale poškodzuje i normálne súčasti tkaniva, čo má za následok resorpciu kosti [13, 40]. Okrem toho, opakovanie autokrinnej a parakrinnej stimulácie môže viesť k neustálemu pretrvávaniu miestnej zápalovej lézie a môže zmeniť tiež funkciu vzdialených tkanív a orgánov.
Histologický obraz typického periapikálneho granulómu predstavuje zápalový proces pozostávajúci z nekrotickej, exsudatívnej, granulomatóznej a fibróznej (väzivovej) zóny (obr. 2). Podľa prevládajúcej zóny môže byť lézia klasifikovaná ako exsudatívny, granulomatózny, granulomatózne fibrózny a fibrózny granulóm. Exsudatívne lézie, charakterizované nadmernou nekrózou a exsudáciou s intersticiálnym edémom, odpovedajú akútnym počiatočným léziám alebo obdobiam akútnej exacerbácie chronickej apikálnej parodontitídy [14, 15, 17].
Obr. 2. Histologická štruktúra chronickej periapikálnej zápalovej lézie [9] Fig. 2. Histological structure of a chronic periapical inflammatory lesion [9] ![Histologická štruktúra chronickej periapikálnej zápalovej lézie [9]
Fig. 2. Histological structure of a chronic periapical inflammatory lesion [9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a98f54edce9591d61132ba89d0b25c54.jpeg)
V nekrotických a exsudatívnych oblastiach periradikulárneho zápalu neutrofilné leukocyty, známe ako mikrofágy, poskytujú prvú obrannú líniu proti bakteriálnej invázii z infikovaného koreňového kanálika (obr. 3). Vďaka ich efektívnej fagocytóze a funkcii zabíjania je väčšina mikroorganizmov zničená a eliminovaná, čím sa predíde ich rozšíreniu cez léziu [4].
Obr. 3. Zápalový bunkový infiltrát prítomný v periapikálnom granulóme V histopatologickom obraze lézie možno vidieť neutrofily (N), histiocyt (H) a obrovskú bunku (OB) – autor Ján Kováč. Fig. 3. Inflammatory cell infiltrate in periapical granuloma Histopathological image of the lesion shows neutrophils (N), a histiocyte (H), and a giant cell (OB) – Author Ján Kováč. 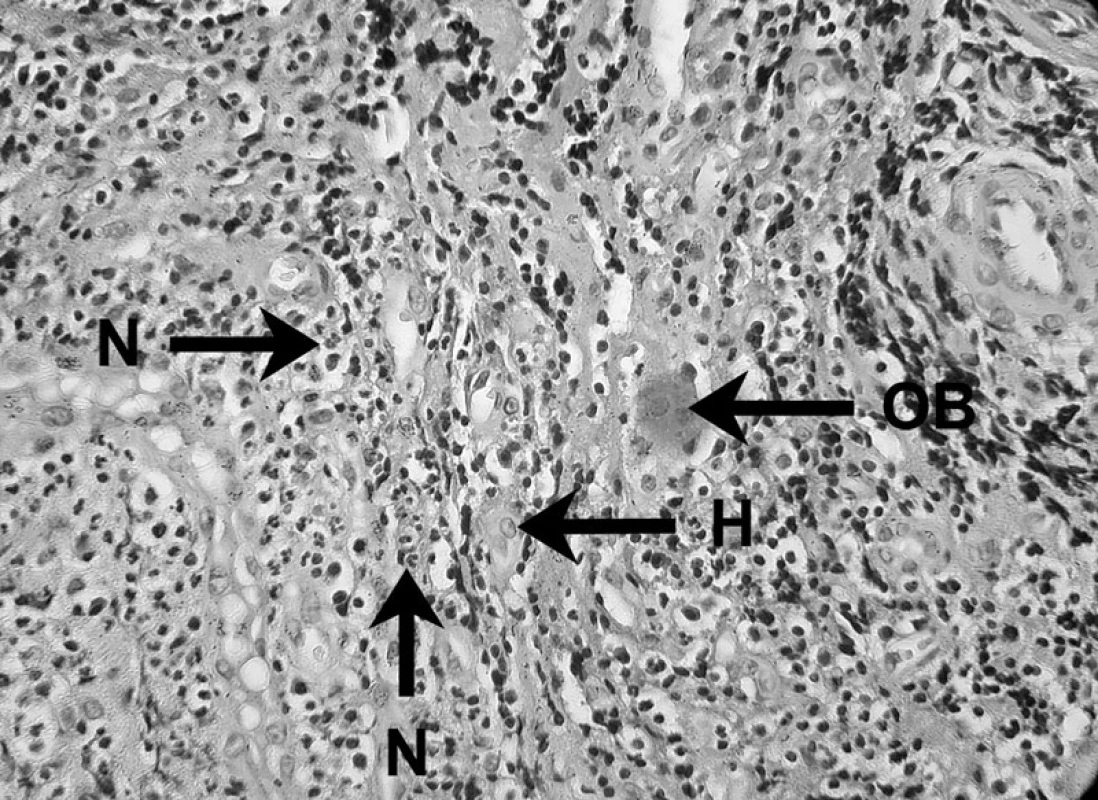
Neutrofilné leukocyty sú prítomné aj v granulomatóznej zóne lézie, hoci tu je ich počet nižší ako v exsudatívnej zóne, v porovnaní s ostatnými infiltrujúcimi bunkami [35]. Tu ich možno nájsť rovnomerne roztrúsené medzi lymfocytmi, plazmatickými bunkami, makrofágmi, eozinofilnými granulocytmi a fibrovaskulárnymi elementami. Význam neutrofilných granulocytov v granulomatóznej zóne je nejasný, keďže vážna bakteriálna kontaminácia je tu skôr výnimkou než pravidlom. Ich antibakteriálny účinok prispieva k zabráneniu šírenia baktérií, rovnako ako k eliminácii vystupujúcich patogénnych bakteriálnych membránových zložiek, antigénov, toxínov a enzýmov z koreňového kanálika a exsudatívnej zóny [16].
Eozinofily, hoci ich konzistentne nachádzame v granulačnom tkanive, predstavujú len minoritnú populáciu z infiltrujúcich polymorfonukleárnych leukocytov (obr. 4). V 70. rokoch a začiatkom 80. rokov minulého storočia, bola za vyvolávanie neobvyklých klinických symptómov pri pacientoch s chronickou apikálnou parodontitídou prisudzovaná významná úloha okamžitej alebo anafylaktickému typu podobnej hypersenzitívnej reakcii, sprostredkovanej histamínom, uvoľneným tkanivovými bazofilmi a mastocytmi (žírnymi bunkami), následne viazaný imunoglobulínom IgE prostredníctvom Fc receptorov. Pokrok v imunológii odhalil skutočnosť, že počet žírnych buniek je omnoho nižší, než sa predtým predpokladalo 18.
Obr. 4. Zápalový bunkový infiltrát prítomný v periapikálnom granulóme V histopatologickom obraze lézie možno vidieť eozinofily (E) a obrovské bunky (OB) – autor Ján Kováč. Fig. 4. Inflammatory cell infiltrate in periapical granuloma Histopathological image of the lesion shows eosinophils (E) and giant cells (OB) – Author Ján Kováč. 
Významná úloha v miestnej antibakteriálnej imunite, na rozdiel od IgE, môže byť prisudzovaná i ďalším triedam imunoglobulínov. Niekoľko autorov demonštrovalo prítomnosť vysokých koncentrácií IgG, IgA a malé množstvá IgM a sekrečného IgA vo vnútri periapikálnych granulómov, v stenách periapikálnych cýst, tekutine cýst, rovnako ako v exsudátoch z koreňových kanálikov periapikálne postihnutých zubov [45]. Ukázalo sa, že hodnoty IgG a IgA v periapikálnom exsudáte korelujú s klinickými nálezmi príslušných zubov [20].
Uvedené skutočnosti potvrdili i skúmania veľkého počtu ľudských a zvieracích granulómov, kde sa v periapikálnom granulačnom tkanive opakovane zistila prítomnosť B lymfocytov a ich produktov, plazmatických buniek produkujúcich IgG, IgA a IgM. Hoci B lymfocyty a plazmatické bunky predstavujú prevažnú populáciu periradikulárneho zápalového infiltrátu, kvantitatívne stanovenie subpopulácií lymfocytov preukázalo nadbytok T nad B lymfocytmi 5, 39 – obrázky 5, 6 a 7.
Obr. 5. Zápalový bunkový infiltrát prítomný v periapikálnom granulóme V histopatologickom obraze lézie možno vidieť lymfocyt (L), plazmatické bunky (PB) a neutrofil (N) – autor Ján Kováč. Fig. 5. Inflammatory cell infiltrate in periapical granuloma Histopathological image of the lesion shows a lymphocyte (L), plasma cells (PB), and a neutrophil (N) – Author Ján Kováč. 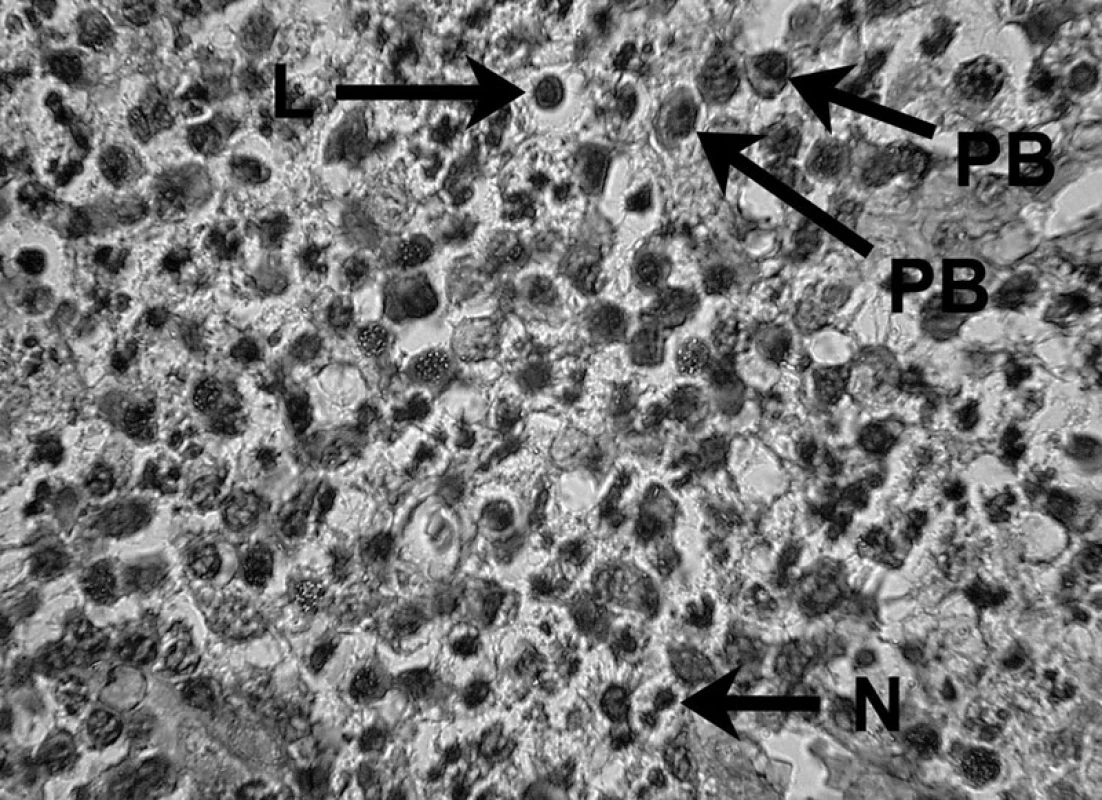
Obr. 6. Prítomnosť B – lymfocytov v periapikálnom granulóme a ich identifikácia pomocou protilátky L-26 (DAKO) – autor Ján Kováč Fig. 6. The presence of B lymphocytes in periapical granuloma and their identification using the L-26 antibody (DAKO) – Author Ján Kováč. 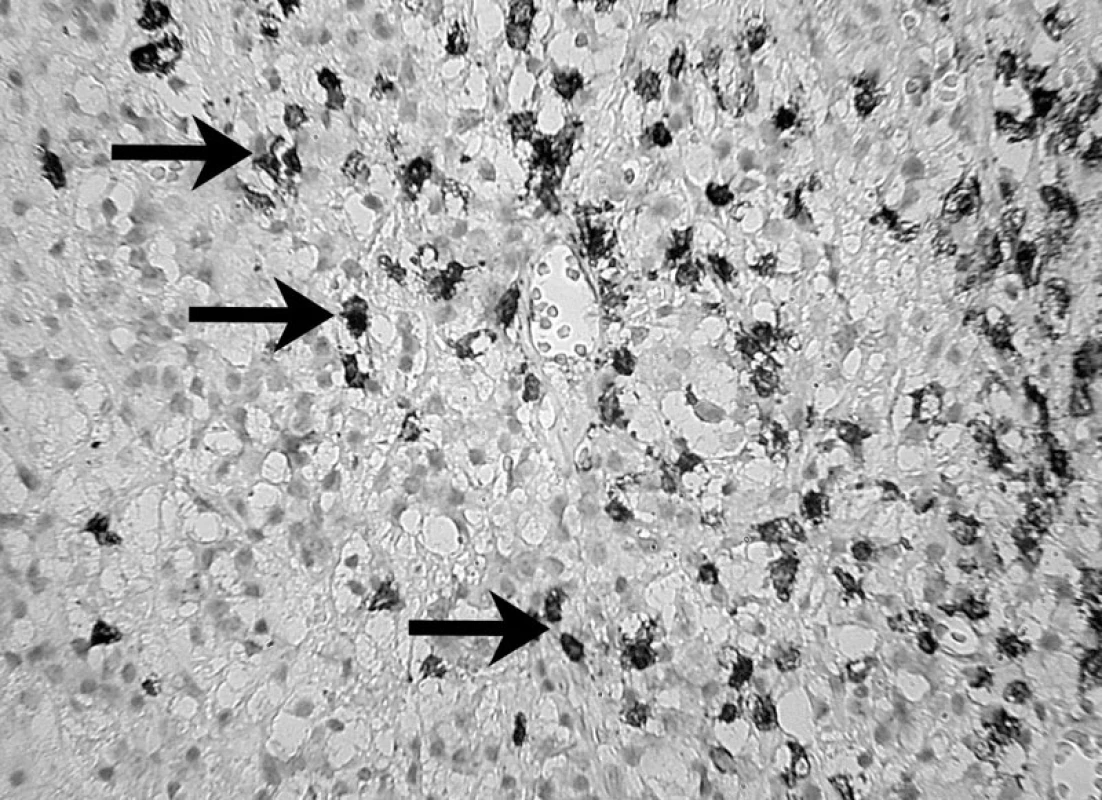
Obr. 7. Prítomnosť T – lymfocytov v periapikálnom granulóme a ich identifikácia pomocou protilátky UCHL-1 (DAKO) – autor Ján Kováč. Fig. 7. The presence of T lymphocytes in periapical granuloma and their identification using the UCHL-1 antibody (DAKO) – Author Ján Kováč. 
Imunohistochemické analýzy periapikálnych lézií dokázali, že v rámci T lymfocytov prevládajú TH nad TC lymfocytmi, pričom pomer TH/TC kolíše približne od 1 do 3 a viac, a to v súlade so zápalom periapikálnych tkanív [12]. Do periapikálnej zápalovej lézie okrem lokálne vytvorených imunoglobulínov prenikajú i ďalšie proteíny plazmy, vytvorené transudáciou z rozšírených krvných ciev, a to súčasti komplementu, proteíny zrážania, kalikreínkinínový systém a reaktanty akútnej fázy [11].
NK bunky (Natural killer cells), ktoré predstavujú spojenie medzi nešpecifickou a antigén-špecifickou zložkou imunitného systému, sa vyskytujú v periapikálnych léziách len v nízkych percentách. Predpokladá sa, že môžu zohrávať obrannú funkciu pri kontrole koreňovej infekcie, alebo sa podieľajú na jej patogenéze, čo sa však zdá byť nepravdepodobné 6.
Nedávne výskumy na potkaních molároch s experimentálne indukovanými periapikálnymi granulómami, vyvolanými vystavením otvorenej dreňovej dutiny orálnej mikrobiálnej flóre, poukázali na skutočnosť, že jednou z prvých reakcií je masívny prílev makrofágov do periapikálnych tkanív. Toto zistenie potvrdzuje fakt, že organizmus v snahe o odstránenie škodlivej noxy, postupujúcej z postihnutej zubnej drene smerom do periapikálneho priestoru, rýchlo mobilizuje lokálne prvú obrannú líniu pozostávajúcu z fagocytov [5].
V rámci nášho histopatologického výskumu preparátov granulómov sa pozorovali makrofágy spojivového tkaniva – histiocyty (obr. 8). Histiocyt je druh makrofágu, schopný pohlcovať odpadový alebo cudzorodý materiál v organizme.
Obr. 8. Zápalový bunkový infiltrát prítomný v periapikálnom granulóme V histopatologickom obraze lézie možno vidieť lymfocyty (L), eozinofily (E), plazmatickú bunku (PB) a histiocyt (H) – autor Ján Kováč. Fig. 8. Inflammatory cell infiltrate in periapical granuloma Histopathological image of the lesion shows lymphocytes (L), eosinophils (E), a plasma cell (PB), and a histiocyte (H) – Author Ján Kováč. 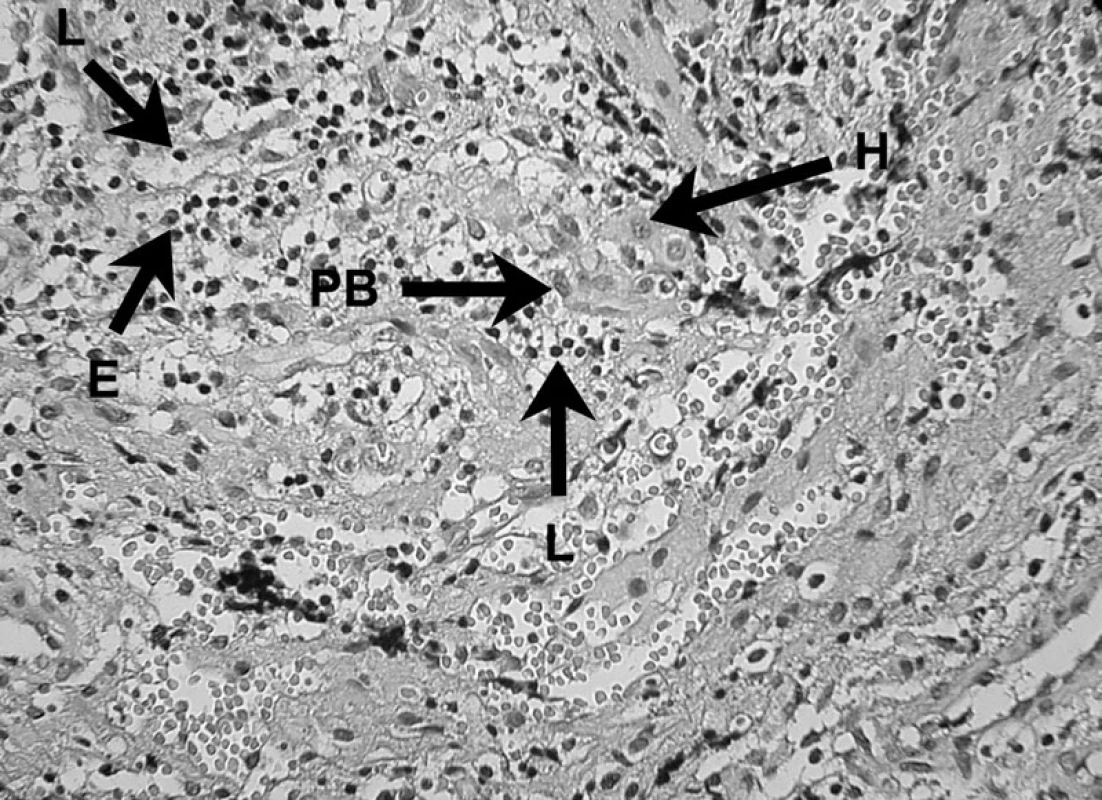
Makrofágy sú významnou súčasťou periapikálnych granulómov (obr. 9). Ústrednú obrannú úlohu majú aj vo vrodenej nešpecifickej a získanej antigén-špecifickej imunitnej odpovedi organizmu. Podieľajú sa nielen na obranných reakciách, ale aj na vývoji lézií, či pretrvávaní zápalových reakcií. Ich množstvo vo vnútri zápalovej celulárnej infiltrácie sa odhaduje v širokom spektre od 4 % do 50 %. Aktivácia makrofágov v periapikálnych granulómoch môže byť vyvolaná cytokínmi produkovanými antigén-aktivovanými T lymfocytmi, alebo bakteriálnym endotoxínom, prípadne ich kombináciou (obr. 10). Štúdie na zvieratách bez týmusu preukázali, že periapikálne granulómy sa môžu vyvinúť nezávisle od T lymfocytov. Odhalili, že hlavnú úlohu pri formovaní periapikálnych lézií majú aktivované makrofágy. Aktivovaných je len niekoľko makrofágov v periapikálnych granulómoch. Aktivované makrofágy sú zdrojom cytokínov, ktoré resorbujú kosť. Pochopenie úlohy aktivovaných makrofágov pri formovaní, rovnako ako aj pri udržiavaní periapikálnych lézií, môže viesť k vývoju nových diagnostických a liečebných postupov v endodoncii 7, 43.
Obr. 9. Prítomnosť fagocytujúceho makrofágu v periapikálnom granulóme (M) Ďalej vidno arteriolu (A) a venulu (V) – autor Ján Kováč. Fig. 9. The presence of a phagocyting macrophage (M) in periapical granuloma. An arteriole (A) and a venule (V) can also be seen – Author Ján Kováč. 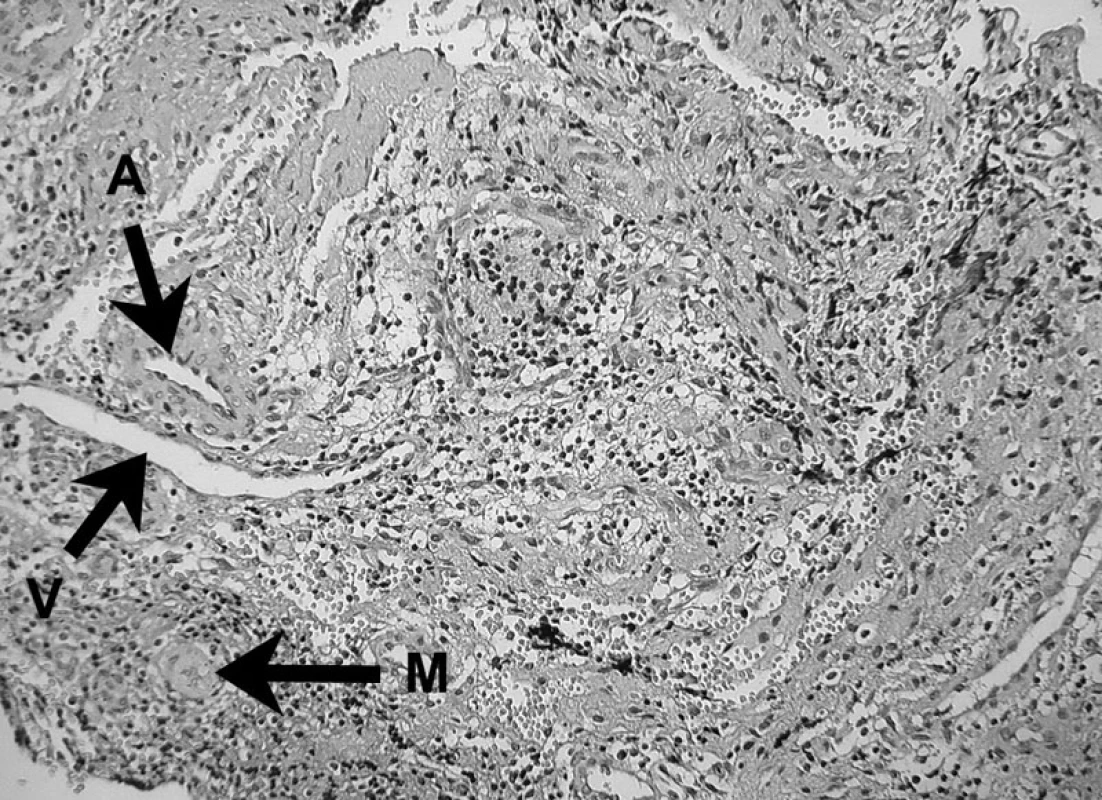
Obr. 10. Ochranná úloha aktivovaných makrofágov a T lymfocytov v periapikálnych granulómoch Aktivácia T lymfocytov vedie k antigénšpecifickej aktivácii B lymfocytov a lokálnej produkcii špecifických protilátok. Tiež vedie k aktivácii makrofágov, čo má za následok zvýšenie fagocytózy týchto buniek, rovnako ako zvýšenie cytokínmi sprostredkovanej marginácie PMNL, chemotaxie a ich aktivácie. Aktivácia makrofágov sa môže dosiahnuť i nezávisle od T lymfocytov bakteriálnym endotoxínom (lipopolysacharidom – LPS) 9. Fig. 10. The protective role of activated macrophages and T lymphocytes in periapical granuloma T lymphocyte activation induces an antigen-specific B lymphocyte response and local production of specific antibodies. It also activates macrophages which results in increased phagocytic activity of these cells as well as in increase in cytokine mediated PMNL marginalization, chemotaxis and their activation. Macrophage activation can also be induced independently of T lymphocytes by a bacterial endotoxin (lipopolysaccharide – LPS) 9. 
Resorpcia kosti nastáva aktiváciou kosť resorbujúcich buniek – osteoklastov. Existuje široký okruh biologicky aktívnych molekúl, ktoré sú v in vitro podmienkach schopné aktivovať osteoklastickú resorpciu kosti. Patria sem prostaglandíny, bakteriálny endotoxín, produkty aktivovaného komplementu, rovnako ako zápalové cytokíny IL-1α, IL-1β, TNF-α, TNF-β, IL-6 a IL‑11, ktoré sa ako skupina označujú „osteoklasty aktivujúci faktor“ (OAF). Z nich najaktívnejším je cytokín IL-1, pričom jeho kosť resorbujúca kapacita je 13-násobne väčšia než pri IL-1α a 1000-násobne väčšia než pri TNF-α a TNF-β. Hoci IL-1 a TNF môžu byť produkované nnohými typmi buniek, za hlavný zdroj IL--1α, IL-1β a TNF-α sa považujú aktivované makrofágy. TNF-β sa zvyčajne považuje za produkt aktivovaných T lymfocytov. So zreteľom na vyššie uvedené skutočnosti, možno za aktiváciu resorpcie kosti v periapikálnych léziách považovať zodpovedné dva typy buniek: aktivované T lymfocyty a aktivované makrofágy [21].
Ak prebieha proces hojenia periapikálnej lézie príliš dlho, je predpoklad, že aktivované bunky zostávajú v aktívnom stave i po eliminácii vyvolávajúcej príčiny. Makrofágy sú známe tým, že pretrvávajú v tkanivách i mnoho mesiacov. Ak pretrvávajú v aktívnom stave, môžu inhibovať fibroblasty a udržovať aktivitu osteoklastov. Zabraňujú tak reparačným procesom v spojivovom tkanive a kosti [22]. Ak je predpoklad správny, je možné sledovať ich stav aktivácie odberom vzoriek z tkanivového moku lézie cez koreňový kanálik 19. Len nedávno sa podarilo Kuovi et al. zmerať obsah IL-1β v apikálnych exsudátoch a korelovať ich s klinickým a RTG obrazom lézií. Nevyhnutná je dlhodobá štúdia, ktorá by preukázala koreláciu medzi klesajúcim obsahom IL‑1β v léziách a ich postupnou reparáciou, pozorovateľnou na RTG snímke [10].
Za predpokladu, že tieto spomaľujúce mechanizmy sú zapojené do predĺženej a oneskorenej reparácie periapikálnych lézií, možno zvažovať využitie farmakologickej modulácie. Stashenko demonštroval na zvieratách, že antagonistu IL‑1 receptora možno použiť na redukciu aktivity kostnej resorpcie a formovanie periapikálnych lézií [41]. S úspechom sa pri experimentálnych a ľudských ochoreniach apikálneho parodontu použili i nesteroidné antiflogistiká. Tieto dva prístupy smerujú buď k blokovaniu viazania už vyprodukovaných cytokínov na ich cieľové bunky, alebo k interferencii ich účinku na osteoklasty a osteoblasty produkciou prostaglandínov [48].
Na inhibíciu sekrécie cytokínov aktivovanými makrofágmi možno použiť tetracyklíny. Shapira et al. skúmali vplyv tetracyklínov na inhibíciu produkcie TNF a IL-1 lipopolysacharidom (LPS) aktivovanými makrofágmi. Zistili, že inhibícia prebieha na posttranskripčnej úrovni, čo znamená, že mRNA a samotné cytokíny sú bunkou produkované, no nie vylučované do jej okolia [37].
Alternatívnou stratégiou môže byť pokus o vypnutie aktivovaných makrofágov, čím sa zníži lokálna produkcia IL-1 v lézii. Modulácia aktivácie makrofágov sa skúmala v in vitro i v in vivo podmienkach použitím glukokortikoidov. Makrofágy, ktoré sú aktivované na to, aby sa stali tumoricídnymi, sú v in vivo podmienkach procesom zahrňajúcim steroidy. Metzger et al. nedávno oznámili, že supresia proliferácie fibroblastov LPS-aktivovanými makrofágmi je obrátená hydrokortizónom. K podobným výsledkom dospeli i ďalší autori, ktorí uvádzajú, že inhibičný účinok steroidov je na úrovni transkripcie génov [22, 32, 36, 46].
Ak po úspešnom endodontickom ošetrení nie sú už viac baktérie prítomné v koreňovom kanáliku, môže aktivovaný stav makrofágov prekročiť hranicu svojho pôvodne užitočného a prospešného účelu. Pokusy o zastavenie hostiteľskej odpovede organizmu v lézii môžu predstavovať nový spôsob terapie s dôrazom na supresiu a reparáciu týchto lézií (obr. 11). Možno to dosiahnuť dlhotrvajúcim lokálnym prísunom liečiv, určených na tento účel. Použijú sa biologicky odbúrateľné, pomaly pôsobiace prostriedky, vo forme vstrebateľnej špičky, ktorá môže byť vložená cez koreňový kanálik, a ktorá môže dodávať liečivo počas predurčeného časového intervalu [9].
Obr. 11. Eliminácia deštruktívnych mediátorov makrofágov (A) Tradičný spôsob: ošetrením koreňového kanálika, elimináciou stimulujúcich podnetov aktivácie, ako bakteriálnych antigénov a lipopolysacharidu – LPS. (B) Navrhovaná metóda: farmakologicky použitím steroidov, tetracyklínov, antagonistov receptorov alebo nesteroidných antiflogistík, ktoré interferujú s produkciou mediátorov alebo s ich pôsobením [9]. Fig. 11. Elimination of destructive macrophage mediators (A) Conventional method: root channel treatment and elimination of activation stimuli such as bacterial antigens and lipopolysaccharide – LPS. (B) Candidate method: Pharmacotherapy with steroids, tetracyclines, receptor antagonists or non-steroidal anti-inflammatory drugs interfering with mediator production or action [9]. ![Eliminácia deštruktívnych mediátorov makrofágov (A) Tradičný spôsob: ošetrením koreňového kanálika, elimináciou stimulujúcich podnetov aktivácie, ako bakteriálnych antigénov a lipopolysacharidu – LPS. (B) Navrhovaná metóda: farmakologicky použitím steroidov, tetracyklínov, antagonistov receptorov alebo nesteroidných antiflogistík, ktoré interferujú s produkciou mediátorov alebo s ich pôsobením [9].
Fig. 11. Elimination of destructive macrophage mediators (A) Conventional method: root channel treatment and elimination of activation stimuli such as bacterial antigens and lipopolysaccharide – LPS. (B) Candidate method: Pharmacotherapy with steroids, tetracyclines, receptor antagonists or non-steroidal anti-inflammatory drugs interfering with mediator production or action [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/85bf8cea34ef8caf5f08d366657a2640.jpeg)
Dynamická rovnováha medzi obrannými a deštruktívnymi mechanizmami môže poskytnúť patobiologický základ pre lepšie pochopenie klinických znakov a symptómov apikálnej parodontitídy a ovplyvniť stratégiu liečby.
Lepšie pochopenie imunobiológie periapikálnych lézií môže viesť v konečnom dôsledku k zmene postupov realizovaných v súčasnej endodoncii. Perspektívnou môže byť diagnostická súprava, ktorá by umožnila definovať, či ide o periapikálnu léziu aktívnu, alebo hojacu sa, odberom vzoriek cez koreňový kanálik ešte pred zaplnením. Vzdialenou nie je ani farmakologická modulácia hojivého procesu aplikáciou biologicky odbúrateľných a pomaly pôsobiacich látok [9].
Záver
Hlavnou príčinou apikálnej parodontitídy je vnútrokanálová infekcia koreňového systému zuba. Cieľom endodontickej terapie je preto eliminácia pôvodcov infekcie z koreňového systému zuba a zabránenie reinfekcie hermetickou koreňovou výplňou.
V prípade výskytu chronickej apikálnej parodontitídy pri zuboch lege artis endodonticky ošetrených, nemusí opätovné ortográdne ošetrenie koreňového systému tento problém vyriešiť. Z tohto dôvodu by lekár, ktorý sa stretne s prípadom pretrvávajúcej chronickej periapikálnej rádiolucencie, mal zvážiť nevyhnutnosť odstránenia príčinných faktorov chirurgickým výkonom, s cieľom zlepšiť dlhodobý výsledok liečby. Chirurgická liečba poskytuje nielen možnosť odstrániť extraradikulárne faktory, ktoré udržiavajú chronickú apikálnu parodontitídu, ale umožňuje aj retrográdny prístup k potenciálnej infekcii v apikálnej časti koreňového systému.
Do redakce došlo dne 8. 12. 2010.
Adresa pro korespondenci:
MUDr. Ján Kováč, PhD.
Klinika stomatológie a maxilofaciálnej chirurgie LFUK a OÚSA Bratislava
Heydukova 10
812 50 Bratislava
Slovenská republika
e-mail: mudr.jan.kovac@gmail.com
Zdroje
1. El-Swiah, J. M., Walker, R. T. Reasons for apicectomies. A retrospective study. Endod. Dent. Traumatol., 1996, 12, 4, p. 185–191.
2. Eriksen, H. M. Endodontology – epidemiologic considerations. Dent. Traumatol., 1991, 7, 5, p. 189–195.
3. Jung, I., Choi, B., Kum, K., Roh, B. et al. Molecular epidemiology and association of putative pathogens in root canal infection. J. Endod., 2000, 26, 10, p. 599–604.
4. Kaufmann, S. H. Immunity to intracellular bacteria. Ann. Rev. Immunol., 11, 1993, p. 129–163.
5. Kawashima, N., Okiji, T., Kosaka, T., Suda, H. Kinetics of macrophages and lymphoid cells during the development of experimentally induced periapical lesions in rat molars: a quantitative immunohistochemical study. J. Endod., 1996, 22, 6, p. 311–316.
6. Kettering, J. D., Torabinejad, M. Presence of natural killer cells in human chronic periapical lesions. Int. Endod. J., 1993, 26, 6, p. 344–347.
7. Kopp, W., Schwarting, R. Differentiation of T lymphocyte subpopulations, macrophages and HLA--restricted cells of apical granulation tissue. J. Endod., 1989, 15, 2, p. 72–75.
8. Kotula, R. Endodoncia – Filozofia a prax. Bratislava: Herba, 2006, 180 s.
9. Kováč, J., Kováč, D. Imunitné procesy organizmu prebiehajúce pri apikálnej parodontitíde. Stomatológ, 2009, 19, 1, s. 3–10
10. Kuo, M. L., Lamster, I. B., Hasselgren, G. Host mediators in endodontic exudates. I. Indicators of inflammation and humoral immunity. J. Endod., 1998, 24, 9, p. 598–603.
11. Lerner, U. H. Regulation of bone metabolism by the kallikrein-kinin system, the coagulation cascade, and the acutephase reactants. Oral Surg. Oral Med. Oral Pathol., 1994, 78, 4, p. 481–493.
12. Liapatas, S., Nakou, M., Rontogianni, D. Inflammatory infiltrate of chronic periradicular lesions: an immunohistochemical study. Int. Endod. J., 2003, 36, 7, p. 464–471.
13. Márton, I. J., Balla, G., Hegedüs, C., Redl, P. et al. The role of reactive oxygen intermediates in the pathogenesis of chronic apical periodontitis. Oral Microbiol. Immunol., 8, 1993, p. 254–257.
14. Márton, I. J., Dezsö, B., Radics, T., Kiss, C. Distribution of interleukin-2 receptor α-chain and cells expressing major histocompatibility complex class II antigen in chronic human periapical lesions. Oral Microbiol. Immunol., 1998, 13, 4, p. 259–262.
15. Márton, I. J., Kiss, C. Influence of surgical treatment of periapical lesions on serum and blood levels of inflammatory mediators. Int. Endod. J., 1992, 25, 5, p. 229–233.
16. Márton, I. J., Kiss, C. Protective and destructive immune reactions in apical periodontitis. Oral Microbiol. Immunol., 2000, 15, 3, p. 139–150.
17. Márton, I. J., Rot, A., Schwarzinger, E., Szakáll, S. et al. Differential in situ distribution of interleukin-8, monocyte chemoattractant protein-1 and Rantes in human chronic periapical granuloma. Oral Microbiol. Immunol., 2000, 15, 1, p. 63–65.
18. Márton, I., Nemes, Z., Harmati, S. Quantitative significance of IgE producing plasma cells and tissue distribution of mast cells in apical periodontitis. Oral Microbiol. Immunol., 1990, 5, 1, p. 46–48.
19. Matsuo, T., Ebisu, S., Nakanishi, T., Yonemura, K. et al. Interleukin-1 alpha and interleukin-1 beta periapical exudates of infected root canals: correlations with the clinical findings of the involved teeth. J. Endod., 1994, 20, 9, p. 432–435.
20. Matsuo, T., Nakanishi, T., Ebisu, S. Immunoglobulins in periapical exudates of infected root canals: correlation with the clinical findings of the involved teeth. Endod. Dent. Traumatol., 1995, 11, 2, p. 95–99.
21. Metzger, Z. Macrophages in periapical lesions. Endod. Dent. Traumatol., 2000, 16, 1, p. 1–8.
22. Metzger, Z., Berg, D., Dotan, M. Fibroblast growth in vitro suppressed by LPS-activated macrophages. Reversal of suppression by hydrocortisone. J. Endod., 1997, 23, 8, p. 517–521.
23. Molven, O., Olsen, I., Kerekes, K. Scanning electron microscopy of bacteria in the apical part of root canals in permanent teeth with periapical lesions. Dent. Traumatol., 1991, 7, 5, p. 226–229.
24. Nair, P. N. R., Sjögren, U., Schumacher, E., Sundqvist, G. Radicular cyst affecting a root-filled human tooth: a long-term post-treatment follow-up. Int. Endod. J., 1993, 26, 4, p. 225–233.
25. Nair, P. N. R. Apical periodontitis: a dynamic encounter between root canal infection and host response. Periodontol., 2000, 1997, 13, 1, p. 121–148.
26. Nair, P. N. R. Non-microbial etiology: foreign body reaction maintaining post-treatment apical periodontitis. Endod. Top., 2003, 6, p. 114–134.
27. Nair, P. N. R. Non-microbial etiology: periapical cysts sustain post-treatment apical periodontitis. Endod. Top, 2003, 6, p. 96–113.
28. Nair, P. N. R. On the causes of persistent apical periodontitis: a review. Int. Endod. J., 2006, 39, 4, p. 249–281.
29. Nair, P. N. R. Pathogenesis of apical periodontitis and the causes of endodontic failures. Crit. Rev. Oral. Biol. Med., 2004, 15, 6, p. 348–381.
30. Nair, P. N. R., Pajarola, G., Schroeder, H. E. Types and incidence of human periapical lesions obtained with extracted teeth. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 1996, 81, 1, p. 93–102.
31. Nair, P. N. R., Sjögren, U., Kahnberg, K. E., Krey, G. et al. Intraradicular bacteria and fungi in root-filled, asymptomatic human teeth with therapy-resistant periapical lesions: a long-term light and electron microscopic follow-up study. J. Endod., 1990, 16, 12, p. 580–588.
32. Nakamura, Y., Murai, T., Ogawa, Y. Effect of in vitro and in vivo administration of dexamethasone on rat macrophage functions: comparison between alveolar and peritoneal macrophages. Eur. Respir. J., 1996, 9, p. 301–306.
33. Įrstavik, D. Time-course and risk analyses of the development and healing of chronic apical periodontitis in man. Int. Endod. J., 1996, 29, 3, p. 150–155.
34. Peřinka, L. Základy klinické endodoncie. Praha: Quintessenz, 2003, 288 s.
35. Piattelli, A., Artese, L., Rosini, S., Quaranta, M. et al. Immune cells in periapical granuloma: morphological and immunohistochemical characterization. J. Endod., 1991, 17, 1, p. 26–29.
36. Politis, A. D., Sivo, J., Driggers, P. H., Ozato, K. et al. Modulation of interferon consensus sequence binding protein mRNA in murine peritoneal macrophages. Induction by IFN-gamma and down-regulation by IFN‑alpha, dexamethasone, and protein kinase inhibitors. J. Immunol., 1992, 148, 3, p. 801–807.
37. Shapira, L., Soskolne, W. A., Houri, Y., Barak, V. et al. Protection against endotoxic shock and lipopolysaccharide induced local inflammation by tetracycline: correlation with inhibition of cytokine secretion. Infect. Immun., 1996, 64, 3, p. 825–828.
38. Siqueira, Jr., J. F., Rôćas, I. N. Polymerase chain reaction based analysis of microorganisms associated with failed endodontic treatment. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 2004, 97, p. 85–94.
39. Sol, M. A., Tkaczuk, J., Voigt, J. J., Durand, M. et al. Characterization of lymphocyte subpopulations in periapical lesions by flow cytometry. Oral Microbiol. Immunol., 1998, 13, 4, p. 253–258.
40. Stashenko, P. The role of immune cytokines in the pathogenesis of periapical lesions. Endod. Dent. Traumatol., 1990, 6, 3, p. 89–96.
41. Stashenko, P., Teles, R., D’Souza, R. Periapical inflammatory responses and their modulation. Crit. Rev. Oral. Biol. Med., 1998, 9, 4, p. 498–521.
42. Stashenko, P., Wang, C. Y., Tani-Ishii, N., Yu, S. M. Pathogenesis of induced rat periapical lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 1994, 78, 4, p. 494–502.
43. Tani, N., Osada, T., Watanabe, Z., Umemoto, T. Comparative immunohistochemical identification and relative distribution of immunocompetent cells in sections of frozen or formalin-fixed tissue from human periapical inflammatory lesions. Endod. Dent. Traumatol., 1992, 8, 4, p. 163–169.
44. Tani-Ishii, N., Wang, C. Y., Tanner, A., Stashenko, P. Changes in root canal microbiota during the development of rat periapical lesions. Oral Microbiol. Immunol., 1994, 9, 3, p. 129–135.
45. Torres, J. O. C., Torabinejad, M., Matiz, R. A. R., Mantilla, E. G. Presence of secretory IgA in human periapical lesions. J. Endod., 1994, 20, 2, p. 87–89.
46. Waage, A., Slupphaug, G., Shalaby, R. Glucocorticoids inhibit the production of IL6 from monocytes, endothelial cells and fibroblasts. Eur. J. Immunol., 1990, 20, 11, p. 2439–2443.
47. Walton, R. E., Ardjmand, K. Histological evaluation of the presence of bacteria in induced periapical lesions in monkeys. J. Endod., 1992, 18, 5, p. 216–227.
48. Wang, C. Y., Stashenko, P. Characterization of bone-resorbing activity in human periapical lesions. J. Endod., 1993, 19, 3, p. 107–111.
49. Wayman, B. E., Murata, S. M., Almeida, R. J., Fowler, C. B. A bacteriological and histological evaluation of 58 periapical lesions. J. Endod., 1992, 18, 4, p. 152–155.
50. Yamasaki, M., Nakane, A., Kumazawa, M., Hashioka, K. et al. Endotoxin and gram-negative bacteria in the rat periapical lesions. J. Endod., 1992, 18, 10, p. 501–504.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Informace SEM ČLS JEP
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2011 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Výsledky administrativní kontroly proočkovanosti v České republice k datu 31. 12. 2009
- Ambulantní péče o uživatele a závislé na návykových látkách v ČR ve zdravotnické statistice od roku 1963
- Sérologie lymeské borreliózy a humánní granulocytární ehrlichiózy v letech 2005–2010
- Histopatológia a etiopatogenéza chronickej apikálnej parodontitídy – periapikálnych granulómov
- Olfaktorický průkaz Mycobacteria tuberculosis ve sputu
- Informace SEM ČLS JEP
- Plán akcí Společnosti pro epidemiologii a mikrobiologii v roce 2011
- Plánované úterní semináře v Lékařském domě v roce 2011
- Zpráva o výsledku voleb do výboru Společnosti pro epidemiologii a mikrobiologii ČLS JEP pro období 2011–2014
- Koncepce a priority epidemiologie v České republice
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Histopatológia a etiopatogenéza chronickej apikálnej parodontitídy – periapikálnych granulómov
- Výsledky administrativní kontroly proočkovanosti v České republice k datu 31. 12. 2009
- Sérologie lymeské borreliózy a humánní granulocytární ehrlichiózy v letech 2005–2010
- Ambulantní péče o uživatele a závislé na návykových látkách v ČR ve zdravotnické statistice od roku 1963
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



