-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vybrané biomarkery asociované s aterosklerózou aj metabolizmom kostí
Selected biomarkers associated with atherosclerosis and bone metabolism
Atherosclerosis is characterized by persistent inflammation of the vascular wall and is considered to be a major cause contributing to the development of cardiovascular disease, which is the leading cause of death worldwide. Due to the prevalence of atherosclerosis and its complications, the need for early and, if possible, non-invasive diagnosis is increasing in order to prevent the development of fatal or disabling complications of atherosclerosis. Imaging methods as well as clinical examinations are used for the detection of atherosclerotic plaques, which capture up to hemodynamically significant plaques. Better prevention of atherosclerosis requires the search for high-risk individuals in early stages. Inflammation manifests itself throughout the course of atherogenesis, i.e. also in the stage of subclinical atherosclerosis, when it is possible to determine the concentration of inflammatory biomarkers in the blood. Biomarkers are of interest for the simplicity of determination in plasma or serum and the possibility of their use for diagnostic, prognostic and therapeutic purposes. Positive correlations with atherosclerosis and its complications have been demonstrated in biomarkers associated with bone metabolism such as fibroblast growth factor 23, osteocalcin, osteoglycin, osteopontin or osteoprotegerin.
Keywords:
fibroblast growth factor 23 – osteocalcin – osteoglycin – osteopontin – osteoprotegerin
Autoři: Demková Katarína; Tkáč Ivan
Působiště autorů: IV. interná klinika LF UPJŠ a UNLP, Košice
Vyšlo v časopise: Clinical Osteology 2020; 25(3): 115-119
Kategorie: Přehledové články
Souhrn
Ateroskleróza je charakterizovaná perzistujúcim zápalom cievnej steny a je považovaná za hlavnú príčinu napomáhajúcu rozvoju kardiovaskulárnych ochorení, ktoré sú celosvetovo vedúcou príčinou úmrtí. Z dôvodu rozšírenia aterosklerózy a jej komplikácií sa zvyšuje potreba včasnej a pokiaľ je to možné neinvazívnej diagnostiky, aby sa predišlo vzniku fatálnych alebo invalidizujúcich komplikácií aterosklerózy. Na detekciu aterosklerotických plátov sa využívajú zobrazovacie metódy aj klinické vyšetrenia, ktoré zachytávajú až pláty hemodynamicky významné. Lepšia prevencia aterosklerózy si žiada vyhľadávanie vysokorizikových jedincov vo včasných štádiách. Zápal sa prejavuje počas celého priebehu aterogenézy, teda aj v štádiu subklinickej aterosklerózy, kedy je možné stanoviť koncentráciu zápalových biomarkerov v krvi. Biomarkery sú predmetom záujmu pre jednoduchosť stanovenia v plazme či sére a možnosť ich využitia na diagnostické, prognostické aj terapeutické účely. Pozitívne korelácie s aterosklerózou a jej komplikáciami boli dokázané u biomarkerov asociovaných s metabolizmom kostí ako fibroblastový rastový faktor 23, osteokalcín, osteoglycín, osteopontín či osteoprotegerín.
Klíčová slova:
fibroblastový rastový faktor 23 – osteoglycín – osteokalcín – osteopontín – osteoprotegerín
Úvod
Vzťah medzi aterosklerózou a osteoporózou je predmetom záujmu mnohých štúdií. Tieto dva patologické procesy zdieľajú spoločné rizikové faktory, ako je vek, deplécia estrogénov, sedavý spôsob života, konzumácia alkoholu, fajčenie, diétne vplyvy ako príjem kalcia, konzumácia nasýtených mastných kyselín, deficit vitamínu C a K. V posledných rokoch sa výskum vo veľkej miere zameriaval na identifikáciu faktorov a mechanizmov zahrnutých v patofyziológii oboch procesov – vaskulárnej patológie aj remodelácie kostí. Existuje asociácia medzi markermi aterosklerózy a markermi metabolizmu kostí. Väčšina doposiaľ publikovaných prierezových štúdií uverejnila inverznú koreláciu medzi prítomnosťou, závažnosťou a progresiou kalcifikácie abdominálnej aorty a množstvom kostnej hmoty v lumbálnej a femorálnej oblasti u postmenopauzálnych žien aj u mužov. Karotická ateromatóza bola tiež asociovaná s úbytkom kostnej hmoty u postmenopauzálnych žien a bola asociovaná aj s vyšším rizikom fraktúr. Pacienti s kardiovaskulárnym ochorením mali zníženú kostnú hmotu bez ohľadu na vek či prítomnosť periférneho artériového obliterujúceho ochorenia dolných končatín (PAOO DK). Ischemická choroba srdca (ICHS) bola asociovaná so zvýšeným rizikom fraktúry panvovej kosti. Prítomnosť cerebrovaskulárneho ochorenia a PAOO DK bola asociovaná aj s úbytkom kostnej hmoty a fragilitou kostí. V aterosklerotických léziách je možné nájsť rôzne proteíny produkované kostnými bunkami ako fibroblastový rastový faktor 23 (FGF23), osteokalcín (OC), osteoglycín (OGN), osteopontín (OPN), osteoprotegerín (OPG) alebo RANKL ligand (Receptor Activator of Nuclear Factor kappa β ligand), tab. 1 [1].
Tab. 1. Porovnanie hladín biomarkerov u rôznych populácií pacientov 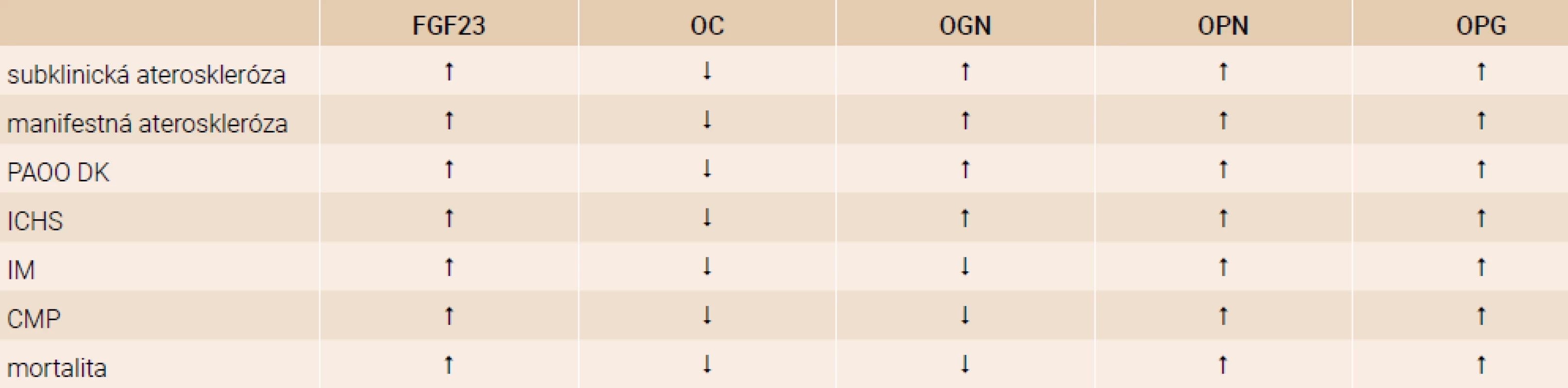
CMP – cievna mozgová príhoda FGF23 – fibroblastový rastový faktor 23 ICHS – ischemická choroba srdca IM – infarkt myokardu OC – osteokalcín OGN – osteoglycín OPG – osteoprotegerín OPN – osteopontín PAOO DK – periférne artériové obliterujúce ochorenie dolných končatín Prehľad biomarkerov
Fibroblastový rastový faktor 23 (Fibroblast Growth Factor 23 – FGF23) je proteín pozostávajúci z 251 aminokyselín produkovaný hlavne osteocytmi a osteoblastmi v kostiach [2]. Reguluje homeostázu fosforu a vitamínu D, stimuluje fosfatúriu a inhibuje aktiváciu vitamínu D v obličke [3]. Tento mechanizmus chráni pred rozvojom fosforom indukovanej aterosklerózy a obzvlášť vaskulárnej kalcifikácie, hoci samotná sérová hladina FGF23 môže slúžiť ako marker vaskulárnej kalcifikácie u pacientov s chronickou renálnou insuficienciou (CHRI) [4].
Hladina FGF23 stúpa s klesajúcou funkciou obličiek a vysoké hladiny FGF23 sú silno asociované s vyšším rizikom úmrtia. Zvýšená hladina FGF23 vedie k zhoršovaniu hypertrofie ľavej komory, akceleruje aterosklerózu a je asociovaná s vyššou incidenciou kardiovaskulárnych (KV) príhod [3]. V štúdii 704 pacientov s ICHS bola u diabetikov 2. typu, u ktorých došlo v priebehu sledovania ku KV-príhode, teda k infarktu myokardu (IM), cievnej mozgovej príhode (CMP), srdcovému zlyhávaniu alebo úmrtiu, hladina FGF23 signifikantne vyššia [5]. FGF23 iniciuje objavenie sa a rozvoj aterosklerózy prostredníctvom jeho vplyvov na vaskulárnu kalcifikáciu a endotelovú dysfunkciu. Sérová hladina FGF23 je asociovaná nielen so subklinickou aterosklerózou, u ktorej koreluje s intimo-mediálnou hrúbkou (IMT) na karotídach, ale aj s ICHS, a rastie s počtom stenotických ciev, čo naznačuje, že FGF23 zohráva úlohu nielen pri vzniku, ale aj pri progresii aterosklerózy [2]. V štúdii 976 diabetikov 2. typu sérová hladina FGF23 nezávisle a pozitívne korelovala s prítomnosťou a závažnosťou PAOO DK [6]. V inej štúdii 401 diabetikov 2. typu mali pacienti s PAOO DK signifikantne vyššie hladiny FGF23 [2]. V kohorte 3 860 pacientov s CHRI v štádiu 2 až 4 bola zvýšená hladina FGF23 nezávisle asociovaná s vyšším rizikom kongestívneho srdcového zlyhávania a aterosklerotických príhod (IM, CMP, PAOO DK) [3].
Osteokalcín (OC) je proteín syntetizovaný osteoblastmi považovaný za marker kostnej formácie. Je exprimovaný v zdravých cievach aj v cievach s prítomnosťou aterosklerotických plátov. Je známy vzťah medzi nízkou hladinou markerov kostnej remodelácie a závažnosťou aterosklerózy. Sérové hladiny OC preukázali negatívnu koreláciu s IMT na karotídach u aziatov s diabetom 2. typu. Pacienti s karotickou ateromatózou a kalcifikáciou aorty mali nižšie hladiny OC v porovnaní so zdravými kontrolami [1].
Osteoglycín (OGN), nazývaný aj mimekan, je jedným z malých proteoglykánov bohatých na leucín. Je vo veľkej miere exprimovaný v zdravých cievach, aterosklerotických plátoch, rohovke, koži, chrupavke a v malej miere aj v myokarde, kostrovom svalstve, mozočku, črevách a obličkách. Je biologicky aktívnym komponentom extracelulárnej matrix zahrnutým do mnohých biologických procesov vrátane zápalu, fibrózy a proliferácie buniek. Hlavná funkcia OGN v extracelulárnej matrix je regulácia kolagénovej fibrilogenézy. Úloha OGN v procese aterosklerózy stále ostáva kontroverzná. Pravdepodobne má úlohu v remodelácii artériovej matrix a aktivácii endotelu. V štúdii, ktorá zahŕňala 462 pacientov podstupujúcich elektívnu koronárnu angiografiu, bola plazmatická hladina OGN signifikantne vyššia u pacientov s ICHS v porovnaní s kontrolami [7]. Podobne aj v inej štúdii 158 pacientov podstupujúcich koronárnu angiografiu bola sérová hladina OGN vyššia u 78 pacientov s ICHS v porovnaní s 80 pacientmi bez ICHS [8]. OGN môže zohrávať úlohu v stabilizácii koronárneho aterosklerotického plátu. Vyššie sérové hladiny OGN u pacientov s ICHS môžu predstavovať adaptívny mechanizmus s cieľom prevencie progresie koronárnej aterosklerózy. Hladina OGN bola nižšia u pacientov po karotickej endarterektómii s hemoragickými, teda nestabilnými plátmi, v porovnaní s pacientami s fibrotickými plátmi. Tieto závery podporujú názor, že nízke hladiny OGN môžu viesť k nestabilite aterosklerotického plátu. Pacienti s komplexnými koronárnymi léziami, ktoré sú známe asociáciou s vulnerabilitou plátov a predikciou koronárnych príhod, mali nižšie plazmatické hladiny OGN, kým u pacientov s ICHS bez komplexných lézií boli hladiny OGN vyššie [7]. Hladina OGN má u pacientov s ICHS prognostickú hodnotu a bola signifikantne asociovaná s výskytom kardiovaskulárnych príhod v priebehu 1 roka po koronárnej angiografii [9].
Osteopontín (OPN) je sialoproteín odvodený od bovinnej kostnej matrix. Nazýva sa aj sekrečný fosfoproteín 1 (SPP1), kostný sialoproteín 1 (BSP1), skorý T-lymfocytový aktivátor 1 (Eta1). OPN je matricelulárny proteín, teda pôsobí ako modulátor interakcií medzi bunkou a matrix, zohráva úlohu aj v procese remodelácie a reparácie tkanív. Je produkovaný bunkami zahrnutými do procesu morfogenézy kostí a jeho hlavnou fyziologickou funkciou je kontrola biomineralizácie a kalcifikácie. Je tiež produkovaný endoteliálnymi bunkami ciev, hladkosvalovými bunkami cievnej steny a makrofágmi. U ľudí existuje 5 izoforiem OPN. Za fyziologických okolností je cirkulujúca a tkanivová expresia OPN v cievach nízka, napriek tomu je OPN potrebný pre normálnu funkciu artérií. OPN je tiež fyziologický inhibítor vaskulárnej kalcifikácie. Ako reakcia na poranenie alebo ischémiu sa hladina OPN zvyšuje, ale expresia sa po čase normalizuje. Je to zápalový cytokín, ktorý je neoddeliteľnou súčasťou prvotnej imunitnej odpovede na poranenie tkaniva a tiež remodelačných procesov pri hojení rán. Expresia OPN je dlhodobo zvýšená u pacientov s chronickými zápalovými ochoreniami ako Crohnova choroba, skleróza multiplex, a iné autoimunitné ochorenia, u diabetikov 1. aj 2. typu, u rôznych typov karcinómov a pri kardiovaskulárnych ochoreniach ako ICHS, PAOO DK, stúpa aj pri ischemickej CMP. Hladinu OPN možno stanoviť v plazme, v cerebrospinálnom likvore, moči aj materskom mlieku. OPN zohráva úlohu v progresii aterosklerotického plátu, vysoké koncentrácie OPN sú pozorované v ľudských aterosklerotických plátoch v oblasti aorty, karotických a koronárnych artérií, taktiež v tkanive odobratom z aneuryzmy abdominálnej aorty. Parciálny alebo totálny nedostatok OPN chráni pred aterosklerózou, čiastočne je to pre zníženú akumuláciu zápalových makrofágov a viabilitu aterosklerotických lézií. Stimulácia vysokými dávkami OPN spôsobila zvýšenú autofágiu, kým nižšie dávky OPN mali pozitívny vplyv na prežívanie. Zvýšené plazmatické hladiny OPN boli v klinických štúdiách asociované s prítomnosťou a závažnosťou ICHS. Koronárna revaskularizácia a sartany znižujú plazmatické hladiny OPN. Mnohé štúdie nezávisle od seba demonštrovali, že plazmatická hladina OPN môže predikovať kardiovaskulárne príhody a mortalitu. Vyššie hladiny OPN sú asociované s rapídnou progresiou koronárnych plátov aj s rýchlosťou vzniku in stent restenózy. Expresia OPN je vyššia v plazme hypertonikov aj u pacientov v terminálnom štádiu srdcového zlyhávania. Nízka hladina OPN pravdepodobne bráni poškodeniu tkanív, naopak vysoká hladina vedie k škodlivej vaskulárnej remodelácii [10].
Osteoprotegerín (OPG) je sekrečný glykoproteín patriaci do tumor necrosis factor (TNF) receptorovej superrodiny cytokínov [11]. Je známy aj pod názvom TNFRSF11B (TNF receptor superfamily member 11B), tropín reduktáza [12], osteoclastogenesis inhibitory factor [13]. Gén pre OPG je lokalizovaný na chromozóme 8q23–24, meria 29 kb a pozostáva z 5 exónov [14]. OPG je zložený z 401 aminokyselín s hmotnosťou 60 kDa a so 7 štrukturálnymi doménami. Existuje ako monomér, ktorý je síce biologicky aktívny, ale vytvára aj diméry spojené disulfidovou väzbou, ktoré sú ešte aktívnejšie a ich formácia je potrebná na zabezpečenie plnej biologickej aktivity [12]. OPG je syntetizovaný osteoblastmi [14], ale aj bunkami, ktoré sa zúčastňujú na tvorbe a rozvoji aterómových plátov, ako sú hladkosvalové bunky artériovej steny, endotelové bunky a megakaryocyty, a aj ďalšími tkanivami [12].
OPG zohráva dôležitú úlohu v regulácii kostnej resorpcie. Chráni receptor RANK (Receptor Activator of Nuclear Factor κB) pred interakciou s RANK ligandom (RANKL), tým, že sa na neho viaže. V neprítomnosti OPG sa RANKL cytokín viaže na RANK receptor, a to vedie ku kostnej resorpcii [13]. RANKL je stimulátor kostnej resorpcie tým, že indukuje diferenciáciu osteoklastov a aktivuje zrelé osteoklasty [12]. OPG je antagonista RANKL, chráni kostné tkanivo pred resorpciou [13]. RANK a RANKL sú proteíny a sú tiež členmi TNF-receptorovej superrodiny [12]. Predpokladá sa, že interakcia medzi RANK a RANKL vedie k destabilizácii aterosklerotických plátov, a teda OPG ako receptor pre RANKL tejto interakcii bráni a správa sa ako protizápalový mediátor [15]. OPG slúži aj ako receptor pre TNF-Related Apoptosis Inducing Ligand (TRAIL) [16]. TRAIL je tiež proteín a člen TNF superrodiny. OPG chráni endotelové bunky pred apoptózou a podporuje neovaskularizáciu [12].
Sérová hladina OPG koreluje so závažnosťou aterosklerózy, ovplyvňuje prítomnosť, závažnosť a progresiu KV-ochorení (KVO) [14], preto je OPG považovaný za včasný prediktor KVO [16]. Zvýšené koncentrácie OPG sú spojené so závažnosťou nestabilnej anginy pectoris, ale aj s asymptomatickou ICHS a IM, ďalej sú asociované s vulnerabilnými karotickými plátmi, symptomatickou karotickou stenózou aj so srdcovým zlyhaním [14]. Sérová hladina OPG koreluje s prítomnosťou a závažnosťou PAOO DK [17]. OPG zohráva dôležitú úlohu v kalcifikácii artériovej steny, vyššia hladina koreluje s vyššou prevalenciou vaskulárnej kalcifikácie, a to prispieva k rozvoju KVO. Kalcifikácia artériovej steny sa spája aj so zníženou kostnou denzitou a zvýšenou incidenciou fraktúr [14]. OPG je silno asociovaný s elevovaným kalciovým skóre, abnormálnou IMT, karotickým plátom aj aortálnou kalcifikáciou. Hladina OPG je u diabetikov 1. aj 2. typu zvýšená a je asociovaná s nedostatočnou glykemickou kontrolou. Hladina OPG je vyššia aj u hypertonikov. Liečba inzulínom, statínmi a glitazónmi znižuje koncentráciu OPG [12].
OPG môže zohrávať úlohu v rozvoji osteoporózy, zápalových ochorení kostí, mnohopočetného myelómu a malígnej kostnej resorpcie [16]. OPG má potenciálne využitie ako biomarker osteoporózy, artritídy, vaskulárnej kalcifikácie, nádorových ochorení kostí. OPG by mohol slúžiť ako biomarker kontroly diabetu, diabetických komplikácií, aterosklerózy, vaskulárnej kalcifikácie aj mortality. Hladina môže byť meraná v plazme (kde je vyššia) aj v sére (kde je nižšia) [12].
Stále nie je známe či elevácia sérovej hladiny OPG v prípade rôznych KVO predstavuje kompenzačný mechanizmus prevencie vaskulárneho poškodenia alebo je zodpovedná za poškodenie [1].
Vzťah medzi mikroRNA, aterosklerózou a osteoporózou
MikroRNA (miRNA, miR) predstavujú relatívne malú skupinu recentne identifikovaných endogénnych malých nekódujúcich molekúl RNA, ktoré pozitívne alebo negatívne regulujú expresiu mnohých génov a bunkové procesy. Regulujú posttranskripčne génovú expresiu väzbou na mRNA a spôsobujú jej degradáciu alebo inhibujú transláciu cielených transkriptov. MiRNA ovplyvňujú veľký počet procesov a zohrávajú rozhodujúcu úlohu nielen v bunkovej diferenciácii, proliferácii a apoptóze, ale tiež ovplyvňujú zloženie extracelulárnej matrix a udržiavajú procesy homeostázy akejkoľvek bunky, tkaniva a orgánu. Jeden gén môže byť regulovaný viacerými miRNA a podobne môže jedna miRNA regulovať viac cieľových génov. Vďaka odolnosti miRNA voči extracelulárnej enzymatickej degradácii v krvi a jej jednoduchej a reproducibilnej detekcii by sa dalo vytvoriť špecifické portfólio miRNA za účelom stanovenia profilov cirkulujúcej miRNA ako biomarkera pri rôznych typoch ochorení a ich liečby prostredníctvom využitia metódy miRNA špecifickej real-time polymerázovej reťazovej reakcie (RT PCR). Sú už dostupné viaceré testy využívajúce miRNA ako biomarkery v klinickej diagnostike [18]. Doposiaľ bola potvrdená asociácia miRNA a mnohých KVO vrátane ICHS, IM, srdcového zlyhania, CMP aj PAOO DK (tab. 2) [19]. Pri osteoporóze môžu miRNA ovplyvňovať tak vývoj osteoblastov (tvorbu kosti), ako aj vývoj osteoklastov (resorpciu kosti), tab. 3 [20].
Tab. 2. Cirkulujúce miRNA ako diagnostické biomarkery kardiovaskulárnych ochorení. Upravené podľa [19] ![Cirkulujúce miRNA ako diagnostické biomarkery kardiovaskulárnych ochorení. Upravené podľa [19]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e14fb1c543d7cac061d5544f383222a9.png)
ICHS – ischemická choroba srdca IM – infarkt myokardu miR – mikroRNA NAP – nestabilná angina pectoris Tab. 3. MiRNA zahrnuté do procesu regulácie metabolizmu kostí. Upravené podľa [20] ![MiRNA zahrnuté do procesu regulácie metabolizmu kostí. Upravené podľa [20]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0cd7a0ad5da0d14c29cdd811818bfaac.png)
miR – mikroRNA Záver
Ateroskleróza a jej rizikové faktory sú jedným z najvýznamnejších zdravotných problémov západnej civilizácie. Predstavuje oblasť výskumu s vysokou prioritou, s cieľom redukcie mortality a morbidity v spojení s týmto problémom [21]. Hoci majú ateroskleróza a jej komplikácie vysokú prevalenciu, genetický podklad, proteomické rizikové faktory aj faktory, ktoré ovplyvňujú odpoveď na liečbu, sú doposiaľ málo známe [22]. Je pravdepodobné, že pri vzniku a progresii aterosklerózy je veľmi významný vplyv environmentálnych faktorov (najmä diabetes mellitus, fajčenia) [21]. Je potrebné zamerať sa na výskum ďalších proteomických biomarkerov, ktorých mechanizmus účinku zatiaľ nie je známy a je nezávislý od tradičných rizikových faktorov aterosklerózy. Perspektívnym biomarkerom sa javí byť aj miRNA. Využiteľnosť doposiaľ získaných výsledkov štúdií s biomarkermi v aplikovanom výskume alebo v praxi je zatiaľ obmedzená. Identifikácia biomarkerov podmieňujúcich aterosklerózu by mohla prispieť k vyhľadávaniu podskupiny pacientov, ktorí sú nositeľmi zvýšeného rizika aterosklerózy a jej komplikácií [22] a mohla by tiež podporiť vývoj nových diagnostických a terapeutických prístupov v manažmente aterosklerózy, teda priniesť personalizovanú medicínu.
MUDr. Katarína Demková, PhD. | katarina.demkova@upjs.sk | https://www.upjs.sk
Received | Doručené do redakcie | Doručeno do redakce 21. 7. 2020
Accepted | Prijaté po recenzii | Přijato po recenzi 23. 8. 2020
Zdroje
-
Reyes-García R, Rozas-Moreno P, Muñoz-Torres M. Cardiovascular disease and bone metabolism. Endocrinol Nutr 2011; 58(7): 353–359. Dostupné z DOI: <http://dx.doi.org/10.1016/j.endonu.2011.05.004>.
-
He X, Hu X, Ma X et al. Elevated serum fibroblast growth factor 23 levels as an indicator of lower extremity atherosclerotic disease in Chinese patients with type 2 diabetes mellitus. Cardiovasc Diabetol 2017; 161): 77. Dostupné z DOI: <http://dx.doi.org/10.1186/s12933–017–0559-x>.
-
Scialla JJ, Xie H, Rahman M et al. Fibroblast Growth Factor-23 and Cardiovascular Events in CKD. J Am Soc Nephrol 2014; 25(2): 349–360. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2013050465>.
-
Yoda K, Imanishi Y, Yoda M et al. Impaired Response of FGF-23 to Oral Phosphate in Patients with Type 2 Diabetes: A Possible Mechanism of Atherosclerosis. J Clin Endocrinol Metab 2012; 97(11): 2036–2043. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–2024>.
-
Tuñón J, Fernández-Fernández B, Carda R et al. Circulating fibroblast growth factor-23 plasma levels predict adverse cardiovascular outcomes in patients with diabetes mellitus with coronary artery disease. Diabetes Metab Res Rev 2016; 32(7): 685–693. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.2787>.
-
Biscetti F, Straface G, Pitocco D et al. Fibroblast growth factor 23 serum level in type 2 diabetic italian subjects with peripheral arterial disease and critical limb ischemia. Eur Rev Med Pharmacol Sci 2016; 20(19): 4048–4054.
-
Seki T, Saita E, Kishimoto Y et al. Low Levels of Plasma Osteoglycin in Patients with Complex Coronary Lesions. J Atheroscler Thromb 2019; 25(11): 1149–1155. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.43059>.
-
Hu Y, Liu J, Zhao Q et al. Correlation between mimecan expression and coronary artery stenosis in patients with coronary heart disease. Int J Clin Exp Med 2015; 8(11): 21641–21646.
-
Cheng JM, Akkerhuis KM, Meilhac O et al. Circulating Osteoglycin and NGAL/MMP9 Complex Concentrations Predict 1-Year Major Adverse Cardiovascular Events After Coronary Angiography. Arterioscler Thromb Vasc Biol 2014; 34(5): 1078–1084. Dostupné z DOI: <http://dx.doi.org/10.1161/ATVBAHA.114.303486>.
-
Lok ZS, Lyle AN. Osteopontin in Vascular Disease: Friend or Foe?. Arterioscler Thromb Vasc Biol 2019; 39(4): 613–622. Dostupné z DOI: <http://dx.doi.org/10.1161/ATVBAHA.118.311577>.
-
Biscetti F, Porreca CF, Bertucci F et al. TNFRSF11B gene polymorphisms increased risk of peripheral arterial occlusive disease and critical limb ischemia in patients with type 2 diabetes. Acta Diabetol 2014; 51(6): 1025–1032. Dostupné z DOI: <http://dx.doi.org/10.1007/s00592–014–0664–1>.
-
Pérez de Ciriza C, Lawrie A, Varo N. Osteoprotegerin in Cardiometabolic Disorders. Int J Endocrinol 2015; 2015 : 564934. Dostupné z DOI: <http://dx.doi.org/10.1155/2015/564934>.
-
Nehring P, Mrozikiewicz-Rakowska B, Sobczyk-Kopcioł A et al. Osteoprotegerin gene rs2073617 and rs3134069 polymorphisms in type 2 diabetes patients and sex – specific rs2073618 polymorphism as a risk factor for diabetic foot. Pol Arch Med Wewn 2013; 123(4): 176–182. Dostupné z DOI: <http://dx.doi.org/10.20452/pamw.1684>.
-
Song DH, Zhou PZ, Xiu XL et al. Relationships of OPG Genetic Polymorphisms with Susceptibility to Cardiovascular Disease: A Meta – Analysis. Med Sci Monit 2016; 22 : 1223–1231. Dostupné z DOI: <http://dx.doi.org/10.12659/msm.895434>.
-
Özkalayci F, Gülmez O, Uğur-Altun B et al. The Role of Osteoprotegerin as a Cardioprotective Versus Reactive Inflammatory Marker: the Chicken or the Egg Paradox. Balkan Med J 2018; 35(3): 225–232. Dostupné z DOI: <http://dx.doi.org/10.4274/balkanmedj.2018.0579>.
-
Guo C, Hu F, Zhang S et al. Association between osteoprotegerin gene polymorphisms and cardiovascular disease in type 2 diabetic patients. Genet Mol Biol 2013; 36(2): 177–182. Dostupné z DOI: <http://dx.doi.org/10.1590/S1415–47572013005000024>.
-
Demková K, Kozárová M, Malachovská Z et al. Osteoprotegerin concentration is associated with the presence and severity of peripheral arterial disease in type 2 diabetes mellitus. VASA 2018; 47(2): 131–135. Dostupné z DOI: <http://dx.doi.org/10.1024/0301–1526/a000682>.
-
Kužma M et al. Prediktívna hodnota mikroRNA v diagnostike a prognóze srdcového zlyhania a osteoporózy. Osteologický bulletin 2017; 22(4): 142–145.
-
Min PK, Chan SY. The Biology of Circulating MicroRNAs in Cardiovascular Disease. Eur J Clin Invest 2015; 45(8): 860–874.
-
Fröhlich LF. MicroRNAs at the Interface between Osteogenesis and Angiogenesis as Targets for Bone Regeneration. Cells 2019; 8(2): 121.
-
Kullo IJ, Leeper NJ. The Genetic Basis of Peripheral Arterial Disease: Current Knowledge, Challenges and Future Directions. Circ Res 2015; 116(9): 1551–1560.
-
Koriyama H et al. Identification of Evidence Suggestive of an Association with Peripheral Arterial Disease at the OSBPL10 Locus by Genome – Wide Investigation in the Japanese Population. J Atheroscler Thromb 2010; 17(10): 1054–1062.
Štítky
Biochemie Dětská gynekologie Dětská radiologie Dětská revmatologie Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Praktické lékařství pro dospělé Radiodiagnostika Rehabilitační a fyzikální medicína Revmatologie Traumatologie Osteologie
Článek Editorial
Článek vyšel v časopiseClinical Osteology
Nejčtenější tento týden
2020 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Editorial
- Ako liečiť diabetika s osteoporózou
- Vybrané biomarkery asociované s aterosklerózou aj metabolizmom kostí
- Ukrajinská verzia FRAX pre posúdenie rizika zlomenín u žien s reumatoidnou artritídou
- Neurogénna heterotopická osifikácia
- Klinická osteológia – certifikovaná pracovná činnosť
-
23. kongres slovenských a českých osteológov s medzinárodnou účasťou
17.–19. 9. 2020 | Double Tree by Hilton | Bratislava
- Clinical Osteology
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neurogénna heterotopická osifikácia
-
23. kongres slovenských a českých osteológov s medzinárodnou účasťou
17.–19. 9. 2020 | Double Tree by Hilton | Bratislava - Klinická osteológia – certifikovaná pracovná činnosť
- Vybrané biomarkery asociované s aterosklerózou aj metabolizmom kostí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



