-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hepatocelulární karcinom u kojence s tyrosinemií typ 1
Hepatocellular carcinoma in an infant with tyrosinemia type 1
Tyrosinemia type 1 is a rare metabolic disease with autosomal recessive inheritance caused by biallelic mutations in the FAH gene, leading to impaired activity of fumarylacetoacetate hydrolase, a key enzyme in tyrosine metabolism. In children with TYR 1, an activation of alternative metabolic pathway leads to an overproduction of toxic metabolites, mainly succinylacetone and fumarylacetoacetate, which damage hepatocytes and renal tubular cells. Clinically, TYR 1 presents with acute progression to liver and renal failure at an early age or chronically with the development of liver fibrosis, cirrhosis, rickets and hepatocellular carcinoma, manifestations of porhyria crisis are also common. Biochemical diagnosis is based on evidence of increased levels of succinylacetone in the blood and urine, accompanied by an elevation of tyrosine and rising level of alpha-fetoprotein. The diagnosis must be confirmed at the molecular level. The treatment is based on an administration of nitisinone, which blocks the production of toxic metabolites in combination with a low-protein diet supplemented with a mixture of essential amino acids without tyrosine and phenylalanine. If conservative therapy does not prevent the progression of liver failure or the development of hepatocellular carcinoma, liver transplantation is indicated. We present the clinical course of the disease in a 10-month-old boy with TYR1, manifesting with hepatopathy, melena, and hepatocellular carcinoma. In addition to nitisinone and diet, chemoembolization of the supplying hepatic artery in the area of the fastest-growing carcinoma was necessary, which enabled us to gain time to prepare liver transplantation. After a successful transplant, the boy is in a good clinical condition.
Keywords:
liver transplantation – succinylacetone – hepatocellular carcinoma – tyrosinemia type 1 – nitisinone – transarterial chemoembolization (TACE )
Autoři: Kelifová Silvie 1; Honzík Tomáš 1; Tesařová Markéta 1; Gonsorčíková Lucie 2; Sticová Eva 3; Mašková Jana 4; Mališ Josef 5; Froněk Jiří 6; Zeman Jiří 1
Působiště autorů: Klinika pediatrie a dědičných poruch metabolismu 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze 1; Pediatrická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní Thomayerovy nemocnice 2; Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny 3; Pracoviště radiodiagnostiky a intervenční radiologie, Institut klinické a experimentální medicíny 4; Klinika dětské hematologie a onkologie 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol 5; Klinika transplantační chirurgie, Institut klinické a experimentální medicíny 6
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (3): 161-165.
Kategorie: Kazuistika
doi: https://doi.org/10.55095/CSPediatrie2023/021Souhrn
Tyrosinemie typ 1 (TYR 1) je vzácné autosomálně recesivní onemocnění z okruhu dědičných poruch metabolismu aminokyselin. Podkladem jsou bialelické mutace v genu FAH, vedoucí k poruše aktivity fumarylacetoacetáthydrolázy, klíčového enzymu v metabolismu tyrosinu. U dětí s TYR 1 dochází alternativní metabolickou cestou k nadprodukci toxických metabolitů, především sukcinylacetonu a fumarylacetoacetátu, které poškozují hepatocyty a tubulární buňky ledvin. Klinicky se TYR 1 projevuje akutní formou jaterního a renálního selhávání v kojeneckém věku nebo chronicky rozvojem jaterní fibrózy, cirhózy, křivice a hepatocelulárního karcinomu v kojeneckém nebo batolecím věku, časté jsou i porfyrické krize. Biochemická diagnostika je založena na průkazu zvýšených hladin sukcinylacetonu v krvi i moči, eventuálně doprovázených elevací tyrosinu a stoupající hladinou alfa-fetoproteinu. Diagnostiku je třeba potvrdit na molekulární úrovni. V léčbě se používá nitisinon, který blokuje produkci toxických metabolitů, v kombinaci s nízkobílkovinnou dietou suplementovanou směsí esenciálních aminokyselin bez tyrosinu a fenylalaninu. Pokud konzervativní terapie nezabrání progresi jaterního selhávání nebo rozvoji hepatocelulárního karcinomu, je indikována transplantace jater. V našem sdělení předkládáme klinický průběh onemocnění u 10měsíčního chlapce, u kterého se onemocnění projevilo hepatopatií, melénou a hepatocelulárním karcinomem. Kromě nitisinonu a diety byla nutná chemoembolizace přívodné jaterní arterie v oblasti nejrychleji rostoucího karcinomu, která umožnila získat čas na přípravu k transplantaci jater. Po úspěšné transplantaci byla metabolická léčba ukončena, chlapec prospívá a je v dobrém klinickém stavu.
Klíčová slova:
hepatocelulární karcinom – transplantace jater – sukcinylacetón – tyrosinemie typ 1 – nitisinon – transarteriální chemoembolizace (TACE )
Úvod
Tyrosinemie typ 1 (TYR 1) je závažná porucha fumarylacetoacetáthydrolázy (FAH), která vede nejen k hromadění tyrosinu, ale alternativní cestou i k nadprodukci vysoce toxických metabolitů sukcinylacetonu (SA) a fumarylacetoacetátu (FAA), které poškozují jaterní buňky a tubulární buňky ledvin. Klíčovým patofyziologickým mechanismem je oxidační stres a poškození DNA vysokou hladinou FAA, SA a tyrosinu. Vysoká koncentrace tyrosinu, prekurzoru dopaminu, má i dopad na rovnováhu mezi neurotransmitery.(1)
Klinicky a laboratorně se TYR 1 nejčastěji projevuje v časném kojeneckém věku neprospíváním, hepatomegalií a hepatopatií se zvýšenými aminotransferázami, koagulopatií a rychle progredujícím jaterním selháváním s hypoproteinemií a rozvojem hepatocelulárního karcinomu s extrémně vysokou hladinou alfa-fetoproteinu (AFP). Sukcinylaceton inhibuje i syntézu δ-aminolevulátdehydratázy s příznaky, které připomínají akutní porfyrickou krizi se zvýšenou hladinou kyseliny δ-aminolevulové. U zhruba třetiny dětí se onemocnění projevuje ke konci kojeneckého věku nebo až v batolecím věku neprospíváním, poruchou růstu, hepatomegalií a splenomegalií s pomalu progredujícím rozvojem jaterní fibrózy a cirhózy a rozvojem hepatocelulárního karcinomu a/nebo poruchou tubulárních funkcí ledvin s hypofosfatemickou křivicí, proteinurií, renální tubulární acidózou a hyperaminoacidurií; vzácněji může docházet k rozvoji porfyrických krizí s bolestmi břicha a periferní neuropatií se změnami tonu autonomního nervstva. Většina postižených dětí bez terapie umírá v předškolním věku.(1,2)
V našem sdělení předkládáme klinický průběh onemocnění u chlapce s tyrosinemií typ 1 a rozvojem hepatocelulárního karcinomu (HCC) v kojeneckém věku, diagnostický postup a úspěšnou terapii pomocí jaterní transplantace.
POPIS PŘÍPADU
Chlapec se narodil z II. fyziologického těhotenství s porodní hmotností 3320 g a délkou 48 cm. Oba rodiče i sourozenec jsou zdrávi. Poporodní adaptace byla bez komplikací (Apgar 9-10-10). Do půl roku byl plně kojen, hmotnost a výška byly na 25. percentilu a vývoj odpovídal věku, ale po zavedení příkrmů se váhová křivka oploštila (hmotnost 6. percentil). Ve věku 10 měsíců byl hospitalizován pro hepatomegalii (palpačně +3 cm) a krátkodobou melénu. Laboratorně byla přítomna elevace aminotransferáz (AST 6 μkat/l, N < 0,6 μkat/l; ALT 1,5 μkat/l, N < 0,63 μkat/l; GGT 4,5 μkat/l, N < 0,39 μkat/l; ALP 14 μkat/l, N < 5,58 μkat/l), koagulopatie (APTT 42,4 s, N < 41 s; APTT-R 1,58, N < 1,3; INR 1,53, N < 1,2; antitrombin III 27 %, N 80–140 %) a vysoká hladina AFP (27 506 μg/l, N < 10 μg/l). V rámci diferenciální diagnostiky byly laboratorně vyloučeny virové i autoimunitní hepatitidy a deficit α1-antitrypsinu. Laboratorní vyšetření funkce ledvin bylo v normě.
Sonografické vyšetření ukázalo mnohočetný ložiskový proces v játrech do 4 mm a jedno velké ohraničené kulovité ložisko v levém jaterním laloku 24 × 25 × 30 mm. Magnetická rezonance (MR) břicha potvrdila difuzní postižení jater s přítomností regeneračních uzlů a ložisko v levém laloku, což společně s významnou elevací AFP budilo podezření na nádorový proces (obr. 1). Metabolická vyšetření ukázala zvýšenou hladinu tyrosinu v krvi (259 μmol/l, N < 180 μmol/l) a zvýšenou hladinu sukcinylacetonu v moči (7,5 mmol/ mol Kr, N < 2 mmol/mol Kr) a krvi (3 μmol/l; N < 0,1 μmol/l). V moči bylo zvýšené vylučování 4-OH-fenyllaktátu (602 mg/g Kr, N < 15 mg/g Kr) i OH-fenylpyruvátu (526 mg/g Kr, N < 15 mg/g Kr) a zvýšené vylučování δ-aminolevulové kyseliny (21 mmol/mol Kr, N < 3 mmol/mol Kr). Diagnóza tyrosinemie typ 1 byla potvrzena na molekulární úrovni, chlapec je složený heterozygot variant c.674T>G (p.Ile225Ser) a c.1063-2A>G v genu FAH.
Obr. 1. Magnetická rezonance břicha desetiměsíčního chlapce s tyrosinemií typ 1. V T2 váženém obraze patrné mírně hypersignální kulovité, ostře ohraničené ložisko v levém laloku jater. 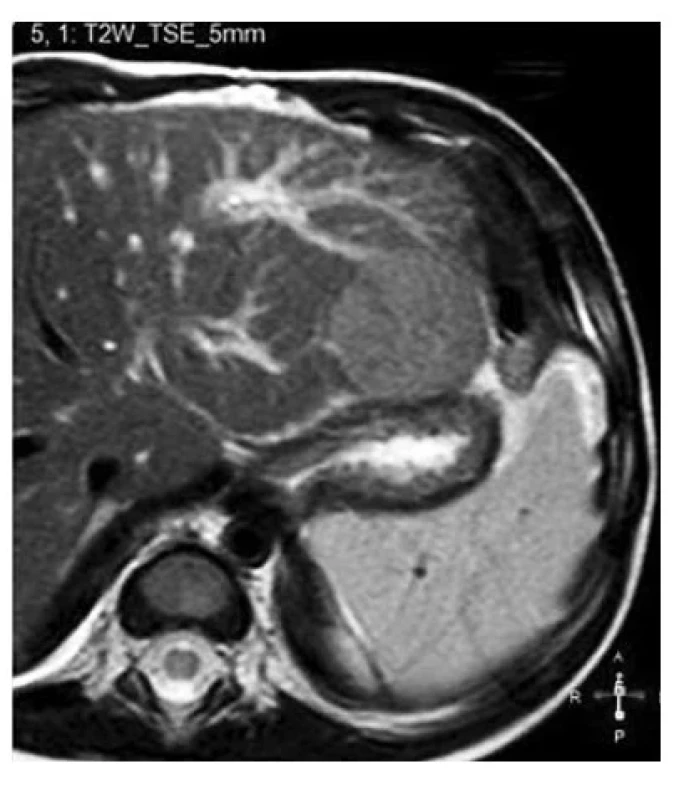
Při terapii nitisinonem (NTBC, 2-(2-nitro-4-trifluoromethylbenzoyl) - 1,3-cyklohexandion), který blokuje produkci SA, v iniciální dávce 1,8 mg/kg/den ve dvou denních dávkách a dietě s omezením přirozených bílkovin (< 0,45 g/kg/ den) suplementované směsí esenciálních aminokyselin bez tyrosinu a fenylalaninu významně klesla hladina AFP, SA i tyrosinu (tab. 1). Koagulopatie byla korigována Kanavitem. Pro významně pokročilé postižení jater s maligní infiltrací byla zahájena příprava na elektivní transplantaci jater. Na základě multioborového konzilia bylo rozhodnuto o nezahajování systémové chemoterapie z důvodu nebezpečí dekompenzace klinického stavu, a tudíž riziku nemožnosti realizace samotné transplantace.
Tab. 1. Laboratorní vyšetření u chlapce s tyrosinemií typ 1 při léčbě nitisinonem a po transplantaci jater 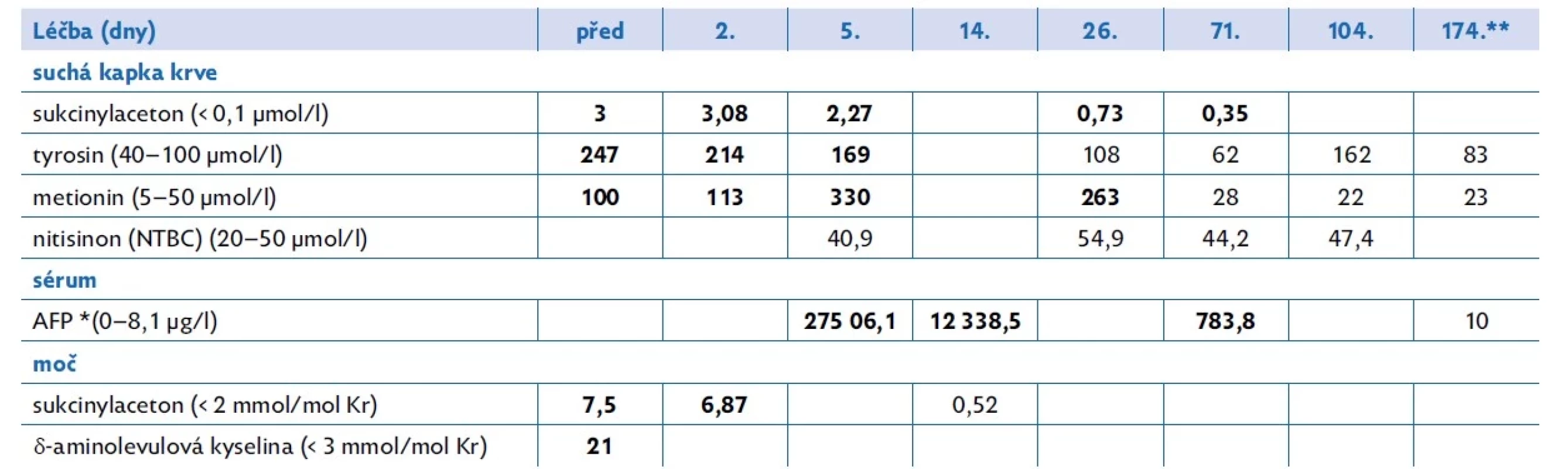
*AFP – α-fetoprotein, ** 70. den po transplantaci (dieta i NTBC byly po transplantaci vysazeny) Ve věku 10 měsíců byl pacient referován do Transplantačního centra IKEM ke zvážení transplantace jater. Případ byl diskutován na jaterním MDT, resekce jater byla vzhledem k základní diagnóze vyloučena, pacient byl po doplnění vyšetření zařazen na čekací listinu transplantace jater od zemřelého dárce. Vzhledem k velikosti nádoru, riziku jeho progrese v rámci čekání na transplantaci a možnosti makrovaskulární invaze (která by byla kontraindikací transplantace) byla provedena transarteriální chemoembolizace (TA CE). Při tomto zákroku došlo k aplikaci doxorubicinu navázaného na embolizační částice do levostranné arteria hepatica. Po výkonu došlo k signifikantnímu poklesu hladiny AFP z desetitisícových hodnot na 226 μg/l.
Jako potenciální žijící dárce jater se přihlásila pacientova matka, ta byla po provedení vyšetření kontraindikována. Druhým možným dárcem byla pacientova teta (sestra matky), která byla po provedení protokolárních vyšetření shledána vhodnou, byť s velmi obtížnou anatomií pro odběr i transplantaci.
Ve věku 14 měsíců, tedy 124 dní od stanovení diagnózy, byla provedena plánovaně transplantace jater (levý lalok, stejnoskupinový štěp) od žijícího příbuzného dárce, tety. U dárkyně byla provedena levostranná hemihepatektomie, vzhledem ke komplexní anatomii včetně segmentu IV, který nemohl být z anatomických důvodů ponechán u dárkyně. Vzhledem k velikosti štěpu byl na „back-table“ resekován segment IVb (obr. 2), žilní výtok levou jaterní žilou rekonstruován kadaverózním límcem. Ortotopická transplantace (obr. 3) byla provedena tzv. modifikovaným levým laterálním sektorem, žlučovod se podařilo anastomozovat na žlučovod příjemce (což je u dětí výjimečné). Manipulační čas byl 25 minut a studená ischemie 3 hodiny 24 minut. Tak jako obvykle u dětí bylo ponecháno „open abdomen“, bylo uzavřeno následující den po transplantaci. Jedenkrát byl pacient revidován pro hematomy v okolí štěpu, a to čtvrtý pooperační den. Po transplantaci došlo k okamžitému nástupu funkce štěpu jater, v pooperačním období byla nutná přechodná podpora levetiracetamem pro výrazný třes a drobné záškuby končetin s dobrou spontánní úpravou. Další průběh byl bez komplikací. Dárkyně se zhojila per primam, nyní je zpět v práci (pracuje jako zdravotní sestra na JIP).
Obr. 2. Štěp jater od žijícího dárce po úpravě na „back-table“, menší část je ze štěpu resekovaný segment IVb 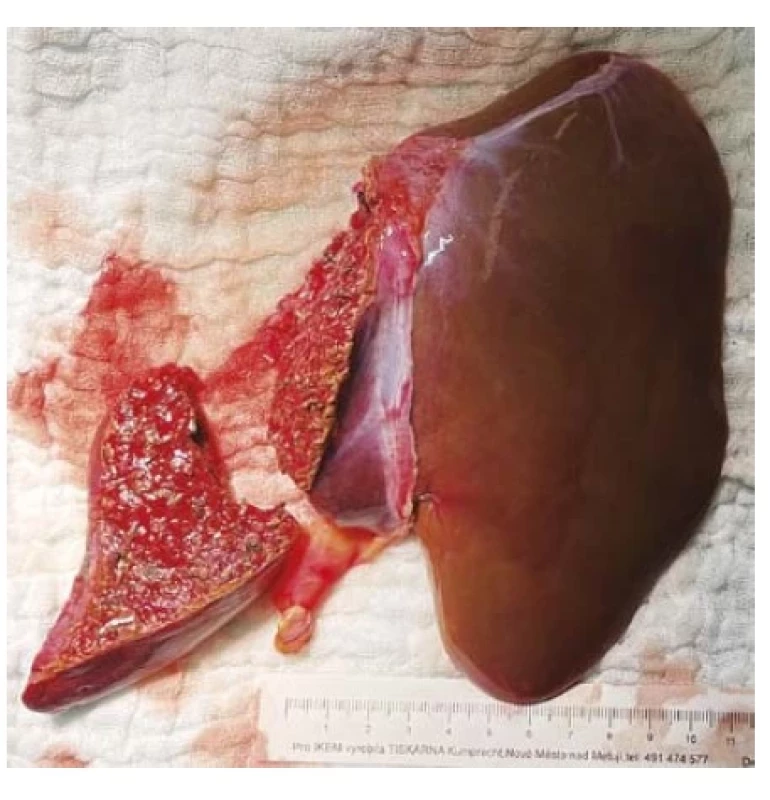
Obr. 3. Anhepatická fáze během transplantace jater (dutina břišní bez jater), svorky na jaterní tepně, portě, jaterních žilách 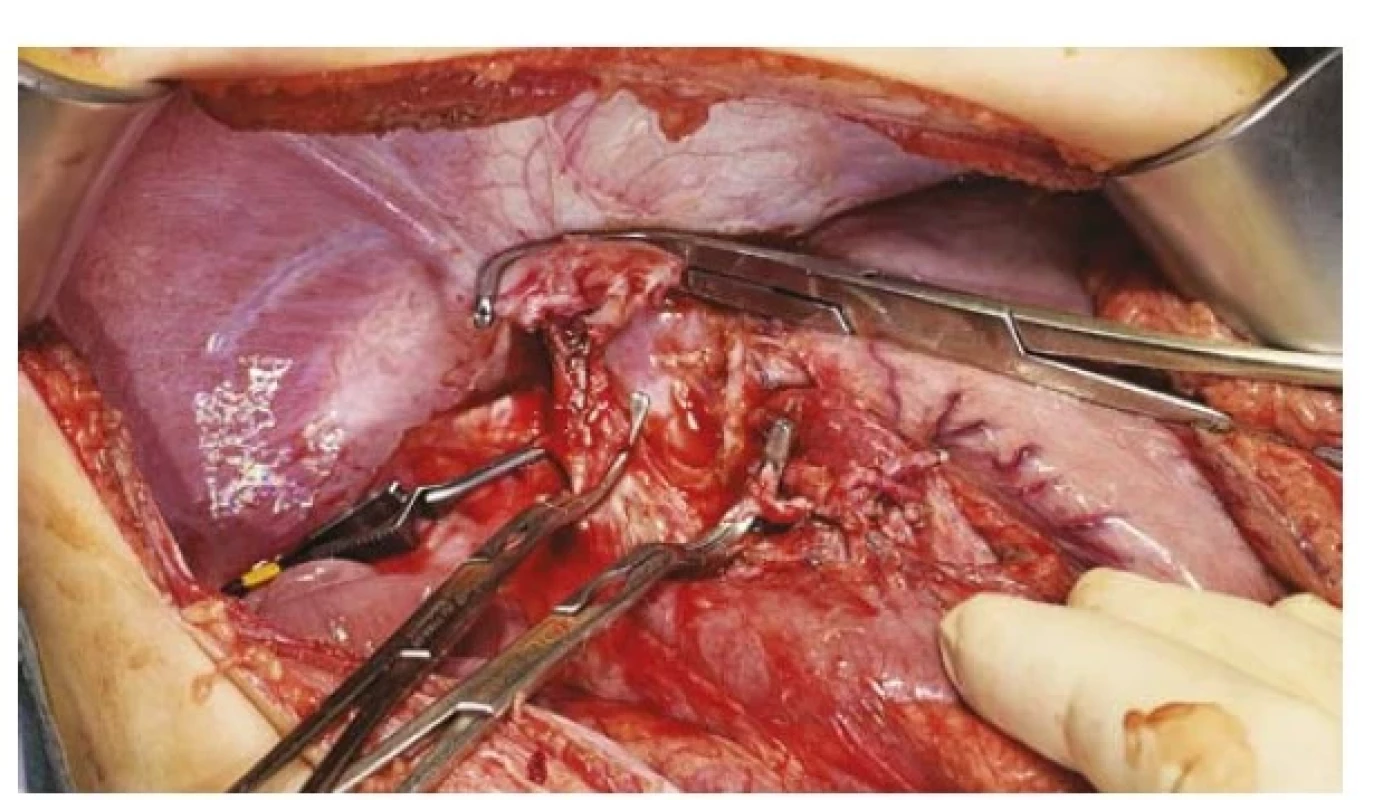
Explantovaná játra byla makroskopicky nerovného povrchu, nažloutlé barvy, tužší konzistence. Na řezu byl jaterní parenchym světle žluté barvy, v levém laloku s neostře ohraničeným ložiskem nažloutlé barvy velikosti 19 × 15 × 14 mm, bez známek makroangioinvaze či prorůstání přes vazivovou kapsulu jater (obr. 4A). Mikroskopicky byl popsán dobře diferencovaný hepatocelulární karcinom, bez známek angioinvaze, bez známek metastatického postižení lymfatických uzlin (obr. 4B). Okolní parenchym jater byl s obrazem vyvinuté cirhotické přestavby s nerovnoměrně distribuovanými metabolickými změnami a fokální obrovskobuněčnou transformací hepatocytů s high-grade dysplastickými ložisky a uzly do 5 mm (obr. 5A, B). Po transplantaci byla ukončena nejen terapie nitisinonem, ale i nízkobílkovinná dieta. Chlapec dostává imunosupresivní terapii podle protokolu, tj. prvních šest měsíců od transplantace v kombinaci prednison a takrolimus, dále je v plánu monoterapie takrolimem. Chlapci je v současné době 18 měsíců, má hmotnost 10 kg, délka je 79 cm, a jeho psychomotorický vývoj odpovídá věku. Hladina AFP je trvale ve fyziologickém rozmezí.
Obr. 4. A – Solitární ložisko hepatocelulárního karcinomu (šipka) v levém laloku jater u čtrnáctiměsíčního chlapce s tyrosinemií typ 1.
B – Mikroskopický obraz dobře diferencovaného hepatocelulárního karcinomu. Hematoxylin-eozin, pův. zvětšení 400×.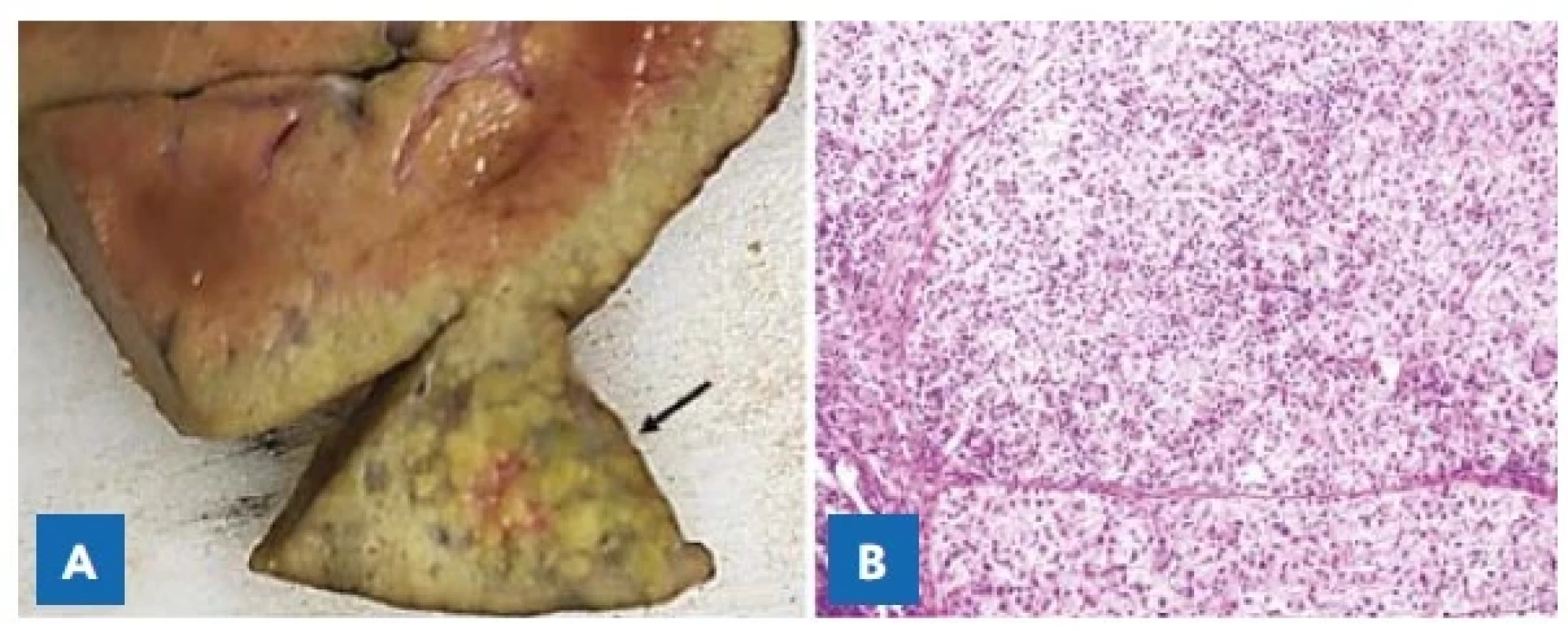
Obr. 5. Jaterní parenchym – mikroskopický obraz. Cirhotická přestavba jaterní tkáně s noduly hepatocytů ohraničenými vazivovými septy. A – Hematoxylin-eozin, pův. zvětšení 100×. B – Van Gieson elastika, pův. zvětšení 100×. 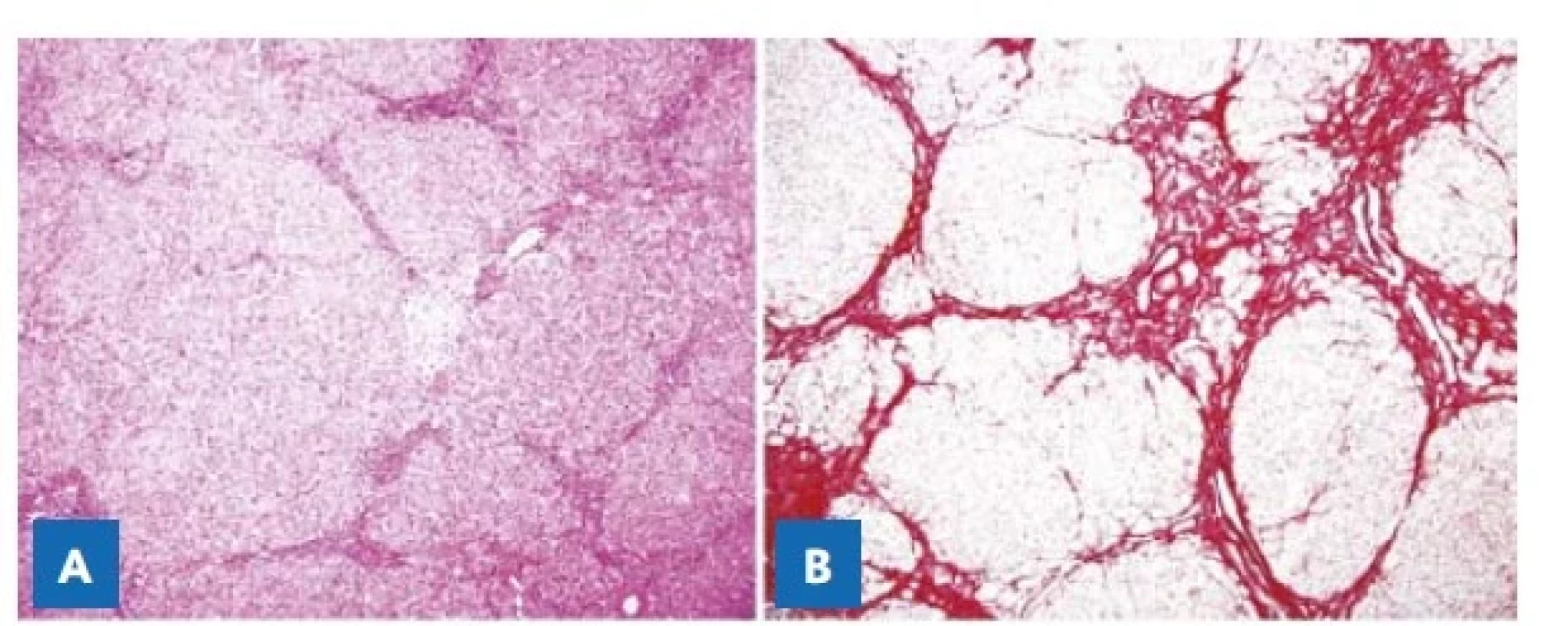
DISKUSE
V rámci diferenciálnědiagnostické rozvahy u dětí s hepatomegalií a/nebo hepatopatií je třeba pomýšlet i na dědičné poruchy metabolismu (DPM). Mezi DPM s jaterní symptomatologií patří kromě tyrosinemie typ 1 i klasická galaktosemie, manifestující se konjugovanou hyperbilirubinemií, fulminantním jaterním selháním a příznaky sepse v novorozeneckém věku, hereditární fruktózová intolerance s chronickým neprospíváním a averzí dítěte k ovoci, jaterní formy glykogenóz s progredující hepatomegalií a atakami hypoglykemií po 2,5–3,5hodinovém lačnění či poruchy cyklu močoviny s hyperamonemií a rozvojem akutního jaterního selhávání. Hepatomegalie či hepatopatie se vyskytují i u dětí s celou řadou lysosomálních střádavých onemocnění, u dětí s poruchou metabolismu tuků či dědičnými poruchami glykosylace. Prognóza postižených dětí obvykle závisí na včasně diagnostice, jak dokumentuje i naše kazuistika.
Tyrosinemie typ 1 (TYR 1) neboli hepatorenální tyrosinemie patří do skupiny DPM z okruhu poruch metabolismu aminokyselin. Incidence ve světě je přibližně 1 : 100 000.(2,3) V některých zemích je onemocnění součástí novorozeneckého screeningu. Hladina AFP je elevována prakticky u všech dětí v době stanovení diagnózy, po zahájení terapie dochází k jejímu poklesu. Základem terapie je podávání nitisinonu v dávce 1 mg/kg/den, případně iniciálně až 2 mg/ kg/den u jaterního selhávání. Nitisinon, původně používaný jako pesticid, blokuje metabolickou dráhu a přeměnu tyrosinu nad působením fumarylacetoacetáthydrolázy odpovědné za tyrosinemii typ 1, čímž zabraňuje endogenní syntéze sukcinylacetonu a fumarylacetoacetátu.(4) Zavedení nitisinonu do klinické praxe představovalo významný milník v prognóze onemocnění, protože terapie zabraňuje jak progresi postižení jater, tak rozvoji HCC, jenž je obávanou komplikací u pacientů s TYR 1. Před zavedením terapie se incidence HCC u dětí pohybovala mezi 17–37 %;(2,5,6) u pacientů diagnostikovaných na základě novorozeneckého screeningu a se zahájenou terapií nitisinonem do měsíce věku nebyl zaznamenán rozvoj HCC v rámci 20letého sledování.(7) Avšak pro vysokou hladinu tyrosinu musí všechny děti s TYR 1 dodržovat i přísnou nízkobílkovinnou dietu suplementovanou esenciálními aminokyselinami bez tyrosinu a fenylalaninu ve formě speciálních potravin pro zvláštní lékařské účely.
V rámci dispenzarizace pacientů s TYR 1 je nutné pravidelné klinické sledování a biochemické monitorování hladin tyrosinu, fenylalaninu a sukcinylacetonu v suché krevní kapce a AFP v krvi. Součástí sledování jsou i pravidelné sonografické a denzitometrické kontroly, eventuálně i MR jater.(2,8) Při rozvoji maligní přestavby jaterní tkáně je indikována transplantace jater.(2) U našeho chlapce sice zahájení terapie vedlo k významnému poklesu sukcinylacetonu, tyrosinu i AFP, ale pokročilé jaterní postižení s nálezem HCC vyžadovalo akutní transarteriální chemoembolizaci (TA CE) a přípravu na transplantaci jater.
Uvedený případ je vůbec první v ČR, kdy byla provedena TA CE u malého dítěte, a současně první v ČR, kdy byla provedena transplantace jater od žijícího dárce pro nádor u dítěte. Nedávno byla provedena jiná metoda transplantace jater u dlouhodobě sledovaného dítěte (nyní mladý dospělý) pro stejnou diagnózu TYR 1 s rozvojem HCC. Vzhledem k velikosti jaterního štěpu od jeho matky byla v tomto případě zvolena metoda RAPID, kdy část vlastních jater zůstává jako metabolická podpora malého transplantátu a ta je odstraněna až s odstupem času po úspěšném přihojení transplantátu. Spolu s transplantací byl resekován levý lalok s HCC.
Maligní nádory jater jsou v dětské populaci velmi vzácné a tvoří přibližně 0,5–1,5 % všech malignit v dětství. V této skupině 70–80 % nádorů jater představuje hepatoblastom. HCC se u dětí, na rozdíl od dospělé populace, vyskytuje sporadicky, ale zvýšené riziko rozvoje je asociováno s některými metabolickými a genetickými onemocněními. Vedle TYR 1 se jedná o některé typy jaterních glykogenóz, deficit α1-antitrypsinu, progresivní familiární intrahepatální cholestázu, zejména 2. typu, či Alagillův syndrom. Z negenetických onemocnění lze uvést autoimunitní hepatitidu a méně často infekční hepatitidy.(9,10,11) Ve velkém retrospektivním souboru pacientů s TYR 1, který zahrnoval i české pacienty, byla transplantace jater indikována u 29/168 dětí. Hlavní indikací k transplantaci jater byl v 72 % HCC, dále cirhóza jater a jaterní selhání.(2)
ZÁVĚR
Včasná diagnostika metabolické etiologie onemocnění v kojeneckém věku, léčba pomocí nitisinonu a eventuální transplantace jater u dětí s tyrosinemií typ 1 umožňuje dobrou prognózu i v případě, že již došlo k rozvoji hepatocelulárního karcinomu.
Podpořeno: RVOVFN-64165; Cooperatio program, vědní oblast „Pediatrie“.
Korespondenční adresa:
prof. MUDr. Jiří Zeman, DrSc.
Ke Karlovu 455/2
128 08 Praha 2
Zdroje
1. Honzík T, Zeman J. Dědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny. Ces-slov Pediat 2022; 77(6): 120–120.
2. Mayorandan S, Meyer U, Gokcay G, et al. Cross-sectional study of 168 patients with hepatorenal tyrosinaemia and implications for clinical practice. Orphanet J Rare Dis 2014; 9 : 107.
3. Hutchesson AC, Hall SK, Preece MA, et al. Screening for tyrosinaemia type I. Arch Dis Child Fetal Neonatal Ed 1996; 74(3): F191–4.
4. Lindstedt S, Holme E, Lock EA, et al. Treatment of hereditary tyrosinaemia type I by inhibition of 4-hydroxyphenylpyruvate dioxygenase. Lancet 1992; 340(8823): 813–817.
5. Weinberg AG, Mize CE, Worthen HG. The occurrence of hepatoma in the chronic form of hereditary tyrosinemia. J Pediatr 1976; 88(3): 434–438.
6. van Spronsen FJ, Thomasse Y, Smit GP, et al. Hereditary tyrosinemia type I: a new clinical classification with difference in prognosis on dietary treatment. Hepatology 1994; 20(5): 1187–1191.
7. Québec NTBC Study Group; Alvarez F, Atkinson S, et al. The Québec NTBC Study. Adv Exp Med Biol 2017; 959 : 187–195.
8. de Laet C, Dionisi-Vici C, Leonard JV, et al. Recommendations for the management of tyrosinaemia type 1. Orphanet J Rare Dis 2013; 8 : 8.
9. Digiacomo G, Serra RP, Turrini E, et al. State of the art and perspectives in pediatric hepatocellular carcinoma. Biochem Pharmacol 2023; 207 : 115373.
10. Varol Fİ. Pediatric hepatocellular carcinoma. J Gastrointest Cancer 2020; 51(4): 1169–1175.
11. Ranganathan S, Lopez-Terrada D, Alaggio R. Hepatoblastoma and pediatric hepatocellular carcinoma: an update. Pediatr Dev Pathol 2020; 23(2): 79–95.Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Antonín Hudeček: Starý Kolín
- Co jsme psali
- Editorial
- O nositelích Nobelovy ceny Coriových, ale nejen o nich
- Po stopách manželů Coriových
- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Hepatocelulární karcinom u kojence s tyrosinemií typ 1
- Je LATCH skórovací systém spolehlivým prediktorem délky kojení?
- Částečné kojení při propuštění novorozence z porodnice nepredikuje insuficientní kojení v prvních šesti měsících
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Profesorka MUDr. Lidka Lisá – devadesátiletá
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



