-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
GLP-1 analogues in therapy of obese adolescents. Early real-life experience with liraglutide treatment
The GLP-1 analog liraglutide is registered for pharmacotherapy of obese adolescents aged 12-17 years since 2021. According to clinical studies, liraglutide administration leads to a mean weight loss 4.6%. We summarize early reallife experience with this novel therapy.
Nine boys were treated with liraglutide under the supervision of out-patient clinic for obesity of Department of Pediatrics, University Hospital Motol between September 2021 and January 2023. At treatment onset, they were 12.0–16.5 years old (median 15), and had body weight 74–188 K g (median 123) and BMI 30.7–65.9 Kg/m2 (median 38.6). Therapy was initiated following failure of conventional treatment including psychological intervention. After the early-phase dose escalation, the long-term daily treatment dose stabilized at 1.8–3.0 mg (median 2.4). Therapy was accompanied by nutritional and behavioral intervention. Following 4–15 months on therapy (median 6), BMI declined to 31.5–61.6 Kg/m2 (median 35.6; p<0.05 vs. treatment onset). BMI dropped by 6.5% (median; range −12.7 to +3.0%; p<0.05). Therapy was terminated in two boys due to questionable success, and is ongoing in all others. Treatment related adverse events were minimal.
Liraglutide may contribute to stabilization or reduction of body weight and BMI in a significant proportion of severely obese adolescents.
Keywords:
obesity – liraglutide – pharmacotherapy – adolescence – GLP-1 analogs
Autoři: Malíková Křenek Jana; Lebl Jan
Působiště autorů: Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (3): 176-181.
Kategorie: Epidemie dětské obezity
doi: https://doi.org/10.55095/CSPediatrie2023/024Souhrn
Pro farmakoterapii obezity u adolescentů ve věku 12–17 let je od roku 2021 registrován analog GLP-1 liraglutid. Podle klinických studií přináší léčba liraglutidem redukci hmotnosti v průměru o 4,6 %. Shrnujeme první praktické zkušenosti s touto novou terapií.
Od září 2021 do ledna 2023 bylo v obezitologické ambulanci Pediatrické kliniky FN Motol léčeno liraglutidem 9 chlapců. Na počátku léčby byl jejich věk 12,0 až 16,5 roku (medián 15), tělesná hmotnost 74–188 kg (medián 123) a BMI 30,7–65,9 kg/m2 (medián 38,6). Léčba byla zahájena po neúspěchu konvenčních léčebných postupů včetně psychologické intervence. Po počáteční eskalaci dávkování byli chlapci dlouhodobě léčeni dávkou 1,8–3,0 mg denně (medián 2,4) při současné kontrole stravovacího a pohybového režimu. Během 4–15 měsíců léčby (medián 6) poklesl BMI na hodnoty 31,5–61,6 kg/m2 (medián 35,6; p < 0,05 proti stavu před léčbou). BMI se snížil o 6,5 % (medián; rozmezí –12,7 % až +3,0 %; p < 0,05). U dvou chlapců byla léčba pro sporný efekt ukončena, u ostatních pokračuje. Výskyt nežádoucích účinků byl minimální.
Po neúspěchu konvenčních postupů může liraglutid přispět ke stabilizaci nebo snížení tělesné váhy a BMI u významné části adolescentních pacientů se závažným stupněm obezity.
Klíčová slova:
obezita – adolescence – liraglutid – farmakoterapie – analoga GLP-1
GLUKAGON-LIKE PEPTID-1 (GLP-1)
První zmínky o látkách produkovaných střevní sliznicí, které ovlivňují glykemii, pocházejí již z počátku 20. století.(1) Vžilo se pro ně označení inkretinové hormony.
Prvním jednoznačně identifikovaným inkretinovým hormonem byl inzulinotropní peptid závislý na glukóze (Glucosodependent Insulinotropic Peptide – GIP).(2) V roce 1983 byla odhalena sekvence GLP-1 jako součást molekuly proglukagonu.( 3) Posttranslační úpravy, které vedou ke vzniku aktivní molekuly GLP-1 o délce 30 nebo 31 aminokyselin (aminokyseliny 7–36 nebo 7–37 z původního řetězce), byly objasněny v roce 1987.(4,5) Obě tyto formy GLP-1 mají stejné biologické účinky.(6) GLP-1 se vytváří v L-buňkách, podnětem je průchod stravy gastrointestinálním traktem.(7) Poločas endogenního GLP-1 v krevním oběhu je krátký, po 2–4 minutách je deaktivován dipeptidylpeptidázou-4.(8)
Receptor pro GLP-1 patří mezi receptory spojené s G-proteinem. Je exprimován v pankreatu, centrálním nervovém systému, gastrointestinálním traktu, cévní stěně, srdci, ledvinách a plicích.(9,10) Hlavní funkcí GLP-1 je regulovat metabolismus glukózy prostřednictvím vlivu na produkci a sekreci inzulinu podle aktuální glykemie(11) a současně snižovat sekreci glukagonu.(12) GLP-1 napomáhá také k ochraně samotných beta-buněk pankreatu díky inhibici apoptózy a stimulaci jejich neogeneze.(13,14) Mezi další významné účinky GLP-1 patří zpomalení motility trávicí trubice(15) a navození pocitu uspokojení a sytosti v regulačních centrech hypotalamu.( 16,17) Analoga GLP-1 mají také kardioprotektivní účinky.(18)
GLP-1 ANALOGA
Krátký poločas vlivem deaktivace dipeptidylpeptidázou-4 je hlavní překážkou pro léčebné využití nativního GLP-1. Průlomovým poznatkem byla extrakce exendinu-4 ze slin ještěrky Heloderma suspectum v roce 1992.(19) Exendin-4 má z 53 % stejnou aminokyselinovou strukturu jako GLP 1 a se stejnou účinností se váže na GLP-1 receptor,(20,21) má ovšem biologický poločas 3 hodiny.(22) Syntetický analog exendinu-4 nazvaný exenatid byl prvním analogem GLP-1 určeným k léčbě diabetu 2. typu. Byl schválen v roce 2005 Úřadem pro kontrolu potravin a léčiv USA (FDA) a v roce 2006 Evropskou lékovou agenturou (EMA). Exenatid se podává dvakrát denně subkutánně. Následně byla syntetizována analoga s mírně pozměněnou základní strukturou endogenního GLP-1 s cílem dále prodloužit biologický účinek.
Analoga GLP-1 se podle struktury molekuly dělí na analoga podobná exendinu-4 a na analoga podobná endogennímu lidskému GLP-1. Podle délky účinku se dělí na krátce a dlouhodobě působící – s každodenním či týdenním podáváním. Naprostá většina analog GLP-1 se podává subkutánní cestou, ale již existuje i možnost perorálního podávání (tab. 1).
Tab. 1. Farmaceutické přípravky na bázi analog GLP-1 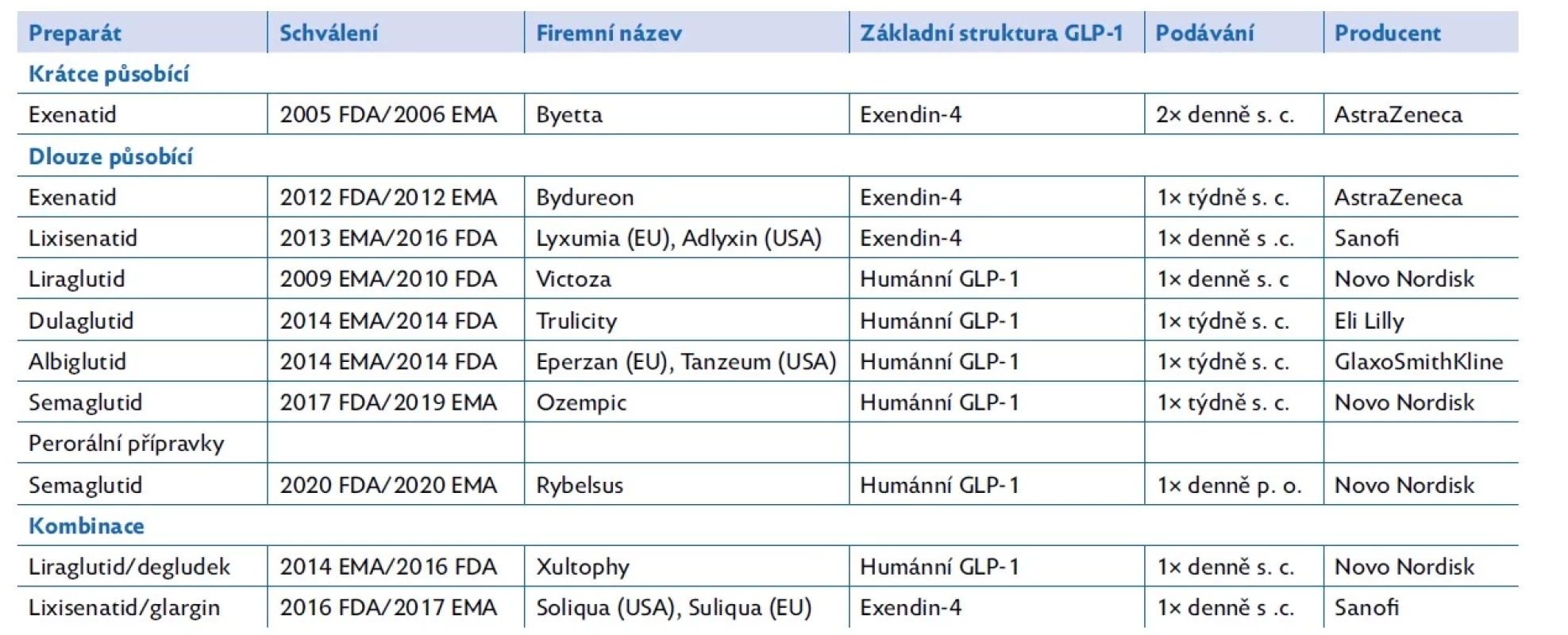
EMA – Evropská léková agentura; FDA – Úřad pro kontrolu potravin a léčiv Spojených států amerických. Upraveno podle (31) Primární indikací pro podávání analog GLP-1 je léčba diabetes mellitus 2. typu. Vzhledem k příznivým metabolickým účinkům se v současnosti rozšiřují indikační kritéria a přípravky liraglutid a semaglutid se začaly testovat a následně používat při léčbě obezity. Semaglutid je schválen pod názvem Wegovy k léčbě obezity u dospělých. Podle studií jeho podávání vede až k 15% redukci BMI.(23) Proběhla i studie bezpečnosti a účinnosti u adolescentů ve věku 12 až 17 let. U nich podávání semaglutidu vedlo k poklesu BMI o 16,7 %.(24)
LIRAGLUTID
O liraglutidu jsme se zmiňovali v rámci článku o současné farmakoterapii obezity u dětí.(25) Liraglutid je strukturou z 97 % shodný s GLP-1. Je odolnější vůči štěpení dipeptidylpeptidázou - 4, což prodlužuje jeho biologický poločas na 13 hodin. EMA schválila liraglutid k léčbě diabetu 2. typu pod názvem Victoza již v roce 2005. Následný průkaz účinků liraglutidu při léčbě obezity vedl v roce 2015 (EMA) k jeho schválení pod názvem Saxenda také k léčbě obezity u dospělých a v roce 2021 k léčbě adolescentů ve věku 12 až 17 let. Očekává se také budoucí schválení pro léčbu dětí ve věku 6 až 11 let, kde momentálně probíhají studie účinnosti.
Podle randomizované a dvojitě zaslepené studie(26) došlo u dospívajících ve věku 12–17 let během 56 týdnů sledování ke snížení BMI o 4,6 %. Efekt léčby byl signifikantní oproti podávání placeba. Indikační kritéria pro podání u dospívajících zahrnují BMI odpovídající ekvivalentu dospělého BMI 30 kg/m2 podle mezinárodních hraničních hodnot (International Obesity Task Force – IOTF) a s tělesnou hmotností více než 60 kg.
Liraglutid se podává jednou denně subkutánně předplněným perem. Dávka liraglutidu se titruje v týdenních intervalech od 0,6 mg až po maximální dávku 3 mg. Podle klinického efektu a případných nežádoucích účinků není nutné dosáhnout maximální dávky, dlouhodobé dávkování může být nižší. Pokud nedojde během prvních 12 týdnů od počátku podávání maximální dávky k poklesu BMI nebo BMI Z-skóre alespoň o 4 %, má být přípravek vysazen.
Během prvních týdnů užívání se mohou vyskytnout nežádoucí účinky – nauzea, bolesti břicha, průjmy či zácpy, bolesti hlavy. Pokud se liraglutid podává při léčbě diabetu v kombinaci s inzulinem nebo preparáty sulfonylurey, může dojít k vyššímu výskytu hypoglykemických epizod. Proto je důležité dávky inzulinu či preparátu sulfonylurey upravit. I při samostatném podávání liraglutidu v léčbě obezity byly zaznamenány hypoglykemické epizody, ale nejednalo se nikdy o těžké hypoglykemie.(26) Ojediněle se vyskytla akutní pankreatitida či cholecystitida.
Po fázi redukce hmotnosti v prvních měsících léčby následuje tzv. fáze „plateau“,(26,27) kdy již váha dále neklesá. Zřejmě dochází k metabolické adaptaci a novému nastavení sekrece leptinu, ghrelinu, neuropeptidu YY, gastrického inhibičního polypeptidu a dalších hormonů.(28) Cílem léčby v této fázi je udržení hmotnosti. Je ale zřejmé, že již váhový úbytek o 5–15 % snižuje komplikace obezity.(29,30)
V současnosti zatím není liraglutid pod názvem Saxenda hrazen z veřejného zdravotního pojištění a není omezena jeho preskripce na odbornost lékaře.
SOUBOR PACIENTŮ A METODIKA
V naší ambulanci jsme léčili liraglutidem po dobu nejméně 3 měsíců 9 těžce obézních adolescentních pacientů ve věku 12,0 až 16,5 let (medián 15). Všichni léčení byli chlapci. Jejich BMI před léčbou dosahoval hodnot 30,7 až 65,9 kg/m2 (medián 38,6) a tělesná hmotnost byla 74–188 kg (medián 123). Další charakteristiky včetně přidružených zdravotních problémů shrnuje tabulka 2.
Tab. 2. Charakteristiky jednotlivých léčených chlapců a výsledky léčby liraglutidem 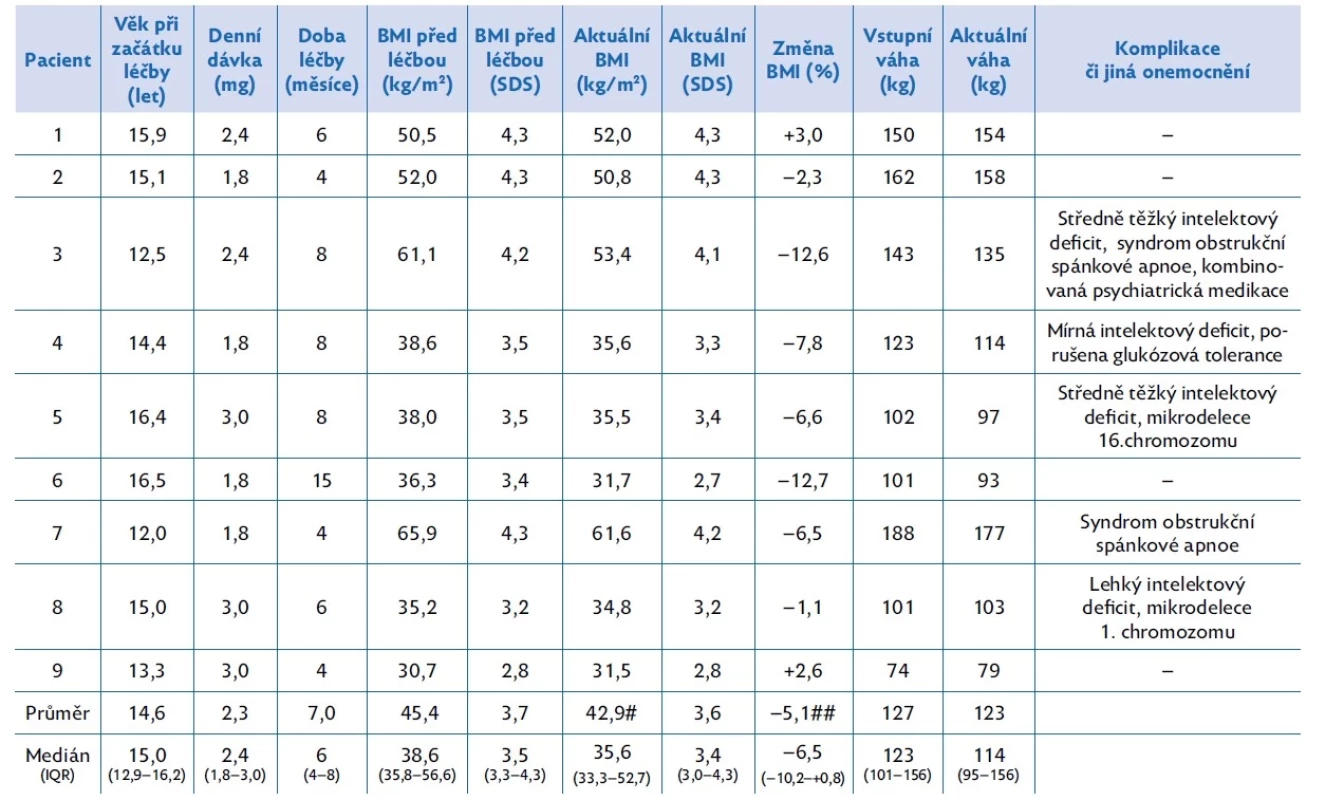
# p < 0,05 ve srovnání s BMI před léčbou (párový t-test); ## p < 0,05 změna proti hodnotě „0“ (one-sample t-test); IQR – interkvartilové rozmezí (Q1–Q3); SDS – skóre směrodatné odchylky Po úvodním zhodnocení anamnézy, posouzení stravovacích návyků včetně jídelního chování, pohybové aktivity, denního režimu a spánku bylo provedeno klinické a laboratorní vyšetření. Laboratorní odběry byly zaměřeny na vyloučení endokrinně podmíněné obezity, genetických syndromů spojených s obezitou a na komplikace obezity (MAFLD – metabolic associated fatty liver disease, dyslipidemii, hyperurikemii a poruchy metabolismu glukózy včetně diabetu 2. typu). Nutriční terapeutka se všemi pacienty a rodiči podrobně rozebrala skladbu jídla a pitný režim. Podle individuálních potřeb a možností fyzioterapeut či lékař tělovýchovného lékařství navrhl pohybový režim či byla zahájena psychologická podpora. Podle potřeby byla v některých případech doplněna další vyšetření (polysomnografie, zobrazovací metody).
Lékař informoval rodiče pacientů indikovaných k zahájení farmakologické léčby o podstatě přípravku, jeho dávkování, nežádoucích účincích a plánu kontrol. Vstupní edukace se sestrou zahrnovala zácvik do subkutánní aplikace, zacházení s předplněným perem a uchovávání přípravku. Dávkování Saxendy probíhalo podle doporučeného schématu s postupným vzestupem do dávky 1,8 mg. K dalšímu navýšení dávek docházelo individuálně podle efektu léčby.
Ke statistickému hodnocení byl použit párový t-test a one-sample t-test.
VÝSLEDKY
V tomto sdělení hodnotíme účinek léčby liraglutidem za období 4–15 měsíců (medián 6). Dávka přípravku byla 1,8 – 3,0 mg 1× denně s. c. (medián 2,4).
Během podávání liraglutidu došlo k poklesu průměrné hodnoty BMI ze 45,4 kg/m2 na 42,9 kg/m2 (p < 0,05), medián poklesu BMI činil 6,5 % (p < 0,05) (viz tab. 2). Průměrná tělesná hmotnost činila před léčbou 127 kg, po hodnoceném intervalu léčby 123 kg (n. s.). Individuální křivky vývoje BMI během léčby uvádí obrázek 1.
Obr. 1. Změna BMI u devíti chlapců v průběhu léčby liraglutidem 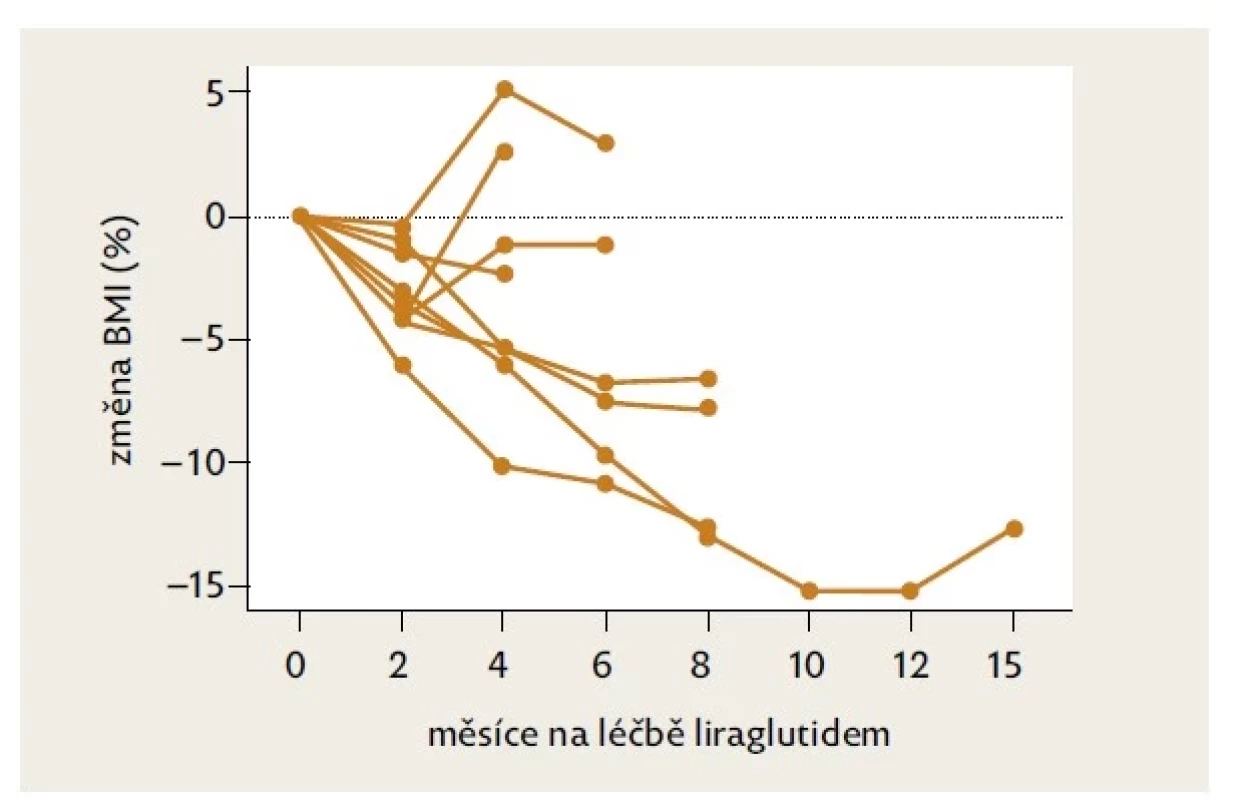
U dvou chlapců (pacienti 8 a 9) byla léčba vzhledem ke spornému efektu ukončena. Podrobněji je průběh léčby popsán v následujících odstavcích. I jejich výsledky jsou zahrnuty do celkového hodnocení efektu léčby, protože i jejich přístup je podle názoru autorů součástí praktické zkušenosti s terapií.
Během léčby nebyly zaznamenány klinicky významné nežádoucí účinky. U dvou chlapců se vyskytly krátké epizody bolestí břicha (pacient 3 a 6) či jednorázové zvracení (pacient 6). V obou případech epizody spontánně odezněly.
Pacient 1 má obezitu 3. stupně od předškolního věku. Nebyla zjištěna genetická příčina obezity, byla vyloučena endokrinní příčina. I přes vysoký BMI nemá chlapec komplikace obezity. Konvenční terapie byla po mnoho let neúspěšná. Krátce po nasazení liraglutidu došlo k poklesu hmotnosti, ale poté se objevil strmý nárůst. Po rozboru rodinné a osobní situace jsme zjistili nedodržování jídelního režimu na internátu a nepravidelnou aplikaci léku. Na přání rodiny i pacienta jsme léčbu ponechali.
Chlapci 3, 4 a 5 mají mírný až střední intelektový deficit. Užívají také psychiatrickou medikaci, která může zvyšovat chuť k jídlu. Mají nízkou motivaci k pohybu. Ve všech třech rodinách byla patrná vyčerpanost ze snahy redukovat konzumaci jídla a frustrace z dosavadních neúspěchů při kontrole hmotnosti. Během léčby liraglutidem u těchto chlapců hmotnost klesá. Významným benefitem je u nich snížení chuti k jídlu, které vede k úlevě u rodičů.
U pacienta 7 byla zahájena léčba ve věku 12 let při obezitě 3. stupně s významnou progresí, se vstupním BMI 65,9 kg/m2 a těžkým syndromem obstrukční spánkové apnoe, pro který byla zavedena neinvazivní ventilační podpora. Nebyla prokázána monogenní či endokrinní příčina obezity či obezita v rámci některého ze syndromů. Opakované pokusy o zavedení konvenční terapie a režimových opatření nebyly úspěšné. Opakovaná lázeňská terapie měla jen přechodný efekt v řádu týdnů. V současnosti váha chlapce klesá i při nižším dávkování liraglutidu (1,8 mg denně) a nemá nežádoucí účinky. Díky omezení chuti k jídlu se daří nastavit racionální jídelníček a chlapec postupně projevuje větší zájem o pohyb.
U pacientů 5 a 6 jsme během posledních měsíců pozorovali stagnaci BMI či menší nárůst hmotnosti. Po analýze údajů jsme u pacienta 5 zaznamenali porušování jídelního režimu. Během posledních měsíců pacient číslo 6 pro pracovní vytížení postupně omezil a poté zcela vyřadil fyzickou aktivitu a zhoršil jídelní režim. U pacienta 6 je efekt léčby vynikající, má nejvyšší pokles BMI, ale je celkově již léčen po dobu 15 měsíců a může nastupovat „plateau“ perioda. Oba mají nyní častější kontroly s nastavováním jednotlivých změn a cílem obnovit motivaci.
Léčba byla ukončena u pacientů 8 a 9 pro nedostatečný efekt po 4 měsících užívání liraglutidu v maximální dávce. Pacient 8 má nedávno zjištěný mikrodeleční syndrom 1. chromosomu s lehkým intelektovým deficitem. Má těžko zvladatelné stavy hyperfagie. Jeho tělesná hmotnost stoupá a přes veškerou snahu rodičů nemá motivaci změnit jídelní chování a navýšit tělesný pohyb. Intenzivní sledování v ambulanci a nastavování režimových opatření vedlo ke stagnaci BMI za cenu maximálního úsilí rodičů. Proto byla zahájena léčba liraglutidem. Během léčby se sice zlepšilo jídelní chování v odpoledních hodinách, ale o to více konzumoval ve večerních hodinách, kdy účinek léku klesá vzhledem k biologickému poločasu. Při pokusech přesunout aplikaci liraglutidu do poledních či časně odpoledních hodin se na lék často zapomínalo. Nakonec byla léčba vysazena.
Pacient č. 9 nemá kromě obezity jiná onemocnění. Vzhledem k velké snaze při zavádění režimových opatření, ale jen částečnému úspěchu při snižování hmotnosti byla nasazena léčba liraglutidem. Váha v prvních týdnech postupně klesala, ovšem poté došlo k navýšení hmotnosti i při aplikaci maximální dávky. Lék byl podáván matkou, proto byla vyloučena nepravidelnost v aplikaci a vynechávání dávek. Na léčbě klesla konzumace jídla během dne, ale narůstal pocit hladu večer. Bohužel ani v tomto případě nebylo možné aplikovat liraglutid v poledne či brzy odpoledne a léčba byla po 3 měsících maximální dávky vysazena.
DISKUSE
V našem sdělení představujeme první průběžné výsledky léčby těžce obézních adolescentních pacientů pomocí liraglutidu. Ve studii Kellyho(26) byl prokázán efekt této léčby s poklesem BMI o 4,6 % během 56 týdnů sledování. K podobnému pozitivnímu vlivu na pokles BMI došlo i u našich pacientů. Výskyt nežádoucích účinků nebyl významný.
I přes velkou naději, kterou léčebné využití analogů GLP-1 přináší, je tato léčba jen jednou ze součástí komplexní léčby obezity. Také naše zkušenosti u jednotlivých pacientů jasně ukázaly, že klíčové je současně dodržovat režimová, jídelní a pohybová doporučení.
Naše zkušenosti potvrzují nutnost pravidelných návštěv v ordinaci s kontrolou nastavení režimu a udržení motivace. Právě motivace je jedním ze základních předpokladů úspěchu. Je nutné počítat s tím, že po prvotním úspěchu následuje tzv. plateau fáze, kdy váha stagnuje a léčba liraglutidem především zabraňuje přibírání.
Objevují se proto otázky, co dále s adolescentními pacienty léčenými analogy GLP-1. V současnosti jiná účinná medikace pro pediatrické období k dispozici není, proto je žádoucí využít první období se slibným poklesem hmotnosti k nastavení životního stylu s vhodnou skladbou a porcemi jídla a optimalizovat pohybový a spánkový režim. Všechny tyto změny je nutné provést v rámci užší rodiny a je vhodná i další podpora okolí – včetně širší rodiny, školy a volnočasových aktivit. Jen takto může být režim dlouhodobě udržitelný a může zajistit dlouhodobou příznivou kontrolu tělesné hmotnosti.
Ve srovnání s léčbou dospělých narážíme u adolescentů na určité limity, které jsou někdy obtížně řešitelné. Jednou z odlišností je obtížné dosažení motivace adolescentního pacienta. U mladistvých s intelektovým deficitem je tento problém ještě výraznější. Obtížné je také zajistit optimální režim, ale i pravidelnou aplikaci léku u adolescentů, kteří žijí během týdne na internátu. Další překážkou léčby i u motivovaných a spolupracujících rodin jsou finanční náklady, které dlouhodobá léčba bez úhrady z veřejného zdravotního pojištění přináší.
Korespondenční adresa:
MUDr. Jana Křenek Malíková, Ph.D.
Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole
V Úvalu 84, 150 06 Praha 5
Zdroje
1. Nauck MA. The rollercoaster history of using physiological and pharmacological properties of incretin hormones to develop diabetes medications with a convincing benefit-risk relationship. Metabolism 2020; 103 : 154031.
2. Brown JC, Dryburgh JR. A gastric inhibitory polypeptide. II. The complete amino acid sequence. Can J Biochem 1971; 49(8): 867–872.
3. Bell GI, Sanchez-Pescador R, Laybourn PJ, et al. Exon duplication and divergence in the human preproglucagon gene. Nature 1983; 304(5924): 368–371.
4. Mojsov S, Weir GC, Habener JF. Insulinotropin: glucagon-like peptide I (7 - 37) co-encoded in the glucagon gene is a potent stimulator of insulin release in the perfused rat pancreas. J Clin Invest 1987; 79(2): 616–619.
5. Holst JJ, Orskov C, Nielsen OV, et al. Truncated glucagon-like peptide I, an insulin-releasing hormone from the distal gut. FEBS Lett 1987; 211(2): 169–174.
6. Orskov C, Rabenhøj L, Wettergren A, et al. Tissue and plasma concentrations of amidated and glycine-extended glucagon-like peptide I in humans. Diabetes 1994; 43(4): 535–539.
7. Orskov L, Holst JJ, Møller J, et al. GLP-1 does not acutely affect insulin sensitivity in healthy man. Diabetologia 1996; 39(10): 1227–1232.
8. Mentlein R, Gallwitz B, Schmidt WE. Dipeptidyl-peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1(7-36)amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur J Biochem 1993; 214(3): 829–835.
9. Körner M, Stöckli M, Waser B, et al. GLP-1 receptor expression in human tumors and human normal tissues: potential for in vivo targeting. J Nucl Med 2007; 48(5): 736–743.
10. Baggio LL, Yusta B, Mulvihill EE, et al. GLP-1 receptor expression within the human heart. Endocrinology 2018; 159(4): 1570–1584.
11. Drucker DJ, Philippe J, Mojsov S, et al. Glucagon-like peptide I stimulates insulin gene expression and increases cyclic AMP levels in a rat islet cell line. Proc Natl Acad Sci U S A 1987; 84(10): 3434–3438.
12. Kreymann B, Williams G, Ghatei MA, et al. Glucagon-like peptide-1 7-36: a physiological incretin in man. Lancet 1987; 330 : 1300–1304.
13. Perfetti R, Hui H. The role of GLP-1 in the life and death of pancreatic beta cells. Horm Metab Res 2004; 36(11–12): 804–810.
14. Cornu M, Thorens B. GLP-1 protects β-cells against apoptosis by enhancing the activity of an IGF-2/IGF1-receptor autocrine loop. Islets 2009; 1(3): 280–282.
15. Nauck MA, Niedereichholz U, Ettler R, et al. Glucagon-like peptide 1 inhibition of gastric emptying outweighs its insulinotropic effects in healthy humans. Am J Physiol 1997; 273(5): E981–988.
16. Turton MD, O’Shea D, Gunn I, et al. A role for glucagon-like peptide-1 in the central regulation of feeding. Nature 1996; 379(6560): 69–72.
17. Flint A, Raben A, Astrup A, et al. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998; 101(3): 515–520.
18. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375(4): 311 – 322.
19. Eng J, Kleinman WA, Singh L, et al. Isolation and characterization of exendin - 4, an exendin-3 analogue, from Heloderma suspectum venom. Further evidence for an exendin receptor on dispersed acini from guinea pig pancreas. J Biol Chem 1992; 267(11): 7402–7405.
20. Göke R, Fehmann HC, Linn T, et al. Exendin-4 is a high potency agonist and truncated exendin-(9-39)-amide an antagonist at the glucagon-like peptide 1-(7-36)-amide receptor of insulin-secreting beta-cells. J Biol Chem 1993; 268(26): 19650–19655.
21. Thorens B, Porret A, Bühler L, et al. Cloning and functional expression of the human islet GLP-1 receptor. Demonstration that exendin-4 is an agonist and exendin-(9-39) an antagonist of the receptor. Diabetes 1993; 42(11): 1678–1682.
22. Yap MKK, Misuan N. Exendin-4 from Heloderma suspectum venom: From discovery to its latest application as type II diabetes combatant. Basic Clin Pharmacol Toxicol 2019; 124(5): 513–527.
23. Wilding JPH, Batterham RL, Calanna S, et al. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021; 384(11): 989–1002.
24. Weghuber D, Barrett T, Barrientos-Pérez M, et al. Once-weekly semaglutide in adolescents with obesity. N Engl J Med 2022; 387(24): 2245–2257.
25. Křenek Malíková J, Alhdoon Hainerová I, Lebl J. Současné možnosti farmakoterapie dětské obezity. Ces-slov Pediat 2023; 78(2): 122–126.
26. Kelly AS, Auerbach P, Barrientos-Perez M, et al. A randomized, controlled trial of liraglutide for adolescents with obesity. N Engl J Med 2020; 382(22): 2117–2128.
27. Rubino DM, Greenway FL, Khalid U, et al. Effect of weekly subcutaneous semaglutide vs daily liraglutide on body weight in adults with overweight or obesity without diabetes: the STEP 8 randomized clinical trial. JAMA 2022; 327(2): 138–150.
28. Sumithran P, Prendergast LA, Delbridge E, et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med 2011; 365(17): 1597 – 1604.
29. Garvey WT, Mechanick JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology Comprehensive Clinical Practice Guidelines for medical care of patients with obesity. Endocr Pract 2016; 22 (Suppl. 3):1–203.
30. Wing RR, Lang W, Wadden TA , et al. Benefits of modest weight loss in improving cardiovascular risk factors in overweight and obese individuals with type 2 diabetes. Diabetes Care 2011; 34(7): 1481–1486.
31. Nauck MA, Quast DR, Wefers J, et al. GLP-1 receptor agonists in the treatment of type 2 diabetes – state-of-the-art. Mol Metab 2021; 46 : 101102.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Antonín Hudeček: Starý KolínČlánek Co jsme psaliČlánek EditorialČlánek Po stopách manželů CoriovýchČlánek Pediatrická poezie
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Antonín Hudeček: Starý Kolín
- Co jsme psali
- Editorial
- O nositelích Nobelovy ceny Coriových, ale nejen o nich
- Po stopách manželů Coriových
- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Hepatocelulární karcinom u kojence s tyrosinemií typ 1
- Je LATCH skórovací systém spolehlivým prediktorem délky kojení?
- Částečné kojení při propuštění novorozence z porodnice nepredikuje insuficientní kojení v prvních šesti měsících
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Profesorka MUDr. Lidka Lisá – devadesátiletá
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



