-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endokrinní příčiny obezity v dětství a adolescenci
Endocrine causes of obesity in childhood and adolescence
The most common type of childhood obesity is simple obesity which develops as a result of a combination of certain genetic and environmental factors. Secondary obesity is caused by rare genetic forms of obesity, by certain drugs and by the following endocrine diseases: hypothyroidism, Cushing’s syndrome, growth hormone deficiency, hypogonadism, pseudohypoparathyroidism type Ia, insulinoma, hypothalamic obesity and polycystic ovary syndrome. Early detection of the endocrine cause of obesity leads to a reduction in morbidity and, in some cases, mortality in these children. Doctors must diagnose secondary obesity, distinguish it from simple obesity, and treat it accordingly. When examining causes of obesity, not only personal medical history, but also the family medical history is necessary; clinical examination and the evaluation of the child’s growth curve and BMI (body mass index) are crucial. This text describes pathophysiological mechanisms resulting in endocrinopathy-related obesity, as well as typical clinical and laboratory findings, pathological growth and BMI curves confirming a specific endocrinopathy.
Keywords:
insulinoma – Polycystic ovary syndrome – Hypothyroidism – Cushing’s syndrome – hypogonadism – secondary obesity – growth hormone deficiency – pseudohypoparathyroidism type Ia – hypothalamic obesity
Autoři: Pomahačová Renata; Paterová Petra; Nykodýmová Eva; Sládková Eva; Skalická Eva; Sýkora Josef
Působiště autorů: Univerzita Karlova v Praze ; Dětská klinika, Lékařská fakulta, a Fakultní nemocnice v Plzni
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (Supplementum 3): 24-29.
Kategorie: Souborný referát
doi: https://doi.org/10.55095/CSPediatrie2022/055Souhrn
Nejčastějším typem dětské obezity, která se vyvíjí v důsledku kombinace genetických a environmentálních faktorů, je obezita prostá. Příčinou sekundární obezity mohou být, vedle vzácných genetických forem obezity a vlivu některých léků, endokrinní choroby, mezi které patří hypotyreóza, Cushingův syndrom, deficit růstového hormonu, hypogonadismus, pseudohypoparatyreóza typu Ia, inzulinom, hypotalamická obezita a syndrom polycystických ovarií. Časné odhalení endokrinní příčiny obezity vede ke snížení morbidity a v některých případech i mortality těchto dětí. Úkolem lékaře je tyto stavy mezi ostatními obézními dětmi rozpoznat a řešit. Při vyšetření příčiny obezity je, vedle rodinné a osobní anamnézy, důležité klinické a laboratorní vyšetření, zhodnocení růstové křivky a křivky BMI (body mass index). Popisujeme patofyziologické mechanismy odpovědné za rozvoj obezity u jednotlivých endokrinopatií, typické klinické a laboratorní nálezy, patologické růstové křivky a křivky vývoje BMI vedoucí k jejich diagnóze.
Klíčová slova:
inzulinom – Cushingův syndrom – hypotyreóza – syndróm polycystických ovárii – hypogonadismus – sekundární obezita – deficit růstového hormonu – pseudohypoparatyreóza typu Ia – hypotalamická obezita
Úvod
Obezita je definována zmnožením tukové tkáně v organismu. Celosvětová epidemie dětské obezity je způsobená obezitogenním zevním prostředím. S nárůstem dětské obezity současně stoupá prevalence metabolických komplikací, které zahrnují dyslipidemii, jaterní steatózu, hypertenzi a diabetes mellitus 2. typu. Obezita v dětství a adolescenci je rizikovým faktorem pro vývoj obezity a kardiovaskulárních chorob v dospělém věku.(1–3)
K zajištění přiměřené tělesné hmotnosti je nutná rovnováha mezi příjmem a výdejem energie. Příjem energie je dán dostupností stravy a individuálním jídelním chováním. Na výdeji energie se podílí aktivní tělesný pohyb a bazální termogeneze. K vývoji nadváhy a obezity tedy dochází při pozitivní energetické bilanci, kdy energetický příjem převažuje nad energetickým výdejem.(1,3,4)
Nejčastějším typem dětské obezity je obezita prostá, kde vedle genetických faktorů hraje roli narušené jídelní chování a nedostatek tělesného pohybu. Příčinou sekundární obezity mohou být, vedle vzácných genetických forem a vlivu některých léků, endokrinní choroby, mezi které patří hypotyreóza, Cushingův syndrom (CS), deficit růstového hormonu (RH), hypogonadismus, pseudohypoparatyreóza typu Ia (PHP Ia), inzulinom, hypotalamická obezita a syndrom polycystických ovarií.(1,4–6)
Popisujeme patofyziologické mechanismy odpovědné za rozvoj obezity u jednotlivých endokrinopatií, typické klinické a laboratorní nálezy, patologické růstové křivky a křivky BMI (body mass index) vedoucí k jejich diagnóze.
Hypotyreóza
Nejčastější příčinou získané primární hypotyreózy je chronická lymfocytární tyreoiditida (CLT). K vývoji nadváhy a obezity vede těžká a dlouhotrvající nekompenzovaná primární hypofunkce štítné žlázy, kdy vedle typicky vysoce elevované hladiny TSH (tyreotropní hormon) je již snížená hladina fT4 (volný thyroxin).(1,2,4,6,7)
Z patofyziologického hlediska se na vývoji obezity podílí snížený bazální metabolismus s poklesem energetického výdeje a myxedém s ukládáním mukopolysacharidů v podkoží a retencí vody.(2,4–6)
Mezi klinické symptomy těžké hypotyreózy patří, kromě myxedému, progredující BMI a naopak zpomalování až zástava růstu, únava, zpomalené psychomotorické tempo, opožděná puberta, nepravidelný menstruační cyklus, zimomřivost, padání vlasů, obstipace a kardiální symptomatologie s bradykardií, hypotenzí a perikardiálním výpotkem.(1,2,7)
S těžkými klinickými symptomy hypotyreózy přichází především děti s atrofickými formami CLT s nehmatnou strumou, což vede většinou k pozdní diagnóze onemocnění.( 7)
Fotodokumentace demonstruje fenotyp 7letého pacienta s těžkou primární nekompenzovanou hypotyreózou při atrofické formě CLT před léčbou a při léčbě levothyroxinem (obr. 1 a 2). Růstová křivka ukazuje zpomalování růstu od 5 let věku a urychlení růstu při léčbě (obr. 3).
Obr. 1. Facies s myxedémem u 7letého pacienta s těžkou nekompenzovanou primární hypotyreózou při atrofické formě chronické lymfocytární tyreoiditidy (foto archiv autorů) 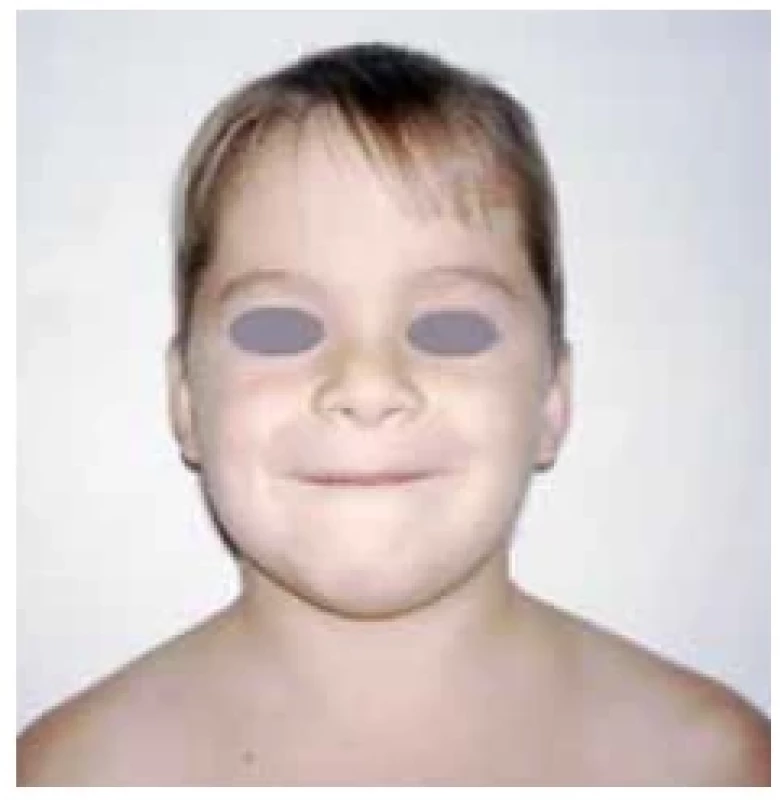
Obr. 2. Normalizace fenotypu s ústupem myxedému při léčbě levothyroxinem u 7letého pacienta s těžkou primární hypotyreózou při chronické lymfocytární tyreoiditidě (foto archiv autorů) 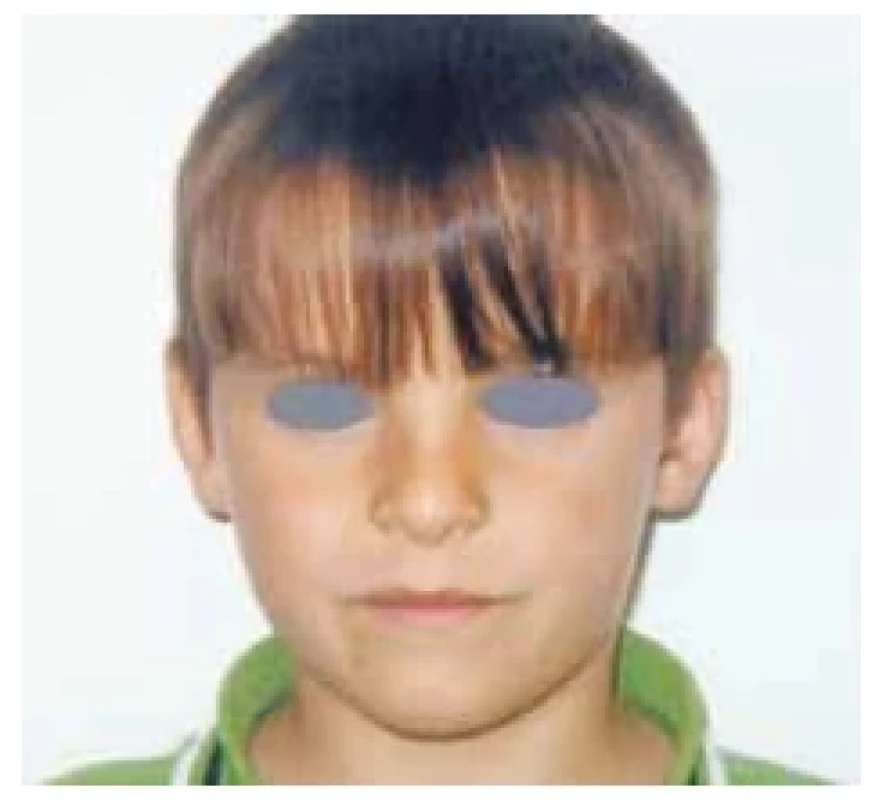
Obr. 3. Růstová křivka s růstovou retardací u 7letého pacienta s těžkou primární hypotyreózou při chronické lymfocytární tyreoiditidě. Od 5 let věku je patrný přechod z 25. pod 3. percentil. Při léčbě levothyroxinem vidíme růstovou akceleraci. (foto archiv autorů) 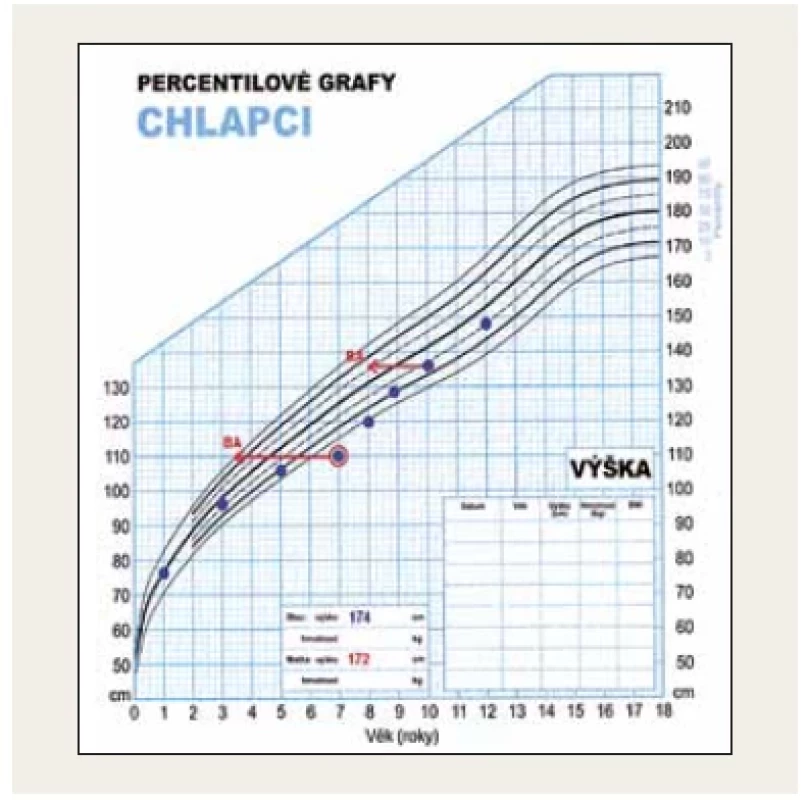
CUSHINGŮV SYNDROM
Převažující příčinou Cushingova syndromu u dětí nad 5 let věku je ACTH (adrenokortikotropní hormon) produkující mikroadenom hypofýzy (Cushingova nemoc), s hlavním výskytem v pubertě a adolescenci.(8–10)
Z patofyziologického hlediska je příčinou hmotnostních přírůstků endogenní hyperkortizolismus, který vede ke zvýšené lipogenezi nejen v oblasti obličeje, ale také v oblasti centrální (abdominální) tkáně a k hyperfagii.(1,2,4–6)
Mezi klinické symptomy CS v dětském věku patří progredující BMI, zpomalování růstu, patologická nadprodukce adrenálních androgenů s vývojem předčasné izosexuální pseudopuberty u chlapců, předčasné heterosexuální pseudopuberty nebo hirsutismu u dívek a opožděná nebo nepostupující pravá puberta. Dalšími symptomy jsou měsícovitý obličej, purpurové strie, hematomy, atrofie svalů, arteriální hypertenze s hypokalemií, porucha v sacharidovém metabolismu, osteoporóza a vzácně psychické změny s depresemi a poruchou spánku.(2,7,8,10,11)
Pro diagnózu CS svědčí narušený diurnální rytmus sekrece kortizolu s chyběním fyziologického poklesu noční hladiny kortizolu v séru, vysoký odpad kortizolu močí za 24 hodin a chybění adekvátní supresibility v hladině kortizolu po podání dexamethasonu. Zvýšená nebo normální hladina ACTH ukazuje na centrální etiologii CS a suprimovaná hladina ACTH na příčinu v nadledvině.(2,8,11)
V praxi se můžeme setkat s plně vyjádřeným klinickým obrazem CS a s neúplným obrazem CS v iniciální fázi onemocnění. Fotodokumentace (obr. 4) demonstruje 11letého pacienta s typickým obrazem CS včetně obezity, purpurových strií, měsícovitého obličeje, se známkami izosexuální pseudopuberty s pokročilým sexuálním ochlupením, nárůstem penisu, ale s prepubertálními testes. Růstová křivka ukazovala zpomalování růstu a současně progredující BMI od 9 let věku. Indikací k vyšetření u pacienta byla progredující obezita. Fotodokumentace (obr. 5) naopak ukazuje neúplný obraz CS u 13leté dívky. Prvotní indikací k vyšetření byla svalová slabost, deprese, porucha spánku a těžká arteriální hypertenze s hypokalemií. V době stanovení diagnózy v klinickém obraze dominoval měsícovitý obličej, hirsutismus, zvýšená tvorba hematomů a opožděná puberta. Strie se začaly postupně tvořit na dolních končetinách a abdominálně docházelo ke zvýšené lipogenezi. Růstová křivka ukazuje zpomalování růstu od 11 let věku (obr. 6).
Obr. 4. 11letý pacient s plně rozvinutým obrazem Cushingova syndromu včetně obezity, purpurových strií, měsícovitého obličeje, izosexuální pseudopuberty a poruchy růstu (foto archiv autorů) 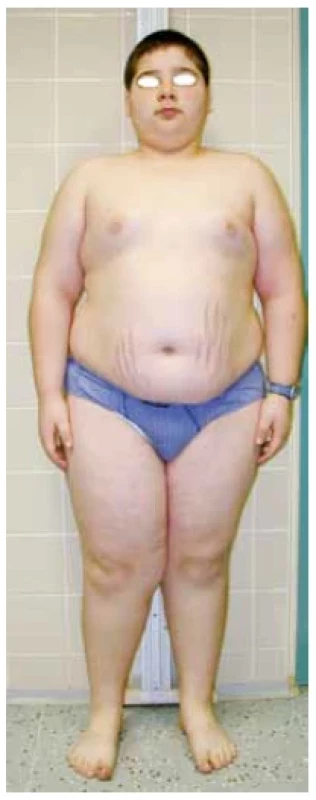
Obr. 5. 13letá pacientka v iniciální fázi onemocnění s neúplným obrazem Cushingova syndromu. Dominoval měsícovitý obličej, zvýšená tvorba hematomů, opožděná puberta a porucha růstu. (foto archiv autorů) 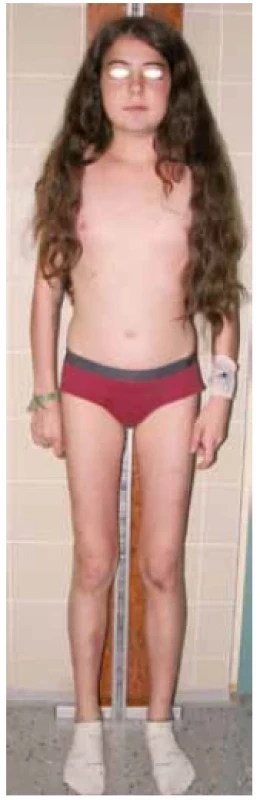
Obr. 6. Patologická růstová křivka se zpomalením růstu 2 roky před stanovením diagnózy Cushingova syndromu u 13leté pacientky s iniciálními symptomy onemocnění (foto archiv autorů) 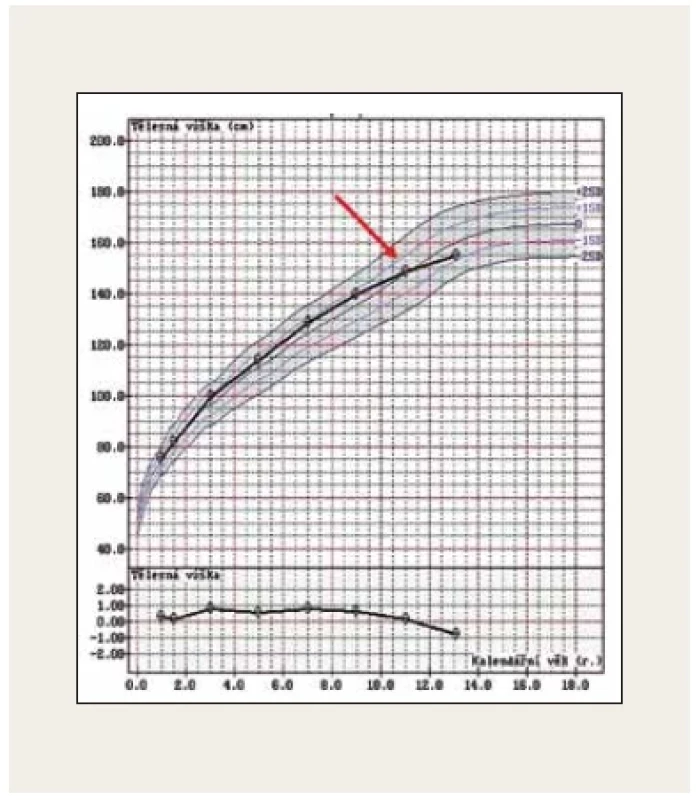
Deficit růstového hormonu
Deficit růstového hormonu je vrozený nebo získaný a může být izolovaný nebo kombinovaný s deficity dalších hypofyzárních hormonů. Příčinou vrozeného deficitu RH je porucha morfogeneze hypofýzy (např. septooptická dysplazie) nebo porucha diferenciace hypofýzy, nejčastěji při defektu genu PROP1. Příčinou získaného deficitu RH jsou nádory střední čáry mozku, radioterapie, trauma nebo zánět.(1,7)
RH hraje významnou roli v regulaci energetického výdeje, tělesného složení, kostní denzity a tukového metabolismu. RH stimuluje lipolýzu a proteosyntézu. Deficit RH proto vede ke změně v tělesném složení s úbytkem svalové hmoty a nadbytkem tukové tkáně v oblasti trupu, takže tyto děti vypadají jako obézní, ale jejich BMI může být v normě. Neléčený deficit RH provází zvýšené kardiovaskulární riziko, proto dnes u těžkého deficitu pokračujeme v léčbě redukovanou dávkou RH po ukončení růstu.(1,2,4–6)
Fotodokumentace ukazuje typickou změnu v tělesném složení s nadbytkem tukové tkáně v oblasti trupu a s úbytkem svalové hmoty u 15letého pacienta s panhypopituitarismem při cystě z Rathkeho výchlipky (obr. 7). Ke změně v tělesném složení vedl těžký deficit růstového hormonu a současně centrální hypogonadismus.
Obr. 7. 15letý pacient s panhypopituitarismem při cystě z Rathkeho výchlipky. Typická změna v tělesném složení s nadbytkem tukové tkáně adominálně a s úbytkem svalové hmoty v důsledku těžkého deficitu růstového hormonu a pohlavních hormonů při hypogonadismu. (foto archiv autorů) 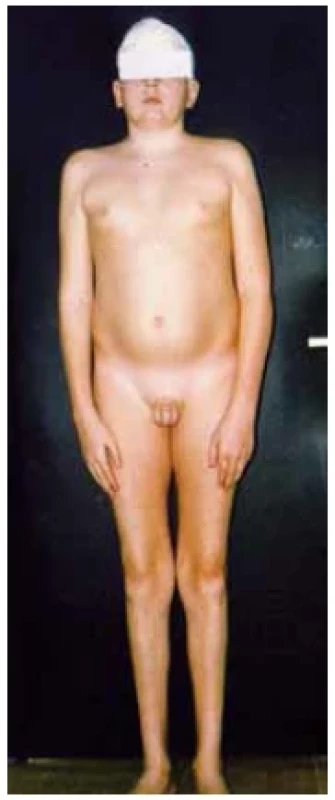
Hypogonadismus
Pohlavní hormony podporují mobilizaci viscerálního tuku, ovlivňují proteosyntézu a kostní denzitu. Jejich deficit vede ke změně v tělesném složení s úbytkem svalové hmoty a rozvojem viscerální obezity s rizikem vývoje metabolického syndromu a s tím souvisejícím kardiovaskulárním rizikem.(4)
Pseudohypoparatyreóza typu IA
PHP Ia je způsobena inaktivační mutací v genu GNAS1 kódujícím α-podjednotku G-proteinu, který zprostředkovává přenos hormonálního signálu v buňce. Pacienti mají rezistenci vůči parathormonu (PTH), což se laboratorně projeví hypokalcemií, hyperfosfatemií při paradoxně vysoké hladině PTH a rezistenci k TSH, která vede k primární hypotyreóze většinou s mírnou elevací TSH do 10 mIU/l a nižší hladinou fT4. Mohou mít rezistenci k dalším hormonům působícím přes G-protein.(1,4,6,7)
Z patofyziologického hlediska je příčinou časného vývoje obezity od kojeneckého věku porucha na úrovni melanokortinového receptoru 4. typu (MCR4) anorexigenní osy, kdy je v důsledku poruchy funkce α-podjednotky G-proteinu narušena fyziologická postreceptorová signalizace. Fyziologická aktivace MCR4 vede ke sníženému příjmu potravy a ke zvýšenému energetickému výdeji, takže pacienti s PHP Ia mají snížený bazální metabolismus a trpí hyperfagií.(12)
Somatické odchylky u PHP Ia, které se nazývají Albrightova hereditární osteodystrofie (AHO), zahrnují kromě obezity malou postavu, kulatý obličej, kožní a podkožní kalcifikace, zkrácené především IV. metakarpy a metatarzy, může být přítomen mentální defekt a katarakta.(1,4,6,7,12)
Fotodokumentace demonstruje typický fenotyp s obezitou a kulatým obličejem u pacientky s molekulárně geneticky potvrzenou PHP Ia (obr. 8). Kalcifikace v oblasti paty a zkrácené IV. metatarzy u pacientů jsou dalšími příznaky PHP Ia (obr. 9 a 10). U pacientky vedl k diagnóze časný vývoj obezity od kojeneckého věku, primární hypotyreóza nejasné etiologie a drobné kalcifikace v oblasti stehna a paty verifikované ve 3 letech věku. Laboratorní vývoj rezistence k PTH s hypokalcemií, hyperfosfatemií a elevací PTH byl zachycen ve 3 letech věku. Matka dítěte trpí pseudopseudohypoparatyreózou s klinickými známkami AHO, ale bez přítomnosti hormonální rezistence.
Obr. 8. Pacientka s pseudohypoparatyreózou typu Ia. Typický fenotyp s obezitou a kulatým obličejem (foto archiv autorů) 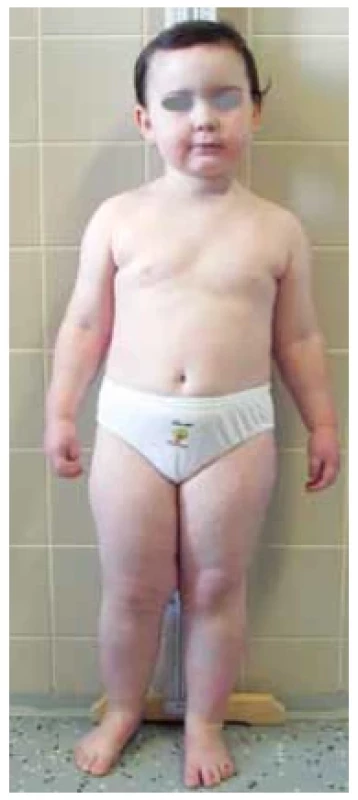
Obr. 9. Kalcifikace v oblasti paty u pacienta s pseudohypoparatyreózou typu Ia (foto archiv autorů) 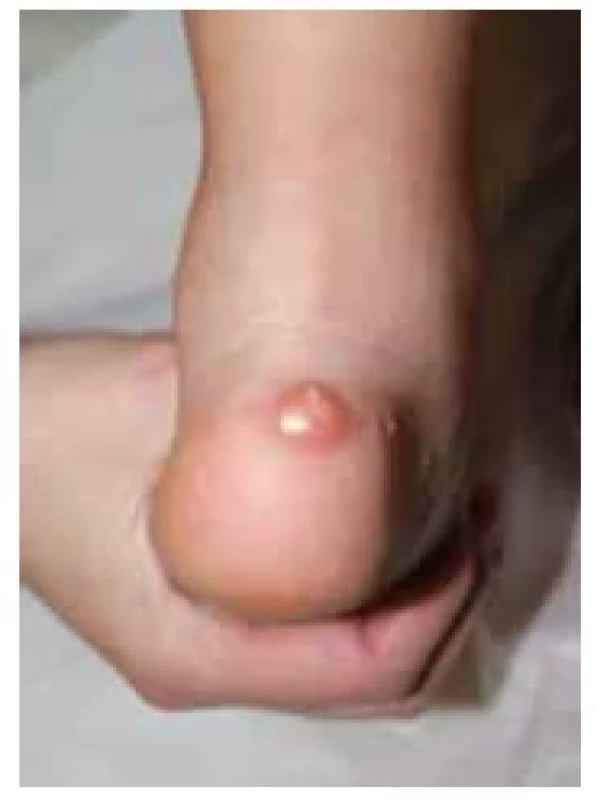
Obr. 10. Zkrácené IV. metatarzy u pacientky s pseudohypoparatyreózou typu Ia (foto archiv autorů) 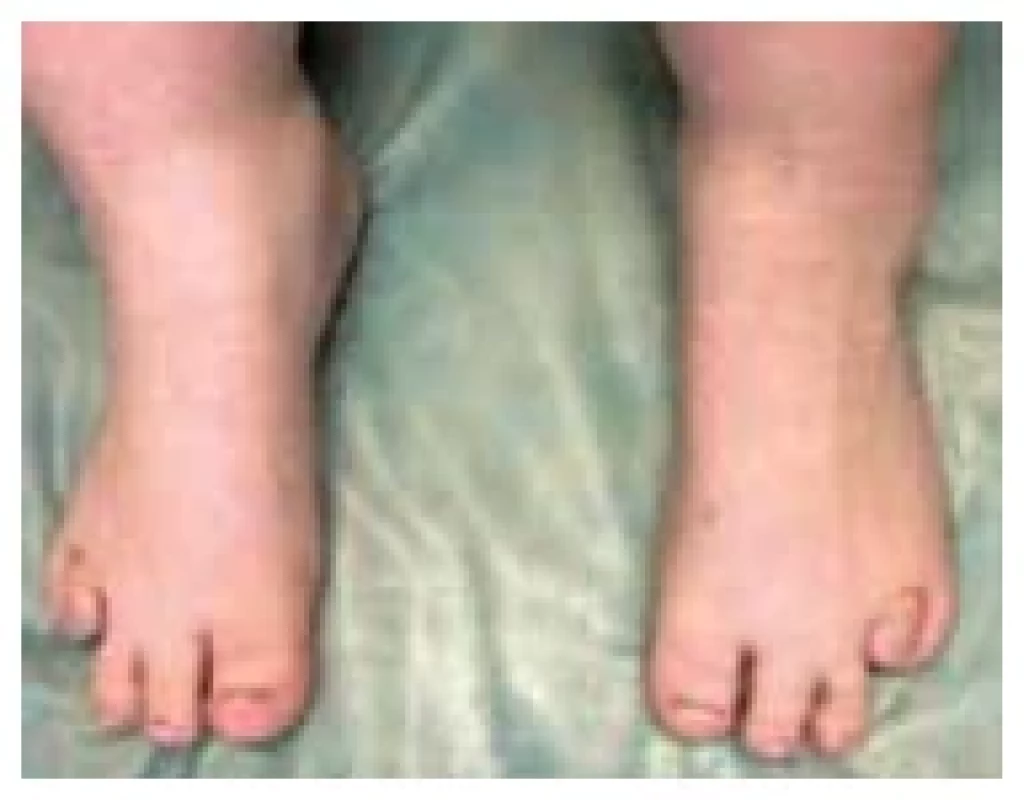
Hypotalamická obezita
K hypotalamické obezitě vedou organické léze v oblasti III. mozkové komory s poškozením ventromediálního hypotalamu, kde je uloženo centrum sytosti, což vede k hyperfagii. Příčinou může být tumor nebo operační výkon v oblasti hypotalamu, radioterapie, zánět, vrozené vývojové anomálie nebo trauma.(1,2,4,5) Pacienti s hypotalamickou obezitou mají často další endokrinopatie, jako je deficit růstového hormonu, předčasná nebo opožděná puberta a centrální diabetes insipidus.(2) Hypotalamická obezita se vyvíjí přibližně u 50 % dětí po operaci kraniofaryngeomu.(2,13,14)
Inzulinom
Inzulinom (nezidiom) je ve většině případů benigní adenom vycházející z β-buněk Langerhansových ostrůvků produkujících inzulin. Klasickým projevem jsou ranní lačné hypoglykemie v důsledku nekontrolované nadprodukce inzulinu. Dominují neuroglykopenické symptomy (bolesti hlavy, diplopie, zhoršené vidění, změny chování, porucha řeči a porucha vědomí s křečemi). Méně často mají pacienti projevy aktivace sympatoadrenálního systému (pocení, palpitace, tachykardie). Typický je ústup potíží po požití sacharidu. Těžká hypoglykemie může mít fatální následky.(1,4,7)
Dlouhotrvající hyperinzulinismus vede k hmotnostním přírůstkům vlivem zvýšeného energetického příjmu při opakovaných hypoglykemiích a současně zvýšené lipogeneze při nadprodukci inzulinu.(4,5)
Syndrom polycystických ovarií
Syndrom polycystických ovarií (PCOS) je definován jako zvýšená hladina androgenů v kombinaci s nepravidelným menstruačním cyklem ve smyslu oligomenorey nebo sekundární amenorey. Diagnózu podporuje nález typické morfologie polycystických vaječníků. Mezi klinické známky hyperandrogenního stavu patří hirsutismus, akné nebo alopecie. Obezita s rozvojem metabolického syndromu je přítomna u 60 % pacientů s PCOS.(6)
Diskuse
Endokrinopatie tvoří mezi dětmi s nadváhou a obezitou minoritní skupinu, ale důsledkem jejich pozdní diagnózy může být vysoká morbidita a v některých případech mortalita jedince.( 1,2,4,5–7)
Při vyšetření dítěte s vývojem nadváhy a obezity je důležité, kromě anamnézy a klinického vyšetření, zhodnocení růstové křivky a křivky vývoje BMI. Zpomalení růstu a naopak stoupající BMI je typické pro těžkou nekompenzovanou primární hypotyreózu, Cushingův syndrom a deficit růstového hormonu. Klinické vyšetření již může vést k podezření na endokrinopatii (např. cushingoidní habitus; myxedém nebo struma u hypotyreózy; kožní a podkožní kalcifikace, zkrácené IV. metakarpy a metatarzy u PHP Ia).(1,2,4,6,7)
Upozorňujeme na atrofické formy CLT, kdy struma není hmatná a tyto děti proto většinou přichází již s těžkými symptomy hypotyreózy včetně poruchy růstu (obr. 1 a 3). Po normalizaci hormonálních hladin dochází k růstové akceleraci, ale v peripubertálním období často vidíme současně rychlý nástup puberty s možným dopadem na nižší finální výšku dítěte.
Obezita u dětí s CS nemusí mít typicky abdominální charakter, ale může být generalizovaná (obr. 4). V dětství a adolescenci můžeme pacienty zachytit ve fázi plně rozvinutého obrazu CS nebo v iniciální fázi onemocnění s neúplně vyjádřeným klinickým obrazem. Zpomalení růstu a vývoj měsícovitého obličeje jsou prvními příznaky endogenního hyperkortizolismu (obr. 5 a 6). Podle našeho pozorování předchází vývoji měsícovitého obličeje zpomalení růstu, proto u dětí s růstovou retardací nejasné etiologie je třeba v diferenciální diagnóze zvažovat vývoj endogenního hyperkortizolismu. V diagnóze CS může pomoci fotodokumentace dítěte potvrzující vývoj cushingoidního habitu v časovém období.(15)
Léčba RH vede k normalizaci tělesného složení s nárůstem svalové hmoty a svalové síly, proto u malých dětí s vrozeným deficitem RH vidíme současně posun v jejich psychomotorickém vývoji. U těžkého deficitu RH pokračujeme v léčbě po ukončení růstu z metabolické indikace.
U dítěte s časným vývojem obezity v kojeneckém věku je v diferenciální diagnóze třeba myslet na PHP Ia a pátrat po příznacích AHO a primární hypotyreóze (obr. 8, 9 a 10). Primární hypotyreóza bývá u PHP Ia většinou mírná s TSH do 10 mIU/l, ale z praxe upozorňujeme na možnost i významné elevace TSH. Časné stanovení diagnózy PHP Ia umožňuje také podchytit vývoj hypokalcemie, a zabránit tak život ohrožujícím hypokalcemickým křečím.
Anamnéza tumoru, operace, vývojové anomálie nebo radioterapie v oblasti hypotalamu je naopak suspektní z hypotalamické obezity. (1,2,4,5) Z praxe víme, že tento typ obezity lze obtížně ovlivnit. U dítěte s náhle vzniklou hyperfagií bychom měli na možnost hypotalamické obezity myslet a zvážit provedení magnetické rezonance mozku. Nezapomínejme, že malé nádory se mohou časně projevit pouze endokrinní poruchou bez nitrolební hypertenze.
Závěr
Pro prostou obezitu dítěte je typická pozitivní rodinná zátěž obezitou a zvýšené BMI většinou již od batolecího věku s postupnou progresí do obezity. Naopak náhle vzniklá a rychle progredující nadváha, obezita nebo změna v tělesném složení s úbytkem svalové a nadbytkem tukové tkáně může signalizovat přítomnost endokrinopatie. Kromě anamnézy a klinického vyšetření by lékaře k podezření na endokrinní poruchu měla vést současně přítomná růstová retardace, opožděná nebo předčasná puberta a předčasná pseudopuberta. Nezapomínejme na iniciální fáze onemocnění s chyběním plně rozvinutého obrazu endokrinopatie.
Korespondenční adresa:
doc. MUDr. Renata Pomahačová, Ph.D.
Dětská klinika FN a LF UK Plzeň
Alej Svobody 80
323 00 Plzeň
pomahacova@fnplzen.cz
Zdroje
- Lebl J, Al Taji E, Koloušková S, et al. Dětská endokrinologie a diabetologie. 1. vyd. Praha: Galén 2016.
- Stipančić G, Požgaj Šepec M. Secondary causes of obesity in children and adolescents. Central Eur J Paed 2018; 14(1): 1–11.
- Styne DM, Arslanian SA, Connor EL, et al. Pediatric obesity-assessment, treatment, and prevention: an Endocrine Society Clinical practice guideline. J Clin Endocrinol Metab 2017; 102(3): 709–757.
- Karam JG, McFarlane SI. Secondary causes of obesity. Therapy 2007; 4(5): 641–650.
- Crocker MK, Yanovski JA. Pediatric obesity: etiology and treatment. Pediatr Clin North Am 2011; 58(5): 1217–41.
- Mason K, Page L, Balikcioglu PG. Screening for hormonal, monogenic, and syndromic disorders in obese infants and children. Pediatr Ann 2014; 43(9): e218–e224.
- Pomahačová R., Kalvachová B. Dětská endokrinologie do kapsy. 3. vyd. Praha: Maxdorf 2021.
- Stratakis CA. An update on Cushing syndrome in pediatrics. Ann Endocrinol (Paris) 2018; 79(3): 125–131.
- Storr HL, Alexandraki KI, Martin L, et al. Comparisons in the epidemiology, diagnostic features and cure rate by transsphenoidal surgery between paediatric and adult-onset Cushing’s disease. Eur J Endocrinol 2011; 164(5): 667–74.
- Savage MO, Storr HL, Chan LF, et al. Diagnosis and treatment of pediatric Cushing’s disease. Pituitary 2007; 10(4): 365–71.
- Savage MO, Storr HL. Pediatric Cushing’s disease: Management Issues. Indian J Endocrinol Metab 2012; 16(2): 171–5.
- Oliveira EM, Keogh JM, Talbot F, et al. Obesity-associated GNAS mutations and the melanocortin pathway. N Engl J Med 2021; 385(17): 1581 – 1592.
- Bereket A, Kiess W, Lustig RH, et al. Hypotalamic obesity in children. Obes Rev 2012; 13(9): 780–98.
- Műller HL, Bueb K, Bartels U, et al. Obesity after childhood craniopharyngioma: German multicenter study on preoperative risk factors and quality of life. Klin Padiatr 2001; 213(4): 244–9.
- Pomahačová R. Cushingův syndrom v dětském věku. Čes-slov Pediat 2015; 70(3): 190–192.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo Supplementum 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (1): Syndromy spojené s vysokým vzrůstem
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (2): Nesyndromický vysoký vzrůst
- Endokrinní příčiny obezity v dětství a adolescenci
- Nesoulad rodu a pohlaví v dětství a adolescenci: současné názory a přístupy, situace v České republice
- První zkušenosti s dlouhodobě působícím růstovým hormonem
- Vážení kolegové, přátelé, pediatři z primární péče, z regionálních nemocnic i z klinik,
- Mystický Hagibor a jeho místo v historii české pediatrie
- Minipuberta – významné a dosud opomíjené období pohlavního vývoje
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Minipuberta – významné a dosud opomíjené období pohlavního vývoje
- První zkušenosti s dlouhodobě působícím růstovým hormonem
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (1): Syndromy spojené s vysokým vzrůstem
- Nesoulad rodu a pohlaví v dětství a adolescenci: současné názory a přístupy, situace v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



