-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Minipuberta – významné a dosud opomíjené období pohlavního vývoje
Minipuberty – an important and still neglected period of sexual development
Minipuberty is defined as temporary postnatal activation of the hypothalamic-pituitary-gonadal (HPG) axis. The HPG axis is triggered three times during lifetime. The first time in the middle of gestation, when it participates in the development and maturation of the sex glands. This is followed by the so-called minipuberty, which begins a few days after birth and lasts 4-6 months in boys and 2-4 years in girls. After the „hormonally sillent“ childhood comes classical sexual adolescence with the development of secondary sexual signs in the second decade of life and is completed by a complete maturation of the sex glands allowing future reproduction. The existence of mini-puberty has been known for almost 50 years, but its full meaning is still not clarified. Levels of sex hormones reach almost to the values of adult individuals during this period. In boys, the penis grows, testes increase in size, in which germ cells proliferate, in girls, estradiol stimulates the growth of mammary glands and the maturation of ovarian follicles. The physiological course of minipuberty is essential for future sexual development and fertility. At the same time, this period is several months‘ „window of opportunity“ of establishing a diagnosis of some congenital disorders of sexual development. In boys with hypogonadotropic hypogonadism, as well as with the possibility of early treatment. The clinical implications of minipuberty in premature babies and infants born young for their gestational age deserve special attention. Minipuberta is considered a real predicition of future sexual development.
Keywords:
estradiol – Luteinizing hormone – testosterone – Minipuberty – hypothalamic-pituitary-gonadal axis – follicle-stimulating hormone – diagnostic window
Autoři: Zapletalová Jiřina
Působiště autorů: Dětská klinika, Lékařská fakulta Univerzity Palackého a FN Olomouc
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (Supplementum 3): 5-10.
Kategorie: Souborný referát
doi: https://doi.org/10.55095/CSPediatrie2022/052Souhrn
Minipuberta je definována jako dočasná postnatální aktivace hypotalamo-hypofyzo-gonadální (HPG) osy. Ke spuštění činnosti HPG osy dochází během života celkem třikrát. Poprvé v polovině gestace, kdy se podílí na vývoji a na dozrávání pohlavních žláz. Následuje tzv. minipuberta, která začíná několik dnů po narození a trvá u chlapců 4–6 měsíců a u dívek 2–4 roky. Po „hormonálně klidovém“ dětství přichází klasické pohlavní dospívání s rozvojem sekundárních sexuálních znaků ve druhé dekádě života a je zakončeno kompletní maturací pohlavních žláz umožňující budoucí reprodukci. Existence minipuberty je známa téměř 50 let, ale stále není objasněn její úplný význam. Hladiny pohlavních hormonů dosahují v tomto období téměř k hodnotám dospělých jedinců. U chlapců roste penis, zvětšují se testes, v nichž proliferují zárodečné buňky, u dívek estradiol stimuluje růst prsních žláz a zrání ovariálních folikulů. Fyziologický průběh minipuberty je významný pro budoucí pohlavní vývoj a fertilitu. Toto období je současně několikaměsíčním „oknem příležitosti“ stanovení diagnózy některých vrozených poruch pohlavního vývoje. U chlapců s hypogonadotropním hypogonadismem i s případnou možností včasné léčby. Zvláštní pozornost zasluhují klinické dopady průběhu minipuberty u předčasně narozených dětí a dětí narozených malých na svůj gestační věk. Minipuberta je považována za reálný „předobraz“ budoucího pohlavního vývoje.
Klíčová slova:
estradiol – testosterón – Minipuberta – hypotalamo-hypofyzo-gonadální osa – folikulostimulační hormon – luteinizační hormon – diagnostické okno
Úvod
Jako pubertu označujeme klasické pohlavní dospívání, které fyziologicky probíhá ve druhé dekádě života a je důsledkem aktivace hypotalamo-hypofyzo-gonadální (HPG) osy. V této době dochází v hypotalamu k postupnému zvyšování tvorby gonadotropin-releasing hormonu (GnRH – gonadoliberinu), který se váže na receptory v gonadotropních buňkách předního laloku hypofýzy. Ty produkují gonadotropiny: folikulostimulační hormon (FSH) a luteinizační hormon (LH) s afinitou k receptorům v pohlavních žlázách (v ovariích a ve varlatech), v nichž se tvoří pohlavní hormony a dozrávají zárodečné buňky. Puberta je zakončena kompletní maturací pohlavních žláz umožňující budoucí reprodukci. Tento složitý proces je ovlivňován několika desítkami genů. Před klasickou pubertou dochází k dočasné aktivaci HPG osy ještě dvakrát: poprvé během fetálního života, podruhé časně postnatálně.(1,2,3) Lidský jedinec tedy zažije za svůj život tři „endokrinní“ puberty (obr. 1). Předkládaný článek shrnuje dostupné základní informace o druhé (dočasné) endokrinní pubertě, zvané „minipuberta“, která byla poprvé popsána již v polovině 70. let,(1) ale její úloha dosud není zcela objasněna.
Obr. 1. Schematické znázornění tří období aktivace HPG osy. 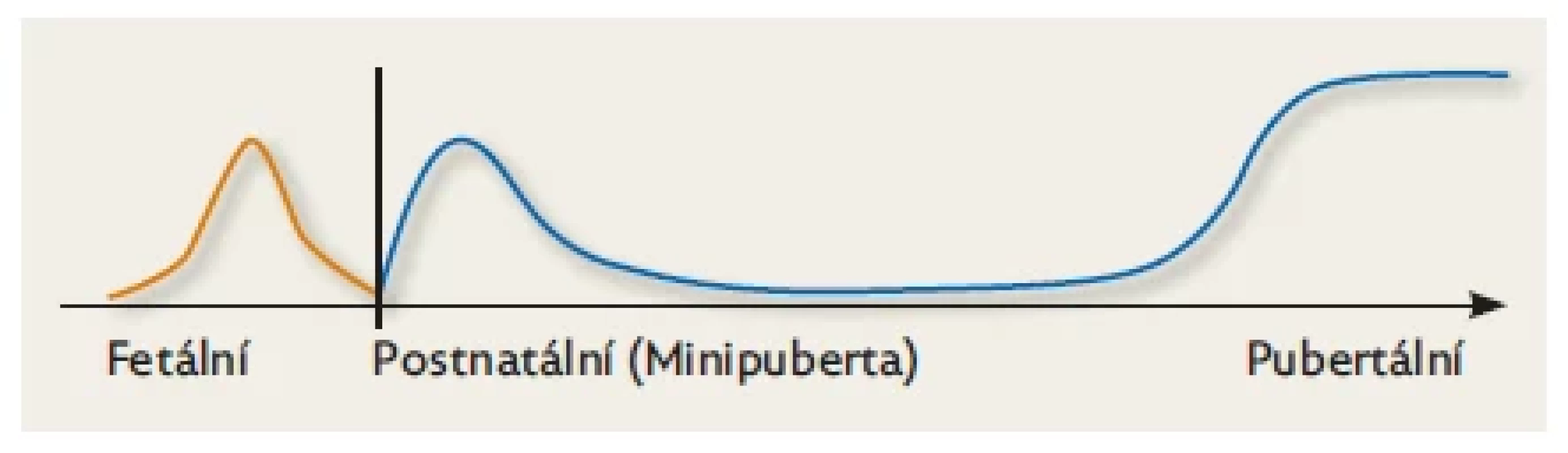
Během fetálního života je maximum aktivity HPG osy zhruba v polovině gestace a postupně se snižuje směrem k termínu porodu. Při narození je její činnost nízká, osa se reaktivuje během 1. týdne života a dosahuje vrcholu za 1–3 měsíce, potom postupně klesá a je nízká během dětství až do období očekávané puberty ve 2. dekádě života. Upraveno dle Kuiri-Hanninen et al. 2014.(9) Prenatální období (Fetální období)
Období pohlavní diferenciace
Jde o komplexní geneticky a hormonálně podmíněný proces, který začíná v 6. týdnu gestace. Do té doby jsou pohlavní žlázy indiferentní a embryo má vyvinuty jak Wolfovy vývody (základ mužského vnitřního genitálu), tak mulleriánské vývody (základ vnitřního genitálu ženského). Zásadní roli v diferenciaci pohlavních žláz hraje karyotyp (46,XY nebo 46,XX). Přítomnost genů v sex determinující oblasti na chromozomu Y (SRY) určuje osud primitivní gonády – diferenciaci v testis, nepřítomnost SRY určuje její vývoj ženským směrem. U chlapců vlivem placentárního choriového gonadotropinu (hCG) (nezávisle na FSH a LH) dochází k diferenciaci testikulární tkáně a produkci specifických hormonů: Leydigovy buňky produkují testosteron, který je metabolizován na aktivní dihydrotestosteron (DHT), Sertolliho buňky a anti-mulleriánský hormon (AMH). Vlivem testosteronu se mění Wolfovy vývody na mužský vnitřní genitál (epididymis, semenné váčky a duktus deferens), vazbou DHT na androgenní receptory v primordiálním urogenitálním sinu směřuje vývoj zevního genitálu mužským směrem. Působením AMH regredují mulleriánské vývody. Testosteron a AMH hrají tedy klíčovou roli v maskulinizaci zevního a vnitřního genitálu.(4,5)
U dívek dávají mulleriánské vývody základ ženskému vnitřnímu genitálu – vejcovodům, děloze a horní třetině pochvy a Wolfovy vývody za nepřítomnosti testosteronu regredují. Ovaria nemají ve vývoji vnitřního a zevního genitálu žádnou úlohu.(4,5)
Fetální HPG osa
GnRH neurony migrují z nazální plakody do hypotalamu během časné embryogeneze a jejich aktivita je regulována spoustou genů. HPG osa je aktivována až ve 2. trimestru a nahrazuje účinky placentárního hCG. U chlapců FSH stimuluje Sertolliho buňky a LH Leydigovy buňky. Dochází k růstu penisu, zvětšování varlat a v posledním trimestru gestace k jejich sestupu do skrota.(2,3,6) Sestup varlete z intraabdominální polohy do skrota je dokončen zhruba v 35. týdnu gestace a je androgen dependentní.(7)
U ženských plodů není úloha fetálních gonadotropinů při vývoji ovarií zcela jasná: estrogeny jsou převážně placentárního původu – stimulují již intrauterinně růst prsních žláz a dělohy.(2,3,7) Bylo prokázáno, že k vývoji folikulů dochází i u anencefalických plodů, ale při narození nedosahují velikosti folikulů u zralých plodů.(8)
Hladiny FSH a LH dosahují u obou pohlaví svého vrcholu zhruba v polovině gestace a postupně klesají až k naprosté supresi vysokou koncentrací placentárních estrogenů v době porodu (donošení novorozenci). U ženských plodů jsou hladiny gonadotropinů během fetálního období vyšší než u mužských plodů a současně je vyšší FSH než LH. U mužských plodů je tomu naopak (obr. 2 a 3).(3,8)
Obr. 2. Chlapci. Fyziologické hladiny FSH, LH a pohlavních hormonů během fetálního života a minipuberty. 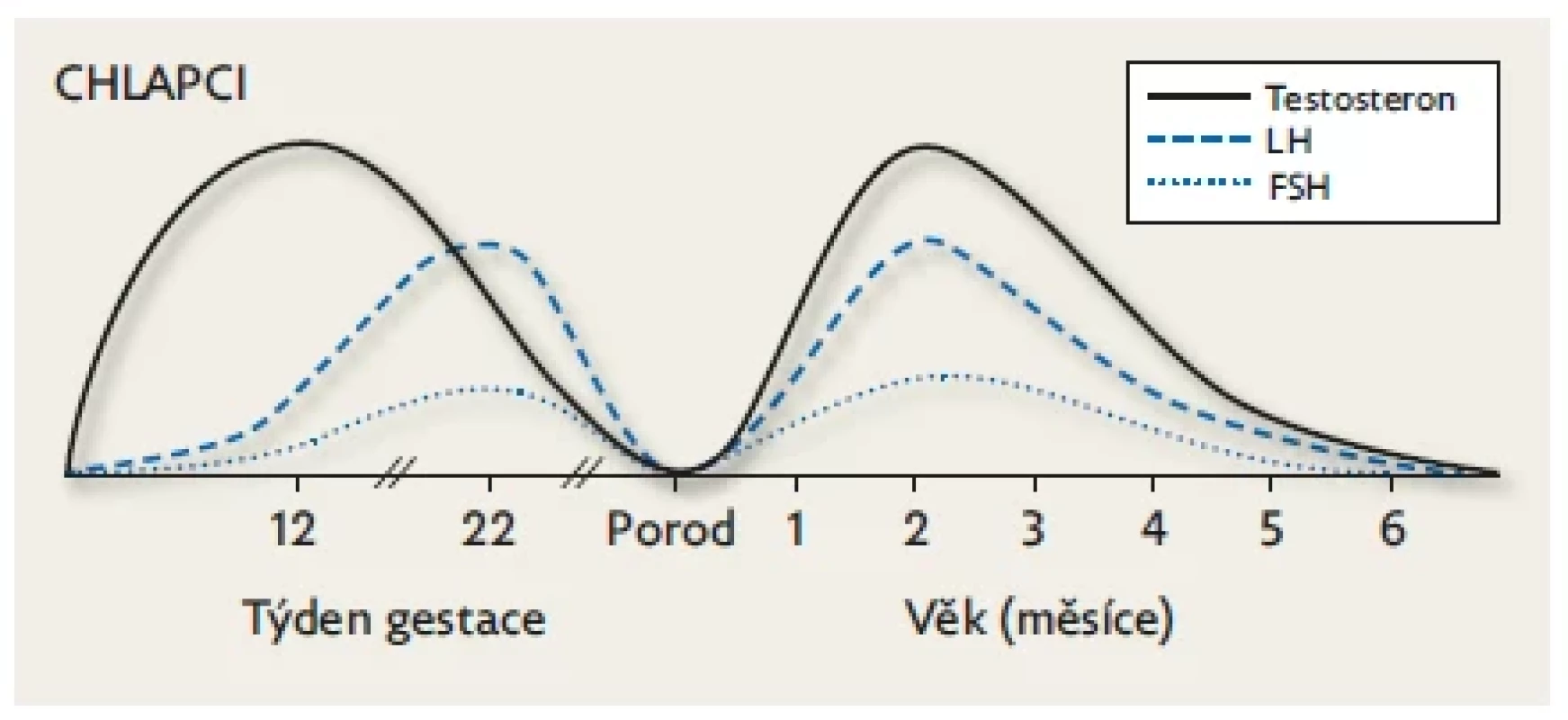
Na počátku nitroděložního života je tvorba testosteronu v gonádách stimulována placentárním hCG a po 9. týdnu gestace již endogenním LH produkovaným spolu s FSH v gonadotropních buňkách předního laloku hypofýzy. Hladiny gonadotropinů a testosteronu stoupají přibližně do poloviny gestace (v testes se objevují seminefrinní tubuly) a potom následuje jejich plynulý pokles až k termínu porodu (suprese stoupajícími hladinami placentárních estrogenů, které jsou nejvyšší v době porodu). Během minipuberty hodnoty FSH, LH a testosteronu stoupají k maximu v 1.–2. měsíci života. Po 6. měsíci následuje kompletní suprese osy až do počátku puberty. Upraveno podle Lanciotti et al. 2018.(10) Obr. 3. Dívky. Fyziologické hladiny FSH, LH a pohlavních hormonů během fetálního života a minipuberty. K aktivaci HPG osy u dívek dochází kolem 9. týdne gestace. 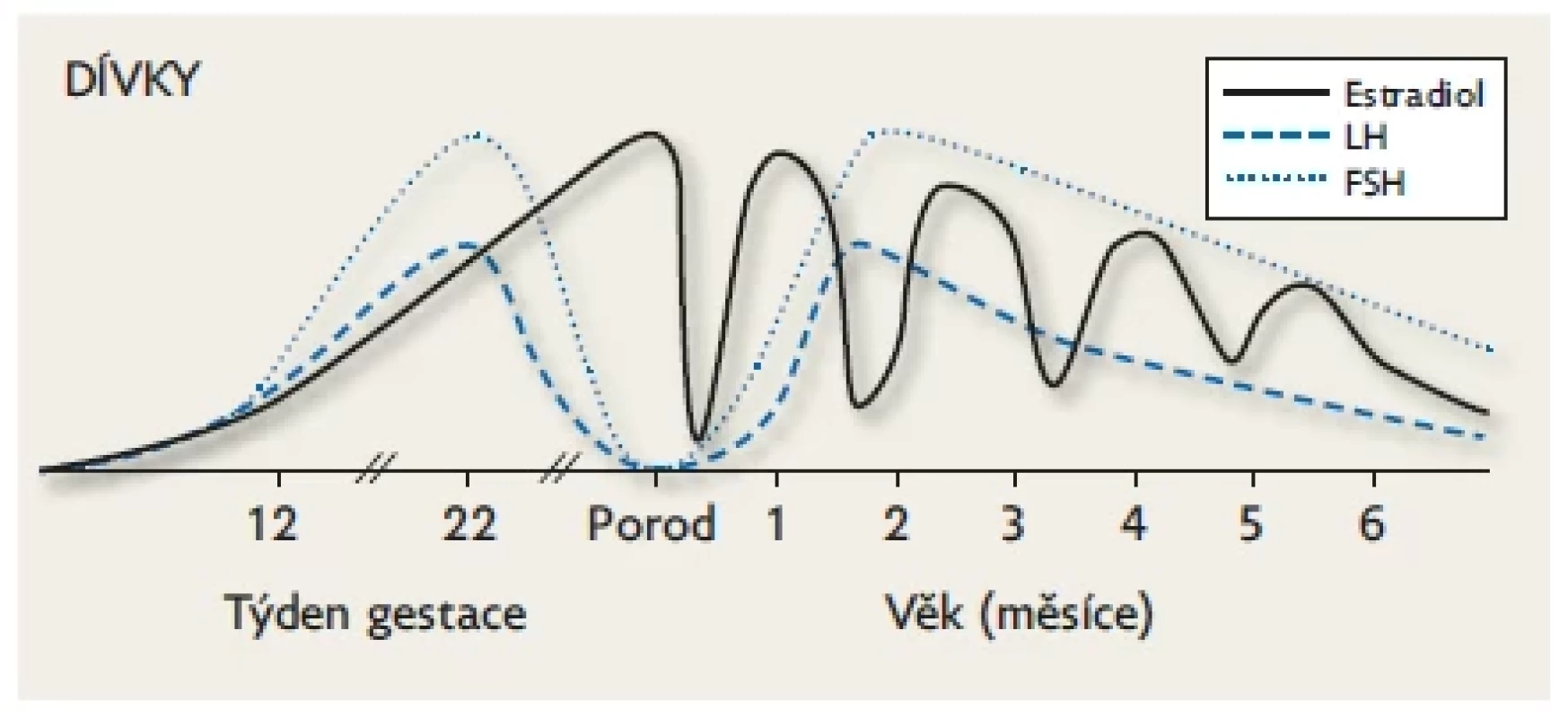
Hodnoty gonadotropinů jsou na vrcholu kolem 20. týdne (přítomnost ovariálních folikulů) a jsou mnohem vyšší než u chlapeckých plodů (zejména FSH), protože produkce estrogenů v ovariích je minimální. Veškeré estrogeny jsou placentárního původu. Následuje pozvolný pokles FSH a LH až k nedetekovatelným hodnotám v době termínu porodu (suprese stoupajícími hladinami placentárních estrogenů, které jsou nejvyšší v době porodu). Po narození se zvyšuje FSH, LH a estradiol do 2. měsíce věku a potom následuje pozvolný pokles FSH a LH s fluktuující hladinou estradiolu až do 18. měsíce věku. Hladiny FSH jsou u dívek daleko vyšší než hladiny LH v prenatálním období i během minipuberty a k prepubertálním hodnotám klesají až mezi 3. a 4. rokem. Upraveno podle Lanciotti et al. 2018.(10) Postnatální období (minipuberta)
Postnatální tranzitorní aktivace HPG osy začíná brzy po narození a je také známa jako „druhá endokrinní puberta“ nebo „minipuberta“. Byla poprvé popsána v r. 1973 lyonskou endokrinoložkou Madelong Forestovou u jedinců mužského pohlaví.(1) Po porodu dochází u novorozence k přerušení cirkulace placentárních hormonů, jejich clearance z oběhu, a tím během několika dnů k reaktivaci vlastní HPG osy.(9–11)
Donošení novorozenci
U zdravých donošených novorozenců obou pohlaví jsou hladiny FSH a LH v pupečníkové krvi nízké inhibičním vlivem placentárních estrogenů a začínají se výrazně zvyšovat již několik hodin po narození. Svého vrcholu dosahují mezi 1. a 3. měsícem a potom postupně klesají. Odlišný trend (tzv. sexuální dimorfismus) byl zaznamenán u chlapců a u dívek.(9–12)
U chlapců jsou hladiny LH vyšší než FSH a dosahují dolní normy pubertálních hladin (obr. 2). Vlivem LH se ve varlatech zvyšuje počet Leydigových buněk, a tím i sekrece testosteronu až k hodnotám fertilních mužů. Od 3. měsíce podléhají fetální Leydigovy buňky apoptóze. Sertolliho buňky se působením FSH sice replikují, ale neexprimují androgenní receptor (AR), takže nedochází k jejich úplné maturaci. Produkuji AMH a inhibin B.(13) V důsledku proliferace Sertolliho, Leydigových buněk a seminefrinních tubulů dochází klinicky k přechodnému mírnému zvětšení objemu varlat (v průměru z 0,27 ml na 0,44 ml), které je patrné zejména při ultrazvukovém vyšetření a pozitivně koreluje s hladinou FSH.(14) Vzestup testosteronu má vliv na růst penisu zejména během prvních tří měsíců života (cca +1 mm/ měsíc), dochází k jeho erekcím, skrotum je prosáknuté a pigmentované.(15) Ke kožním projevům patří mírné ochlupení genitálu a hypertrofie mazových žláz s akné. Pokles hormonálních hladin k prepubertálním hodnotám je patrný od 4. měsíce života, současně ustupují výše popsané klinické příznaky.(12) U chlapců bylo jednoznačně prokázáno, že vliv postnatální tranzitorní aktivace HPG osy se úzce váže k jejich budoucí reprodukční funkci. Výsledky longitudinální studie skandinávských autorů z r. 2022 potvrdily u 259 mužů ve věku 18–20 let, že výše hladiny testosteronu a poměr testosteron/LH v prvních 3 měsících života jsou významnými prediktory budoucí fertility (počet a motilita spermií).(16) Výše postnatální hladiny testosteronu je rovněž spojena s chováním mužského typu již v batolecím období, což naznačuje roli postnatálních androgenů v neurobehaviorálním vývoji.(17)
U dívek je situace odlišná: sekrece gonadotropinů během minipuberty napodobuje sexuální dimorfismus sekrece gonadotropinů během druhé poloviny gestace. Tvorba FSH je během prvních tří měsíců vyšší než LH, který klesá podobně jako u chlapců během 4.–6. měsíce života, zatímco FSH přetrvává stabilně zvýšený až do období 3. a 4. roku života (obr. 3). Estradiol, který je v pupečníkové krvi u obou pohlaví vysoký (placentární a maternální zdroj), během prvních dnů po porodu klesá, tím dochází k uvolnění zpětné vazby a vlivem prudkého vzestupu gonadotropinů stoupá u dívek jeho endogenní (ovariální) produkce. Kolem 3. měsíce života mohou hladiny estrogenů kolísat v důsledku cyklické maturace a atrofie ovariálních folikulů.(12) Volum ovarií stoupá zhruba šestinásobně až do 16. týdne života. Velké antrální folikuly mohou být patrny při USG vyšetření, často imitují ovariální cysty.(12,18) Estrogeny stimulují cílové tkáně – prsní žlázy a dělohu. Při narození je u obou pohlaví možno palpovat zvětšené prsní žlázy. Jde o důsledek intrauterinní stimulace placentárními estrogeny. U chlapců během několika měsíců regredují, ale u dívek se mohou vlivem endogenní sekrece estradiolu prsní žlázy zvětšovat a persistovat až do 2 let věku.(12,19)
Studie dánských autorů z r. 2018, která hodnotila hormonální profil u kohorty 1870 zdravých donošených dětí během minipuberty, prokázala, že k významným projevům sexuálního dimorfismu patří hladina AMH (u chlapců 100násobně vyšší než u dívek) a testosteronu (10násobek). Neméně důležitý ukazatel rozdílu mezi pohlavími je poměr LH/FSH. U chlapců dosahuje medián této hodnoty 1,4 (rozmezí 0,5 až 3,98), zatímco u dívek 0,02 (rozmezí 0,01 až 0,14). Nejvyšší hodnoty byly u jedinců mužského pohlaví mladších 3,5 měsíce věku, u starších dochází k postupnému poklesu v průměru o 11 % za měsíc.(12)
Kromě aktivní produkce testikulárních androgenů se některé slabší androgenní steroidy, zejména dehydroepiandrosteron (DHEA), jeho sulfátový konjugát (DHEAS) a androstendion, tvoří u obou pohlaví během prvních postnatálních měsíců v involuční fetální zóně kůry nadledvin. Tyto hormony mají sice malý androgenní potenciál, ale mohou být přeměněny na silné androgeny v periferních cílových tkáních (kůže). Androgenní kožní projevy, jako je hypertrofie mazových žláz a akné, jsou běžnými nálezy během prvních měsíců života.(20)
Předčasně narozené děti
Hladiny FSH a LH jsou u předčasně narozených dětí v pupečníkové krvi vyšší než u donošených novorozenců v důsledku náhlého přerušení fetální aktivity HPG osy, která fyziologicky klesá až v posledním trimestru gravidity. Po porodu se ale stejně jako u zralých novorozenců odblokuje absencí placentálních estrogenů zpětná vazba, a tím u nich přetrvává kumulativní hladina gonadotropinů vyšší (obr. 4). Kuiri-Hanninenová se spolupracovníky popsala zvýšené hladiny LH a testosteronu u předčasně narozených chlapců ve srovnání s donošenými a pozitivní korelaci mezi aktivací HPG osy a stupněm nezralosti.(21) U předčasně narozených dívek je na rozdíl od chlapců extrémně vysoká hladina FSH způsobená pozdější maturací negativní zpětné vazby v důsledku nezralosti ovariální tkáně a u těžce nezralých děvčátek může způsobit až ovariální hyperstimulační syndrom, který byl poprvé popsán Sedinem v r. 1985.(22,23) Klinicky se projevuje solitárními nebo mnohočetnými ovariálními cystami, edémem vulvy, růstem prsních žláz a vaginálním krvácením. Nevyžaduje žádnou léčbu, spontánně ustoupí během několika týdnů. FSH začíná klesat v době původního termínu porodu a postnatálně časově kopíruje snižování aktivity HPG osy donošených děvčátek. Tato změna se spojuje se zráním ovariálních folikulů a zvýšením hladin AMH a estradiolu, což podporuje tvrzení že činnost HPG osy je vývojově regulována.(22)
Obr. 4. Rozdíly v postnatální aktivitě HPG u donošených a předčasně narozených dětí. 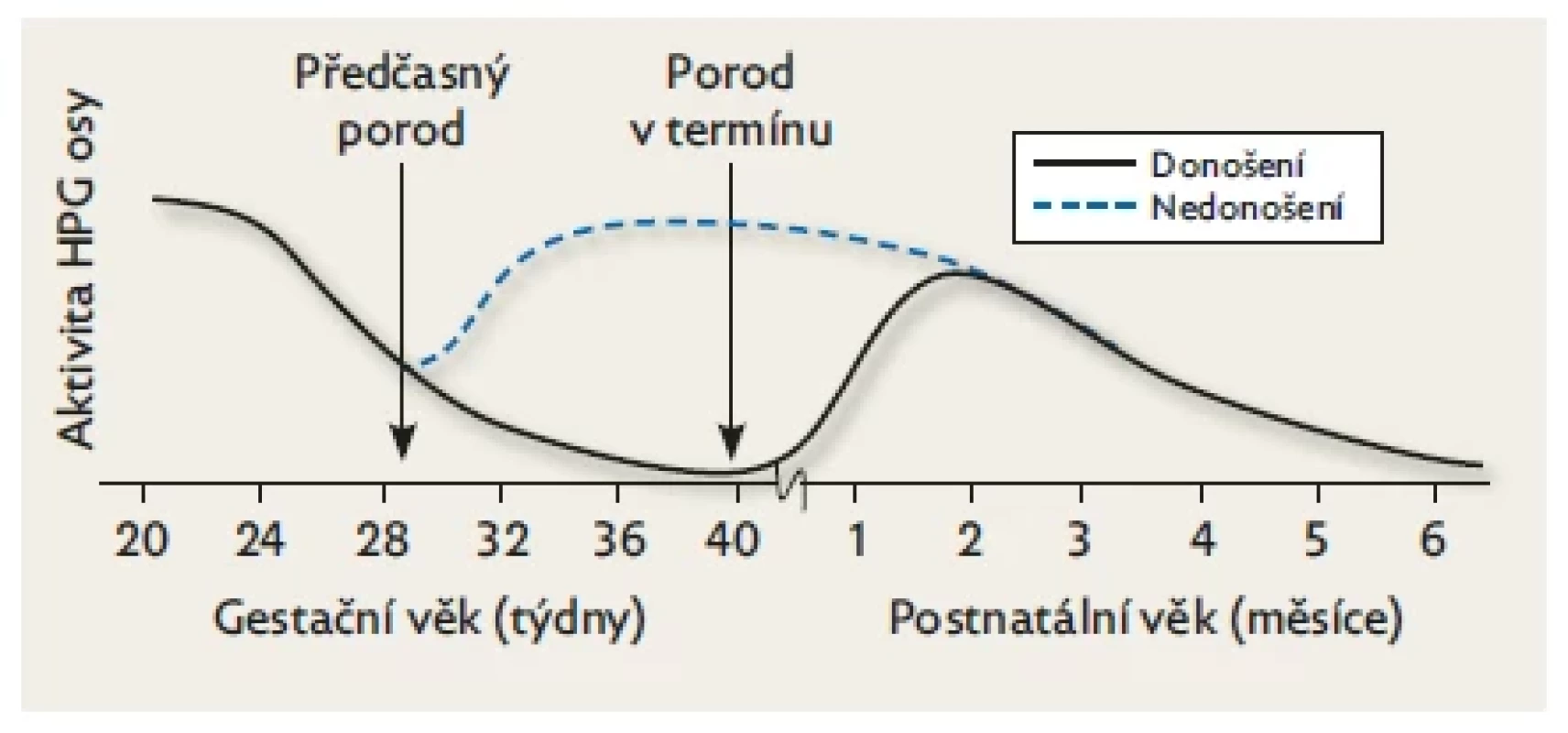
Aktivita fetální hypofýzy je nejvyšší v polovině gestace a klesá směrem k termínu porodu. Hladiny gonadotropinů v pupečníkové krvi jsou vyšší u předčasně narozených než u donošených dětí. Po narození vede absence placentárních estrogenů k reaktivaci HPG a hladiny gonadotropinů se u nich zvyšují významněji než u donošených. K poklesu dochází u nezralých dětí v době fyziologického termínu porodu, což potvrzuje skutečnost, že aktivita osy HPG je vývojově regulována. Upraveno podle Kuiri-Hanninen et al. 2014.(9) Klinické projevy aktivace HPG osy se u předčasně narozených dětí liší od donošených novorozenců. Estrogenní receptory v prsních žlázách jsou přítomny až od 30. týdne gestačního věku, což vysvětluje absenci palpovatelných prsních žláz těsně po narození u středně a těžce nezralých novorozenců obojího pohlaví. V rámci minipuberty jsou ale projevy aktivace HPG osy u nezralých dětí výraznější než u dětí porozených v termínu: u chlapců je patrný rychlejší růst penisu a varlat a u dívek je nápadnější zvětšení prsních žláz a růst dělohy.(21,22)
Děti narozené malé na svůj gestační věk (SGA)
Údaje o průběhu minipuberty u SGA jedinců nejsou jednoznačné. V největší prospektivní longitudinální studii z r. 2022 byly v tomto období u SGA kojenců mužského pohlaví popsány vyšší hladiny testosteronu, LH a vyšší poměr LH/FSH než u chlapců narozených s přiměřenou délkou a hmotností na svůj gestační věk (AGA).(24) U SGA dívek byly nalezeny vyšší hladiny estradiolu a LH. Nálezy byly statisticky významnější u SGA předčasně narozených.(21,22,24) Přechozí studie uváděly jak vyšší hladiny, tak i nižší hladiny FSH u SGA dětí obou pohlaví ve srovnání s AGA. Tyto nálezy bývaly dávány do souvislosti s poruchami fertility.(25,26) Z uvedeného je ale obtížné vyvodit jednoznačné závěry s ohledem na malé počty probandů a užití odlišných a často nesrovnatelných analytických metod. Je potvrzeno, že SGA děti mají zvýšené riziko vzniku metabolických a endokrinních onemocnění (snížená citlivost na inzulin, časný nástup dospívání, u žen hyperandrogenní stavy a anovulační cykly…).(27,29) K ověření skutečnosti, že SGA děti vykazují významnější hormonální změny během minipuberty oproti AGA, a tím si nesou potenciální důsledky pro budoucí život, jsou nutné další kontrolované studie na větším počtu dětí.
Děti s poruchami pohlavního vývoje
Postnatální aktivace HPG osy byla studována i u pacientů s poruchami pohlavního vývoje. V období minipuberty se během prvních měsíců života nabízí možnost včasné diagnostiky nejen různých forem hypogonadismu, ale i některých poruch sexuální diferenciace, a to ještě před nástupem klasického pohlavního dospívání. Vzorce hormonální tvorby (FSH, LH, AMH, testosteron, estradiol) jsou v období minipuberty a v období klasické puberty totožné, a jak již bylo zmíněno, vykazují významný rozdíl mezi pohlavími.(12) V případě narození dítěte s odlišným vzhledem genitálu (u chlapců kryptorchismus, mikropenis, závažná hypospadie; u dívek virilizace zevního genitálu…), ev. při podezření na genetické syndromy spojené s poruchou pohlavního vývoje (Praderův–Williho, Turnerův…) je možné využít tohoto „diagnostického okna“ k vyšetření spontánní hormonální sekrece a udělat tak první významný krok k určení gonadálního pohlaví, stanovení diagnózy hypogonadismu nebo poruch sexuální diferenciace a částečně predikovat, jak bude pohlavní vývoj jedince probíhat za dalších více než 10 let (věk nástupu očekávané puberty).(11,29,31)
U novorozených chlapců s oboustranným kryptorchismem je těžké rozlišit, zda jde o anorchii, nebo intraabdominálně uložená testes. U anorchie jsou v důsledku nefunkční testikulární tkáně (syndrom testikulární regrese) vysoké hladiny FSH a LH a nízká hladina testosteronu, zatímco u vrozeného hypogonadotropního hypogonadismu (HH), který se často prezentuje nesestouplými varlaty a mikropenisem (u 25 % pacientů), jsou nízké všechny tři parametry. HH může být izolovaný, ale i kombinovaný s chyběním jiných hypofyzárních hormonů (TSH, ACTH, STH). U těchto pacientů bývá často protrahovaný ikterus a jsou vystaveni riziku těžké hypoglykemie. U prosté oboustranné retence testes vykazuje hormonální profil přiměřené zvýšení gonadotropinů a testosteronu ve srovnání s jedinci stejného gestačního věku.(31,32) U převážné většiny dívek s Turnerovým syndromem je typická gonadální dysgeneze s hypergonadotropním hypogonadismem, který je možno predikovat již v časném postnatálním období na základě nápadně vysoké hladiny FSH a LH.(33)
Minipuberta je tedy „diagnostickým oknem“ pro včasné rozpoznání některých vrozených poruch pohlavního vývoje, zejména HH u chlapců. V poslední době je považována i za možné „terapeutické okno“, kdy se podáváním gonadotropinů napodobuje fyziologická minipuberta se stimulací Sertolliho a Leydigových buněk a zvyšováním hladiny testosteronu. Bezprostředním klinickým dopadem je růst penisu, zvětšování varlat a jejich případný sestup do skrota a jednoznačné pozitivní ovlivnění budoucí fertility.(34,35)
Minipuberta a tělesný růst
Četné populační studie prokázaly, že v prvním půl roce života je tělesný růst a nárůst svalové hmoty odlišný u chlapců a u dívek.(36) Kivirnata se spolupracovníky zhodnotili přesné načasování a míru tohoto sexuálního dimorfismu u více než 18 000 dětí a potvrdili hypotézu, že nejvyšší rozdíl v růstové rychlosti (RR) byl ve věku 1–2 měsíce spolu s vrcholem postnatální aktivace HPG osy, s významnou korelací s hladinami testosteronu. Pohlavní steroidy sice ovlivňují růst prostřednictvím osy růstový hormon – inzulinu podobní faktor 1 (GH – IGF-1), ale mají pravděpodobně i přímé účinky na růstovou ploténku prostřednictvím androgenních receptorů. Zde dochází k aromatizaci androgenů typu testosteronu (C19) na estrogeny, které se na regulaci tělesného růstu významně podílejí.(37) Tento nález částečně objasňuje novou biologickou extragonadální roli minipuberty. Výsledky studie potvrzuje skutečnost, že chlapci s vrozeným izolovaným HH rostou v časném postnatálním období pomaleji než zdraví jedinci a naopak svou RR vyrovnávají, pokud jsou jim v rámci terapeutického okna podávány gonadotropiny nebo testosteron.(38)
Závěr
I přes četné studie věnující se prenatální a postnatální regulaci činnosti HPG osy stále není plně objasněn význam „druhé endokrinní puberty“ (minipuberty). V kontextu teorie peri - a postnatálního programování je fyziologický průběh minipuberty považován za důležitý pro budoucí reprodukční zdraví, tělesný růst i neurobehaviorální vývoj.(39) Zvláštní pozornost a další výzkum si zaslouží předčasně narozené a SGA děti, u kterých je HPG osa v tomto období aktivována výrazněji a déle. Biologická role této hyperaktivity pro budoucí život zůstává dosud nejasná. Hormonální změny provázející minipubertu jsou jednoznačně rozdílné mezi pohlavími. Tento sexuální dimorfismus dává možnost využít unikátní několikaměsíční okno pro stanovení včasné diagnózy u jedinců s podezřením na poruchu pohlavního vývoje a u některých typů chlapeckých hypogonadismů i možnost terapeutického zásahu ke zlepšení budoucí fertility. Zatím nebyla nalezena odpověď na otázku, proč se osa na konci minipuberty spontánně „vypne“ a zůstává nečinná přibližně jednu dekádu až do období klasické puberty.
Korespondenční adresa:
doc. MUDr. Jiřina Zapletalová, Ph.D.
Dětská klinika LF UP a FNO
I. P. Pavlova 6
775 20 Olomouc
jirina.zapletalova@fnol.cz
Zdroje
- Forest MG, Cathiard AM, Bertrand JA. Evidence of testicular activity in early infancy. J Clin Endocrinol Metab 1973; 37(1): 148–151.
- Winter JS, Faiman C, Hobson WC, et al. Pituitary-gonadal relations in infancy. Patterns of serum gonadotropin concentrations from birth to four years of age in man and chimpanzee. J Clin Endocrinol Metab 1975; 40(4): 545–551.
- Kaplan SL, Grumbach MM. Pituitary and placental gonadotrophins and sex steroids in the human and sub-human primate fetus. Clinics Endocrinol Metab 1978; 7(3): 487–511.
- Hughes IA. Minireview: Sex differentiation. Endocrinology 2001; 142(8): 3281–3287.
- MacLaughlin DT, Donahoe PK. Sex determination and differentiation. N Engl J Med 2004; 350(4): 367–378.
- Takagi S, Yoshida T, Tsubata K, et al. Sex differences in fetal gonadotropins and androgens. J Steroid Biochem 1977; 8(5): 609–620.
- Virtanen HE, Cortes D, Rajpert-De Meyts E, et al. Development and descent of the testis in relation to cryptorchidism. Acta Pædiatrica 2007; 96(5): 622–627.
- Baker TG, Scrimgeour JB. Development of the gonad in normal and anencephalic human fetuses. J Reprod Fertil 1980; 60(1): 193–199.
- Kuiri-Hänninen T, Sankilampi U, Dunkel L. Activation of the hypothalamic - -pituitary-gonadal axis in infancy: minipuberty. Horm Res Paediatr 2014; 82(2): 73–80.
- Lanciotti L, Cofini M, Leonardi A, et al. Up-to-date review about minipuberty and overview on hypothalamic-pituitary-gonadal axis activation in fetal and neonatal life. Front Endocrinol (Lausanne) 2018; 23(9): 410.
- Bizzarri C, Cappa M. Ontogeny of hypothalamus-pituitary gonadal axis and minipuberty: an ongoing debate? Front Endocrinol 2020; 11 : 187.
- Johannsen TH, Main KM, Ljubicic ML, et al. Sex differences in reproductive hormones during mini-puberty in infants with normal and disordered sex development. J Clin Endocrinol Metab 2018; 103(8): 3028 – 3037.
- Busch AS, Ljubicic ML, Upners EN, et al. Dynamic changes of reproductive hormones in male minipuberty: temporal dissociation of Leydig and Sertoli cell activity. J Clin Endocrinol Metab 2022; 107(6): 1560 – 1568.
- Kuijper EA, van Kooten J, Verbeke JI, et al. Ultrasonographically measured testicular volumes in 0-to 6-year-old boys. Hum Reprod 2008; 23(4): 792–796.
- Boas M, Boisen KA, Virtanen HE, et al. Postnatal penile length and growth rate correlate to serum testosterone levels: a longitudinal study of 1962 normal boys. Eur J Endocrinol 2006; 154(1): 125–129.
- Henriksen LS, Petersen JH, Skakkebæk NE, et al. Serum testosterone levels in 3-month-old boys predict their semen quality as young adults. J Clin Endocrinol Metab 2022; 107(7): 1965–1975.
- Hines M, Spence DR, Kung KTF, et al. The early postnatal period, mini - -puberty, provides a window on the role of testosterone in human neurobehavioural development. Curr Opin Neurobiol 2016; 38 : 69–73.
- Chin HB, Baird DD, Kaplan SL, et al. Characterization of ovarian development in girls from birth to 9 months. Paediatr Perinat Epidemiol 2021; 38 : 75–82.
- Kuiri-Hänninen T, Haanpää M, Turpeinen U, et al. Postnatal ovarian activation has effects in estrogen target tissues in infant girls. J Clin Endocrinol Metab 2013; 98(12): 4709–4716.
- Kuiri-Hänninen T, Haanpää M, Turpeinen U, et al. Transient postnatal secretion of androgen hormones is associated with acne and sebaceous gland hypertrophy in early infancy. J Clin Endocrinol Metab 2013; 98(1): 199 – 206.
- Kuiri-Hänninen T, Seuri R, Tyrväinen E, et al. Increased activity of the hypothalamic - Pituitary-Testicular axis in infancy results in increased androgen action in premature boys. J Clin Endocrinol Metab 2011; 96(1): 98–105.
- Kuiri-Hänninen T, Kallio S, Seuri R, et al. Postnatal developmental changes in the pituitary-ovarian axis in preterm and term infant girls. J Clin Endocrinol Metab 2011; 96(11): 3432–3439.
- Sedin G, Bergquist C, Lindgren PG. Ovarian hyperstimulation syndrome in preterm infants. Pediatr Res 1985; 19(6): 548–552.
- Pepe G, Calafiore M, Velletri MR, et al. Minipuberty in born small for gestational age infants: A case control prospective pilot study. Endocrine 2022; 76(2): 465–473.
- Ibáñez L, Valls C, Cols M, et al. Hypersecretion of FSH in infant boys and girls born small for gestational age. J Clin Endocrinol Metab 2002; 87(5):1986–1988.
- Nagai S, Kawai M, Myowa-Yamakoshi M, et al. Gonadotropin levels in urine during early postnatal period in small for gestational age preterm male infants with fetal growth restriction. J Perinatol 2017; 37(7): 843–847.
- Deng X, Li W, Luo Y, et al. Association between small fetuses and puberty timing: a systematic review and meta‐analysis. Int J Environ Res Public Health 2017; 14(11): 1377–1388.
- Tack LJW, van der Straaten S, Riedl S, et al. Growth, puberty and testicular function in boys born small for gestational age with a nonspecific disorder of sex development. Clin Endocrinol 2022; 96(2): 165–174.
- Renault CH, Højrup Ch, Aksglaede L, et al. Minipuberty of human infancy „A window of opportunity to evaluate hypogonadism and differences of sex development?“ Ann Pediat Endocrinol Metab 2020; 25(2): 84–91.
- Quinton R, Mamoojee Y, Jayasena CN, et al. Society for endocrinology UK guidance on the evaluation of suspected disorders of sexual development: emphasizing the opportunity to predict adolescent pubertal failure through a neonatal diagnosis of absent minipuberty. Clin Endocrinol 2016; 86(2): 305–306.
- Grumbach MM. A window of opportunity: the diagnosis of gonadotropin deficiency in the male infant. J Clin Endocrinol Metab 2005; 90(5): 3122–3127.
- Swee DS, Quinton R. Congenital hypogonadotrophic hypogonadism: minipuberty and the case for neonatal diagnosis. Front Endocrinol (Lausanne) 2019; 10 : 97. doi: 10.3389/fendo.2019.00097
- Ljubicic ML, Busch AS, Upners EN, et al. A biphasic pattern of reproductive hormones in healthy female infants: The COPENHAGEN Minipuberty Study. J Clin Endocrinol Metab 2022; 107(9): 2598–2605.
- Papadimitriop DT, Chrysis D, Nyktari G, et al. Replacement of male mini - -puberty. J Endocr Society 2019; 3(7): 1275–1282.
- Bougnères P, François M, Pantalone L, et al. Effects of an early postnatal treatment of hypogonadotropic hypogonadism with a continuous subcutaneous infusion of recombinant follicle-stimulating hormone and luteinizing hormone. J Clin Endocrinol Metab 2008; 93(6): 2202–2205.
- Davis SM, Kaar JL, Ringham BM, et al. Sex differences in infant body composition emerge in the first 5 months of life. J Pediatr Endocrinol Metab 2019; 32(11): 1235–1239.
- Kiviranta P, Kuiri-Hänninen T, Saari A, et al. Transient postnatal gonadal activation and growth velocity in infancy. Pediatrics 2016; 138(1): e20153561.
- Varimo T, Hero M, Laitinen EM, et al. Childhood growth in boys with congenital hypogonadotropic hypogonadism. Pediatr Res 2016; 79(5): 705–709.
- Lucaccioni L, Trevisani V, Boncompagni A, et al. Minipuberty: looking back to understand moving forward. Front Pediat 2021; 18(8): 612235. doi: 10.3389/fped.2020.612235
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo Supplementum 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (1): Syndromy spojené s vysokým vzrůstem
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (2): Nesyndromický vysoký vzrůst
- Endokrinní příčiny obezity v dětství a adolescenci
- Nesoulad rodu a pohlaví v dětství a adolescenci: současné názory a přístupy, situace v České republice
- První zkušenosti s dlouhodobě působícím růstovým hormonem
- Vážení kolegové, přátelé, pediatři z primární péče, z regionálních nemocnic i z klinik,
- Mystický Hagibor a jeho místo v historii české pediatrie
- Minipuberta – významné a dosud opomíjené období pohlavního vývoje
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Minipuberta – významné a dosud opomíjené období pohlavního vývoje
- První zkušenosti s dlouhodobě působícím růstovým hormonem
- Současný pohled na etiologii vysokého vzrůstu dětí a dospívajících (1): Syndromy spojené s vysokým vzrůstem
- Nesoulad rodu a pohlaví v dětství a adolescenci: současné názory a přístupy, situace v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



