-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce vyvolané Clostridioides difficile u dětských pacientů Fakultní nemocnice v Motole
Clostridioides difficile infection in children hospitalised in Motol University Hospital
Clostridioides difficile infections (CDI) are traditionally attributed to adults, but children can also be affected. In children, when indicated, laboratory diagnosis of CDI should be combined with testing for the presence of other gastrointestinal pathogens that are a common cause of diarrhoea, particularly in younger children. This was also confirmed in a cohort of 652 children with diarrhoea admitted to the Motol University Hospital, where 71 PCR positive tests for toxigenic C. difficile revealed another infectious cause in 33.8% (n = 24) by multiplex PCR. The detection of toxigenic C. difficile by PCR does not distinguish between colonisation and active infection, so the stool sample with a positive PCR test should be tested also for the presence of toxins A/B. Of the above 71 PCR-positive stools, 65 were further tested with the immunoenzymatic assay, and simultaneous positivity of C. difficile GDH and A/B toxins was detected only in 44.6% of stools (n = 24), but in almost half of these samples (n = 10), another infectious cause of diarrhoea was detected. In recurrent CDI, as in the first episode, emphasis should be placed on combined laboratory diagnostics to exclude co-infection with another intestinal pathogen or colonization with C. difficile. Compared with adult inpatients, available clinical data in children are limited and further prospective studies are needed to determine the prevalence of CDI and the efficacy of treatment regimens.
Keywords:
fidaxomicin – Epidemiology – Vancomycin – treatment – diagnostics – ribotyping – metronidazole
Autoři: Krůtová Marcela; Briksi Aleš; Dřevínek Pavel
Působiště autorů: Ústav lékařské mikrobiologie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (6): 340-344.
Kategorie: Původní práce
doi: https://doi.org/10.55095/CSPediatrie2022/060Souhrn
Infekce vyvolané Clostridioides difficile (CDI) jsou tradičně připisovány starším dospělým pacientům, ale mohou jimi být postiženy i děti. U dětí by v indikovaných případech měla být laboratorní diagnostika CDI kombinována s testováním přítomnosti dalších gastrointestinálních patogenů, které jsou hlavně u mladších dětí častou příčinou průjmu. To bylo potvrzeno i v kohortě 652 dětí s průjmem hospitalizovaných ve Fakultní nemocnici v Motole, kde u 71 PCR pozitivní testů na přítomnost toxigenního C. difficile byla u 33.8 % (n = 24) prokázána jiná infekční příčina pomocí multiplexového PCR. Průkaz toxigenního C. difficile pomocí PCR neodliší kolonizaci od aktivní infekce, tudíž pozitivní PCR test je nutné doplnit o stanovení přítomnosti toxinů A/B. Z výše uvedených 71 PCR pozitivních stolic bylo 65 dotestováno imunoenzymatickým testem a současná pozitivita C. difficile GDH a toxinů A/B byla detekována pouze u 44,6 % stolic (n = 24), ale u téměř poloviny těchto vzorků (n = 10) byla současně prokázána další infekční příčina průjmu. U recidivující CDI by měl být stejně jako u první epizody kladen důraz na kombinovanou laboratorní diagnostiku k vyloučení koinfekce jiným střevním patogenem, případně k vyloučení pouhé kolonizace C. difficile. V porovnání s dospělými hospitalizovanými pacienty jsou dostupná klinická data u dětí limitovaná a je zapotřebí dalších prospektivních studií pro stanovení prevalence CDI a účinnosti léčebných režimů.
Klíčová slova:
diagnostika – epidemiologie – léčba – fidaxomicin – vankomycin – ribotypizace – metronidazol
Úvod
Clostridioides (či Clostridium) difficile je grampozitivní anaerobní bakterie tvořící spory. Toxigenní kmeny C. difficile nesou gen(y) pro produkci toxinu(ů), a mohou tak produkovat různé spektrum toxinů (toxin A, toxin B, binární toxin). Vyskytují se ale i kmeny netoxigenní, které takovou genetickou výbavu nemají. Infekce vyvolané C. difficile (CDI) se mohou manifestovat jako „samoúzdravný“ průjem, gastroenteritida, pseudomembranózní kolitida, fulminantní kolitida, ileus nebo toxické megakolon.(1,2)
K přenosu C. difficile dochází fekálně orální cestou zpravidla prostřednictvím spor, jelikož živé buňky C. difficile jsou citlivé na přítomnost kyslíku, a proto v zevním prostředí nepřežívají. Spory jsou metabolicky neaktivní, jsou tedy rezistentní k antibiotikům a řadě dezinfekčních přípravků běžně používaných v nemocničních zařízeních. Zmíněná rezistence umožňuje přetrvávání spor v prostředí po řadu let a kontaminace nemocničního prostředí může hrát zásadní roli v šíření C. difficile.(3)
Rizikové faktory pro rozvoj CDI u dětí jsou podobné jako u dospělých s výjimkou vyššího věku. Obecně je patogeneze CDI spojována se změnou střevní mikroflóry, která způsobí tzv. ztrátu kolonizační rezistence. C. difficile kolonizuje sliznici střeva, kde se pomnoží a produkuje toxiny, které jsou zodpovědné za rozvoj infekce.(4) Nejčastějším faktorem, který se podílí na narušení složení střevní mikrobioty, je užívání antibiotik.(5) Změny ve složení střevní mikrobioty, které představují riziko pro rozvoj CDI, byly pozorovány také u jedinců s autoimunitními poruchami, alergiemi, rakovinou, diabetem a zánětlivým onemocněním střev.(6) Mezi další specifické populace se zvýšeným rizikem pro rozvoj CDI patří pacienti po transplantaci krvetvorných buněk (HSCT) nebo solidních orgánů či onkologičtí pacienti.(7–10)
V souladu s evropskými doporučeními je laboratorní diagnostika CDI založena na dvoustupňovém testovacím algoritmu, jelikož žádný dostupný test nemá sám o sobě dostatečně vysokou negativní a zároveň i pozitivní prediktivní hodnotu.(11) U mladších dětí je navíc nutné brát v úvahu relativně velkou pravděpodobnost kolonizace C. difficile, která je častá do dvou let věku, a také možnou koinfekci jiným střevní patogenem.(12) Podstatou PCR testu je detekce genů pro produkci toxinů; imunoenzymatické testy určují přítomnost glutamát dehydrogenázy (GDH) coby markeru přítomnosti C. difficile ve stolici a toxinů A/B (více viz kapitola Diagnostika).
Doporučení pro léčbu CDI u dětí byla zpracována Americkou pediatrickou akademií, Americkou společností pro epidemiologii ve zdravotnictví (SHEA) a Americkou společností pro infekční nemoci (IDSA).(13,14) Od publikování těchto doporučení byly dokončeny klinické studie, jejichž výsledky podporují nutnost tato doporučení revidovat.(15)
V následujícím textu shrnujeme současný stav poznání o infekcích vyvolaných C. difficile u pediatrické populace a současně předkládáme vlastní zkušenosti s diagnostikou a epidemiologií u dětských pacientů hospitalizovaných ve Fakultní nemocnici v Motole.
Epidemiologie
Od roku 2006 byl celosvětově zaznamenán nárůst incidence CDI u dospělých v souvislosti s rozšířením epidemickou linií C. difficile ribotypu 027. U dětí byl narůstající výskyt CDI hlášen ve Spojených státech amerických,(16,17) ale v Evropě nebyl stejně dramatický nárůst CDI u dětské populace jako u dospělých zaznamenán, jak mohou ilustrovat data z evropské multicentrické studie, byť pouze 1,5 % izolátů z 1196 izolátů C. difficile pocházelo od pacientů ve věku 2–18 let.(18)
Pro efektivní kontrolu šíření C. difficile v nemocničním prostředí je důležitým nástrojem typizace kmenů. Jednou z možných technik je ribotypizace, která je metodou doporučenou Evropským centrem pro prevenci a kontrolu infekcí (ECDC). Ribotypizace je na Ústavu lékařské mikrobiologie 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole (dále jen ÚLM) rutinně prováděna u všech kmenů C. difficile od roku 2009, sbírka zahrnuje již více než 6000 kmenů. V grafu na obrázku 1 jsou znázorněny nejčastější ribotypizační profily izolátů C. difficile kultivovaných ze vzorků stolic od dětských a dospělých pacientů FN v Motole.
Obr. 1. Distribuce ribotypů Clostridioides difficile kultivovaných ze stolic pacientů ve FN v Motole v období 2009–2022. 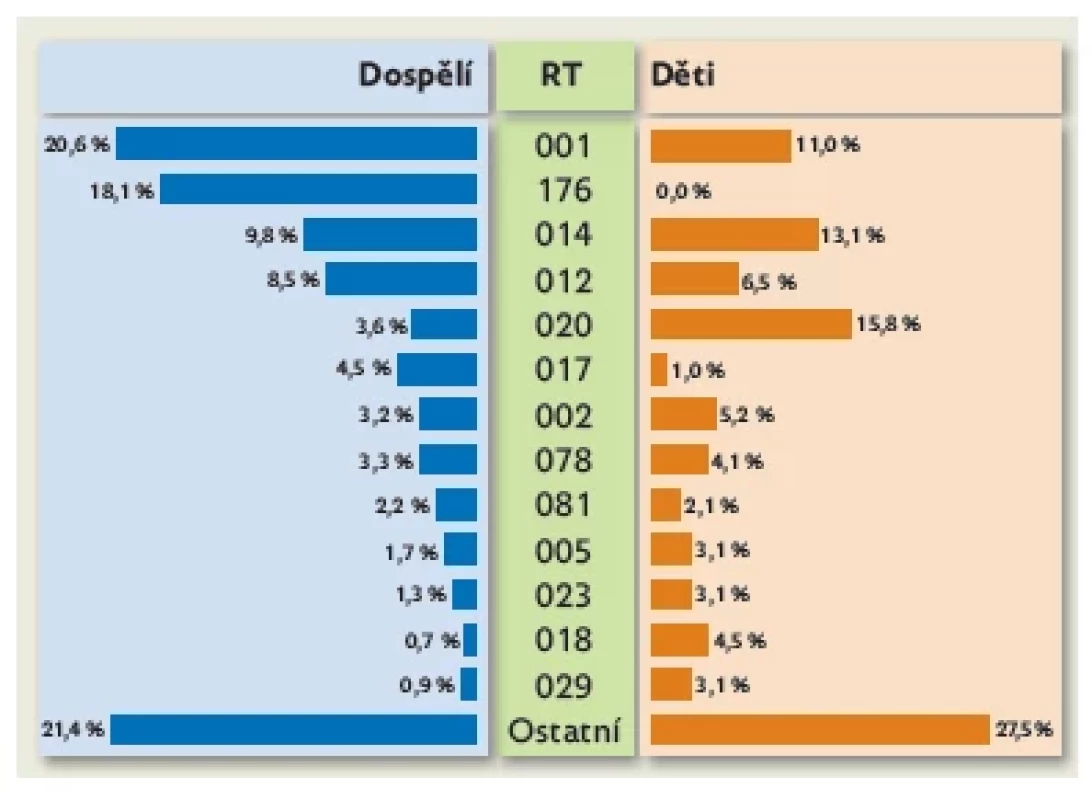
Dospělí: n = 1264, děti: n = 291. U pacientů s CDI v České republice dominují dva ribotypy, 001 a 176.(19) Jak je patrné z obrázku 1, C. difficile ribotyp 176, který je blízce příbuzný s celosvětově rozšířeným ribotypem 027, je ribotypem téměř výhradně se vyskytujícím u dospělých hospitalizovaných. Oproti tomu epidemický ribotyp 001 je zastoupený u obou populací, ale s vyšším procentuálním zastoupením u dospělých. Česká data jsou v souladu s evropskými, kdy CDI u dětí je převážně komunitní, epidemická linie ribotypu 027 se vyskytuje zřídka a převažují jiné ribotypy.( 20,21)
Diagnostika
Laboratorní vyšetření pro potvrzení CDI by mělo být indikováno u všech hospitalizovaných pacientů ve věku ≥ 2 roky, kteří měli během 24 hodin tři nebo více neformovaných stolic, tzn. stolic kopírující tvar kontejneru.(11,14) Indikace vyšetření u dětí ve věku ≤ 24 měsíců by mělo být prováděno ve specifických případech, jako je Hirschsprungova choroba nebo jiné závažné poruchy motility, průkaz pseudomembranózní kolitidy, toxické megakolon nebo klinicky významný průjem bez zjevné příčiny.(13,14) U pediatrické populace je třeba zvážit prostou kolonizaci C. difficile. Kolonizace toxigenním C. difficile se běžně vyskytuje u kojenců a mladších dětí. Studie zahrnující 338 dětí ve věku ≤ 2 roky ukázala, že míra prevalence kolonizace C. difficile je závislá na věku, neboť se zvyšuje do 11 měsíců věku a poté klesá.(21) Vzhledem k možné kolonizaci je tedy diagnostika CDI u dětí mladších dvou let zvláště při absenci rizikových faktorů velmi obtížná a vyžaduje pečlivý klinický úsudek.
Pro laboratorní potvrzení CDI není v současné době k dispozici komerční test s vysokou negativní a pozitivní prediktivní hodnotou, který by byl vhodný jako samostatný test pro potvrzení aktivní infekce. Z tohoto důvodu je Evropskou společností pro klinickou mikrobiologii a infekční lékařství (ESCMID) doporučený vícestupňový testovací algoritmus.(11) V prvním kroku je použitý citlivý vyhledávací test (detekce GDH) nebo PCR průkaz genů pro produkci toxinů. V případě pozitivního vyhledávacího testu je vzorek stolice vyšetřen na přítomnost vlastních toxinů A/B. Průkaz toxinů je testem s vysokou pozitivní prediktivní hodnotou, bohužel citlivost těchto komerčních testů se mezi jednotlivými výrobci liší. V případě pozitivního průkazu GDH a negativního průkazu toxinů A/B je tedy nutné vyšetření doplnit o PCR průkaz nebo kultivaci cílenou na C. difficile s následnou charakterizací kmene, abychom získali informaci o schopnosti kmene C. difficile toxiny produkovat. U těchto pacientů je také nutná klinická rozvaha o dalších možných příčinách průjmu. Stanovení diagnózy CDI pouze na základě pozitivního PCR průkazu toxigenního C. difficile ve vzorku stolice není doporučeno vzhledem k neschopnosti tohoto testu odlišit kolonizaci C. difficile od infekce.(11) Pokud je PCR jediným dostupným testem pro diagnostiku CDI, je vhodné brát v úvahu Ct (cycle of treshold) hodnotu výsledku, kdy nižší hodnota Ct může predikovat vyšší bakteriální nálož, a aproximativně tedy i tvorbu toxinů.(22)
U dětí jsou časté koinfekce C. difficile s jinými gastrointestinálními patogeny, jak ukázala analýza 1718 dětských pacientů s pozitivním testem na C. difficile. Souhrnná prevalence byla 20,7 % (n = 355), nejčastějšími koinfekcemi byly virové infekce (46 %), bakteriální a parazitární infekce byly zjištěny v 14,9 %, a 0,01 % případů.(12) Na základě těchto dat by laboratorní diagnostika CDI u dětí měla být kombinována s testováním na přítomnost jiných gastrointestinálních patogenů.(15)
Na ÚLM byla s cílem zvýšení citlivosti a rozšíření detekovaných agens původců střevních infekcí provedena evaluační studie, kdy 90 vzorků průjmových stolic, již vyšetřených v rámci rutinního provozu, bylo následně analyzováno novou diagnostickou soupravou (AusDiagnostics Faecal Pathogens M), která detekuje následující virová, bakteriální a parazitární agens: enteroinvazivní E. coli (Shiga-like), Shigella, Salmonella, Campylobacter, Aeromonas, Yesinia, Sapovirus, Rotavirus, Norovirus, Adenovirus, Astrovirus, Giardia intestinalis, Cryptosporidium, Entamoeba histolytica a C. difficile. Překvapivě byl u 27 % stolic v rutinním provozu vyšetřených jen na virová agens a u 40 % stolic testovaných v běžném provozu jen na bakteriální patogeny zjištěn alespoň jeden nový nález.(23) Výsledky této studie představovaly pádný argument pro zavedení tohoto testu s širokým spektrem mikrobiálních agens do rutinní diagnostiky střevních infekcí na ÚLM. Ačkoliv je C. difficile jedním z detekovaných agens v tomto panelu, jsou všechny PCR pozitivní stolice na průkaz toxigenního C. difficile dotestovány enzymatickým testem ještě na přítomnost GDH a toxinů A/B (mariPOC, CDI test, ArcDia, Finsko) k odlišení kolonizace od aktivní infekce v souladu s evropským doporučeným postupem.(11)
Výsledky testování po zavedení výše uvedeného multiplexového PCR jsou znázorněné na obrázku 2. Z celkem 652 stolic pacientů ≤ 18 let bylo 71 vzorků PCR pozitivních na přítomnost toxigenního C. difficile. Z těchto 71 vzorků bylo 65 dále testováno na přítomnost C. difficile pomocí detekce GDH a toxinů A/B.
U 6 vzorků pozitivních na přítomnost toxigenního C. difficile pomocí PCR byl průkaz C. difficile GDH a toxinů A/B zcela negativní (obr. 2). Domníváme se, že u těchto vzorků byla detekce GDH pod diagnostickým limitem metody nebo se jednalo o záchyt DNA toxigenního C. difficile přítomné ve sporách.
Obr. 2. Přehled výsledků testování stolic, u kterých byla zjištěna pozitivita toxigenního C. difficile pomocí PCR panelu střevních patogenů a které byly následně testovány imunoenzymatickým testem detekujícím C. difficile GDH a toxiny A/B 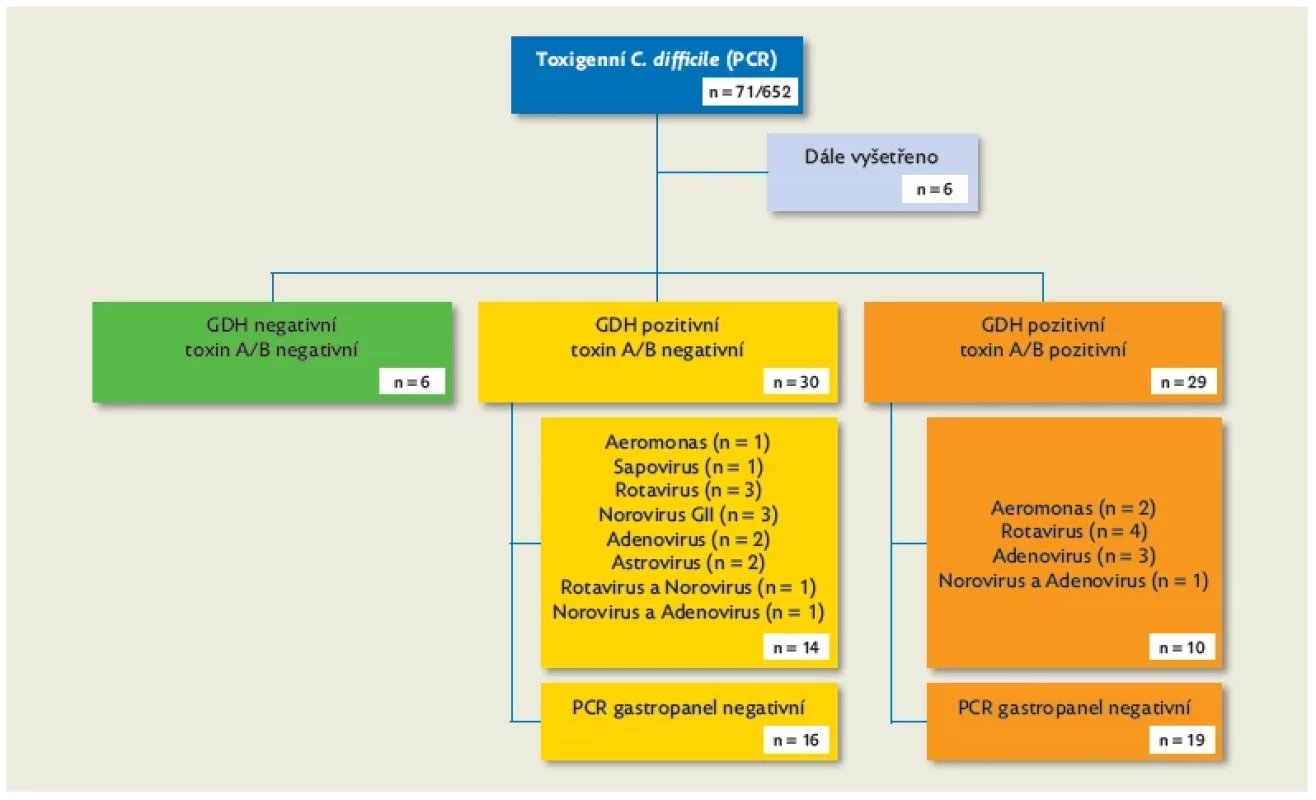
Současná pozitivita C. difficile GDH a toxinů A/B byla detekována pouze u 29/65 (44,6 %) testů, avšak u 10 z těchto vzorků byla zjištěna přítomnost další možné příčiny infekčního průjmu (obr. 2). Pouze 19 vzorků bylo pozitivní na C. difficile GDH a toxiny A/B bez jiné pozitivity v PCR panelu gastrointestinálních patogenů, podporujících tak diagnózu CDI, pokud příznaky u pacienta stále přetrvávají.
Obtížně diagnosticky interpretovatelnou skupinou jsou pacienti s pozitivním průkazem C. difficile GDH, ale negativním nálezem pro toxiny A/B, u nichž PCR indikuje, že se může jednat o kmen s potenciálem produkovat toxiny (přítomnost genu pro tvorbu toxinu). U 14 z těchto pacientů byla nalezena jiná infekční příčina průjmu (obr. 2) a bez multiplexového PCR by tito pacienti mohli být nesprávně diagnostikováni jako případy CDI. Právě používání PCR v diagnostice CDI může být důvodem vysoké incidence těchto onemocnění u americké pediatrické populace(16,17) v porovnání s Evropou, kde jsou více podporované imunoenzymatické testy.(11) U zbylých 16 pacientů, kde byla zjištěna přítomnost toxigenního C. difficile bez přítomnosti toxinů A/B, je nutná pečlivá klinická rozvaha, zda není průjem způsoben jinou neinfekční příčinou nebo zda se nejedná o možnou falešnou negativitu imunoenzymatického testu pro detekci toxinů.(11) Také je nutné vyhodnotit další laboratorní parametry a vývoj klinických příznaků.
Léčba
U dětí s laboratorně potvrzenou nezávažnou CDI může k vymizení průjmu stačit ukončení podávání antibiotik, která vyvolala střevní dysmikrobii, a vhodná rehydratace.(24) Pokud děti nereagují, doporučuje se zahájit specifickou anti-CDI antibiotickou léčbu. Kromě údajů o klinické účinnosti by lék volby měl být v souladu s pravidly antimikrobiálního stewardshipu s důrazem na rychlou obnovu střevní mikroflóry, aby se minimalizovalo riziko rekurence onemocnění.(25)
Ačkoliv je metronidazol doporučeným lékem volby pro léčbu CDI u dětí,(14) randomizovaná klinická data u pediatrické populace chybí. U dospělých je použití metronidazolu pro léčbu CDI doporučeno pouze v případě nedostupnosti fidaxomicinu nebo vankomycinu,(14,22) a to na základě dvou randomizovaných studií, ve kterých byla prokázána inferiorita metronidazolu v porovnání s vankomycinem.(26) Metronidazol také dosahuje velmi nízké koncentrace ve stolici a většina je ho absorbována do krve.(25)
Fidaxomicin a vankomycin dosahují vysokých koncentrací ve stolici a k systémovému vstřebávání při orálním podání téměř nedochází.(25) Účinnost použití fidaxomicinu v porovnání s vankomycinem u pediatrické populace s CDI byla testována v randomizované studii SUNSHINE.(27) V této studii bylo 142 pacientů ve věku < 18 let léčeno po dobu 10 dní fidaxomicinem (n = 98) nebo vankomycinem (n = 44). Ačkoliv klinické odpovědi 2 dny po ukončení léčby se významně nelišily u pacientů léčených fidaxomicinem a vankomycinem (77,6 % oproti 70,5 %, s upraveným rozdílem léčby 7,5 %; 95 % interval spolehlivosti (CI) 7,4–23,9 %), klinická odpověď bez rekurence CDI do 30 dnů byla významně vyšší u pacientů léčených fidaxomicinem (68,4 % oproti 50,0 %; upravený rozdíl v léčbě, 18,8 %; 95 % CI 1,5–35,3 %).(27) Vzhledem k tomu, že v klinických studiích byl fidaxomicinu vystaven pouze jeden dětský pacient mladší 6 měsíců,(27,28) FDA neschvaluje použití fidaxomicinu u dětí mladších 6 měsíců a EMA doporučuje léčit pacienty v této věkové skupině s opatrností.(29,30) Doporučená dávka u dětských pacientů je 200 mg (jedna tableta) podávaná perorálně dvakrát denně (jednou za 12 hodin) po dobu 10 dnů.(29,30) Nižší procento rekurentních infekcí u skupiny dětí léčených fidaxomicinem můžeme odůvodnit selektivním působením fidaxomicinu na klostridia, a tím jeho minimální zásah do složení střevní mikrobioty v porovnání s vankomycinem, který díky vysoké koncentraci ve stolici působí kromě grampozitivní flóry i na gramnegativní anaeroby.(25)
Klinická data porovnávající zároveň metronidazol, vankomycin a nově schválený fidaxomicin u dětí a dospělých nejsou dostupná.
V případě rekurence CDI by stejně jako u první ataky CDI měl být kladen důraz na laboratorní diagnostiku k vyloučení přítomnosti koinfekcí. U potvrzené infekce by měla být léčba upravena z léku (léků) nebo lékového režimu použitého k léčbě v předchozí epizodě (epizodách).(15) U mnohočetné rekurentní CDI by měla být zvážena transplantace fekální mikrobioty (FMT) po standardní léčbě poslední epizody CDI.(14,31) Nedávná rozsáhlá americká multicentrická retrospektivní studie zahrnující 335 pacientů ve věku 11 měsíců až 23 let, kteří podstoupili FMT a byli sledováni po dobu 2 měsíců nebo déle, ukázala, že 271 pacientů (81 %) bylo bez rekurence CDI po jednorázové FMT a 86,6 % po první nebo opakované FMT.(32)
V porovnání s dospělými hospitalizovanými pacienty jsou dostupná klinická data u dětí limitovaná a je zapotřebí dalších prospektivních studií pro stanovení prevalence CDI a účinnosti léčebných režimů u této populace.
Výzkum je podpořen z: Výzkumného záměru FN v Motole 00064203 a EU projektem: Národní institut virologie a bakteriologie, program EXCELES, ID:LX22NPO5103, Next Generation EU.
Korespondenční adresa:
Mgr. Marcela Krůtová, Ph.D.
Ústav lékařské mikrobiologie 2. LF UK a FN Motol
V Úvalu 84, 150 06, Praha 5
marcela.krutova@lfmotol.cuni.cz
Zdroje
1. Lawson PA , Citron DM, Tyrrell KL, et al. Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O’Toole 1935) Prévot 1938. Anaerobe 2016; 40 : 95–9.
2. Oren A, Rupnik M. Clostridium difficile and Clostridioides difficile: two validly published and correct names. Anaerobe 2018; 52 : 125–126.
3. Paredes-Sabja D, Shen A, Sorg JA. Clostridium difficile spore biology: sporulation, germination, and spore structural proteins. Trends Microbiol 2014; 22(7): 406–16.
4. Chilton CH, Pickering DS, Freeman J. Microbiologic factors affecting Clostridium difficile recurrence. Clin Microbiol Infect 2018; 24(5): 476–82.
5. Miranda-Katz M, Parmar D, Dang R, et al. Epidemiology and risk factors for community associated Clostridioides difficile in children. J Pediatr 2020; 221 : 99–106.
6. Clemente JC, Ursell LK, Parfrey LW, et al. The impact of the gut microbiota on human health: an integrative view. Cell. 2012; 148(6): 1258–70.
7. Dominguez SR, Dolan SA, West K, et al. High colonization rate and prolonged shedding of Clostridium difficile in pediatric oncology patients. Clin Infect Dis 2014; 59(3): 401–3.
8. Barbar R, Hayden R, Sun Y, et al. Epidemiologic and clinical characteristics of Clostridioides difficile infections in hospitalized and outpatient pediatric oncology and hematopoietic stem cell transplant patients. Pediatr Infect Dis J 2021; 40(7): 655–62.
9. Breuer C, Döring S, Rohde H, et al. Clostridium difficile infection after pediatric solid organ transplantation: a practical single-center experience. Pediatr Nephrol 2019; 34(7): 1269–75.
10. Mayer EF, Maron G, Dallas RH, et al. A multicenter study to define the epidemiology and outcomes of Clostridioides difficile infection in pediatric hematopoietic cell and solid organ transplant recipients. Am J Transplant 2020; 20(8): 2133–42.
11. Crobach MJ, Planche T, Eckert C, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22 Suppl 4: S63–81.
12. de Graaf H, Pai S, Burns DA, et al. Co-infection as a confounder for the role of Clostridium difficile infection in children with diarrhoea: a summary of the literature. Eur J Clin Microbiol Infect Dis 2015; 34(7): 1281–7.
13. Schutze GE, Willoughby RE; Committee on Infectious Diseases; American Academy of Pediatrics. Clostridium difficile infection in infants and children. Pediatrics 2013; 131(1): 196–200.
14. McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018; 66(7): 987–94.
15. Krutova M, de Meij TGJ, Fitzpatrick F, et al. How to: Clostridioides difficile infection in children. Clin Microbiol Infect 2022; 28(8): 1085–1090.
16. Khanna S, Baddour LM, Huskins WC, et al. The epidemiology of Clostridium difficile infection in children: a population-based study. Clin Infect Dis 2013; 56(10): 1401–6.
17. Wendt JM, Cohen JA, Mu Y, et al. Clostridium difficile infection among children across diverse US geographic locations. Pediatrics 2014; 133(4): 651–8.
18. Davies KA, Ashwin H, Longshaw CM, et al. Diversity of Clostridium difficile PCR ribotypes in Europe: results from the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID), 2012 and 2013. Euro Surveill 2016; 21(29).
19. Krutova M, Capek V, Nycova E, et al. The association of a reduced susceptibility to moxifloxacin in causative Clostridium (Clostridioides) difficile strain with the clinical outcome of patients. Antimicrob Resist Infect Control 2020; 9(1): 98.
20. van Dorp SM, Smajlović E, Knetsch CW, et al. Clinical and microbiological characteristics of Clostridium difficile infection among hospitalized children in the Netherlands. Clin Infect Dis 2017; 64(2): 192–8.
21. Stoesser N, Eyre DW, Quan TP, et al. Epidemiology of Clostridium difficile in infants in Oxfordshire, UK: Risk factors for colonization and carriage, and genetic overlap with regional C. difficile infection strains. PLoS One 2017; 12(8): e0182307.
22. van Prehn J, Reigadas E, Vogelzang EH, et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect 2021; 27(Suppl 2): S1–S21.
23. Briksí A, Hubáček P, Šumová J, et al. Porovnání tradiční a komerční molekulárně - biologické detekce gastrointestinálních patogenů firmy AusDiagnostics ve FN Motol. Klin Mikrobiol Infekc Lek 2019; 25(4): 132–139.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition; European Society for Pediatric Infectious Diseases. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59(1): 132–52.
25. Krutova M, Wilcox M, Kuijper JE. Clostridioides difficile infection: are the three currently used antibiotic treatment options equal from pharmacological and microbiological points of view? Int J Infect Dis 2022: S1201 - 9712(22)00512-4.
26. Johnson S, Louie TJ, Gerding DN, et al. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis 2014. 59(3): 345–54.
27. Wolf J, Kalocsai K, Fortuny C, et al. Safety and efficacy of fidaxomicin and vancomycin in children and adolescents with Clostridioides (Clostridium) difficile infection: a phase 3, multicenter, randomized, single-blind clinical trial (SUNSHINE). Clin Infect Dis 2020; 71(10): 2581–8.
28. O ’Gorman MA, Michaels MG, Kaplan SL, et al. Safety and pharmacokinetic study of fidaxomicin in children with Clostridium difficile-associated diarrhea: a phase 2a multicenter clinical trial. J Pediatric Infect Dis Soc 2018; 7(3): 210–8.
29. European Medicines Agency, Dificlir European public assessment report, last update (04/06/2021). Available at: https: //www.ema.europa.eu/en/documents/ product-information/dificlir-epar-product-information_en.pdf
30. US Food and Drug Administration (FDA), DIFICID® (fidaxomicin), 2020. https: //www.accessdata.fda.gov/drugsatfda_docs/label/2020/213138lbl. pdf
31. Davidovics ZH, Michail S, Nicholson MR, et al. Fecal microbiota transplantation for recurrent Clostridium difficile infection and other conditions in children: a joint position paper from the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2019; 68(1): 130–43.
32. Nicholson MR, Mitchell PD, Alexander E, et al. Efficacy of fecal microbiota transplantation for Clostridium difficile infection in children. Clin Gastroenterol Hepatol 2020; 18(3): 612–19.e1.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Bohumil Kubišta: Cirkus
- Co jsme psali
- Editorial
- Století Ervína Adama a příběh eradikace poliomyelitidy
- Poliomyelitída a problémy eradikácie
- Epidemiologie a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (PIMS-TS) v České republice
- Infekce vyvolané Clostridioides difficile u dětských pacientů Fakultní nemocnice v Motole
- Liečba spánkových porúch dýchania neinvazívnym pozitívnym pretlakom (NIV) – naše skúsenosti
- Iný pohľad na následky syndrómu CAN
- Nomofobie v pediatrické populaci
- Suprakondylické zlomeniny humeru v dětském věku – souhrnný přehled
- Nemocnost dětí ve věku 0–2 roky v okresech s rozdílným znečištěním ovzduší
- Dědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny
- Suprakondylické zlomeniny humeru v dětském věku – souhrnný přehled
- Epidemiologie a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (PIMS-TS) v České republice
- Liečba spánkových porúch dýchania neinvazívnym pozitívnym pretlakom (NIV) – naše skúsenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



