-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny
Inborn errors of amino acid, organic acid metabolism and disorders of the urea cycle
Introduction: Inborn errors of amino acid (AA), organic acid (OA) metabolism and disorders of the urea cycle (UCD) represent a heterogeneous group of 135 different diseases caused by impaired synthesis, transport or degradation of AA, OA and ammonia. Individual diseases are rare, but the overall incidence in the population is 1 : 3000–4000.
Methodology: The work summarizes the clinical, diagnostic and therapeutic aspects of the most common inborn errors of AA, OA metabolism and UCD. Eight diseases are part of laboratory neonatal screening, diagnosis of other IEMs depends on clinical suspicion, determination of ammonia in the blood and rapid indication of selective metabolic screening.
Results: Inborn errors of AA, OA metabolism and UCD are clinically manifested by acute or subacute metabolic disruption with metabolic alkalosis or acidosis and subsequent hepatic, renal and / or cerebral impairment or slowly progressive brain impairment with developmental delay and cognitive decline. The first group includes OA, tyrosinemia type 1, leucinosis and UCD, which are manifested by the accumulation of toxic metabolites arising from amino acid degradation. The second group includes phenylketonuria and homocystinuria, which are associated with eye, bone and / or thromboembolic events.
Conclusion: Adequate therapy depends on early diagnosis. Elimination methods are used in patients with acute brain involvement, such as severe hyperammonaemia. In patients with chronic disease, a lifelong low-protein diet supplemented with foods for special medical purposes, vitamin therapy and chaperone therapy supporting the activities of affected enzymes and efforts to block or activate alternative metabolic pathways are used. The number of diseases in which enzyme replacement therapy or liver or kidney transplantation is used is increasing. Trials with gene therapy are underway.
Keywords:
tyrosinemia – Inborn errors of metabolism – Urea cycle disorders – phenylketonuria – homocystinuria – leucinosis – glycine encephalopathy – organic acidurias
Autoři: Honzík Tomáš; Zeman Jiří
Působiště autorů: Klinika pediatrie a dědičných poruch metabolismu 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (6): 370-382.
Kategorie: Kapitoly k atestaci z pediatrie
doi: https://doi.org/10.55095/CSPediatrie2022/066Souhrn
Úvod: Dědičně podmíněné poruchy metabolismu (DPM) aminokyselin (AMK), organických kyselin (OA) a cyklu močoviny (UCD) představují heterogenní skupinu 135 různých onemocnění způsobených porušenou syntézou, transportem či odbouráváním AMK, OA a amoniaku. Jednotlivá onemocnění jsou vzácná, ale celkový výskyt v populaci je 1 : 3000–4000.
Metodika: Práce shrnuje klinické, diagnostické a terapeutické aspekty nejčastějších DPM-AMK, OA a UCD. Osm nemocí je součástí laboratorního novorozeneckého screeningu, diagnostika ostatních DPM závisí na klinickém podezření, stanovení amoniaku v krvi a rychlé indikaci selektivního metabolického screeningu.
Výsledky: DPM-AMK, OA a UCD se klinicky projevují akutním nebo subakutním rozvratem metabolismu s metabolickou alkalózou nebo acidózou a následným postižením funkcí jater, ledvin a/nebo mozku nebo pomalu progredujícím postižením CNS se zpomalením vývoje a poruchou kognitivních funkcí. Do první skupiny patří OA, tyrosinemie typu 1, leucinóza a UCD, které se projevují hromaděním toxických metabolitů vznikajících při degradaci aminokyselin. Do druhé skupiny patří fenylketonurie a homocystinurie, u které se přidružuje i postižení očí, kostí a/nebo tromboembolické příhody.
Závěr: Adekvátní terapie závisí na včasné diagnostice. U pacientů s akutním postižením mozku, například při těžké hyperamonemii, se používají eliminační metody. U pacientů s pomaleji progredujícím onemocněním se uplatňuje celoživotní nízkobílkovinná dieta suplementovaná potravinami pro zvláštní lékařské účely, vitaminoterapie a chaperonová terapie podporující aktivity postižených enzymů a snaha blokovat či aktivovat alternativní metabolické dráhy. Zvyšuje se počet onemocnění, u kterých se používá enzymová substituční terapie či transplantace jater nebo ledvin. Nově probíhají trialy s genovou terapií.
Klíčová slova:
poruchy cyklu močoviny – fenylketonurie – dědičné poruchy metabolismu – homocystinurie – tyrosinemie – leucinóza – glycinová encefalopatie – organické acidurie
Úvod
Metabolismus je neustálý koloběh biochemických reakcí, při kterých se tvoří látky potřebné pro růst a funkci buněk a organismu, a současně se odbourávají a odstraňují degradační produkty, které již nemají uplatnění. Dědičné poruchy metabolismu (DPM) představují heterogenní skupinu více než 1600 geneticky podmíněných onemocnění (iembase.org). Jednotlivě se jedná o vzácná onemocnění, ale souhrnně postihují až 1 % populace. Předmětem toho sdělení je seznámit čtenáře s poruchami metabolismu aminokyselin.
Dědičné poruchy metabolismu aminokyselin (DPM - -AMK) reprezentují skupinu více než 135 onemocnění s porušenou syntézou, transportem či katabolismem aminokyselin. I když se v přírodě vyskytuje více než 300 různých aminokyselin, bílkoviny člověka se tvoří výhradně jen ze skupiny 20 L-α-aminokyselin (devět z nich patří mezi aminokyseliny esenciální s nutným příjmem potravou – leucin, isoleucin, valin, lysin, tryptofan, threonin, methionin, fenylalanin a histidin). Porucha se může objevit v metabolismu kterékoliv z nich. DPM-AMK patří mezi nejznámější, nejčastější a terapeuticky ovlivnitelné DPM (tab. 1). Mezi tato onemocnění se řadí i poruchy cyklu močoviny (UCD), protože člověk vylučuje přebytečný dusík vznikající katabolismem proteinů převážně ve formě neutrální močoviny – urey. Tato látka vzniká z toxického amoniaku sledem reakcí zvaných cyklus močoviny (1932, Krebs a Henseleit). Vybraných šest DPM-AMK a dvě onemocnění z UCD jsou součástí laboratorního novorozeneckého screeningu (LNS) v České republice.(1)
Tab. 1. Skupiny dědičných poruch metabolismu s nejvyšším výskytem v populaci 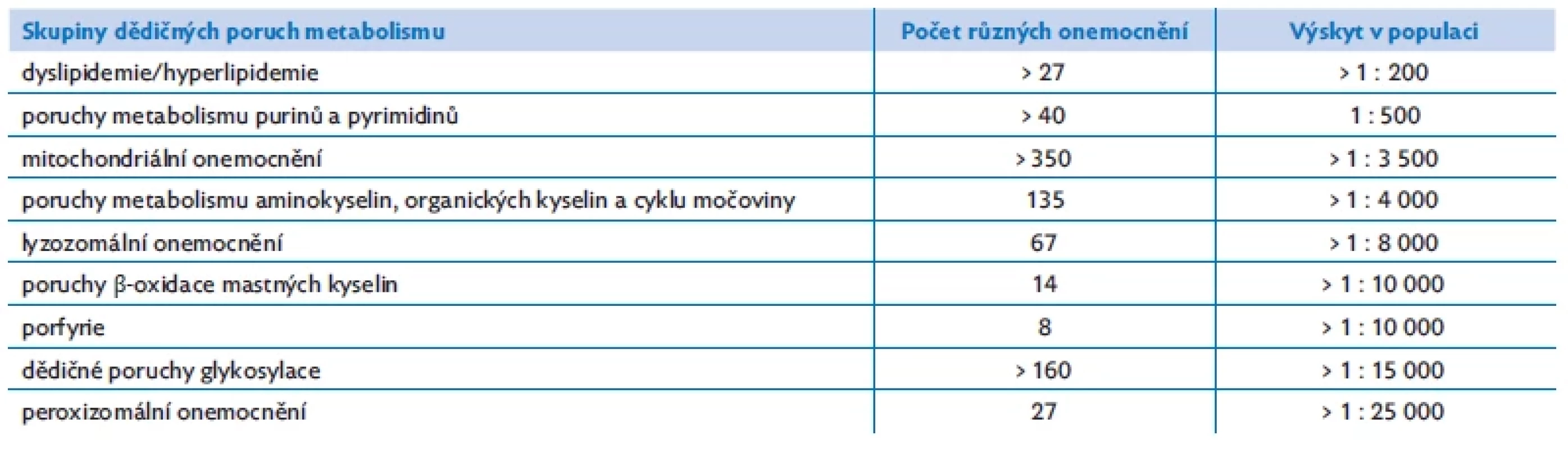
Patofyziologie
DPM-AMK patří mezi DPM malých molekul (< 1500 Da), kdy je typickou příčinou rozvoje onemocnění hromadění substrátu pro chybějící enzym či nedostatek produktu neproběhlé enzymatické reakce. Často se jedná o kombinaci obou patofyziologických pochodů, o poruchu membránového transportu nebo o aktivaci alternativní metabolické dráhy, která může produkovat toxické metabolity.(2) Pro významnější toxicitu (než vlastní akumulace určité aminokyseliny) některých metabolitů s projevy akutních intoxikací s rychlou deteriorací stavu a rozvojem metabolické acidózy je zvlášť vyčleněna podskupina organických acidurií (tab. 2), u které bývá i charakteristický nález při vyšetření profilu organických kyselin v moči. U řady DPM-AMK je situace složitější, protože způsobují i nerovnováhu mezi hladinami neurotransmiterů, poruchu methylačních reakcí s dopadem na funkci řady genů nebo poruchu membránového potenciálu s dopadem na homeostázu kalcia. Na progresi onemocnění se může podílet i zvýšený oxidativní stres, aktivace signálních proteinů a dysregulace proteostázou indukované stresové odpovědi buněk.
Tab. 2. Patofyziologické aspekty, klinické projevy a možnosti terapie vybraných dědičných poruch metabolismu aminokyselin, organických kyselin a cyklu močoviny 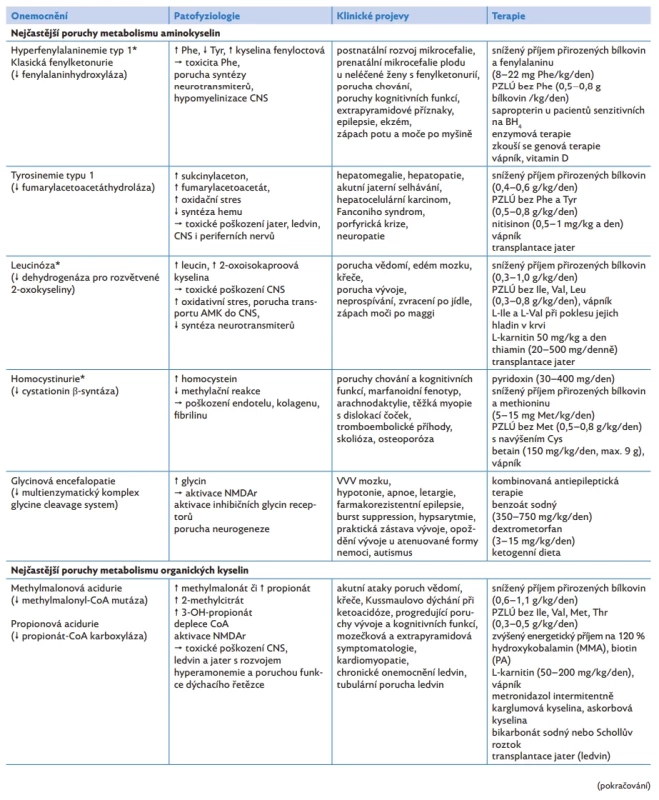

*Diagnostika onemocnění je součástí laboratorního novorozeneckého screeningu.
AMK – aminokyseliny, CK – kreatinkináza, CNS – centrální nervový systém, Cys – cystein, DNA – deoxyribonukleová kyselina, Gly – glycin, Ile – isoleucin, LDL – lipoprotein o nízké hustotě, Leu – leucin, Lys – lysin, Met – methionin, MMA – methylmalonová acidurie, NMDAr – N-methyl-D-aspartát receptory, PA – propionová acidurie, Phe – fenylalanin, PZLÚ – potraviny pro zvláštní lékařské účely a speciální směsi esenciálních AMK, TA G – triacylglyceroly, Thr – threonin, Trp – tryptofan, Tyr – tyrosin, Val – valinKlinické projevy
Klinicky se část DMP-AMK manifestuje brzy po narození postižením funkce CNS, jater a/nebo ledvin, ale při vyšší zbytkové aktivitě postiženého enzymu se mohou projevit i později opakovanými atakami výrazného zhoršení klinického stavu po větším přívodu exogenních aminokyselin (zahájení perorální výživy, její změna z nízkobílkovinného mateřského mléka na umělou mléčnou výživu či příkrmy s vyšším obsahem bílkovin) anebo v průběhu akutních horečnatých onemocnění. Souvisí to nejen s rozvojem katabolického stavu u nemocného dítěte, ale také s dalším poklesem již původně nízké aktivity postiženého enzymu, neboť nestabilní proteiny s geneticky podmíněnými změnami v primární, sekundární nebo terciální struktuře podléhají snáze proteolýze a degradaci, která nastává při zvýšené teplotě působením akutně vyplavených proteáz. Příkladem DMP-AMK, u kterých převažuje hromadění škodlivě působících látek z výživy nebo nadprodukce, je hyperamonemické kóma u pacientů s UCD s rozvojem poruchy vědomí při edému mozku či těžký metabolický rozvrat s Kussmaulovým dýcháním u pacientů s organickými aciduriemi. Mezi DPM, u kterých se aktivují alternativní metabolické dráhy, patří tyrosinemie typu 1 s nadprodukcí toxického sukcinylacetonu, který vede k selhání jater a ledvin a rozvoji akutní porfyrické krize. Fenylketonurie je příkladem komplexního onemocnění způsobeného toxickým působením fenylalaninu, poruchou syntézy cholesterolu, nedostatkem tyrosinu a monoaminogenních neurotransmiterů v CNS s akumulací alternativních metabolitů. Klinicky se projevuje poruchou vývoje a kognitivních funkcí, epilepsií, porušenou myelinizací, chronickým ekzémem a nepříjemným zápachem potu a moče po myšině. Některé DPM se projevují charakteristickými projevy. U pacientů s homocystinurií to je marfanoidní fenotyp, subluxace čoček a prohlubující se intelektuální nedostatečnost u dětí nebo akutní tromboembolické příhody u dospívajících. U kojenců s glutarovou aciduirií typu 1 to bývá praskání přemosťujících cév, které vedou k rozvoji subdurálních hematomů a makrocefalií.(3,4)
Dědičnost
U většiny pacientů s DPM-AMK je dědičnost onemocnění autozomálně recesivní (AR), ale u poruchy ornitintranskarbamylázy (OTC) je dědičnost vázaná na chromozom X.
Obecné principy terapie
I přes intenzivní výzkum je počet léčitelných či léčbou ovlivnitelných DPM omezený, odhaduje se, že účinná terapie je dostupná u cca 120 DPM. U DPM na podkladě tzv. malých molekul se nejvíce používá dietní léčba. U DPM-AMK se uplatňuje nízkobílkovinná dieta. Její přísnost závisí na věku pacienta, zbytkové aktivitě postiženého enzymu a individuální toleranci k aminokyselinám, kterou pozitivně ovlivňuje růst a prospívání v dětském věku a negativně rozvoj katabolismu při akutních respiračních infekcích a gastrointestinálních obtížích. Snížený příjem přirozených bílkovin ve výživě je třeba pravidelně suplementovat potravinami pro zvláštní lékařské účely (PZLÚ), například pomocí směsí esenciálních aminokyselin bez aminokyselin, které pacient neumí účinně metabolizovat. Přitom celkový příjem přirozených a umělých bílkovin musí odpovídat denní potřebě dle věku. Pacienti s organickou acidurií potřebují i vyšší příjem kalorií (120 % denní potřeby) a současně i vysoké dávky L-karnitinu, který brání rozvoji sekundární karnitinové deficience, pomáhá s transportem mastných kyselin s dlouhým řetězcem přes mitochondriální membránu a zvyšuje vylučování toxických metabolitů močí.(5,6)
U některých pacientů s DMP-AMK lze zvýšit aktivity postižených enzymů pomocí vysokých dávek vitaminů, specifických kofaktorů nebo enzymových substrátů a chaperonů. V rámci vitaminoterapie se uplatňuje vitamin B6 u pacientů s B6-senzitivní homocystinurií, betain u pacientů s B6-rezistentní homocystinurií a kalcium folinát a hydroxykobalamin u pacientů s remethylačními formami homocystinurie. K úpravě hladin neurotransmiterů v CNS u pacientů s maligní formou fenylketonurie na podkladě poruch metabolismu pterinů pomáhá sapropterin (analog tetrahydrobiopterinu), 5-OH-tryptofan, L-DOPA a karbidopa. Sapropterin se uplatňuje jako chaperon jaterní fenylalaninhydroxylázy v léčbě některých pacientů s fenylketonurií.(5,6)
U některých DPM se používá léčba pomocí chybějícího produktu. To je například L-arginin a L-citrulin u pacientů s některými UCD, L-serin při poruše syntézy serinu a dextromethorfan u pacientů s glycinovou encefalopatií ve snaze blokovat NMDA (N-methyl-D-aspartát) receptory. Blokátory aktivace alternativní metabolické dráhy pomáhají snižovat produkci toxických metabolitů. Například u pacientů s tyrosinemií typu 1 lze pomocí nitisinonu blokovat endogenní nadprodukci toxických metabolitů, mezi které patří maleylacetoacetát, fumarylacetoacetát a sukcinylaceton. Naopak aktivace alternativní metabolické dráhy se uplatňuje například u pacientů s UCD, u kterých chemické látky jako benzoát sodný, fenylbutyrát sodný či fenylacetát sodný významně pomáhají snižovat hladinu amoniaku zvýšeným vylučováním nebílkovinného dusíku močí. U většiny dětí s některou z organických acidurií je třeba korekce metabolické acidózy pomocí bikarbonátu sodného a/nebo Schollova citrátového alkalizačního roztoku, u kriticky nemocných dětí s hyperamonemií je nutná akutní detoxikace pomocí eliminačních metod (hemodialýza či hemodiafiltrace).
V posledních letech došlo k velkému rozvoji enzymové substituční terapie (ERT) a substrát redukční terapie (SRT). I když se tato terapie týká dominantně pacientů s různými typy lyzozomálních onemocnění, modifikovaný enzym se již používá také i v terapii fenylketonurie a probíhají studie u homocystinurie z deficitu cystationin β-syntázy. Transplantace jater se používá u pacientů s UCD, tyrosinemií typu 1, leucinózou nebo methylmalonovou či propionovou acidurií.
V dalším textu rozebereme podrobněji jednotlivé vybrané DPM-AMK, které jsou uvedeny v tabulce 2. Pomocí programu LNS a díky možnosti detekovat některá další metabolická onemocnění, která nejsou primárním cílem screeningu, lze u zachycených pacientů zahájit poměrně účinnou terapii ještě před rozvojem klinických příznaků a jejich rozvoji tím zabránit.
Hyperfenylalaninemie (klasická fenylketonurie, mírná hyperfenylalaninemie a poruchy metabolismu tetrahydrobiopterinu)
Etiologie a patogeneze: poruchy metabolismu aminokyselin, při kterých dochází k hyperfenylalaninemii (HPA ), představují heterogenní skupinu několika nemocí. Celkový výskyt HPA v naší populaci je 1 : 5200 a dědičnost je u všech typů autozomálně recesivní (AR). Nejčastější je hyperfenylalaninemie typu 1 (klasická fenylketonurie – PKU), která byla poprvé popsána v roce 1934. Postihuje cca 70 % pacientů s HPA a obvykle je způsobená dvěma výrazně patogenními nonsense mutacemi v PAH genu pro jaterní fenylalaninhydroxylázu (PA H). Méně častá je mírná hyperfenylalaninemie, která je obvykle způsobená méně patogenními missense mutacemi v PAH. Nejméně časté jsou maligní formy PKU (1–2 % pacientů s PKU), způsobené poruchou metabolismu tetrahydrobiopterinu (BH4), který slouží jako kofaktor pro jaterní PA H.(7)
Klasická fenylketonurie
Výrazná porucha jaterní PA H způsobuje hromadění fenylalaninu a naopak nedostatek tyrosinu. Fenylalanin se navíc alternativním metabolismem přeměňuje na kyseliny fenylpyrohroznovou, fenylmléčnou a fenyloctovou, které u neléčených pacientů s PKU způsobují zvýšenou iritabilitu pokožky, chronické dermatitidy (ekzém) a zápach potu a moče po myšině. Nedostatek tyrosinu, který je v CNS ještě umocněn jeho kompeticí s vysokými hladinami fenylalaninu o transport přes hematoencefalickou bariéru, způsobuje sníženou syntézu monoaminových neurotransmiterů v CNS se závažným dopadem na kognitivní funkce. Jejich nedostatek v CNS včetně oka se také podílí na rozvoji parkinsonismu a poruchy zrakové kontrastní citlivosti. Postižení CNS však nevzniká jen na podkladě nedostatku tyrosinu. Vysoké hladiny fenylalaninu inhibují i funkci 3-OH-3-methylglutaryl - CoA reduktázy (HMG-CoA) v oligodendrocytech. HMG-CoA je klíčový i pro syntézu cholesterolu a jeho inhibice vede v mozku k poruše myelinizace, viditelné u neléčených pacientů na magnetické rezonanci.(7)
Klinické projevy: u dětí s PKU, které nejsou zachyceny LNS a/nebo nejsou na dietoterapii, dochází již od kojeneckého věku k mikrocefalizaci, ke vzniku ekzémů rezistentních na terapii, rozvoji spasticity a ireverzibilnímu poškození mozku s poruchou kognitivních funkcí a závažnou intelektuální nedostatečností (IQ < 50 bodů). V dospívání se objevují extrapyramidové příznaky (parkinsonismus, tremor) a poruchy chůze. U cca 25 % pacientů se manifestuje epilepsie, ale hrubé abnormality na EEG má až 80 % neléčených pacientů. V dospělosti mají neléčení pacienti behaviorální problémy, obsese, kompulze, stereotypie, agresivitu či anxietu. Nedostatek tyrosinu, který je i prekurzorem melaninu, způsobuje u neléčených pacientů s PKU charakteristický obraz světlé kůže a vlasů doprovázený fotosenzitivitou.
Diagnostika: první metodu pro novorozenecký screening PKU objevil v polovině 20. století dr. Guthrie a u nás byl LNS zahájen v roce 1975 (prof. Hyánek, doc. Blehová). Metody screeningu se postupně měnily, nyní se používá spřažená hmotnostní spektrometrie (MS/MS). U všech novorozenců s pozitivním screeningem je třeba co nejrychleji zajistit kontrolní metabolické vyšetření s cílem potvrdit hyperfenylalaninemii a odlišit klasickou PKU od HPA a maligní PKU. Rychlá diagnostika maligní PKU je založena na vyšetření pterinů v moči a změření aktivity dihydropterinreduktázy v suché kapce krve. Navíc se na některých pracovištích provádí i zátěžový perorální test s dichloridem sapropterinu (analog BH4). Diagnózu všech typů hyperfenylalaninemie je třeba potvrdit i na molekulární úrovni vyšetřením genu PAH nebo genů pro enzymy, které se podílejí na metabolismu BH4.(7)
Terapie: dietní léčba se sníženým příjmem přirozených bílkovin suplementovaná směsí esenciálních aminokyselin bez fenylalaninu (tab. 2) je založena na principu, že pacienti s PKU potřebují stejně jako zdravé osoby esenciální množství fenylalaninu pro růst a proteosyntézu, ale na rozdíl od zdravých nemohou metabolizovat nadbytečný fenylalanin na tyrosin. Cílem léčby pomocí neustále kontrolované výživy je snaha udržovat hladinu fenylalaninu v krvi trvale na hodnotách, o kterých se ví, že nejsou škodlivé. Dietní léčba u pacientů s PKU je celoživotní. Řada studií prokázala škodlivý vliv vysokých hladin fenylalaninu na zdraví během celého života. Compliance léčby je u většiny malých dětí vynikající, protože většina rodičů chápe význam léčby a naučí se dietní léčbu správně používat. Naopak období dospívání přináší velký problém, protože u řady mladistvých s PKU compliance klesá. Vede to nejen k značnému rozkolísání hladin fenylalaninu, ale při déletrvající nespolupráci dochází s vysokými hladinami fenylalaninu i k poklesu IQ. Obsah fenylalaninu ve vybraných potravinách je uveden v tabulce 3. Přísnost diety závisí na individuální toleranci pacienta k fenylalaninu, která se zvyšuje v období rychlého růstu.(8) Naopak nejpřísnější dietu je třeba dodržovat v přípravě na graviditu a v graviditě, protože vysoká hladina fenylalaninu v průběhu těhotenství poškozuje vývoj plodu.
Tab. 3. Obsah bílkovin, tuků, cukrů, energie a aminokyselin fenylalaninu a methioninu ve vybraných potravinách (v nevařeném či nepečeném stavu) (zdroj: Potravinové tabulky výživových hodnot, Národní sdružení PKU a jiných DMP, 2012.) 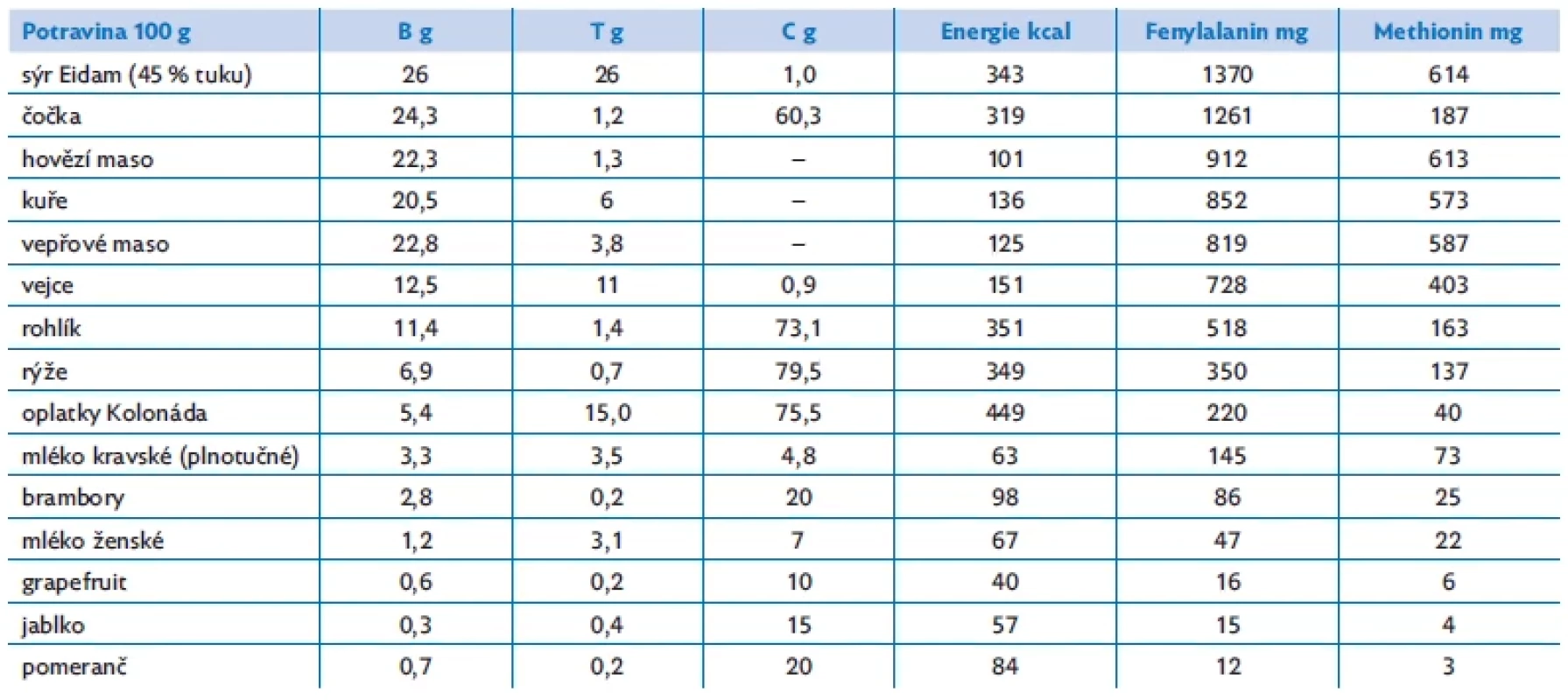
Počáteční snahy o léčbu pomocí nízkobílkovinné diety bez suplementace esenciálními aminokyselinami byly až do poloviny 20. století neúspěšné, protože postižené děti neprospívaly a docházelo u nich k poruchám růstu. Chemik L. I. Woolf z Great Ormond Street Hospital v Londýně vyslovil teorii, že děti s PKU by bylo možné léčit speciální výživou se sníženým obsahem fenylalaninu, čehož docílil enzymatickým štěpením kaseinu a odstraněním fenylalaninu pomocí aktivního uhlí. Účinnost navrženého postupu potvrdil prof. Horst Bickel v letech 1954–1955. Od té doby se výroba dietetik (PZLÚ) značně změnila. Existuje řada kvalitních směsí esenciálních aminokyselin bez fenylalaninu v práškových nebo tekutých formách, v granulích i tabletách, které jsou obohacené o ionty, stopové prvky, vitaminy a polynenasycené mastné kyseliny. PZLÚ pro novorozence a kojence s PKU se podobají umělé mléčné výživě a pro starší děti obsahují různé příchutě pro zlepšení chuti. Ke zlepšení chuti by měly přispět i nové PZLÚ na bázi glykomakropeptidu. Významně se zvýšila i nabídka různých komerčně vyráběných potravin se sníženým obsahem bílkovin.
Alternativním přístupem k léčbě některých pacientů s PKU s BH4 plně responzivním genotypem je sapropterin, který ve vybraných případech může zvýšit aktivitu PAH a snižovat hladinu fenylalaninu. Rozšíření této léčby však v některých zemích brání příliš vysoká cena, která je cca 10× vyšší, než jsou finanční náklady na dietoterapii. Zcela novou možnost v léčbě PKU představuje enzymová substituční terapie pomocí „PEGylated phenylalanine ammonia lyase (PAL)“.
V léčbě pacientů s maligní PKU se používají prekurzory neurotransmiterů, například L-DOPA a 5-OH-tryptofan v kombinaci se sapropterinem.
Prognóza: u pacientů s PKU, kteří jsou na celoživotní terapii a kteří mají hladiny fenylalaninu trvale v doporučených rozmezích, je velmi dobrá. To se týká i mladistvých s PKU, pokud období často snížené compliance v průběhu dospívání netrvá příliš dlouho a hladiny fenylalaninu nejsou dlouhodobě příliš vysoké. Tabulka 4 a obrázek 1 ukazují možné dopady přerušené diety na další vývoj jedinců s PKU.
Tab. 4. Vliv závažného porušení diety na další vývoj jedince s klasickou fenylketonurií 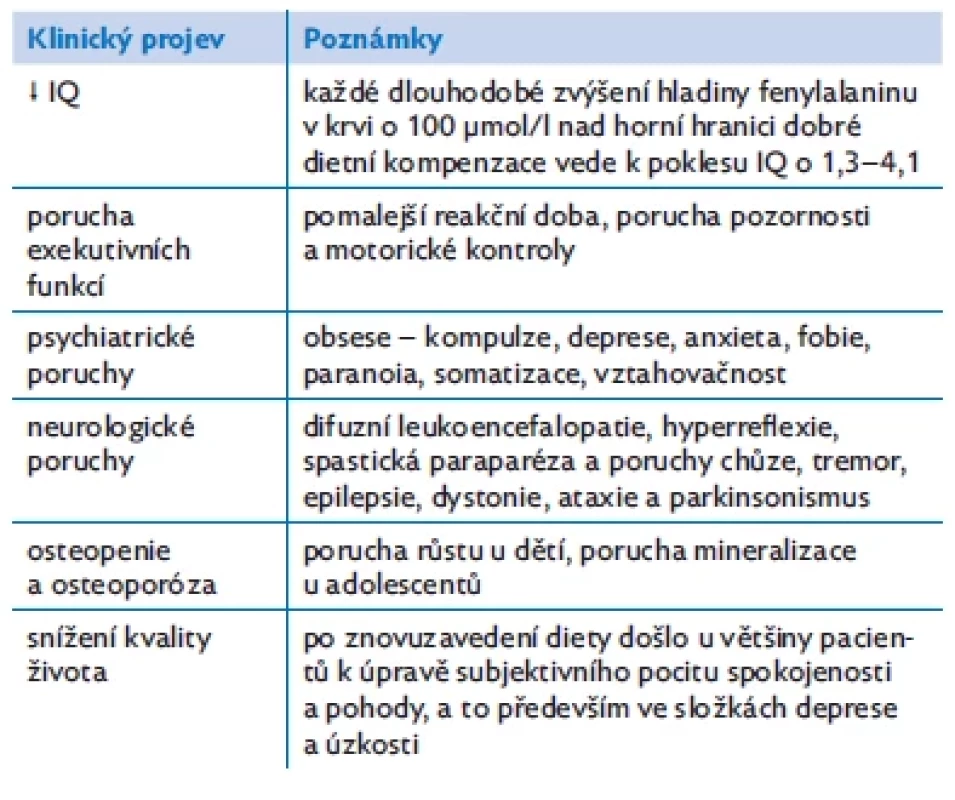
Obr. 1. MR mozku 14leté dívky s fenylketonurií a dlouhodobým nedodržováním diety. A – symetrické periventrikulární ložiskové hyperintenzity v T2-vážených obrazech v bílé hmotě supratentoriálně. B – ložiskové hyperintenzity ve FLAIR periventrikulárně parietálně. (S laskavostí poskytla Radiodiagnostická klinika VFN a 1. LF UK, Praha.) 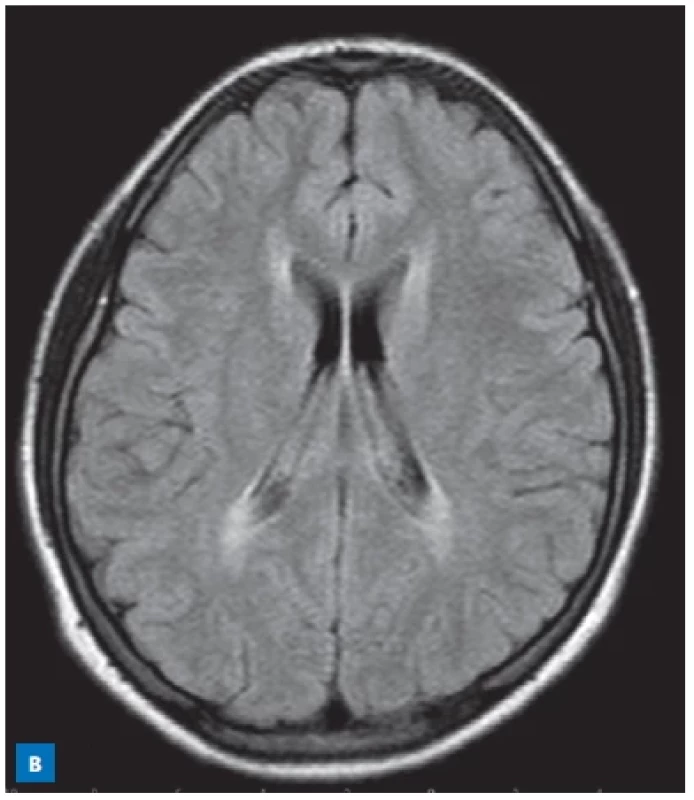
Tyrosinemie typu 1
Etiologie a patogeneze: příčinou tyrosinemie typu 1 (HT 1, hepatorenální tyrosinemie) je porucha fumarylacetoacetáthydrolázy (FAH) na úrovni posledního kroku přeměny tyrosinu na fumarát a acetoacetát. Výskyt HT 1 se odhaduje na 1 : 125 000, dědičnost je autozomálně recesivní. Metabolický blok způsobuje hromadění maleylacetoacetátu, který se přeměňuje na toxické metabolity sukcinylaceton (SA) a fumarylacetoacetát (FAA). Postiženy jsou zejména hepatocyty, tubulární buňky ledvin a periferní nervová tkáň. Inhibována je rovněž syntéza hemu na úrovni dehydratázy kyseliny δ-aminolevulové s příznaky, které připomínají akutní porfyrii. Klíčovým patofyziologickým mechanismem je oxidativní stres a poškození DNA vysokou hladinou tyrosinu, FAA a SA. Jakožto prekurzor dopaminu může vysoká koncentrace tyrosinu ovlivnit i vzájemnou rovnováhu mezi neurotransmitery.(9)
Klinické projevy: akutní typ HT 1 je nejčastější a manifestuje se již v novorozeneckém nebo časném kojeneckém věku akutním jaterním selháváním s koagulopatií, subakutní typ začíná progredující hepatomegalií a hepatopatií ve věku mezi 6. a 12. měsícem a chronický typ, který je nejméně častý, se projevuje v batolecím až předškolním věku neprospíváním a progredující hepatomegalií s postupným přechodem z fibrózy do cirhózy. Morfologické změny viditelné při zobrazení jater jsou v čase stanovení diagnózy přítomny až v 75 % případů, zejména se jedná o cirhózu. Specifickou komplikací je častý rozvoj hepatocelulárního karcinomu, který se může objevit v kterémkoliv věku, a to dokonce i u léčených pacientů. Časté jsou krvácivé projevy, naproti tomu ikterus a elevace jaterních testů jsou mírné. Časté je postižení ledvin s rozvojem Fanconiho syndromu, tubulární acidózy, eventuálně i glomerulosklerózy, nefrokalcinózy a křivice. I když renální postižení může klinické manifestaci dominovat, vždy je přítomno i postižení jater (obr. 2). Nejcharakterističtějším neurologickým projevem je porfyria-like syndrom, většinou při interkurentním infektu. Krize se projeví těžkou bolestí břicha, slabostí a změnami tonu autonomního nervstva (např. ataka hypertenze). Progresivní motorická neuropatie si v důsledku respiračního selhání může vynutit ventilační podporu. U chronického typu onemocnění se může rozvinout i kardiomyopatie.(9)
Obr. 2. 6měsíční chlapec s tyrosinemií typu 1. A – rachitický růženec, objemné bříško s hepatomegalií. B – rtg známky floridní křivice u stejného chlapce. 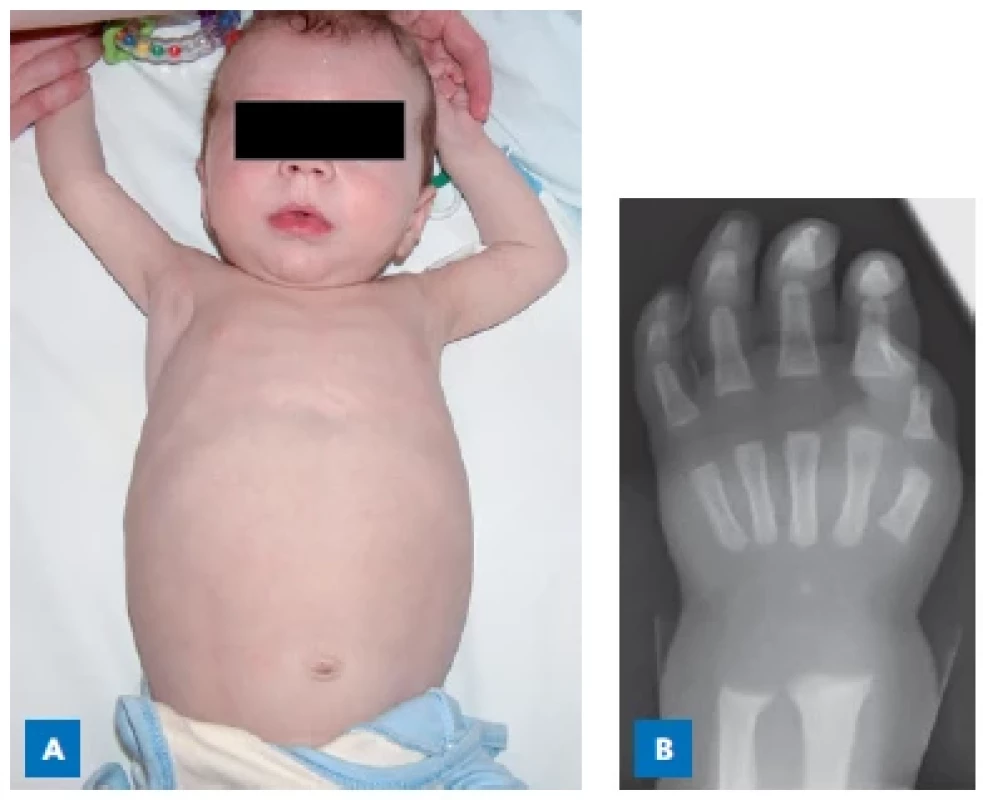
Diagnostika: je založena na klinickém podezření a laboratorních projevech z postižení jaterních a ledvinných funkcí. Diagnózu podporuje zvýšená hladina aminokyseliny tyrosinu v séru, zvýšená hladina sukcinylacetonu v suché kapce krve nebo moči a zvýšené vylučování δ-aminolevulové kyseliny. Diagnózu je nutno potvrdit na molekulární úrovni vyšetřením genu FAH. Vysoká hladina ɑ1-fetoproteinu je důležitým laboratorním markerem možného rozvoje hepatocelulárního karcinomu. V některých zemích je diagnostika HT 1 součástí LNS.
Terapie: ihned po stanovení diagnózy by měla být zahájena léčba nitisinonem, který zabraňuje tvorbě toxických metabolitů inhibicí enzymu 4-OH-fenylpyruvát dioxygenázy, metabolického kroku předcházejícího vzniku fumarylacetoacetátu. Nitisinon významně snižuje riziko rozvoje hepatocelulárního karcinomu, ale naopak významně zvyšuje hladiny tyrosinu, a proto je nutná i nízkobílkovinná dieta se sníženým obsahem tyrosinu a fenylalaninu doplněná směsí esenciálních aminokyselin bez těchto aminokyselin (tab. 2). Dietu lze uvolnit po úspěšné transplantaci jater.
Leucinóza
Etiologie a patogeneze: leucinóza (nemoc javorového sirupu, maple sirup urine disease – MSUD) je způsobena poruchou dehydrogenáz 2-oxokyselin s rozvětveným řetězcem, které se podílejí na metabolismu leucinu, valinu a isoleucinu. V důsledku metabolické poruchy se v těle hromadí nejen aminokyseliny s rozvětveným řetězcem, ale i alloisoleucin a vysoce toxické ketoanalogy (např. kyselina 2-oxoisokaproová). Výskyt MSUD je 1 : 94 000, dědičnost je autozomálně recesivní.(10)
Klinické projevy: onemocnění se nejčastěji projevuje mezi 4.–7. dnem života hypotonií, poruchou sání a rychle progredující poruchou vědomí s křečemi a stáčením do opistotonu. U postiženého dítěte je nápadný zápach moče po javorovém sirupu nebo po maggi, zejména je-li dítě umístěno v inkubátoru.(10)
Intermediální forma leucinózy se obvykle projevuje až v kojeneckém, batolecím nebo předškolním věku nechutenstvím, neprospíváním, poruchou růstu, atakami zvracení po jídle s vyšším obsahem bílkovin a poruchou vývoje. Průběh onemocnění je na rozdíl od pacientů s klasickou leucinózou mírnější, ale při katabolismu v průběhu respiračních či gastrointestinálních onemocnění se mohou rozvinout i příznaky těžkého metabolického rozvratu s křečemi, poruchou vědomí a edémem mozku.
Intermitentní forma leucinózy se projevuje metabolickým rozvratem se změnou chování pouze v období akutních infekcí nebo zvýšené zátěže. Pokud ataky nejsou časté a příliš intenzivní, pacienti mohou prospívat a mají normální psychomotorický vývoj. Dlouhodobá prognóza pak závisí na frekvenci a tíži metabolických dekompenzací.
Zvláštní variantou je thiamin responzivní forma leucinózy, která klinicky probíhá obdobně jako intermediální forma. Pacienti mají zbytkovou aktivitu dehydrogenázy pro větvené α-oxokyseliny mezi 2–30 % normy a velmi dobře reagují na podání thiaminu.(10)
Diagnostika: je založena na LNS. Je však nutné zmínit, že mírnější formy onemocnění (případně forma intermitentní) nemusí být LNS zachycené. Laboratorní vyšetření ukazuje masivní ketózu s méně vyjádřenou metabolickou acidózou, v krvi jsou zvýšeny koncentrace leucinu, valinu, isoleucinu a alloisoleucinu a v moči jsou vysoké koncentrace 2-oxokyselin. Diagnózu je třeba potvrdit enzymatickým vyšetřením a/nebo na molekulární úrovni.
Terapie: u pacientů s akutním metabolickým rozvratem je třeba urychleně snížit hladiny neurotoxických metabolitů. Nejúčinnější je hemodialýza nebo hemodiafiltrace. U méně závažně nemocných pacientů je metodou volby snaha zastavit katabolismus pomocí infuzí glukózy s ionty a eventuální podporou malé dávky inzulinu, který má i anabolickou funkci. Dostatečně vysoký kalorický příjem je zajištěn i pomocí nutriční podpory s tukovými emulzemi. V případě křečí je nutná antikonvulzivní terapie. Dlouhodobá léčba je založená na nízkobílkovinné dietě se sníženým příjmem přirozených bílkovin v závislosti na věku a individuální toleranci (tab. 2). Denní potřeba bílkovin je suplementována speciální směsí esenciálních aminokyselin bez leucinu, isoleucinu a valinu. U části pacientů na přísné dietoterapii se hladina leucinu upravuje, ale současně dochází k příliš výraznému poklesu hladiny isoleucinu a valinu s následným neprospíváním a poruchou proteosyntézy. V tomto případě i děti s leucinózou potřebují suplementaci isoleucinu a/nebo valinu.(10) Výživu je vždy nutno doplnit o mikronutrienty a vitaminy. Část pacientů s leucinózou je thiamin responzivní a vysoké dávky vitaminu B1 umožňují určité zvolnění diety. Naopak u pacientů, u kterých se dlouhodobě nedaří udržet dobrou metabolickou kompenzaci pomocí diety, je třeba zvažovat indikaci léčby pomocí transplantace jater.
Homocystinurie
Etiologie a patogeneze: homocystinurie, způsobená poruchou cystathionin β-syntázy (CBS), je nejčastějším onemocněním s poruchou metabolismu sirných aminokyselin, které slouží jako donor methyl skupiny pro > 300 enzymů a tvorbu bazického myelinového proteinu, kreatinu, fosfolipidů, glutathionu, sirných neurotransmiterů atd. Dědičnost je autozomálně recesivní. Vzácnější formy geneticky podmíněné hyperhomocysteinemie jsou způsobeny poruchou enzymů, které se podílejí na zpětné přeměně homocysteinu na methionin nebo na metabolismu kobalaminu. Navíc dochází i k poruše rovnováhy mezi S-adenosylmethioninem a S-adenosylhomocysteinem s negativním dopadem na methylační reakce v těle. Klasická homocystinurie je poměrně vzácné onemocnění, ale sekundární hyperhomocysteinemie je častá, především při deficitu vitaminu B12 nebo folátů.(11)
Klinické projevy: klasická homocystinurie, která je pyridoxin non-responzivní, se projevuje v dětství a dospívání poruchami chování a kognitivních funkcí, vyšší postavou, skoliózou, arachnodaktylií (obr. 3), těžkou myopií, dislokací čoček, tromboembolickými příhodami a osteoporózou. Podobnost s Marfanovým syndromem se vysvětluje poruchou struktury pojiva s redukcí disulfidových vazeb fibrilinu 1 a nedostatkem cysteinu. V patofyziologii cévních příhod se zvažuje řada faktorů, ale nejvíce přijatelnou teorií je toxicita homocysteinu při hodnotách > 100 μmol/l v indukci stresu endoplasmatického retikula v endotelových buňkách, porušená nitrobuněčná signalizace a zvýšená tvorba disulfidických vazeb u bílkovin. Projevy onemocnění u pacientů s pyridoxin senzitivní formou homocystinurie jsou mírnější.(11)
Obr. 3. 10letý chlapec s homocystinurií. A – skolióza, mírná deformita hrudníku, genua valga s atypickou konfigurací kolenních kloubů v rámci metabolické osteopatie. B – arachnodaktylie u stejného chlapce. 
Diagnostika: je součástí LNS, jinak je založena na klinickém podezření a průkazu vysokých hladin homocysteinu a methioninu v krvi spojených se sníženou hladinou cystathioninu a cysteinu. Diagnózu je třeba potvrdit na enzymatické a/nebo molekulární úrovni. Sekundární hyperhomocysteinemie je nejčastěji způsobena deficitem vitaminu B12 při chronické gastritidě nebo veganství.
Terapie: závisí na výsledku testu s pyridoxinem. Asi polovina pacientů s pyridoxin senzitivní formou onemocnění reaguje příznivě na podávání vitaminu B6 a kyseliny listové (tab. 2). U pacientů s pyridoxin non-responzivní homocystinurií se používá dieta se sníženým příjmem přirozených bílkovin (0,5–0,8 g/kg/den) a methioninu (5–15 mg/kg/ den) dle věku a individuální tolerance, která je suplementovaná směsí esenciálních aminokyselin bez methioninu. Cílem léčby je snížit hladinu homocysteinu v krvi < 80 μmol/l. Obsah methioninu ve vybraných potravinách je uveden v tabulce 3. U pacientů, u kterých dietní intervence nestačí k dosažení metabolické kompenzace, se do terapie přidává betain, který podporuje zpětnou remethylaci homocysteinu na methionin. Samotná léčba betainem není možná, protože by způsobila závažnou hypermethionemii. Je-li léčba zahájena v novorozeneckém období, zabrání rozvoji intelektové nedostatečnosti a je oddálen začátek a progrese dislokace čočky.
Glycinová encefalopatie (neketotická hyperglycinemie)
Etiologie a patogeneze: neketotická hyperglycinemie (NKH), porucha metabolismu aminokyseliny glycinu, je způsobena poruchami v multienzymatickém komplexu glycine cleavage system (GCS), který odbourává glycin na amoniak a CO2. Glycin působí v mozku na N-methyl-D-aspartát (NMDA) receptory, které mají důležitou roli v ontogenezi mozkového kortexu, a podílí se na formování excitability vyvíjejícího se mozku. V neuronálních kmenových buňkách v průběhu embryonálního vývoje působí glycin přímou excitací přes glycinové receptory, na neurony v oblasti mozkového kmene a míchy působí inhibičně. Vysoké koncentrace glycinu v mozku u postižených dětí mají závažný dopad na vývoj a funkce CNS.(12) Výskyt NKH se odhaduje na 1 : 76 000. Dědičnost NKH je autozomálně recesivní.
Klinické projevy: u více než 85 % pacientů se onemocnění projevuje již v novorozeneckém věku, u ostatních v průběhu kojeneckého až batolecího věku. U dobře adaptovaného novorozence se obvykle několik hodin až dní po porodu objevuje letargie, hypotonie a vymizí Moro reflex. Nakupí se apnoické pauzy a rozvinou se myoklonie s přechodem do tonicko - klonických křečí. Na EEG je obraz burst suppression (BS), který předchází rozvoji klinických příznaků a je přítomný již od narození. BS obraz mizí ve věku kolem 4 týdnů a přechází do hypsarytmie. MR CNS dokumentuje progresivní mozkovou atrofizaci s opožděnou myelinizací. Přítomna může být i dysgeneze corpus callosus a malformace gyrů, která však vzniká již intrauterinně. Psychomotorický vývoj postižených dětí se prakticky zastaví a hypotonie přechází do spasticity. Mírnější průběh onemocnění je méně častý.(12)
Diagnostika: je založena na průkazu zvýšené koncentrace glycinu v mozkomíšním moku (MMM) a zvýšeného poměru mezi koncentrací glycinu v MMM a krvi (> 0,08, norma 0,01–0,02). Pro účely genetického poradenství v rodině a prenatální diagnostiky je nutno potvrdit diagnózu i na molekulární úrovni. Enzymatické vyšetření GCS v jaterní biopsii se v ČR neprovádí.
Terapie: dieta s omezením glycinu ve stravě není obvykle úspěšná, k postižení CNS dochází již intrauterinně. U všech dětí je nutná antiepileptická terapie. Hladinu glycinu lze snižovat podáváním benzoátu sodného. Excitační vliv glycinu na NMDA receptory lze ovlivnit podáváním dextrometorfanu – antagonisty NMDA receptorů. V poslední době se zkouší ketogenní dieta.
Organické acidurie
Organické acidurie představují heterogenní skupinu 36 různých poruch intermediárního metabolismu. Nejčastější jsou methylmalonová acidurie, propionová acidurie, isovalerová acidurie a glutarová acidurie. Dědičnost u všech typů organických acidurií je AR.
Methylmalonová acidurie, propionová acidurie a isovalerová acidurie
Etiologie a patogeneze: methylmalonová acidurie (MMA; výskyt 1 : 50 000) je způsobena poruchou methylmalonyl - -CoA mutázy, která potřebuje jako kofaktor adenosylkobalamin (aktivní vitamin B12). Propionová acidurie (PA ; 1 : 90 000) je způsobena poruchou propionyl-CoA karboxylázy. Oba enzymy mají klíčovou roli v metabolismu valinu, isoleucinu, methioninu a threoninu a podílejí se i na metabolismu postranních řetězců cholesterolu a mastných kyselin s lichým počtem uhlíků. Isovalerová acidurie (IVA; 1 : 200 000) je způsobena poruchou isovaleryl-CoA dehydrogenázy, která se účastní metabolismu leucinu. U postižených dětí se hromadí jak aminokyseliny a organické kyseliny z metabolické dráhy nad úrovní konkrétní poruchy (např. kyselina methylmalonová, propionová nebo isovalerová), které jsou v nadbytku toxické, tak především vysoce hepatotoxické a neurotoxické metabolity vznikající alternativními metabolickými dráhami (např. 2-methylcitrát, 3-hydroxypropionát), které navíc inhibují glukoneogenezi, první enzym v cyklu močoviny, komplexy enzymů dýchacího řetězce a degradaci glycinu, a naopak aktivují NMDA receptory v mozku. Toxicita organických látek je zvýšena i sekundárním deficitem volného karnitinu, který se za normálních okolností váže na organické látky a snižuje jejich toxicitu.(13)
Klinické projevy: nejtěžší formy onemocnění obvykle začínají po krátkém bezpříznakovém období v prvních hodinách až dnech po porodu akutními projevy progredující toxické encefalopatie s ketoacidózou, hyperamonemií a hypoglykemií. Postižený novorozenec odmítá pít, nesaje, rozvíjí se apatie, hypotonie, apnoické pauzy, křeče a poruchy prokrvení. Mírnější formy onemocnění se projevují v kojeneckém až batolecím věku příznaky toxické encefalopatie při katabolismu v důsledku horečnatých infekcí, nechutenství, zvracení a průjmu. Rozvoj metabolické acidózy se projeví Kussmaulovým typem dýchání. U neléčených dětí s isovalerovou acidurií je typický zápach moči a potu po zpocených nohách. Opakované metabolické rozvraty u dětí s organickou acidurií vedou k opoždění psychomotorického vývoje a neurologické symptomatologii z poškození mozečku a bazálních ganglií (obr. 4). Častá je sekundární epilepsie, porucha kognitivních funkcí a mikrocefalie pro atrofii mozku. Akutní pankreatitida a kardiomyopatie jsou častými komplikacemi především u dětí s PA , ale vyskytují se i u dětí s MMA, u kterých často dochází i k rozvoji chronické renální insuficience s postižením i tubulárních funkcí.(13)
Obr. 4. MR CNS 14letého chlapce s methylmalonovou acidurií. V oblasti globus pallidus jsou symetrická pruhovitá ložiska zvýšeného signálu v T2-vážených obrazech (A) a sníženého signálu v T1-vážených obrazech (B). (S laskavostí poskytla Radiodiagnostická klinika VFN a 1. LF UK, Praha.) 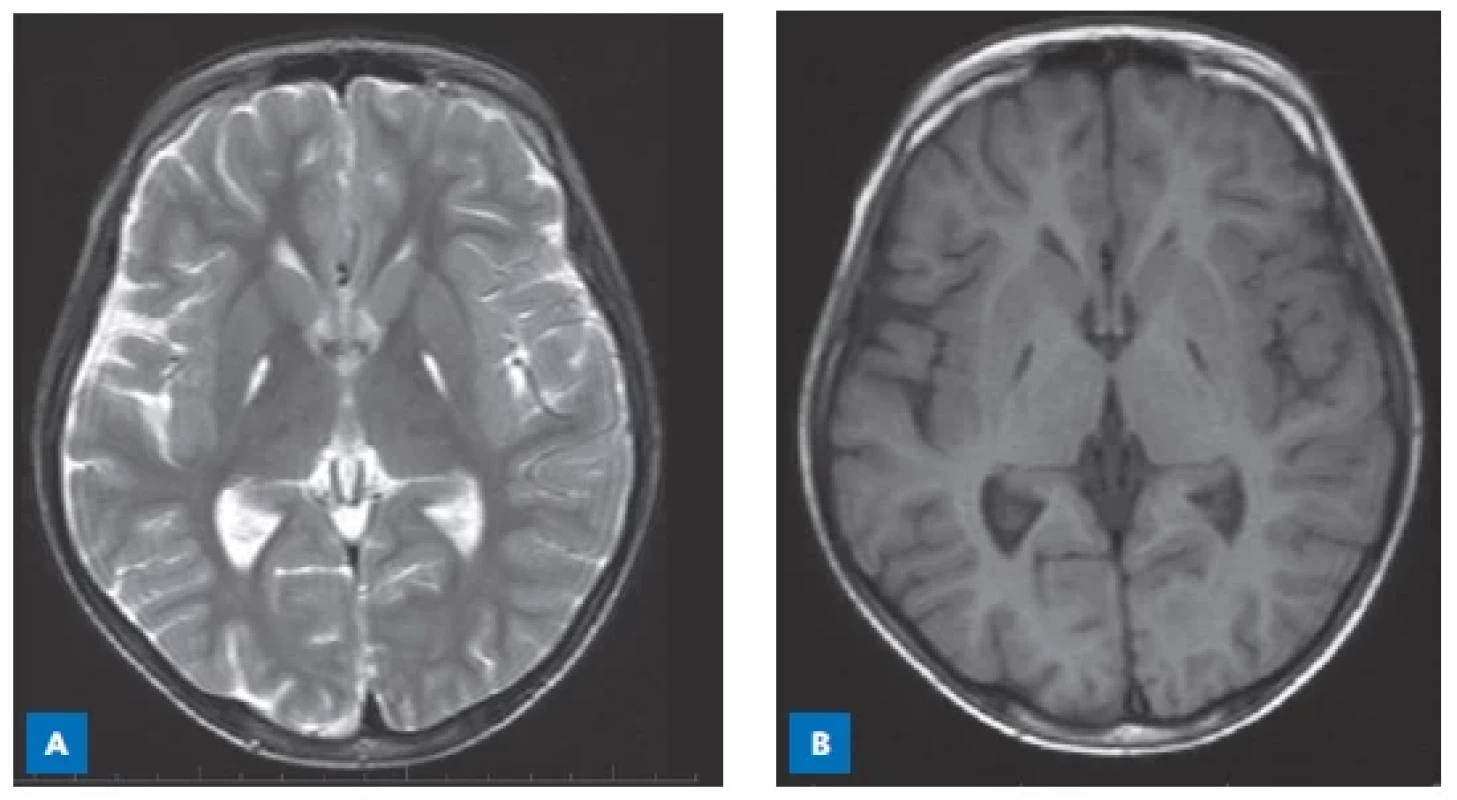
Diagnostika: je založena na klinickém podezření, přítomnosti metabolické acidózy, hyperamonemie, leukopenie a trombocytopenie, ale v některých zemích EU již probíhá novorozenecký screening. V ČR byla diagnostika isovalerové acidurie zařazena do LNS pro lepší prognózu léčených pacientů v porovnání s pacienty s MMA a PA . Diagnózu je třeba potvrdit selektivním metabolickým screeningem v suché kapce krve nebo vyšetřením organických kyselin v moči a dostupná je i diagnostika na molekulární úrovni.
Terapie: již při podezření na organickou acidurii je nutné zajistit dítěti dostatečný kalorický příjem formou glukózy (u novorozence a malého kojence minimálně 10, resp. 8 mg/ kg/min) v kombinaci s malou kontinuální dávkou inzulinu ve snaze zabránit katabolismu. Při hyperamonemii jsou lékem volby scavengery amoniaku – intravenózní benzoát sodný nebo perorální karglumová kyselina. Při vzestupu amoniaku nad 400 μmol/l se zahajuje hemodialýza nebo hemodiafiltrace. L-karnitin zvyšuje vylučování toxických metabolitů u dětí se zachovalou funkcí ledvin.
Dlouhodobá léčba je založena na nízkobílkovinné dietě s omezením přirozených bílkovin suplementovaná dle věku a tolerance směsí esenciálních aminokyselin bez isoleucinu, valinu, methioninu a threoninu v případě MMA/PA nebo bez leucinu v případě IVA. Podává se i L-karnitin, vitaminy a vápník a při metabolické acidóze bikarbonát sodný a/nebo Schollův roztok. Část pacientů s MMA potřebuje hydroxykobalamin. Zvýšenou potřebu energetického příjmu lze zajistit pomocí MCT olejů (tuků s mastnými kyselinami se středně dlouhým řetězcem) a škrobů, u kojenců jsou vhodnější polysacharidy na bázi maltodextrinů. Intermitentně, například 10 dní v měsíci, se u pacientů s MMA a PA podává metronidazol (případně amoxicilin nebo cotrimoxazol), které ve střevě snižují počet anaerobních bakterií podílejících se na endogenní tvorbě propionátu. Novou metodou léčby u metabolicky nestabilních pacientů s MMA a PA je podávání kyseliny karglumové, která snižuje hladinu amoniaku aktivací NAGS v cyklu močoviny.(13)
Glutarová acidurie typu 1
Etiologie a patogeneze: glutarová acidurie typu 1 (GA 1) je způsobena poruchou glutaryl-CoA dehydrogenázy, která se podílí na metabolismu lysinu, hydroxylysinu a tryptofanu. V těle stoupají koncentrace kyseliny glutarové a 3-hydroxyglutarové, které jsou vysoce toxické pro mozkové buňky (zejména působením na NMDA receptory). Zvyšuje se vylučování metabolitů sukcinátu a 2-oxoglutarátu, což dokumentuje současné postižení funkce Krebsova cyklu.(14) Výskyt GA 1 je cca 1 : 200 000.
Klinické projevy: příznaky onemocnění se projevují u kojenců hypotonií či zvýšenou dráždivostí a makrocefalií, někdy v souvislosti s rozvojem subdurálních hematomů či hygromů. Část kojenců s GA 1 prodělá po očkování nebo při nechutenství v průběhu akutního respiračního nebo gastrointestinálního onemocnění ataku encefalopatické krize s Reye-like syndromem, hypoglykemií a metabolickou acidózou. Po atace se rozvíjí centrální hypotonický syndrom s pozdějším přechodem do dystonie či spasticity,(14) zpomaluje se psychomotorický vývoj a objevuje se i sekundární epilepsie s patologickým nálezem na MR CNS (obr. 5).
Obr. 5. MR mozku 4,5letého chlapce s glutarovou acidurií typu 1 s obrazem výrazně dystrofických změn v levé hemisféře s relativním ušetřením centrální šedi. Subdurálně kolekce tekutiny, nejspíše hygrom, prakticky nad celou levou hemisférou. Komorový systém je rozšířen, více na levé straně, mírná retrakce středočárových struktur doleva (T2-vážený obraz). (S laskavostí poskytla Radiodiagnostická klinika VFN a 1. LF UK, Praha.) 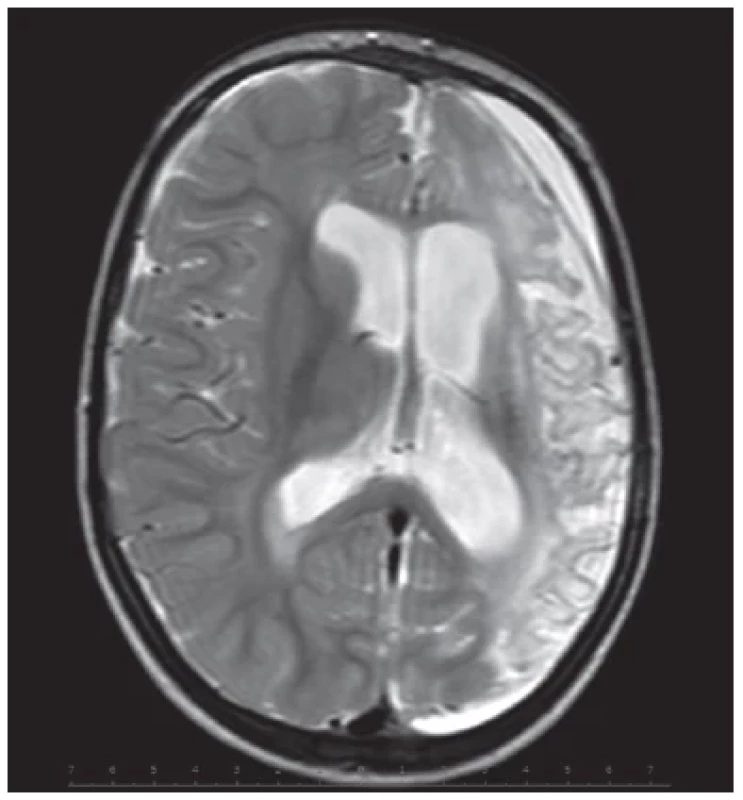
Diagnostika: provádí se v rámci LNS. Dostupná je i diagnostika na molekulární úrovni. Při metabolickém rozvratu jsou vysoké především hladiny lysinu, kyseliny glutarové a kyseliny 3-OH-glutarové. Zvyšuje se vylučování sukcinátu a 2-oxoglutarátu.
Terapie: základem chronické léčby, která má být zahájena co nejdříve po potvrzení diagnózy, je nízkobílkovinná dieta a prevence katabolismu vysoce energetickou výživou doplněnou polysacharidy na bázi maltodextrinů u kojenců a škroby u starších dětí. Přísnost nízkobílkovinné diety závisí na věku a individuální toleranci (tab. 2). Denní potřeba bílkovin pro růst a vývoj dítěte je zajištěna pomocí směsí esenciálních aminokyselin bez lysinu a se sníženým obsahem tryptofanu. Součástí léčby je trvalé podávání L-karnitinu, který se uplatňuje při konjugaci glutaryl-koenzymu A na netoxický glutarylkarnitin. Akutní léčba, zejména při horečce, nechutenství, zvracení či průjmu, vyžaduje výrazné snížení příjmu přirozených bílkovin, parenterální zajištění dostatečně vysokého energetického přísunu pomocí glukózy ve snaze zabránit katabolismu a kontinuální podávání malé dávky inzulinu ve snaze zabránit rozvoji hyperglykemie. Nezbytná je dostatečná hydratace, přísun L-karnitinu, iontů a kontrola acidobazické rovnováhy.(14) Názory na podávání riboflavinu u pacientů s GA 1 jsou kontroverzní. Také se neprokázalo, že by původně doporučované podávání kreatinfosfátu, jako vysoce energetické látky, N-acetylcysteinu a antioxidantů nebo antagonistů glutamátového receptoru vedlo ke zlepšení prognózy. Bohužel ani včasná diagnostika pomocí LNS a okamžité zahájení léčby nemusí být u části dětí s GA 1 vždy zárukou dobré prognózy.
Poruchy cyklu močoviny
Etiologie a patogeneze: cyklus močoviny je klíčová metabolická dráha složená z 6 enzymů, které syntetizují močovinu z amoniaku vznikajícího při degradaci bílkovin. Za normálních okolností je hladina amoniaku v krvi < 60 μmol/l (u novorozenců < 80), ale všechny poruchy cyklu močoviny na úrovni N-acetylglutamátsyntázy (NAGS), karbamoylfosfátsyntázy (CPS), ornitintranskarbamylázy (OTC), argininsukcinátsyntázy (citrulinemie), argininsukcinátlyázy (argininjantarová acidurie) a arginázy (argininemie) způsobí hyperamonemii, která působí neurotoxicky a hepatotoxicky. Na neurotoxicitě se spolupodílí i akumulace glutaminu. U argininjantarové acidurie se na encefalopatii podílí i abnormní produkce NO a akumulace argininosukcinátu a jeho derivátu quanidinosukcinátu.(15) Dědičnost poruchy OTC, která je nejčastější (cca 1 : 60 000), je gonozomálně recesivní, ale onemocnění se může manifestovat i u heterozygotních dívek. Všechny ostatní poruchy cyklu močoviny mají dědičnost AR.
Klinické projevy: příznaky se většinou projeví již v novorozeneckém nebo kojeneckém věku nechutenstvím, hypotonií, apatií a rychle progredující poruchou vědomí, edémem mozku, hepatomegalií a jaterním selháním. Prognóza neléčených dětí je prakticky infaustní. Mírnější formy onemocnění se projevují v předškolním a školním věku atakami jaterní encefalopatie, nejčastěji v průběhu gastrointestinálních obtíží.(15)
Diagnostika: je založena na klinickém podezření a vyšetření amoniaku v krvi, které má být dostupné v každé nemocnici. Hladina urey je snížená, vyšetření acidobazické rovnováhy na začátku ataky ukáže respirační alkalózu a později metabolickou acidózu. V krvi je zvýšená hladina kyseliny glutamové a glutaminu a nízká hladina argininu, pouze při argininemii je koncentrace argininu zvýšená. Vysoká koncentrace citrulinu svědčí pro citrulinemii či argininjantarovou acidurii, nízká koncentrace citrulinu a zvýšené vylučování kyseliny orotové pro poruchu OTC. U argininjantarové acidurie je navíc výrazně zvýšené vylučování kyseliny argininjantarové. Diagnózu je třeba potvrdit i na molekulární úrovni.
Terapie: nízkobílkovinná dieta s omezením příjmu přirozených bílkovin do 0,4–0,8 g/kg/den suplementovaná L-argininem (kromě pacientů s argininemií), L-citrulinem (kromě pacientů s citrulinemií, argininjantarovou acidurií a argininemií) a směsí esenciálních aminokyselin (0,2–0,6 g/ kg/den) dle věku, denní potřeby bílkovin a individuální tolerance. Benzoát sodný, fenylbutyrát sodný a/nebo fenylacetát sodný v pravidelných 3–4 denních dávkách pomáhá snižovat amoniak zvýšeným vylučováním nebílkovinného dusíku. Metodou volby u těžké formy onemocnění je transplantace jater a u poruchy OTC se již zkouší i genová terapie.
Akutní léčba: u novorozenců a kojenců se zahajuje při hladině amoniaku nad 120 μmol/l, u větších dětí při hladině amoniaku nad 100 μmol/l. Zastavuje se příjem bílkovin a navyšují se dávky L-argininu, benzoátu sodného, fenylbutyrátu a/nebo fenylacetátu sodného o cca 25 %. Nejpozději za 2–4 hodiny se amoniak musí zkontrolovat a při dalším vzestupu se zahajuje intravenózní podávání argininchloridu (250 mg/kg/den) a natriumbenzoátu (250 mg/kg/den) rozdělené do čtyř dávek. Současně je třeba zastavit katabolismus endogenních proteinů pomocí intravenózní infuze glukózy (3–10 mg/kg/min dle věku) s ionty, eventuálně s inzulinem. Při vzestupu amoniaku nad 400 μmol/l se zahajuje hemodialýza nebo hemodiafiltrace.(15)
Práce vznikla s podporou projektu RVO-VFN64165 a v rámci programu Cooperatio, vědní oblasti „Pediatrie“.
Korespondenční adresa:
prof. MUDr. Tomáš Honzík, Ph.D.
Klinika pediatrie a dědičných poruch metabolismu 1. LF UK a VFN
Ke Karlovu 2
120 00 Praha 2
tomas.honzik@vfn.cz
Zdroje
1. Honzík T, Kožich V, Pešková K, Votava F. Laboratorní novorozenecký screening. Ces-slov Pediat 2022; 77(1): 12–18.
2. Saudubray JM, Baumgartner MR, Walter JH. Inborn metabolic diseases: diagnosis and treatment. 6th ed. Heidelberg: Springer 2016 : 4–5.
3. Honzík T, Zeman J, et al. Dědičné poruchy metabolismu v kazuistikách. Praha: Mladá fronta 2016.
4. Kolářová H, Honzík T. Charakteristické klinické příznaky a laboratorních odchylky dědičných poruch metabolismu. Čes-slov Pediat 2018; 73(6): 348–364.
5. Honzík T, Zeman J. Výživa u dědičných metabolických poruch. In: Kohout P, et al. Klinická výživa. Praha: Galén 2021 : 779–798.
6. Blau N, Duran M, Gibson KM, et al. Physician’s guide to the diagnosis, treatment, and follow-up of inherited metabolic diseases. Heidelberg: Springer 2014.
7. van Wegberg AMJ, MacDonald A, Ahring K, et al. The complete European guidelines on phenylketonuria: diagnosis and treatment. Orphanet J Rare Dis 2017; 12(1): 162.
8. Zemanova M, Chrastina P, Sebron V, et al. Extremely low birthweight neonates with phenylketonuria require special dietary management. Acta Paediatr 2021; 110(11): 2994–2999.
9. Mayorandan S, Meyer U, Gokcay G, et al. Cross-sectional study of 168 patients with hepatorenal tyrosinemia and implication for clinical practice. Orphanet J Rare Dis 2014; 9 : 107.
10. Frazier DM, Allgeier C, Homer C, et al. Nutrition management guideline for maple sirup urine disease: an evidence and consensus-based approach. Mol Genet Metab 2014; 12(3): 210–217.
11. Morris A, Kožich V, Santra S, et al. Guidelines for the diagnosis and management of cystathionine beta-synthase deficiency. J Inherit Metab Dis 2017; 40(1): 49–74.
12. Hoover-Fong JE, Shah S, van Hove JL, et al. Natural history of nonketotic hyperglycinemia in 65 patients. Neurology 2004; 63 : 1847–1853.
13. Forny P, Hörster F, Ballhausen D, et al. Guidelines for the diagnosis and management of methylmalonic acidaemia and propionic acidaemia: first revision. J Inherit Metab Dis 2021; 44(3): 566–592.
14. Boy N, Mühlhausen Ch, Maier EM, et al. Proposed recommedations for diagnosing and managing individuals with glutaric aciduria type I: second revision. J Inherit Metab Dis 2007; 30(1): 5–22.
15. Häberle J, Burlina A, Chakrapani A, et al. Suggested guidelines for the diagnosis and management of urea cycle disorders: first revision. J Inherit Metab Dis 2019; 42(6): 1192–1230.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Bohumil Kubišta: Cirkus
- Co jsme psali
- Editorial
- Století Ervína Adama a příběh eradikace poliomyelitidy
- Poliomyelitída a problémy eradikácie
- Epidemiologie a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (PIMS-TS) v České republice
- Infekce vyvolané Clostridioides difficile u dětských pacientů Fakultní nemocnice v Motole
- Liečba spánkových porúch dýchania neinvazívnym pozitívnym pretlakom (NIV) – naše skúsenosti
- Iný pohľad na následky syndrómu CAN
- Nomofobie v pediatrické populaci
- Suprakondylické zlomeniny humeru v dětském věku – souhrnný přehled
- Nemocnost dětí ve věku 0–2 roky v okresech s rozdílným znečištěním ovzduší
- Dědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné poruchy metabolismu aminokyselin, organických kyselin a cyklu močoviny
- Suprakondylické zlomeniny humeru v dětském věku – souhrnný přehled
- Epidemiologie a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (PIMS-TS) v České republice
- Liečba spánkových porúch dýchania neinvazívnym pozitívnym pretlakom (NIV) – naše skúsenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





