-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Gregor Mendel a řízení růstu dítěte: geny, molekuly a pediatrická klinická praxe
Gregor Mendel and regulation of child’s growth: genes, molecules, and paediatric clinical routine
Determination of human growth is mostly genetic (80%) and only partially environmental (20%). The key genes regulating growth include genes encoding proteohormones a related molecules (growth hormone, IGF-1, IGF-2, acid-lable subunit ALS), hormonal receptors (receptors for growth hormone, IGF and pituitary releasing hormones – GHRH and ghrelin), with a limited role of enzymes (PAPPA 2). Genes encoding transcription factors regulate pituitary morphogenesis (sonic hedgehog cascade and others) and differentiation (PROP1, POU1F1) and also chondrocytes (SHOX). Structural molecules include components of cartilagineous extracellular matrix (gens encoding aggrecan, collagens, matrillin, fibrillin and others). The spectrum of genes responsible for both severe growth failure and minor variability of height includes genes for paracrine chondrocyte signalisation (FGFR3/NPR2 system), for intracellular signalisation (Ras-MAPK cascade, JAK-STAT signalling pathway) and for fundamental intracellular processes – regulation of DNA epigenetic modifications and control of DNA integrity. Genetic testing offers dual benefits: Immediate, as it bears an important information for the patient and his/her family about the disease nature, its future outcome and its inheritance – and a long-term – each testing contributes to understanding of disease mechanisms and to proposing novel therapies.
Keywords:
genes – Mendel – regulation of longitudinal growth – pituitary – chondrocyte
Autoři: Toni Ledjona *; Plachý Lukáš *; Amaratunga Anne Shenali *; Dušátková Petra; Kodytková Aneta; Koloušková Stanislava; Průhová Štěpánka; Lebl Jan
Působiště autorů: Pediatrická klinika 2. lékařské fakulty UK a Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (4): 206-213.
Kategorie: Souborný referát
doi: https://doi.org/10.55095/CSPediatrie2022/033Souhrn
Růst člověka je řízen z 80 % geneticky, jen 20 % se na něm podílejí vlivy prostředí. Pro růst jsou klíčové geny kódující proteohormony a podobné molekuly (růstový hormon, IGF-1, IGF-2, acidolabilní pojednotku ALS), hormonální receptory (receptor pro růstový hormon, pro IGF a pro spouštěcí hormony hypofýzy – GHRH a ghrelin) a v omezené míře enzymy (PAPPA 2). Důležité jsou geny pro transkripční faktory, které řídí morfogenezi (kaskáda sonic hedgehog a další) a diferenciaci adenohypofýzy (PROP1, POU1F1), ale také geny kódující transkripční faktory chondrocytů (SHOX). Ze strukturálních molekul jsou v popředí zájmu součásti chrupavčité mezibuněčné matrix (geny pro aggrecan, kolageny, matrilin, fibrilin a další). Spektrum genů zodpovědných jak za závažné růstové poruchy, tak za běžnou variabilitu růstu doplňují geny pro parakrinní signalizaci chondrocytu (systém FGFR3/NPR2), pro nitrobuněčnou signalizaci (Ras-MAPK kaskáda, JAK-STAT signalizační dráha) a pro fundamentální nitrobuněčné procesy, mezi které patří regulace epigenetických modifikací DNA a kontrola integrity DNA. Genetické testování má dvojí smysl: okamžitý, protože přináší důležitou informaci pro pacienta a jeho rodinu o podstatě odchylky, o jejím budoucím vývoji a o dědičném přenosu – a dlouhodobý, protože pomáhá porozumět mechanismu nemoci a navrhovat nové terapie.
Klíčová slova:
geny – Mendel – regulace longitudinálního růstu – hypofýza – chondrocyt
* tito tři autoři přispěli ke vzniku článku stejnou měrou
Gregor Johann Mendel představil výsledky svých experimentů a základní zákony dědičnosti na setkání Brněnského přírodovědného spolku (Naturforschendes Verein in Brünn) v roce 1865.(1) O několik let později, v roce 1869, objevil Friedrich Miescher v jádře buňky sloučeninu s nejasnou funkcí – deoxyribonukleovou kyselinu (DNA). V roce 1896 začal Archibald Edward Garrod studovat původ alkaptonurie – nápadné enzymatické poruchy. Nositelé patogenní varianty genu HGD, který kóduje enzym homogentisát 1,2-dioxygenázu, vylučují moč tmavnoucí na vzduchu. Na příkladu alkaptonurie ukázal, že enzymatické poruchy se v rodinách přenášejí podle Mendelových zákonů dědičnosti. Mendelovy zákony přenesl do klinické medicíny.(2)
V roce 1941 George Beadle a Edward Tatum prokázali, že geny kódují proteiny a předložili hypotézu „jeden gen = jeden protein“. Nastával zlatý věk genetiky. V roce 1953 Francis Crick a James Watson rozpoznali dvoušroubovici DNA jako nositelku genetické informace a za svůj objev byli oceněni Nobelovou cenou. V roce 1958 Crick navrhl systém tripletů jako klíčový princip zápisu genetické informace v DNA, rozpoznal výkonnou roli molekuly RNA a definoval „centrální dogma“ transkripce a translace genetické informace.
V roce 1961 další budoucí nobelista Marshall Nirenberg, mladý biochemik v americkém Národním institutu kloubních a metabolických onemocnění, identifikoval první triplet kódující aminokyselinu (TTT pro fenylalanin) a v následujících pěti letech se osobně přičinil o identifikaci kompletní sady 64 tripletů.(3) Začalo čtení genetické informace.
V roce 1972 Walter Fiers určil první genovou sekvenci a Fred Sanger v roce 1977 přečetl genom prvního celého organismu, fágu Phi-X174. Jeho tým v roce 1981 sekvenoval genom lidské mitochondrie.
Na přelomu tisíciletí byla postupně publikována sekvence celého lidského genomu jako výsledek jednoho z nejambicióznějších vědeckých projektů historie biomedicíny – Human Genome Project.(4) Díky technikám sekvenování nové generace (NGS) poznáváme v posledním desetiletí téměř každý týden funkce dalších a dalších genů, stále lépe rozumíme etiopatogenezi geneticky přenosných znaků, vývojových a funkčních variant i skutečných nemocí a umíme je mnohem lépe diagnostikovat a některé z nich cíleně léčit.
Geny, bílkoviny a růst dítěte
Poznávání spektra strukturálních i funkčních proteinů a jejich biologické úlohy v lidskému organismu krok za krokem odhalovalo podstatu biologických procesů.
Geny kódují: (1) proteohormony, (2) hormonální receptory, (3) enzymy, (4) transkripční faktory, (5) strukturální proteiny, (6) parakrinní regulační molekuly a jejich receptory, (7) nitrobuněčné signální molekuly, (8) molekuly řídící epigenetické modifikace – které řídí strukturu a přístupnost chromatinu, acetylaci a metylaci histonů či metylaci DNA, (9) reparační molekuly potřebné k zachování integrity DNA, (10) řadu dalších. Tyto jednotlivé skupiny proteinů se uplatňují také v řízení longitudinálního růstu člověka.
Genetické testování má dvojí smysl. Okamžitý – protože přináší důležitou informaci pro pacienta a jeho rodinu o podstatě poruchy, o jejím budoucím vývoji a dědičném přenosu. A dlouhodobý – protože pomáhá porozumět mechanismu nemocí a vývojových odchylek a navrhovat nové léčebné postupy.
Proteohormony
Prvními kandidáty při hledání genetické podmíněnosti růstu byly geny, které kódují cirkulující hormony s přímým vlivem na tělesný růst. Patří mezi ně gen GH1 pro molekulu lidského růstového hormonu a geny IGF1 a IGF2, které kódují oba růstové faktory podobné inzulinu – IGF-1 a IGF-2.
Těžký izolovaný deficit růstového hormonu (IGHD) je vzácnou nemocí s incidencí 1 : 4000 až 1 : 10 000.(5) Patogenní varianty GH1 genu jsou málo častou příčinou IGHD. Autozomálně recesivní přenos IGHD byl nejdříve prokázán u dětí s homozygotní delecí celého GH1 genu.(6) Děti s delecí genu GH1 mají nulové hladiny růstového hormonu a těžce zaostávají v růstu od prvního půlroku života. Některé z nich při léčbě růstovým hormonem začnou vytvářet neutralizační protilátky, protože si vůči molekule růstového hormonu nevyvinuly imunologickou toleranci (obr. 1).
Obr. 1. Dívka s patogenní variantou GH1 genu. Pro děti s těžkým deficitem růstového hormonu je typický vpáčený kořen nosu a široce prominující čelo. 
(foto archiv autorů) Patogenní varianty genu IGF1 byly u člověka dlouho považované za neslučitelné s přežitím, i když knock-out model myši s chybějícím Igf1 genem je dlouho známý a přežití umožňuje. Až v roce 1996 Woods se spolupracovníky popsala 15letého chlapce s částečnou delecí IGF1. Po těžké intrauterinní růstové restrikci (37. t.t., 1400 g / 38 cm, obvod hlavy 27 cm) následovala postnatálně závažná růstová retardace spojená s progredující mikrocefalií, senzorineurální hluchotou a mentálním deficitem (obr. 2).(7)
Obr. 2. První pacient s prokázanou delecí IGF1 genu ve věku 15 let. 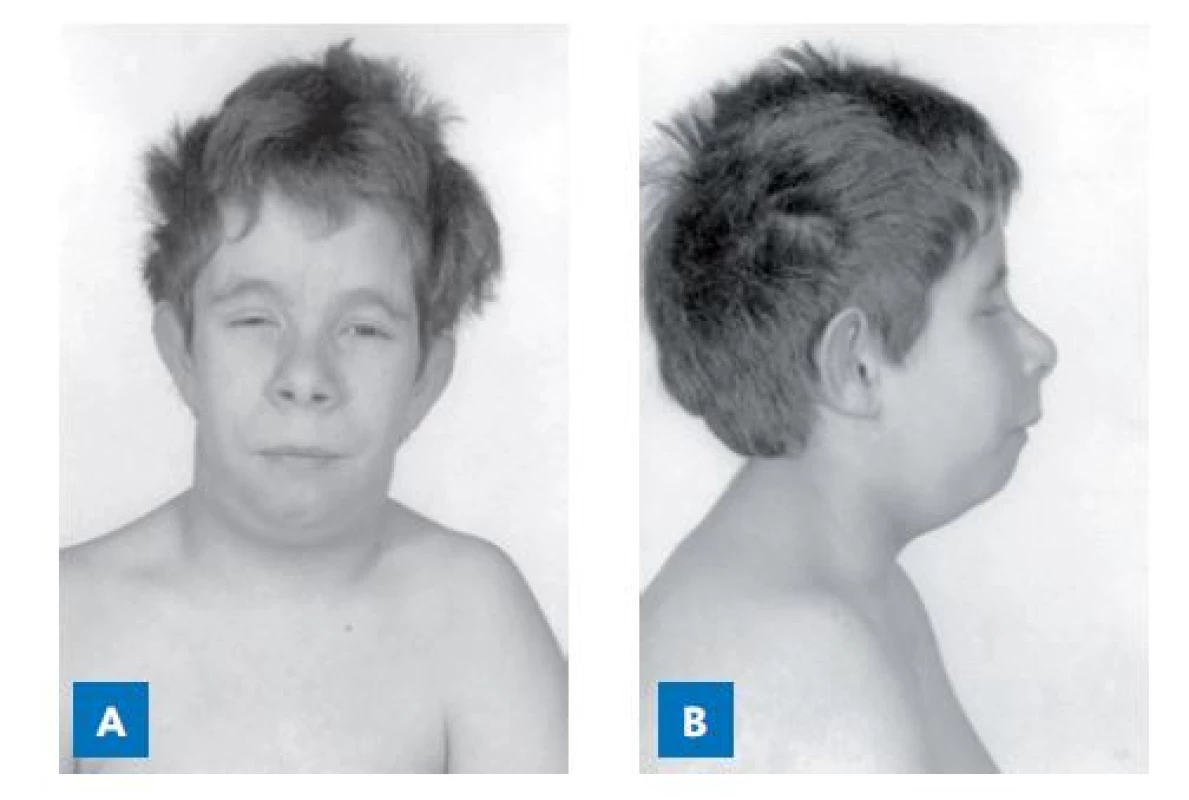
Převzato ze(7) IGF-1 cirkuluje v krvi převážně ve formě ternárního komplexu – ve spojení s vazebným proteinem IGFBP-3 a s acidolabilní podjednotkou (ALS). Tento ternární komplex chrání IGF-1 před rychlou degradací, významně prodlužuje jeho biologický poločas, a zajišťuje tak jeho dlouhodobé a vyvážené působení.
Zatímco v genu IGFBP3 dosud patogenní varianty popsány nebyly, patogenní varianty genu IGFALS, který kóduje molekulu ALS, způsobují mírnou až střední růstovou retardaci a mohou se přenášet autozomálně dominantně (monoalelicky).(8)
Molekula IGF-2 je důležitá zejména pro intrauterinní růst. Exprese genu IGF2 je narušena u nejčastější varianty Silverova–Russelova syndromu (11p15-SRS), v tomto případě ale jde o imprintingovou poruchu, nikoliv o mendelovskou dědičnost. Nedávno byla nalezena autozomálně dominantně přenesená patogenní varianta genu IGF2. Klinický obraz a růstový vzorec intrauterinní růstové restrikce s pomalým růstem v dětství se podobá Silverovu–Russelovu syndromu, nejsou vyznačené další známky syndromu.(9)
Zatím nebyly nalezeny patogenní varianty v genech, které kódují regulátory hypofyzární sekrece růstového hormonu – GHRH, somatostatin a ghrelin.(10)
Hormonální receptory
Patogenní varianty genu GHR, který kóduje receptor pro lidský růstový hormon, jsou příčinou necitlivosti k růstovému hormonu, pro kterou se vžil název Laronův syndrom – na počest objevitele této poruchy, žijícího klasika dětské endokrinologie prof. Zvi Larona z Izraele, který ji popsal již v roce 1966 v populaci aškenázských Židů (obr. 3).(11) Nositelé poruchy měli vysoké hladiny růstového hormonu, ale nízké IGF-1. Podávání růstového hormonu po dobu 7 dnů hladinu IGF-1 nezvýšilo.(12) Její molekulární podstata – neschopnost vazby růstového hormonu na receptor – byla prokázána v roce 1984.(13)
Obr. 3. Fenotyp chlapce s necitlivostí k růstovému hormonu (Laronovým syndromem) v důsledku patogenní varianty GHR genu 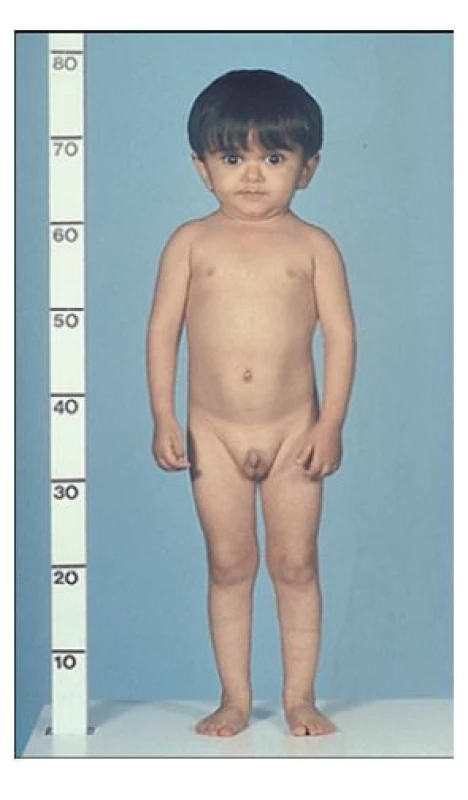
(foto laskavě poskytl prof. M. Savage ze svého archivu) Stejná porucha byla rozpoznána v židovských i arabských populacích severní Afriky, Blízkého východu a v importované podobě v několika vesnicích v ekvádorských Andách. V oblastech se zvýšeným výskytem je příčinou kombinace příbuzenských sňatků a tzv. efektu zakladatele – tedy vznik patogenní varianty u dávného předka, od kterého se varianta začala šířit v uzavřených populacích. Úlohu konsanguinity v hledání molekulární podstaty autozomálně recesivně podmíněných onemocnění, včetně porušené regulace růstu, jsme nedávno popsali v souborném článku, ze kterého částečně čerpá i tento přehled.(14)
Gen GHRHR kóduje receptor pro growth hormone-releasing hormone (GHRH). Tento receptor se exprimuje na somatotrofních buňkách adenohypofýzy a jeho stimulace prostřednictvím molekuly GHRH je předpokladem pro syntézu a sekreci růstového hormonu. Patogenní varianty GHRHR tedy vedou ke geneticky odlišné, ale klinicky podobné formě izolovaného deficitu růstového hormonu. Tato porucha byla poprvé popsána u sourozenecké dvojice z konsanguinní rodiny v Indii(15] a následně ve větším rozsahu u dětí i dospělých ze dvou vesnic v provincii Sindh v jižním Pákistánu – opět v důsledku kombinace efektu zakladatele a konsanguinity. Nositelé poruchy mají extrémně nízkou tělesnou výšku, prominující čelo, jsou obézní, ale zpravidla nemají jiné zdravotní problémy a jsou fertilní.(16) V jiných populacích jsou patogenní varianty GHRHR vzácné, ale při cíleném vyšetřování je lze mezi osobami s těžkým izolovaným deficitem růstového hormonu občas nalézt.
V nedávné době byl popsán také deficit růstového hormonu způsobený patogenní variantou genu GHSR (growth hormone secretagogue receptor), který kóduje receptor pro ghrelin – druhý ze „spouštěcích“ hormonů, který se podílí na řízení somatotrofních buněk hypofýzy.(17)
Gen IGFR kóduje receptor pro obě molekuly IGF – pro IGF-1 i IGF-2. Jeho monoalelické patogenní varianty jsou spojené s malým vzrůstem, který se v rodinách může dědit autozomálně dominantně. Jedná se o jednu z poměrně častých geneticky podmíněných forem familiárně malého vzrůstu s různým stupněm závažnosti podle tíže genové mutace.(18)
Enzymy
Enzymy se v regulaci růstu uplatňují omezeně, protože na rozdíl od steroidních a tyreoidálních hormonů je syntéza proteohormonů na enzymech nezávislá.
Jednou z mála výjimek je nedávno objevený enzym PAPPA 2 (pregnancy-associated plasma protein A2), kódovaný genem PAPPA2. Tento enzym štěpí ternární komplex IGF-1/ IGFBP3/ALS a zajišťuje dostupnost a biologickou účinnost volného IGF-1. Děti s bialelickými patogenními variantami genu PAPPA2 špatně rostou, přestože mají nápadně vysoké hladiny celkového IGF-1, IGFBP-3, acidolabilní podjednotky, ale také IGF-2 a IGFBP-5.(19)
Transkripční faktory
Morfogeneze hypofýzy je součástí embryonálního vývoje středočárových struktur mozku, očí, zrakových nervů, chiasmatu a zrakových drah. Tento proces koordinuje kaskáda transkripčních faktorů, která v dokonalé souhře zajišťuje časově ohraničenou transkripci cílových genů a diferenciaci buněčných populací, které utvářejí struktury CNS (obr. 4). Čím dříve ve vývoji nastává porucha, tím závažnější dysmorfie vznikají – od anencefalie přes kyklopii, anoftalmii, různě vyjádřené formy holoprosencefalie (obr. 5) až po nezřídka klinicky málo nápadný obraz septooptické dysplazie. Tyto poruchy jsou spojeny s variabilními formami hypopituitarismu – izolovaného deficitu růstového hormonu (IGHD) či kombinovaného deficitu hypofyzárních hormonů (CPHD).(20)
Obr. 4. Schematické znázornění funkce transkripčního faktoru. Transkripční faktor (regulátor) se váže na promotor cílového genu. Touto vazbou indukuje (případně potlačuje) transkripci tohoto genu. 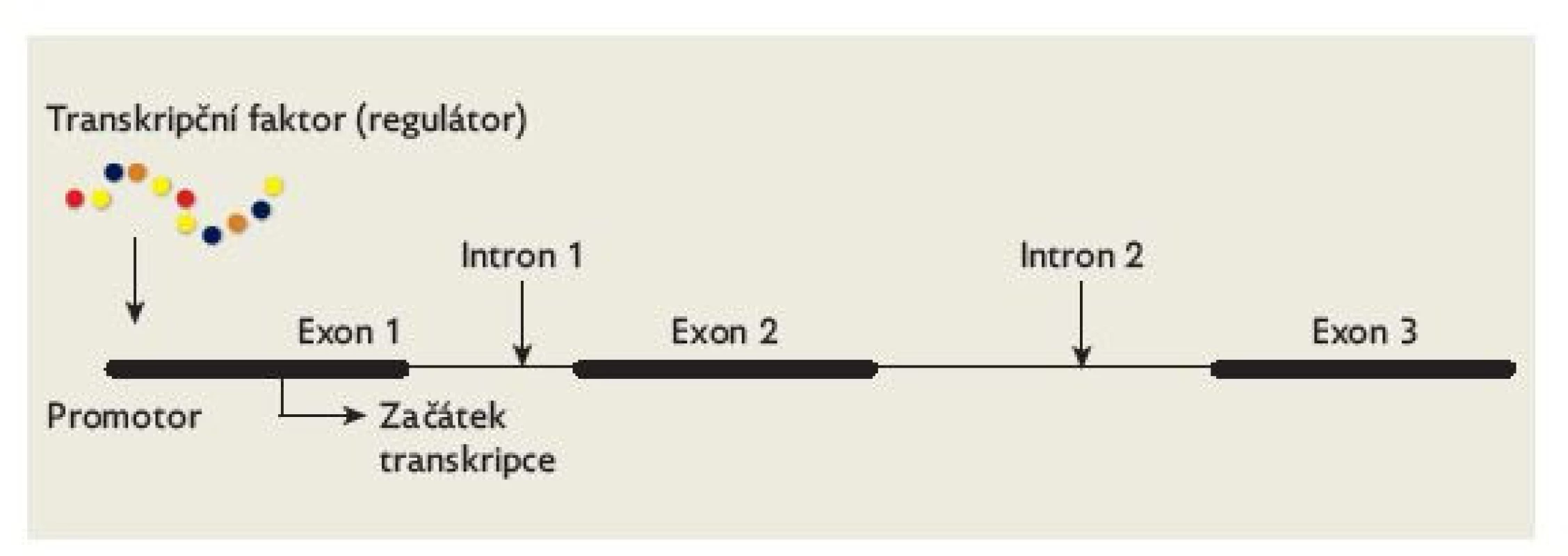
Obr. 5. Dívka se semilobární holoprosencefalií v důsledku mutace SHH genu. Narodila se s rozštěpem rtu a patra, deformací nosu, hypotelorismem, mikrocefalií a závažnou deformací mozku. Trpěla poruchami termoregulace, neurogenní hypernatremií, deficitem ACTH, ale zejména progredujícími křečemi s apnoickými pauzami a desaturacemi na podkladě heteropie mozkové tkáně. A – ve věku 2 měsíců. B– fetální MR v gestačním věku 30 týdnů. 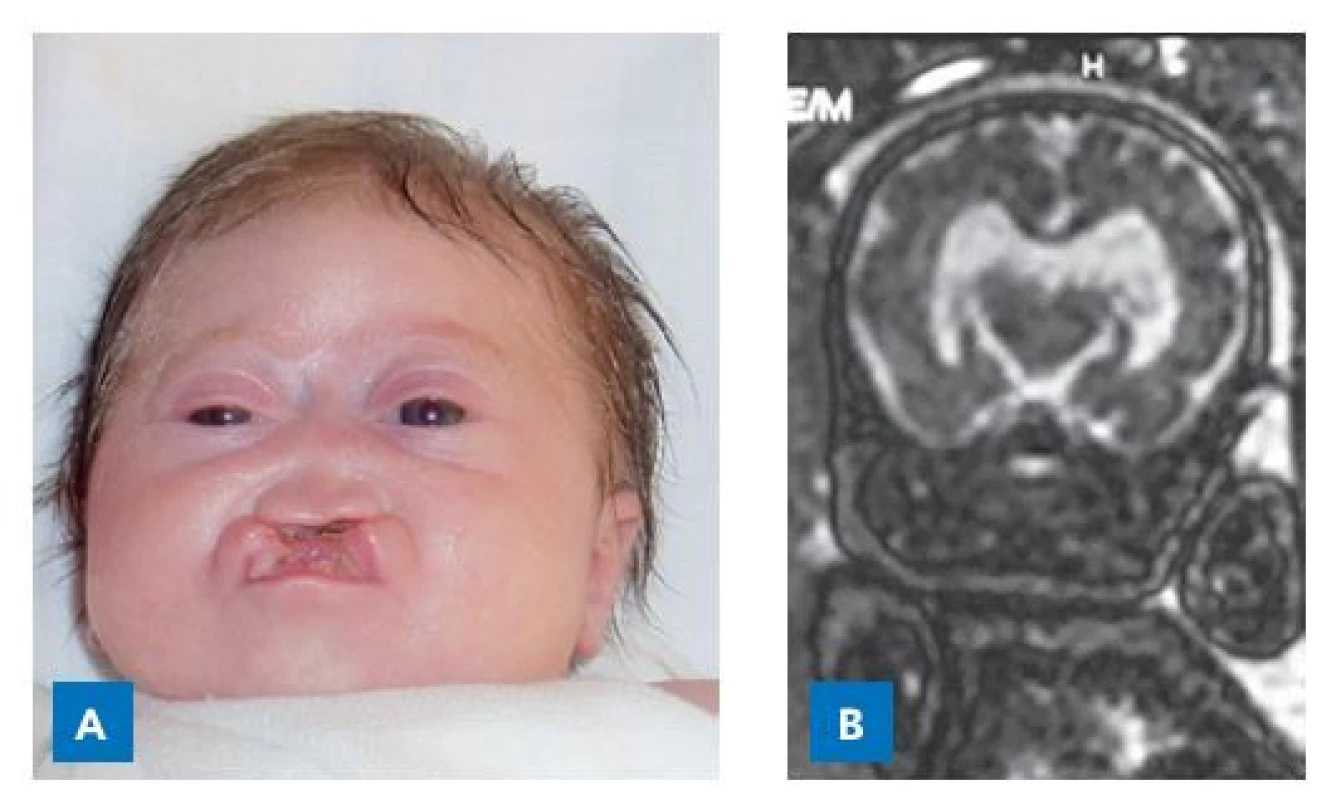
(foto archiv autorů) Typickou příčinou poruchy morfogeneze hypofýzy jsou patogenní varianty genů kaskády sonic hedgehog (SHH, PTCH1, GLI2) a dále např. genů OTX2, FGF8, HESX1, RIEG, SOX2, SOX3, LHX3, LHX4 a FOXA2, které kódují jednotlivé transkripční faktory.(11,21)
Na morfogenezi hypofýzy navazuje diferenciace hypofýzy – vznik pěti buněčných linií se specifickou hormonální produkcí, tedy somatotrofů (růstový hormon), tyreotrofů (TSH), gonadotrofů (FSH, LH), kortikotrofů (ACTH) a laktotrofů (prolaktin). Tuto fázi koordinují především transkripční faktory kódované geny PROP1 a POU1F1. Patogenní varianty PROP1 jsou nejčastější příčinou kombinovaného deficitu hypofyzárních hormonů ve střední a východní Evropě (obr. 6).(22–24)
Obr. 6. Fenotyp sedmiletého chlapce, který je složeným heterozygotem s dvěma patogenními variantami PROP1 genu. Měří 99 cm (− 4,5 SD), výškový věk odpovídá 3,4 roku. 
(foto archiv autorů) Bialelická patogenní varianta genu POU1F1 (původně nazvaného PIT1) byla poprvé popsána v roce 1992 u dvou sester z konsanguinní rodiny s klinickým obrazem podobným kretenismu. Dívky měly téměř nulové hladiny růstového hormonu, TSH a prolaktinu. Na tomto příkladu se podařilo poprvé prokázat, že defekt transkripčního faktoru ovlivní transkripci několika cílových genů (obr. 7).(25)
Obr. 7. Příznačný faciální fenotyp při mutaci POU1F1 genu. Chlapec měřil ve věku 2,5 roku 70 cm, měl růstový hormon po stimulaci 0,6 𝛍g/l, centrální hypotyreózu a hladinu prolaktinu pod dolní hranicí detekce. 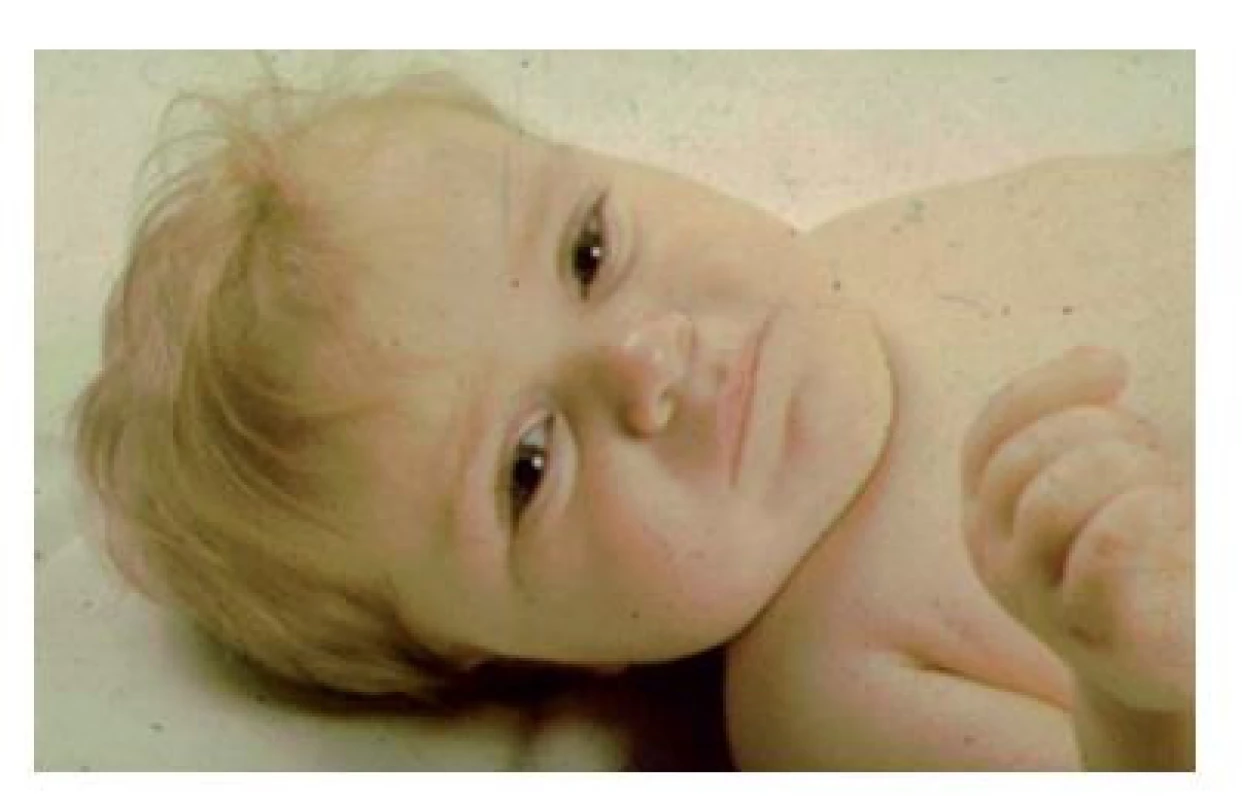
(foto archiv autorů) Transkripční faktory se uplatňují nejen v embryonálním a fetálním vývoji tkání a orgánů, ale mohou být i předpokladem jejich další funkce. Jedním z příkladů je SHOX protein, který je kódován genem SHOX – short stature homeobox-containing gene na X chromozomu. Ten je potřebný pro správnou funkci chondrocytů v růstové chrupavce. I když jeho přesná úloha není jasná, je zřejmé, že homozygotní mutace způsobují těžkou kostní dysplazii Langerova typu, zatímco monoalelické patogenní varianty stejně jako chybění genu u Turnerova syndromu vyvolají růstovou poruchu, která je někdy spojena s mírnou mezomelickou kostní dysplazií a s Madelungovou deformitou předloktí.(26,27)
Strukturální molekuly
Longitudinální růst probíhá v chrupavčité epifyzární růstové ploténce. Ta je efektorovou tkání, která zajišťuje prodlužování dlouhých kostí, zvyšování tělesné délky a výšky. Chondrocyty epifyzární růstové chrupavky procházejí řízenou buněčnou diferenciací z pluripotentních progenitorových buněk směrem k rychle proliferujícím buňkám a konečně k chondrocytům hypertrofické zóny novotvořené kosti.
Aktivní chondrocyty růstové chrupavky secernují chrupavčitou matrix, mezibuněčnou strukturu bohatou na kolageny a proteoglykany s řadou funkčních molekul významných pro tělesný růst.(11)
Gen ACAN kóduje bílkovinnou část proteoglykanu aggrecan. Aggrecan je hydrofilní proteoglykan, který přispívá k pružnosti chrupavky a podílí se na absorpci dynamického zatížení kloubů, kostí i páteře. Monoalelické patogenní varianty genu ACAN vedou ke klinickému obrazu familiárně malého vzrůstu, který může být u dospělých nositelů poruchy spojen s časnými kloubními a páteřními obtížemi.(28)
Mezi další součásti mezibuněčné matrix patří některé kolageny, fibrilin a matrilin, kódované geny COL2A1, COL9A1, COL10A1, COL11A1, FBN1, MATN3.(26,29,30) Patogenní varianty těchto genů v heterozygotní (monoalelické) formě způsobují mírnější růstovou poruchu, která může být dominantně dědičná (familiárně malý vzrůst). Homozygotní (bialelické) mutace se vyskytují častěji v konsanguinních rodinách – např. mutace MATN3 způsobuje těžkou formu autozomálně recesivní spondyloepimetafyzeální dysplazie (SEMD).(31)
Také poruchy strukturálních proteinů mimo epifyzární chrupavku mohou způsobit růstovou poruchu. Jedním z nich je lamin, protein tvořící vnitřní skelet membrány buněčného jádra. Je kódován genem LMNA. Některé patogenní varianty LMNA způsobují velmi závažný klinický obraz Hutchinsonovy – Gilfordovy progerie, syndromu předčasného stárnutí, který vede k časným úmrtím v důsledku cévních mozkových příhod (obr. 8).(32)
Obr. 8. Chlapec s Hutchinsonovou–Gilfordovou progerií (HGPS) v důsledku patogenní varianty genu LMNA. A – ve věku 1 měsíc. B – ve věku 3 roky. C – příčinou smrti ve 4 letech byla ischemie oblasti bazálních ganglií vpravo a kortexu a subkortikálních oblastí frontálního laloku vpravo. 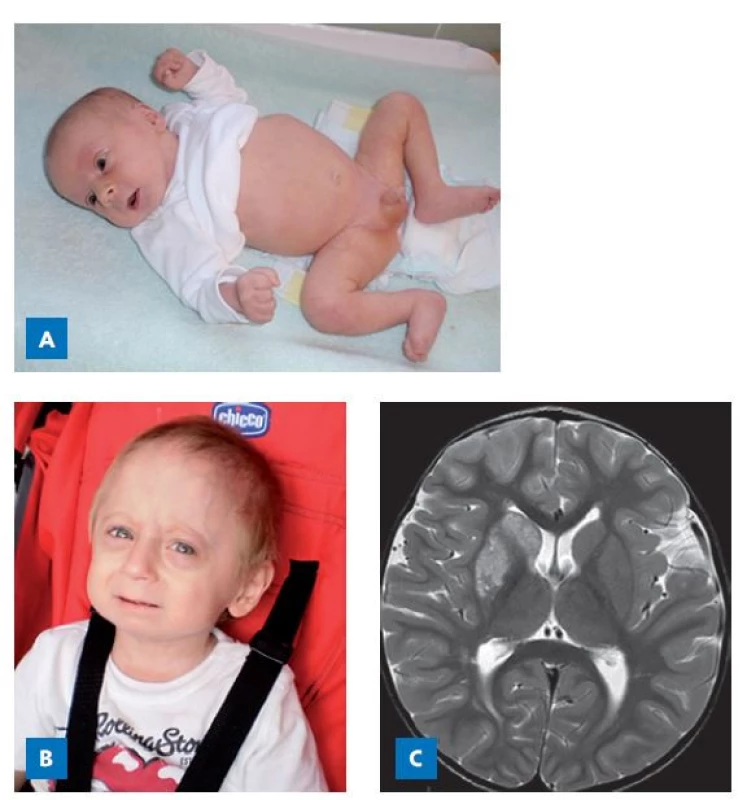
(foto archiv autorů) Parakrinní regulační molekuly a jejich receptory
Parakrinní signalizace je součástí řízení proliferace a diferenciace chondrocytů růstové ploténky a tvorby extracelulární matrix.(33) Důležité místo v parakrinní regulaci mají fibroblastové růstové faktory (FGF). Patogenní varianty genu FGFR3, který kóduje receptor pro FGF 3. typu, nepříznivě ovlivňují růst kosti a vedou ke spektru klinických fenotypů od tanatoformní dysplazie (fatální forma při bialelických patogenních variantách) přes achondroplazii, hypochondroplazii a „idiopatický malý vzrůst“ při monoalelických variantách různé tíže.(26)
Natriuretický peptid typu C (CNP) a jeho receptor NPR2 představují další parakrinní systém přímo spřažený se systémem FGF. Homozygotní inaktivační mutace genu NPR2 způsobují závažnou akromezomelickou kostní dysplazii typu Maroteaux, zatímco heterozygotní inaktivační mutace vedou k mírnější formě růstové poruchy, která se dědí autozomálně dominantně, a přestavuje tak další formu familiárně menšího vzrůstu. Vzhledem k odhadované četnosti heterozygotů 1 : 700 v běžné populaci je častou formou monogenně dědičného malého vzrůstu.(26,34,35) Aktivační mutace genu NPR2 způsobují naopak vysoký vzrůst, také dominantně dědičný.(36)
Mezi další geny zodpovědné za parakrinní regulaci chondrocytu patří například IHH, PTHLH a kostní morfogenní faktory (BMPs).(26)
Nitrobuněčné signalizační molekuly
Poruchy nitrobuněčné signalizace způsobují široké spektrum poruch, pro jejichž klinický obraz je typická také porucha růstu. Nejčastějšími jsou tzv. RASopatie, poruchy Ras/MAPK signalizační kaskády, které podle odhadů postihují 1 : 1000 osob. RASopatie zahrnují skupinu příbuzných stavů – syndrom Noonanové, Coffinův–Lowryho syndrom, Costellův syndrom, syndrom LEOPARD , Noonan-like syndrom with loose anagen hair a několik dalších.
Příčinou je abnormální aktivace Ras/MAPK signalizační dráhy, která přenáší informaci mezi membránovým receptorem pro růstové faktory a buněčným jádrem, ve kterém ovlivňuje transkripci genů důležitých pro buněčnou proliferaci, migraci, diferenciaci a apoptózu.(26,37) Pro Ras/MAPK kaskádu jsou klíčové geny PTPN11, KRAS, HRAS, SOS1, BRAF a SHOC2. 60 % případů vzniká jako de novo heterozygotní patogenní varianta, ve 40 % případů se varianta přenáší autozomálně dominantně (obr. 9).(37)
Obr. 9. Faciální fenotypy dětí se syndromem Noonanové na podkladě patogenních variant jednotlivých genů Ras/MAPK signalizační kaskády. A – SOS1; B – KRAS; C – SOS1; D – PTPN11; E – PTPN11; F – SHOC2 
(foto archiv autorů) Další nitrobuněčnou signalizační kaskádou důležitou pro růst je JAK-STAT systém. Přenáší do jádra buňky informaci o stimulaci receptoru pro růstový hormon. Patogenní varianty genu STAT5B,(38) které znemožňují přenos signálu, vedou k rezistenci vůči růstovému hormonu (jedna z variant Laronova syndromu), často ve spojení se závažnými infekcemi, protože stejná signalizace je klíčová pro funkci imunitního systému. Nedávno jsme popsali chlapce s patogenní variantou genu STAT3, který měl rezistenci vůči růstovému hormonu a spektrum časně nastupujících imunopatologických projevů – diabetes 1. typu, tyreoiditidu, bicytopenii, lymfoproliferaci a časté závažné infekce.(39)
Řízení epigenetických modifikací
Molekuly, které řídí epigenetické modifikace, ovlivňují strukturu a přístupnost chromatinu, acetylaci a metylaci histonů či metylaci DNA. Tím mohou zvyšovat či tlumit expresi jednotlivých cílových genů.
Syndrom kabuki způsobují patogenní varianty genu KMT2D, který kóduje H3-lysin-4-metyltransferázu (autozomálně dominantní nebo de novo mutace), nebo vzácněji genu UTX/KDM6A, kódujícího histon-H3-lysin-27-demetylázu (X-vázaný). Příznaky syndromu kabuki vznikají v důsledku nestability chromatinu, a tím nevyváženým přepisem určitých cílových genů.(40) Děti s tímto syndromem jsou hypotonické, vývojově poněkud opožděné s autistickými rysy a mají příznačný faciální fenotyp – obličej připomíná způsob líčení herců divadla kabuki, jedné ze tří forem tradičního japonského divadla (obr. 10). Všechny děti se syndromem kabuki mají poruchu růstu, často také orgánové anomálie srdce, ledvin a gastrointestinálního traktu a v dospělosti jim hrozí zvýšené riziko nádorů. Je zřejmé, že nestabilita chromatinu ovlivňuje jak časné embryonální a fetální období, tak i postnatální růst a vývoj.(41)
Obr. 10. Syndrom kabuki. A – fenotyp chlapce se syndromem kabuki na podkladě patogenní varianty genu KMT2D. B – způsob líčení herců při tradičním japonském divadle kabuki. C – dynamická metylace histonů, která zvyšuje či tlumí expresi jednotlivých genů. HMT – H3-lysin- -4-metyltransferáza (kódována genem KMT2D); HDM – histon-H3-lysin-27-demetyláza (kódována genem UTX/KDM6A). Mutace těchto genů mohou způsobit syndrom kabuki. 
(foto archiv autorů) Kontrola integrity DNA
Systémy, které opravují DNA, jsou potřebné pro optimální funkci všech buněk v lidském těle. Jejich porucha je příčinou těžké růstové retardace ze skupiny primordiálního nanismu. Příkladem je gen PCNT, který kóduje centrozomální protein pericentrin, důležitý pro zachování struktury DNA. Homozygotní patogenní varianty PCNT způsobují mikrocefalický osteodysplastický primordiální nanismus typu II – vzácnou poruchu, jejíž nositelé se rodí s hmotností pod 1500 g při porodu v termínu a nedosahují dospělé výšky ani 100 cm.(42)
Závěr
Lidský růst je komplexním biologickým fenoménem, který má snadno měřitelný průběh a výsledek. Až 80 % longitudinálního růstu člověka je podmíněno geneticky, jen přibližně z 20 % k němu přispívají vlivy prostředí. V nepřeberném množství genových variant se učíme nacházet ty, které pravděpodobně nebo s jistotou způsobují poruchu, a pomocí kritérií ACMG (American College of Clinical Genetics and Genomics) je odlišujeme od variant nevinných (benigních), pravděpodobně nevinných či od variant nejasného významu. Od „velké patologie“ pronikáme k subtilnějším variantám normy, uvědomujeme si obtížnost definice „zdraví“ a „nemoci“ a lépe rozumíme i vlivu genů na běžně přijímanou variabilitu tělesných znaků, mezi kterými má různorodost tělesné výšky významné místo. Bezděčně se tak vracíme k Mendelovi, který poznával principy genetiky na barvě květu a tvaru semen – tedy na variantách normy.
Poděkování
Výzkum genetické podmíněnosti růstu probíhá s podporou grantů AZV NV18-07-00283, NU21-07-00335, NU22J-07-00014 a grantů GA UK 340420 a 408120. Autoři děkují všem spolupracujícím lékařům, kteří jim posílají svoje komplikované dětské pacienty, a také rodičům dětí a dětem samotným za jejich spolupráci. Fotografie dětských pacientů jsou zveřejněny se souhlasem rodičů, kteří si přejí, aby přispěly ke vzdělávání lékařů a studentů medicíny.
Korespondenční adresa:
prof. MUDr. Jan Lebl, CSc.
Pediatrická klinika 2. lékařské fakulty a FN Motol
V Úvalu 84
150 06 Praha
Zdroje
1. Mendel G. Versuche über Pflanzenhybriden. Verhandlungen des naturforschenden Vereines in Brünn, Bd. IV für das Jahr 1865 : 3–47.
2. Garrod AE. The incidence of alkaptonuria: a study in clinical individuality. Lancet 1902; 2(4137): 1616–1620.
3. Nirenberg M. Historical review: Deciphering the genetic code – a personal account. Trends Biochem Sci 2004; 29 : 46–54.
4. Green ED, Watson JD, Collins FS. Human Genome Project: Twenty-five years of big biology. Nature 2015; 526 : 29–31.
5. Mullis PE. Genetics of growth hormone deficiency. Endocrinol Metab Clin North Am 2007; 36 : 17–36.
6. Phillips JA 3rd, Hjelle BL, Seeburg PH, Zachmann M. Molecular basis for familial isolated growth hormone deficiency. Proc Natl Acad Sci USA 1981; 78 : 6372–6375.
7. Woods KA, Camacho-Hübner C, Savage MO, Clark AJL. Intrauterine growth retardation and postnatal growth failure associated with deletion of the insulin-like growth factor I gene. N Engl J Med 1996; 335 : 1363–1367.
8. Toni L, Pádrová K, Plachý L, et al. Význam acidolabilní podjednotky (ALS) v etiologii a v diagnostice malého vzrůstu. Ces-Slov Pediat 2021; 75 : 214–218.
9. Begemann M, Zirn B, Santen G, et al. Paternally Inherited IGF2 mutation and growth restriction. N Engl J Med 2015; 373 : 349–56.
10. Dauber A, Rosenfeld RG, Hirschhorn JN. Genetic evaluation of short stature. J Clin Endocrinol Metab 2014; 99 : 3080–92.
11. Laron Z, Pertzelan A, Mannheimer S. Genetic pituitary dwarfism with high serum concentration of growth hormone--a new inborn error of metabolism? Isr J Med Sci 1966; 2 : 152–155.
12. Amselem S, Duquesnoy P, Attree O, et al. Laron dwarfism and mutations of the growth hormone-receptor gene. N Engl J Med 1989; 321 : 989–995.
13. Eshet R, Laron Z, Pertzelan A, et al. Defect of human growth hormone receptors in the liver of two patients with Laron-type dwarfism. Isr J Med Sci 1984; 20 : 8–11.
14. Amaratunga SA, Tayeb TH, Dusatkova P, et al. Invaluable role of consanguinity in providing insight into paediatric endocrine conditions: Lessons learnt from congenital hyperinsulinism, monogenic diabetes, and short stature. Horm Res Paediatr 2022; 95 : 1–11.
15. Wajnrajch MP, Gertner JM, Harbison MD, et al. Nonsense mutation in the human growth hormone-releasing hormone receptor causes growth failure analogous to the little (lit) mouse. Nat Genet 1996; 12 : 88 – 90.
16. Baumann G, Maheshwari H. The Dwarfs of Sindh: severe growth hormone (GH) deficiency caused by a mutation in the GH-releasing hormone receptor gene. Acta Paediatr Suppl 1997; 423 : 33–38.
17. Chanoine JP, De Waele K, Walia P. Ghrelin and the growth hormone secretagogue receptor in growth and development. Int. J. Obes 2009; 33(S1): S48–S52.
18. Klammt J, Kiess W, Pfäffle R. IGF1R mutations as cause of SGA. Best Pract Res Clin Endocrinol Metab 2011; 25 : 191–206.
19. Dauber A, Muñoz-Calvo MT, Barrios V, et al. Mutations in pregnancy-associated plasma protein A2 cause short stature due to low IGFI availability. EMBO Mol Med 2016; 8 : 363–74.
20. Riedl S, Vosahlo J, Battelino T, et al. Refining clinical phenotypes in septo - -optic dysplasia based on MRI findings. Eur J Pediatr 2008; 167 : 1269–76.
21. Gregory LC, Dattani MT. The molecular basis of congenital hypopituitarism and related disorders. J Clin Endocrinol Metab 2020; 105: dgz184.
22. Lebl J, Vosáhlo J, Pfaeffle RW, et al. Auxological and endocrine phenotype in a population-based cohort of patients with PROP1 gene defects. Eur J Endocrinol 2005; 153 : 389–96.
23. Navardauskaite R, Dusatkova P, Obermannova B, et al. High prevalence of PROP1 defects in Lithuania: phenotypic findings in an ethnically homogenous cohort of patients with multiple pituitary hormone deficiency. J Clin Endocrinol Metab 2014; 99 : 299–306.
24. Dusatkova P, Pfäffle R, Brown MR, et al. Genesis of two most prevalent PROP1 gene variants causing combined pituitary hormone deficiency in 21 populations. Eur J Hum Genet 2016; 24 : 415–20.
25. Tatsumi K, Miyai K, Notomi T, et al. Cretinism with combined hormone deficiency caused by a mutation in the PIT1 gene. Nat Genet 1992; 1 : 56–58.
26. Jee YH, Andrade AC, Baron J, Nilsson O. Genetics of Short Stature. Endocrinol Metab Clin North Am 2017; 46 : 259–281.
27. Shears DJ, Vassal HJ, Goodman FR, et al. Mutation and deletion of the pseudoautosomal gene SHOX cause Leri-Weill dyschondrosteosis. Nat Genet 1998; 19 : 70–73.
28. Gkourogianni A, Andrew M, Tyzinski L, et al. Clinical characterization of patients with autosomal dominant short stature due to Aggrecan mutations. J Clin Endocrinol Metab 2017; 102 : 460–469.
29. Plachy L, Dusatkova P, Maratova K, et al. Familial Short Stature - a novel phenotype of growth plate collagenopathies. J Clin Endocrinol Metab 2021; 106 : 1742–1749.
30. Plachy L, Strakova V, Elblova L, et al. High prevalence of growth plate gene variants in children with familial short stature treated with growth hormone. J Clin Endocrinol Metab 2019; 104 : 4273–4281.
31. Borochowitz ZU, Scheffer D, Adir V, et al. Spondylo-epi-metaphyseal dysplasia (SEMD) matrilin 3 type: homozygote matrilin 3 mutation in a novel form of SEMD. J Med Genet 2004; 41 : 366–372.
32. Toni L, Dušátková P, Novotná D, et al. Short stature in a boy with atypical progeria syndrome due to LMNA c.433G>A.(p.(Glu145Lys)]: apparent growth hormone deficiency but poor response to growth hormone therapy. J Pediatr Endocrinol Metab 2019; 32 : 775–779.
33. Kronenberg HM. Developmental regulation of the growth plate. Nature 2003; 423(6937): 332–6.
34. Bartels CF, Bükülmez H, Padayatti P, et al. Mutations in the transmembrane natriuretic peptide receptor NPR-B impair skeletal growth and cause acromesomelic dysplasia, type Maroteaux. Am J Hum Genet 2004; 75 : 27–34.
35. Plachy L, Dusatkova P, Maratova K, et al. NPR2 variants are frequent among children with familiar short stature and respond well to growth hormone. J Clin Endocrinol Metab 2020; 105: dgaa037.
36. Miura K, Namba N, Fujiwara M, et al. An overgrowth disorder associated with excessive production of cGMP due to a gain-of-function mutation of the natriuretic peptide receptor 2 gene. PLoS One 2012; 7: e42180.
37. Lebl J, Kolouskova S, Toni L, et al. Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie. Ces-Slov Pediat 2020; 75 : 219 – 226.
38. Klammt J, Neumann D, Gevers EF, et al. Dominant-negative STAT5B mutations cause growth hormone insensitivity with short stature and mild immune dysregulation. Nat Commun 2018; 9 : 2105.
39. Sediva H, Dusatkova P, Kanderova V, et al. Short stature in a boy with multiple early-onset autoimmune conditions due to a STAT3 activating mutation: Could intracellular growth hormone signalling be compromised? Horm Res Paediatr 2017; 88 : 160–166.
40. Wang YR, Xu NX, Wang J, Wang XM. Kabuki syndrome: review of the clinical features, diagnosis and epigenetic mechanisms. World J Pediatr 2019; 15 : 528–535.
41. Boniel S, Szymańska K, Śmigiel R, Szczałuba K. Kabuki syndrome – clinical review with molecular aspects. Genes (Basel) 2021; 12 : 468.
42. Rauch A, Thiel CT, Schindler D, et al. Mutations in the pericentrin (PCNT) gene cause primordial dwarfism. Science 2008; 319(5864): 816–819.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Co jsme psaliČlánek EditorialČlánek DystrofinopatieČlánek Sepse u dětíČlánek Pediatrická poezie
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Purkyňova cena za rok 2022 byla udělena prof. MUDr. Otto Hrodkovi, DrSc.
- Editorial
- Gregor Mendel slaví 200 let: ze zahrad augustiniánského kláštera v Brně až ke kauzální léčbě monogenně podmíněných chorob
- Dystrofinopatie
- Gregor Mendel a řízení růstu dítěte: geny, molekuly a pediatrická klinická praxe
- Genetická různorodost monogenního diabetu na Ukrajině
- Syndrom intelektuálního postižení související s DYRK1A
- Fabryho choroba v dětském věku – přehled a kazuistika
- Klinický fenotyp a genetická diagnostika raritného syndrómu cutis laxa u polystigmatizovaného novorodenca
- Pacient s Williamsovým–Beurenovým syndromem v ordinaci dětského lékaře
- Diferenciální diagnostika mikroskopické hematurie
- Hypertermie, její příčiny a rizika z pohledu patofyziologa
- Sepse u dětí
- Za MUDr. Janem Škovránkem, CSc.
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sepse u dětí
- Diferenciální diagnostika mikroskopické hematurie
- Hypertermie, její příčiny a rizika z pohledu patofyziologa
- Dystrofinopatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



