-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapie teduglutidem u pacientů se syndromem krátkého střeva
Teduglutide therapy in patients with short bowel syndrome
Short bowel syndrome (SBS) is defined as malabsorption resulting from anatomical loss of a significant length of the small intestine, that is unable to provide the body's nutritional needs. A completely new therapeutic option for patients with SBS is a pharmacological support of intestinal adaptation by the administration of teduglutide - an analogue of glucagon-like peptide 2 (GLP-2).
The article describes current knowledge about the effects of teduglutide, summarizes the indications, contraindications, side effects of treatment and current consensual recommendations for monitoring of patients during therapy. The goal of treatment with teduglutide is the reduction of the volume and caloric content of parenteral nutrition (PN), which leads to reduction in PN complications. In some patients the treatment may allow PN weaning. The reduction of PN volume is also associated with an improvement in the quality of life of patients and their parents.
Keywords:
short bowel syndrome – parenteral nutrition – glucagon-like peptide 2 (GLP-2) – teduglutide – children
Autoři: K. Špičáková; F. Fencl
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (3): 141-146.
Kategorie: Původní práce
Souhrn
Syndrom krátkého střeva (short bowel syndrome, SBS) je důsledkem redukce funkčně využitelné plochy střeva pod minimum schopné zajistit nutriční potřeby organismu. Zcela novou terapeutickou možností pro pacienty s SBS je farmakologická podpora adaptace střeva aplikací teduglutidu – analog glukagon-like peptidu 2 (GLP-2). Cílem léčby je možnost redukce objemu a kalorického obsahu parenterální výživy (PV), což vede ke snížení rizik komplikací PV.
Text popisuje současné poznatky o účincích tohoto nového léčebného prostředku, shrnuje indikace, kontraindikace, nežádoucí účinky léčby a aktuální konsenzuální doporučení pro sledování pacientů v průběhu terapie. Recentní práce prokázaly po 6 měsících terapie efektivitu u 85 % pacientů, u části pacientů může léčba vést až k dosažení nutriční autonomie a ukončení aplikace parenterální výživy. Se snížením objemu PV je spojeno zlepšení kvality života pacientů a jejich rodičů.
Klíčová slova:
syndrom krátkého střeva – parenterální výživa – glukagon-like peptid 2 (GLP-2) – teduglutid – deti
ÚVOD
Syndrom krátkého střeva (short bowel syndrome, SBS) je důsledkem redukce funkčně využitelné plochy střeva pod minimum schopné zajistit nutriční potřeby organismu. K resekci střeva a vzniku SBS může dojít z řady příčin – nejčastěji nekrotizující enterokolitida u nedonošených novorozenců, méně často volvulus, mnohočetné atrezie střeva, rozsáhlé aganglionózy střeva, vaskulární příhody gastrointestinálního traktu (GIT) a další. Tabulka 1 uvádí dělení možných příčin SBS podle periodizace dětského věku.
Zastoupení těchto stavů je v dětském lékařství významně odlišné od dospělých pacientů, zastoupení nejčastějších příčin SBS v dětském věku pak uvádí tabulka 2. Incidence SBS bývá většinou udávána v rozmezí 2–5 : 1 000 000, u novorozenců 2–3 : 10 000, u těžce nedonošených dokonce až 1–5 : 1000.
SBS je v pediatrii jednoznačně nejčastější indikací k provádění dlouhodobé a domácí parenterální výživy (PV), podle dat ze souboru dětských pacientů na domácí PV z ČR představuje SBS asi 70 % indikací k provádění domácí PV (z těchto pacientů byl téměř v 50 % SBS důsledkem rozsáhlé resekce střeva při nekrotizující enterokolitidě).
Tab. 1. Příčiny extenzivních intestinálních resekcí vedoucích potenciálně k syndromu krátkého střeva (SBS). 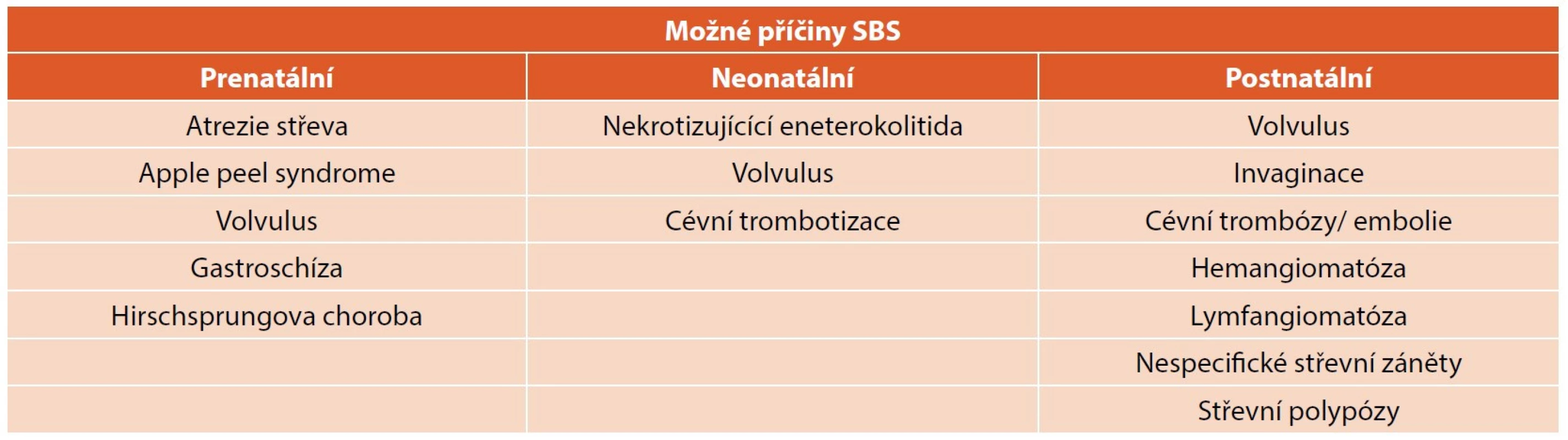
Tab. 2. Zastoupení nejčastějších příčin syndromu krátkého střeva (SBS) u dětí. 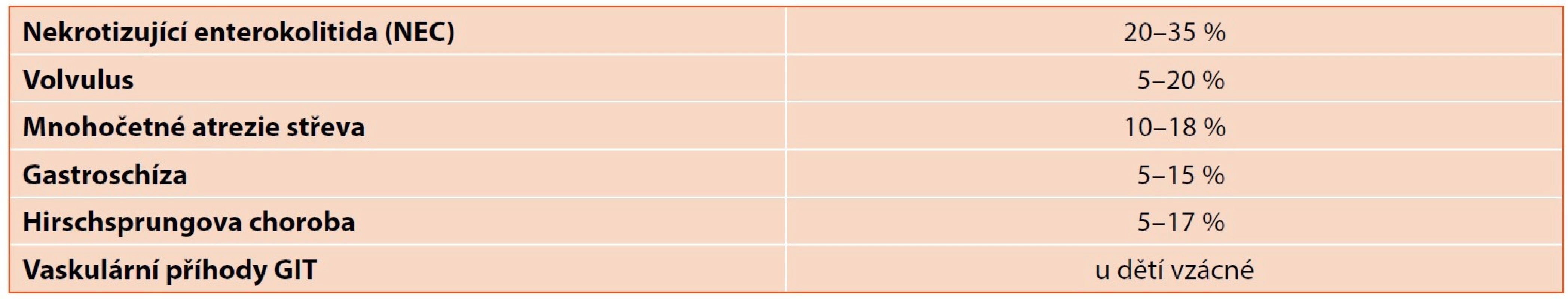
Tab. 3. Nežádoucí účinky teduglutidu. 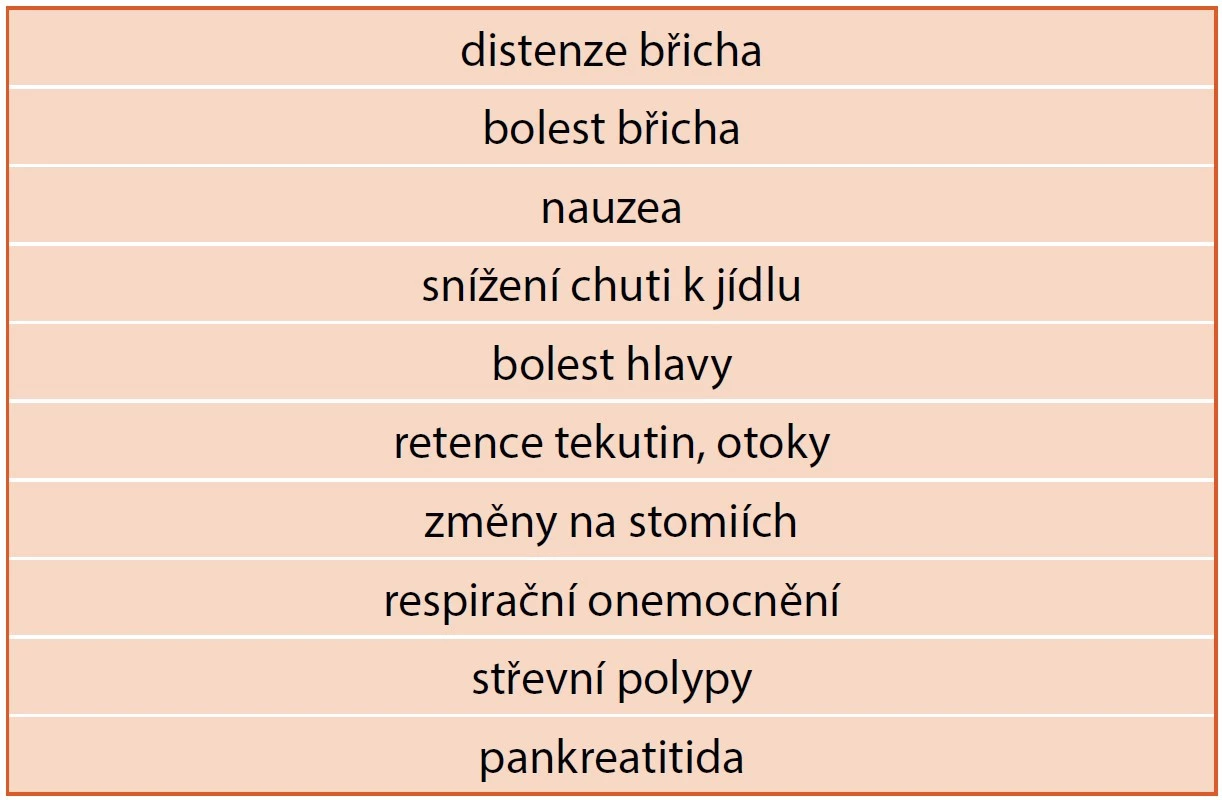
GLP-2, TEDUGLUTID
Léčba SBS zahrnuje enterální výživu, parenterální výživu (PV), farmakoterapii a chirurgickou terapii. Zcela novou terapeutickou možností pro pacienty s SBS je farmakologická podpora adaptace střeva aplikací teduglutidu – analoga glukagon-like peptidu 2 (GLP-2). GLP-2 je tvořen 33 aminokyselinami, ve střevě jej produkují L buňky [1]. Mezi jeho biologické účinky patří zvyšování průtoku krve v portálním řečišti, inhibice sekrece žaludečních kyselin a snižování střevní motility. Biologický poločas GLP-2 je velmi krátký, asi 7 minut. Pro terapeutické využití je nezbytný delší biologický poločas, čehož bylo u teduglutidu dosaženo záměnou 1 aminokyseliny (alanin nahrazenglycinem na druhé pozici N-konce GLP-2). Důsledkem je vyšší rezistence teduglutidu vůči degradaci a tedy delší biologický poločas [2]. Hlavními efekty terapie jsou zvýšení proliferace a snížení apoptózy buněk střevní sliznice vedoucí ke zvýšení výšky klků a hloubky krypt, zároveň dochází ke snížení permeability střevní sliznice, snížení motility a zvýšení průtoku krve střevem [3].
Studie prokázaly dobrou toleranci preparátu. Popisované nežádoucí účinky jsou shrnuty v tabulce 3, přičemž velmi časté jsou zejména distenze a bolesti břicha. Dlouhodobá stimulace růstu epiteliální sliznice vede k obavám, zda terapie nemůže vést ke vzniku malignit. V průběhu terapie byl popsán vznik polypů na sliznici střeva, nicméně jejich charakter je benigní (hyperplazie sliznice při stimulaci proliferace a inhibici apoptózy buněk). Podle studie z roku 2016 byl popsán vznik polypů u 9/51 léčených pacientů [2]. S ohledem na vznik polypů je nutné u dětí starších 12 let provádět před zahájením terapie endoskopické vyšetření k vyloučení přítomnosti polypů. Další kontrola následuje po roce terapie a dále v intervalu po 5 letech (tab. 8).
Ve studiích bývá kritérium efektivity léčby definováno jako snížení objemu PV o alespoň 20 % oproti výchozímu stavu před terapií. Nejvyšší efektivita byla prokázána u dávkování teduglutidu 0,05 mg/kg/den [4]. Studie STEPS zaměřená na efektivitu terapie SBS teduglutidem z roku 2012 [5] prokázala po 24 týdnech terapie efektivitu léčby u 63 % pacientů, zatímco ve skupině s placebem dosáhlo požadované redukce objemu PV o alespoň 20 % objemu jen 30 % pacientů (p = 0,002). U pacientů léčených teduglutidem dochází ke snížení parenterální potřeby tekutin v důsledku poklesu ztrát průjmy, neboť tento pokles není kompenzován navýšením perorálního příjmu či poklesem diurézy [5]. Terapie nevede jen k redukci objemu tekutin v PV (snížení ztrát střevem), ale umožňuje i redukci živin podávaných parenterálně (zlepšení vstřebávání živin střevem) [6]. Tato práce spolu s dalšími ukazuje také snížení počtu stolic během terapie [6, 7]. Recentní práce prokázaly při zachování stejného kritéria účinnosti léčby (redukce objemu PV o alespoň 20 %) po 6 měsících terapie efektivitu u 85 % pacientů, ukončení aplikace PV bylo možné u 25 % pacientů [8]. Dlouhodobější studie (1 rok terapie) dosahují dokonce více než 90% úspěšnost.
Ve studii sledující pediatrické pacienty se SBS z roku 2017 byla jedním ze sledovaných parametrů sérová koncentrace citrulinu. Citrulin je aminokyselina, která se téměř výlučně tvoří v enterocytech. Z klinického hlediska má význam snížená hladina, která odráží nedostatek funkční masy enterocytů [9]. Výsledky potvrdily korelaci mezi měnící se koncentrací citrulinu a změnou množství enterocytů, nepřesvědčivé však bylo porovnání se střevní absorpcí – nebyla pozorována jasná korelace mezi plazmatickou koncentrací citrulinu a redukcí množství PV [11].
Několik navazujících výzkumů mělo za cíl popsat další možné pozitivní dopady léčby. Metabolická kostní nemoc je rizikový faktor dlouhodobé parenterální výživy u pacientů s SBS. Jelikož GLP-2 snižuje koncentraci CTX (collagen type I fragments) v séru, byla zde možnost ovlivnění kostní resorpce u pacientů léčených teduglutidem. Dosud jsou ale závěry studií nejisté, jen několik málo léčených pacientů mělo snížené markery kostní resorpce a vyšší kostní denzitu [6].
Při snaze o predikci efektu terapie u individuálního pacienta lze vycházet ze studie autorů Jeppesen et al. z roku 2018. Jedná se o retrospektivní analýzu dat popisující 85 pacientů se selháním střeva na podkladě syndromu krátkého střeva léčených teduglutidem v letech 2008–2011. Tato studie prokazuje korelaci redukce objemu PV s objemem PV před zahájením terapie (větší pokles objemu PV u pacientů vyžadujících iniciálně větší objemy PV (graf 1) a rovněž závislost redukce objemu PV na anatomii střeva po resekci (nejlepší výsledky ve skupině pacientů s jejunostomií a střevem v kontinuitě při délce kolon pod 50 % (tab. 4).
Lze zobecnit, že u pacientů s jejunostomií (obvykle vyšší závislost na PV, vyšší objemy tekutin parenterálně, nižší stupeň adaptace střeva) lze očekávat nejlepší efekt na absorpci tekutin a tedy možnost redukce objemu PV [10]. Efekt terapie u této skupiny pacientů bude nejrychlejší a umožní nejvýraznější a časnou redukci objemu PV. V důsledku změn ztrát tekutin a iontů vyžadují tito pacienti intenzivnější monitoraci vnitřního prostředí v průběhu léčby. Cílem je u nich snížení objemu PV, s čímž je spojeno snížení řady metabolických komplikací vyplývajících z takto prováděné PV.
Graf 1. Korelace redukce objemu parenterální výživy s objemem parenterální výživy před zahájením terapie teduglutidem [10]. ![Korelace redukce objemu parenterální výživy s objemem parenterální výživy před zahájením
terapie teduglutidem [10].](https://pl-master.mdcdn.cz/media/image_pdf/e0a7c749b052408fc86b5f02bef472c3.jpeg?version=1624309205)
Tab. 4. Redukce objemu parenterální výživy u pacientů léčených teduglutidem v závislosti na anatomii reziduálního střeva [7]. ![Redukce objemu parenterální výživy u pacientů léčených teduglutidem v závislosti na anatomii reziduálního střeva [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/14844171151a7521dff2a1c2ee79efcc.jpeg)
Tab. 5. Indikační kritéria pro léčbu SBS teduglutidem u pediatrických pacientů. 
Tab. 6. Kontraindikace terapie teduglutidem. 
Na druhé straně spektra pacientů figurují jedinci s jejunokolickou anastomózou a dostatečnou délkou tlustého střeva. Je pro ně obvykle charakteristická nižší závislost na PV, nižší objem parenterálně aplikovaných tekutin, jejich střevo bývá obvykle lépe adaptováno. Efekt teduglutidu bude pravděpodobně méně výrazný a projeví se později po zahájení aplikace [10]. Takoví pacienti však budou mít nejvyšší pravděpodobnost dosažení nutriční autonomie, resp. ukončení podávání PV. Zároveň ve srovnání s první skupinou nekladou nároky na příliš frekventní kontroly vnitřního prostředí.
Důležitými faktory podporujícími zahájení terapie teduglutidem jsou omezená dostupnost centrálního žilního řečiště (stavy po trombózách) a závažná porucha růstu či neprospívání.
Indikace
Současná indikační kritéria k léčbě teduglutidem u dětí jsou uvedena v tabulce 5.
Kontraindikace
Kontraindikace vyplývají z SPC, jsou uvedeny v tabulce 6.
Sledování před zahájením terapie a v průběhu terapie
V případě rozhodnutí o zahájení terapie u daného pacienta je vhodné provést řadu vyšetření, která jsou shrnuta v tabulce 7. Platí, že péče o tyto pacienty musí probíhat ve specializovaných centrech.
Léčba spočívá v dlouhodobé subkutánní aplikaci teduglutidu v intervalech á 24 hodin v domácím prostředí. V průběhu terapie je nezbytné sledovat možné nežádoucí účinky, zejména u pacientů s přidruženým kardiovaskulárním onemocněním kontrolovat stav hydratace, zohlednit možné změny ve vstřebávání léků (zejména antikoagulancia, antihypertenziva, antiepileptika, hormony štítné žlázy apod.). S ohledem na individuální anatomii střeva po resekci je nutné pravidelné sledování sérových koncentrací vitaminů a stopových prvků – i na léčbě trvá riziko jejich deficitu. Vyšetření doporučená v průběhu sledování spolu s orientační frekvencí jejich provádění jsou uvedena v tabulce 8.
Zatím není zcela vyjasněna optimální délka terapie. Aktuálně platí, že terapie se ukončí kdykoliv z důvodu neakceptovatelné toxicity, nebo pokud není dosaženo po 52 týdnech terapie alespoň 20% redukce v objemu PV. Jinak by měla pokračovat, dokud přetrvává její účinnost.
V rámci Pediatrické kliniky FN Motol je nyní teduglutid podáván čtyřem dětským pacientům ve věkovém rozmezí od 18 měsíců do 13 let. U jednoho z pacientů, který je na terapii nejdéle (v době publikace tohoto článku celkově 6 měsíců), byl v rámci kontrolního endoskopického vyšetření popsán drobný polyp a vřed v anastomóze. Další léčení jsou dosud bez komplikací. Stran efektivity léčby pozorujeme u všech dětí na terapii splnění kritéria redukce objemu o 20 % a více. Indikační kritéria k podání teduglutidu nyní splňuje další pacient se syndromem krátkého střeva ve věku pěti let.
Tab. 7. Vyšetření nezbytná před zahájením terapie teduglutidem. 
(Upraveno z: Gesellschaft für Pädiatrische Gastroenterologie und Ernährung e. V. Positionspapier des GPGE Vorstands und der GPGE Arbeitsgruppe chronisches Darmversagen zu Teduglutid, 2018 [8]). Tab. 8. Vyšetření doporučená v průběhu sledování pacientů na terapii teduglutidem. 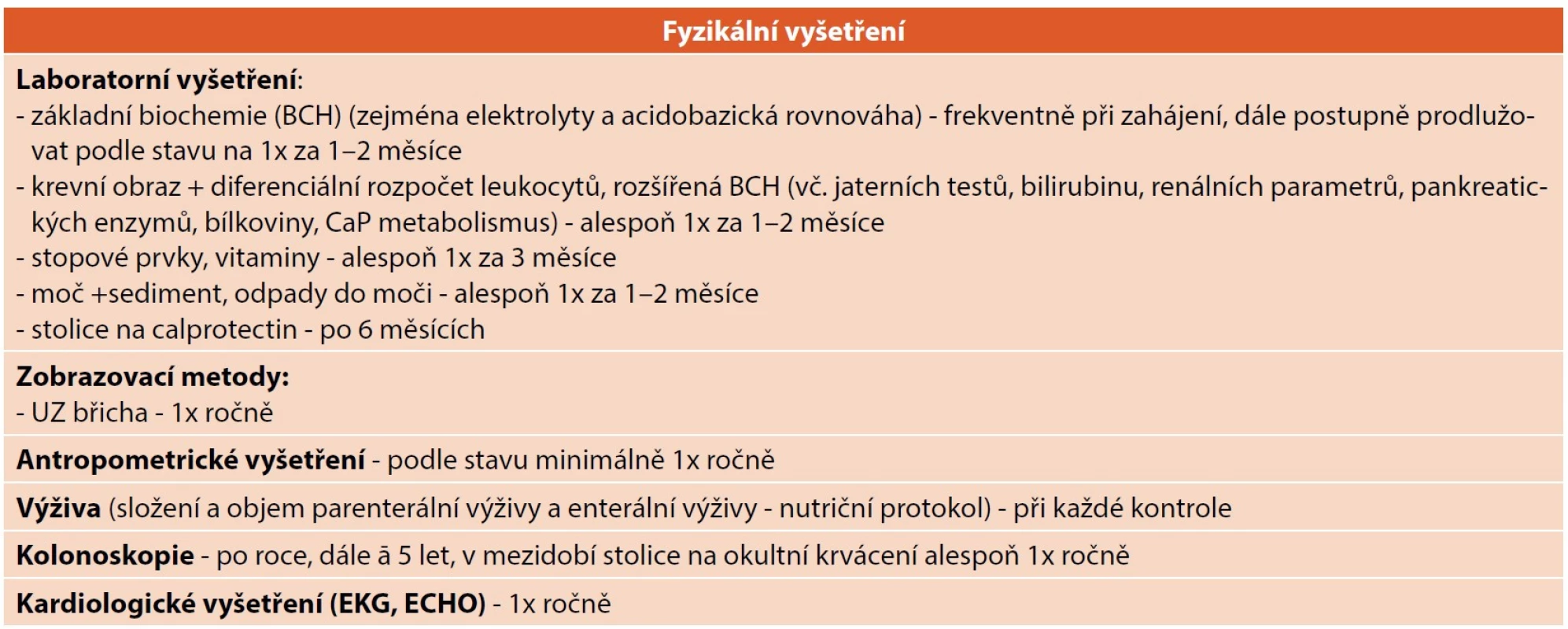
(Upraveno z: Gesellschaft für Pädiatrische Gastroenterologie und Ernährung e.V. Positionspapier Teduglutid. 2018.) ZÁVĚR
Teduglutid představuje zcela novou léčebnou modalitu u pacientů se syndromem krátkého střeva. V současnosti představuje jako analog GLP-2 jedinou farmakologickou podporu adaptace střeva. Účinnost a bezpečnost teduglutidu byly ověřeny klinickými studiemi. Cílem léčby je možnost redukce objemu a kalorického obsahu PV, což vede ke snížení rizik komplikací PV. U části pacientů může léčba vést k dosažení nutriční autonomie a ukončení aplikace parenterální výživy.
V současnosti jsou k dispozici konsenzuální doporučení k indikaci léčby teduglutidem u dětských pacientů. Za kontraindikace jsou aktuálně považovány aktivní maligní onemocnění a anamnéza maligního onemocnění GIT v posledních 5 letech a dále obstrukce střeva. Léčba spočívá v subkutánní aplikaci preparátu 1krát denně. V průběhu terapie je nezbytné sledovat možné nežádoucí účinky – zejména změny hydratace, ovlivnění vnitřního prostředí, změny ve vstřebávání chronické medikace (např. antikoagulancia, antihypertenziva, antiepileptika), či vznik polypů. Dosud není zcela uzavřena otázka ideální délky podávání dané terapie. Snížení podávaného objemu PV vede ke zlepšení kvality života pacientů a jejich rodičů.
Došlo: 13. 8. 2020
Přijato: 11. 12. 2020
Korespondující autorka:
MUDr. Karolina Špičáková
Pediatrická klinika 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha
e-mail: karolina.spicakova@fnmotol.cz
Zdroje
- Guan X, Karpen HE, Stephens J, et al. GLP-2 Receptor localizes to enteric neurons and endocrine cells expressing vasoactive peptides and mediates in-creased blood flow. Gastroenterology 2006; 130 : 150–164. doi: 10.1053/j.gastro.2005.11.005.
- Tee CT, Wallis K, Gabe SM. Emerging treatment options for short bowel syndrome: potential role of teduglutide. Clin Exp Gastroenterol 2011; 4 : 189–196. doi: 10.2147/CEG.S13906.
- Berg JK, Kim EH, Li B, et al. A randomized, double-blind, placebo-controlled, multiple-dose, parallel-group clinical trial to assess the effects of tedu-glutide on gastric emptying of liquids in healthy subjects. BMC Gastroenterol 2014; 14 : 25. doi: 10.1186/1471-230X-14-25.
- Jeppesen PB, Gilroy R, Pertkiewicz M, et al. Randomised placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut 2011; 60 : 902–914. doi: 10.1136/gut.2010.218271.
- Jeppesen PB, Pertkiewicz M, Messing B, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal silure. Gastroenterology 2012; 143 : 1473–1481. e3. doi: 10.1053/j.gastro.2012.09.007.
- Pevny S, Massberg S, Rieger A, et al. Experience with teduglutide treatment for short bowel syndrome in clinical practice. Clin Nutr 2019; 38 : 1745–1755. doi: 10.1016/j.clnu.2018.07.030.
- Iturrino J, Camilleri M, Acosta A, et al. Acute effects of a glucagon-like peptide 2 analogue, teduglutide, on gastrointestinal motor function and permeability in adult patients with short bowel syndrome on home parenteral nutrition. JPEN J Parenter Enteral Nutr 2016; 40 : 1089–1095. doi: 10.1177/0148607115597644.
- Joly F, Seguy D, Nuzzo A, et al. Six-month outcomes of teduglutide treatment in adult patients with short bowel syndrome with chronic intestinal failure: A real-world French observational cohort study. Clin Nutr 2020 Sep; 39 (9): 2856–2862. doi: 10.1016/j.clnu.2019.12.019.
- Oliverius M, Kudla M, Baláž P, Valsamis A. Hladina plazmatického citrulinu – spolehlivý neinvazivní ukazatel množství funkčních enterocytů. Čas Lék čes 2010; 149 (4): 160–162.
- Jeppesen PB, Gabe SM, Seidner DL, et al. Factors associated with response to teduglutide in patients with short-bowel syndrome and intestinal silure. Gastroenterology 2018; 154 : 874–885. doi: 10.1053/j.gastro.2017.11.023.
- Ballauff A, Busch A, De Laffolie J, et al. Gesellschaft für Pädiatrische Gastroenterologie und Ernährung e.V. Positionspapier Teduglutid, 2018. http://www.gpge.eu/leitlinien.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Kongenitální epulisČlánek Tumory srdce u dětí
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Ženy a muži v české pediatrii
- Závislosti hodnôt variability frekvencie srdca a tlaku krvi od parametrov rastu a vývoja nedonosených novorodencov
- Terapie teduglutidem u pacientů se syndromem krátkého střeva
- Hypernatriemická dehydratácia
- Infekční endokarditida s embolizací vegetace do centrální nervové soustavy
- Kongenitální epulis
- Klíšťová encefalitida a kojení
- Tumory srdce u dětí
- Vzpomínka na profesora MUDr. Emila Poláčka, DrSc., zakladatele dětské nefrologie v Čechách
- Akí sme boli. Antropometria a demografia pražských detí pred 130 rokmi
- Rozlúčili sme sa s primárkou MUDr. Marianou Miklerovou
- VYHLÁŠENÍ CENY JANA EVANGELISTY PURKYNĚ
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klíšťová encefalitida a kojení
- Hypernatriemická dehydratácia
- Tumory srdce u dětí
- Kongenitální epulis
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



